Method Article
poisson zèbre
Dans cet article
Résumé
Ce manuscrit décrit les méthodes pour les enregistrements électrophysiologiques de neurones spinaux des embryons de poisson zèbre et les larves. La préparation maintient les neurones in situ et implique souvent la dissection minimum. Ces méthodes permettent l'étude électrophysiologique d'une variété de neurones de la colonne vertébrale, de l'acquisition de l'excitabilité électrique initiale dans les premiers stades larvaires.
Résumé
Le poisson zèbre, d'abord présenté comme un modèle de développement, ont gagné en popularité dans de nombreux autres domaines. La facilité d'élevage un grand nombre d'organismes en développement rapide, combinée à la clarté optique embryonnaire, a servi de premiers attributs convaincants de ce modèle. Au cours des deux dernières décennies, le succès de ce modèle a été propulsé par son plus amenability aux écrans de mutagenèse à grande échelle et par la facilité de transgénèse. Plus récemment, les approches d'édition génétique ont étendu la puissance du modèle.
Pour les études neurodéveloppementaux, l'embryon de poisson zèbre et larve fournissent un modèle auquel plusieurs méthodes peuvent être appliquées. Ici, nous nous concentrons sur les méthodes qui permettent l'étude d'une propriété essentielle des neurones, excitabilité électrique. Notre préparation pour l'étude électrophysiologique des neurones spinaux de poisson zèbre implique l'utilisation de colle de suture vétérinaire pour garantir la préparation à une chambre d'enregistrement. Des méthodes alternatives pour l'enregistrementà partir d' embryons de poisson zèbre et les larves impliquent la fixation de la préparation à la chambre à l' aide d' une amende broche de tungstène 1, 2, 3, 4, 5. Une broche de tungstène est le plus souvent utilisé pour monter la préparation dans une orientation latérale, même si elle a été utilisée pour monter des larves face dorsale jusqu'à 4. La colle de suture a été utilisé pour monter des embryons et des larves dans les deux orientations. Utilisation de la colle, une dissection minimale peut être effectuée, ce qui permet l'accès aux neurones spinaux sans l'utilisation d'un traitement enzymatique, ce qui évite tout dommage résultant. Cependant, pour les larves, il est nécessaire d'appliquer un bref traitement enzymatique pour enlever le tissu musculaire entourant la moelle épinière. Les méthodes décrites ici ont été utilisées pour étudier les propriétés électriques intrinsèques des neurones moteurs, interneurones et les neurones sensoriels à plusieurs developmentÃl étapes 6, 7, 8, 9.
Introduction
George Streisinger pionnier dans l'utilisation de Danio rerio, communément appelé poisson zèbre, en tant que système modèle pour l'analyse génétique du développement des vertébrés 10. Le modèle offre plusieurs avantages, notamment: (1) l'élevage relativement simple et peu coûteux; (2) la fertilisation externe, ce qui permet un accès facile aux embryons dès les premiers stades de développement; et (3) un embryon transparent, ce qui permet des observations directes et répétées de cellules, de tissus et d'organes tels qu'ils forment.
Au cours des décennies qui ont suivi, plusieurs avancées ont augmenté encore la puissance du modèle de poisson zèbre. En particulier, les écrans génétiques avant et les efforts de séquençage du génome entier ont joué un rôle clé dans l'identification des mutations et des gènes essentiels à de nombreux processus de développement 11, 12, 13, 14,« > 15, 16. Les méthodes de clonage de passerelle ont permis à l'application routine de transgénique approches 17, 18. Les progrès récents dans la modification du génome, illustré par activateur de transcription (TALENs) et en grappes courtes répétitions palindromiques régulièrement espacées (CRISPR) -Cas9 des nucleases, permettre l'introduction ciblée de mutations, ainsi que knock-out et knock-in approche 19, 20, 21, 22. Ensemble, ces méthodes font zebrafish un modèle puissant pour l'étude des mécanismes génétiques sous - jacents des comportements spécifiques et plusieurs maladies humaines 23, 24, 25, 26, 27.
Ce travail se concentre sur développerla réglementation mentale et le rôle de l'activité électrique dans le développement des neurones. L'accent est mis sur la moelle épinière, pour laquelle le modèle de poisson zèbre offre plusieurs avantages. Tout d'abord, il est relativement facile d'accès à des stades zebrafish embryonnaire et larvaire; Par conséquent, on peut étudier la fonction de la moelle épinière au cours des stades de développement qui ont moins de neurones et les circuits plus simples 28, 29. En outre, la moelle épinière poisson - zèbre comporte un ensemble diversifié de neurones, similaire à d' autres vertébrés, comme démontré par des motifs caractéristiques et distinctifs de facteurs de transcription 30, 31, 32, 33, 34, 35.
La majorité des études chez le poisson zèbre qui visent à découvrir les mécanismes qui sous-tendent la fonction des circuits de la moelle épinière, en particulierceux qui prennent en charge la locomotion, sont naturellement porté sur les stades larvaires 36, 37, 38, 39, 40, 41, 42, 43. Cependant, la plupart des neurones qui forment les réseaux de locomotive de la colonne vertébrale à leur différenciation initier les premiers stades embryonnaires, ~ 9-10 h après la fécondation (HPF) 44, 45, 46, 47, 48, 49, 50, 51. Compte tenu de cela, la compréhension de la façon dont les propriétés morphologiques et électriques des neurones de la colonne vertébrale se posent et le changement entre les stades embryonnaire et larvaire est important pour un Overacompréhension ll de la formation du circuit locomoteur et la fonction.
Les méthodes de dissection décrites ici permettent des enregistrements de patch-clamp de neurones de la colonne vertébrale et ont été appliquées avec succès à des stades embryonnaires (~ 17-48 HPF) et stades larvaires (~ 3-7 jours après fécondation [dpf]). Cette approche limite la quantité de dissection nécessaire pour permettre l'accès aux neurones d'intérêt. Le protocole diffère de la plupart des autres procédés publiés pour l'enregistrement à partir de neurones spinaux zebrafish en ce que la colle de suture vétérinaire est utilisé, au lieu d'une amende broche de tungstène, pour fixer l'embryon ou une larve de la chambre d'enregistrement. La disponibilité de deux approches différentes ( par exemple, la colle de suture par rapport à la broche de tungstène) pour le montage des embryons de poisson zèbre ou larves pour l' analyse électrophysiologique offre aux chercheurs des options alternatives pour atteindre leurs objectifs expérimentaux spécifiques.
Tout d'abord, les procédures d'accès et l'enregistrement à partir d'un pop ulation des neurones sensoriels primaires, des cellules Rohon-Barbe, sont décrits. Les corps cellulaires de ces neurones se situent dans la moelle épinière dorsale. Cellules Rohon-Barbe existent dans de nombreuses espèces de vertébrés, se différencient au début du développement, et sous - tendent la réponse tactile embryonnaire 6, 44, 47, 48.
En second lieu, les procédures d'accès et d'enregistrement des neurones moteurs spinaux sont détaillés. motoneurones spinaux Zebrafish surviennent pendant deux vagues de la neurogenèse. Les neurones moteurs primaires plus tôt nés surviennent à la fin de la gastrulation (~ 9-16 HPF), avec seulement 3-4 neurones moteurs primaire présents par hemisegment 45, 46, 49. En revanche, la population née plus tard des neurones moteurs secondaires sont plus nombreux et se pose au cours d'une période prolongée, à partir de ~ 14 HPFef "> 45, 50. genèse du neurone moteur secondaire dans des segments à mi-tronc est en grande partie rempli par 51 HPF 50. neurones moteurs secondaires sont considérés comme étant l'équivalent des neurones moteurs dans amniotes 46. Il est intéressant de neurones supraspinales, via la dopamine, régulent la locomotion dans la larve et la genèse du neurone moteur secondaire dans l'embryon et le jeune larve 50, 51. moteur primaire et secondaire neurones comprennent chacun plusieurs sous - types différents. chaque projets de sous - types de neurones moteurs primaires un axone périphérique qui innerve un groupe musculaire caractéristique, résultant en un stéréotype, l'identification trajectoire axonale. en général, les neurones moteurs secondaires suivent les voies axonales précédemment établies par les neurones moteurs primaires. Ainsi, en ce qui concerne les trajectoires des axones, les neurones moteurs primaires et secondaires sont similaires, à l'exception que l'épaisseur et la taille des axones somata unre plus grande pour les neurones moteurs primaires 45.
En troisième lieu, les méthodes pour l'enregistrement de quelques types d'interneurones sont discutés. Cependant, dans ces cas, une quantité limitée d'élimination des autres cellules de la moelle épinière est nécessaire, et donc de la moelle épinière est moins intact que pour des enregistrements à partir de cellules Rohon-Barbe ou neurones moteurs.
Protocole
Toutes les procédures d'animaux ont été approuvées par le Comité de protection des animaux institutionnel et utilisation (IACUC, Bureau du laboratoire des ressources animales, Université du Colorado Anschutz Medical Campus).
1. Zebrafish parachimie
- Élever et maintenir le poisson zèbre adulte (Danio rerio) à 28,5 ° C sur un 10 h cycle lumière obscurité / 14 h et avec un traitement approprié de l' eau et de l' échange 52.
- Soulever les embryons de poisson zèbre / larves à 28,5 ° C dans du milieu d'embryon jusqu'à ce qu'ils atteignent le stade désiré (par exemple, 2 dpf).
2. Préparation des matériaux Dissection
- Distributeur de colle pour la dissection zebrafish
NOTE: Ce protocole implique l'utilisation de colle de suture vétérinaire pour attacher la préparation à la chambre d'enregistrement. L'utilisation réussie de la colle de suture nécessite l'application de petites quantités de colle de manière contrôlée. La colle commence à durcir dès qu'ilrencontre un environnement aqueux. Par conséquent, tirer la colle dans une micropipette et délivrer de petites quantités à l'aide d'un home-made « distributeur de colle » qui permet à l'application d'une pression négative ou positive par la bouche. La partie centrale du distributeur de colle est un alésage de verre, un morceau qui est inclus dans le paquet contenant les capillaires en verre à paroi mince borosilicate (Figure 1A). Sur une extrémité, l'alésage est relié par l' intermédiaire d' un morceau de tuyau flexible à un embout buccal, tandis que l'autre extrémité possède la micropipette en verre (Figure 1).- Retirer l'ampoule noir d'un alésage de verre et de le remplacer par l'adaptateur en caoutchouc blanc d'un autre alésage de verre (Figure 1B et 1C).
REMARQUE: Cet alésage en verre à double adaptateur coiffé permet la connexion à une micropipette de verre sur une extrémité et, à l'autre extrémité, à un morceau de tuyau souple par l' intermédiaire d' un petit raccord de polypropylène linéaire (figure 1B, encart). - couper un morceau de tuyau flexible à une longueur de ~ 38 cm. Fixer l'embout buccal (par exemple, un embout de 200 ul de micropipette jaune) à l'extrémité du tube flexible non relié à l'alésage de verre.
NOTE: Le morceau de tube doit être suffisamment longue pour permettre la manipulation de la micropipette de verre sous un microscope de dissection tandis que la pointe jaune micropipette est dans la bouche (figure 1D).
- Retirer l'ampoule noir d'un alésage de verre et de le remplacer par l'adaptateur en caoutchouc blanc d'un autre alésage de verre (Figure 1B et 1C).

Figure 1: distributeur de colle. (AC) d' un alésage de verre se connecte à un tube flexible à une extrémité et la micropipette de verre à l'autre. Les adaptateurs de caoutchouc permettent une fixation au moyen d' un petit raccord en polypropylène (B, encart) à la tubulure et, éventuellement, à une micropipette de verre à l'autre extrémité. (D) Le distributeur de colle final présente un embout buccal (par exemple, réalisé à partir d' un plasla pointe de pipette tic) à une extrémité du tube et l'alésage de verre avec la micropipette fixée à l'autre (tête de flèche).
- Dissection / chambre d' enregistrement
NOTE: La chambre de dissection sert également de chambre d'enregistrement électrophysiologique. La chambre est formée sur une lame de verre en utilisant des morceaux prédécoupés d'élastomère de silicone durcie (Figure 2A).- Pour préparer l'élastomère de silicone, d'ajouter la base et l'agent de durcissement dans un tube conique en matière plastique à un rapport de 4: 1, respectivement.
- Mélanger la base d'élastomère et l'agent de durcissement en profondeur et verser le mélange dans deux boites de Pétri de 100 mm. Verser l'élastomère à une épaisseur <1 mm dans une boîte de Petri et ~ 2,5 mm dans l'autre.
- Laisser l'élastomère de silicone durcir par l'exposition à l'air pendant 4-5 jours ~. Si élastomère durci est nécessaire plus tôt, incuber à 60 ° C.
- Coupez des morceaux de l'élastomère de silicone durci aux dimensions suivantes:
- De la ~ 1 mm-thick élastomère durci, découper un rectangle ~ 3,8 x 6,3 cm; cette pièce servant de fond de la chambre (figure 2A). De l'~ 2,5 mm d'épaisseur silicone durci, découper un rectangle ~ 3,8 x 6,3 cm. De ce dernier rectangle, découper un rectangle interne ~ 2,5 x 5 cm; la trame résultante sert de la partie supérieure de la chambre (figure 2A).
- Pour que la chambre de dissection / enregistrement, placer le rectangle mince de silicone directement sur une lame de verre (5 x 7,6 cm), en veillant à éliminer les bulles d'air entre le silicone et le verre (figure 2A). Placer le cadre de rectangle de silicone, découpée dans l'élastomère plus épais, au-dessus de la couche mince inférieure de silicone.
- Vérifiez que les couches de silicone se fixent ainsi les uns aux autres et qu'il n'y a pas de bulles d'air entre les deux couches (figure 2A).
- Après utilisation, démonter la chambre en enlevant le cadre de silicone épaisse de rectangle de l'agencement de silicone inférieurer qui est attaché à la lame de verre. Rincer les surfaces de silicone avec ddH 2 O avant l'utilisation et après chaque session d' enregistrement et sec avec des lingettes peu pelucheux.
- Stocker le sec de la chambre pour empêcher la croissance fongique entre les deux morceaux de silicone.
REMARQUE: Si des toxines ou des agents pharmacologiques qui ne peuvent pas rincer facilement à partir du silicone sont utilisés, consacrez chambres spécifiques à ces fins.

Figure 2: chambre de électrophysiologie et des outils de dissection. (A) La chambre utilisée pour les dissections et des enregistrements électrophysiologiques se compose d'une lame de verre sur laquelle sont placées deux pièces d'élastomère de silicone durci, posés les uns sur les autres pour fournir un cadre et un fond d'un puits. La taille du puits, 2,5 ~ x 5 cm, permet l'utilisation de petits volumes (2-2,5 ml) d'enregistrement extracellulaireSolution. La couche de silicone inférieure permet un positionnement sûr de l'embryon de poisson zèbre en utilisant un adhésif de tissu qui ne colle pas au verre. (B) Une micropipette en verre ( en haut) est utilisé pour la livraison de la colle lors de la dissection. Le verre à paroi mince est retirée pour créer une longue extrémité effilée qui est coupée plus tard, la création d'une pointe d'un diamètre d'environ 75 um. La micropipette en verre conique est fixé à l'extrémité libre du distributeur de colle (figure 1D, pointe de flèche) et de l' avant-remplie avec de la colle à travers l'application d' une aspiration. L'autre micropipette ( en bas), tiré aussi pour celle utilisée pour un enregistrement patch-clamp, est utilisé pour la transection du cerveau postérieur et pour l' enlèvement de la peau. (C) sous un microscope droit, un micromanipulateur est utilisé pour manoeuvrer le micropipette pour les étapes finales de dissection. Une micropipette en verre, comme en B, en bas, est fixé sur le porte-électrode (flèche). l'élimination musculaire est atteint par unpplying aspiration à travers la tubulure raccordée à la sortie de l' air (flèche). A son autre extrémité, le tube se connecte à un robinet d' arrêt (tête de flèche noire) qui, sur son autre côté (astérisque), a un tube fixé à un embout buccal.
3. Dissection et Embryons pour Larves patch-clamp enregistrements de la colonne vertébrale Neurones

Figure 3: dissection dorsale de la moelle épinière poisson zèbre. (AA ») Après rhombencéphale transection (a) d'un embryon de 2 dpf, la peau est découpée sur les côtés gauche et droit de l'embryon (b). Une seconde coupe, perpendiculaire à la première, est ensuite effectuée (c). Ensuite, la peau est soulevée à l'aide d'une micropipette, ce qui permet des pincettes pour saisir et tirer loin de la peau. (B) enlèvement de la peau expose la moelle épinière dorsale. Rostrale à la ligne noire, le skin a été enlevé et la surface de la moelle épinière (astérisque), contenu dans les méninges, est exposée. La peau reste intacte caudale à la ligne noire (flèche). (CC ») La pointe de la micropipette en verre est pressé sur les méninges et rapides, des mouvements latéraux courts sont effectués pour percer les méninges. (DD « et EE ») Une fois que les méninges sont percés (DD « ), la micropipette est avancé et (EE ») déplacé rostrale pour déchirer les méninges en deux segments. Le soma des neurones Rohon-Barbe émergent typiquement lors de l' enlèvement des méninges (flèche). (FG) Dans une larve 7-dpf, des couches de muscle couvre la face dorsale de la moelle épinière, ce qui entrave l' accès aux neurones Rohon-barbe. Après l'élimination de la peau, la larve est traité avec 0,05% de collagénase. (F) Une incubation de 5 minutes avec 0,05% de collagénase est trop rigoureux, ce qui entraînedans une lésion musculaire excessive, comme en témoigne le muscle effiloché (flèche et encadré). (F ») traitement excessif de la collagénase peut également endommager les neurones Rohon-Barbe (flèche), révélés ici par leur expression de la GFP dans la Tg (islet2b: gfp) ligne. Dans la Tg (islet2b: gfp) ligne, ganglion racine dorsale neurones expriment également la GFP (pointe de flèche). Un bref 1 min d' incubation avec 0,05% de collagénase se desserre suffisamment le muscle (G) tout en conservant la morphologie des myotome (flèche et encart). (G ») des cellules de pigment sont présentes sur le dessus de la couche de muscle dorsal plus (tête de flèche). (H et I) Dans la Tg (islet2b: gfp) ligne, les neurones Rohon-Barbe (flèches) et le ganglion de la racine dorsale (tête de flèche) continuent d'exprimer la GFP à 7 dpf. Dorsale vues de Tg (islet2b: gfp) embryons de poisson zèbre à 2 dpf (H) und 7 dpf (I). Dans le panneau A barres Echelle = 500 um; BE (représenté dans le panneau B) Echelle barres = 80 pm; F 'et G' (représentée dans le panneau F) Echelle barres = 200 um; H et I (représentée dans le panneau H) Echelle barres = 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
- Dissection d'embryons pour les enregistrements à partir de cellules Rohon-Barbe
- Placer un embryon dans une chambre de dissection contenant ~ 2-3 ml de la solution de Ringer (figure 2A). Immobiliser l'embryon en ajoutant ~ 100 pi de solution à 0,4% de tricaïne à la chambre.
- Tirer micropipettes en verre à paroi mince sur un extracteur micropipette en utilisant un filament de la boîte pour obtenir une longue pointe mince, semblable à une micropipette d'injection (figure 2B, en haut) 53.
- Fixez le micropipette de verre tiré à l'alésage de verre of distributeur de colle. Sous le microscope de dissection, des pinces à utiliser pour briser la pointe de la micropipette de verre de telle sorte que la pointe est d' environ 75 pm (figure 2B, en haut).
REMARQUE: La taille de la pointe doit être suffisamment grand pour permettre le chargement efficace de la colle dans l'embout grâce à l'application d'une pression négative (aspiration de la bouche) à l'avant de remplir la micropipette, mais assez petit pour permettre l'application précise de la colle par l'intermédiaire d'une pression positive . - Charger la micropipette en verre avec ~ 3-5 pi de la colle par application d'une aspiration à travers l'embout buccal. Amener la pointe remplie de colle à la chambre de dissection.
REMARQUE: Remplir la micropipette avec de la colle nécessite une forte aspiration. Si la micropipette remplit rapidement avec faible aspiration, la pointe est trop grande. - Placer l'embryon dans la chambre d'enregistrement (figure 3A et 3A »); pour les enregistrements à partir d'embryons et de jeunes larves (≤72 HPF), il n'y a pas besoin d'enlever le tissu musculaire.
- Apporterla pointe de la micropipette chargé de colle à proximité de la tête de l'embryon / larve, tout en maintenant une légère pression positive à la micropipette par le tube d'embouchure (pour empêcher l'entrée de solution aqueuse). Une fois que la pointe se trouve à proximité de la tête de l'embryon, appliquer une pression positive suffisante pour expulser une petite goutte de colle sur le fond de la chambre.
REMARQUE: La colle durcit une fois en contact avec la solution aqueuse, il est donc important d'appliquer et de maintenir une pression positive légère comme il est placé dans la solution de dissection. - Utiliser un outil de broche de dissection pour déplacer l'embryon / larve vers la goutte de colle de sorte que la tête est en contact avec la colle. Orientez la dorsale côté embryon et appuyez sur la tête pour assurer un bon contact avec la colle.
- Comme la colle durcit lentement, en utilisant la broche de dissection pour repositionner l'embryon / larve sorte qu'il se trouve du côté ventral vers le bas, jusqu'à côté dorsal. Tremper l'outil de la broche de dissection dans la goutte de colle et de tirer des fils de la colle sur et à travers la têtede l'embryon pour fixer sa position.
REMARQUE: Tricaine accélère la vitesse à laquelle la colle durcisse. Pour plus de temps pour travailler avec la colle, utilisez la quantité minimale de tricaïne nécessaire pour immobiliser l'embryon / larve. En outre, le taux de durcissement peut varier avec différents lots de colle. Par conséquent, lors de l'utilisation d'un nouveau lot de colle, de déterminer sa vitesse de durcissement avant de l'utiliser pour la dissection. - Une fois que la tête est solidement fixée à la silicone et la colle est solidifiée, sacrifier l'embryon / larve par transection au niveau du cerveau postérieur avec un autre micropipette en verre (Figure 3A - a et 4A- a).
REMARQUE: Rhombencéphale transection est la méthode qui est utilisée ici pour le sacrifice sans cruauté des animaux. Toutefois, en fonction des objectifs expérimentaux (par exemple, l'étude de la natation fictive), une autre méthode peut être nécessaire. - Avant d'attacher la queue de la chambre, enlever la peau du tronc.
- Utilisationun verre frais micropipette (figure 2B, en bas) pour couper superficiellement la peau à plusieurs reprises à une caudale de position pour le cerveau postérieur (figure 3A - B et 4A- b). Pierce superficiellement la peau en déplaçant la pipette perpendiculaire à l'axe rostro-caudale de chaque côté du tronc pour les spécimens dorsalement monté (figure 3A - B) ou sur le côté exposé du tronc pour les échantillons montés latéralement (Figure 4A- B).
- Pour créer un lambeau de peau de pinces pour saisir, gratter la peau plusieurs fois avec de la micropipette au niveau de et perpendiculairement à la coupe initiale dans l' étape 3.1.10.1 (Figure 3A - C et 4A- c).
- En utilisant une pince à épiler, soulever progressivement le rabat de la peau et tirez la peau caudale.
NOTE: Il en résulte souvent la suppression de la totalité de la peau du tronc. Cependant, il est SOMETImes nécessaires pour enlever la peau en plusieurs sections en effectuant réitéré grattage et de traction de la peau. Pour certaines applications, l' élimination partielle de la peau peut permettre un accès suffisant aux segments de la moelle épinière d'intérêt (figures 3B et 4B). - Délivrer une petite goutte de colle à proximité de la queue de l'embryon / larve. Utiliser cette colle pour fixer la queue au fond de la chambre de dissection. Au cours de cette étape, comme la colle durcit, ajuster la position du tronc avec l'outil de la broche de dissection pour garantir que le coffre reste orientée dorsalement et qu'il est fermement attaché à la chambre.
- À la suite de cette dissection initiale, rincer la préparation intensivement avec la solution de Ringer pour éliminer les tricaïne et les débris. Laisser la préparation reposer pendant environ 5 min.
- Remplacer la solution de dissection avec une solution d'enregistrement extracellulaire. Si nécessaire, ajoutez un agent immobilisant à la préparation (par exemple., Α-bungarotoxine [conce finalentration de 1 uM]).
NOTE: 1 uM α-bungarotoxine immobilise de 1 à 2 dpf embryons à l'intérieur de ~ 30 min. Pour les larves plus, une concentration plus élevée d'α-bungarotoxine peut être nécessaire. a-bungarotoxine est maintenue dans la solution du bain au cours des enregistrements, qui sont généralement effectuées dans une période de 1 h. solutions d'enregistrement qui contiennent des cations divalents, tels que le cobalt, ne nécessitent pas l'addition d'un agent immobilisant. Pour les expériences nécessitant de longues périodes d'enregistrement (plus de 1 h), la préparation est perfusé avec une solution de bain à un débit de 0,5 à 1 ml / min. - Déplacer la chambre de dissection avec l'embryon monté sur la platine d'un microscope composé vertical équipé d'une immersion dans l'eau 40x objectif à long-distance de travail.
NOTE: Ce microscope fait partie de la plate-forme où les enregistrements seront effectués. La plate - forme devrait également être équipé d'un headstage, un amplificateur de patch-clamp, un micromanipulateur et un système d' acquisition de données / ordinateur (figure 2C). - Monter un vide en verre borosilicaté d' épaisseur de paroi micropipette sur le porte-électrode de la headstage (figures 2B, 2C et inférieure, flèche). Fixer le tube (diamètre interne: 0,16 cm, diamètre extérieur: 0,32 cm, et la longueur: ~ 90 cm) à une extrémité à la sortie d'air du porte-électrode (tête de flèche) et à l'autre extrémité à un robinet d' arrêt à trois voies (Figure 2C , pointe de flèche noire).
- Placer une embouchure à une extrémité d'un autre morceau de tube (~ 60-70 cm de longueur) et l' attacher au robinet à trois voies à l'autre extrémité (figure 2C, l' astérisque noir).
Remarque: Ce système de tubes permet l'application d'une pression positive et négative à l'intérieur de la pipette d'enregistrement pendant la formation du joint d'étanchéité.
- Placer une embouchure à une extrémité d'un autre morceau de tube (~ 60-70 cm de longueur) et l' attacher au robinet à trois voies à l'autre extrémité (figure 2C, l' astérisque noir).
- Amener la pointe de la micropipette à la partie la plus dorsale de la moelle épinière et percer délicatement les méninges. Suivez avec rapide, court, mouvements latéraux pour loosen les méninges (figure 3C et 3C »).
- Après la pointe de micropipette a traversé les méninges, faire avancer et augmenter le micropipette pour tirer les méninges loin de la moelle épinière (Figure 3D et 3D).
- Déplacer la micropipette rostrale, avançant au-dessus de 1 à 2 hemisegments pour exposer les cellules Rohon-Barbe (Figure 3E et 3F).
REMARQUE: Disséquer la quantité minimale de meninges nécessaire pour exposer seulement quelques cellules Rohon-Barbe. Après chaque enregistrement, la dissection supplémentaire est effectuée pour révéler plusieurs cellules Rohon-barbe. Dans les deux embryons et les larves, les neurones Rohon-Barbe peuvent parfois éclater au contact avec le patch micropipette. D'autres neurones de la moelle épinière ne se comportent pas de cette façon, ce qui suggère que cela pourrait refléter des propriétés uniques des cellules Rohon-Barbe, comme leur mécanosensibilité. A l' appui de ce fait , plusieurs compositions de solution (par exemple, des composants ioniqueset osmolarité) ont été testés, et aucun n'a empêché ce comportement des cellules Rohon-Barbe.
- Dissection des larves pour les enregistrements à partir de cellules Rohon-Barbe
NOTE: Dans 7 larves dpf, les muscles entourant la moelle épinière dorsale doit être enlevée. Suivre les étapes 3.1.1 à 3.1.15 (avec une larve se substitue à un embryon) avant le traitement avec l'enzyme.- Pour retirer le muscle, la larve incuber avec 0,05% de collagénase pendant 1 min.
- Retirez la collagénase par rinçage la préparation ~ 5 fois avec la solution de Ringer. Suivez avec ~ 5 rinçages de solution extracellulaire pour éliminer complètement la collagénase.
- Effectuer le reste de la dissection après le montage de la chambre d'enregistrement sur la platine du microscope de la plate-forme d'enregistrement. Attacher une pièce à paroi épaisse borosilicate micropipette (figure 2B, en bas) sur le porte-électrode et de briser la pointe de la micropipette par brossage doucement contre le fond dela chambre de silicone.
- Utilisez la micropipette légèrement fracturées à démêler l'écart du muscle et d'exposer la moelle épinière dorsale. Pour retirer les fibres musculaires de la préparation, appliquer une aspiration à travers le tube fixé à la sortie du porte-électrode. Utilisez le micromanipulateur pour déplacer la micropipette sur la longueur d'une fibre musculaire tout en appliquant une aspiration.
NOTE: L'objectif est d'abord utiliser la micropipette pour desserrer mécaniquement le muscle, puis à aspirer et retirer les fibres musculaires. De temps en temps, lors de la suppression du muscle, la micropipette est bouché par le tissu dragués.- Pour décolmater la micropipette, brosser la micropipette contre le fond de la chambre, légèrement cassant la pointe, tout en soufflant de l'air à travers le tube pour expulser le contenu.
NOTE: Si la taille de la pointe de micropipette devient trop grande, une nouvelle micropipette peut être nécessaire. La taille de la pointe de la micropipette est plus critique lors de l'enlèvement des couches musculaires closest aux membranes entourant la moelle épinière ou les méninges (petits conseils micropipette permettent un travail plus contrôlé).
- Pour décolmater la micropipette, brosser la micropipette contre le fond de la chambre, légèrement cassant la pointe, tout en soufflant de l'air à travers le tube pour expulser le contenu.
- Retirez les méninges comme décrit dans les étapes 3.1.18-3.1.20 en utilisant une nouvelle micropipette (figure 2B, en bas).
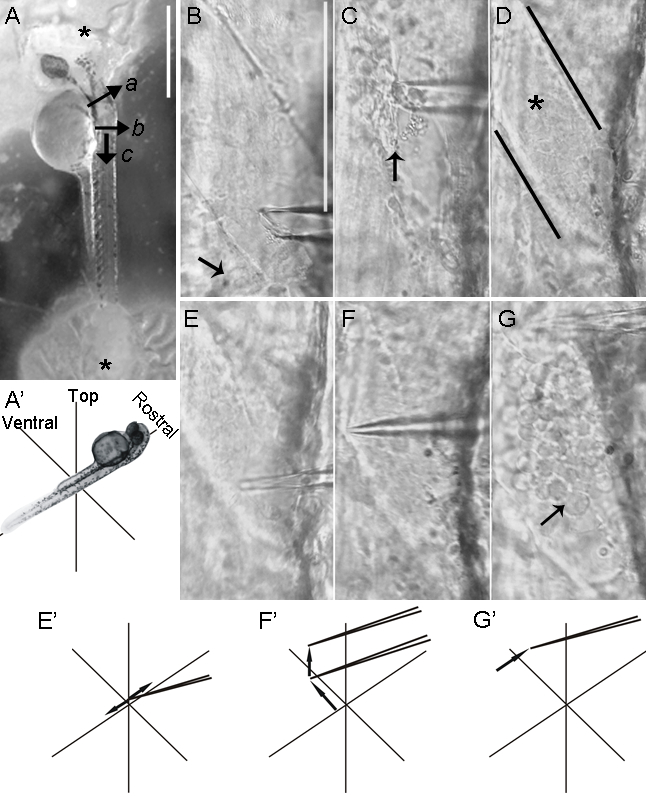
Figure 4: dissection latérale de la moelle épinière poisson zèbre. Montage embryons de poisson zèbre dans une orientation latérale facilite l'accès aux neurones moteurs. L'élimination du muscle et de la dissection des méninges pour exposer les neurones moteurs est réalisée sous un microscope droit adaptée avec un objectif à immersion dans l' eau 40x (voir Figure 2). (A) des corps cellulaires des neurones moteurs sont situés ventralement et latéralement à l'intérieur de la moelle épinière. Les embryons sont fixés à la chambre de sorte que leur face dorsale tournée vers le porte-électrode.Notez que la colle de suture apparaît blanche une fois qu'il durcisse (astérisques). Une fois que le cerveau postérieur est sectionnée (a), la peau est coupée en surface plusieurs fois à un site (b) caudale à l'aide d' une micropipette hindbrain de verre. D' autres coupures superficielles (c), perpendiculaires à la première série (b), former une languette de la peau que des pinces peuvent saisir pour l'enlèvement de la peau. (BG) Une micropipette en verre vide, tiré à une pointe courte, conique (figure 2B, en bas), est fixé sur le porte-électrode. La micropipette est manoeuvré à l'aide du micromanipulateur pour la dissection et l'élimination ultérieure fin du tissu musculaire. (B) La pointe de la micropipette de verre est tout d' abord rompu légèrement par brossage il doucement contre le fond de la chambre, ce qui crée une extrémité dentelée et un diamètre d'extrémité plus large. La micropipette est déplacé le long de la longueur des fibres musculaires pendant l'aspiration est appliquée. Les fibres musculaires sont enlevés une coucheà la fois pour éviter la rupture des méninges sous-jacents. Chez les embryons, les couches musculaires les plus dorsaux sont enlevés en premier lieu, car ceux-ci ont tendance à être plus minces. La peau est pas retirée de hemisegments plus caudales (flèche). (C) a été retiré de la moitié dorsale du muscle dans une hemisegment (flèche). (D) Les lignes noires délimitent une hemisegment dépourvue de fibres musculaires, avec des méninges intactes couvrant la moelle épinière (astérisque). (EE ») en utilisant une micropipette, une pression est appliquée sur les méninges à une position légèrement dorsale de soma des neurones moteurs. mouvements rapides, courts, latéraux du micropipette mènent au perçage des méninges. (FF ») La micropipette est avancé ventralement, vers la face ventrale de la hemisegment, et soulevé pour séparer les méninges à partir du tissu neuronal. (GG ») Meninges sont découpées par le déplacement de la micropipette rostrale le long de la longueur de lahemisegment. Neurones émergent immédiatement de la moelle épinière exposée et sont maintenant accessibles aux électrodes de patch (flèche). Les barres d'échelle = 500 um (A); Les barres d'échelle = 100 um BG (représentée en partie B).
- Dissection d'embryons à des neurones moteurs et des enregistrements des interneurones
- Placer l'embryon dans une chambre de dissection contenant la solution de Ringer et immobiliser l'embryon avec tricaïne, comme à l'étape 3.1.1.
- Monter l'embryon latéralement, par sa face dorsale tournée vers le côté de la chambre qui est optimale pour l'utilisateur (dépend typiquement chiralité). Suivre les étapes 3.1.2-3.1.17 et faire en sorte que l'embryon reste à plat contre la silicone (figure 4A et 4A »).
- Utilisez un borosilicate micropipette à paroi épaisse avec une pointe qui a été rompu à ~ 25 um pour gratter et aspirer l' écart du muscle et exposer les méninges, comme décrit dans les étapes 3.2.4-3.2.4.1 (Figure 4B - 4D).
- Une fois que les couches musculaires sont retirées de la hemisegment (s) d'intérêt (Figure 4D), remplacer la micropipette de verre avec une nouvelle qui a une pointe intacte (figure 2B, en bas). Perforer les méninges à une position qui est dorsal pour les neurones cibles. Utilisation du micromanipulateur, pousser la micropipette vers le bas sur les méninges et ensuite le déplacer rapidement de côté pour déchirer et traverser les méninges (Figure 4E et 4F).
- Lors de la rupture des méninges, faire avancer et élever la micropipette pour soulever les méninges loin de la moelle épinière (figure 4F et 4F). Déplacer la micropipette rostrale pour déchirer la membrane le long de la longueur de la hemisegment (Figure 4G et 4G »).
NOTE: Pour les enregistrements à partir de cellules Rohon-Barbe et les neurones moteurs primaires, la dissection est limitée à dégager les méninges loin de la immediate région cible. En revanche, pour les enregistrements depuis les interneurones et les neurones moteurs secondaires, il est nécessaire d'éliminer les neurones au sein de la moelle épinière qui entravent l'accès à la cellule d'intérêt. Dans ce dernier cas, en raison de la perturbation des circuits de grande moelle épinière, les études sont limitées à l'analyse des propriétés des membranes électriques intrinsèques.
4. électrophysiologique des enregistrements à partir de la colonne vertébrale Neurones
- Pour les enregistrements à partir de cellules Rohon-barbe et les neurones moteurs, utiliser des capillaires en verre de borosilicate à paroi épaisse tiré à une résistance d'environ 3 MQ lorsqu'elles sont remplies de la solution de la pipette (figure 2B, en bas).
- Appliquer une pression positive en soufflant doucement à travers le tube fixé au porte-électrode avant l'immersion de la micropipette dans le bain.
REMARQUE: La pression positive empêche les débris de boucher l'extrémité de la micropipette et est maintenu en tournant le robinet à trois voies à l'arrêt position. Une fois près du neurone cible, la pression positive se traduira par une empreinte distincte de la membrane cellulaire, un indicateur utile que la micropipette est suffisamment proche pour initier la formation du joint. - Libérer la pression positive en tournant le robinet d'arrêt à la position ouverte tout en appliquant une aspiration lumineuse supplémentaire par l'embout buccal.
- Après la formation d'un GQ-joint entre la membrane cellulaire et la pointe de la micropipette, appliquer de brèves impulsions d'aspiration à la rupture de la membrane et obtenir une configuration de cellule entière.
- Après l'établissement d'une configuration à cellules entières stable, avec une résistance d'entrée 500 MQ et une résistance d'accès 10 MQ, obtenir des enregistrements en mode tension ou courant-clamp.
- Appliquer une pression positive en soufflant doucement à travers le tube fixé au porte-électrode avant l'immersion de la micropipette dans le bain.
Résultats
Nous avons réussi à enregistrer des neurones Rohon-Barbe dans 17 HPF embryons à 7 dpf larves (figure 5A et 5B). Lorsque les cellules Rohon-Barbe ont été enregistrées, la préparation a été monté en place du côté dorsal. Un tel montage permet d'identifier sans ambiguïté des cellules Rohon-Barbe en fonction de leurs positions dorsales superficielles et grandes tailles soma. L'identification est en outre confirmé par le potentiel membranaire de repos hyperpolarisé stéréotypé de ces neurones (figure 5, tableau encadré) 6, 54. De plus, comme les neurones sensoriels primaires, les neurones Rohon-Barbe manquent entrée synaptique. Par conséquent, en l'absence de stimulation électrique, aucun changement dans le potentiel de membrane devrait se produire lors de l' enregistrement en mode courant de serrage (figure 5B). Depuis les premiers enregistrements de cellules Rohon-Barbe chez le poisson zèbre ont été réalisées 6, diverses lignées transgéniques (par exemple, Tg (islet2b: gfp), Tg (ngn: gfp) et Tg (isletss: gfp)) ont été produits qui expriment des rapporteurs fluorescents dans ces neurones, ce qui facilite en outre leur identification 55, 56, 57.
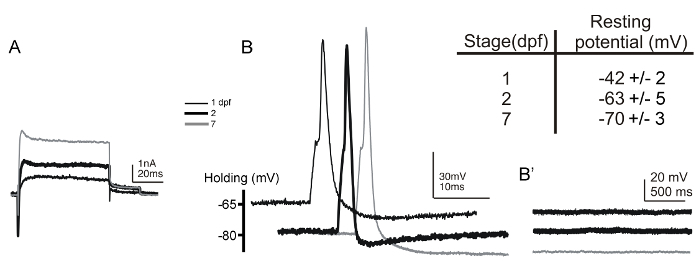
Figure 5: tension - cellules entières et des enregistrements de courant-clamp de neurones Rohon-barbe 1 et 2 dpf embryons et 7 dpf larves. (A) des enregistrements de serrage de tension des courants vers l' extérieur et vers l' intérieur ont été obtenus à partir de neurones Rohon-barbe 1- (fine ligne noire), le 2- (trait noir épais), et 7-dpf (ligne grise) embryons / larves. Le potentiel de maintien était -80 mV et les courants ont été provoqués par une étape de dépolarisation à 20 mV. (B) des potentiels d'action individuels sont provoquées par une brève (1 ms) Courantinjections (~ 0,35 nA) pour les neurones Rohon-Barbe de 1- (mince ligne noire), le 2- (ligne noire épaisse), et les embryons / larves 7-dpf (ligne grise). (B ») En l'absence de stimulation électrique, aucune modification du potentiel de membrane, tels que des dépolarisations spontanées post - synaptiques, se produisent dans les neurones Rohon-barbe. Le tableau encadré résume les valeurs des potentiels de membrane au repos des neurones enregistrés Rohon-Barbe de 1- (n = 21) et de 2- (n = 9) dpf embryons et l'acide 7- (n = 7) dpf larves. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Les lignées transgéniques qui permettent l'identification sans équivoque des autres sous-types de neurones spinaux sont également disponibles. Parmi ceux - ci, la Tg lignée transgénique mnx1 (mnx1: gfp) exprime la protéine fluorescente verte (gfp) dans un sous - ensemble de neurones moteurs spinaux peu après leur spécification (~ 14-16 HPF) 58, 59. En raison de la position stéréotypée des neurones moteurs primaires dans chaque hemisegment (figure 6A), ainsi que l'expression de la GFP dans la transgénique mnx1, il est possible d'identifier les différents sous - types de neurones moteurs primaires (Figure 6B et 6C). Comprenant un colorant fluorescent dans la solution d'électrode d'enregistrement permet la visualisation des trajectoires axonales, fournissant une confirmation supplémentaire de l' identité des neurones moteurs, comme certains interneurones expriment également la GFP dans la Tg (mnx1: gfp) ligne. En variante, une autre lignée transgénique qui permet l'identification des neurones moteurs est la ligne 60 ET2.
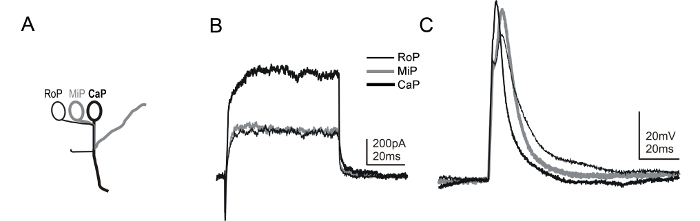
Figure 6: Tension cellules entières et des enregistrements de courant-clamp de neurones moteurs de 1 dpf zebrafish embryos. (A) Un dessin représente les caractéristiques morphologiques spécifiques des sous - types de neurones moteurs primaires présents dans la moelle épinière du poisson zèbre. Neurones moteurs principaux sont identifiés par la position de leur soma intérieur d' un segment ( par exemple, [RoP] rostral, [MiP] médial, ou caudale [CaP]) 45. En outre, chaque sous-type étend un axone à la périphérie par un chemin distinct. L'utilisation combinée de la Tg (mnx1: gfp) et la ligne d' étiquetage colorant révèle l'arbre axonale stéréotypé et l'identité du sous - type de neurone moteur pendant un enregistrement. En utilisant les méthodes présentées ici, il est possible de manière séquentielle à partir de trois différents enregistrement sous-types de neurones moteur primaire dans le même hemisegment. (B) des enregistrements de verrouillage de tension sont présentés qui ont été obtenues à partir de ROP, MiP et CaP, le tout dans un seul hemisegment. Une étape de tension de 20 mV a été utilisé pour induire des courants à partir d'un potentiel de maintien de -80 mV. (C) Au cours de pince de courant recordings de ROP, MiP, et plafonnant, bref (1 ms, ~ 0,4 nA) injections de courant ont été appliquées pour déclencher un potentiel d'action. Le potentiel de membrane a eu lieu à ~ -65 mV. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Une différence principale entre les neurones moteurs primaire et secondaire est le plus grand soma des neurones nés plus tôt. Cependant, les sous-types de neurones moteurs secondaires ne sont pas identifiables par la taille ou la position de soma. Pour les enregistrements de neurones moteurs secondaires spécifiques, deux lignées transgéniques, Tg (GATA2: gfp) et Tg (islet1: gfp), ont été utilisées pour l'identification des neurones moteurs secondaires avec les axones en saillie ventralement et dorsalement, respectivement 55, 61. Cependant, un troisième sous-type de neurone moteur secondaire est présent dans la moelle épinière poisson-zèbre, avec axons que dorsalement projet et ventral 62. Par conséquent, le colorant peut être utilisé pour remplir les neurones moteurs secondaires lors des enregistrements pour identifier les sous - types sur la base de la morphologie (figure 7A) 8, 9. Souvent, au cours de voltage-clamp (Figure 7B, des astérisques) ou des enregistrements courants serrage (figure 7C et 7C », pointes de flèches) de neurones moteurs secondaires, les événements spontanés ou synaptiques sont enregistrées.

Figure 7: Tension cellules entières et des enregistrements de courant-clamp de neurones moteurs secondaires de 2 dpf embryons. (A) Dans la Tg (GATA2: gfp) ligne, deux sous - types de neurones moteurs secondaires différents expriment la GFP 62. Dans le hemisegment gauche, un neurone moteur secondaire ventral(Astérisque et flèche indiquent soma et axone, respectivement). Dans le hemisegment voisin, sur la droite (caudale), il y a une ventrale / dorsale neurone moteur secondaire (astérisque indique soma, les flèches indiquent les deux axones, une saillie ventralement [flèche bas] et l'autre dorsalement [haut flèche]). Ces neurones ont été marqués avec un colorant fluorescent rouge pendant les enregistrements. Pour identifier ventrale / dorsale neurones moteurs secondaires, il est essentiel de veiller à ce que la dissection ne supprime pas les muscles du hemisegment caudal adjacent, ainsi d'endommager ou de retirer l'axone dorsale. Après l'enregistrement, le soma des neurones reste attaché à la micropipette car il est retiré de la préparation (astérisque haut à droite). Lors de l' utilisation des colorants pour remplir les neurones pendant un enregistrement, le colorant fuit souvent pendant que l'électrode se trouve dans le bain, ce qui entraîne dans un fond fluorescent rouge visible dans la moelle épinière et notocorde (astérisque bas dans rostral [gauche] hemisegment < / Em>). (B) des enregistrements de verrouillage de tension sont obtenus à partir ventrale et ventrale / dorsale neurones moteurs secondaires. mesures de tension (-30, -10, +10, +30, +50, +70, +90 et +110 mV) provoquées vers l'extérieur et vers l'intérieur des courants. Potentiels d'action non fixées / dépolarisations peuvent être présents dans les enregistrements (astérisques). (C) Pendant l' enregistrement courant-clamp de neurones moteurs secondaires, les brèves (1 ms) injections de courant d'amplitude croissante ont été appliqués aux neurones pour déclencher un potentiel d'action (astérisques). (C ») Exemples de potentiels d'action déclenchés simples dans les neurones moteurs secondaires par ~ 0,4-nA injections de courant sont représentés. A ce stade, les potentiels d'action spontanés sont également observés (C et C », têtes de flèche). (D) prolongée (100 ms) des injections de courant (~ 0,35 NA) déclenche la mise à feu répétitive de potentiels d'action. Le potentiel de membrane a eu lieu à ~ -65 mV.charge / 55507 / 55507fig7large.jpg » target = « _ blank »> S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Les méthodes décrites ici permettent la caractérisation électrique et morphologique des neurones sensoriels et moteurs d'embryons de poisson zèbre après dissection minimale de la moelle épinière. Neurones restent en bonne santé pendant au moins 1 h, la limite de temps imposée à ces enregistrements. Neurones ont été enregistrées en utilisant la configuration standard de cellules entières, ainsi que des patches nucléées; ce dernier procédé minimise les problèmes d'espace-clamp qui peut empêcher une étude biophysique détaillée des courants ioniques 9.
Un défi important est de réaliser l'attachement ferme de l'embryon ou larve à la chambre afin d'enlever la peau et d'effectuer la dissection limitée nécessaire pour permettre l'accès aux neurones d'intérêt. La préparation doit également être correctement fixé à la chambre d'enregistrement pour l'ensemble des cellules méthodes de patch-clamp. Un procédé qui répond à ce problème par l'utilisation de colle de suture vétérinaire pour fixer l'embryon ou de larvela chambre de dissection / enregistrement est décrite ici, une approche qui a été utilisée pour la dissection d'autres organismes modèles (par exemple, Drosophila) 63. De nos autres la formation d'expérience, nous constatons que l'étape la plus critique à maîtriser est la distribution contrôlée et précise de petites quantités de colle. Ici, un dispositif de distribution de colle qui permet à un utilisateur d'appliquer une pression négative et positive pour charger la colle dans ou pour l'expulser de la pointe d'une micropipette est discutée. Utilisation de la colle de suture, les embryons et les larves peuvent être solidement fixés à la chambre et orientés soit dorsale du côté vers le haut ou latéralement. De cette façon, les options d'accès différents pour une variété de neurones sont disponibles. En outre, la couche d'élastomère de silicone sur le fond de chambre peut être encore plus mince que la 1 mm spécifiés ici, en fournissant des avantages potentiels optiques. Une autre méthode, plus communément utilisé pour attacher la préparation à une chambre d'enregistrement, implique l' utilisation de broches de tungstène fines 1 , 2, 3, 4, 5. Bien que que les méthodes diffèrent, les deux permettent l'accès électrophysiologique aux neurones de la colonne vertébrale de poisson zèbre, offrant aux chercheurs des options qui peuvent être sélectionnés en fonction des objectifs et des défis de l'expérience.
La préparation de poisson zèbre décrite ici permet l'étude électrique et morphologique des neurones spinaux in situ au cours de leurs premiers stades de différenciation. En enregistrant des neurones de la colonne vertébrale en utilisant ces méthodes, nous avons acquis des connaissances sur les effets cellulaires de plusieurs mutations, même avant l'identification du gène 6 lésion, 64, 65.
Déclarations de divulgation
Les auteurs déclarent une absence d'intérêts financiers en compétition.
Remerciements
Ce travail a été soutenu par des subventions du NIH (F32 NS059120 à RLM et R01NS25217 et P30NS048154 à ABR).
matériels
| Name | Company | Catalog Number | Comments |
| Vacuum filter/Storage bottle, 0.22 mm pore | Corning | 431096 | |
| Syringe filter 0.2 mm | Whatman | 6780-2502 | |
| Tricaine | Sigma | A-5040 | Ethyl 3-aminobenzoate methanesulfonate salt |
| α-bugarotoxin | Tocris | 11032-79-4 | |
| Tetrodotoxin | Tocris | 4368-28-9 | |
| Alexa-549 hydrazine salt | Molecular Probes | A-10438 | fluorescent dye |
| Spin-X centrifuge tube filter | Corning | 8161 | |
| Glass microscope slide | Fisher | 12-550C | |
| Sylgard silicone elastomer kit | Dow Corning | 184 | silicone elastomer |
| Petri dishes | Falcon | 351029 | |
| Borosilicate glass capillaries | Harvard Apparatus | 30-0038 | inner and outer diameters of 0.78 and 1.0 mm (thin walled glass capillaries) |
| Borosilicate glass capillaries | Drummond Scientific | 1-000-1000-100 | inner and outer diameters of 1.13 and 1.55 mm (thick walled glass capillaries) |
| Miniature barbed polypropylene fitting | Cole-Palmer | 6365-90 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Collagenase XI | Sigma | C7657 | |
| Microelectrode puller | Sutter Instruments | Model P-97 | |
| Amplifier | Molecular Devices | Axopatch 200B | |
| Head stage | Molecular Devices | CV203BU | |
| Motorized micromanipulator | Sutter Instruments | MP-285 | |
| Tygon tubing | Fisher | 14-169-1B | ID 1/16 IN, OD 1/8 IN and WALL 1/32 IN (flexible laboratory tubing) |
| Electrode holder | Molecular Devices | 1-HC-U | |
| Pharmaseal Three-Way Stopcocks | Baxter | K75 | |
| Digitizer | Axon Instruments | Digidata 1440A | |
| Inverted microscope | Zeiss | Axioskop2 FS plus | |
| 40X/0.80W Achroplan objective | Zeiss | ||
| Data acquisition and analysis software | Axon Instruments | PClamp 10 - Clampex and Clampfit | |
| Micropipette puller | Sutter Instruments | Model P-97 | |
| Name | Company | Catalog Number | Comments |
| Dissection and Recording Solutions (in mM) | |||
| All solutions, except the intracellular, are stable for ~2-3 months when filtered (0.22 mm filter cups) and stored at room temperature (RT). | |||
| The intracellular solution is filtered (0.2 mm syringe filters) and stored frozen (-20 °C) in small aliquots that are individually thawed on the day of use. | |||
| Dissection/Ringer’s solution | 145 NaCl, 3 KCl, 1.8 CaCl2.2H2O, 10 HEPES; pH 7.4 (with NaOH) | ||
| Pipette (intracellular) recording solution | 135 KCl, 10 EGTA-acid, 10 HEPES; pH 7.4 (with KOH). | ||
| Bath (extracellular) recording solution/voltage and current-clamp | 125 NaCl, 2 KCl, 10 CaCl2.2H2O, 5 HEPES; pH 7.4 (with NaOH). | ||
| Alexa-594 hydrazine salt stock solution. | Prepare a 13.2 mM stock in ddH2O, aliquot (~100 µl) and store at -20 °C. For use, dilute the stock solutiond 132 fold with pipette solution to a final concentration of 100 mM. After dilution, filter the Alexa-594 containing pipette solution with a centrifuge tube filter. | ||
| Name | Company | Catalog Number | Comments |
| Immobilizing agents | |||
| 0.4% ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Prepare a 0.4% stock solution in 0.2 M Tris, pH 9 (0.4 g Tricaine/100 mL 0.2 M Tris | ||
| Adjust pH to 7 with NaOH and store at -20 °C. | |||
| For use, dilute the stock solution ~25 fold in embryo media | |||
| 250 mM α-bungarotoxin | Prepare a 250 mM stock in ddH2O (1 mg/500 mL), prepare 100 µL aliquots, and sotre at -20 °C. | ||
| For use, dilute 2,500-fold with extracellular solution to a final concentration of 100 nM. | |||
| 1 mM Tetrodotoxin | Prepare a 1 mM stock in ddH2O (1 mg/3 mL), prepare 100 µL aliquots, and sotre at -20 °C. | ||
| For use, dilute 2,000-fold with extracellular solution to a final concentration of 500 nM. | |||
Références
- Drapeau, P., Ali, D. W., Buss, R. R., Saint-Amant, L. In vivo recording from identifiable neurons of the locomotor network in the developing zebrafish. J Neurosci Methods. 88 (1), 1-13 (1999).
- Drapeau, P., Saint-Amant, L., Buss, R. R., Chong, M., McDearmid, J. R., Brustein, E. Development of the locomotor network in zebrafish. Prog Neurobiol. 68 (2), 85-111 (2002).
- Saint-Amant, L., Drapeau, P. Whole cell patch-clamp recordings from identified spinal neurons in the zebrafish embryo. Methods Cell Sci. 25, 59-64 (2003).
- Masino, M. A., Fetcho, J. R. Fictive Swimming Motor Patterns in Wild Type and Mutant Larval Zebrafish. J Neurophysiol. 93 (6), 3177-3188 (2005).
- Wen, H., Brehm, P. Paired motor neuron-muscle recordings in zebrafish test the receptor blockade model for shaping synaptic current. J Neurosci. 25 (35), 8104-8111 (2005).
- Ribera, A. B., Nüsslein-Volhard, C. Zebrafish Touch-Insensitive Mutants Reveal an Essential Role for the Developmental Regulation of Sodium Current. J Neurosci. 18, 9181-9191 (1998).
- Pineda, R. H., Heiser, R. A., Ribera, A. B. Developmental, molecular, and genetic dissection of INa in vivo in embryonic zebrafish sensory neurons. J Neurophysiol. 93, 3582-3593 (2005).
- Moreno, R. L., Ribera, A. B. Zebrafish motor neuron subtypes differ electrically prior to axonal outgrowth. J Neurophysiol. 102, 2477-2484 (2009).
- Moreno, R. L., Ribera, A. B. Spinal neurons require Islet1 for subtype-specific differentiation of electrical excitability. Neural Dev. 9 (1), 19 (2014).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291 (5813), 293-296 (1981).
- Driever, W., et al. A genetic screen for mutations affecting embryogenesis in zebrafish. Development. 123, 37-46 (1996).
- Haffter, P., et al. The identification of genes with unique and essential functions in the development of the zebrafish, Danio rerio. Development. 123, 1-36 (1996).
- Vogel, G. Genomics: Sanger will sequence zebrafish genome. Science. 290 (5497), 1671 (2000).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. 2 (12), 956-966 (2001).
- Lawson, N. D., Wolfe, S. A. Forward and reverse genetic approaches for the analysis of vertebrate development in the zebrafish. Dev Cell. 21 (1), 48-64 (2011).
- Yates, A., et al. Ensembl. Nucleic Acids Res. 44 (D1), D710-D716 (2016).
- Kawakami, K. Transgenesis and gene trap methods in zebrafish by using the Tol2 transposable element. Methods Cell Biol. 77, 201-222 (2004).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Huang, P., Xiao, A., Zhou, M., Zhu, Z., Lin, S., Zhang, B. Heritable gene targeting in zebrafish using customized TALENs. Nat Biotechnol. 29, 699-700 (2011).
- Sander, J. D., et al. Targeted gene disruption in somatic zebrafish cells using engineered TALENs. Nat Biotechnol. 29 (8), 697-698 (2011).
- Chang, N., et al. Genome editing with RNA-guided Cas9 nuclease in zebrafish embryos. Cell Res. 23 (4), 465-472 (2013).
- Hwang, W. Y., et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nat Biotechnol. 31 (3), 227-229 (2013).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nature Rev Genet. 8 (5), 353-367 (2007).
- Levin, E. D., Cerutti, D. T., Buccafusco, J. J. Behavioral neuroscience of zebrafish. Methods of behavior analysis in neuroscience. , (2009).
- Stewart, A., Gaikwad, S., Kyzar, E., Green, J., Roth, A., Kalueff, A. Modeling anxiety using adult zebrafish: A conceptual review. Neuropharmacology. 62, 135-143 (2012).
- Mushtaq, M. Y., Verpoorte, R., Kim, H. K. Zebrafish as a model for systems biology. Biotechnol Genet Eng Rev. 29 (2), 187-205 (2013).
- Phillips, J. B., Westerfield, M. Zebrafish models in translational research: tipping the scales toward advancements in human health. Dis Model Mech. 7 (7), 739-743 (2014).
- Weis, J. S. Analysis of the development of nervous system of the zebrafish, Brachydanio rerio. I. The normal morphology and development of the spinal cord and ganglia of the zebrafish. J Embryol Exp Morphol. 19 (2), 109-119 (1968).
- Bernhardt, R. R., Chitnis, A. B., Lindamer, L., Kuwada, J. Y. Identification of spinal neurons in the embryonic and larval zebrafish. J Comp Neurol. 302 (3), 603-616 (1990).
- Tsuchida, T., et al. Topographic organization of embryonic motor neurons defined by expression of LIM homeobox genes. Cell. 79 (6), 957-970 (1994).
- Guillemot, F. Spatial and temporal specification of neural fates by transcription factor codes. Development. 134, 3771-3780 (2007).
- Goulding, M. Circuits controlling vertebrate locomotion: Moving in a new direction. Nat Rev Neurosci. 10, 507-518 (2009).
- Fetcho, J. R., McLean, D. L. Some principles of organization of spinal neurons underlying locomotion in zebrafish and their implications. Ann N Y Acad Sci. 1198, 94-104 (2010).
- Del Barrio, M. G., et al. A transcription factor code defines nine sensory interneuron subtypes in the mechanosensory area of the spinal cord. PLoS One. 8 (11), (2013).
- Satou, C., Kimura, Y., Hirata, H., Suster, M. L., Kawakami, K., Higashijima, S. Transgenic tools to characterize neuronal properties of discrete populations of zebrafish neurons. Development. 140 (18), 3927-3931 (2013).
- McLean, D. L., Fan, J., Higashijima, S., Hale, M. E., Fetcho, J. R. A topographic map of recruitment in spinal cord. Nature. 446, 71-75 (2007).
- McLean, D. L., Masino, M. A., Koh, I. Y., Lindquist, W. B., Fetcho, J. R. Continuous shifts in the active set of spinal interneurons during changes in locomotor speed. Nat. Neurosci. 11, 1419-1429 (2008).
- McLean, D. L., Fetcho, J. R. Spinal interneurons differentiate sequentially from those driving the fastest swimming movements in larval zebrafish to those driving the slowest ones. J. Neurosci. 29, 13566-13577 (2009).
- Ampatzis, K., Song, J., Ausborn, J., El Manira, A. Separate microcircuit modules of distinct V2a interneurons and motoneurons control the speed of locomotion. Neuron. 83, 934-943 (2014).
- Ljunggren, E. E., Haupt, S., Ausborn, J., Ampatzis, K., El Manira, A. Optogenetic activation of excitatory premotor interneurons is sufficient to generate coordinated locomotor activity in larval zebrafish. J. Neurosci. 34, 134-139 (2014).
- Menelaou, E., VanDunk, C., McLean, D. L. Differences in the morphology of spinal V2a neurons reflect their recruitment order during swimming in larval zebrafish. J Comp Neurol. 522, 1232-1248 (2014).
- Hubbard, J. M., et al. Intraspinal Sensory Neurons Provide Powerful Inhibition to Motor Circuits Ensuring Postural Control during Locomotion. Curr Biol. 26 (21), 2841-2853 (2016).
- Song, J., Ampatzis, K., Björnfors, E. R., El Manira, A. Motor neurons control locomotor circuit function retrogradely via gap junctions. Nature. 529 (7586), 399-402 (2016).
- Lamborghini, J. E. Rohon-beard cells and other large neurons in Xenopus embryos originate during gastrulation. J. Comp. Neurol. 189, 323-333 (1980).
- Myers, P. Z., Eisen, J. S., Westerfield, M. Development and axonal outgrowth of identified motoneurons in the zebrafish. J Neurosci. 6, 2278-2289 (1986).
- Kimmel, C. B., Westerfield, M., Edelman, G. M., Gall, W. E., Cowan, W. M. Primary neurons of the zebrafish. Signals and Sense: Local and Global Order in Perceptual Maps. , 561-588 (1990).
- Metcalfe, W. K., Myers, P. Z., Trevarrow, B., Bass, M. B., Kimmel, C. B. Primary neurons that express the L2/HNK-1 carbohydrate during early development in the zebrafish. Development. 110 (2), 491-504 (1990).
- Rossi, C. C., Kaji, T., Artinger, K. B. Transcriptional control of Rohon-Beard sensory neuron development at the neural plate border. Dev Dyn. 238, 931-943 (2009).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Progress in Neurobiology. 69 (6), 419-449 (2003).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Dev Cell. 25 (5), 478-491 (2013).
- Lambert, A. M., Bonkowsky, J. L., Masino, M. A. The conserved dopaminergic diencephalospinal tract mediates vertebrate locomotor development in zebrafish larvae. J Neurosci. 32 (39), 13488-13500 (2012).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (1995).
- Oesterle, A. . Pipette Cookbook 2015 P-97 & P-1000 Micropipette pullers. , (2015).
- Spitzer, N. C. The ionic basis of the resting potential and a slow depolarizing response in Rohon-Beard neurons of Xenopus tadpoles. J Physiol. 255 (1), 105-135 (1976).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20, 206-218 (2000).
- Blader, P., Plessy, C., Strahle, U. Multiple regulatory elements with spatially and temporally distinct activities control neurogenin1 expression in primary neurons of the zebrafish embryo. Mech Dev. 120, 211-218 (2003).
- Palanca, A. M., et al. New transgenic reporters identify somatosensory neuron subtypes in larval zebrafish. Dev Neurobiol. 73, 152-167 (2013).
- Flanagan-Street, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132, 4471-4481 (2005).
- Arkhipova, V., Wendik, B., Devos, N., Ek, O., Peers, B., Meyer, D. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365, 290-302 (2012).
- Balciunas, D., Davidson, A. E., Sivasubbu, S., Hermanson, S. B., Welle, Z., Ekker, S. C. Enhancer trapping in zebrafish using the Sleeping Beauty transposon. BMC Genomics. 5 (1), 62 (2004).
- Meng, A., Tang, H., Ong, B. A., Farrell, M. J., Lin, S. Promoter analysis in living zebrafish embryos identifies a cis-acting motif required for neuronal expression of GATA-2. Proc. Natl. Acad. Sci. USA. 94, 6267-6272 (1997).
- Menelaou, E., McLean, D. L. A gradient in endogenous rhythmicity and oscillatory drive matches recruitment order in an axial motor pool. J Neurosci. 32, 10925-10939 (2012).
- Rohrbough, J., Pinto, S., Mihalek, R. M., Tully, T., Broadie, K. latheo, a Drosophila gene involved in learning, regulates functional synaptic plasticity. Neuron. 23 (1), 55-70 (1999).
- McKeown, K. A., Moreno, R., Hall, V. L., Ribera, A. B., Downes, G. B. Disruption of Eaat2b, a glutamate transporter, results in abnormal motor behaviors in developing zebrafish. Dev Biol. 362 (2), 162-171 (2012).
- Carmean, V., et al. pigk mutation underlies macho behavior and affects Rohon-Beard cell excitability. J Neurophysiol. 114 (2), 1146-1157 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon