Method Article
斑马鱼
摘要
这手稿描述了从斑马鱼胚胎和幼虫的脊髓神经元的电生理记录的方法。制备维持神经元在原地 ,往往涉及到最小的清扫。这些方法允许对多种脊髓神经元的电生理学研究中,从通过早期幼体阶段的初始电兴奋采集。
摘要
斑马鱼,首先介绍了作为一个发展模式,在许多领域都得到了普及。饲养迅速发展生物体的大数自如,与胚胎光学透明度结合,担任该模型的初始吸引力属性。在过去的二十年里,这种模式的成功得到了进一步的顺从大规模诱变筛选,并通过易于转基因的推动。最近,基因编辑方法扩展了模型的力量。
对于神经发育研究,斑马鱼胚胎和幼虫提供到可应用多种方法的模型。在这里,我们专注于让神经元,电兴奋性的本质属性的研究方法。我们对斑马鱼的脊髓神经元的电生理研究编制涉及使用兽医缝合的胶水,以确保准备录音室。记录替代方法从斑马鱼胚胎和幼虫涉及使用细钨针1,2,3,4,5的制备腔室的连接。钨销是最经常用于安装在横向取向的制备中,虽然它已被用于安装幼虫背的一面朝上4。缝合胶水已被用于安装在两个方向的胚胎和幼虫。使用胶水,一个最小的夹层可以执行,允许访问脊髓神经元而不使用酶处理的,从而避免了任何所得的损坏。然而,对于幼虫,有必要施加一个简短酶处理以除去脊髓周围的肌肉组织。这里所描述的方法已被用来在几个developmenta研究运动神经元的interneurons和感觉神经元的内在电性能升级6,7,8,9。
引言
乔治·斯特雷伊辛格率先使用斑马鱼 ,俗称斑马鱼作为脊椎动物发育10的遗传分析模型系统。该模型提供了几个优点,包括:(1)相对简单和便宜畜牧业; (2)外部受精,从而允许方便地从最早的发育阶段的胚胎;和(3)的透明胚胎,从而允许细胞,组织和器官的直接和重复观察,因为它们形成。
在随后的几十年里,进行了若干改进进一步增加了斑马鱼模型的力量。特别是,正向遗传学屏幕和全基因组测序工作发挥了重要作用的基因突变和基因关键的标识许多发育过程11,12,13,14,"> 15,16。Gateway克隆方法已经允许转基因的常规应用方法17,18。在基因组编辑的最新进展,通过转录激活状(TALEN的)中列举和群集规则间隔开的短回文重复序列(CRISPR)-Cas9核酸酶,允许有针对性地引入突变,以及敲除和敲入接近19,20,21,22,组合,这些方法使斑马鱼为底层的具体行为和一些人类疾病的遗传机制的研究提供强大的模型23,24,25,26,27。
今年工作重点放在发展心理调节和电活动的神经发育中的作用。重点是脊髓,为此,斑马鱼模型提供了几个优点。首先,它是相对容易的,在胚胎和幼体阶段访问斑马鱼;因此,可以在具有较少的神经元和较简单的电路28,29的发育阶段研究脊髓功能。此外,斑马鱼脊髓具有一组不同的神经元,类似于其他脊椎动物中,因子30,31,32,33,34,35所证明由转录的特性和特征图案。
旨在揭示背后脊髓电路的功能的机制的多数在斑马鱼的研究中,尤其是支持运动的,是可以理解集中于幼虫阶段36,37,38,39,40,41,42,43。然而,许多形成脊柱机车网络中的神经元的启动它们的分化在早期胚胎阶段,〜9-10小时后受精(HPF)44,45,46,47,48,49,50,51。鉴于此,了解如何脊髓神经元的形态学和电学性质发生和胚胎和幼虫阶段之间的变化是一个重要overa的运动电路形成和功能LL理解。
这里描述的解剖方法允许从脊髓神经元膜片钳记录,并在胚胎阶段(〜17-48 HPF)和幼体阶段(〜3-7天受精后[DPF])得到成功应用。该方法限制了解剖,以提供对感兴趣的神经元所需要的量。所述协议从多数的其它公开的方法的不同之从在兽医缝合胶斑马鱼脊髓神经元的记录使用的,而不是一个细钨针,胚胎或幼虫附着到记录室。的两种不同的方法的可用性( 即,缝合胶相对于钨针)用于安装所述斑马鱼的胚胎或幼虫用于电生理分析为研究人员提供替代方案,以实现其特定的实验目标。
首先,从弹出访问和记录过程初级感觉神经元的ulation,Rohon-胡子细胞,进行了描述。这些神经元的细胞体位于背侧脊髓内。 Rohon-胡子细胞存在于许多脊椎动物物种,在开发早期分化,和背后胚胎触摸响应6,44,47,48。
第二,用于访问和从脊髓运动神经元的记录程序的详细。期间神经发生的两个波斑马鱼脊髓运动神经元引起的。在出生较早初级运动神经元出现在原肠胚形成(〜9-16 HPF)的端部,只有3-4本每hemisegment 45,46,49初级运动神经元。相反,次级运动神经元的后出生人口是比较多,而且在长时间内产生,起始于14〜HPFEF"> 45,50。在中间躯干段二级运动神经元起源主要是由51 HPF 50完成。二级运动神经元都被认为是运动神经元的羊膜对方46。有趣的是,脊椎神经元,经由多巴胺,调节运动在胚胎的幼虫和次级运动神经元起源和年轻幼虫50,51。初级和次级的运动神经元的每一个包括若干不同的亚型。每个初级运动神经元亚型的项目的外围轴突其支配的特性的肌肉群,从而导致刻板,识别轴突轨迹。通常,次级运动神经元遵循先前由初级运动神经元建立的轴索途径。因此,相对于轴突轨迹,原发性和继发性运动神经元是相似的,不同之处在于厚度轴突胞体和尺寸的重新更大初级运动神经元45。
三,讨论从几个类型的interneurons的记录方法。然而,在这些情况下,需要去除其它脊髓细胞的有限量的,因此,脊髓比从Rohon-胡子细胞或运动神经元的录音少完好无损。
研究方案
(;实验动物资源处安舒茨科罗拉多大学医学校园IACUC)所有动物的程序是由机构动物护理和使用委员会的批准。
1.斑马鱼的饲养
- 提高,并在28.5℃下在10小时黑暗/ 14小时光照循环,并用适当的水处理和交换52保持成年斑马鱼鱼(Danio rerio)。
- 提高斑马鱼胚胎/幼虫在28.5℃下在胚胎培养基,直到它们达到所要求的阶段( 例如,2 DPF)。
2.夹层材料的制备
- 点胶机斑马鱼解剖
注意:此协议涉及使用兽医缝合胶水附着制备到录音室。成功使用缝线胶需要少量胶水的以受控的方式应用。胶开始固化,只要它遇到水环境中。因此,绘制成胶微量和交付使用自制的"点胶",允许通过口腔负压或正压应用少量。胶分配器的中央部分是一个玻璃的孔,被包括含有硼硅酸盐薄壁玻璃毛细管中( 图1A)的封装内的部件。在一端,该孔经由一块柔性管到吹嘴连接,而另一端保持所述玻璃微量( 图1)。- 从一个玻璃孔取出黑色灯泡并与来自另一玻璃孔( 图1B和1C)的白色橡胶适配器代替它。
注意:此双适配器封端的玻璃孔通过一个小的,直的聚丙烯配件( 图1B, 插图 )允许在一个端部连接到玻璃微量吸管和,在另一端,一块柔性管。 - 切一块柔性管到的〜38厘米的长度。附嘴件( 例如,黄色200μL微管尖端)到不连接到上述玻璃孔中的柔性管的端部。
注:管件应足够长,以允许下解剖范围的玻璃微量移液管的操纵的同时微量黄色尖端是在口腔中( 图1D)。
- 从一个玻璃孔取出黑色灯泡并与来自另一玻璃孔( 图1B和1C)的白色橡胶适配器代替它。

图1:胶分配器。 (AC)的玻璃孔在一端和在另一玻璃微量移液管连接到柔性管。橡胶适配器允许附件通过小配件聚丙烯(B, 插图 )到管道,并最终到在另一端的玻璃微量移液管。 (D)最终胶分配器具有烟嘴( 例如,从一个PLAS制成抽动移液管尖端)在管道的一端,并且,在另一( 箭头所附微量玻璃孔)。
- 分割/记录室
注:解剖室也作为电录音室。形成在使用固化的有机硅弹性体( 图2A)的预切割片载玻片的腔室中。- 为了制备有机硅弹性体,所述基部和所述固化剂以4添加到塑料锥形管:1的比例,分别。
- 调匀的弹性体基体和固化剂和倾混合成两个百毫米培养皿中。倾弹性体的厚度为<1mm的一个培养皿中,并〜2.5mm的另一个。
- 允许硅胶弹性体暴露于固化在空气中〜4-5天。如果需要固化的弹性体越早,在60℃下孵育它。
- 切固化有机硅弹性体为以下尺寸的部分:
- 从〜1毫米厚的固化的弹性体,切出一个〜3.8×6.3厘米矩形;这一块作为腔室( 图2A)的底部。从约2.5毫米厚的固化的有机硅,切矩形〜3.8×6.3厘米。从后者矩形,切出一个内部矩形〜2.5×5厘米;所得到的帧作为所述腔室( 图2A)的顶部。
- 为了使夹层/记录室中,直接放置在薄硅酮矩形在载玻片上(5×7.6cm)的顶部,确保有机硅和玻璃( 图2A)之间除去任何气泡。放置硅酮矩形框,从较厚弹性体切割,在有机硅的薄底部层的顶部。
- 验证硅层以及附着到彼此,并且有两个层( 图2A)之间没有气泡。
- 在使用后,通过从底部硅氧烷捻除去厚矩形硅氧烷帧拆卸腔室呃附加到载玻片。冲洗与DDH 2 O的使用和干燥之前和每个记录会话后,用低皮棉湿巾硅酮表面。
- 存放室干燥,防止硅的两片之间的真菌生长。
注意:如果使用,可能无法从硅酮容易冲洗毒素或药理学试剂,专用于这些目的具体腔室。

图2:电室和解剖工具。 (A)用于解剖和电生理记录的室由玻璃载片,其上放置固化的有机硅弹性体的两片,层叠在彼此的顶部上,以提供一个框架和用于井底部的。孔的大小,〜2.5×5厘米,允许使用细胞外记录的小体积(2-2.5毫升)的解。底部硅层允许与不粘附到玻璃上的斑马鱼胚胎使用组织粘合剂的安全定位。 (B)的玻璃微量移液管(顶部)被用于在解剖胶水输送。薄壁玻璃被拉以创建长,锥形端稍后切割,用直径为75μm的〜创建的尖端。锥形玻璃微量附着于胶分配器( 图1D, 箭头 )和前填充通过吸入的应用用胶水的自由端。其它微量( 底部 ),拉作为一个用于膜片钳记录,用于后脑的横切和皮肤去除。 (C)在一个直立显微镜,显微操作用来操纵微量的最后解剖步骤。的玻璃微量移液管,如在B, 底部 ,被附接到电极支架( 箭头 )。肌去除以实现通过连接到空气出口( 箭头 )的管pplying吸力。在其另一端,管连接到旋塞阀( 黑色箭头 )的是,在其另一侧( 星号 ),具有连接到吹口管。
3.胚胎和幼虫的解剖用于脊髓神经元的膜片钳记录

图3:斑马鱼脊髓背清扫。 (AA")横断后脑的(a)的2旦胚胎的,皮肤被切断对胚胎(b)中的左侧和右侧后。第二切口,垂直于所述第一,然后进行(c)中 。接下来,皮肤用微量,让镊子夹住并拉离皮肤解除。 (B)在皮肤的除去暴露该背侧脊髓。喙黑线,滑雪N具有被移除和脊髓( 星号 ),包含在脑膜内的表面,被暴露。皮肤保持不变尾椎黑线( 箭头 )。 (CC")的玻璃微量的前端被按压在脑膜,快捷,横向短的运动被执行以刺穿脑膜。 (DD"和E-E")一旦脑膜刺穿(DD"),微量先进(EE")移动到吻侧脑膜撕裂成两个部分。 Rohon-胡子神经元的胞体通常出现在去除脑膜( 箭头 )。 (FG")在7旦幼虫,肌肉层覆盖脊髓的背侧,阻碍进入Rohon-胡子神经元。在除去皮,幼虫用0.05%胶原酶处理。 (F)将5分钟温育用0.05%胶原酶是过于严格,导致在过度肌肉损伤,如通过磨损肌肉( 箭头和插图 )证实。 (F")过度胶原酶处理也可能会损坏Rohon-胡子神经元( 箭头 ),可以通过在TG(islet2b:GFP)的GFP的表达这里揭示线。 在TG(islet2b:GFP)线,背根神经节神经元也表达GFP( 箭头 )。甲简短1分钟温育用0.05%胶原酶充分放松肌肉(G),同时保护所述肌节形态( 箭头和插图 )。 (G")颜料的细胞存在于最背侧肌肉层( 箭头 )的顶部上。 (H和I)在TG(islet2b:GFP)线,Rohon-胡子神经元( 箭头 )和背根神经节( 箭头 )继续在7旦表达GFP。背视图Tg为:在2旦(islet2b GFP)斑马鱼胚胎(H)的ð7旦(I)。在图A比例尺= 500微米; BE(图B示出)比例尺= 80微米; F '和G'(在图F示出)比例尺= 200微米; H和I(在图H所示)比例尺= 100微米。 请点击此处查看该图的放大版本。
- 胚胎解剖从Rohon胡子细胞录音
- 放置在含有林格氏溶液的约2-3毫升( 图2A)解剖腔的胚胎。通过加入0.4%三卡因溶液到室100〜μL固定胚胎。
- 上微量拉薄壁玻璃微量牵拉使用箱长丝,以获得长而细的尖端,类似的注射微量( 图2B, 上图)53。
- 装上拉玻璃微玻璃孔ØF中的胶分配器。下的解剖显微镜下,使用镊子打破玻璃微量的尖端,使得尖端是〜75微米( 图2B,上图)。
注:笔尖尺寸应该足够大,以允许胶的高效装载入通过负压(口吸入)到的应用程序的尖端前填充微量,但小到足以允许所述胶水通过正压精确应用。 - 通过吹口施加吸力加载用胶水的〜3-5μL的玻璃微量。使胶填充的尖端到清扫室。
注:灌装胶水微量需要强大的吸力。如果微管与弱吸附迅速填满,尖端太大。 - 放置在记录室( 图3A和3A")的胚胎;从胚胎和低龄幼虫(≤72HPF)的录音,也没有必要去除肌肉组织。
- 带来胚胎/幼虫,同时维持经由嘴管的微微正压的头部附近的胶加载微量的尖端(防止水溶液的条目)。一旦该尖端部是胚胎的头部附近,施加足够的正压力以排出胶水小滴到室的底部。
注:胶在与水溶液接触变硬一次,所以适用,且它被放置在解剖溶液保持温和正压是重要的。 - 用解剖针工具来移动胚胎/幼虫对胶水的下降,使得头部与所述胶水接触。定位在头上的胚胎背侧的一面朝上,然后按以确保与胶水接触良好。
- 由于胶水慢慢变硬,用解剖针重新定位胚胎/幼虫使得其位于腹面的一面朝下,背部朝上。浸解剖销工具进入胶的下降和绘制胶线程结束,整个头胚胎,以进一步巩固其地位。
注:三卡因加快在该胶硬化率。为了让更多的时间与胶工作,使用固定的胚胎/幼虫需要三卡因的最小量。另外,硬化速度可与不同批次的胶水的不同而不同。因此,使用一批新的胶水时,将其用于解剖前确定它的硬化速度。 - 一旦头被牢固地附接至硅氧烷和胶水固化,牺牲由横切胚胎/幼虫在后脑水平与另一个玻璃微量( 图3A-a和4A-a)中 。
注:后脑横断是这里用于人道处死动物的方法。但是,根据实验的目标( 例如,假想的游泳的研究),可能需要另一种方法。 - 尾部附着到腔室之前,除去从树干皮肤。
- 使用新鲜的玻璃微量( 图2B, 底部 )表面上切开皮肤几次的位置处尾椎后脑( 图3A-B和4A-B)。刺穿皮肤表面上通过在躯干为背侧的每一侧垂直于首尾轴移动移液管安装( 图3A-B)标本或树干上为横向安装的试样( 图4A-B)的暴露侧。
- 创建皮肤镊子夹住的襟翼,刮去皮肤数次微量在水平和垂直于在步骤3.1.10.1( 图3A-C和4A-C)的初始切割。
- 使用镊子,逐步解除皮瓣和尾部拉扯皮肤。
注意:这常常导致去除躯干皮肤的整体。但是,someti必要MES通过执行重申刮皮肤的拉动去除皮肤中的几个部分。对于一些应用,部分除去皮肤的可允许足够的权限访问兴趣( 图3B和4B)的脊髓节段。 - 递送胶的附近的胚胎/幼虫的尾部一小滴。使用该胶尾部连接到解剖腔的底部。在该步骤期间,由于胶变硬,调整与所述解剖销工具躯干的位置,以确保躯干保持背侧定向并且其牢固地附接至腔室中。
- 根据这一初步解剖,林格氏液冲洗广泛的制备取三卡因和碎片。允许制备静置约5分钟。
- 更换与细胞外的录音解决方案的夹层解决方案。如果需要,添加固定剂的制备( 例如 ,α银环蛇毒素[最终conce1μM的ntration])。
注:1μMα银环蛇毒素固定不动1到2旦的胚胎内〜30分钟。对于较老的幼虫,可能需要α银环蛇毒素的浓度较高。 α-银环蛇毒素被记录,其通常持续1个小时内进行的过程中保持在浴溶液。含有二价阳离子,如钴录音解决方案,不需要另外的固定剂。对于需要长时间记录期间(在1个小时内)的实验中,制剂被灌注在0.5-1毫升/分钟的速率浴溶液。 - 与所安装的胚胎到装有40X水浸泡长工作距离物镜直立化合物显微镜的载物台移动的清扫室。
注意:此显微镜是其中记录将被执行的钻机的一部分。该钻机还应该配备一个探头,一个膜片钳放大器,显微操作,和一个数据采集/计算机系统( 图2C)。 - 安装一个空的硼硅酸盐厚壁玻璃微量到探头( 图2B, 底部和2C, 箭头 )的电极保持器。在一个端部到所述电极保持器( 箭头 )的空气出口,并且在另一端连接到三路活塞( 图2C连接管(〜90厘米内径:0.26厘米,外径:0.32厘米,长度) , 黑色箭头 )。
- 放置在烟嘴另一个管件的一端(〜长度60-70厘米),并将其在另一端( 图2C, 黑星号 )附加到三通旋塞阀。
注意:此管系统允许的正,负压力时密封形成应用到记录移液管的内部。
- 放置在烟嘴另一个管件的一端(〜长度60-70厘米),并将其在另一端( 图2C, 黑星号 )附加到三通旋塞阀。
- 使微管尖端到脊髓的最背侧部分并轻轻刺穿脑膜。与迅速跟进,短,侧向移动到厕所森脑膜( 图3C和3C")。
- 微量移液器尖端已经穿过脑膜后,前进和提高的微拉脑膜从脊髓( 图3D和3D")的距离。
- 嘴侧移动至微量,在前进1〜2 hemisegments以暴露Rohon-胡子细胞( 图3E和图3E")。
注:解剖只露出几个Rohon胡子细胞所需脑膜的最小量。每个记录之后,进行额外的解剖以显示更多Rohon-胡子细胞。在这两种胚胎和幼虫,Rohon-胡子神经元可能偶尔突发在与补丁微量接触。其他脊髓神经元不行为这种方式,并暗示这可能反映了Rohon胡子细胞的独特性能,如他们的mechanosensitivity。为了支持这一点,几个溶液组合物( 例如,离子成分及渗透压)进行了测试,并没有阻止Rohon-胡子细胞的这种行为。
- 幼虫的解剖从Rohon胡子细胞录音
注意:在图7的dpf幼虫,围绕所述背侧脊髓肌肉必须被去除。按照步骤3.1.1至3.1.15(与胚胎取代的幼虫)用酶处理之前。- 要取出肌肉,孵育用0.05%胶原酶的幼虫1分钟。
- 通过用林格氏溶液漂洗制备〜5倍除去胶原酶。遵循〜5漂洗细胞外溶液中,以完全除去胶原酶。
- 在记录钻机的显微镜的载物台安装在记录室之后进行解剖的剩余部分。附加一个硼硅酸盐厚壁补丁微量( 图2B, 底部 )到电极保持器,并通过轻轻刷涂靠在底部打破微量的尖端硅室。
- 用略微沙哑微管逗肌肉路程,暴露脊髓背侧。从制品中除去肌纤维,通过附接至电极保持器出口管施加吸力。使用显微操作沿着肌纤维的长度移动微量而施加抽吸。
注:我们的目标是先用微量到松开机械肌肉,然后吸走,并删除个别的肌肉纤维。偶尔,去除肌肉的过程中,微量变得与被吸附的组织堵塞。- 以疏通微量,刷微量抵靠腔室的底部,稍微打破了尖端,同时通过管道吹入空气以排出内容物。
注意:如果微管尖端的大小变得过大,可能需要一个新的微量。除去肌肉层CL当微量移液器尖端的尺寸是更关键osest至脊髓周围的或脑膜(小微量提示允许更受控工作)的膜。
- 以疏通微量,刷微量抵靠腔室的底部,稍微打破了尖端,同时通过管道吹入空气以排出内容物。
- 除去脑膜如在步骤中描述3.1.18-3.1.20使用新的微量( 图2B, 底部 )。
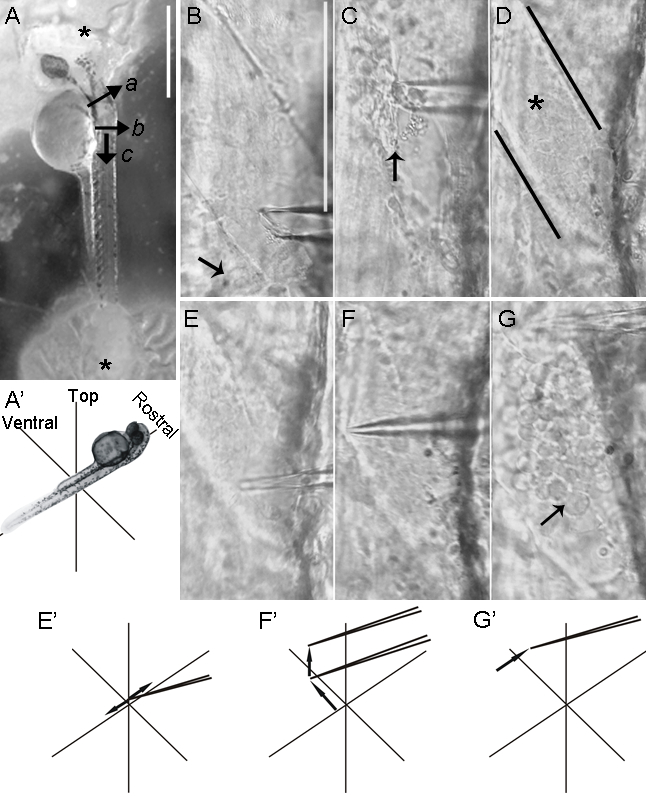
图4:斑马鱼脊髓横向清扫。在横向取向安装斑马鱼胚胎便于访问运动神经元。适于与40X水浸物镜直立显微镜下进行,以暴露运动神经元在去除肌肉和脑膜的夹层(参见图2)。 (A)运动神经元细胞体和腹侧横向位于脊髓内。使得它们的背侧面电极架胚附接至腔室中。需要注意的是缝合胶一旦硬化( 星号 )显示为白色。一旦后脑被横切( 一 ),皮肤以点(B)到尾使用玻璃微后脑砍表面上几次。附加浅表切口(c)所示,垂直于第一组(b)中 ,形成皮肤标签该镊子可以抓住用于去除皮肤。 (BG)一个空的玻璃微量,上拉至一个短,锥形尖端( 图2B, 底部 ),被附接到电极保持器。微量使用用于随后的精细解剖和除去肌肉组织的显微操纵。 (B)的玻璃微量的尖端首先通过轻轻刷涂它抵靠腔室的底部,从而形成锯齿状端和较大尖端直径稍微打破。而被施加抽吸微量沿着肌肉纤维的长度移动。肌纤维去除一个层在一个时间,以防止潜在的脑膜的破坏。在胚胎,最背侧肌肉层首先除去,因为这些倾向于更薄。皮肤不从更尾hemisegments( 箭头 )去除。 (C)在一个hemisegment肌肉的背部一半已被移除( 箭头 )。 (D)黑线划界hemisegment缺乏肌纤维,具有完整脑膜覆盖脊髓( 星号 )。 (EE")使用微量吸管,将压力的位置处施加到脑膜略微背侧到运动神经元胞体。快,短,微量的横向运动导致脑膜的刺穿。 (FF")的微量被腹侧前进时,朝向hemisegment的腹面,且被起吊脑膜从神经元组织中分离出来。 (GG")脑膜通过沿的长度吻侧移动微量横断hemisegment。神经元立即从暴露的脊髓出现,现在到贴片电极( 箭头 )访问。比例尺=500μm的在(A);比例尺=100μm的BG(在图B示出)。
- 胚胎运动神经元和中间神经元记录的解剖
- 放置在含有林格氏溶液解剖腔室中的胚胎,并用三卡因固定胚胎,如在步骤3.1.1。
- 安装胚胎横向地,以其背侧面对最适于用户在腔室的一侧(通常取决于旋向)。按照步骤3.1.2-3.1.17和确保胚胎保持靠在硅氧烷( 图4A和4A")是平的。
- 使用硼硅酸盐厚壁微量具有尖端已破碎至〜25μm至刮和抽吸肌肉远离并暴露脑膜,如在步骤中描述3.2.4-3.2.4.1( 图4B - <强> 4D)。
- 一旦肌肉层从感兴趣( 图4D)的hemisegment(一个或多个)中除去,更换一个新的,具有完整末端( 图2B, 下图)的玻璃微。在那个背是向目标神经元的位置穿刺脑膜。使用显微操作,推微量向下到脑膜,然后迅速将其移动侧向撕裂并遍历脑膜( 图4E和图4E")。
- 一旦破裂脑膜,推进和提高微量解除脑膜从脊髓( 图4F和4F")的距离。嘴侧移动至微量撕裂沿hemisegment( 图4G和4G")的长度的膜。
注:对于从Rohon-胡子细胞和原运动神经元的录音,清扫被限制为从immediat清除脑膜远Ë目标区域。相反,对于从的interneurons和次级运动神经元的记录,有必要以除去阻碍获得感兴趣的细胞的脊髓内的神经元。在后一种情况下,由于脊髓电路的广泛中断,研究仅限于固有电膜性能的分析。
4.电生理记录从脊髓神经元中
- 用于从Rohon-胡子细胞和运动神经元的记录,使用拉至〜3MΩ的电阻硼硅酸盐厚壁玻璃毛细管时充满移液管溶液(图2B, 底部 )。
- 通过附接至电极保持器在浴中浸渍微量之前的管轻轻地吹施加正压。
注:正压力防止碎屑堵塞微量移液器尖端和通过转动旋塞阀三通到关闭p保持osition。一旦目标神经元附近时,正压力将导致细胞膜,一个有用的指标,该微量足够接近以启动密封形成鲜明的缩进。 - 通过转动旋塞阀到打开位置,同时通过吹口施加额外的光吸释放正压力。
- 细胞膜和微量移液器尖端之间的GΩ密封的形成后,施加吸力的短暂脉冲破裂的膜,实现了全细胞构型。
- 建立稳定的全细胞构型,与输入电阻500MΩ和接入电阻10MΩ后,得到在任一电压或电流钳模式记录。
- 通过附接至电极保持器在浴中浸渍微量之前的管轻轻地吹施加正压。
结果
( 图5A和5B),我们已经成功地从Rohon胡子神经元记录在17个HPF胚胎到7 DPF幼虫。当Rohon-胡子细胞记录,将制备物固定背的一面朝上。这种安装允许基于它们的表面背的位置和大胞体大小Rohon-胡子细胞的明确识别。识别另外由这些神经元的超极化的定型静息膜电位( 图5, 小图表 )6,54证实。此外,由于初级感觉神经元,Rohon-胡子神经元缺乏突触输入。因此,在没有电刺激的,在电流钳模式( 图5B")记录,而应该发生在膜电位没有变化。由于从Rohon-胡子细胞的初始记录在斑马鱼中进行 6,各种转基因品系( 例如,TG(islet2b:GFP),TG(NGN:GFP),且Tg(isletss:GFP))已经产生,在这些神经元表达荧光报告,进一步促进他们识别55,56,57。
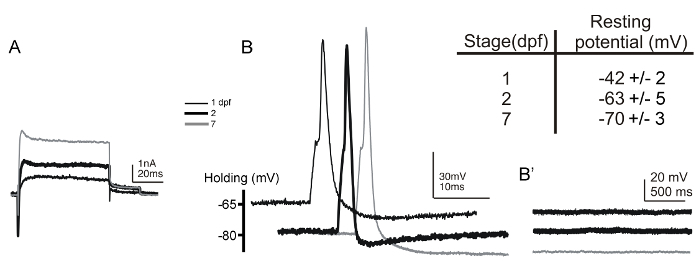
图5:在1从Rohon-胡子神经元全细胞电压和电流钳记录和2 DPF胚胎和7 DPF幼虫。 (A)的向外电压钳记录和内向电流从Rohon-胡子神经元在1-(细黑线)得到的2-(粗黑线)和7-DPF(灰线)的胚胎/幼虫。保持电位是-80毫伏和电流由一个去极化步骤,以20毫伏引出。 (B)单动作电位是通过短暂(1ms)中的电流引起的注射(〜0.35 NA)至1-(细黑线)的Rohon-胡子神经元,2-(粗黑线)和7-DPF(灰线)的胚胎/幼虫。 (B")在不存在的电刺激的,在膜电位没有变化,如自发突触后去极化,发生在Rohon-胡子神经元。插图表总结搁从Rohon-胡子神经元记录的1-(N = 21)和2-(N = 9)的dpf胚胎和7-(N = 7)单丝旦幼虫膜电势的值。 请点击此处查看该图的放大版本。
转基因株系允许其他脊髓神经元亚型的明确识别也可用。在这些当中,MNX1转基因品系的Tg(MNX1:GFP)表达在脊髓运动神经元的一个子集的绿色荧光蛋白(GFP)及其规范(〜14-16 HPF)后不久 58,59。由于每个hemisegment( 图6A)内的初级运动神经元的刻板的定位,与在转基因MNX1 GFP表达在一起,所以能够识别各种初级运动神经元亚型( 图6B和6C)。包括在记录电极溶液中的荧光染料允许轴突轨迹的可视化,提供运动神经元的身份附加的确认,因为一些的interneurons也表达在TG(MNX1:GFP)GFP线。可替代地,另一种转基因品系,其允许运动神经元的鉴定是ET2线60。
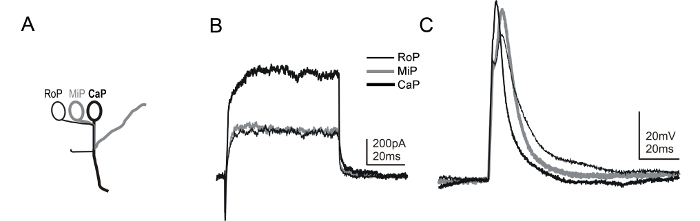
图6:全细胞电压和电流钳从1运动神经元的dpf斑马鱼安柏瑞录音操作系统。 (A)一种卡通描绘存在于所述斑马鱼脊髓初级运动神经元亚型的特定形态特征。初级运动神经元可以通过体细胞的一个段内的位置来识别( 即,喙[的RoP],内侧[MIP],或尾鳍[CAP])45。此外,每个亚型延伸经由不同路径的轴突到外围。将合并使用的Tg(MNX1:GFP)的线和染料标记揭示的定型轴突在心轴和运动神经元亚型的记录期间的标识。使用这里介绍的方法,能够以相同的hemisegment内从三个不同的初级运动神经元亚型顺序记录。 (B)电压钳记录中示出从的RoP,MIP和CAP,都在一个单一hemisegment获得的。电压步骤到20毫伏是用来从-80mV的保持电位激发电流。 (C)在电流钳ř从的RoP,MIP和CAP,短暂(1毫秒,0.4〜NA)ecordings电流注射的施加以触发一个动作电位。膜电位在〜-65举行毫伏。 请点击此处查看该图的放大版本。
初级和次级的运动神经元之间的主要区别是出生早期神经元的胞体较大。然而,次级运动神经元亚型是不是由体细胞大小或位置识别。用于从特定辅运动神经元的录音中,两个转基因品系,TG(GATA2:GFP)和TG(islet1:GFP),已被用于识别次级运动神经元腹侧与背侧和突出轴突,分别为55,61。然而,第三次级运动神经元亚型存在于斑马鱼脊髓,用AXONS该项目背部和腹部62。因此,染料可以被用于填充次级运动神经元记录期间识别的形态的基础上( 图7A)8,9上亚型。通常情况下,从二次运动神经元,电压钳( 图7B中 , 星号 )或电流钳记录( 图7C和图7C", 箭头 )中自发的或突触事件被记录。

图7:全细胞电压和电流钳从2次级运动神经元的dpf胚胎录音。 (A)在TG(GATA2:GFP)线,两个不同的二次运动神经元亚型表达GFP 62。在左hemisegment,腹侧辅助运动神经元( 星号和箭头指示胞体和轴突,分别地)。在邻近hemisegment,右侧(尾侧),有一个腹侧/背次级运动神经元( 星号表示体细胞; 箭头指示两个轴突,一个突出腹侧[底部箭头]以及其他背侧[顶箭头])。这些神经元标记与记录时的红色荧光染料。为了鉴定腹侧/背次级运动神经元,这是至关重要的,以确保解剖不会在相邻的尾hemisegment除去肌肉,从而损坏或去除所述背轴突。在记录之后,因为它是从制剂( 右顶部星号 )拉离所述神经元细胞体保持附着在微量。当使用染料记录期间填充神经元,染料常常泄漏而电极是在浴,产生了红色荧光背景在脊髓和脊索( 底部星号在延髓[左] hemisegment <可见 / em>的)。从腹侧和腹侧/背次级运动神经元得到的(B)的电压钳记录。电压的步骤(至-30,-10,+ 10,+ 30,50,70,90,和110毫伏)引起向外和向内的电流。松开动作电位/去极化可以是存在于所述记录( 星号 )。 (C)在从二次运动神经元,短暂(1毫秒)增加振幅的电流注射的电流钳记录施加到神经元触发动作电位( 星号 )。 (C")由〜0.4-NA电流注射的在次级运动神经元触发单个动作电位的例子被示出。在此阶段,自发动作电位也观察到(C和C", 箭头 )。 (D)长时间(100毫秒)电流注射的(〜0.35 NA)引发动作电位的重复放电。膜电位在〜-65举行毫伏。负载/ 55507 / 55507fig7large.jpg"目标=‘_空白’>点击此处查看该图的放大版本。
讨论
这里描述的方法允许脊髓的最小解剖后斑马鱼胚胎的感觉和运动神经元的电和形态学特征。神经元至少1小时,强加给这些录音时间限制保持健康。神经元已经使用标准的全细胞构型记录,以及从核贴剂;后者的方法最小化,可以排除离子电流9的详细研究生物物理空间钳的问题。
一个重要的挑战是实现胚胎或幼虫室的坚定执着,以去除皮肤和执行提供访问感兴趣的神经元所需要的有限的解剖。制剂也需要被适当地固定到录音室的全细胞膜片钳方法。即通过使用兽医缝合胶应对这一挑战的方法来连接胚胎或幼虫解剖/记录室这里所描述的,已被用于其它模式生物的解剖性的方法( 例如,果蝇 )63。从我们的经验培训他人,我们发现,掌握了最关键的一步是少量胶水的控制和精准投放。这里,胶分配器装置,其允许使用者施加负和正压力,以胶装入或从微量的尖端排出被讨论。使用缝线胶,胚胎和幼虫可被牢固地附接到所述腔室和面向既背朝上或横向。通过这种方式,为各种神经元的不同的接入选项可供选择。另外,在腔室底部有机硅弹性体的层可以比此处指定的1mm时,提供潜在的优点光学甚至更薄。另一种方法,更通常用于连接的准备到记录室中,包括使用的细钨插针1 <SUP>,2,3,4,5。虽然这方法不同,都允许以斑马鱼的脊髓神经元的电接入,从而得到研究人员可以根据目标和实验的挑战,可以选择的选项。
这里所描述的斑马鱼制备允许原位脊髓神经元的电和形态学研究期间分化的他们的早期阶段。通过使用这些方法从脊髓神经元的记录,我们甚至损毁基因6,64,65的识别之前,获得了洞察几个突变的细胞效应。
披露声明
作者宣称没有竞争的经济利益。
致谢
这项工作是由来自美国国立卫生研究院(F32 NS059120到RLM和R01NS25217和P30NS048154到ABR)的资助。
材料
| Name | Company | Catalog Number | Comments |
| Vacuum filter/Storage bottle, 0.22 mm pore | Corning | 431096 | |
| Syringe filter 0.2 mm | Whatman | 6780-2502 | |
| Tricaine | Sigma | A-5040 | Ethyl 3-aminobenzoate methanesulfonate salt |
| α-bugarotoxin | Tocris | 11032-79-4 | |
| Tetrodotoxin | Tocris | 4368-28-9 | |
| Alexa-549 hydrazine salt | Molecular Probes | A-10438 | fluorescent dye |
| Spin-X centrifuge tube filter | Corning | 8161 | |
| Glass microscope slide | Fisher | 12-550C | |
| Sylgard silicone elastomer kit | Dow Corning | 184 | silicone elastomer |
| Petri dishes | Falcon | 351029 | |
| Borosilicate glass capillaries | Harvard Apparatus | 30-0038 | inner and outer diameters of 0.78 and 1.0 mm (thin walled glass capillaries) |
| Borosilicate glass capillaries | Drummond Scientific | 1-000-1000-100 | inner and outer diameters of 1.13 and 1.55 mm (thick walled glass capillaries) |
| Miniature barbed polypropylene fitting | Cole-Palmer | 6365-90 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Collagenase XI | Sigma | C7657 | |
| Microelectrode puller | Sutter Instruments | Model P-97 | |
| Amplifier | Molecular Devices | Axopatch 200B | |
| Head stage | Molecular Devices | CV203BU | |
| Motorized micromanipulator | Sutter Instruments | MP-285 | |
| Tygon tubing | Fisher | 14-169-1B | ID 1/16 IN, OD 1/8 IN and WALL 1/32 IN (flexible laboratory tubing) |
| Electrode holder | Molecular Devices | 1-HC-U | |
| Pharmaseal Three-Way Stopcocks | Baxter | K75 | |
| Digitizer | Axon Instruments | Digidata 1440A | |
| Inverted microscope | Zeiss | Axioskop2 FS plus | |
| 40X/0.80W Achroplan objective | Zeiss | ||
| Data acquisition and analysis software | Axon Instruments | PClamp 10 - Clampex and Clampfit | |
| Micropipette puller | Sutter Instruments | Model P-97 | |
| Name | Company | Catalog Number | Comments |
| Dissection and Recording Solutions (in mM) | |||
| All solutions, except the intracellular, are stable for ~2-3 months when filtered (0.22 mm filter cups) and stored at room temperature (RT). | |||
| The intracellular solution is filtered (0.2 mm syringe filters) and stored frozen (-20 °C) in small aliquots that are individually thawed on the day of use. | |||
| Dissection/Ringer’s solution | 145 NaCl, 3 KCl, 1.8 CaCl2.2H2O, 10 HEPES; pH 7.4 (with NaOH) | ||
| Pipette (intracellular) recording solution | 135 KCl, 10 EGTA-acid, 10 HEPES; pH 7.4 (with KOH). | ||
| Bath (extracellular) recording solution/voltage and current-clamp | 125 NaCl, 2 KCl, 10 CaCl2.2H2O, 5 HEPES; pH 7.4 (with NaOH). | ||
| Alexa-594 hydrazine salt stock solution. | Prepare a 13.2 mM stock in ddH2O, aliquot (~100 µl) and store at -20 °C. For use, dilute the stock solutiond 132 fold with pipette solution to a final concentration of 100 mM. After dilution, filter the Alexa-594 containing pipette solution with a centrifuge tube filter. | ||
| Name | Company | Catalog Number | Comments |
| Immobilizing agents | |||
| 0.4% ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Prepare a 0.4% stock solution in 0.2 M Tris, pH 9 (0.4 g Tricaine/100 mL 0.2 M Tris | ||
| Adjust pH to 7 with NaOH and store at -20 °C. | |||
| For use, dilute the stock solution ~25 fold in embryo media | |||
| 250 mM α-bungarotoxin | Prepare a 250 mM stock in ddH2O (1 mg/500 mL), prepare 100 µL aliquots, and sotre at -20 °C. | ||
| For use, dilute 2,500-fold with extracellular solution to a final concentration of 100 nM. | |||
| 1 mM Tetrodotoxin | Prepare a 1 mM stock in ddH2O (1 mg/3 mL), prepare 100 µL aliquots, and sotre at -20 °C. | ||
| For use, dilute 2,000-fold with extracellular solution to a final concentration of 500 nM. | |||
参考文献
- Drapeau, P., Ali, D. W., Buss, R. R., Saint-Amant, L. In vivo recording from identifiable neurons of the locomotor network in the developing zebrafish. J Neurosci Methods. 88 (1), 1-13 (1999).
- Drapeau, P., Saint-Amant, L., Buss, R. R., Chong, M., McDearmid, J. R., Brustein, E. Development of the locomotor network in zebrafish. Prog Neurobiol. 68 (2), 85-111 (2002).
- Saint-Amant, L., Drapeau, P. Whole cell patch-clamp recordings from identified spinal neurons in the zebrafish embryo. Methods Cell Sci. 25, 59-64 (2003).
- Masino, M. A., Fetcho, J. R. Fictive Swimming Motor Patterns in Wild Type and Mutant Larval Zebrafish. J Neurophysiol. 93 (6), 3177-3188 (2005).
- Wen, H., Brehm, P. Paired motor neuron-muscle recordings in zebrafish test the receptor blockade model for shaping synaptic current. J Neurosci. 25 (35), 8104-8111 (2005).
- Ribera, A. B., Nüsslein-Volhard, C. Zebrafish Touch-Insensitive Mutants Reveal an Essential Role for the Developmental Regulation of Sodium Current. J Neurosci. 18, 9181-9191 (1998).
- Pineda, R. H., Heiser, R. A., Ribera, A. B. Developmental, molecular, and genetic dissection of INa in vivo in embryonic zebrafish sensory neurons. J Neurophysiol. 93, 3582-3593 (2005).
- Moreno, R. L., Ribera, A. B. Zebrafish motor neuron subtypes differ electrically prior to axonal outgrowth. J Neurophysiol. 102, 2477-2484 (2009).
- Moreno, R. L., Ribera, A. B. Spinal neurons require Islet1 for subtype-specific differentiation of electrical excitability. Neural Dev. 9 (1), 19 (2014).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291 (5813), 293-296 (1981).
- Driever, W., et al. A genetic screen for mutations affecting embryogenesis in zebrafish. Development. 123, 37-46 (1996).
- Haffter, P., et al. The identification of genes with unique and essential functions in the development of the zebrafish, Danio rerio. Development. 123, 1-36 (1996).
- Vogel, G. Genomics: Sanger will sequence zebrafish genome. Science. 290 (5497), 1671 (2000).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. 2 (12), 956-966 (2001).
- Lawson, N. D., Wolfe, S. A. Forward and reverse genetic approaches for the analysis of vertebrate development in the zebrafish. Dev Cell. 21 (1), 48-64 (2011).
- Yates, A., et al. Ensembl. Nucleic Acids Res. 44 (D1), D710-D716 (2016).
- Kawakami, K. Transgenesis and gene trap methods in zebrafish by using the Tol2 transposable element. Methods Cell Biol. 77, 201-222 (2004).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Huang, P., Xiao, A., Zhou, M., Zhu, Z., Lin, S., Zhang, B. Heritable gene targeting in zebrafish using customized TALENs. Nat Biotechnol. 29, 699-700 (2011).
- Sander, J. D., et al. Targeted gene disruption in somatic zebrafish cells using engineered TALENs. Nat Biotechnol. 29 (8), 697-698 (2011).
- Chang, N., et al. Genome editing with RNA-guided Cas9 nuclease in zebrafish embryos. Cell Res. 23 (4), 465-472 (2013).
- Hwang, W. Y., et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nat Biotechnol. 31 (3), 227-229 (2013).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nature Rev Genet. 8 (5), 353-367 (2007).
- Levin, E. D., Cerutti, D. T., Buccafusco, J. J. Behavioral neuroscience of zebrafish. Methods of behavior analysis in neuroscience. , (2009).
- Stewart, A., Gaikwad, S., Kyzar, E., Green, J., Roth, A., Kalueff, A. Modeling anxiety using adult zebrafish: A conceptual review. Neuropharmacology. 62, 135-143 (2012).
- Mushtaq, M. Y., Verpoorte, R., Kim, H. K. Zebrafish as a model for systems biology. Biotechnol Genet Eng Rev. 29 (2), 187-205 (2013).
- Phillips, J. B., Westerfield, M. Zebrafish models in translational research: tipping the scales toward advancements in human health. Dis Model Mech. 7 (7), 739-743 (2014).
- Weis, J. S. Analysis of the development of nervous system of the zebrafish, Brachydanio rerio. I. The normal morphology and development of the spinal cord and ganglia of the zebrafish. J Embryol Exp Morphol. 19 (2), 109-119 (1968).
- Bernhardt, R. R., Chitnis, A. B., Lindamer, L., Kuwada, J. Y. Identification of spinal neurons in the embryonic and larval zebrafish. J Comp Neurol. 302 (3), 603-616 (1990).
- Tsuchida, T., et al. Topographic organization of embryonic motor neurons defined by expression of LIM homeobox genes. Cell. 79 (6), 957-970 (1994).
- Guillemot, F. Spatial and temporal specification of neural fates by transcription factor codes. Development. 134, 3771-3780 (2007).
- Goulding, M. Circuits controlling vertebrate locomotion: Moving in a new direction. Nat Rev Neurosci. 10, 507-518 (2009).
- Fetcho, J. R., McLean, D. L. Some principles of organization of spinal neurons underlying locomotion in zebrafish and their implications. Ann N Y Acad Sci. 1198, 94-104 (2010).
- Del Barrio, M. G., et al. A transcription factor code defines nine sensory interneuron subtypes in the mechanosensory area of the spinal cord. PLoS One. 8 (11), (2013).
- Satou, C., Kimura, Y., Hirata, H., Suster, M. L., Kawakami, K., Higashijima, S. Transgenic tools to characterize neuronal properties of discrete populations of zebrafish neurons. Development. 140 (18), 3927-3931 (2013).
- McLean, D. L., Fan, J., Higashijima, S., Hale, M. E., Fetcho, J. R. A topographic map of recruitment in spinal cord. Nature. 446, 71-75 (2007).
- McLean, D. L., Masino, M. A., Koh, I. Y., Lindquist, W. B., Fetcho, J. R. Continuous shifts in the active set of spinal interneurons during changes in locomotor speed. Nat. Neurosci. 11, 1419-1429 (2008).
- McLean, D. L., Fetcho, J. R. Spinal interneurons differentiate sequentially from those driving the fastest swimming movements in larval zebrafish to those driving the slowest ones. J. Neurosci. 29, 13566-13577 (2009).
- Ampatzis, K., Song, J., Ausborn, J., El Manira, A. Separate microcircuit modules of distinct V2a interneurons and motoneurons control the speed of locomotion. Neuron. 83, 934-943 (2014).
- Ljunggren, E. E., Haupt, S., Ausborn, J., Ampatzis, K., El Manira, A. Optogenetic activation of excitatory premotor interneurons is sufficient to generate coordinated locomotor activity in larval zebrafish. J. Neurosci. 34, 134-139 (2014).
- Menelaou, E., VanDunk, C., McLean, D. L. Differences in the morphology of spinal V2a neurons reflect their recruitment order during swimming in larval zebrafish. J Comp Neurol. 522, 1232-1248 (2014).
- Hubbard, J. M., et al. Intraspinal Sensory Neurons Provide Powerful Inhibition to Motor Circuits Ensuring Postural Control during Locomotion. Curr Biol. 26 (21), 2841-2853 (2016).
- Song, J., Ampatzis, K., Björnfors, E. R., El Manira, A. Motor neurons control locomotor circuit function retrogradely via gap junctions. Nature. 529 (7586), 399-402 (2016).
- Lamborghini, J. E. Rohon-beard cells and other large neurons in Xenopus embryos originate during gastrulation. J. Comp. Neurol. 189, 323-333 (1980).
- Myers, P. Z., Eisen, J. S., Westerfield, M. Development and axonal outgrowth of identified motoneurons in the zebrafish. J Neurosci. 6, 2278-2289 (1986).
- Kimmel, C. B., Westerfield, M., Edelman, G. M., Gall, W. E., Cowan, W. M. Primary neurons of the zebrafish. Signals and Sense: Local and Global Order in Perceptual Maps. , 561-588 (1990).
- Metcalfe, W. K., Myers, P. Z., Trevarrow, B., Bass, M. B., Kimmel, C. B. Primary neurons that express the L2/HNK-1 carbohydrate during early development in the zebrafish. Development. 110 (2), 491-504 (1990).
- Rossi, C. C., Kaji, T., Artinger, K. B. Transcriptional control of Rohon-Beard sensory neuron development at the neural plate border. Dev Dyn. 238, 931-943 (2009).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Progress in Neurobiology. 69 (6), 419-449 (2003).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Dev Cell. 25 (5), 478-491 (2013).
- Lambert, A. M., Bonkowsky, J. L., Masino, M. A. The conserved dopaminergic diencephalospinal tract mediates vertebrate locomotor development in zebrafish larvae. J Neurosci. 32 (39), 13488-13500 (2012).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (1995).
- Oesterle, A. . Pipette Cookbook 2015 P-97 & P-1000 Micropipette pullers. , (2015).
- Spitzer, N. C. The ionic basis of the resting potential and a slow depolarizing response in Rohon-Beard neurons of Xenopus tadpoles. J Physiol. 255 (1), 105-135 (1976).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20, 206-218 (2000).
- Blader, P., Plessy, C., Strahle, U. Multiple regulatory elements with spatially and temporally distinct activities control neurogenin1 expression in primary neurons of the zebrafish embryo. Mech Dev. 120, 211-218 (2003).
- Palanca, A. M., et al. New transgenic reporters identify somatosensory neuron subtypes in larval zebrafish. Dev Neurobiol. 73, 152-167 (2013).
- Flanagan-Street, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132, 4471-4481 (2005).
- Arkhipova, V., Wendik, B., Devos, N., Ek, O., Peers, B., Meyer, D. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365, 290-302 (2012).
- Balciunas, D., Davidson, A. E., Sivasubbu, S., Hermanson, S. B., Welle, Z., Ekker, S. C. Enhancer trapping in zebrafish using the Sleeping Beauty transposon. BMC Genomics. 5 (1), 62 (2004).
- Meng, A., Tang, H., Ong, B. A., Farrell, M. J., Lin, S. Promoter analysis in living zebrafish embryos identifies a cis-acting motif required for neuronal expression of GATA-2. Proc. Natl. Acad. Sci. USA. 94, 6267-6272 (1997).
- Menelaou, E., McLean, D. L. A gradient in endogenous rhythmicity and oscillatory drive matches recruitment order in an axial motor pool. J Neurosci. 32, 10925-10939 (2012).
- Rohrbough, J., Pinto, S., Mihalek, R. M., Tully, T., Broadie, K. latheo, a Drosophila gene involved in learning, regulates functional synaptic plasticity. Neuron. 23 (1), 55-70 (1999).
- McKeown, K. A., Moreno, R., Hall, V. L., Ribera, A. B., Downes, G. B. Disruption of Eaat2b, a glutamate transporter, results in abnormal motor behaviors in developing zebrafish. Dev Biol. 362 (2), 162-171 (2012).
- Carmean, V., et al. pigk mutation underlies macho behavior and affects Rohon-Beard cell excitability. J Neurophysiol. 114 (2), 1146-1157 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。