Method Article
ゼブラフィッシュ
要約
この原稿は、ゼブラフィッシュの胚および幼生の脊髄神経細胞からの電気生理学的記録のための方法を説明します。準備は、 その場で神経細胞を維持し、多くの場合、最小の切開を必要とします。これらのメソッドは、最初の電気的興奮の買収からの早期の幼虫の段階を経て、脊髄神経細胞の様々な電気生理学的研究が可能になります。
要約
ゼブラフィッシュは、最初に発達モデルとして導入、他の多くの分野で人気を得ています。急速に発展する生物の大量飼育の容易さは、胚の光学的透明性と組み合わせて、このモデルの初期の魅力的な属性を務めていました。過去20年間、このモデルの成功は、さらに大規模突然変異誘発画面へと遺伝子導入の容易さによって、その従順によって推進されてきました。さらに最近では、遺伝子編集手法は、モデルの力を高めています。
神経発達の研究のために、ゼブラフィッシュ胚及び幼虫は、複数の方法が適用可能なモデルを提供します。ここでは、神経細胞の本質的な特性、電気的興奮の研究を可能にする方法に焦点を当てています。ゼブラフィッシュ脊髄ニューロンの電気生理学的研究のための私たちの準備は、記録室への準備を確保する獣医師の縫合接着剤の使用を含みます。記録のための代替方法ゼブラフィッシュ胚および幼虫から微細なタングステンピン1、2、3、4、5を用いてチャンバに製剤の付着を含みます。最大4幼虫の背側をマウントするために使用されてきたものの、タングステンピンはほとんどの場合、横方向で準備を取り付けるために使用されます。縫合糸の接着剤は両方の向きで胚および幼生をマウントするために使用されています。接着剤を使用して、最小限の解剖は、それによってどんな結果として損傷を回避する、酵素処理を使用せずに脊髄の神経細胞へのアクセスを許可する、実行することができます。しかし、幼虫のために、脊髄の周囲の筋肉組織を除去するために簡単な酵素処理を施す必要があります。ここで説明する方法は、いくつかのdevelopmentaで運動ニューロン、介在ニューロン、及び感覚ニューロンの固有の電気的特性を研究するために使用されていますLステージ6、7、8、9。
概要
ジョージ・ストレジンガー脊椎動物の発生10の遺伝子分析のためのモデル系として、一般的にゼブラフィッシュとして知られ、 ゼブラフィッシュの使用を開拓しました。モデルは、以下を含むいくつかの利点が提供しています:(1)比較的単純で安価な畜産を、 (2)体外受精、最も初期の発達段階から胚への容易なアクセスを可能にします。 (3)透明胚、それらが形成するように、細胞、組織、および器官の直接繰り返し観察を可能にします。
その後数十年にわたり、いくつかの進歩はさらにゼブラフィッシュモデルのパワーを増加させました。具体的には、フォワード遺伝子スクリーニング及び全ゲノム配列決定努力は、14、13、12、11、多くの発生過程に重要な変異および遺伝子の同定に重要な役割を果たし「> 15、16。Gatewayクローニング方法は、転写活性化因子様(TALENs)によって例示さ、トランスジェニックのルーチンアプリケーション17、18に近づくゲノム編集の最近の進歩を可能にし、クラスタ化された定期的interspaced短いパリンドローム反復(CRISPR)-Cas9ヌクレアーゼ、 19、20、21、22に近づく変異の標的に導入を可能と同様に、ノックアウトおよびインをノック。組み合わせ、これらの方法では、ゼブラフィッシュ、特定の行動の根底にある遺伝的メカニズムと、いくつかのヒト疾患の研究のための強力なモデルを作ります23、24、25、26、27。
この作品は、開発に焦点を当てて精神的な規制や神経の発達における電気的活動の役割。焦点は、ゼブラフィッシュモデルはいくつかの利点を提供するために脊髄にあります。まず、胚および幼生の段階でゼブラフィッシュにアクセスすることは比較的容易です。そのため、人は少ないニューロンとシンプルな回路28、29を持っているの発達段階中に脊髄機能を研究することができます。また、ゼブラフィッシュ脊髄は、転写の特性及び特徴的なパターンによって実証されるように、他の脊椎動物と同様ニューロンの多様なセットを持っている30、31、32、33、34、35因子 。
特に、脊髄回路の機能の根底にあるメカニズムを解明することを目指しゼブラフィッシュにおける大多数の研究歩行をサポートするものは、当然のことながら幼虫36、37、38、39、40、41、42、43に焦点を当てています。しかしながら、脊椎機関車のネットワークを形成するニューロンの多くは、初期胚の段階でそれらの分化を開始する、〜9-10時間後に受精(HPF)44、45、46、47、48、49、50、51。そこで、脊髄神経細胞の形態学的および電気的特性が生じ、胚および幼虫期の間でどのように変化するかを理解することOveraのために重要です運動回路の形成と機能のLL理解。
ここで説明する解剖方法は、脊髄の神経細胞からパッチクランプ記録を許可し、正常胚期(〜17から48 HPF)と幼生期(〜3-7日受精後[DPF])で適用されています。このアプローチは、関心のニューロンへのアクセスを提供するために必要な解剖の量を制限します。プロトコルは、獣医の縫合接着剤におけるゼブラフィッシュ脊髄ニューロンから記録するための他の公表された方法の大部分とは異なる記録チャンバーに胚または幼虫を取り付けるために、かなり微細なタングステンピンよりも、使用されています。 2つの異なるアプローチの可用性は( すなわち、タングステンピン対縫合のり)電気生理学的解析のためにゼブラフィッシュの胚や幼生を取り付けるための代替オプションを持つ研究者が具体的な実験の目標を達成するために用意されています。
まず、ポップからアクセスして記録するための手順一次感覚ニューロンのピュレーションは、Rohon-ベアード細胞は、記載されています。これらのニューロンの細胞体は、背側脊髄内にあります。 Rohon・ベアード細胞は、多数の脊椎動物種に存在する初期の開発で差別化、および胚タッチレスポンス6、44、47、48の基礎となります。
第二に、脊髄運動ニューロンからアクセスして記録するための手順が詳述されています。ゼブラフィッシュ脊髄運動ニューロンは、神経発生の二つの波の間に生じます。以前生まれの一次運動ニューロンはhemisegment 45、46、49あたりに存在するだけで3-4一次運動ニューロンと、原腸形成の終わり(〜9-16 HPF)で発生します。これとは対照的に、二次運動ニューロンの後に生まれ人口は、より多数で、長期間の間に発生する、〜14 HPFで始まりますEF "> 45、50。中間トランクセグメントにおける二次運動ニューロン起源が主に51 HPF 50によって完成される。二次運動ニューロンは、羊膜46における運動ニューロンの相手であると考えられる。興味深いことに、脊柱上のニューロンは、ドーパミンを介して、運動を制御します胚及び若い幼虫50における幼虫と二次運動ニューロン起源で、51。一次および二次運動ニューロンそれぞれは、いくつかの異なるサブタイプを含む。各一次運動ニューロンのサブタイプは、ステレオタイプその結果、特性の筋肉群を神経支配する末梢軸索を投射軸索の軌跡を識別する。一般に、二次運動ニューロンは、以前に一次運動ニューロンによって確立された軸索の経路をたどる。このように、軸索軌道に対して、一次および二次運動ニューロンを除いて、類似している軸索の厚さと細胞体サイズA一次運動ニューロン45のための大きい再。
第三に、介在ニューロンの数のタイプからの記録のための方法が説明されています。しかしながら、これらの場合に、他の脊髄細胞の除去の限られた量が必要であり、従って脊髄Rohon-ひげ細胞又は運動ニューロンから記録のためのより少ない無傷です。
プロトコル
すべての動物の手順は、施設内動物管理使用委員会(;実験動物資源のオフィス、コロラドアンシュッツメディカルキャンパスの大学IACUC)によって承認されました。
1.ゼブラフィッシュの飼育
- 上げ、10時間の暗/ 14時間の明サイクルで、適切な水処理及び交換52と28.5℃の成体ゼブラフィッシュ( ゼブラフィッシュ ) を維持します。
- それらは所望の段階( 例えば、2 DPF)に達するまで、胚培地中で28.5℃でのゼブラフィッシュ胚/幼虫を育てます。
解離材料の調製
- ゼブラフィッシュ解剖用接着剤ディスペンサー
注:このプロトコルは、録音室に準備を取り付けるための獣医師の縫合接着剤の使用を含みます。縫合糸、接着剤の使用の成功は、制御された方法で接着剤の少量のアプリケーションが必要です。接着剤は、それとすぐに硬化し始め水性環境に遭遇します。そのため、マイクロピペットに接着剤を描画し、口から負または正の圧力の適用を可能に自家製「接着剤ディスペンサー」を使用して、少量を提供します。接着剤ディスペンサの中央部分は、ガラス穴、ホウケイ酸薄壁ガラスキャピラリー( 図1A)を含むパッケージ内に含まれる部分です。もう一方の端は、ガラスマイクロピペット( 図1)を保持しながら、一方の端部に、穴は、マウスピースにフレキシブルチューブの部分を介して接続されています。- 一方のガラス孔から黒球を除去し、別のガラス孔( 図1Bおよび1C)からの白色ゴムアダプタに置き換え。
注:この二重アダプタキャップされたガラスの穴が小さい、直線状のポリプロピレンフィッティング( 図1B、 挿入図 )を介して可撓性チューブの部分に、他端に、一端にガラスマイクロピペットへの接続を可能にし。 <李は>〜38センチメートルの長さにフレキシブルチューブの部分をカットします。ガラス孔に接続されていない可撓性チューブの端部にマウスピース( 例えば、黄色200μLマイクロピペットチップ)を取り付けます。
注:チューブの部分は、マイクロピペット先端が黄色口( 図1D)にある間に解剖スコープの下でガラスマイクロピペットの操作を可能にするのに十分長くなければなりません。 - 一方のガラス孔から黒球を除去し、別のガラス孔( 図1Bおよび1C)からの白色ゴムアダプタに置き換え。

図1:接着剤ディスペンサー。 (AC)は、ガラスボアは、一端と他端にガラスマイクロピペットで可撓性チューブに接続されています。ゴムアダプタは他端にガラスマイクロピペットに、最終的には、チューブに小さなポリプロピレンフィッティング(B、 挿入図 )を介して結合を可能と。 (D)は 、最終的な接着剤ディスペンサーは、(マウスピースを有し、例えば、のPLAから作られチックチューブの一端にピペットチップ)と他の( 矢印で結合マイクロピペットを用いてガラスボア)。
- 解剖/録音室
注:解剖室はまた、電気生理学的記録チャンバーとして機能します。チャンバは、硬化したシリコーンエラストマー( 図2A)の事前に切断片を用いてガラススライド上に形成されています。- それぞれ、1比:シリコーンエラストマーを調製し、4℃でプラスチックコニカルチューブにベースと硬化剤を加えます。
- エラストマーベースと硬化剤が十分に混合二百ム・ペトリにミックスを注ぎます。 1枚のペトリ皿および他に〜2.5ミリメートルで<1mmの厚さにエラストマーを注ぎます。
- シリコーンエラストマーは〜4-5日間空気に曝露することによって硬化させます。硬化したエラストマーが早く必要な場合は、60°Cでそれをインキュベートします。
- 以下のサイズに硬化したシリコーンエラストマーの部分をカット。
- 〜1ミリメートルから〜3.8×6.3センチメートル矩形を切り出し、硬化エラストマーを-thick。この作品は、チャンバ( 図2A)の底部として機能します。 〜2.5ミリメートルの厚さの硬化したシリコーンから、矩形〜3.8×6.3センチメートルを切ります。後者の矩形から、〜2.5×5cmの内部矩形を切り出します。得られたフレームは、チャンバ( 図2A)の頂部として機能します。
- 、切開/記録チャンバを作るシリコーンおよびガラス( 図2A)との間に気泡を除去することを確認して、スライドガラス(5×7.6 cm)以上の上に直接薄いシリコーン矩形を配置します。シリコーンの薄い底部層の上に、厚いエラストマーから切断シリコーン矩形枠を置き。
- シリコーン層がお互いによく付着し、二つの層( 図2A)との間に気泡がないことをことを確認します。
- 使用後、底シリコーンレイから厚い矩形シリコーン枠を除去することによって、チャンバを解体ガラススライドに取り付けられている。えー。使用前に各記録セッションの後、低リントワイプとドライのddH 2 Oを有するシリコーン表面をすすぎます。
- シリコンの2枚の間に真菌の増殖を防ぐために、チャンバーが乾燥して保管してください。
注:シリコーンから容易にすすぎないかもしれない毒素または薬剤が使用される場合、それらの目的のための特定のチャンバを捧げます。

図2:電気生理学室と解剖ツール。 (A)解剖及び電気生理学的記録のために使用されるチャンバは井戸のためのフレーム及び底部を提供するために、互いの上に積層硬化したシリコーンエラストマーの二つの部品を、配置された際にスライドガラスから成ります。ウェルのサイズ、〜2.5×5cmのは、細胞外記録の少量(2-2.5 mL)での使用を可能にします溶液。下部シリコン層がガラスに付着しない組織接着剤を使用して、ゼブラフィッシュ胚の確実な位置決めを可能にします。 (B)ガラスマイクロピペット(上部)解剖時糊送達のために使用されます。薄壁ガラス〜75ミクロンの直径を有する先端部を作成、後で切断される長い、先細端部を作成するために引っ張られます。テーパ状ガラスマイクロピペット吸引の適用によって接着剤が充填されたフロントグルーディスペンサー( 図1D、 矢印 )の自由端に取り付けられています。他のマイクロピペット( 下 )、後脳の離断のための皮膚除去のために使用され、パッチクランプ記録のために使用されるものと同様に引っ張ります。 (C)正立顕微鏡下で、マイクロマニピュレータは、最終的な解剖ステップのマイクロピペットを操作するために使用されます。ガラスマイクロピペットは、B、 下のように、電極ホルダ( 矢印 )に取り付けられています。筋肉の除去は、によって達成されます空気出口( 矢印 )に接続されたチューブを介して吸引をpplying。その他端側に、チューブが、( アスタリスク )は、その反対側に、マウスピースに取り付けられたチューブを有するストップコック( 黒矢印 )に接続されています。
脊髄ニューロンからのパッチクランプ記録のための胚および幼虫の3解剖

図3:ゼブラフィッシュ脊髄の背側解剖。後脳離断(a)は2-DPF胚の、皮膚が胚(B)の左右に切断した後(AA」)。第二の切断は、最初に垂直、次いで(c)を行います。次に、皮膚をピンセットをつかむと、皮膚を引き離すできるように、マイクロピペットを用いて持ち上げられます。 (B)皮膚の除去は、背側脊髄を公開します。黒い線への吻側、スキーnが除去されたと髄膜内に含まれる脊髄( アスタリスク )の表面が露出しています。肌が黒い線( 矢印 )にそのまま尾のまま。ガラスマイクロピペットの先端(CC」)が髄膜に押し付けられ、かつ迅速、横、短い運動は髄膜を穿刺するために行われます。髄膜は(DD「)穿孔されると(DD「とE-E」)は、(2つのセグメントに髄膜を引き裂くために吻側移動し、マイクロピペットは、高度及びEE)です」。 Rohon-ひげニューロンの細胞体は、典型的には、髄膜( 矢印 )の除去の際に現れます。 (FG」)7-DPFの幼虫で、筋肉の層はRohon-ひげニューロンへのアクセスを妨げ、脊髄の背側面を覆います。皮膚を除去した後、幼虫は0.05%コラゲナーゼで処理されます。 (F)が0.05%コラゲナーゼで5分間のインキュベーションは、結果として得られる、あまりにも厳しいですほつれた筋肉( 矢印および挿入図 )によって証明されるように、過剰な筋損傷、インチライン:(F」)過度のコラゲナーゼ処理もRohon・ビアードニューロン( 矢印 ) を損傷する可能性があり、Tgは(GFP islet2b)におけるGFPの発現によってここに明らかにしました。 Tgは(islet2b:GFP)のライン、後根神経節ニューロンはまた、GFP( 矢印 ) を発現します。筋節の形態( 矢印および挿入図 ) を保存しながら、0.05%コラゲナーゼと簡潔1分間のインキュベーションが十分筋肉(G)を緩めます。 (G」)色素細胞は最も背側筋層( 矢印 )の上に存在しています。 (HとI) のTg(islet2b:GFP)でライン、Rohon-ひげニューロン( 矢印 )および後根神経節( 矢印 ) が 7 DPFにGFPを発現し続けます。ゼブラフィッシュ胚2 DPFで(H)AN:Tgは(GFP islet2b)の景色を背D 7 DPF(I)。 = 500μmのパネルAスケールバーで、 BE(パネルBに示されている)バー= 80ミクロンのスケール。 F「及びG」(パネルFに示す)=200μmでバースケール。 (パネルHで示す)H及びI =100μmでバースケール。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- Rohon・ビアード細胞からの録音のための胚の解剖
- リンゲル液〜2-3 ML( 図2A)を含む解剖室に胚を置き。チャンバに0.4%トリカイン溶液〜100μLを添加することにより、胚を固定化します。
- 注射マイクロピペット( 図2B、 上部 )53と同様長い、細い先端を得るために、ボックスのフィラメントを用いてプラーマイクロピペット上の薄壁ガラスマイクロピペットを引っ張ります。
- ガラスボアOに引っ張らガラスマイクロピペットを取り付けます接着剤ディスペンサーF。先端があるように、解剖顕微鏡下で、使用ピンセットは〜75ミクロン( 図2B、トップ)ガラスマイクロピペットの先端を破ります。
注:チップサイズは、フロントフィルマイクロピペットに対して負圧(吸引口)のアプリケーションを介して先端に接着剤の効率的な充填を可能にするのに十分大きいが、正圧を介して接着剤の正確な適用を可能にするのに十分に小さくなければなりません。 - マウスピースを介して吸引を適用することにより、接着剤の〜3-5μLのガラスマイクロピペットをロードします。解剖室に接着剤が充填されたチップをもたらします。
注:接着剤でマイクロピペットを埋めるには、強力な吸引が必要です。マイクロピペットが弱い吸引すぐいっぱいになると、先端が大きすぎます。 - 記録チャンバー( 図3Aと3A」)で胚を置き。胚および若い幼虫(≤72HPF)からの記録のために、筋肉組織を除去する必要はありません。
- 持って来ます口チューブを介してマイクロピペットにわずかな正圧を維持しながら、胚/幼虫の頭の近くに接着剤を装填マイクロピペットの先端が(水溶液の侵入を防止するため)。先端が胚の頭部付近になると、チャンバの底部に接着剤の小滴を放出するのに十分な正の圧力を加えます。
注:接着剤は、水溶液と接触して一度硬化するので、適用され、それが解剖の溶液中に置かれているよう軽度の正圧を維持することが重要です。 - ヘッドが接着剤に接触するように、接着剤の低下に向けて胚/幼虫を移動するために解剖のピンツールを使用してください。オリエント接着剤との良好な接触を確保するために頭の上に胚背側を上に押します。
- 接着剤が徐々に硬化するとして、それは腹側を下に位置するように、胚/幼虫の再位置に背側を上に解剖ピンを使用します。接着剤のドロップに解剖のピンツールを浸しそして頭の上と間で接着剤のスレッドを描きますさらにその位置を確保する胚の。
注:トリカインは、接着剤が硬化する速度をスピードアップ。糊で動作するように多くの時間を許可するには、胚/幼虫を固定化するために必要なトリカイン最小限の量を使用します。また、硬化速度は接着剤の異なるロットと異なる場合があります。接着剤の新しいバッチを使用する際に、解剖のためにそれを使用する前に、硬化のそのレートを確かめます。 - ヘッドがしっかりシリコーンに取り付けられ、接着剤が固化した後、別のガラスマイクロピペット( 図3A-A及び4A〜A)と後脳レベルで離断によって胚/幼虫を犠牲にします。
注:後脳離断は人道的な動物の犠牲のために、ここで使用されている方法です。しかし、実験的な目標に応じて( 例えば、仮想水泳の研究は)、別の方法が必要になることがあります。 - 室に尾を取り付ける前に、トランクから皮膚を除去。
- つかいます新鮮ガラスマイクロピペット( 図2B、 下 ) は、表面的に後脳( 図3A〜Bおよび4A〜B)に位置尾の皮膚を数回カットします。ピアス皮膚は表面的に背側のトランクの両側に吻側-尾側軸に垂直なピペットを移動させることにより( 図3A-Bの )標本をマウントまたは横方向に取り付けられた試験片( 図4A-Bの)のためにトランクの露出面に。
- 、つかむためにピンセットのために皮膚のフラップを作成するステップ3.1.10.1における初期カット( 図3A-Cおよび 4A-C)のレベルと垂直マイクロピペットを用いて皮膚を数回こすりします。
- ピンセットを使用して、徐々に皮膚弁を持ち上げ、皮膚の尾を引きます。
注:これは、多くの場合、トランクから肌全体の除去をもたらします。しかし、それはsometiです実行することにより、いくつかのセクションで皮膚を除去するために必要なMESは、こすると皮膚を引っ張る改めて表明しました。いくつかの用途のために、皮膚の部分的な除去は、対象( 図3Bおよび4B)の脊髄セグメントへの十分なアクセスを可能にすることができます。 - 胚/幼虫の尾の近くに接着剤の小滴を提供します。解剖室の底に尾を添付し、この接着剤を使用してください。このステップの間に、接着剤が硬化として、トランクが背側配向のままであり、それがしっかりとチャンバに接続されていることをことを保証するために、解剖ピンツールを使用してトランクの位置を調整します。
- この初期の解剖の後、トリカインや破片を除去するためにリンゲル液で徹底的に準備をすすぎます。準備は〜5分間の休息を許可します。
- 細胞外記録溶液との解剖ソリューションを交換してください。必要に応じて、 例えば (準備への固定化剤を加える。、αブンガロトキシン[最終conce1μMのntration])。
注:1μMのαブンガロトキシンは〜30分以内に胚DPF 2に1を固定します。古い幼虫のために、αブンガロトキシンのより高い濃度が必要になることがあります。 αブンガロトキシンは、典型的には1時間の期間内に実行される録画中浴溶液中に維持されます。コバルトのような二価の陽イオンを含む溶液を、録音、固定化剤の添加を必要としません。 (1時間以上)延長された記録期間を必要とする実験のために、製剤は、0.5〜1 mL /分の速度で浴溶液で灌流されます。 - 40X水浸長作動距離対物レンズを備えた正立複合顕微鏡のステージに取り付けられた胚との解剖室を移動させます。
注:この顕微鏡は、録音が実行されるリグの一部です。リグはまた、ヘッドステージ、パッチクランプ増幅器、マイクロマニピュレータ、及びデータ収集/計算機システム( 図2Cを装備しなければなりません)。 - ヘッドステージの電極ホルダーに空のホウケイ酸厚肉ガラスマイクロピペット( 図2B、 底部および2C、 矢印 ) をマウント。チューブを取り付け(内径0.16センチ、外径0.32 cmであり、長さ:~90センチ)電極ホルダー( 矢印 )の空気出口に一端が三方活栓( 図2Cの他端に、 黒矢印 )。
- チューブの別の部分(長さ〜60〜70センチメートル)の一端にマウスピースを置き、もう一方の端( 図2C、 黒アスタリスク )で三方活栓に接続します。
注:この配管システムは、シール形成時の記録ピペットの内側に正および負の圧力の適用を可能にします。
- チューブの別の部分(長さ〜60〜70センチメートル)の一端にマウスピースを置き、もう一方の端( 図2C、 黒アスタリスク )で三方活栓に接続します。
- 脊髄の中で最も背の部分にマイクロピペットチップを持参し、優しく髄膜を突き刺します。迅速にフォロー、短い、横の動きがトイレにします銭髄膜( 図3C及び3C」)。
- マイクロピペットチップは、髄膜を横断した後、前進させ、離れた脊髄( 図3Dおよび3D」)から髄膜を引っ張るためにマイクロピペットを上げます。
- Rohon-ひげ細胞( 図3Eおよび図3E」)を露出させるために1〜2 hemisegments上前進、吻側マイクロピペットを移動させます。
注:少数のRohon・ベアード細胞を公開するために必要な髄膜の最小限の量を分析。各記録後、追加の切開をよりRohon-ベアード細胞を明らかにするために行われます。胚および幼虫の両方において、Rohon-ひげニューロンは時折パッチマイクロピペットとの接触の際に破裂することがあります。他の脊髄ニューロンが、これは、そのような彼らのmechanosensitivityなどRohon・ビアード細胞のユニークな特性を反映かもしれないことを示唆し、このように動作しません。これを支持して、いくつかの溶液組成( 例えば、イオン成分および浸透圧)を試験し、いずれもRohon-ビアード細胞のこの動作を妨げませんでした。
- Rohon・ビアード細胞からの録音のための幼虫の解剖
注:7 DPFの幼虫では、背側脊髄の周囲の筋肉を削除する必要があります。手順に従う酵素処理の前に(胚を置換幼虫で)3.1.15へ3.1.1。- 筋肉を削除するには、1分間0.05%コラゲナーゼと幼虫をインキュベートします。
- リンゲル液で準備〜5回すすぐことによりコラゲナーゼを削除します。完全にコラゲナーゼを削除するには、細胞外液の〜5回のすすぎに従ってください。
- 記録リグの顕微鏡のステージ上の記録チャンバを搭載した後解剖の残りを行います。電極ホルダーにホウケイ酸厚い壁パッチマイクロピペット( 図2B、 下 ) を取り付け、ゆっくりの底部に対してそれをブラッシングすることによりマイクロピペットの先端を破りますシリコーン室。
- 離れて筋肉をいじめると背側脊髄を露出させ、わずかに壊れたマイクロピペットを使用してください。調製物から筋線維を除去するために、電極ホルダーの出口に取り付けられたチューブを介して吸引を適用します。吸引を印加しながら、筋肉繊維の長さに沿ってマイクロピペットを移動させるためにマイクロマニピュレーターを使用。
注:目標は、最初に機械的に筋肉を緩めるためにマイクロピペットを使用するようにして、離れて吸うと、個々の筋線維を削除することです。時折、筋肉を除去する際に、マイクロピペットを吸引組織で目詰まりになります。- マイクロピペットを邪魔を除くために、内容物を排出するためのチューブを通して空気を吹き込みながら、わずかに、チップを破壊する、チャンバの底部に対してマイクロピペットを磨きます。
注:マイクロピペットチップのサイズが大きくなりすぎた場合は、新しいマイクロピペットが必要な場合があります。筋肉層CLを取り外す際にマイクロピペットチップの大きさがより重要です脊髄または髄膜を囲む膜にosest(小さなマイクロピペット先端がより制御作業を可能にします)。
- マイクロピペットを邪魔を除くために、内容物を排出するためのチューブを通して空気を吹き込みながら、わずかに、チップを破壊する、チャンバの底部に対してマイクロピペットを磨きます。
- 手順に記載されているように髄膜を除去3.1.18-3.1.20新しいマイクロピペット( 図2B、 下 ) を使用。
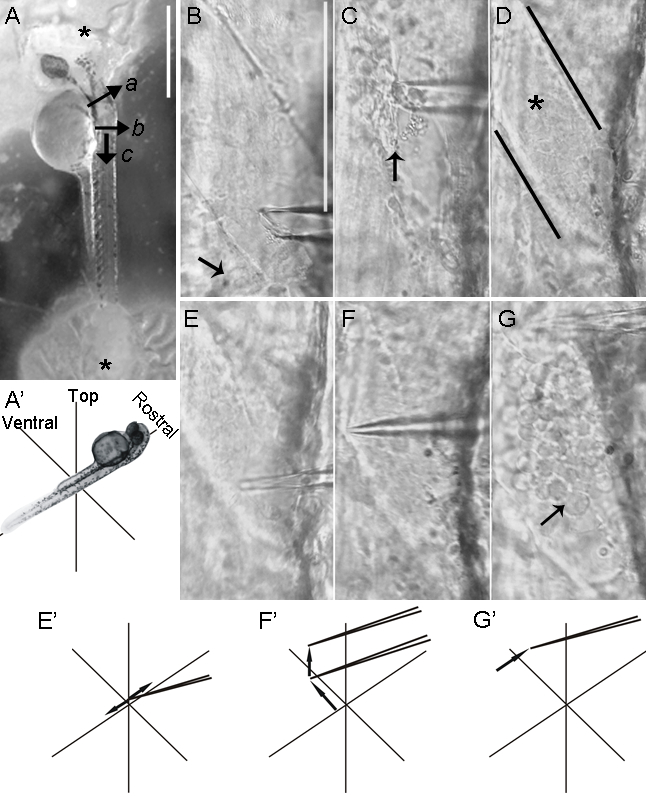
図4:ゼブラフィッシュ脊髄の横解剖。横方向にゼブラフィッシュの胚をマウントすると、運動ニューロンへのアクセスを容易にします。運動ニューロンを露出する筋肉および髄膜の解剖の除去は40X水浸対物レンズと適合正立顕微鏡下で行われる( 図2参照 )。 (A)運動ニューロンの細胞体は、脊髄内の腹側および横方向に配置されています。その背側は、電極ホルダーを向くように胚をチャンバに取り付けられています。それは( アスタリスク ) を硬化後に縫合糸糊が白く見えることに注意してください。後脳は、(a)の横に切断されると、皮膚は、ガラスマイクロピペットを用いて後脳のサイト(b)の尾側で表面的に数回カットされます。付加的な表層カット(C)に示すように、第1セットの(b)に垂直、ピンセットは、皮膚の除去のためにつかむことができ、皮膚のタブを形成します。 (BG)空のガラスマイクロピペットは、短い、先細の先端( 図2B、 下 )に引っ張られ、電極ホルダに取り付けられています。マイクロピペットは、その後の細かい解剖や筋肉組織を除去するためのマイクロマニピュレーターを使用して操作されます。 (B)ガラスマイクロピペットの先端が最初優しく、チャンバの底部に対してそれをブラッシングギザギザの端と大きい先端直径を作成することによって、わずかに破壊されます。吸引が適用されながらマイクロピペットは、筋肉繊維の長さに沿って移動されます。筋線維は、一つの層を除去し、基礎となる髄膜の破壊を防ぐために、一度に。これらは薄くなる傾向にあるよう胚では、ほとんどの背部の筋肉層は、最初に削除されます。皮膚は、より尾側hemisegments( 矢印 )から削除されません。 (C)1 hemisegmentにおける筋肉の背側半分は( 矢印 ) が削除されました。 (D)黒のラインはそのまま髄膜脊髄( アスタリスク ) をカバーして、筋線維を欠いhemisegmentの境界を定めます。マイクロピペットを用いて(EE」)は 、圧力がわずかに運動ニューロンの細胞体に背側位置で髄膜に適用されます。マイクロピペットのクイック、ショート、横方向の動きは、髄膜のピアスにつながります。 (FF」)マイクロピペットはhemisegmentの腹側面に向かって、腹側前進、および神経組織から髄膜を分離するために持ち上げられます。 (GG」)髄膜はの長さに沿って吻側マイクロピペットを移動させることにより離断さhemisegment。ニューロンはすぐにさらさ脊髄から出てくると、今パッチ電極( 矢印 )にアクセス可能です。スケールバー=(A)には500μm。スケールバー= BG(パネルBに示されている)で100μmです。
- 運動ニューロンと介在ニューロンの録音のための胚の解剖
- リンゲル液を含む解剖チャンバ内で胚を置き、ステップ3.1.1のように、トリカインで胚を固定化します。
- その背側は、ユーザのために最適であるチャンバの側面に対向して、横方向に胚をマウントする(典型的には、利き手に依存します)。手順に従っ3.1.2-3.1.17及び胚がシリコーン( 図4Aおよび4A」)に対して平らのままであることを保証します。
- 手順に記載されているように3.2.4-3.2.4.1、掻き取り、吸引筋肉離れと髄膜を露出させるためには25μm〜に切断された先端を有するホウケイ酸厚肉マイクロピペットを使用した( 図4B - <強い> 4D)。
- 筋層が関心のhemisegment(S)( 図4D)から除去されると、無傷の先端( 図2B、 下 ) を有する新しいものと、ガラスマイクロピペットを交換します。ターゲットニューロンに背の位置で髄膜を穿刺。マイクロマニピュレーターを使用して、髄膜上にマイクロピペットを押し下げ、次いで、涙および髄膜( 図4Eおよび4E」)を横断する横迅速に移動します。
- 髄膜を破裂すると、事前離れ脊髄( 図4Fおよび4F」)から髄膜を持ち上げるためにマイクロピペットを上げます。 hemisegment( 図4Gおよび4G」)の長さに沿って膜を引き裂くために吻側マイクロピペットを移動させます。
注:Rohon-ビアード細胞と一次運動ニューロンからの記録のために、解剖がimmediatから離れて髄膜をクリアに限定されています電子標的領域。対照的に、介在ニューロンおよび二次運動ニューロンから記録するためには、目的の細胞へのアクセスを妨げ、脊髄内のニューロンを除去する必要があります。後者の場合には、脊髄回路の大規模な破壊のために、研究は固有の電気膜特性の分析に限定されています。
脊髄ニューロンから4.電気生理学的記録
- ピペット溶液(図2B、 下 )を充填した場合Rohon-ひげ細胞および運動ニューロンから記録のために、〜3MΩの抵抗に引っ張らホウケイ酸厚い壁のガラスキャピラリーを使用します。
- 前浴にマイクロピペットを浸漬する電極ホルダに取り付けられたチューブを通して穏やかに吹き込むことにより、正の圧力を加えます。
注:正圧がマイクロピペット先端を目詰まりからデブリを防止し、オフpに三方活栓を回すことによって維持されていますosition。一度標的ニューロンの近くに、正圧は、細胞膜、マイクロピペットは、シール形成を開始するのに十分に近い人インジケータの独特のくぼみをもたらすであろう。 - マウスピースを介して追加の光吸引を印加しながら開位置にストップコックバルブを回して正圧を解放します。
- 細胞膜およびマイクロピペットチップとの間GΩシールを形成した後、膜を破壊し、全細胞構成を達成するために、吸引の短いパルスを印加します。
- 入力抵抗500MΩとアクセス抵抗10MΩで、安定した全細胞構成を確立した後、いずれかの電圧 - または電流クランプモードで記録を得ます。
- 前浴にマイクロピペットを浸漬する電極ホルダに取り付けられたチューブを通して穏やかに吹き込むことにより、正の圧力を加えます。
結果
我々が正常幼虫DPF 7を介して17個のHPF胚でRohon-ひげニューロンから記録された( 図5Aおよび5B)。 Rohon-ベアード細胞を記録した場合、調製物は、背側を上に取り付けました。そのような実装は、その表層背側位置と大細胞体のサイズに基づいRohon-ビアード細胞の明確な同定を可能にします。識別は、さらにこれらのニューロンのステレオタイプの過分極静止膜電位( 図5、 挿入図のテーブル )6、54によって確認されます。また、一次感覚ニューロンとして、Rohon-ひげニューロンは、シナプス入力を欠いています。電流クランプモード( 図5B」)に記録しつつ、電気的刺激の非存在下で、膜電位の変化は生じないはずです。ゼブラフィッシュにおけるRohon-ビアード細胞から最初の記録が行われたので 6、種々のトランスジェニック系統( 例えば、Tgは(islet2b:GFP)、Tgは(NGN:GFP)、及びTgが(isletss:GFP))は、これらのニューロンに蛍光レポーターを発現生成された、さらに容易にそれらの識別55、56、57。
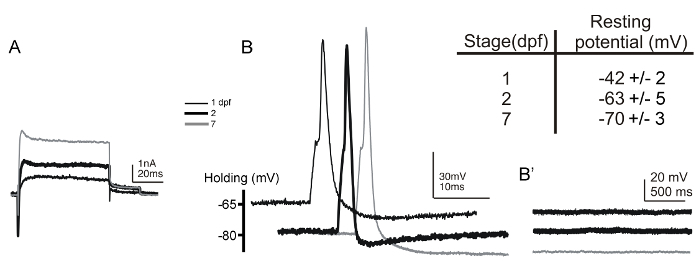
図5:胚および7 DPF幼虫DPF 1及び2におけるRohon-ビアードニューロンからの全細胞電圧-電流-クランプ記録。 (A)外向きと内向き電流の電圧クランプ記録は、1-(細い黒線)におけるRohon-ひげニューロンから得た2-(太い黒線)、及び7-DPF(灰色線)の胚/幼虫。保持電位は-80 mVであったと電流は+20 mVでの脱分極ステップによって誘発しました。 (B)単一の活動電位を短時間(1秒)によって誘発された電流注射1-(細い黒線)のRohon-ひげニューロンに(〜0.35 NA)、2-(太い黒線)、及び7-DPF(灰色線)の胚/幼虫。 (B」)は、電気刺激の非存在下では、このような自発的なシナプス後脱分極、膜電位の変化は、Rohon-ひげニューロンにおいて生じません。挿入図のテーブルは、1-(N = 21)および2-(N = 9)胚DPFと、7-(N = 7)幼虫DPFのRohon-ひげニューロンから記録された膜電位を休止値をまとめたものです。 この図の拡大版をご覧になるにはこちらをクリックしてください。
他の脊髄ニューロンのサブタイプの明確な同定を可能にするトランスジェニックラインもご利用いただけます。これらのうち、mnx1トランスジェニックラインのTg(mnx1:GFP)はすぐに彼らの仕様(〜14-16 HPF)した後、脊髄運動ニューロンのサブセットで緑色蛍光タンパク質(GFP)を発現します 58、59。一緒にmnx1トランスジェニックにおけるGFPの発現と各hemisegment内の一次運動ニューロンのステレオタイプの位置決め( 図6A)に、種々の一次運動ニューロンのサブタイプ( 図6Bおよび6C)を識別することが可能です。ライン:いくつかの介在ニューロンはまた、Tgは(GFP mnx1)でGFPを発現するように、記録電極溶液中の蛍光色素を含む、運動ニューロンのアイデンティティの追加の確認を提供する、軸索軌道の可視化を可能にします。あるいは、運動ニューロンの同定を可能にする別のトランスジェニック系統は、ET2ライン60です。
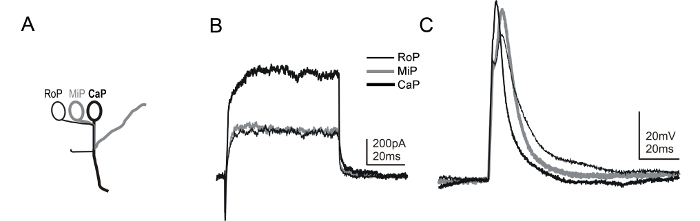
図6:ゼブラフィッシュエンブリーDPF 1の運動ニューロンからのホールセル電圧および電流クランプ記録OS。 (A)漫画ゼブラフィッシュ脊髄中に存在する一次運動ニューロンサブタイプの特異的な形態学的特徴を示しています。一次運動ニューロンは、セグメント内のそれらのソーマの位置によって識別される( すなわち、吻側【のRoP]、中間[MIP]、または尾[キャップ])45れます。また、各サブタイプは、異なる経路を介して周囲に軸索を拡張します。 Tgは(mnx1:GFP)の併用ラインおよび染料標識は、ステレオタイプの軸索アーバーと記録時の運動ニューロンサブタイプのアイデンティティを明らかにする。ここで紹介する方法を使用して、同じhemisegment内の3つの異なる一次運動ニューロンのサブタイプからレコードを順次ことが可能です。 (B)電圧クランプ記録は全て単一hemisegmentでのRoP、MIP、およびキャップから得られたことが示されています。 +20ミリボルトの電圧ステップは、保持電位-80mVから電流を引き出すために使用されました。電流クランプR中(C)RoP、MIP、およびキャップからecordings、短時間(1ミリ秒〜0.4 NA)現在の注射は活動電位をトリガするために適用しました。膜電位は-65〜Mvで開催されました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
一次および二次運動ニューロンの主な違いは、以前の生まれのニューロンの大きな細胞体です。しかし、二次運動ニューロンのサブタイプは、細胞体の大きさや位置によって識別されません。特定二次運動ニューロンから記録のために二つのトランスジェニック系統は、Tgは(GATA2:GFP)及びTgは(islet1:GFP)は 、それぞれ55、61腹側と背側突出軸索、二次運動ニューロンを同定するために使用されてきました。しかし、第3の二次運動ニューロンのサブタイプはAXOと、ゼブラフィッシュ脊髄に存在します背側と腹側62プロジェクトNS。したがって、染料は、形態( 図7A)に基づいてサブタイプを同定するために記録時の二次運動ニューロンを充填するために使用することができる8,9。しばしば、二次運動ニューロンからの電圧クランプ( 図7B、 アスタリスク )または電流クランプ記録( 図7Cおよび7C」、 矢印 )中、自発的またはシナプス事象が記録されます。

図7:2個のDPF胚の二次運動ニューロンからのホールセル電圧および電流クランプ記録。 Tgは(GATA2:GFP)で(A)線は、二つの異なる二次運動ニューロンのサブタイプは、GFP を発現する62。左hemisegmentに、腹二次運動ニューロン( アスタリスクと矢印は 、それぞれ、細胞体と軸索を示しています)。 (;一方は腹側に突出する矢印は 、2本の軸索を示す[底矢印]と他の背[トップ矢印] アスタリスクはソーマを示す)隣接hemisegmentにおいて、右(尾)に、背側/腹二次運動ニューロンがあります。これらのニューロンは、録音中に赤色蛍光色素で標識しました。腹側/背側の二次運動ニューロンを同定するために、切開、それによって損傷または背部軸索を除去し、隣接する尾hemisegmentの筋肉を除去しないことを確実にするために重要です。記録した後、ニューロンの細胞体は、それが準備( 右上アスタリスク )から引き離されると、マイクロピペットに取り付けられたまま。録音中にニューロンを埋めるために染料を使用する場合、電極は、脊髄および脊索で可視赤色蛍光背景([左]吻側中底アスタリスクhemisegment <その結果、浴にある間に、染料はしばしば漏れます / em>の)。 (B)電圧クランプ記録は、腹側及び背側/腹二次運動ニューロンから得ました。電圧ステップ(-30、-10、10、30、50、70、90、および+110 mVでの)が外向きと内向き電流を誘発しました。クランプ活動電位/脱分極は、録音( アスタリスク )で存在してもよいです。二次運動ニューロン、短時間(1秒)増加する振幅の電流注入から電流クランプ記録中(C)は、活動電位( アスタリスク ) をトリガするためにニューロンに適用しました。 (C」)〜0.4-NA電流注射によって二次運動ニューロンでトリガ単一の活動電位の例に示されています。この段階で、自発的な活動電位はまた、(CとC」、 矢印 )が観察されます。 (D)長期(100ミリ秒)現在の注射(〜0.35 NA)は活動電位の反復発火をトリガします。膜電位は-65〜Mvで開催されました。ロード/ 55507 / 55507fig7large.jpg」ターゲット= 『_空白』>この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
ここで説明する方法は、脊髄の最小限の解剖後のゼブラフィッシュ胚の感覚と運動ニューロンの電気的および形態学的特性評価を可能とします。ニューロンは、少なくとも1時間、これらの記録に課される時間制限のために健康なままです。ニューロンは、標準の全細胞構成を使用して記録だけでなく、有核パッチからされています。後者の方法は、イオン電流9の詳細な生物物理学的研究を排除することができる空間クランプの問題を最小限に抑えます。
重要な課題は、皮膚を除去するために、関心のニューロンへのアクセスを提供するために必要な限られた解剖を実行するために、チャンバーへの胚や幼虫の会社の添付ファイルを達成することです。調製物はまた、適切に、全細胞パッチクランプ法のための記録チャンバーに固定する必要があります。に胚または幼虫を取り付けるために獣医縫合接着剤の使用を介して、この挑戦に合致する方法解剖/記録チャンバーは、ここで他のモデル生物の解剖のために使用されてきたアプローチ( 例えば、ショウジョウバエ )63に記載されています。我々の経験他の人を訓練から、我々はマスターにとって最も重要なステップは、接着剤の少量の制御と正確な配達であることがわかります。ここで、ユーザはに接着剤をロードするか、マイクロピペットの先端からそれを排出する負および正の圧力を適用することを可能にする接着剤ディスペンサ装置について説明します。縫合接着剤を用いて、胚および幼虫がしっかりチャンバに取り付けられ、いずれかの背側上または横方向に配向させることができます。このように、神経細胞のさまざまな異なるアクセスオプションが用意されています。また、チャンバの底部にシリコーンエラストマーの層は、潜在的な光学効果を提供する、ここで指定された1ミリメートルよりも薄くすることができます。別の方法は、記録チャンバーに準備を取り付けるために使用されるより一般的には、微細なタングステンピンの使用を伴う1 <SUP>、2、3、4、5。方法が異なることが、両方が目標と実験の課題に基づいて選択することができるオプションで研究者を与える、ゼブラフィッシュ脊髄の神経細胞への電気アクセスを許可します。
ここで説明するゼブラフィッシュの準備は、それらの分化の初期段階中にその場での脊髄の神経細胞の電気的および形態学的研究が可能になります。これらのメソッドを使用して脊髄の神経細胞から記録することによって、私たちも前に病変の遺伝子6、64、65の識別に、いくつかの突然変異の細胞効果の洞察を得ています。
開示事項
著者は何の競合する金融利益を宣言していません。
謝辞
この作品は、NIH(ABRにRLMとR01NS25217とP30NS048154にF32のNS059120)からの助成金によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Vacuum filter/Storage bottle, 0.22 mm pore | Corning | 431096 | |
| Syringe filter 0.2 mm | Whatman | 6780-2502 | |
| Tricaine | Sigma | A-5040 | Ethyl 3-aminobenzoate methanesulfonate salt |
| α-bugarotoxin | Tocris | 11032-79-4 | |
| Tetrodotoxin | Tocris | 4368-28-9 | |
| Alexa-549 hydrazine salt | Molecular Probes | A-10438 | fluorescent dye |
| Spin-X centrifuge tube filter | Corning | 8161 | |
| Glass microscope slide | Fisher | 12-550C | |
| Sylgard silicone elastomer kit | Dow Corning | 184 | silicone elastomer |
| Petri dishes | Falcon | 351029 | |
| Borosilicate glass capillaries | Harvard Apparatus | 30-0038 | inner and outer diameters of 0.78 and 1.0 mm (thin walled glass capillaries) |
| Borosilicate glass capillaries | Drummond Scientific | 1-000-1000-100 | inner and outer diameters of 1.13 and 1.55 mm (thick walled glass capillaries) |
| Miniature barbed polypropylene fitting | Cole-Palmer | 6365-90 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Collagenase XI | Sigma | C7657 | |
| Microelectrode puller | Sutter Instruments | Model P-97 | |
| Amplifier | Molecular Devices | Axopatch 200B | |
| Head stage | Molecular Devices | CV203BU | |
| Motorized micromanipulator | Sutter Instruments | MP-285 | |
| Tygon tubing | Fisher | 14-169-1B | ID 1/16 IN, OD 1/8 IN and WALL 1/32 IN (flexible laboratory tubing) |
| Electrode holder | Molecular Devices | 1-HC-U | |
| Pharmaseal Three-Way Stopcocks | Baxter | K75 | |
| Digitizer | Axon Instruments | Digidata 1440A | |
| Inverted microscope | Zeiss | Axioskop2 FS plus | |
| 40X/0.80W Achroplan objective | Zeiss | ||
| Data acquisition and analysis software | Axon Instruments | PClamp 10 - Clampex and Clampfit | |
| Micropipette puller | Sutter Instruments | Model P-97 | |
| Name | Company | Catalog Number | Comments |
| Dissection and Recording Solutions (in mM) | |||
| All solutions, except the intracellular, are stable for ~2-3 months when filtered (0.22 mm filter cups) and stored at room temperature (RT). | |||
| The intracellular solution is filtered (0.2 mm syringe filters) and stored frozen (-20 °C) in small aliquots that are individually thawed on the day of use. | |||
| Dissection/Ringer’s solution | 145 NaCl, 3 KCl, 1.8 CaCl2.2H2O, 10 HEPES; pH 7.4 (with NaOH) | ||
| Pipette (intracellular) recording solution | 135 KCl, 10 EGTA-acid, 10 HEPES; pH 7.4 (with KOH). | ||
| Bath (extracellular) recording solution/voltage and current-clamp | 125 NaCl, 2 KCl, 10 CaCl2.2H2O, 5 HEPES; pH 7.4 (with NaOH). | ||
| Alexa-594 hydrazine salt stock solution. | Prepare a 13.2 mM stock in ddH2O, aliquot (~100 µl) and store at -20 °C. For use, dilute the stock solutiond 132 fold with pipette solution to a final concentration of 100 mM. After dilution, filter the Alexa-594 containing pipette solution with a centrifuge tube filter. | ||
| Name | Company | Catalog Number | Comments |
| Immobilizing agents | |||
| 0.4% ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Prepare a 0.4% stock solution in 0.2 M Tris, pH 9 (0.4 g Tricaine/100 mL 0.2 M Tris | ||
| Adjust pH to 7 with NaOH and store at -20 °C. | |||
| For use, dilute the stock solution ~25 fold in embryo media | |||
| 250 mM α-bungarotoxin | Prepare a 250 mM stock in ddH2O (1 mg/500 mL), prepare 100 µL aliquots, and sotre at -20 °C. | ||
| For use, dilute 2,500-fold with extracellular solution to a final concentration of 100 nM. | |||
| 1 mM Tetrodotoxin | Prepare a 1 mM stock in ddH2O (1 mg/3 mL), prepare 100 µL aliquots, and sotre at -20 °C. | ||
| For use, dilute 2,000-fold with extracellular solution to a final concentration of 500 nM. | |||
参考文献
- Drapeau, P., Ali, D. W., Buss, R. R., Saint-Amant, L. In vivo recording from identifiable neurons of the locomotor network in the developing zebrafish. J Neurosci Methods. 88 (1), 1-13 (1999).
- Drapeau, P., Saint-Amant, L., Buss, R. R., Chong, M., McDearmid, J. R., Brustein, E. Development of the locomotor network in zebrafish. Prog Neurobiol. 68 (2), 85-111 (2002).
- Saint-Amant, L., Drapeau, P. Whole cell patch-clamp recordings from identified spinal neurons in the zebrafish embryo. Methods Cell Sci. 25, 59-64 (2003).
- Masino, M. A., Fetcho, J. R. Fictive Swimming Motor Patterns in Wild Type and Mutant Larval Zebrafish. J Neurophysiol. 93 (6), 3177-3188 (2005).
- Wen, H., Brehm, P. Paired motor neuron-muscle recordings in zebrafish test the receptor blockade model for shaping synaptic current. J Neurosci. 25 (35), 8104-8111 (2005).
- Ribera, A. B., Nüsslein-Volhard, C. Zebrafish Touch-Insensitive Mutants Reveal an Essential Role for the Developmental Regulation of Sodium Current. J Neurosci. 18, 9181-9191 (1998).
- Pineda, R. H., Heiser, R. A., Ribera, A. B. Developmental, molecular, and genetic dissection of INa in vivo in embryonic zebrafish sensory neurons. J Neurophysiol. 93, 3582-3593 (2005).
- Moreno, R. L., Ribera, A. B. Zebrafish motor neuron subtypes differ electrically prior to axonal outgrowth. J Neurophysiol. 102, 2477-2484 (2009).
- Moreno, R. L., Ribera, A. B. Spinal neurons require Islet1 for subtype-specific differentiation of electrical excitability. Neural Dev. 9 (1), 19 (2014).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291 (5813), 293-296 (1981).
- Driever, W., et al. A genetic screen for mutations affecting embryogenesis in zebrafish. Development. 123, 37-46 (1996).
- Haffter, P., et al. The identification of genes with unique and essential functions in the development of the zebrafish, Danio rerio. Development. 123, 1-36 (1996).
- Vogel, G. Genomics: Sanger will sequence zebrafish genome. Science. 290 (5497), 1671 (2000).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. 2 (12), 956-966 (2001).
- Lawson, N. D., Wolfe, S. A. Forward and reverse genetic approaches for the analysis of vertebrate development in the zebrafish. Dev Cell. 21 (1), 48-64 (2011).
- Yates, A., et al. Ensembl. Nucleic Acids Res. 44 (D1), D710-D716 (2016).
- Kawakami, K. Transgenesis and gene trap methods in zebrafish by using the Tol2 transposable element. Methods Cell Biol. 77, 201-222 (2004).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Huang, P., Xiao, A., Zhou, M., Zhu, Z., Lin, S., Zhang, B. Heritable gene targeting in zebrafish using customized TALENs. Nat Biotechnol. 29, 699-700 (2011).
- Sander, J. D., et al. Targeted gene disruption in somatic zebrafish cells using engineered TALENs. Nat Biotechnol. 29 (8), 697-698 (2011).
- Chang, N., et al. Genome editing with RNA-guided Cas9 nuclease in zebrafish embryos. Cell Res. 23 (4), 465-472 (2013).
- Hwang, W. Y., et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nat Biotechnol. 31 (3), 227-229 (2013).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nature Rev Genet. 8 (5), 353-367 (2007).
- Levin, E. D., Cerutti, D. T., Buccafusco, J. J. Behavioral neuroscience of zebrafish. Methods of behavior analysis in neuroscience. , (2009).
- Stewart, A., Gaikwad, S., Kyzar, E., Green, J., Roth, A., Kalueff, A. Modeling anxiety using adult zebrafish: A conceptual review. Neuropharmacology. 62, 135-143 (2012).
- Mushtaq, M. Y., Verpoorte, R., Kim, H. K. Zebrafish as a model for systems biology. Biotechnol Genet Eng Rev. 29 (2), 187-205 (2013).
- Phillips, J. B., Westerfield, M. Zebrafish models in translational research: tipping the scales toward advancements in human health. Dis Model Mech. 7 (7), 739-743 (2014).
- Weis, J. S. Analysis of the development of nervous system of the zebrafish, Brachydanio rerio. I. The normal morphology and development of the spinal cord and ganglia of the zebrafish. J Embryol Exp Morphol. 19 (2), 109-119 (1968).
- Bernhardt, R. R., Chitnis, A. B., Lindamer, L., Kuwada, J. Y. Identification of spinal neurons in the embryonic and larval zebrafish. J Comp Neurol. 302 (3), 603-616 (1990).
- Tsuchida, T., et al. Topographic organization of embryonic motor neurons defined by expression of LIM homeobox genes. Cell. 79 (6), 957-970 (1994).
- Guillemot, F. Spatial and temporal specification of neural fates by transcription factor codes. Development. 134, 3771-3780 (2007).
- Goulding, M. Circuits controlling vertebrate locomotion: Moving in a new direction. Nat Rev Neurosci. 10, 507-518 (2009).
- Fetcho, J. R., McLean, D. L. Some principles of organization of spinal neurons underlying locomotion in zebrafish and their implications. Ann N Y Acad Sci. 1198, 94-104 (2010).
- Del Barrio, M. G., et al. A transcription factor code defines nine sensory interneuron subtypes in the mechanosensory area of the spinal cord. PLoS One. 8 (11), (2013).
- Satou, C., Kimura, Y., Hirata, H., Suster, M. L., Kawakami, K., Higashijima, S. Transgenic tools to characterize neuronal properties of discrete populations of zebrafish neurons. Development. 140 (18), 3927-3931 (2013).
- McLean, D. L., Fan, J., Higashijima, S., Hale, M. E., Fetcho, J. R. A topographic map of recruitment in spinal cord. Nature. 446, 71-75 (2007).
- McLean, D. L., Masino, M. A., Koh, I. Y., Lindquist, W. B., Fetcho, J. R. Continuous shifts in the active set of spinal interneurons during changes in locomotor speed. Nat. Neurosci. 11, 1419-1429 (2008).
- McLean, D. L., Fetcho, J. R. Spinal interneurons differentiate sequentially from those driving the fastest swimming movements in larval zebrafish to those driving the slowest ones. J. Neurosci. 29, 13566-13577 (2009).
- Ampatzis, K., Song, J., Ausborn, J., El Manira, A. Separate microcircuit modules of distinct V2a interneurons and motoneurons control the speed of locomotion. Neuron. 83, 934-943 (2014).
- Ljunggren, E. E., Haupt, S., Ausborn, J., Ampatzis, K., El Manira, A. Optogenetic activation of excitatory premotor interneurons is sufficient to generate coordinated locomotor activity in larval zebrafish. J. Neurosci. 34, 134-139 (2014).
- Menelaou, E., VanDunk, C., McLean, D. L. Differences in the morphology of spinal V2a neurons reflect their recruitment order during swimming in larval zebrafish. J Comp Neurol. 522, 1232-1248 (2014).
- Hubbard, J. M., et al. Intraspinal Sensory Neurons Provide Powerful Inhibition to Motor Circuits Ensuring Postural Control during Locomotion. Curr Biol. 26 (21), 2841-2853 (2016).
- Song, J., Ampatzis, K., Björnfors, E. R., El Manira, A. Motor neurons control locomotor circuit function retrogradely via gap junctions. Nature. 529 (7586), 399-402 (2016).
- Lamborghini, J. E. Rohon-beard cells and other large neurons in Xenopus embryos originate during gastrulation. J. Comp. Neurol. 189, 323-333 (1980).
- Myers, P. Z., Eisen, J. S., Westerfield, M. Development and axonal outgrowth of identified motoneurons in the zebrafish. J Neurosci. 6, 2278-2289 (1986).
- Kimmel, C. B., Westerfield, M., Edelman, G. M., Gall, W. E., Cowan, W. M. Primary neurons of the zebrafish. Signals and Sense: Local and Global Order in Perceptual Maps. , 561-588 (1990).
- Metcalfe, W. K., Myers, P. Z., Trevarrow, B., Bass, M. B., Kimmel, C. B. Primary neurons that express the L2/HNK-1 carbohydrate during early development in the zebrafish. Development. 110 (2), 491-504 (1990).
- Rossi, C. C., Kaji, T., Artinger, K. B. Transcriptional control of Rohon-Beard sensory neuron development at the neural plate border. Dev Dyn. 238, 931-943 (2009).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Progress in Neurobiology. 69 (6), 419-449 (2003).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Dev Cell. 25 (5), 478-491 (2013).
- Lambert, A. M., Bonkowsky, J. L., Masino, M. A. The conserved dopaminergic diencephalospinal tract mediates vertebrate locomotor development in zebrafish larvae. J Neurosci. 32 (39), 13488-13500 (2012).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (1995).
- Oesterle, A. . Pipette Cookbook 2015 P-97 & P-1000 Micropipette pullers. , (2015).
- Spitzer, N. C. The ionic basis of the resting potential and a slow depolarizing response in Rohon-Beard neurons of Xenopus tadpoles. J Physiol. 255 (1), 105-135 (1976).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20, 206-218 (2000).
- Blader, P., Plessy, C., Strahle, U. Multiple regulatory elements with spatially and temporally distinct activities control neurogenin1 expression in primary neurons of the zebrafish embryo. Mech Dev. 120, 211-218 (2003).
- Palanca, A. M., et al. New transgenic reporters identify somatosensory neuron subtypes in larval zebrafish. Dev Neurobiol. 73, 152-167 (2013).
- Flanagan-Street, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132, 4471-4481 (2005).
- Arkhipova, V., Wendik, B., Devos, N., Ek, O., Peers, B., Meyer, D. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365, 290-302 (2012).
- Balciunas, D., Davidson, A. E., Sivasubbu, S., Hermanson, S. B., Welle, Z., Ekker, S. C. Enhancer trapping in zebrafish using the Sleeping Beauty transposon. BMC Genomics. 5 (1), 62 (2004).
- Meng, A., Tang, H., Ong, B. A., Farrell, M. J., Lin, S. Promoter analysis in living zebrafish embryos identifies a cis-acting motif required for neuronal expression of GATA-2. Proc. Natl. Acad. Sci. USA. 94, 6267-6272 (1997).
- Menelaou, E., McLean, D. L. A gradient in endogenous rhythmicity and oscillatory drive matches recruitment order in an axial motor pool. J Neurosci. 32, 10925-10939 (2012).
- Rohrbough, J., Pinto, S., Mihalek, R. M., Tully, T., Broadie, K. latheo, a Drosophila gene involved in learning, regulates functional synaptic plasticity. Neuron. 23 (1), 55-70 (1999).
- McKeown, K. A., Moreno, R., Hall, V. L., Ribera, A. B., Downes, G. B. Disruption of Eaat2b, a glutamate transporter, results in abnormal motor behaviors in developing zebrafish. Dev Biol. 362 (2), 162-171 (2012).
- Carmean, V., et al. pigk mutation underlies macho behavior and affects Rohon-Beard cell excitability. J Neurophysiol. 114 (2), 1146-1157 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved