Method Article
zebrafish
In questo articolo
Riepilogo
Questo manoscritto descrive i metodi per le registrazioni elettrofisiologiche da neuroni spinali di embrioni di zebrafish e larve. La preparazione mantiene neuroni in situ e spesso comporta la dissezione minimo. Questi metodi consentono lo studio elettrofisiologico di una varietà di neuroni spinali, dalla acquisizione iniziale eccitabilità elettrica attraverso le prime fasi larvali.
Abstract
Zebrafish, introdotto come modello di sviluppo, hanno guadagnato popolarità in molti altri campi. La facilità di allevamento gran numero di organismi rapido sviluppo, combinata con la chiarezza ottica embrionale, servito come attributi convincenti iniziali di questo modello. Nel corso degli ultimi due decenni, il successo di questo modello è stato ulteriormente spinto dalla sua riconducibilità agli schermi di mutagenesi su larga scala e dalla facilità di transgenesi. Più di recente, gene-editing approcci hanno esteso la potenza del modello.
Per gli studi neurologico, zebrafish e larva forniscono un modello a cui possono essere applicati diversi metodi. Qui, ci concentriamo sui metodi che consentono lo studio di una proprietà essenziale dei neuroni, eccitabilità elettrica. La nostra preparazione per lo studio elettrofisiologico dei neuroni spinali zebrafish implica l'uso di colla veterinario sutura per fissare la preparazione ad una camera di registrazione. Metodi alternativi per la registrazioneda embrioni zebrafish e larve comportare l'attacco della preparazione per la camera con un perno multa tungsteno 1, 2, 3, 4, 5. Un perno di tungsteno è più spesso utilizzato per montare il preparato in un orientamento laterale, anche se è stato utilizzato per montare larve dorsale rivolta verso l'alto 4. La colla sutura è stato utilizzato per montare embrioni e larve in entrambi gli orientamenti. Utilizzando la colla, una dissezione minima può essere eseguita, consentendo l'accesso ai neuroni spinali senza l'uso di un trattamento enzimatico, evitando così ogni danno risultante. Tuttavia, per le larve, è necessario applicare un trattamento enzimatico breve per rimuovere il tessuto muscolare che circonda il midollo spinale. I metodi descritti qui sono stati utilizzati per studiare le proprietà elettriche intrinseche dei neuroni motori, interneuroni e neuroni sensoriali in diversi Sviluppo deil stadi 6, 7, 8, 9.
Introduzione
George Streisinger aperto la strada all'uso di Danio rerio, comunemente noto come pesce zebra, come sistema modello per l'analisi genetica di sviluppo dei vertebrati 10. Il modello offre diversi vantaggi tra cui: (1) relativamente semplice e poco costoso zootecnia; (2) fecondazione esterna, consente un facile accesso alle embrioni dalle prime fasi di sviluppo; e (3) un embrione trasparente, permettendo osservazioni dirette e ripetute di cellule, tessuti e organi in quanto costituiscono.
Nel corso dei decenni successivi, numerosi miglioramenti aumentato ulteriormente la potenza del modello di zebrafish. In particolare, gli schermi genetici avanti e sforzi sequenziamento dell'intero genoma giocato un ruolo chiave nella identificazione di mutazioni e geni critici per molti processi di sviluppo 11, 12, 13, 14,"> 15, 16 metodi di clonazione. Gateway hanno permesso l'applicazione di routine di transgenico si avvicina a 17, 18. I recenti progressi nella modifica del genoma, esemplificato dalla trascrizione attivatore-simile (Talens) e cluster regolarmente intervallati ripetizioni brevi palindromi (CRISPR) -Cas9 nucleasi, consentire l'introduzione mirata di mutazioni, così come knock-out e knock-in si avvicina 19, 20, 21, 22. combinata, questi metodi fanno zebrafish un potente modello per lo studio dei meccanismi genetici sottostanti specifici comportamenti e diverse malattie umane 23, 24, 25, 26, 27.
Questo lavoro si concentra su svilupporegolazione mentale e il ruolo dell'attività elettrica nello sviluppo neuronale. L'attenzione è sul midollo spinale, per cui il modello zebrafish fornisce diversi vantaggi. In primo luogo, è relativamente facile accedere zebrafish nelle fasi embrionali e larvali; Pertanto, si può studiare la funzione del midollo spinale durante fasi di sviluppo che hanno meno neuroni e semplice circuiteria 28, 29. Inoltre, il midollo spinale zebrafish ha un diverso insieme di neuroni, simile ad altri vertebrati, come dimostrato dai modelli caratteristici e distintivi di fattori di trascrizione 30, 31, 32, 33, 34, 35.
La maggior parte degli studi in zebrafish che mirano a scoprire i meccanismi che stanno alla base del funzionamento dei circuiti del midollo spinale, specialmentequelli che supportano locomozione, sono comprensibilmente focalizzati su stadi larvali 36, 37, 38, 39, 40, 41, 42, 43. Tuttavia, molti dei neuroni che formano le reti locomotiva spinali iniziato la loro differenziazione nelle fasi embrionali, ~ 9-10 ore dopo la fecondazione (HPF) 44, 45, 46, 47, 48, 49, 50, 51. In considerazione di ciò, comprendere come le proprietà morfologiche ed elettriche dei neuroni spinali sorgono e cambiamento tra gli stadi embrionali e larvali è importante per un overall comprensione della formazione circuito motorio e funzione.
I metodi di dissezione qui descritti permettono registrazioni di patch clamp da neuroni spinali e sono stati applicati con successo nelle fasi embrionali (~ 17-48 HPF) e stadi larvali (~ 3-7 giorni dopo la fecondazione [dpf]). Questo approccio limita la quantità di dissezione necessaria per fornire l'accesso ai neuroni di interesse. Il protocollo differisce dalla maggior parte degli altri metodi pubblicati per la registrazione da neuroni spinali zebrafish a che la colla veterinario sutura viene utilizzata, anziché un perno di tungsteno fine, per fissare l'embrione o larva alla camera di registrazione. La disponibilità di due approcci differenti (cioè, colla sutura rispetto al perno tungsteno) per il montaggio delle zebrafish embrioni o larve per l'analisi elettrofisiologica fornisce ai ricercatori opzioni alternative per raggiungere i loro obiettivi sperimentali specifiche.
In primo luogo, le procedure per l'accesso e la registrazione da un pop ulation di neuroni sensoriali primarie, cellule ROHON-barba, sono descritti. I corpi cellulari di questi neuroni si trovano all'interno del midollo spinale dorsale. Cellule ROHON-barba esistono in numerose specie di vertebrati, differenziano prime fasi di sviluppo, e alla base la risposta al tocco embrionale 6, 44, 47, 48.
In secondo luogo, le procedure per l'accesso e la registrazione da motoneuroni spinali sono dettagliate. Zebrafish motoneuroni spinali sorgono durante due onde di neurogenesi. Motoneuroni primari precedenza nati sorgono a fine gastrulazione (~ 9-16 HPF), con solo 3-4 motoneuroni primari presenti per hemisegment 45, 46, 49. Al contrario, la popolazione più tardi-nato motoneuroni secondari è più numerose e si verifica durante un periodo prolungato, da ~ 14 HPFef "> 45, 50. secondario motoneurone genesi segmenti metà tronco principalmente è completata da 51 HPF 50. motoneuroni secondari sono considerati la controparte dei motoneuroni del amnioti 46. È interessante notare che i neuroni sovraspinali, tramite dopamina, regolano locomozione la larva e motore secondario neurone genesi nell'embrione e giovane larva 50, 51. motoneuroni primari e secondari comprendono ciascuno diversi sottotipi differenti. ogni motore primario progetti neurone sottotipo un assoni periferici che innerva un gruppo muscolare caratteristico, con un conseguente stereotipo, identificando traiettoria assonale. Generalmente, i motoneuroni secondari seguono percorsi assonale prestabiliti dalla motoneuroni primari. Pertanto, rispetto a traiettorie assoni, motoneuroni primari e secondari sono simili, con l'eccezione che lo spessore assonale e somata dimensione are maggiore per motoneuroni primari 45.
In terzo luogo, i metodi per la registrazione da alcuni tipi di interneuroni sono discussi. Tuttavia, in questi casi, è richiesta una quantità limitata di rimozione di altre cellule del midollo spinale, e quindi il midollo spinale è meno intatta che per registrazioni da cellule ROHON-barba o neuroni motori.
Protocollo
Tutte le procedure di animali sono stati approvati dal Comitato Istituzionale cura degli animali ed uso (IACUC; Ufficio di laboratorio Risorse Animali, Università del Colorado Anschutz Medical Campus).
1. Zebrafish Zootecnica
- Sollevare e mantenere adulto zebrafish (Danio rerio) a 28,5 ° C in un / 14 h ciclo luce 10 h scuro e con apposito trattamento dell'acqua e scambio 52.
- Sollevare zebrafish embrioni / larve a 28,5 ° C in terreno di embrione fino a raggiungere la fase desiderata (ad esempio, 2 dpf).
2. Preparazione di dissezione Materiali
- Erogatore di collante per la dissezione zebrafish
NOTA: Questo protocollo prevede l'utilizzo di colla veterinario sutura per fissare la preparazione alla camera di registrazione. uso efficace della colla sutura richiede l'applicazione di piccole quantità di colla in modo controllato. La colla comincia a indurirsi non appenaincontra un ambiente acquoso. Pertanto, disegnare la colla in una micropipetta e fornire piccole quantità utilizzando un "erogatore di collante" fatta in casa che permette l'applicazione di pressione negativa o positiva per via orale. La parte centrale del distributore colla è un foro di vetro, un pezzo che è incluso all'interno della confezione contenente capillari di vetro a pareti sottili borosilicato (Figura 1A). Su un'estremità, il foro è collegato tramite un pezzo di tubo flessibile ad un boccaglio, mentre l'altra estremità tiene la micropipetta di vetro (Figura 1).- Rimuovere la lampadina nero da un foro vetro e sostituirlo con l'adattatore gomma bianca da un altro foro di vetro (Figura 1B e 1C).
NOTA: Questo foro vetro-adattatore-capped doppia consente il collegamento a una micropipetta di vetro su un'estremità e, all'altra estremità, ad un pezzo di tubo flessibile attraverso un piccolo, raccordo polipropilene diritta (Figura 1B, riquadro). - Tagliare un pezzo di tubo flessibile per una lunghezza di ~ 38 cm. Fissare il boccaglio (ad esempio, giallo 200 microlitri micropipetta punta) all'estremità del tubo flessibile non collegata al foro di vetro.
NOTA: Il pezzo di tubo deve essere sufficientemente lungo da consentire la manipolazione della micropipetta di vetro sotto un ambito dissezione mentre la punta gialla micropipetta è in bocca (Figura 1D).
- Rimuovere la lampadina nero da un foro vetro e sostituirlo con l'adattatore gomma bianca da un altro foro di vetro (Figura 1B e 1C).

Figura 1: erogatore di collante. Foro (AC) Un vetro connette al tubo flessibile ad un'estremità e la micropipetta di vetro all'altra. Gli adattatori di gomma permettono il fissaggio tramite un piccolo raccordo polipropilene (B, riquadro) al tubo e, infine, ad una micropipetta di vetro all'altra estremità. (D) L'erogatore di collante finale ha un boccaglio (ad esempio, costituito da un plaspunta tic pipetta) ad un'estremità del tubo e il foro di vetro con la micropipetta attaccato all'altro (freccia).
- Dissezione / camera di registrazione
NOTA: La camera di dissezione serve anche come camera di registrazione elettrofisiologia. La camera è formata su un vetrino utilizzando pezzi pretagliati di elastomero siliconico polimerizzato (Figura 2A).- Per preparare l'elastomero siliconico, aggiungere la base e l'agente reticolante in una provetta conica plastica in un rapporto di 4: 1, rispettivamente.
- Miscelare la base elastomero e l'agente di indurimento a fondo e versare la miscela in due 100 millimetri di Petri. Versare l'elastomero di spessore <1 mm in una capsula di Petri e ~ 2,5 mm all'altra.
- Lasciare che l'elastomero siliconico per curare per esposizione all'aria per ~ 4-5 giorni. Se è necessaria elastomero vulcanizzato prima, incubare a 60 ° C.
- Tagliare pezzi dell'elastomero siliconico polimerizzato alle seguenti dimensioni:
- Dal ~ 1 millimetro-thick elastomero indurito, tagliare una ~ 3,8 x 6,3 centimetri rettangolo; questo pezzo funge da fondo della camera (Figura 2A). Dal ~ da 2,5 mm di spessore siliconica reticolata, tagliare un rettangolo ~ 3,8 x 6,3 centimetri. Da quest'ultimo rettangolo, tagliare un rettangolo interno ~ 2,5 x 5 cm, il frame risultante serve come la parte superiore della camera (Figura 2A).
- Per rendere la camera di dissezione / registrazione, collocare il sottile rettangolo silicone direttamente su di un vetrino (5 x 7,6 cm), avendo cura di eliminare eventuali bolle d'aria tra il silicone e il vetro (Figura 2A). Posizionare il telaio rettangolo silicone, tagliata dalla elastomero spessore, sulla sommità dello strato inferiore sottile di silicone.
- Verificare che gli strati di silicone attaccano anche per l'altra e che non vi siano bolle d'aria tra i due strati (Figura 2A).
- Dopo l'uso, smontare la camera rimuovendo il telaio rettangolo silicone spessa dal lay silicone fondoer che è attaccato al vetrino. Risciacquare le superfici in silicone con DDH 2 O prima dell'uso e dopo ogni sessione di registrazione e asciugare con salviette basso rilascio di fibre.
- Conservare la camera di lavaggio per prevenire la crescita fungina tra i due pezzi di silicone.
NOTA: Se si utilizzano tossine o agenti farmacologici che potrebbero non lavare facilmente dal silicone, dedicare alloggiamenti specifici per tali scopi.

Figura 2: camera elettrofisiologia e strumenti di dissezione. (A) La camera usata per la dissezione e registrazioni elettrofisiologiche consiste di un vetrino su cui sono collocati due parti di elastomero siliconico polimerizzato, sovrapposto l'altro per fornire un telaio ed un fondo per un pozzo. La dimensione del pozzo, ~ 2,5 x 5 cm, permette l'utilizzo di piccoli volumi (2-2,5 mL) di registrazione extracellularesoluzione. Lo strato di silicone fondo permette un posizionamento sicuro dello zebrafish embrione utilizzando tessuto adesivo che non aderisce al vetro. (B) Un micropipetta di vetro (in alto) viene utilizzato per la consegna di colla durante la dissezione. Il vetro a parete sottile è tirato per creare un lungo estremità rastremata che viene successivamente tagliato, creando una punta con un diametro di circa 75 micron. La micropipetta di vetro rastremato è fissato all'estremità libera del distributore di colla (Figura 1D, freccia) e front-riempita con colla attraverso l'applicazione di aspirazione. L'altra micropipetta (basso), tirato da per quello utilizzato per una registrazione patch-clamp, viene utilizzato per la transezione del romboencefalo e per la rimozione della pelle. (C) Sotto un microscopio verticale, un micromanipolatore viene utilizzato per manovrare la micropipetta per le fasi finali di dissezione. Un micropipetta di vetro, come in B, in basso, è attaccato al portaelettrodo (freccia). rimozione muscolo viene raggiunto da unpplying aspirazione attraverso il tubo collegato all'uscita di aria (freccia). All'altra sua estremità, il tubo collega ad un rubinetto (freccia nera) che, sull'altro lato (asterisco), ha tubo attaccato ad un boccaglio.
3. Dissezione di embrioni e larve per le registrazioni di patch-clamp da neuroni spinali

Figura 3: dissezione dorsale di un midollo spinale zebrafish. (AA') Dopo transezione encefalo (a) di un embrione 2-dpf, la pelle è tagliata sui lati sinistro e destro dell'embrione (b). Un secondo taglio, perpendicolare al primo, viene quindi eseguita (c). Successivamente, la pelle viene sollevata con una micropipetta, permettendo pinzetta per afferrare e tirare via la pelle. (B) La rimozione della pelle espone il midollo spinale dorsale. Rostrale alla linea nera, lo scin è stato rimosso e la superficie del midollo spinale (asterisco), contenuto all'interno delle meningi, viene esposto. La pelle rimane intatta caudale alla linea nera (freccia). (CC') La punta della micropipetta di vetro viene premuto meningi, e veloci, laterali, brevi movimenti vengono eseguiti per forare le meningi. (DD 'e EE') Una volta che le meningi sono forate (DD '), la micropipetta è avanzato e (EE') spostato rostralmente strappare le meningi in due segmenti. Somata di neuroni ROHON-barba tipicamente emergono alla rimozione delle meningi (freccia). (FG') In una larva di 7 dpf, strati di muscoli coprire la parte dorsale del midollo spinale, impedendo l'accesso ai neuroni ROHON-barba. Dopo la rimozione della pelle, la larva viene trattato con 0,05% collagenasi. (F) A 5 minuti di incubazione con 0,05% collagenasi è troppo severe, risultantein danno muscolare eccessivo, come evidenziato dal muscolo sfilacciato (freccia e riquadro). (F') trattamento con collagenasi eccessiva può anche danneggiare neuroni ROHON-barba (freccia), rivelati qui per la loro espressione di GFP nel Tg (islet2b: GFP) linea. Nel Tg (islet2b: GFP) linea, neuroni dei gangli della radice dorsale esprimono GFP (freccia). Un più breve 1 min di incubazione con 0,05% collagenasi allenta sufficientemente muscolo (G) pur conservando la morfologia myotome (freccia e riquadro). (G'), le cellule del pigmento sono presenti sulla parte superiore dello strato muscolare più dorsale (freccia). (H e I) Nel Tg (islet2b: GFP) linea, neuroni ROHON-barba (frecce) e del ganglio della radice dorsale (freccia) continuano ad esprimere GFP a 7 dpf. Dorsale vista Tg (islet2b: GFP) zebrafish embrioni a 2 dpf (H) und 7 dpf (I). In Pannello una scala bar = 500 um; BE (mostrato in Pannello B) Scala bar = 80 um; F 'e G' (mostrato in Pannello F) Scala bar = 200 um; H e I (mostrato in Pannello H) Scala bar = 100 pm. Si prega di cliccare qui per vedere una versione più grande di questa figura.
- Dissezione di embrioni per registrazioni cellule ROHON-barba
- Collocare un embrione in una camera contenente dissezione ~ 2-3 ml di soluzione di Ringer (Figura 2A). Immobilizzare l'embrione aggiungendo ~ 100 ml di soluzione 0,4% tricaine alla camera.
- Tirare micropipette di vetro a pareti sottili su una micropipetta estrattore usando un filamento box per ottenere una lunga punta sottile, simile ad una micropipetta iniezione (Figura 2B, superiore) 53.
- Fissare la micropipetta di vetro tirato al foro vetro of l'erogatore di collante. Al microscopio da dissezione, utilizzare una pinzetta per rompere la punta della micropipetta di vetro in modo che la punta si ~ 75 micron (Figura 2B, in alto).
NOTA: La dimensione punta dovrebbe essere sufficientemente grande da consentire il caricamento efficiente della colla nella punta attraverso l'applicazione di pressione negativa (bocca di aspirazione) a fronte-riempire la micropipetta, ma abbastanza piccolo per consentire l'applicazione precisa della colla tramite pressione positiva . - Caricare la micropipetta di vetro con ~ 3-5 ml di colla applicando aspirazione attraverso il boccaglio. Portare la punta colla riempito alla camera di dissezione.
NOTA: riempire la micropipetta con colla richiede una forte aspirazione. Se la micropipetta si riempie rapidamente con aspirazione debole, la punta è troppo grande. - Posizionare l'embrione in camera di registrazione (Figura 3A e 3A'); per le registrazioni da embrioni e larve giovani (≤72 HPF), non v'è alcuna necessità di rimuovere il tessuto muscolare.
- Portarela punta della micropipetta colla caricata vicino alla testa dell'embrione / larva mantenendo una leggera pressione positiva alla micropipetta attraverso il tubo bocca (per evitare l'ingresso di soluzione acquosa). Una volta che la punta è vicino alla testa dell'embrione, applicare una pressione positiva sufficiente per espellere una goccia di colla sul fondo della camera.
NOTA: La colla indurisce una volta in contatto con la soluzione acquosa, quindi è importante applicare e mantenere la pressione positiva mite è collocato nella soluzione dissezione. - Utilizzare uno strumento perno dissezione per spostare l'embrione / larva verso la goccia di colla in modo che la testa entra in contatto con la colla. Orientare l'embrione dorsale rivolta verso l'alto e premere sulla testa per assicurare un buon contatto con la colla.
- Come la colla indurisce lentamente, utilizzare il perno dissezione per riposizionare l'embrione / larva modo che giaccia ventrale rivolto verso il basso, dorsale rivolta verso l'alto. Immergere lo strumento perno dissezione nella goccia di colla e disegnare filettature della colla sopra e attraverso la testadell'embrione per garantire ulteriormente la propria posizione.
NOTA: Tricaine accelera la velocità con cui la colla si indurisce. Per consentire più tempo per lavorare con la colla, utilizzare la quantità minima di tricaine necessaria per immobilizzare l'embrione / larva. Inoltre, il tasso di indurimento può variare con diversi lotti di colla. Di conseguenza, quando si utilizza un nuovo lotto di colla, accertarsi sulla velocità di indurimento prima di utilizzarlo per dissezione. - Una volta che la testa è saldamente collegato al silicone e la colla è solidificata, sacrificare l'embrione / larva da transezione a livello hindbrain con un altro micropipetta di vetro (Figura 3A- ae 4a- a).
NOTA: transection romboencefalo è il metodo che viene utilizzato qui per umana sacrificio di animali. Tuttavia, a seconda degli obiettivi sperimentali (ad esempio, lo studio di nuoto fittizia), può essere necessario un altro metodo. - Prima di fissare la coda alla camera, togliere la pelle dal tronco.
- Usouna micropipetta di vetro fresco (Figura 2B, in basso) per tagliare superficialmente la pelle più volte in una posizione caudale romboencefalo (Figura b 3A- e 4a- b). Forare la pelle superficialmente spostando la pipetta perpendicolare all'asse rostro-caudale su ciascun lato del tronco per dorsalmente montato (Figura 3A- b) campioni o sul lato esposto del tronco per provini montati lateralmente (figura 4a- b).
- Per creare un lembo di pelle per pinzette per afferrare, raschiare la pelle più volte con la micropipetta a livello di e perpendicolarmente al taglio iniziale nella fase 3.1.10.1 (Figura 3A- c e 4a- c).
- Con una pinzetta, a poco a poco sollevare il lembo di pelle e tirare la pelle caudale.
NOTA: Questo si traduce spesso nella rimozione della totalità della pelle dal tronco. Tuttavia, è sometimes necessari per rimuovere la pelle in diverse sezioni eseguendo ribadito raschiatura e trazione della pelle. Per alcune applicazioni, la rimozione parziale della pelle può consentire un adeguato accesso ai segmenti del midollo spinale di interesse (figure 3B e 4B). - Fornire una piccola goccia di colla vicino alla coda dell'embrione / larva. Utilizzare questa colla per fissare la coda alla parte inferiore della camera di dissezione. Durante questa fase, come il collante si indurisce, regolare la posizione del tronco con lo strumento perno dissezione per garantire che il tronco rimane dorsalmente orientato e che sia saldamente collegato alla camera.
- Seguendo questa dissezione iniziale, sciacquare la preparazione estesamente con soluzione di Ringer per rimuovere tricaine e detriti. Lasciare che la preparazione a riposo per ~ 5 min.
- Sostituire la soluzione dissezione con soluzione di registrazione extracellulare. Se necessario, aggiungere un agente immobilizzante alla preparazione (ad es., Α-bungarotoxin [conce finalentration di 1 pM]).
NOTA: 1 micron α-bungarotoxin immobilizza 1-2 dpf embrioni entro ~ 30 min. Per le larve più vecchio, può essere necessaria una maggiore concentrazione di α-bungarotoxin. a-bungarotossina è mantenuta nella soluzione del bagno durante la registrazione, che sono tipicamente eseguite entro un periodo di 1 ora. soluzioni di registrazione contenenti cationi bivalenti, come il cobalto, non richiedono l'aggiunta di un agente di immobilizzazione. Per gli esperimenti richiedono periodi prolungati di registrazione (oltre 1 h), il preparato viene perfuso con soluzione del bagno a una velocità di 0,5-1 ml / min. - Spostare la camera di dissezione con l'embrione montato alla fase di un microscopio composto verticale dotata di un obiettivo a lungo lavorazione distanza 40X immersione in acqua.
NOTA: Questo microscopio è parte della piattaforma in cui verranno eseguite le registrazioni. L'impianto deve inoltre essere dotato di un headstage, un amplificatore patch-clamp, un micromanipolatore, e un sistema di acquisizione dati / computer (Figura 2C). - Montare una micropipetta di vetro a pareti spesse vuoto borosilicato sul supporto elettrodo della headstage (Figure 2B, 2C e inferiore, freccia). Collegare il tubo (diametro interno: 0.16 cm, diametro esterno: 0,32 cm e lunghezza: ~ 90 cm) ad un'estremità alla presa d'aria del portaelettrodo (freccia) ed all'altra estremità ad una valvola a tre vie (Figura 2C , punta di freccia nera).
- Posizionare un boccaglio ad un'estremità di un altro pezzo di tubo (~ 60-70 cm di lunghezza) e collegarlo alla tre vie rubinetto all'altra estremità (Figura 2C, asterisco nero).
NOTA: Questo sistema consente tubazione per l'applicazione di pressione positiva e negativa all'interno della pipetta registrazione durante la formazione della guarnizione.
- Posizionare un boccaglio ad un'estremità di un altro pezzo di tubo (~ 60-70 cm di lunghezza) e collegarlo alla tre vie rubinetto all'altra estremità (Figura 2C, asterisco nero).
- Portare la punta micropipetta alla porzione più dorsale del midollo spinale e forare delicatamente le meningi. Seguire con rapide, brevi, di lato movimenti per loosen meningi (Figura 3C e 3C').
- Dopo che la punta micropipetta ha attraversato le meningi, avanzare e sollevare la micropipetta per tirare le meningi lontano dal midollo spinale (Figura 3D e 3D').
- Spostare la micropipetta rostralmente, avanzando oltre 1 a 2 hemisegments per esporre cellule ROHON-barba (Figura 3E e 3E').
NOTA: Sezionare la quantità minima di meningi necessarie per esporre solo poche cellule ROHON-Beard. Dopo ogni registrazione, la dissezione aggiuntiva viene eseguita per rivelare più celle ROHON-Beard. In entrambi gli embrioni e larve, i neuroni ROHON-Beard possono occasionalmente scoppiare al contatto con la micropipetta patch. Altri neuroni del midollo spinale non si comportano in questo modo, il che suggerisce che questo potrebbe riflettere proprietà uniche delle cellule ROHON-Barba, come il loro mechanosensitivity. A sostegno di questa, varie composizioni in soluzione (ad esempio, componenti ionicie osmolarità) sono stati testati, e nessuno ha impedito questo comportamento delle cellule ROHON-Beard.
- La dissezione di larve per registrazioni da cellule ROHON-Beard
NOTA: In 7 dpf larve, il muscolo che circonda il midollo spinale dorsale deve essere rimosso. Seguire passaggi 3.1.1 a 3.1.15 (con una larva sostituito un embrione) prima del trattamento con l'enzima.- Per rimuovere il muscolo, incubare la larva con 0,05% collagenasi per 1 min.
- Rimuovere la collagenasi risciacquando preparati ~ 5 volte con soluzione di Ringer. Seguire con ~ 5 risciacqui di soluzione extracellulare per rimuovere completamente la collagenasi.
- Eseguire il resto della dissezione dopo il montaggio della camera di registrazione sul palco del microscopio del impianto di registrazione. Collegare un borosilicato a pareti spesse cerotto micropipetta (Figura 2B, in basso) alla portaelettrodo e rompere la punta della micropipetta spazzolando delicatamente contro il fondo dila camera di silicone.
- Utilizzare la micropipetta un po 'rotto a prendere in giro il muscolo, allontanandosi ed esporre il midollo spinale dorsale. Per rimuovere fibre muscolari dalla preparazione, applicare aspirazione attraverso il tubo attaccato alla presa portaelettrodo. Utilizzare il micromanipolatore per spostare la micropipetta lungo la lunghezza di una fibra muscolare durante l'applicazione di aspirazione.
NOTA: L'obiettivo è quello di utilizzare prima la micropipetta per allentare meccanicamente il muscolo e poi a succhiare via e rimuovere le singole fibre muscolari. Di tanto in tanto, durante la rimozione del muscolo, la micropipetta si intasa con il tessuto aspirato.- Per sbloccare la micropipetta, spazzolare la micropipetta contro il fondo della camera, leggermente rompendo la punta, mentre soffia aria attraverso il tubo per espellere il contenuto.
NOTA: Se la dimensione della punta micropipetta diventa eccessivamente grande, può essere necessaria una nuova micropipetta. La dimensione della punta micropipetta è più critica quando rimuovendo gli strati muscolari closest alle membrane che circondano il midollo spinale o meningi (piccole punte micropipetta permettono lavoro più controllato).
- Per sbloccare la micropipetta, spazzolare la micropipetta contro il fondo della camera, leggermente rompendo la punta, mentre soffia aria attraverso il tubo per espellere il contenuto.
- Rimuovere le meningi come descritto nei punti 3.1.18-3.1.20 utilizzando un nuovo micropipetta (Figura 2B, in basso).
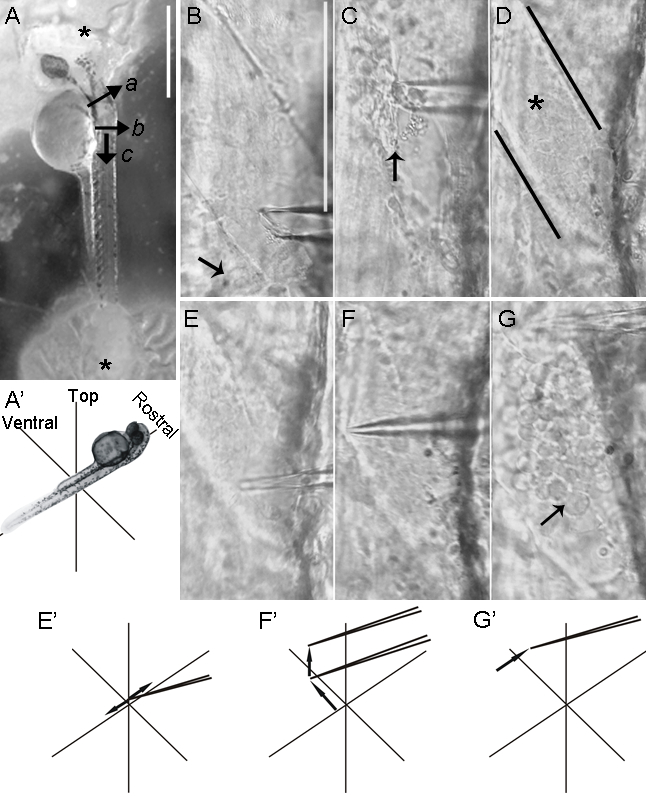
Figura 4: dissezione laterale del midollo spinale zebrafish. Montaggio zebrafish embrioni in un orientamento laterale agevola l'accesso ai neuroni motori. La rimozione del muscolo e dissezione delle meningi per esporre i motoneuroni viene eseguita sotto un microscopio verticale adattato con un obiettivo 40X immersione in acqua (vedere Figura 2). (A) corpi cellulari Motoneurone sono situati ventralmente e lateralmente all'interno del midollo spinale. Gli embrioni sono attaccati alla camera in modo che il loro lato dorsale affronta il portaelettrodo.Si noti che la colla sutura appare bianco, una volta che si indurisce (asterischi). Una volta romboencefalo viene sezionato (a), la pelle è tagliata superficialmente diverse volte in un sito (b) caudalmente al romboencefalo con una micropipetta di vetro. Ulteriori tagli superficiali (c), perpendicolare al primo insieme (b), formano una linguetta pelle che pinzetta può afferrare per la rimozione della pelle. (BG) Una micropipetta di vetro vuoto, tirato a breve, punta rastremata (Figura 2B, in basso), è collegato alla porta elettrodo. La micropipetta è manovrato con il micromanipolatore per la successiva dissezione multa e la rimozione del tessuto muscolare. (B) La punta della micropipetta di vetro viene prima diviso leggermente spazzolando delicatamente contro il fondo della camera, creando un'estremità frastagliata e un diametro di punta. La micropipetta viene spostato lungo la lunghezza delle fibre muscolari mentre si effettua l'aspirazione. fibre muscolari sono rimossi uno stratoalla volta per evitare la rottura delle meningi sottostanti. In embrioni, gli strati muscolari dorsali più vengono rimossi prima, in quanto questi tendono ad essere più sottile. La pelle non viene rimosso dal hemisegments caudali più (freccia). (C) La metà dorsale del muscolo in una hemisegment è stato rimosso (freccia). (D) linee nere delimitano una hemisegment privo di fibre muscolari, con meningi intatte coprono il midollo spinale (asterisco). (EE') mediante una micropipetta, pressione è applicata meningi in una posizione leggermente dorsale di motoneuroni somata. Brevemente i movimenti laterali della micropipetta conducono alla perforazione delle meningi. (FF') La micropipetta è avanzato ventralmente, verso l'aspetto ventrale del hemisegment, e sollevato per separare le meningi dal tessuto neuronale. Meningi (GG') sono transected spostando la micropipetta rostralmente lungo la lunghezza delhemisegment. I neuroni immediatamente emergono dal midollo spinale esposto e sono accessibili agli elettrodi di patch (freccia). Barre di scala = 500 um (A); Barre di scala = 100 micron in BG (mostrata in Pannello B).
- Dissezione di embrioni per motoneuroni e interneuroni registrazioni
- Posizionare l'embrione in una camera di dissezione contenente soluzione di Ringer e immobilizzare l'embrione con tricaine, come al punto 3.1.1.
- Montare l'embrione lateralmente, con il lato dorsale di fronte al lato della camera che è ottimale per l'utente (tipicamente dipende manualità). Seguire i passaggi 3.1.2-3.1.17 e garantire che l'embrione rimane piatto contro il silicone (Figura 4A e 4A').
- Utilizzare una micropipetta borosilicato a pareti spesse con una punta che è stato rotto a ~ 25 um a raschiare e aspirare il muscolo via ed esporre le meningi, come descritto nei punti 3.2.4-3.2.4.1 (Figura 4B - 4D).
- Una volta che gli strati muscolari vengono rimossi dal hemisegment (s) di interesse (Figura 4D), sostituire la micropipetta di vetro con uno nuovo che ha una punta intatto (Figura 2B, in basso). Forare le meningi in una posizione che è dorsale ai neuroni bersaglio. Utilizzando il micromanipolatore, spingere la micropipetta verso il basso sulle meningi e poi spostarla lateralmente rapidamente strappare ed attraversare le meningi (Figura 4E e 4E').
- Su rottura le meningi, avanzare e sollevare la micropipetta per sollevare le meningi lontano dal midollo spinale (Figura 4F e 4F'). Spostare la micropipetta rostralmente strappare la membrana lungo la lunghezza del hemisegment (Figura 4G e 4G').
NOTA: per registrazioni da cellule ROHON-barba e motoneuroni primari, dissezione è limitato alla compensazione meningi lontano dal immediatregione di destinazione e. Al contrario, per registrazioni interneuroni e motoneuroni secondari, è necessario rimuovere i neuroni all'interno del midollo spinale che impediscono l'accesso alla cella di interesse. In quest'ultimo caso, data la notevole perturbazione dei circuiti del midollo spinale, gli studi sono limitati all'analisi delle proprietà intrinseche di membrana elettriche.
4. Le registrazioni elettrofisiologiche da neuroni spinali
- Per registrazioni cellule ROHON-barba e motoneuroni, utilizzare capillari di vetro a pareti spesse borosilicati tirato ad una resistenza di circa 3 MW quando riempita con la soluzione di pipetta (Figura 2B, in basso).
- Applicare pressione positiva soffiando dolcemente attraverso il tubo attaccato al portaelettrodo prima immergendo la micropipetta nel bagno.
NOTA: La pressione positiva impedisce che i residui intasamento punta micropipetta ed è mantenuto ruotando il rubinetto a tre vie per l'off posizione. Una volta vicino al neurone bersaglio, la pressione positiva si tradurrà in una rientranza distintivo della membrana cellulare, un indicatore utile che la micropipetta è abbastanza vicino per iniziare la formazione di tenuta. - Rilasciare la pressione positiva ruotando la valvola rubinetto in posizione aperta durante l'applicazione di aspirazione luce supplementare attraverso il boccaglio.
- Dopo la formazione di un GΩ-tenuta fra la membrana cellulare e la punta micropipetta, applicare brevi impulsi di aspirazione la rottura della membrana e raggiungere una cellula intera configurazione.
- Dopo aver stabilito una cellula intera configurazione stabile, con una resistenza d'ingresso di 500 MW e una resistenza di accesso 10 MW, ottenere registrazioni sia in modalità da tensione o corrente-clamp.
- Applicare pressione positiva soffiando dolcemente attraverso il tubo attaccato al portaelettrodo prima immergendo la micropipetta nel bagno.
Risultati
Noi abbiamo registrato con successo da neuroni ROHON-barba in 17 HPF embrioni a 7 dpf larve (Figura 5A e 5B). Quando sono stati registrati cellule ROHON-barba, la preparazione è stata montata dorsale rivolta verso l'alto. Tale montaggio consente l'identificazione univoca delle cellule ROHON-barba basati sulle loro posizioni dorsali superficiali e grandi dimensioni soma. L'identificazione è ulteriormente confermata dal potenziale di membrana a riposo hyperpolarized stereotipo di questi neuroni (Figura 5, tavolo riquadro) 6, 54. Inoltre, come i neuroni sensoriali primari, i neuroni ROHON-barba mancano ingresso sinaptica. Pertanto, in assenza di stimolazione elettrica, variazioni nel potenziale di membrana dovrebbe verificarsi durante la registrazione in modalità current-clamp (Figura 5B'). Poiché le registrazioni iniziali da cellule ROHON-barba in zebrafish sono stati eseguiti 6, varie linee transgeniche (per esempio, Tg (islet2b: GFP), Tg (NGN: GFP), e Tg (isletss: GFP)) sono stati generati che esprimono reporter fluorescente in questi neuroni, facilitare ulteriormente loro identificazione 55, 56, 57.
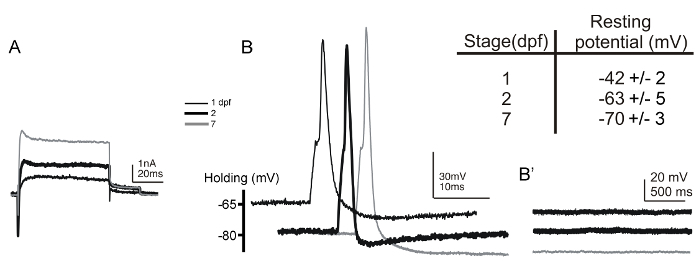
Figura 5: Voltage- cellule intere e corrente-clamp registrazioni da neuroni ROHON-barba in 1 e 2 dpf embrioni e 7 dpf larve. (A) voltage-clamp di andata e correnti attivo sono stati ottenuti dai neuroni ROHON-barba 1- (sottile linea nera), 2- (spessa linea nera), e 7-dpf (linea grigia) embrioni / larve. Il potenziale possesso era -80 mV e correnti era suscitato da un passo depolarizzante a +20 mV. (B) potenziali d'azione singole sono suscitato da breve (1 ms) Correnteiniezioni (~ 0,35 Na) ai neuroni ROHON-Beard di 1- (sottile linea nera), 2- (spessa linea nera), e 7-dpf (linea grigia) embrioni / larve. (B') In assenza di stimolazione elettrica, variazioni nel potenziale di membrana, come depolarizzazioni postsinaptici spontanee, si verificano nei neuroni ROHON-barba. La tabella inserto riassume i valori dei potenziali di membrana registrate da neuroni ROHON-barba di 1- (n = 21) e 2- (n = 9) dpf embrioni e 7- (n = 7) dpf larve riposo. Si prega di cliccare qui per vedere una versione più grande di questa figura.
linee transgeniche che permettono l'identificazione univoca di altri sottotipi di neuroni spinali sono anche disponibili. Tra questi, la linea mnx1 transgenici Tg (mnx1: GFP) esprime la proteina fluorescente verde (GFP) in un sottoinsieme dei motoneuroni spinali subito dopo la loro specifica (~ 14-16 HPF) 58, 59. A causa del posizionamento stereotipo dei motoneuroni primari all'interno di ogni hemisegment (Figura 6A), insieme con l'espressione di GFP nel transgenico mnx1, è possibile identificare i vari sottotipi motoneurone primaria (Figura 6B e 6C). Tra cui un colorante fluorescente nella soluzione elettrodo di registrazione permette la visualizzazione delle traiettorie degli assoni, fornendo ulteriori conferma dell'identità motoneurone, come alcuni interneuroni esprimono anche GFP nel Tg (mnx1: GFP) linea. In alternativa, un'altra linea transgenica che permette l'identificazione dei motoneuroni è la linea ET2 60.
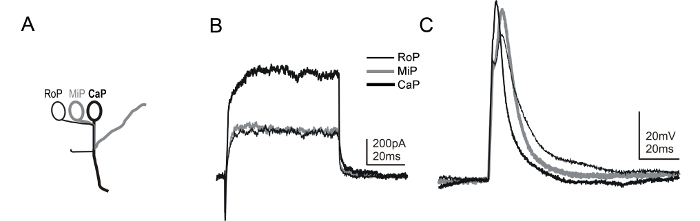
Figura 6: tensione cellule intere e corrente-clamp registrazioni da motoneuroni 1 dpf zebrafish Embryos. (A) Un fumetto descrive le caratteristiche morfologiche delle principali sottotipi motoneurone presenti nel midollo spinale zebrafish. Motoneuroni primari sono identificati dalla posizione del loro soma all'interno di un segmento (cioè rostrale [POR], mediale [MiP], o caudale [CaP]) 45. Inoltre, ogni sottotipo estende un assone verso la periferia attraverso un percorso distinto. L'uso combinato della Tg (mnx1: GFP) e linea colorante etichettatura rivela il mozzo assonale stereotipo e l'identità del sottotipo motoneurone durante una registrazione. Usando i metodi qui presentati, è possibile registrare sequenzialmente da tre diversi sottotipi primario motoneurone nella stessa hemisegment. (B) voltage-clamp sono mostrati che sono stati ottenuti da ROP, MiP, e CaP, tutto in una sola hemisegment. Un gradino di tensione di +20 mV è stato usato per indurre le correnti da un potenziale di -80 mV. (C) Durante corrente-clamp recordings da ROP MiP, e CaP, brevi (1 ms, ~ 0,4 nA) iniezioni di corrente sono stati applicati per innescare un potenziale d'azione. Il potenziale di membrana è tenuto presso ~ -65 mV. Si prega di cliccare qui per vedere una versione più grande di questa figura.
Una differenza principale tra neuroni motori primari e secondari è il più grande somata dei neuroni in precedenza nati. Tuttavia, secondarie sottotipi motoneurone non sono identificabili dalla dimensione soma o posizione. Per registrazioni specifiche motoneuroni secondari, due linee transgeniche, Tg (GATA2: GFP) e Tg (islet1: GFP), sono stati utilizzati per l'identificazione dei motoneuroni secondari con assoni ventrale e dorsale sporgenti, rispettivamente 55, 61. Tuttavia, una terza secondaria sottotipo motoneuroni è presente nel midollo spinale zebrafish, con axons che dorsale del progetto e ventrale 62. Di conseguenza, tintura può essere utilizzato per riempire motoneuroni secondari durante la registrazione per identificare sottotipi sulla base della morfologia (figura 7A) 8, 9. Spesso, durante voltage-clamp (Figura 7B, asterischi) o registrazioni corrente-clamp (Figura 7C e 7C', frecce) da motoneuroni secondari, vengono registrati eventi spontanei o sinaptici.

Figura 7: tensione cellule intere e corrente-clamp registrazioni da motoneuroni secondari di 2 DPF embrioni. (A) Nel Tg (GATA2: GFP) linea, due diversi sottotipi del motoneurone secondario esprimono GFP 62. Nel hemisegment sinistra, una ventrale motoneurone secondaria(Asterisco e la freccia indicano soma e assone, rispettivamente). Nel hemisegment vicina, a destra (caudale), v'è una ventrale / dorsale motore secondario neurone (asterisco indica soma; frecce indicano i due assoni, uno sporgenti ventrale [freccia in basso] e l'altra dorsalmente [freccia in alto]). Questi neuroni sono state marcate con un colorante fluorescente rosso durante le registrazioni. Per identificare ventrale / dorsale motoneuroni secondari, è fondamentale garantire che la dissezione non rimuove muscolare nel hemisegment caudale adiacente, così danneggiare o rimuovere l'assone dorsale. Dopo la registrazione, il soma neurone rimane attaccato al micropipetta mentre viene tirata via dalla preparazione (a destra asterisco in alto). Quando si utilizza coloranti ad occupare neuroni durante le registrazioni, il colorante spesso perdite mentre l'elettrodo è nel bagno, risultante in uno sfondo fluorescente rossa visibile nel midollo spinale e notochord (asterisco fondo in rostrale [sinistra] hemisegment < / Em>). (B) voltage-clamp sono stati ottenuti da ventrale e ventrale / dorsale motoneuroni secondari. gradini di tensione (a -30, -10, +10, +30, +50, +70, +90, +110 mV) hanno suscitato verso l'esterno e verso l'interno correnti. Potenziali d'azione di sbloccaggio / depolarizzazioni possono essere presenti nelle registrazioni (asterischi). (C) durante la registrazione corrente-clamp da neuroni motori secondari, brevi (1 ms) iniezioni di corrente di ampiezza crescente sono stati applicati ai neuroni per innescare un potenziale d'azione (asterischi). (C') Esempi di potenziali di azione singoli innescati nei motoneuroni secondari da ~ 0,4-nA iniezioni correnti sono mostrati. In questa fase, potenziali d'azione spontanei sono anche osservati (C e C', frecce). (D) prolungato (100 ms) iniezioni di corrente (~ 0,35 na) innescare la cottura ripetitiva dei potenziali d'azione. Il potenziale di membrana è tenuto presso ~ -65 mV.carico / 55507 / 55507fig7large.jpg" target = '_ blank'> Clicca qui per vedere una versione più grande di questa figura.
Discussione
I metodi qui descritti consentono la caratterizzazione elettrica e morfologica dei neuroni sensoriali e motori di embrioni zebrafish dopo minima dissezione del midollo spinale. Neuroni restano sani per almeno 1 h, il limite di tempo imposto su queste registrazioni. I neuroni sono stati registrati utilizzando la configurazione a cellula intera serie, così come da patch nucleate; quest'ultimo metodo minimizza problemi di spazio-clamp che può precludere uno studio biofisico dettagliato delle correnti ioniche 9.
Una sfida importante è ottenere il fermo attaccamento dell'embrione o larva alla camera al fine di rimuovere la pelle e per eseguire la dissezione limitate richieste per fornire l'accesso ai neuroni di interesse. La preparazione ha anche bisogno di essere adeguatamente fissato alla camera di registrazione per le cellule intere metodi patch-clamp. Un metodo che risponde a questa sfida mediante l'uso di colla veterinario sutura per fissare l'embrione o larva dila camera di dissezione / registrazione viene qui descritto, un approccio che è stata usata per la dissezione di altri organismi modello (ad esempio, Drosophila) 63. Dalla nostra esperienza di formazione altri, troviamo che la fase più critica per padroneggiare è la consegna controllata e precisa di piccole quantità di colla. Qui, un dispositivo erogatore di collante che consente all'utente di applicare pressione negativa e positiva per caricare colla in o espellerla dalla punta di una micropipetta è discusso. Utilizzando la colla sutura, embrioni e larve possono essere saldamente fissati alla camera ed orientati entrambi dorsale rivolta verso l'alto o lateralmente. In questo modo, diverse opzioni di accesso per una varietà di neuroni sono disponibili. Inoltre, lo strato di elastomero siliconico sul fondo della camera può essere ancora più sottile di 1 mm qui specificati, forniscono vantaggi potenziali ottici. Un altro metodo, più comunemente usato per fissare la preparazione di una camera di registrazione, prevede l'utilizzo di perni di tungsteno sottili 1 , 2, 3, 4, 5. Mentre che i metodi sono diversi, entrambi permettono l'accesso elettrofisiologico ai neuroni spinali zebrafish, offrendo i ricercatori con le opzioni che possono essere selezionati in base agli obiettivi e le sfide dell'esperimento.
La preparazione zebrafish qui descritto permette di studiare elettrica e morfologico dei neuroni spinali in situ durante le prime fasi di differenziazione. Registrando dai neuroni spinali utilizzando questi metodi, abbiamo acquisito conoscenza sugli effetti cellulari di diverse mutazioni, anche prima della identificazione del gene lesionata 6, 64, 65.
Divulgazioni
Gli autori dichiarano alcun interesse finanziario in competizione.
Riconoscimenti
Questo lavoro è stato sostenuto da finanziamenti del NIH (NS059120 F32 per RLM e R01NS25217 e P30NS048154 a ABR).
Materiali
| Name | Company | Catalog Number | Comments |
| Vacuum filter/Storage bottle, 0.22 mm pore | Corning | 431096 | |
| Syringe filter 0.2 mm | Whatman | 6780-2502 | |
| Tricaine | Sigma | A-5040 | Ethyl 3-aminobenzoate methanesulfonate salt |
| α-bugarotoxin | Tocris | 11032-79-4 | |
| Tetrodotoxin | Tocris | 4368-28-9 | |
| Alexa-549 hydrazine salt | Molecular Probes | A-10438 | fluorescent dye |
| Spin-X centrifuge tube filter | Corning | 8161 | |
| Glass microscope slide | Fisher | 12-550C | |
| Sylgard silicone elastomer kit | Dow Corning | 184 | silicone elastomer |
| Petri dishes | Falcon | 351029 | |
| Borosilicate glass capillaries | Harvard Apparatus | 30-0038 | inner and outer diameters of 0.78 and 1.0 mm (thin walled glass capillaries) |
| Borosilicate glass capillaries | Drummond Scientific | 1-000-1000-100 | inner and outer diameters of 1.13 and 1.55 mm (thick walled glass capillaries) |
| Miniature barbed polypropylene fitting | Cole-Palmer | 6365-90 | |
| Vetbond tissue adhesive | 3M | 1469SB | |
| Collagenase XI | Sigma | C7657 | |
| Microelectrode puller | Sutter Instruments | Model P-97 | |
| Amplifier | Molecular Devices | Axopatch 200B | |
| Head stage | Molecular Devices | CV203BU | |
| Motorized micromanipulator | Sutter Instruments | MP-285 | |
| Tygon tubing | Fisher | 14-169-1B | ID 1/16 IN, OD 1/8 IN and WALL 1/32 IN (flexible laboratory tubing) |
| Electrode holder | Molecular Devices | 1-HC-U | |
| Pharmaseal Three-Way Stopcocks | Baxter | K75 | |
| Digitizer | Axon Instruments | Digidata 1440A | |
| Inverted microscope | Zeiss | Axioskop2 FS plus | |
| 40X/0.80W Achroplan objective | Zeiss | ||
| Data acquisition and analysis software | Axon Instruments | PClamp 10 - Clampex and Clampfit | |
| Micropipette puller | Sutter Instruments | Model P-97 | |
| Name | Company | Catalog Number | Comments |
| Dissection and Recording Solutions (in mM) | |||
| All solutions, except the intracellular, are stable for ~2-3 months when filtered (0.22 mm filter cups) and stored at room temperature (RT). | |||
| The intracellular solution is filtered (0.2 mm syringe filters) and stored frozen (-20 °C) in small aliquots that are individually thawed on the day of use. | |||
| Dissection/Ringer’s solution | 145 NaCl, 3 KCl, 1.8 CaCl2.2H2O, 10 HEPES; pH 7.4 (with NaOH) | ||
| Pipette (intracellular) recording solution | 135 KCl, 10 EGTA-acid, 10 HEPES; pH 7.4 (with KOH). | ||
| Bath (extracellular) recording solution/voltage and current-clamp | 125 NaCl, 2 KCl, 10 CaCl2.2H2O, 5 HEPES; pH 7.4 (with NaOH). | ||
| Alexa-594 hydrazine salt stock solution. | Prepare a 13.2 mM stock in ddH2O, aliquot (~100 µl) and store at -20 °C. For use, dilute the stock solutiond 132 fold with pipette solution to a final concentration of 100 mM. After dilution, filter the Alexa-594 containing pipette solution with a centrifuge tube filter. | ||
| Name | Company | Catalog Number | Comments |
| Immobilizing agents | |||
| 0.4% ethyl 3-aminobenzoate methanesulfonate salt (Tricaine) | Prepare a 0.4% stock solution in 0.2 M Tris, pH 9 (0.4 g Tricaine/100 mL 0.2 M Tris | ||
| Adjust pH to 7 with NaOH and store at -20 °C. | |||
| For use, dilute the stock solution ~25 fold in embryo media | |||
| 250 mM α-bungarotoxin | Prepare a 250 mM stock in ddH2O (1 mg/500 mL), prepare 100 µL aliquots, and sotre at -20 °C. | ||
| For use, dilute 2,500-fold with extracellular solution to a final concentration of 100 nM. | |||
| 1 mM Tetrodotoxin | Prepare a 1 mM stock in ddH2O (1 mg/3 mL), prepare 100 µL aliquots, and sotre at -20 °C. | ||
| For use, dilute 2,000-fold with extracellular solution to a final concentration of 500 nM. | |||
Riferimenti
- Drapeau, P., Ali, D. W., Buss, R. R., Saint-Amant, L. In vivo recording from identifiable neurons of the locomotor network in the developing zebrafish. J Neurosci Methods. 88 (1), 1-13 (1999).
- Drapeau, P., Saint-Amant, L., Buss, R. R., Chong, M., McDearmid, J. R., Brustein, E. Development of the locomotor network in zebrafish. Prog Neurobiol. 68 (2), 85-111 (2002).
- Saint-Amant, L., Drapeau, P. Whole cell patch-clamp recordings from identified spinal neurons in the zebrafish embryo. Methods Cell Sci. 25, 59-64 (2003).
- Masino, M. A., Fetcho, J. R. Fictive Swimming Motor Patterns in Wild Type and Mutant Larval Zebrafish. J Neurophysiol. 93 (6), 3177-3188 (2005).
- Wen, H., Brehm, P. Paired motor neuron-muscle recordings in zebrafish test the receptor blockade model for shaping synaptic current. J Neurosci. 25 (35), 8104-8111 (2005).
- Ribera, A. B., Nüsslein-Volhard, C. Zebrafish Touch-Insensitive Mutants Reveal an Essential Role for the Developmental Regulation of Sodium Current. J Neurosci. 18, 9181-9191 (1998).
- Pineda, R. H., Heiser, R. A., Ribera, A. B. Developmental, molecular, and genetic dissection of INa in vivo in embryonic zebrafish sensory neurons. J Neurophysiol. 93, 3582-3593 (2005).
- Moreno, R. L., Ribera, A. B. Zebrafish motor neuron subtypes differ electrically prior to axonal outgrowth. J Neurophysiol. 102, 2477-2484 (2009).
- Moreno, R. L., Ribera, A. B. Spinal neurons require Islet1 for subtype-specific differentiation of electrical excitability. Neural Dev. 9 (1), 19 (2014).
- Streisinger, G., Walker, C., Dower, N., Knauber, D., Singer, F. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature. 291 (5813), 293-296 (1981).
- Driever, W., et al. A genetic screen for mutations affecting embryogenesis in zebrafish. Development. 123, 37-46 (1996).
- Haffter, P., et al. The identification of genes with unique and essential functions in the development of the zebrafish, Danio rerio. Development. 123, 1-36 (1996).
- Vogel, G. Genomics: Sanger will sequence zebrafish genome. Science. 290 (5497), 1671 (2000).
- Patton, E. E., Zon, L. I. The art and design of genetic screens: zebrafish. Nature Reviews Genetics. 2 (12), 956-966 (2001).
- Lawson, N. D., Wolfe, S. A. Forward and reverse genetic approaches for the analysis of vertebrate development in the zebrafish. Dev Cell. 21 (1), 48-64 (2011).
- Yates, A., et al. Ensembl. Nucleic Acids Res. 44 (D1), D710-D716 (2016).
- Kawakami, K. Transgenesis and gene trap methods in zebrafish by using the Tol2 transposable element. Methods Cell Biol. 77, 201-222 (2004).
- Kwan, K. M., et al. The Tol2kit: a multisite gateway-based construction kit for Tol2 transposon transgenesis constructs. Dev Dyn. 236 (11), 3088-3099 (2007).
- Huang, P., Xiao, A., Zhou, M., Zhu, Z., Lin, S., Zhang, B. Heritable gene targeting in zebrafish using customized TALENs. Nat Biotechnol. 29, 699-700 (2011).
- Sander, J. D., et al. Targeted gene disruption in somatic zebrafish cells using engineered TALENs. Nat Biotechnol. 29 (8), 697-698 (2011).
- Chang, N., et al. Genome editing with RNA-guided Cas9 nuclease in zebrafish embryos. Cell Res. 23 (4), 465-472 (2013).
- Hwang, W. Y., et al. Efficient genome editing in zebrafish using a CRISPR-Cas system. Nat Biotechnol. 31 (3), 227-229 (2013).
- Lieschke, G. J., Currie, P. D. Animal models of human disease: zebrafish swim into view. Nature Rev Genet. 8 (5), 353-367 (2007).
- Levin, E. D., Cerutti, D. T., Buccafusco, J. J. Behavioral neuroscience of zebrafish. Methods of behavior analysis in neuroscience. , (2009).
- Stewart, A., Gaikwad, S., Kyzar, E., Green, J., Roth, A., Kalueff, A. Modeling anxiety using adult zebrafish: A conceptual review. Neuropharmacology. 62, 135-143 (2012).
- Mushtaq, M. Y., Verpoorte, R., Kim, H. K. Zebrafish as a model for systems biology. Biotechnol Genet Eng Rev. 29 (2), 187-205 (2013).
- Phillips, J. B., Westerfield, M. Zebrafish models in translational research: tipping the scales toward advancements in human health. Dis Model Mech. 7 (7), 739-743 (2014).
- Weis, J. S. Analysis of the development of nervous system of the zebrafish, Brachydanio rerio. I. The normal morphology and development of the spinal cord and ganglia of the zebrafish. J Embryol Exp Morphol. 19 (2), 109-119 (1968).
- Bernhardt, R. R., Chitnis, A. B., Lindamer, L., Kuwada, J. Y. Identification of spinal neurons in the embryonic and larval zebrafish. J Comp Neurol. 302 (3), 603-616 (1990).
- Tsuchida, T., et al. Topographic organization of embryonic motor neurons defined by expression of LIM homeobox genes. Cell. 79 (6), 957-970 (1994).
- Guillemot, F. Spatial and temporal specification of neural fates by transcription factor codes. Development. 134, 3771-3780 (2007).
- Goulding, M. Circuits controlling vertebrate locomotion: Moving in a new direction. Nat Rev Neurosci. 10, 507-518 (2009).
- Fetcho, J. R., McLean, D. L. Some principles of organization of spinal neurons underlying locomotion in zebrafish and their implications. Ann N Y Acad Sci. 1198, 94-104 (2010).
- Del Barrio, M. G., et al. A transcription factor code defines nine sensory interneuron subtypes in the mechanosensory area of the spinal cord. PLoS One. 8 (11), (2013).
- Satou, C., Kimura, Y., Hirata, H., Suster, M. L., Kawakami, K., Higashijima, S. Transgenic tools to characterize neuronal properties of discrete populations of zebrafish neurons. Development. 140 (18), 3927-3931 (2013).
- McLean, D. L., Fan, J., Higashijima, S., Hale, M. E., Fetcho, J. R. A topographic map of recruitment in spinal cord. Nature. 446, 71-75 (2007).
- McLean, D. L., Masino, M. A., Koh, I. Y., Lindquist, W. B., Fetcho, J. R. Continuous shifts in the active set of spinal interneurons during changes in locomotor speed. Nat. Neurosci. 11, 1419-1429 (2008).
- McLean, D. L., Fetcho, J. R. Spinal interneurons differentiate sequentially from those driving the fastest swimming movements in larval zebrafish to those driving the slowest ones. J. Neurosci. 29, 13566-13577 (2009).
- Ampatzis, K., Song, J., Ausborn, J., El Manira, A. Separate microcircuit modules of distinct V2a interneurons and motoneurons control the speed of locomotion. Neuron. 83, 934-943 (2014).
- Ljunggren, E. E., Haupt, S., Ausborn, J., Ampatzis, K., El Manira, A. Optogenetic activation of excitatory premotor interneurons is sufficient to generate coordinated locomotor activity in larval zebrafish. J. Neurosci. 34, 134-139 (2014).
- Menelaou, E., VanDunk, C., McLean, D. L. Differences in the morphology of spinal V2a neurons reflect their recruitment order during swimming in larval zebrafish. J Comp Neurol. 522, 1232-1248 (2014).
- Hubbard, J. M., et al. Intraspinal Sensory Neurons Provide Powerful Inhibition to Motor Circuits Ensuring Postural Control during Locomotion. Curr Biol. 26 (21), 2841-2853 (2016).
- Song, J., Ampatzis, K., Björnfors, E. R., El Manira, A. Motor neurons control locomotor circuit function retrogradely via gap junctions. Nature. 529 (7586), 399-402 (2016).
- Lamborghini, J. E. Rohon-beard cells and other large neurons in Xenopus embryos originate during gastrulation. J. Comp. Neurol. 189, 323-333 (1980).
- Myers, P. Z., Eisen, J. S., Westerfield, M. Development and axonal outgrowth of identified motoneurons in the zebrafish. J Neurosci. 6, 2278-2289 (1986).
- Kimmel, C. B., Westerfield, M., Edelman, G. M., Gall, W. E., Cowan, W. M. Primary neurons of the zebrafish. Signals and Sense: Local and Global Order in Perceptual Maps. , 561-588 (1990).
- Metcalfe, W. K., Myers, P. Z., Trevarrow, B., Bass, M. B., Kimmel, C. B. Primary neurons that express the L2/HNK-1 carbohydrate during early development in the zebrafish. Development. 110 (2), 491-504 (1990).
- Rossi, C. C., Kaji, T., Artinger, K. B. Transcriptional control of Rohon-Beard sensory neuron development at the neural plate border. Dev Dyn. 238, 931-943 (2009).
- Lewis, K. E., Eisen, J. S. From cells to circuits: development of the zebrafish spinal cord. Progress in Neurobiology. 69 (6), 419-449 (2003).
- Reimer, M. M., et al. Dopamine from the brain promotes spinal motor neuron generation during development and adult regeneration. Dev Cell. 25 (5), 478-491 (2013).
- Lambert, A. M., Bonkowsky, J. L., Masino, M. A. The conserved dopaminergic diencephalospinal tract mediates vertebrate locomotor development in zebrafish larvae. J Neurosci. 32 (39), 13488-13500 (2012).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (1995).
- Oesterle, A. . Pipette Cookbook 2015 P-97 & P-1000 Micropipette pullers. , (2015).
- Spitzer, N. C. The ionic basis of the resting potential and a slow depolarizing response in Rohon-Beard neurons of Xenopus tadpoles. J Physiol. 255 (1), 105-135 (1976).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. J Neurosci. 20, 206-218 (2000).
- Blader, P., Plessy, C., Strahle, U. Multiple regulatory elements with spatially and temporally distinct activities control neurogenin1 expression in primary neurons of the zebrafish embryo. Mech Dev. 120, 211-218 (2003).
- Palanca, A. M., et al. New transgenic reporters identify somatosensory neuron subtypes in larval zebrafish. Dev Neurobiol. 73, 152-167 (2013).
- Flanagan-Street, H., Fox, M. A., Meyer, D., Sanes, J. R. Neuromuscular synapses can form in vivo by incorporation of initially aneural postsynaptic specializations. Development. 132, 4471-4481 (2005).
- Arkhipova, V., Wendik, B., Devos, N., Ek, O., Peers, B., Meyer, D. Characterization and regulation of the hb9/mnx1 beta-cell progenitor specific enhancer in zebrafish. Dev Biol. 365, 290-302 (2012).
- Balciunas, D., Davidson, A. E., Sivasubbu, S., Hermanson, S. B., Welle, Z., Ekker, S. C. Enhancer trapping in zebrafish using the Sleeping Beauty transposon. BMC Genomics. 5 (1), 62 (2004).
- Meng, A., Tang, H., Ong, B. A., Farrell, M. J., Lin, S. Promoter analysis in living zebrafish embryos identifies a cis-acting motif required for neuronal expression of GATA-2. Proc. Natl. Acad. Sci. USA. 94, 6267-6272 (1997).
- Menelaou, E., McLean, D. L. A gradient in endogenous rhythmicity and oscillatory drive matches recruitment order in an axial motor pool. J Neurosci. 32, 10925-10939 (2012).
- Rohrbough, J., Pinto, S., Mihalek, R. M., Tully, T., Broadie, K. latheo, a Drosophila gene involved in learning, regulates functional synaptic plasticity. Neuron. 23 (1), 55-70 (1999).
- McKeown, K. A., Moreno, R., Hall, V. L., Ribera, A. B., Downes, G. B. Disruption of Eaat2b, a glutamate transporter, results in abnormal motor behaviors in developing zebrafish. Dev Biol. 362 (2), 162-171 (2012).
- Carmean, V., et al. pigk mutation underlies macho behavior and affects Rohon-Beard cell excitability. J Neurophysiol. 114 (2), 1146-1157 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon