Method Article
Sendai Virüs ve santrifüj kullanılarak Kan Hücreleri indüklenmiş pluripotent kök hücre Üretimi
Bu Makalede
Özet
We propose a protocol for reprogramming peripheral blood mononuclear cells (PBMCs) into induced pluripotent stem cells (iPSCs). By plating the transduced blood cells onto matrix-coated plates with centrifugation, iPSCs are successfully induced from floating cells. This technique suggests a simple and effective reprogramming protocol for cells such as PBMCs and CBMCs.
Özet
İnsan uyarılmış pluripotent kök hücreler (hiPSCs) son gelişme olgun somatik hücreler farklılaşmamış bir, pluripotent duruma geri kanıtladı. İlk deneyler, genellikle deri fibroblast ile yapıldı vb keratinositler, idrar hücreler, fibroblastlar, Şimdi, yeniden programlama çeşitli yetişkin somatik hücre tipleri ile yapılır. Ancak, bu hastaların fibroblastlar elde etmek için invazif cerrahi prosedür gerekli. Bu nedenle, kan ve idrar hücreleri gibi süspansiyon hücreleri, çünkü birincil hücreler elde rahatlık yeniden programlama için ideal olarak kabul edildi. Burada, periferal kan tek-çekirdekli hücreleri (PBMC) için iPSC üretilmesi için etkili bir yöntem sunulmaktadır. Yeni, matris kaplı plaka kullanılarak santrifüj seri olarak transduced PBMC'ler kaplama olarak, bu protokol kolayca iPSC koloniler sağlayabilir. Bu yöntem aynı zamanda göbek kordonu kan tek-çekirdekli hücreleri (CBMCs) için de geçerlidir. Bu çalışma, basit ve etkili bir Prot sunarPBMC'ler ve CBMCs yeniden programlanmasını ocol.
Giriş
Kök hücreleri, son birkaç on yıl 1 Klinik terapisinde en cazip malzemelerden biri olmuştur. Kök hücrelerin çekici özellikleri Pluripotency ve kendini yenilemek yeteneği vardır. 1981 yılında ilk embriyonik kök hücrelerin (ESCs) fare embriyo 2 izole edilmiştir. teknik insan embriyosunun uygulanmıştır Ancak, birkaç etik konuları karşılaştı.
Dr. Yamanaka ve ekibi fare somatik hücrelerden ilk pluripotent hücre reprogrammed zaman 2006 yılında, kök hücre alanı kendi imkanı kazanmış ve faiz 3 canlanan edildi. Birkaç tanımlanmış faktörleri teslim ederek, pluripotent kök hücreler başarıyla yetişkin somatik hücrelerden "uyarılmış" olduğunu ve böylece adlandırılmıştır "(iPSCs) uyarılmış pluripotent kök hücreler." 2007 yılında, bu teknik EKH kesin özelliklere sahip hücreler üreterek, insan hücrelerinde 4 uygulanmış fakat etik tartışmaların hiçbiri. Teorik olarak, iPSCs herhangi bir birey veya hastadan elde edilen herhangi bir hücre tipinden oluşturulabilir. Hastaya özel iPSCs hastalık fenotipleri ve her hastanın epigenetik koşullarını taklit edebilirsiniz potansiyel bir araç olarak artıyor. Gen düzenleme veya patojenik durumu tersine çevirmek için başka yöntemler kullanılarak, hastaya özel iPSCs, kişiselleştirilmiş ilaç 5 kullanılabilir. Bunlar 6 otomatik nakli daha uygun hale verici ile aynı bağışıklık kimliğe sahip çünkü Ayrıca, iPSCs az bağışıklık reddi ile ilişkilidir. Bu nedenle, iPSCs hastalık modelleme, ilaç tarama ve rejeneratif tedaviler en umut verici bir platform haline gelmiştir. Bu faydaları, sürekli geliştirilmekte olan küçük hücre kaynağından zaman az miktarda daha saf ve daha yüksek verim verebilir geliştirilmiş protokoller göz önüne alındığında. Gelecekteki uygulama için en verimli protokol bulma biri önemli unsurlardan primer hücre tipidir. Erken iPSC üretimi proto çoğucols orijinal iPSC hatları deri fibroblastları 4 indüklenen beri yapışık hücreler için optimize edilmiştir. Bununla birlikte, bu hücrelerin izole edilmesi ve hazırlanması, emek yoğun işlemlerdir. Ayrıca, cilt fibroblast izolasyonu daha geniş bir uygulama için büyük bir eksiklik olabilir invaziv cerrahi prosedürleri içermektedir.
Bu nedenle, iPSCs ve daha fazla kullanım için, uygun edinimi ile bir hücre kaynağı gereklidir. Bu oldukça minimal invaziv prosedür 7-9 ile elde edilir çünkü kan ideal bir hücre kaynağı olarak kabul edilir. Bu çalışmada, periferal kan tek-çekirdekli hücreleri (PBMC) için hiPSCs üreten protokole basit modifikasyon geliştirdi. Bu CD34 + hücreleri gibi belirli bir hücre tipi, zor genişletme işlemi olmadan, tam kan hücreleri veya PBMC'ler seri Yamanaka faktörleri içeren Sendai virüsü ile transdüksiyon sonra santrifüjleme ile matris kaplı plakalar üzerine kaplandı. Bu yöntem için gerekli süre azalırtransduse yüzen hücreleri bağlanma ve kendi eklemek mümkün değildi yeniden programlanan hücrelerin kaybı azalmıştır.
Protokol
Etik Beyanı: Bu çalışma protokolü Kore Katolik Üniversitesi (KC12TISI0861) kurumsal inceleme kurulu tarafından onaylanmıştır.
Kandan Monositik Hücreleri 1. İzolasyon
- monositik hücrelerin izolasyonu (Gün -5)
- Bir hücre hazırlama borusu (CPT) ve kan alımı taze kan, en az 10 ml elde etmek.
- Yeni 50-ml'lik konik tüpe kan transferi ve 1 steril fosfat tamponlu salin (PBS) ile seyreltilmiş: 4 oranında.
NOT: seyreltme oranının daha yüksek daha yüksek bir saflık için kullanılabilir. - Yeni 50-ml'lik konik tüpe yoğunluk gradyanlı ortam 10 ml ilave edilir ve dikkatli bir şekilde yoğunluk gradyan medyanın üstüne seyreltilmiş kan tabaka. bir santrifüjleme fren oda sıcaklığında (RT) 30 dakika boyunca 750 x g'de santrifüjleyin.
- Dikkatle, yeni bir 50 ml konik tüp buffy tabaka transferi tüp PBS 30 ml ekleyin ve hücreleri yıkayın.
- Oda sıcaklığında 5 dakika boyunca 515 x g'de santrifüjleyin hücreleri.
- PBS atın ve kan hücre medya 0.5 ml hücreleri tekrar süspansiyon.
- Hücre sayımı ve 24 oyuklu plakanın her bir kuyucuğu için 1 x 10 6 hücre plaka. Buharlaşmayı önlemek için çevre gözlere PBS ilave edin.
- Transdüksiyon önce% 5, 37 ° C'de CO2 5 gün boyunca hücrelerle stabilize. hücreleri bozmadan gün 3-4 taze kan hücre ortamının bir ek 0.5 ml ilave edilir.
Sendai Virüs tarafından 2. İletimi
- İletimi (Gün 0)
- Toplayın ve 15 ml konik tüp kan hücreleri transferi ve hemasitometre kullanarak onları saymak.
- Transdüksiyon başına 3 x 10 5 hücre hazırlanması ve oda sıcaklığında 5 dakika boyunca 515 x g'de santrifüj hücreleri.
- Emme ile Süpernatantı atın ve kan hücre medya 0.5 ml hücreleri tekrar süspansiyon.
- olmayan bir kaplı 24 oyuklu plaka iyi hücreleri aktarın.
- buz Sendai virüsü karışımı çözülme ve su eklemekspended hücreleri. imalatçının tavsiyelerine göre hücrelere Sendai virüsü ekleyin.
- bir sızdırmaz film ile plaka kapatılır ve 30 ° C'de 30 dakika boyunca 1,150 x g'de da santrifüj.
- Santrifüj işleminden sonra,% 5 bir gece boyunca CO2 (O / N) 37 ° C'de inkübe hücreleri.
- besleyici matris hücre transferi (Gün 1)
- Sonraki gün, kaplama vitronektin ile 24 oyuklu plaka. bir son 5 ng / ml arasında bir konsantrasyonda PBS içinde vitronektin çözeltisi ile seyreltilir. 24-iyi plaka iyi vitronektin 1 ml ilave edilir ve en az 1 saat oda sıcaklığında inkübe edin. Kullanmadan önce Kaplama çözeltisini çıkarın. Kaplanmış plakalar, 3 gün boyunca oda sıcaklığında saklanabilir.
- iyi kaplanmış hücreleri ve virüs içeren tüm medya aktarın.
- Taze kan hücre ortamının bir ek 0.5 ml kalan hücreleri toplamak ve hücre ihtiva eden bir oyuğa ekleyin.
- 35 ° C'de 10 dakika boyunca 1,150 x g'de plaka santrifüjleyin.
- yüzde sonrarifugation, süpernatant kaldırmak iPSC ortam 1 ml ekleyin ve% 5 CO2 göre O / N 37 ° C 'de hücreleri korumak.
- Ikinci hücre transferi (Gün 2)
- Kat aşama 2.2.1 tarif edildiği gibi 5 ug / ml, vitronektin ile yeni bir 24-yuvalı plakanın yuvalarına. Her transdüksiyon için plakanın bir kuyu kullanın.
- yeni kaplanmış vitronektin plakaya ilk plaka hücre süspansiyonu aktarın.
Not: gerekli değilse, süspansiyon hücreleri iptal edilebilir. Aşama 2.3 açıklanan prosedüre süspansiyon hücreleri ile 2-3 kez tekrarlanabilir. adımlar tekrarlanır edilecek olursa, hücreler hasat. - Bununla birlikte,% 5 CO2 göre O / N 37 ° C 'de muhafaza edilmesi için, ilk plaka oyuğuna iPSC ortam 1 ml ekleyin ve inkübe edilir.
- 37 ° C'de eklenmiş hücreleri korumak ve% 5 CO2 ve taze iPSC ortamı ile günlük ortam değişikliği yapılması. Koloniler transdüksiyon sonra günlerde 14-21 görünecektir.
- Centrifuge 1,150 x g'de 10 dakika süre ile 35 ° C 'de süspansiyon hücreleri ihtiva eden yeni kaplanmış plaka.
- Santrifüj işleminden sonra, CO2 O / N,% 5, 37 ° C'de inkübe hücreleri.
- Ertesi gün, süpernatant kaldırmak ve taze iPSC ortam ile değiştirin.
Not: Aşama 2.3 açıklanan prosedüre süspansiyon hücreleri ile 2-3 kez tekrarlanabilir. adımlar tekrarlanır olacaksa, süpernatant hücrelerin hasat ve adım 2.3 tekrarlayın. - % 80 kaynaşma elde edilene kadar her gün ortam değişiklikleri ile bağlı hücreleri korumak.
3. yeniden programlandı hücre bakım
- 24-plaka kültürden sonra erken bakım
- Hücreler birleştiklerinde kez 7-10 gün transdüksiyon sonra, bir vitronektin kaplamalı, 60 mm yemek hazırlamak. bir son 5 ng / ml arasında bir konsantrasyonda PBS içinde vitronektin çözeltisi ile seyreltilir. çanak vitronektin 1 ml ilave edilir ve en az 1 saat oda sıcaklığında inkübe edin.
- yıkaPBS ile hücre ve hücreleri ayırmak için PBS / 1 mM EDTA 1 ml.
- 2 dakika için CO2, 37 ° C'de inkübe ve% 5.
- hücreler hasat ve 2 dakika boyunca 250 x g'de ve oda sıcaklığında santrifüj. Süpernatantı ve taze iPSC medya 3 ml hücreleri tekrar süspansiyon.
- yeni kaplanmış 60 mm çanak üzerine tüm yeniden süspanse hücreleri Plate.
- Hücreler% 80 birleşmeye kadar% 5 CO2 içinde 37 ° C sıcaklıkta tekrar hücrelere 10 mM RHO kinaz inhibitörü ekleyin ve korur.
- koloni görünümü Split (Altklonlaması Hazırlık)
- Aşama 3.1.2 de tarif edildiği gibi, bir vitronektin kaplı, 100 mm tabak için hazırlayın.
- Hücrelerin PBS ile yıkayın ve hücreleri ayırmak için PBS / 1 mM EDTA 1 ml.
- 2 dakika için CO2, 37 ° C'de inkübe ve% 5.
- hücreler hasat ve 2 dakika boyunca 250 x g'de ve oda sıcaklığında santrifüj.
- Bir hemasitometre kullanarak hücreleri saymak ve çanak başına 1 x 10 4 hücre hazırlamak.
- 250 xg'de hücreleri Santrifüj ve RT 2 dakika süreyle.
- IPSC medya 6 ml, yeniden süspanse 1 x 10 4 hücre kaplamalı 100 mm çanak üzerine onları plaka ve medyaya 10 mM RHO kinaz inhibitörü ekleyin.
- Büyük koloniler görünene kadar hafta% 5 37 ° C'de CO2 hücreleri inkübe edin.
NOT: Bakım ve alt klonlama için koloniler genişletin. Alt-klonlama genellikle 5 pasajlar altında yapılır.
- Koloni çözümü ayrılmakta iPSC koloni kullanarak toplama
- Koloni toplama, tohum aşamasında 3.2.7 de belirtildiği gibi bir vitronektin kaplı, 100 mm çanak 1 x 10 4 hücre, bir hafta önce.
- Vitronektin 2 ml solüsyon eklenmesi ve en az 1 saat boyunca oda sıcaklığında inkübe edilerek bir vitronektin kaplanmış 60 mm çanak hazırlayın.
- Bir mikroskop (40X veya 100X büyütme) aracılığıyla gözlemleyerek, bir işaretleyici kalem kullanarak kesin sınırlarla koloniler işaretleyin. Adım 3.3.2 yapılan yeni plakadan vitronektin çözüm çıkarın ve 6 ml ekleyinIPSC ortam, 10 mM RHO kinaz ile takviye edilmiştir.
- hücrelerin kültür ortamı çıkarın ve PBS 3 ml ile yıkayın.
- iPSC koloni ayırma çözeltisi 1 ml ilave edilir ve oda sıcaklığında 30 s için inkübe.
- plakadan çözüm kaldırmak ve ilave bir 30 saniye boyunca oda sıcaklığında inkübe.
- P200 pipet kullanarak, plakadan medya 200 ul çizin ve pipetle hedef koloniler ayırmak. Yeni 100 mm çanak dağınık koloniler aktarın.
- Inkübe ve% 5 CO2 içinde 37 ° C'de hücreleri korumak.
NOT: onlar 10. Karakterizasyonu en az 10 pasajlar sonra yapıldığını geçit ulaşıncaya kadar saf iPSC koloni elde ettikten sonra, hücreler muhafaza edilmiştir. Antikor seyreltikleri, ve primer bilgiler Tablo 1 ve 2'de gösterilmektedir.
Sonuçlar
Bu protokol kanından izole PBMC'ler yeniden programlamak için basit bir yöntem sunar. Seri kaplama ve santrifüj kombinasyonu kullanılarak, iPSCs başarıyla üretildi. Bu yöntemle, iPSCs izole edilmesi ya da belirli bir hücre tipi genişletmeden tam kan hücrelerinin küçük bir miktar ile oluşturulabilir. Başarıyla küçük hücre kültürü plakasının sadece 1x10 4 hücrelerinden iPSCs oluşturulur.
yeniden programlama önce, kan hücreleri yoğunluk gradyanlı ortamı kullanılarak izole edilmiştir. Kan hücreleri, 5 gün sonra, izolasyon transdüse edilmiştir. Şekil 1A, süspansiyon hücreleri için yeniden programlama yönteminin şemasını göstermektedir. İzolasyondan sonra PBMCler Sendai virüsü olmayan bir kaplanmış kuyuda Yamanaka faktörleri içeren transdüse edilmiştir. Sonraki gün, süspansiyon hücreleri, santrifüj kullanılarak bir vitronektin kaplı plaka üzerinde toplandı ve ekildi hücreler att iseolmayan kaplı kuyuya ağrıyordu atıldı. Vitronektin kaplı plaka üzerinde çıktı ekli hücreler muhafaza ve daha genişletildi. Ekli hücreler iPSC ortamını kullanarak günlük medya değişikliklerle muhafaza edildi. santrifüj ile kaplama işlemi Kalan süspansiyon hücreleri için tekrar edilmiştir.
Yeniden programlanan iPSCs iletimi sonra farklı morfoloji birkaç gün ile ayırt edilebilir. Bununla birlikte, yeniden programlama esnasında, saf bir formda yeniden programlanması hücreleri genişletmek zordu. Yeniden programlama erken aşamasında, iPSCs bağlı olmayan yeniden programlanması farklılaşmış hücreleri (Şekil 2A) ile karıştırılmıştır. Şekil 2A ok görüntü iPSC benzeri hücre türlerini göstermektedir. genişlemeden önce, iPSCs ve diğer hücreleri ayırt etmek zordur. Bu nedenle, saf bir kolonisi tek koloni toplama işlemi ile elde edilmiştir. Bir düşük yoğunluklu l koloniler tohum hücreleri tarafındanŞekil 2B'de gösterildiği gibi, çekme için yeterli ARGE, elde edilmiştir. Koloni izole sonra, hücre kümeleri, tek hücre ve kültür (Şekil 2C) ayrışmış edildi. Saf iPSC koloni (Şekil 2B) daha sonra görülmüştür. Saf iPSCs genişletilmiş sonra, hücreler kalitesi test edilmiştir. Hücreler iPSCs (Şekil 3A) farklılaşmamış durumunu teyit etmek için alkalin fosfataz ile boyandı. İzole iPSCs tüm türetilmiş koloniler pozitif boyanma gösterdi. Pluripotent belirteçler Şekil 3B'de gösterildiği immünofloresan boyama ile doğrulanmıştır. yeniden programlanan hücreler son derece gibi en önemlisi SSEA4, Oct4, Sox2, TRA-1-81, Klf4 ve, TRA-1-60 olarak pluripotent işaretlerini dile getirdi. Pluripotent markerlerinin ifadesi Şekil 3C'de gösterildiği RT-PCR ile teyit edilmiştir. Floresan veri gösterilen Oct4 ve Sox2, tespit edilmiştir. Nanog, DPPA5, TDGF1 gibi ek markörler positiv edildiEly da ifade edilmiştir.
daha fazla analiz için, karyotip analizi yapıldı. Şekil 4A'da gösterildiği gibi, oluşturulan iPSCs normal kromozomal modelini sergiledi. Gerçek pluripotensini onaylamak için hücreler ektoderm, mezoderm ve endoderm içine ayırt edildi. Oluşturulan iPSCs başarıyla Şekil 4B görülen her üç germ içine farklılaştırılmış. Sendai virüsü entegrasyon içermeyen özelliği bilindiğinden, viral DNA'nın çıkarılması Şekil 4C'de gösterilmektedir. viral DNA sahip eğiliminde üç hücre dışına biri hatta birkaç pasaj sonra, kalır. Ancak, entegre gen işlemleri alt-klonlanmasıyla çıkarılabilir oldu.
Sonuç olarak, kayan PBMC'lerden iPSCs üreten bir protokol göstermiştir. Protokol yüksek verim gösterdi ve kan sadece küçük bir miktar gerekli. Oluşturulan iPSCs yüksek pluripotensini vardı ve vi kaçınılması ral entegrasyon.
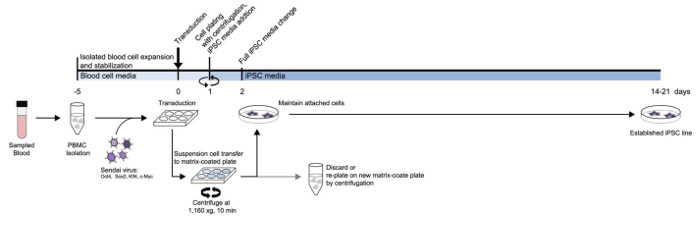
Şekil 1: PBMC'lerden iPSC üretim protokolü Şema. orta tip ve zaman çizelgesi dayalı olarak düzenlenen protokol ayrıntılı bir diyagram. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
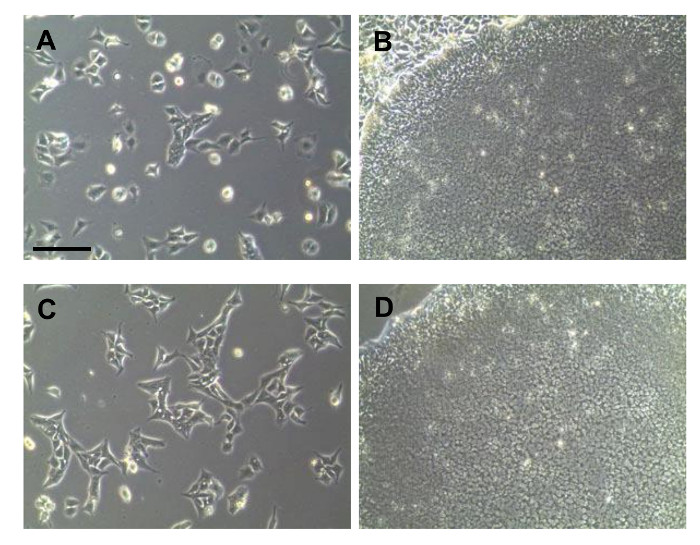
Şekil 2: PBMC'lerden üretilen iPSCs Bright alan görüntüsü. (A) tekrar programlanması hücrelerin erken morfolojisi. Çekme önce bir koloni (B) Görüntü. Koloni toplama arıtma işleminden sonra (C) Hücreler. Saf koloni (D) Morfoloji. Tüm ölçek çubukları 200 mikron göstermektedir. /ecsource.jove.com/files/ftp_upload/54650/54650fig2large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
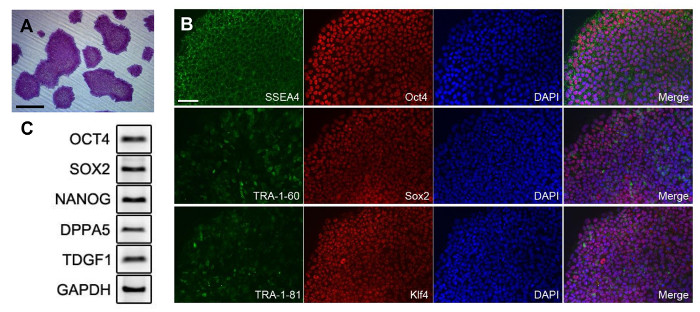
Şekil 3: iPSCs arasında pluripotensin PBMC'lerden oluşturulur. (A), koloniler alkalin fosfataz ile boyandı. Oluşturulan iPSCs (B) Floresan görüntü. Antikor seyreltme oranı Tablo 1 'de gösterilmiştir. Pluripotent işaretlerinin (C), PCR analizi. Astar bilgiler Tablo 2'de verilmektedir. Tüm ölçek çubukları 200 mikron göstermektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
/ 54650 / 54650fig4.jpg "upload />
Şekil 4: oluşturulan iPSCs daha fazla analizi. (A) IPSC normal karyogram. Üç germ tabakası farklılaşmadan sonra hücreler (B) Floresans görüntüsü. Sendai viral vektörler (C), PCR analizi. Transdüksiyona tâbi tutulmamış hücreler, negatif kontrol olarak kullanıldı ve transdüksiyon pozitif kontrol olarak kullanılmıştır sonra hücreler bir gün toplandı. Astar bilgiler Tablo 2'de verilmektedir. Tüm ölçek çubukları 200 mikron göstermektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| antikor Ad | konsantrasyon |
| SSEA4 | 1: 200 |
| Oct3 / 4 | 1: 100 |
| TRA-1-60 | 1: 200 |
| Sox2 | 1: 100 |
| TRA-1-81 | 1: 100 |
| Klf4 | 1: 250 |
| Alexa Fluor 488 keçi anti-fare IgG (H + L) antikoru | 1: 400 |
| Alexa Fluor 594 keçi anti-tavşan IgG (H + L) antikoru | 1: 400 |
Tablo 1. Antikor seyreltikleri.
| hedef Adı | yön | primer sekans | Boyut |
| Zeiss OCT3 / 4 | ileri | ACC CCT GGT GCC GTG AA | 190 |
| Ters | GGC TGA ATA CCT TCC, CAbir ATA | ||
| Sox2 | ileri | CAG CGC ATG GAC AGT TAC | 321 |
| Ters | GGA GTG GGA GGA AGA GGT | ||
| nanog | ileri | AAA GGC AAA CAA CCC ACT | 270 |
| Ters | GTT ATT CTT CGG CCA GTT | ||
| LIN28 | ileri | GTT CGG CTT CCT GTC CAT | 122 |
| Ters | CTG CCT CAC CCT CCT TCA | ||
| DPPB5 | ileri | CGG CTG CTG AAA GCC ATT TT | 215 |
| Ters | AGT TTG AGC ATC CCT CGC TC | ||
| TDGF1 | ileri | TCC TTC TAC GGA CGG AAC TG | 140 |
| Ters | AGA AAT GCC TGA GGA AAG, CA | ||
| SeV | ileri | GGA TCA CTA GGT GAT ATC GAG C | 181 |
| Ters | ACC AGA CAA GAG TTT AAG AGA TAT GTA TC | ||
| KOS | ileri | ATG CAC CGC TAC GAC GTG AGC GC | 528 |
| Ters | ACC TTG ACA ATC CTG ATG TGG | ||
| Klf4 | ileri | TTC CTG CAT GCC AGA GGA GCC C | 410 |
| Ters | AAT GTA TCG AAG GTG CTC AA |
Tablo 2. Primer bilgiler.
Tartışmalar
Embriyonik kök hücreler (ESCs) birçok takım eksiklikler göstermiştir için, alternatif bir araca gerek gerekmiştir. Bu nedenle, Yamanaka tarafından uyarılmış pluripotent kök hücrelerinin gelişimi (iPSCs) uluslararası mercek altına geldi. Yamanaka Pluripotency yetişkin somatik hücre içine sadece dört gen ekleyerek uyarılan edilebileceğini keşfetti beri neredeyse on yıl olmuştur. iPSCs olgun somatik hücrelerden "uyarılmış" olduklarından, bir zamanlar EKH ilgili endişe olmuştu etik sorunları kaçmasına olabilir. EKH aksine iPSCs her birey oluşturulabilir. Bu nedenle, kişiselleştirilmiş tıbbi araştırma ve ilaç tarama, hastalığın modelleme ya da rejeneratif ilaçlar gibi başka çalışmalar da kullanılabilir.
İlk insan iPSC başarıyla hücre tipi reprogrammed 2007 Çeşitli gruplarda dermal fibroblastlar elde edilmiş, ancak invaziv cerrahi prosedür, bu birincil hücre elde etmek için gerekli oldu. Bu nedenle, bir fikir değildiçeşitli hastalık iPSCs üreten veya rejeneratif tıp tasarımı l kaynağı. Alternatif ve kolay bir şekilde elde edilen hücre türleri, keratinositler, idrar monositler ve kan hücreleri gibi, ihtiyaç vardı. Ancak, bu hücreler genişletmek için zor, ve bazıları kontaminasyon 10 daha yüksek bir şans var.
Bu çalışmada, başarılı gibi PBMC'ler olarak bütün kan hücrelerinden iPSCs üreten bir protokol verilmektedir. Belirli bir hücre tipinin bir genişletme işlemi olmadan, bu protokol da primer kan hücrelerinin küçük bir miktar, iPSCs oluşturmak için nispeten basit bir yöntem önerir. PBMC'ler kanından izole edildi sonra, hücreler, 5 gün süreyle kan hücresi ortamı içinde stabilize edilmiştir. transdüksiyon önce istikrar adım, bu protokolde kritik oldu. yeniden programlama verimliliği kan hücresi medya hücreleri kuluçka sonra daha iyi oldu. Bu ortam CD34 + hücrelerinin genişlemesi için kullanılmıştır. Ancak, ne zaman tam kan hücreleri bana bu tutuldu5 gün boyunca dia, hücre sayısı ilk sayısı ile neredeyse aynıydı. Tam kan hücreleri kullanarak, CD34 + hücre genişletilmiş olsaydı onaylamak için zor oldu. Bununla birlikte, stabilizasyon adım kendisi başarılı yeniden programlama için önemli olduğu gibi görünüyordu.
transdüksiyon sonra, seri olarak santrifüj ile bir vitronektin kaplı plaka üzerine hücreleri kaplama. Başlangıçta, yeniden programlanan hücreler transdüksiyon sonra kuyunun dibine battı. mekanik kuvvet veya santrifüj ile hücreler artırarak, transdüksiyona uğramış hücreler eklemek ve çoğalırlar başardık. Protokol tam kan hücreleri kullanılan bu yana genişletilmiş Ancak, farklı numuneler ile teşebbüs çalışmaların yarısı morfolojileri çeşitli sonuçlandı. Bu nedenle, koloni toplama saf iPSC kolonilerin izolasyonu Bu protokol kritik oldu. izole koloniden genişletilmiş hücreler saf iPSCs tüm özelliklerini gösterdi.
diğer faydalarına rağmen, iPSCs varBirkaç engeller aşmak için. Birkaç Yamanaka faktörleri onkogenlerin bilindiğinden, iPSCs in vivo tümörler dönüşebilir endişeler vardır. Nedenle, yeniden programlanan hücreler entegrasyonu hiçbir kalan eksojen gen ifadesini sahip olması önemlidir. Bu retrovirüsler ve lentivirüsler olarak iPSCs, virüs meydana getirilmesinden sonra ilk yıl içinde, yeniden programlama için kullanılmıştır. yeniden programlama oranı başarıyla yüksek, henüz bu virüsler hücre genomuna rasgele entegrasyon gereklidir. Bu nedenle, birçok başka yöntem geliştirilmiştir. Sendai virüsü gibi virüsler entegrasyonu olmadan hücreleri nakletmek için bilinmektedir ve küçük molekülleri ve epizomal vektörleri kullanılarak başka metotlar da geliştirilmiştir. Bu çalışmada, yeniden programlama için Sendai virüsü kullanılmıştır. Entegrasyon oranı Lentivirüslerden kıyasla daha düşük olmuştur. Biz de üretilen iPSCs bazı kalan viral bileşenler olduğunu doğruladı. Üç deneme biri üzerinden bütünleşik sonuçlandıiyon sonra bile 15-20 pasajlar. Bununla birlikte, bu uyum, bir tek hücreden türetilen koloniler alt-klonlanmasıyla çıkarılabilir oldu. Bizim tecrübelerimize göre, tek bir hücreden türetilen sağlıklı bir koloni elde etmek için yoğunluk 100 mm tabak başına 1x10 4 hücre oldu. tam dairesel olarak elde koloniler alınmış ve geri kalan, viral bileşenler, PCR yeniden onay genişletilmiştir. olmayan entegre hücrelerinden türetilmiş koloniler sonraki kullanım için muhafaza edilmiştir. silindikten sonra, hücreler entegre olmayan devlet sürdürdü.
Bu çalışmada, biz kan hücresi yeniden programlama için bir protokol göstermektedir. Dalgalı hücrelerin yeniden programlanmasının oranını artırmak için, bu tür bir seri kaplama ve santrifüj gibi çeşitli adımları ilave edildi. Bu yöntem, PBMC ve kordon kan tek çekirdekli hücreleri (CBMCs) ile yapıldı. Bu protokol Güney Kore GMP tesislerinde homozigot iPSCs üretmek için kullanıldı. Grubumuz kullanarak iPSC yeniden programlama sürecinin hızlanması için sabırsızlanıyorBizim protokol.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was supported by a grant from the Basic Science Research Program through the National Research Foundation of Korea (NRF), funded by the Ministry of Science, ICT, and Future Planning (2013R1A1A1076125).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Plasticware | |||
| 100 mm Dish | TPP | 93100 | |
| 6-well Plate | TPP | 92006 | |
| 50 ml Cornical Tube | SPL | 50050 | |
| 15 ml Cornical Tube | SPL | 50015 | |
| 10 ml Disposable Pipette | Falcon | 7551 | |
| 5 ml Disposable Pipette | Falcon | 7543 | |
| 12-well Plate | TPP | 92012 | |
| 24-well Plate | TPP | 92024 | |
| PBMC Isolation Materials | |||
| DPBS | Life Technologies | 14190-144 | |
| Ficoll | GE Healthcare | 17-1440-03 | |
| StemSpan | STEMCELL Technologies | 9805 | Blood cell media |
| CC110 | STEMCELL Technologies | 8697 | Blood cell media supplement (100x) |
| iPSC Generation and Culture Materials | |||
| CytoTune-iPSC Sendai Reprogramming Kit | Life Technologies | A16518 | |
| TeSR-E8 Media | STEMCELL Technologies | 5940 | iPSC media |
| Vitronectin | Life Technologies | A14700 | |
| ROCK Inhibitor | Sigma Aldrich | Y0503 | |
| TrypLE express (TrypLE) | Life Technologies | 12604-039 | |
| ReleSR | STEMCELL Technologies | 12604-039 | Colony detaching solution |
| Quality Control Materials | |||
| 18 mm Cover Glass | Superior | HSU-0111580 | |
| 4% Paraformaldyhyde | Tech & Innovation | BPP-9004 | |
| Triton X-100 | BIOSESANG | 9002-93-1 | |
| Bovine Serum Albumin | Vector Lab | SP-5050 | |
| Anti-SSEA4 Antibody | Millipore | MAB4304 | |
| Anti-Oct4 Antibody | Santa Cruz | SC9081 | |
| Anti-TRA-1-60 Antibody | Millipore | MAB4360 | |
| Anti-Sox2 Antibody | Biolegend | 630801 | |
| Anti-TRA-1-81 Antibody | Millipore | MAB4381 | |
| Anti-Klf4 Antibody | Abcam | ab151733 | |
| Alexa Fluor 488 goat anti-mouse IgG (H+L) antibody | Molecular Probe | A11029 | |
| Alexa Fluor 594 goat anti-rabbit IgG (H+L) antibody | Molecular Probe | A11037 | |
| DAPI | Molecular Probe | D1306 | |
| Prolong gold antifade reagent | Invitrogen | P36934 | |
| Slide Glass, Coated | Hyun Il Lab-Mate | HMA-S9914 | |
| Trizol | Invitrogen | 15596-018 | |
| Chloroform | Sigma Aldrich | 366919 | |
| Isoprypylalcohol | Millipore | 109634 | |
| Ethanol | Duksan | 64-17-5 | |
| RevertAid First Strand cDNA Synthesis kit | Thermo Scientfic | K1622 | |
| i-Taq DNA Polymerase | iNtRON BIOTECH | 25021 | |
| UltraPure 10X TBE Buffer | Life Technologies | 15581-044 | |
| loading star | Dyne Bio | A750 | |
| Agarose | Sigma-Aldrich | 9012-36-6 | |
| 1kb (+) DNA ladder marker | Enzynomics | DM003 | |
| Alkaline Phosphatase | Millipore | SCR004 | |
| Tris base | Fisher Scientific | BP152-1 | Rinse Buffer |
| Sodium Chloride | Duchefa Biochemie | S0520.1000 | Rinse Buffer |
| Tween-20 | BIOSESANG | T1027 | Rinse Buffer |
| Hydrochloric Acid | Duksan | 1129 | Rinse Buffer |
Referanslar
- Serra, M., Brito, C., Correia, C., Alves, P. M. Process engineering of human pluripotent stem cells for clinical application. Trends Biotechnol. 30 (6), 350-359 (2012).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78 (12), 7634-7638 (1981).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Chun, Y. S., Byun, K., Lee, B. Induced pluripotent stem cells and personalized medicine: current progress and future perspectives. Anat Cell Biol. 44 (4), 245-255 (2011).
- Seki, T., Fukuda, K. Methods of induced pluripotent stem cells for clinical application. World J Stem Cells. 7 (1), 116-125 (2015).
- Churko, J. M., Burridge, P. W., Wu, J. C. Generation of human iPSCs from human peripheral blood mononuclear cells using non-integrative Sendai virus in chemically defined conditions. Methods Mol Biol. 1036, 81-88 (2013).
- Loh, Y. H., et al. Reprogramming of T cells from human peripheral blood. Cell Stem Cell. 7 (1), 15-19 (2010).
- Ohmine, S., et al. Induced pluripotent stem cells from GMP-grade hematopoietic progenitor cells and mononuclear myeloid cells. Stem Cell Res Ther. 2 (6), (2011).
- Mae, S., et al. Monitoring and robust induction of nephrogenic intermediate mesoderm from human pluripotent stem cells. Nat Commun. 4, 1367 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır