Method Article
Индуцированные плюрипотентные поколение стволовых клеток из клеток крови с помощью вируса Сендай и центрифугирование
В этой статье
Резюме
We propose a protocol for reprogramming peripheral blood mononuclear cells (PBMCs) into induced pluripotent stem cells (iPSCs). By plating the transduced blood cells onto matrix-coated plates with centrifugation, iPSCs are successfully induced from floating cells. This technique suggests a simple and effective reprogramming protocol for cells such as PBMCs and CBMCs.
Аннотация
Недавнее развитие человеческих индуцированных плюрипотентных стволовых клеток (hiPSCs) доказали, что зрелые соматические клетки могут вернуться к недифференцированной, плюрипотентного состояния. Теперь, перепрограммирование осуществляется с различными типами взрослых соматических клеток: кератиноциты, клетки мочи, фибробласты и т.д. Ранние эксперименты обычно с помощью дермальных фибробластов. Тем не менее, это потребовало инвазивной хирургической процедуры, чтобы получить фибробласты от пациентов. Следовательно, подвесные клетки, такие как кровь и моча клетки, считались идеальными для перепрограммирования из-за удобства получения первичных клеток. Здесь мы сообщаем эффективный протокол для генерации иПСК из мононуклеарных клеток периферической крови (МКПК). Путем покрывать трансдуцированных МНПК последовательно к новой, матрицы с покрытием пластин с помощью центрифугирования, этот протокол может легко обеспечить IPSC колонии. Этот метод также применим к пупочной мононуклеарных клеток пуповинной крови (CBMCs). Это исследование представляет собой простой и эффективный Protocol для перепрограммирования МНПК и CBMCs.
Введение
Стволовые клетки являются одним из наиболее привлекательных материалов в клинической терапии в течение последних нескольких десятилетий 1. Привлекательные свойства стволовых клеток плюрипотентности и способность к самообновлению. В 1981 году, первые эмбриональные стволовые клетки (ЭСК) были выделены из эмбриона мыши 2. Однако, когда техника была применена к эмбрионов человека, она столкнулась с рядом этических проблем.
В 2006 году , когда доктор Яманака и его команда перепрограммировали первый плюрипотентные клетки от мышей соматических клеток, поле стволовых клеток вновь обрела возможность и интерес был реанимирован 3. Предоставляя несколько определенных факторов, плюрипотентные стволовые клетки были успешно "индуцированные" из взрослых соматических клеток, и, таким образом, были названы "индуцированные плюрипотентные стволовые клетки (ИПСК)." В 2007 году этот метод был применен к клеткам человека 4, получая клетки с точными характеристиками ЭСК , но ни одна из этических дискуссий. Теоретически, плюрипотентныхCs могут быть получены из любого типа клеток, полученной из любого индивидуума или пациента. Специфическая для пациента иПСК растут как потенциальный инструмент, который может имитировать фенотипа заболевания и эпигенетических условия каждого отдельного пациента. Использование редактирования гена или другие методы , которые могут полностью изменить патогенное состояние, иПСК конкретного пациента , также может быть использован в персонифицированной медицины 5. Кроме того, иПСК менее связаны с иммунным отторжением , потому что они имеют один и тот же иммунный идентичность в качестве донора, что делает автоматической трансплантации более осуществимыми 6. Поэтому иПСК стали наиболее перспективной платформой в моделировании заболеваний, скрининга лекарственных средств и регенеративной терапии. С учетом этих преимуществ, улучшенные протоколы, которые могут дать более чистым и более высокие урожаи в наименьшее количество времени от самого маленького источника клеток постоянно находятся в стадии разработки. Одним из главных факторов найти наиболее эффективный протокол для будущего применения является тип первичной ячейкой. Большинство ранних иПСК поколения протосмещ_по_столбцам оптимизированы для адгезивных клеток , так как оригинальные IPSC линии были вызваны из фибробластов кожи 4. Тем не менее, выделение и получение этих клеток являются трудоемкими. Кроме того, выделение фибробластов кожи включает в себя инвазивных хирургических процедур, которые могут стать одним из основных недостатков для более широкого применения.
Таким образом, для дальнейшего использования ИПСК, источник клеток с удобным приобретением требуется. Кровь рассматривается как идеальный источник клеток , так как она получена через довольно минимально инвазивные процедуры 7-9. В данном исследовании мы разработали простую модификацию протокола генерации hiPSCs из мононуклеарных клеток периферической крови (МКПК). Без сложного процесса расширения определенного типа клеток, таких как клетки CD34 +, целые клетки крови или PBMC, серийно высевали на матричных пластинок, покрытых центрифугированием после трансдукции с вирусом Сендай, содержащим Яманака факторы. Этот метод уменьшило время, необходимое дляприсоединение трансдуцированных плавающих клеток и снижение потерь перепрограммировать клетки, которые не смогли прикрепить на свои собственные.
протокол
Заявление по этике: Этот протокол исследования был одобрен этическими комитетами католического университета Кореи (KC12TISI0861).
1. Выделение моноцитов из крови
- Выделение моноцитов (День -5)
- Получают по крайней мере 10 мл свежей крови из взятия крови в препарате клеток трубки (CPT).
- Перенести кровь на новый 50-мл коническую пробирку и разбавить его стерильным фосфатно-буферным солевым раствором (PBS) в соотношении 1: 4.
Примечание: более высокий коэффициент разбавления может быть использовано для более высокой чистоты. - Добавьте 10 мл градиента плотности сред на новый 50-мл коническую пробирку и осторожно слой разбавленного кровь на верхней части градиента плотности сред. Центрифуга при 750 х г в течение 30 мин при комнатной температуре (RT) без центрифугирование тормоза.
- Аккуратно перенести БАФФИ слой на новый 50-мл коническую пробирку, добавляют 30 мл PBS на пробирку, и промыть клетки.
- Центрифуга клетки при 515 мкг в течение 5 мин при комнатной температуре.
- Выбросите PBS и клетки вновь суспендируют в 0,5 мл клеток крови сред.
- Граф клеток и пластины 1 × 10 6 клеток на лунку 24-луночного планшета. Добавить PBS в окружающие лунки, чтобы предотвратить испарение.
- Стабилизируйте клетки в течение 5 дней при температуре 37 ° С в 5% CO 2 до того трансдукции. Добавить еще 0,5 мл свежей клеток крови СМИ в дни 3-4, не нарушая клетки.
2. Трансдукция вирус Сендай
- Трансдукция (день 0)
- Собрать и перенести клетки крови в 15-мл коническую трубку и сосчитать их с помощью гемоцитометра.
- Подготовьте 3 х 10 5 клеток на трансдукции и центрифугировать клетки при 515 мкг в течение 5 мин при комнатной температуре.
- Жидкость над осадком сливают отсасыванием и клетки вновь суспендируют в 0,5 мл клеток крови сред.
- Передача клеток в лунку без покрытия пластины 24-луночного.
- Оттепель вирус Сендай смесь льдом и добавить его к сутовар.Обращайте клетки. Добавить вирус Сендай в клетки, основанные на рекомендациях изготовителя.
- Уплотнение пластины с уплотнительной пленкой и центрифугировать его на 1,150 мкг в течение 30 мин при 30 ° С.
- После центрифугирования, инкубировать клетки при 37 ° С в 5% CO 2 в течение ночи (O / N).
- Передача клеток фидерными матрицы (1 день)
- На следующий день, пальто 24-луночного планшета с витронектина. Разбавляют раствор витронектиновый в PBS для конечной 5 мкг концентрации / мл. Добавить 1 мл витронектина в лунку 24-луночного планшета и инкубировать ее при комнатной температуре в течение по крайней мере 1 часа. Удалите раствор для нанесения покрытия перед использованием. Покрытые планшеты могут храниться в КТ в течение 3-х дней.
- Перенесите все носители, содержащие клетки и вирус к лунке.
- Соберите оставшиеся клетки с дополнительными 0,5 мл свежей клеток крови СМИ и добавить его в клетке, содержащей хорошо.
- Центрифуга планшет при 1,150 мкг в течение 10 мин при 35 ° С.
- После того, как процентаrifugation, удалить супернатант, добавить 1 мл иПСК сред, а также поддерживать клетки при 37 ° С в 5% СО 2 O / N.
- Второй перенос клеток (2-й день)
- Покрывают лунки нового 24-луночного планшета с 5 мкг / мл витронектина, как описано в пункте 2.2.1. Используйте одну лунку планшета для каждого трансдукции.
- Передачи клеточной суспензии от первой пластины на вновь покрытой витронектина пластины.
Примечание: Если не требуется, в суспензионной могут быть отброшены. Процедура, упомянутая в пункте 2.3 можно повторить 2-3 раза с суспензией клеток. Если будет повторяться шаги, сбора клеток. - В то же время, добавляют 1 мл иПСК сред в скважину первой пластины, для технического обслуживания, и инкубировать при 37 ° С в 5% СО 2 O / N.
- Поддерживать прикрепленные клетки при 37 ° С и 5% СО 2 и выполнить ежедневное изменение СМИ со свежими иПСК средств массовой информации. Колонии появится в дни 14-21 после трансдукции.
- Centrifugе вновь покрытием пластины, содержащий суспензию клеток при 1150 х г и 35 ° С в течение 10 мин.
- После центрифугирования, инкубировать клетки при 37 ° С в 5% СО 2 O / N.
- На следующий день, удалить супернатант и заменить его свежей средой IPSC.
Примечание: Процедура, упомянутая в пункте 2.3 можно повторить 2-3 раза с суспензией клеток. Если будет повторяться шаги, сбора клеток в супернатант и повторите шаг 2.3. - Поддерживать прикрепленные клетки с изменениями ежедневных СМИ до 80% конфлуэнтности пока не будет достигнута.
3. перепрограммировать сотовый техническое обслуживание
- Раннее обслуживание после культивирования пластины 24-луночного
- Через 7-10 дней после трансдукции, как только клетки сливающийся, готовят витронектиновый покрытием, 60-мм блюдо. Развести витронектиновый раствор в PBS для конечной 5 мкг концентрации / мл. Добавить 1 мл витронектина на блюдо и инкубировать ее при комнатной температуре в течение по крайней мере 1 часа.
- мытьклетки с PBS и добавляют 1 мл PBS / 1 мМ ЭДТА, чтобы отделить клетки.
- Выдержите их при температуре 37 ° С и 5% СО 2 в течение 2 мин.
- Сбора клеток и их центрифуге при 250 мкг и КТ в течение 2 мин. Удалить супернатант и клетки вновь суспендируют в 3 мл свежей среды, IPSC.
- Пластинчатые все ресуспендировали клетки на вновь покрытую 60-мм блюдо.
- Добавляют 10 мМ ингибитор киназы RHO к клеткам и поддерживать их при температуре 37 ° С в 5% CO 2 до тех пор , пока клетки не являются 80% сплошности.
- Сплит для внешнего вида колонии (Субклонирование Подготовка)
- Приготовьте витронектином с покрытием, 100-мм чашку, как описано в пункте 3.1.2.
- Вымойте клеток с PBS и добавьте 1 мл PBS / 1 мМ ЭДТА, чтобы отделить клетки.
- Выдержите их при температуре 37 ° С и 5% СО 2 в течение 2 мин.
- Сбора клеток и их центрифуге при 250 мкг и КТ в течение 2 мин.
- Граф клеток с использованием гемоцитометра и подготовить 1 х 10 4 клеток на чашку.
- Центрифуга клетки при 250 мкг и комнатной температуре в течение 2 мин.
- Ресуспендируют 1 х 10 4 клеток в 6 мл иПСК сред, пластины их на покрытую 100-мм чашку и добавляют 10 мМ ингибитор киназы RHO в средствах массовой информации.
- Инкубируйте клетки при 37 ° С в 5% CO 2 в течение недели до появления крупных колоний.
Примечание: Поддерживать и расширять колонии для субклонирования. Субклонирование обычно делается в возрасте до 5 проходов.
- Колонии сбор с использованием IPSC колонии отсоединение решение
- За неделю до сбора колонии, семена 1 х 10 4 клеток в витронектина покрытием, 100-мм блюдо, как указано в пункте 3.2.7.
- Приготовьте витронектином с покрытием, 60-мм чашку, добавив 2 мл витронектина раствора и инкубирования при комнатной температуре в течение по крайней мере 1 часа.
- Наблюдая под микроскопом (40х или 100х), отметьте колонии с четкими границами, используя маркером. Удалить решение витронектиновый из новой пластинки, изготовленной на этапе 3.3.2 и добавьте 6 млIPSC из средств массовой информации с добавлением 10 мМ RHO-киназы.
- Удалите культуральную среду из клеток и промыть их 3 мл ФБС.
- Добавляют 1 мл IPSC колонии отсоединении раствора и инкубировать их в течение 30 секунд при комнатной температуре.
- Удалить раствор из пластины и инкубировать ее при комнатной температуре в течение еще 30 сек.
- Использование P200 пипетки, возьмите 200 мкл среды из пластины и снять целевые колонии пипеткой. Перенесите разбросанные колонии на новый 100-мм блюдо.
- Инкубируют и поддержания клеток при 37 ° С в 5% CO 2.
ПРИМЕЧАНИЕ: После получения чистого IPSC колонии, клетки поддерживали, пока они не достигли прохода 10. Характеристика было сделано после того, как по меньшей мере 10 проходов. Разведений антител и праймер информация приведены в таблицах 1 и 2.
Результаты
Этот протокол представляет собой простой способ перепрограммировать МНПК, выделенные из крови. Используя сочетание последовательного обшивкой и центрифугирования, иПСК были успешно создана. С помощью этого метода, иПСК может быть сгенерирован с небольшим количеством цельной крови клеток без выделения или расширения определенного типа клеток. Мы успешно создали иПСК только из 1x10 4 клеток в маленькой клеточной культуры пластины.
Перед перепрограммированием, клетки крови выделяли с использованием градиента плотности носителей. Клетки крови были трансдуцированных через 5 дней после изоляции. Фигура 1А иллюстрирует схему метода перепрограммирования для суспензии клеток. После выделения РВМС трансдуцированная с вирусом Сендай, содержащий Яманака факторы в непокрытые хорошо. На следующий день суспензию клетки собирали и наносили на пластину витронектина покрытием с использованием центрифугирование, то время как клетки АТТжаждал не- лунке были отброшены. Прикрепленные клетки, которые появились на пластинке витронектина покрытием были сохранены и расширены дальше. Прикрепленные клетки поддерживали с изменениями ежедневных средств массовой информации с использованием средств массовой информации IPSC. Процесс обшивки с центрифугирования повторили для остальных клеток суспензии.
Перепрограммирован иПСК можно отличить по их морфологии различных несколько дней после того, как трансдукции. Тем не менее, во время перепрограммирования, было трудно расширить перепрограммировать клетки в чистом виде. На ранней стадии перепрограммирования, то иПСК были смешаны с прикрепленными не-перепрограммировать дифференцированные клетки (фиг.2А). Стрелка на рисунке 2А показаны Ipsc подобные типы клеток в изображении. Перед тем как расширения, иПСК и другие клетки было трудно различить. Таким образом, чистая колонии была получена только процесса загрузки колонии. Посевом клеток в среде с низкой плотностью, отбирали колонии, лдостаточно для получения АРГЕ были получены, как показано на фигуре 2В. После выделения колонии, клеточные скопления диссоциируют на отдельные клетки и культивировали (фиг.2С). Чистые колонии IPSC были замечены впоследствии (рис 2D). После того, как были расширены чистые иПСК, тестировали качество клеток. Клетки окрашивали щелочной фосфатазы для подтверждения недифференцированного состояния ИПСК (фиг.3А). Колонии, полученные из изолированных ИПСК всех показали положительное окрашивание. Плюрипотентные маркеры были подтверждены иммунофлуоресценции окрашивания, как показано на фигуре 3В. Перепрограммированных клетки высоко экспрессируется плюрипотентных маркеры, такие как SSEA4, Oct4, Sox2, TRA-1-81, Klf4 и, самое главное, TRA-1-60. Выражение плюрипотентных маркеров была подтверждена с помощью ОТ-ПЦР, как показано на фиг.3С. OCT4 и SOX2 были обнаружены, как это показано в данных флуоресценции. Дополнительные маркеры, такие как NANOG, DPPA5, TDGF1 были ПозитивEly выразил также.
Для дальнейшего анализа, анализ кариотипа был сделан. Как показано на фиг.4А, сгенерированные иПСК показал нормальную структуру хромосомного. Для того, чтобы подтвердить истинную плюрипотентности, клетки дифференцировались в эктодермы, мезодермы и энтодермы,. Сформированные иПСК успешно дифференцироваться во все три зародышевых листков, показано на рисунке 4B. Так как вирус Сендай известен своей собственности интеграции , свободной, удаление вирусной ДНК показана на фигуре 4C. Один из трех клеток, как правило, имеют вирусную ДНК остаются, даже после нескольких пассажей. Тем не менее, интегрированный ген был съемным субклонированием процессы.
В заключение, мы показали протокол генерации иПСК из плавающих МНПК. Протокол показал высокую эффективность и требуется только небольшое количество крови. Сформированные иПСК имели высокую плюрипотентности и избегать VI Интеграция цвета RAL.
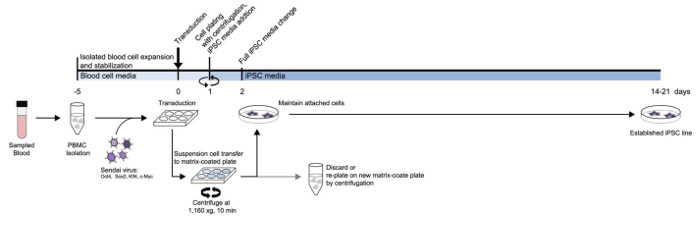
Рисунок 1: Схема протокола генерации иПСК из МНПК. Подробная схема разработанного протокола на основании среднего типа и временной шкале. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
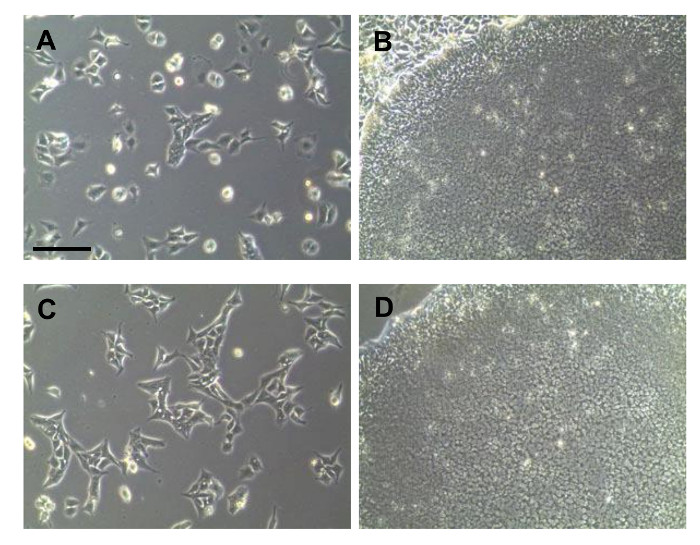
Рисунок 2: светлого поля изображение ИПСК , полученных от МНПК. (A) Ранняя морфология перепрограммированных клеток. (B) Изображение колонии , прежде чем выбрать. (С) Клетки после процесса очистки захватывающего колонии. (D) Морфология чистой колонии. Все масштабные полоски указывают на 200 мкм. /ecsource.jove.com/files/ftp_upload/54650/54650fig2large.jpg "целевых =" _blank "> Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
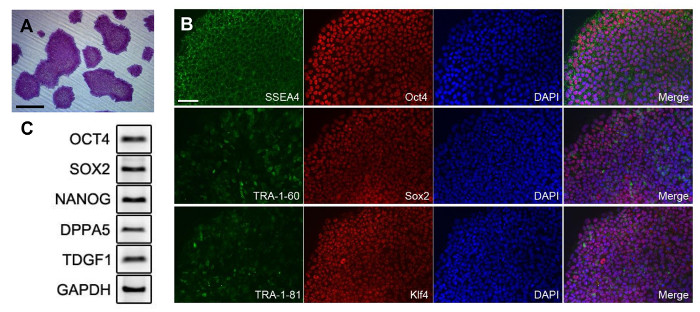
Рисунок 3: плюрипотентности ИПСК генерируется из МКПК. (A) Колонии окрашивали щелочной фосфатазы. (B) Флуоресценция образ генерируемых ИПСК. Коэффициент разбавления антител показаны в Таблице 1. (С) ПЦР - анализ плюрипотентных маркеров. Грунтовка информация представлена в таблице 2. Все масштабные полоски указывают на 200 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
загрузить / 54650 / 54650fig4.jpg "/>
Рисунок 4: Дальнейший анализ генерируемых ИПСК. (A) Нормальная кариограмма из IPSC. (Б) Флуоресцентный образ клеток после дифференцировки трех зародышевых слоя. (C) ПЦР анализ Сендай вирусных векторов. Номера трансдуцированных клетки использовали в качестве отрицательного контроля, и клетки собирали через день после трансдукции были использованы в качестве положительного контроля. Грунтовка информация представлена в таблице 2. Все масштабные полоски указывают на 200 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| Антитело Имя | концентрация |
| SSEA4 | 1: 200 |
| Oct3 / 4 | 1: 100 |
| TRA-1-60 | 1: 200 |
| Sox2 | 1: 100 |
| TRA-1-81 | 1: 100 |
| Klf4 | 1: 250 |
| Alexa Fluor 488 козьего антитела против мышиных IgG (H + L) антитела | 1: 400 |
| Alexa Fluor 594 козьего антитела против кроличьего IgG (H + L) антитела | 1: 400 |
Таблица 1. Разведения антител.
| Имя цели | направление | Праймер Последовательность | Размер |
| Oct3 / 4 | Вперед | ACC CCT GGT GTG НКУ А.А. | 190 |
| Задний ход | GGC TGA ATA ССТ ТСС CAATA | ||
| SOX2 | Вперед | CAG CGC ATG GAC AGT TAC | 321 |
| Задний ход | GGA GTG GGA GGA AGA GGT | ||
| NANOG | Вперед | AAA AAA GGC CAA CCC ACT | 270 |
| Задний ход | GCT ATT СТТ CGG CCA GTT | ||
| Lin28 | Вперед | GTT CGG СТТ ССТ GTC CAT | 122 |
| Задний ход | CTG ССТ CAC CCT CCT TCA | ||
| DPPB5 | Вперед | CGG CTG CTG AAA НКУ ATT TT | 215 |
| Задний ход | AGT TTG AGC ATC CCT CGC TC | ||
| TDGF1 | Вперед | TCC TTC TAC GGA CGG AAC TG | 140 |
| Задний ход | AGA AAT GCC TGA GGA AAG CA | ||
| SeV | Вперед | GGA ТСА CTA GGT GAT ATC GAG C | 181 |
| Задний ход | ACC AGA CAA GAG ТТТ AAG AGA TAT GTA TC | ||
| KOS | Вперед | ATG CGC CAC TAC GAC GTG AGC GC | 528 |
| Задний ход | ACC TTG АСА ATC CTG ATG TGG | ||
| Klf4 | Вперед | TTC CTG CAT GCC AGA GGA GCC C | 410 |
| Задний ход | AAT GTA TCG AAG GTG CTC А.А. |
Таблица 2. Праймер информация.
Обсуждение
Так как эмбриональные стволовые клетки (ЭСК) показал несколько недостатков, требовалось необходимость альтернативного инструмента. Таким образом, развитие индуцированных плюрипотентных стволовых клеток (иПСК) путем Яманака попал под международный центр внимания. Прошло почти десять лет с тех пор Яманака обнаружили, что плюрипотентности может быть вызвано добавлением только четырех генов во взрослые соматические клетки. Поскольку иПСК являются "индуцированные" из зрелых соматических клеток, они могут уйти от этических проблем, которые были когда-то озабоченность в связи с ЭСК. В отличие от ЭСК, иПСК могут быть получены от каждого индивидуума. Таким образом, они могут быть использованы в персонифицированной медицинских исследований и других исследований, таких как скрининг наркотиков, моделирование заболевания или регенеративных лекарств.
Первый человек IPSC был создан из фибробластов кожи в 2007 году различные группы успешно перепрограммировать этот тип клеток, но требовалась инвазивная хирургическая процедура, чтобы получить эту первичную ячейку. Таким образом, это была не идеял источником для генерации различных ИПСК заболеваний или проектирование регенеративной медицины. Необходимы Альтернативным и легко достижимым типы клеток, такие как кератиноциты, моноциты мочи, а также клетки крови. Тем не менее, эти клетки трудно расширить, а некоторые из них имеют более высокую вероятность загрязнения 10.
В данном исследовании мы представили протокол, который может успешно генерировать ИПСК из цельной крови клеток, таких как РВМС. Без какого-либо процесса расширения определенного типа клеток, этот протокол предлагает сравнительно простой способ для создания ИПСК, даже от небольшого количества первичных клеток крови. После того, как РВМС выделяли из крови, клетки, стабилизированные в клетки крови средах в течение 5 дней. Шаг стабилизации, прежде чем трансдукции имеет решающее значение в этом протоколе. Эффективность перепрограммирование было лучше после инкубации клеток в клетки крови средах. Эта среда используется для расширения CD34 + клеток. Тем не менее, когда цельной крови клетки поддерживали в этом мнеDia в течение 5 дней число клеток была почти идентична с первого подсчета. Используя целые клетки крови, это было трудно подтвердить, если CD34 + клетки были расширены. Тем не менее, сам шаг стабилизации, казалось важным для успешного перепрограммирования.
После того, как трансдукции, мы последовательно высевают в клеток на витронектина покрытием пластины центрифугированием. Первоначально перепрограммировать клетки оседают на дно скважины после трансдукции. Увеличивая клетки с механической силой или центрифугирования трансдуцированных клетки были способны прикрепиться и размножаться. Тем не менее, так как протокол, используемый целые клетки крови, половина попыток испытаний с различными образцами привели к различным типам морфологией при расширении. Таким образом, выделение чистых колоний IPSC, подбирая колонии имеет решающее значение в этом протоколе. Клетки расширенные от изолированной колонии показали все характеристики чистого ИПСК.
Несмотря на другие выгоды, иПСК естьнесколько препятствий, чтобы преодолеть. Так как несколько факторов Яманака известны онкогенов, есть опасения , что иПСК могут развиться в опухоли в естественных условиях. Поэтому, важно, чтобы перепрограммировать клетки не имеют никакого остаточного экзогенной экспрессии генов интеграции. В первые годы после создания ИПСК, вирусов, таких как ретровирусы и лентивирусов, были использованы для перепрограммирования. Скорость перепрограммирование был успешно высокой, но эти вирусы необходимы случайные интеграции в геном клетки. По этой причине были разработаны несколько других методов. Вирусы, как вирус Сендай, как известно, трансдукции клеток без интеграции, а также другие методы, использующие малые молекулы, и эписомные векторы были разработаны, а также. В данном исследовании мы использовали вирус Сендай для перепрограммирования. Уровень интеграции была относительно низкой по сравнению с лентивирусов. Мы также подтвердили, что были некоторые оставшиеся вирусные компоненты в генерируемых ИПСК. Один из трех испытаний привели к интегиона, даже после 15-20 пассажей. Тем не менее, эта интеграция была съемная субклонированием колонии, полученные из одной единственной клетки. По нашему опыту, плотность , чтобы получить здоровую колонию , полученную из одной клетки был 1x10 4 клеток на 100-мм блюдо. Колонии, которые привели в идеальной круглой формы были выбраны и расширены для ПЦР повторного подтверждения остальных вирусных компонентов. Колонии, полученные из неинтегрированных клетки были сохранены для дальнейшего использования. После удаления клетки сохранили Неинтегрированные состояние.
В данном исследовании мы предлагаем протокол для перепрограммирования клеток крови. Мы добавили несколько этапов, таких как последовательные обшивкой и центрифугирования, чтобы увеличить скорость перепрограммирования плавающих клеток. Этот метод был сделан с МНПК и мононуклеарных клеток пуповинной крови (CBMCs). Этот протокол был использован для создания гомозиготных ИПСК в GMP объектов в Южной Корее. Наша группа с нетерпением ожидает ускорения процесса перепрограммирования иПСК с использованиемнаш протокол.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by a grant from the Basic Science Research Program through the National Research Foundation of Korea (NRF), funded by the Ministry of Science, ICT, and Future Planning (2013R1A1A1076125).
Материалы
| Name | Company | Catalog Number | Comments |
| Plasticware | |||
| 100 mm Dish | TPP | 93100 | |
| 6-well Plate | TPP | 92006 | |
| 50 ml Cornical Tube | SPL | 50050 | |
| 15 ml Cornical Tube | SPL | 50015 | |
| 10 ml Disposable Pipette | Falcon | 7551 | |
| 5 ml Disposable Pipette | Falcon | 7543 | |
| 12-well Plate | TPP | 92012 | |
| 24-well Plate | TPP | 92024 | |
| PBMC Isolation Materials | |||
| DPBS | Life Technologies | 14190-144 | |
| Ficoll | GE Healthcare | 17-1440-03 | |
| StemSpan | STEMCELL Technologies | 9805 | Blood cell media |
| CC110 | STEMCELL Technologies | 8697 | Blood cell media supplement (100x) |
| iPSC Generation and Culture Materials | |||
| CytoTune-iPSC Sendai Reprogramming Kit | Life Technologies | A16518 | |
| TeSR-E8 Media | STEMCELL Technologies | 5940 | iPSC media |
| Vitronectin | Life Technologies | A14700 | |
| ROCK Inhibitor | Sigma Aldrich | Y0503 | |
| TrypLE express (TrypLE) | Life Technologies | 12604-039 | |
| ReleSR | STEMCELL Technologies | 12604-039 | Colony detaching solution |
| Quality Control Materials | |||
| 18 mm Cover Glass | Superior | HSU-0111580 | |
| 4% Paraformaldyhyde | Tech & Innovation | BPP-9004 | |
| Triton X-100 | BIOSESANG | 9002-93-1 | |
| Bovine Serum Albumin | Vector Lab | SP-5050 | |
| Anti-SSEA4 Antibody | Millipore | MAB4304 | |
| Anti-Oct4 Antibody | Santa Cruz | SC9081 | |
| Anti-TRA-1-60 Antibody | Millipore | MAB4360 | |
| Anti-Sox2 Antibody | Biolegend | 630801 | |
| Anti-TRA-1-81 Antibody | Millipore | MAB4381 | |
| Anti-Klf4 Antibody | Abcam | ab151733 | |
| Alexa Fluor 488 goat anti-mouse IgG (H+L) antibody | Molecular Probe | A11029 | |
| Alexa Fluor 594 goat anti-rabbit IgG (H+L) antibody | Molecular Probe | A11037 | |
| DAPI | Molecular Probe | D1306 | |
| Prolong gold antifade reagent | Invitrogen | P36934 | |
| Slide Glass, Coated | Hyun Il Lab-Mate | HMA-S9914 | |
| Trizol | Invitrogen | 15596-018 | |
| Chloroform | Sigma Aldrich | 366919 | |
| Isoprypylalcohol | Millipore | 109634 | |
| Ethanol | Duksan | 64-17-5 | |
| RevertAid First Strand cDNA Synthesis kit | Thermo Scientfic | K1622 | |
| i-Taq DNA Polymerase | iNtRON BIOTECH | 25021 | |
| UltraPure 10X TBE Buffer | Life Technologies | 15581-044 | |
| loading star | Dyne Bio | A750 | |
| Agarose | Sigma-Aldrich | 9012-36-6 | |
| 1kb (+) DNA ladder marker | Enzynomics | DM003 | |
| Alkaline Phosphatase | Millipore | SCR004 | |
| Tris base | Fisher Scientific | BP152-1 | Rinse Buffer |
| Sodium Chloride | Duchefa Biochemie | S0520.1000 | Rinse Buffer |
| Tween-20 | BIOSESANG | T1027 | Rinse Buffer |
| Hydrochloric Acid | Duksan | 1129 | Rinse Buffer |
Ссылки
- Serra, M., Brito, C., Correia, C., Alves, P. M. Process engineering of human pluripotent stem cells for clinical application. Trends Biotechnol. 30 (6), 350-359 (2012).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78 (12), 7634-7638 (1981).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Chun, Y. S., Byun, K., Lee, B. Induced pluripotent stem cells and personalized medicine: current progress and future perspectives. Anat Cell Biol. 44 (4), 245-255 (2011).
- Seki, T., Fukuda, K. Methods of induced pluripotent stem cells for clinical application. World J Stem Cells. 7 (1), 116-125 (2015).
- Churko, J. M., Burridge, P. W., Wu, J. C. Generation of human iPSCs from human peripheral blood mononuclear cells using non-integrative Sendai virus in chemically defined conditions. Methods Mol Biol. 1036, 81-88 (2013).
- Loh, Y. H., et al. Reprogramming of T cells from human peripheral blood. Cell Stem Cell. 7 (1), 15-19 (2010).
- Ohmine, S., et al. Induced pluripotent stem cells from GMP-grade hematopoietic progenitor cells and mononuclear myeloid cells. Stem Cell Res Ther. 2 (6), (2011).
- Mae, S., et al. Monitoring and robust induction of nephrogenic intermediate mesoderm from human pluripotent stem cells. Nat Commun. 4, 1367(2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены