Method Article
从血细胞使用仙台病毒和离心诱导多能干细胞代
摘要
We propose a protocol for reprogramming peripheral blood mononuclear cells (PBMCs) into induced pluripotent stem cells (iPSCs). By plating the transduced blood cells onto matrix-coated plates with centrifugation, iPSCs are successfully induced from floating cells. This technique suggests a simple and effective reprogramming protocol for cells such as PBMCs and CBMCs.
摘要
最近的人类诱导多能干细胞(iPS细胞)的发展证明,成熟的体细胞可以返回到未分化,多能状态。角质形成细胞,尿细胞,成纤维等早期实验一般用真皮成纤维细胞进行:现在,重新编程各种类型成年体细胞进行。然而,这需要侵入性手术,以获得从病人的成纤维细胞。因此,悬浮细胞,例如血液和尿液细胞,分别因为得到原代细胞的方便的认为是理想的重新编程。这里,我们报告从外周血单核细胞(PBMC)对的iPSC产生一个有效的协议。通过串联电镀转导的PBMC到一个新的,包衣基质使用板离心,该协议可以很容易地提供的iPSC集落。这种方法也适用于脐带血单核细胞(CBMCs)。这项研究提出了一个简单而有效的PROTocol的外周血单个核细胞和CBMCs的重新编程。
引言
干细胞一直是最有吸引力的材料在临床治疗在过去几十年1中的一个。干细胞的吸引人的特性是多能性和能力的自我更新。在1981年,第一个胚胎干细胞(ESCs)从小鼠胚胎2隔离。然而,当该技术被应用到人的胚胎,它面临几个伦理问题。
在2006年,当山博士和他的团队重新编程小鼠体细胞第一多能细胞,干细胞领域恢复了可能性和兴趣再次被点燃3。通过提供几个限定的因素,多能干细胞成功地从成年体细胞"诱导",并由此命名为"诱导多能干细胞(iPS细胞)。"在2007年,该技术被应用到人类细胞4,得到具有胚胎干细胞的确切特征的细胞,但没有伦理争论。从理论上讲,IPS铯可以从任何个体或患者获得的任何细胞类型中产生。患者特异性iPSCs的上升作为能够模拟疾病表型和每个个体患者的后生条件的潜在工具。使用基因的编辑或可逆转的致病条件的其它方法,患者专用的iPSC也可在个性化用药5中使用。此外,iPS细胞较少与免疫排斥反应相关的,因为他们有相同的免疫标识作为供体,使得自动移植更为可行6。因此,iPSCs的已成为疾病建模,药物筛选,并再生疗法的最有希望的平台。考虑到这些好处,改善了协议,可以从最小的细胞来源给予纯净和较高的收益率在最短的时间内量都在不断发展之中。发现为将来应用的最有效的协议中的一个重要的考虑是主要的细胞类型。大多数早期的iPSC产生的原COLS是为贴壁细胞,因为原来的iPSC系从皮肤成纤维细胞诱导4优化。然而,这些细胞的分离和制备是劳动密集型的。此外,皮肤成纤维细胞的隔离包括微创手术过程,可以成为更广泛应用的一大缺憾。
因此,对于进一步使用的iPSC的,则需要用采集方便的细胞来源。由于它是通过一个相当微创手术7-9获得的血液被视为理想的细胞来源。在这项研究中,我们开发了一个简单的修改协议产生外周血单个核细胞(PBMC)iPS细胞。没有特定的细胞类型,例如CD34 +细胞的困难扩张过程中,全血细胞或外周血单个核细胞中连续通过离心用含有山因子的仙台病毒转导之后镀上涂覆基质的平板。这种方法减少了所需的时间转导的漂浮细胞的附着和重编程的细胞是不能够自己附加的损失减少。
研究方案
伦理学声明:本研究方案被批准由韩国天主教大学(KC12TISI0861)的机构审查委员会。
1.血单核细胞的分离
- 单核细胞的分离(-5天)
- 从在细胞制备管(CPT)抽血获得至少10毫升新鲜血液。
- 血液转移到一个新的50毫升锥形管中,用在一个1的无菌磷酸盐缓冲盐水(PBS)稀释:4的比例。
注:稀释液的比例越高,可用于较高的纯度。 - 10毫升密度梯度介质添加到一个新的50毫升锥形管,仔细层稀释血液的密度梯度介质的顶部。离心在750 xg离心在室温(RT)下30分钟不离心制动。
- 小心地将血沉棕黄层转移到新的50毫升锥形管中,加入30毫升的PBS至管中,并洗涤细胞。
- 离心将细胞在515×g离心5分钟,在RT
- 丢弃PBS中重悬细胞在0.5ml血细胞介质。
- 计数细胞,和板,每孔1×10 6个细胞在24孔板的。添加PBS到周围井以防止蒸发。
- 转导之前,稳定5天将细胞于37℃在5%CO 2。天3-4添加而增加的0.5毫升的新鲜血液细胞培养基而不干扰细胞。
2.转导仙台病毒
- 转导(第0天)
- 收集和血细胞转移到15毫升锥形管中,并使用血球计数。
- 准备每转3×10 5细胞并离心将细胞在515×g离心在RT 5分钟。
- 丢弃通过抽吸上清,重悬细胞在0.5ml血细胞介质。
- 转移细胞到一个非涂布24孔板的孔中。
- 解冻仙台病毒混合物在冰中,并把它添加到苏spended细胞。仙台病毒添加到根据制造商的建议的细胞。
- 用密封薄膜密封板,并在30℃下在1150 xg离心离心它为30分钟。
- 离心后,孵育细胞在37℃下在5%CO 2过夜(O / N)。
- 细胞转移到饲养基质(第1天)
- 第二天,外套一个24孔板与玻。稀释为最终的5微克/毫升的浓度在PBS中的玻连蛋白溶液。 1毫升玻连蛋白添加至24孔平板的孔中,并在室温下孵育,然后至少1小时。使用前取下涂料解决方案。涂覆的板可以存储在室温3天。
- 传送含有细胞和病毒的包被的孔中的所有媒体。
- 收集剩余的细胞用增加的0.5毫升的新鲜血液细胞培养基,并把它添加到井的含细胞。
- 离心板在1150 xg离心35℃10分钟。
- %之后rifugation,去除上清,加入1ml的iPSC媒体,并在5%CO 2 O / N保持在37℃。
- 第二小区传送(第2天)
- 涂层用5微克/毫升玻连新的24孔板的孔中,如在步骤2.2.1说明。使用该板的一个孔中的每个转导。
- 从第一板细胞悬液转移到新涂玻连板。
注意:如果不需要,悬浮细胞可以被丢弃。在步骤2.3中提到的过程可以与悬浮细胞被重复2-3次。如果该步骤将重复,收获细胞。 - 同时,在5%的CO 2 O / N在37℃下加入1 ml的iPSC介质到第一板的孔,进行维护,孵育它。
- 保持附着的细胞在37℃和5%的CO 2,并执行用新鲜的iPSC媒体每日更换培养基。菌落转导后14-21出现在天。
- CentrifugÈ含有在1150 xg离心和35℃下10分钟的悬浮细胞的新包被的平板。
- 离心后,孵育细胞在37℃下在5%CO 2 O / N。
- 次日,去除上清,并用新鲜的iPSC媒体更换。
注:在步骤2.3中提到的步骤可以与悬浮细胞被重复2-3次。如果该步骤将重复,收获上清液中的细胞,并重复步骤2.3。 - 保持附着细胞日报传媒的变化,直到达到80%汇合。
3.重编程的细胞维护
- 24孔板培养后早期维护
- 转导后7-10天,一旦细胞汇合,制备玻连蛋白涂覆的60毫米培养皿中。稀释PBS玻解决方案作最后的5微克/毫升的浓度。 1毫升玻连蛋白添加到培养皿,并在室温下孵育,然后至少1小时。
- 洗细胞用PBS并加入1ml的PBS / 1mM EDTA中的分离的细胞。
- 孵育它们在37℃和5%CO 2的2分钟。
- 收获细胞并在250 xg离心和RT 2分钟离心它们。去除上清,悬浮细胞在3毫升新鲜的iPSC媒体。
- 板上的所有悬浮细胞到新涂60毫米的菜。
- 在37℃下添加10毫Rho激酶抑制剂的细胞,并维持它们在5%CO 2,直到所述细胞是80%汇合。
- 拆分菌落外观(亚克隆准备)
- 制备玻连蛋白包被的,100毫米的菜,如在步骤3.1.2说明。
- 清洗细胞,用PBS,并添加1毫升的PBS / 1mM EDTA中的分离的细胞。
- 孵育它们在37℃和5%CO 2的2分钟。
- 收获细胞并在250 xg离心和RT 2分钟离心它们。
- 算使用血球细胞和每培养皿制备1×10 4个细胞。
- 离心细胞,在250 xg离心和RT 2分钟。
- 悬浮1×10 4个细胞在6ml的iPSC介质,盘它们涂布后100毫米培养皿,并添加10mM的Rho激酶抑制剂的介质。
- 孵育细胞在37℃,5%CO 2的一个星期,直到大菌落出现。
注意:保持和扩大殖民地的亚克隆。亚克隆通常是在5代做英寸
- 殖民地采摘使用的iPSC菌落分离解决方案
- 菌落采摘,种子1×10 4个细胞在玻连蛋白包被的,100毫米的菜,如在步骤3.2.7中提到前一个星期。
- 加入2毫升玻连蛋白溶液,并在室温温育至少1小时制备玻璃体结合蛋白涂布的,60毫米培养皿中。
- 通过显微镜(40X或100X放大倍数)观察,标志用记号笔界限清楚的殖民地。从步骤3.3.2取得新盘取出玻的解决方案,并添加6毫升IPSC的介质补充有10毫Rho激酶。
- 从细胞中除去培养基,并用3毫升的PBS洗涤。
- 加入1毫升的iPSC菌落分离解决方案,并培育他们在室温为30秒。
- 除去从板的溶液中并在室温下孵育它为另外的30秒。
- 使用P200移液器,从板块吸取200微升媒体和吹打分离针对性的殖民地。转移殖民地散落到新的100毫米的菜。
- 孵化和在5%CO 2维持在37℃。
注:获得纯的iPSC集落后,将细胞维持,直到它们到达通道10表征为至少10次传代之后进行。抗体的稀释液和引物信息示于表1和2。
结果
该协议提供了一个简单的方法来重新编程从血液中分离外周血单个核细胞。利用串行电镀和离心的组合,成功地产生的iPSC。用这种方法,可以与全血细胞的少量生成的iPSC无需分离或扩大特定的细胞类型。我们在一个小细胞培养板成功生成iPS细胞仅1×10 4个细胞。
重新编程之前,血细胞用密度梯度介质隔离。血细胞分离后第5天转导。 图1A示出了用于在悬浮细胞重新编程的方法的方案。分离后,将PBMC用含有山因子在非包被的孔仙台病毒转导。次日,收集悬浮细胞并到达使用离心一个玻连蛋白包被的板镀,而细胞的att痛到非涂覆孔中丢弃。贴壁细胞上出现的玻连蛋白包被的板被保留下来并且进一步扩大。附细胞保存用的iPSC媒体每日介质的变化。重复对其余悬浮细胞用离心电镀工艺。
重编程的iPSCs可以通过不同的形态几天转导后加以区别。然而,重新编程期间,很难扩大重编程的细胞以纯的形式。在重新编程的早期阶段,iPSCs的是附加的非重编程分化的细胞( 图2A)进行混合。在图2A中的箭头示出了在图像中的的iPSC样细胞类型。扩建前,iPS细胞和其他细胞难以区分。因此,通过菌落采摘过程只得到一个纯的菌落。通过接种细胞在密度低,即分别为升菌落得到ARGE足够用于拾取, 如图2B所示 。分离菌落后,将细胞团块解离成单细胞和培养的( 图2C)。纯的iPSC集落之后看到( 图2D)。纯的iPSC被扩展后,细胞的质量进行测试。细胞用碱性磷酸酶染色以确认iPSCs的( 图3A)的未分化状态。从孤立的iPS细胞衍生的所有菌落呈阳性。多能性标记物进行免疫染色, 图3B中所示的证实。所述重编程的细胞中高度表达多能性标志物例如SSEA4,OCT4,SOX2,TRA-1-81,KLF4,以及最重要的是,TRA-1-60。多能性标记物的表达通过RT-PCR,在图3C所示的证实。检测OCT4和SOX2,如图荧光数据。其它标记如NANOG,DPPA5,TDGF1分别positiv伊利表示为好。
为了进一步分析,一个染色体核型分析已完成。 如图4A所示,所产生的的iPSC显示正常的染色体图案。来确认真正的多能性,将细胞分化成外胚层,中胚层和内胚层。所产生的iPSC成功分化成所有三种胚层,在图4B中看出。由于仙台病毒以其自由集成属性,病毒DNA的去除是示于图4C。一出来往往有病毒DNA三格依然存在,即使经过多次传代。然而,集成基因通过亚克隆过程移除。
总之,我们都表现出了协议,从外周血单个核细胞漂浮iPS细胞生成。协议表现出较高的效率和所需的唯一的少量血液。生成的iPS细胞具有较高的多能性和避免VI拉尔整合。
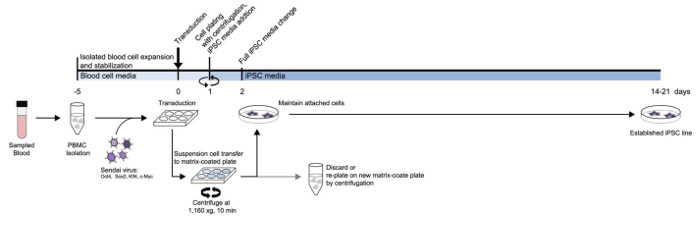
图1:从外周血中的iPSC生成协议的方案。根据该记录介质类别和时间表所设计的协议的详细图。 请点击此处查看该图的放大版本。
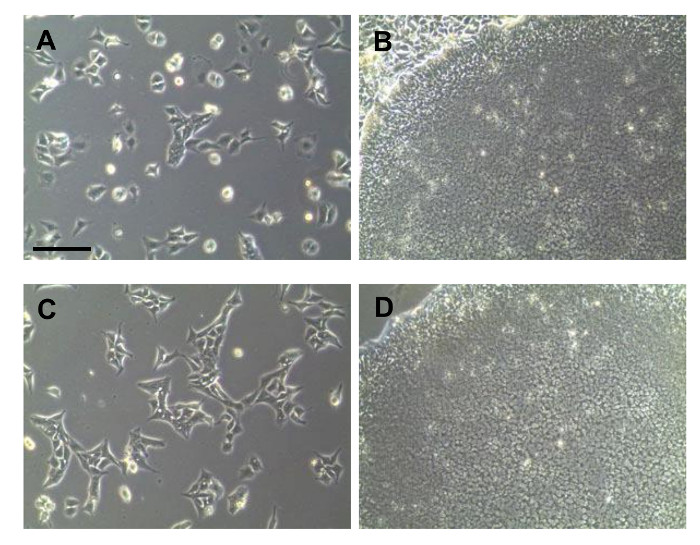
图2:从PBMC中产生的iPSC的亮场图像。 (A)重编程细胞的早期形态。殖民地的(B)图像采摘之前。殖民地采摘净化过程后(C)细胞。一个纯粹的殖民地(D)形态。所有规模横道200微米。 /ecsource.jove.com/files/ftp_upload/54650/54650fig2large.jpg"目标="_空白"> 点击此处查看该图的放大版本。
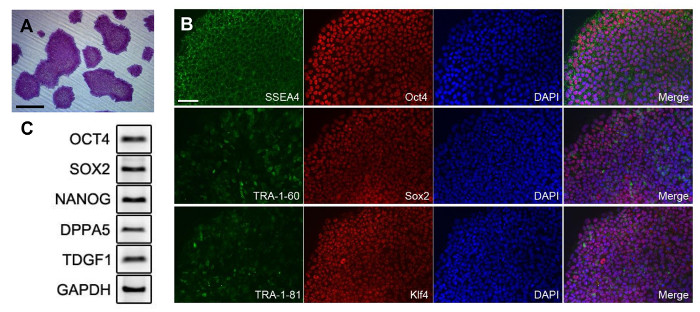
图3:iPS 细胞多能性的外周血单个核细胞从生成。 (A)菌落染色碱性磷酸酶。所产生的iPSC的(B)的荧光图像。抗体稀释比示于表1中 。多能标记(C)PCR分析。底漆信息在表2中提供。所有规模横道200微米。 请点击此处查看该图的放大版本。
上传/ 54650 / 54650fig4.jpg"/>
图4: 所产生的iPSC的进一步分析。 ( 一 )的iPSC的正常karyogram。后三胚层分化的细胞(B)的荧光图像。 (C)PCR仙台病毒载体的分析。非转导的细胞用作阴性对照,并收集细胞一天转导被用作阳性对照后。底漆信息在表2中提供。所有规模横道200微米。 请点击此处查看该图的放大版本。
| 抗体名称 | 浓度 |
| SSEA4 | 1:200 |
| OCT3 / 4 | 1:100 |
| TRA-1-60 | 1:200 |
| SOX2 | 1:100 |
| TRA-1-81 | 1:100 |
| KLF4 | 1:250 |
| 的Alexa Fluor 488山羊抗小鼠IgG(H + L)抗体 | 1:400 |
| 的Alexa Fluor 594山羊抗兔IgG(H + L)抗体 | 1:400 |
表1抗体稀释液。
| 目标名称 | 方向 | 引物序列 | 尺寸 |
| OCT3 / 4 | 前锋 | ACC CCT GGT GCC GTG AA | 190 |
| 相反 | GGC TGA ATA CCT TCC CA一个ATA | ||
| SOX2 | 前锋 | CAG CGC ATG GAC AGT TAC | 321 |
| 相反 | GGA GTG GGA GGA AGA GGT | ||
| NANOG | 前锋 | AAA GGC AAA CAA CCC ACT | 270 |
| 相反 | GCT ATT CTT CGG GTT CCA | ||
| LIN28 | 前锋 | GTT CTT CGG CCT GTC CAT | 122 |
| 相反 | CTG CCT CAC CCT CCT TCA | ||
| DPPB5 | 前锋 | CGG CTG CTG AAA GCC ATT TT | 215 |
| 相反 | AGT TTG AGC ATC CCT CGC TC | ||
| TDGF1 | 前锋 | TCC TTC TAC GGA CGG AAC TG | 140 |
| 相反 | AGA AAT GCçTGA GGA AAG CA | ||
| SeV载体 | 前锋 | GGA TCA CTA GGT GAT ATC GAGÇ | 181 |
| 相反 | ACC AGA CAA GAG TTT AAG AGA TAT GTA TC | ||
| KOS | 前锋 | ATG CAC TAC CGC GAC GTG AGC GC | 528 |
| 相反 | ACC TTG ACA ATC CTG ATG TGG | ||
| KLF4 | 前锋 | TTC CTG CAT GCC AGA GGA GCCÇ | 410 |
| 相反 | AAT GTA TCG AAG GTG CTC AA |
表2.引物信息。
讨论
由于胚胎干细胞(ESCs)显示若干缺点,需要一种替代的工具的需要。因此,诱导多能干细胞由山开发(iPS细胞)在国际聚光灯下的来。它已经将近十年,因为山中发现多能性可以通过添加只有四个基因导入成年体细胞被诱导。由于iPS细胞是由成熟的体细胞"诱导",他们可以逃避那个曾经是与胚胎干细胞的关注伦理问题。不像胚胎干细胞,可以从每个生成的iPSC。因此,它们可以在个性化医学研究和其它研究,如药物筛选,疾病建模,或再生医学中使用。
人类第一次的iPSC从皮肤成纤维细胞在2007年各群体成功地重编程这类细胞生成,但被要求的微创手术程序,以获取该主要小区。因此,它不是想法产生各种疾病的iPS细胞或设计再生医学l源。还需要一种替代和容易获得的细胞类型,例如角质形成细胞,尿单核细胞和血细胞。然而,这些细胞是很难扩大,其中一些有污染10的机会较高。
在这项研究中,我们提出了一个协议,可以成功地产生从全血细胞的iPSC如外周血单个核细胞。没有特定的细胞类型的任何扩张过程中,该协议建议一个相对简单的方法来产生的iPSC,即使从原血细胞量小。一旦将PBMC从血液中分离,将细胞在血细胞培养基稳定5天。转之前的稳定步骤是在这个协议的关键。重编程效率为血细胞培养基孵育细胞后更好。用于CD34 +细胞的扩大此介质。然而,当全血细胞保持在此箱直径为5天,细胞数是与第一计数几乎相同。使用全血细胞,这是很难确定是否CD34 +细胞已扩大。然而,稳定化步骤本身似乎是成功的重新编程重要。
转导后,我们串联镀细胞上通过离心一个玻连蛋白包被的板。本来,重编程的细胞沉到井的转导后的底部。通过提高机械力或离心细胞,将转导的细胞能够附着和增殖。然而,由于协议使用全血细胞,当扩大了与不同的样品未遂试验一半导致各种类型形态。因此,通过菌落采摘纯的iPSC菌落隔离在这个协议中的关键。从分离菌落扩大了的细胞表现出纯的iPSC的所有特征。
尽管有其他好处,iPS细胞具有几个障碍需要克服。因为几个山因素是已知的癌基因,有iPSCs的可发展成在体内肿瘤的关注。因此,重要的是,重编程的细胞具有由积分没有剩余的外源基因的表达。在iPS细胞,病毒,如逆转录病毒和慢病毒后发展初期,被用于重新编程。重编程率较高的成功,但需要这些病毒随机整合入细胞基因组。出于这个原因,其它几种方法已经被开发。像仙台病毒的病毒是已知的转导的细胞中没有集成,并利用小分子和游离型载体的其它方法已经被开发为好。在这项研究中,我们使用仙台病毒进行重新编程。相比慢病毒的整合率较低。我们还证实,有在产生的iPSC一些剩余的病毒成分。三个试验一出导致INTEGRAT离子,即使在15-20通道。然而,这种整合是通过亚克隆从一个单细胞衍生的克隆移除。在我们的经验中,密度,以获得从单细胞衍生的健康菌落每100毫米培养皿1×10 4个细胞。了会导致一正圆形状的菌落,对于剩余病毒成分的PCR的再确认展开。来自非集成细胞衍生的菌落保持以进一步使用。一旦删除,细胞保持了非整合状态。
在这项研究中,我们建议对血细胞重编程的协议。我们增加了几个步骤,例如串行电镀和离心,以提高漂浮细胞的重新编程速率。此方法用PBMC和脐带血单核细胞(CBMCs)完成。该协议被用来产生在韩国GMP设施纯合子iPS细胞。我们集团期待的iPSC重编程过程的加速使用我们的协议。
披露声明
The authors have nothing to disclose.
致谢
This work was supported by a grant from the Basic Science Research Program through the National Research Foundation of Korea (NRF), funded by the Ministry of Science, ICT, and Future Planning (2013R1A1A1076125).
材料
| Name | Company | Catalog Number | Comments |
| Plasticware | |||
| 100 mm Dish | TPP | 93100 | |
| 6-well Plate | TPP | 92006 | |
| 50 ml Cornical Tube | SPL | 50050 | |
| 15 ml Cornical Tube | SPL | 50015 | |
| 10 ml Disposable Pipette | Falcon | 7551 | |
| 5 ml Disposable Pipette | Falcon | 7543 | |
| 12-well Plate | TPP | 92012 | |
| 24-well Plate | TPP | 92024 | |
| PBMC Isolation Materials | |||
| DPBS | Life Technologies | 14190-144 | |
| Ficoll | GE Healthcare | 17-1440-03 | |
| StemSpan | STEMCELL Technologies | 9805 | Blood cell media |
| CC110 | STEMCELL Technologies | 8697 | Blood cell media supplement (100x) |
| iPSC Generation and Culture Materials | |||
| CytoTune-iPSC Sendai Reprogramming Kit | Life Technologies | A16518 | |
| TeSR-E8 Media | STEMCELL Technologies | 5940 | iPSC media |
| Vitronectin | Life Technologies | A14700 | |
| ROCK Inhibitor | Sigma Aldrich | Y0503 | |
| TrypLE express (TrypLE) | Life Technologies | 12604-039 | |
| ReleSR | STEMCELL Technologies | 12604-039 | Colony detaching solution |
| Quality Control Materials | |||
| 18 mm Cover Glass | Superior | HSU-0111580 | |
| 4% Paraformaldyhyde | Tech & Innovation | BPP-9004 | |
| Triton X-100 | BIOSESANG | 9002-93-1 | |
| Bovine Serum Albumin | Vector Lab | SP-5050 | |
| Anti-SSEA4 Antibody | Millipore | MAB4304 | |
| Anti-Oct4 Antibody | Santa Cruz | SC9081 | |
| Anti-TRA-1-60 Antibody | Millipore | MAB4360 | |
| Anti-Sox2 Antibody | Biolegend | 630801 | |
| Anti-TRA-1-81 Antibody | Millipore | MAB4381 | |
| Anti-Klf4 Antibody | Abcam | ab151733 | |
| Alexa Fluor 488 goat anti-mouse IgG (H+L) antibody | Molecular Probe | A11029 | |
| Alexa Fluor 594 goat anti-rabbit IgG (H+L) antibody | Molecular Probe | A11037 | |
| DAPI | Molecular Probe | D1306 | |
| Prolong gold antifade reagent | Invitrogen | P36934 | |
| Slide Glass, Coated | Hyun Il Lab-Mate | HMA-S9914 | |
| Trizol | Invitrogen | 15596-018 | |
| Chloroform | Sigma Aldrich | 366919 | |
| Isoprypylalcohol | Millipore | 109634 | |
| Ethanol | Duksan | 64-17-5 | |
| RevertAid First Strand cDNA Synthesis kit | Thermo Scientfic | K1622 | |
| i-Taq DNA Polymerase | iNtRON BIOTECH | 25021 | |
| UltraPure 10X TBE Buffer | Life Technologies | 15581-044 | |
| loading star | Dyne Bio | A750 | |
| Agarose | Sigma-Aldrich | 9012-36-6 | |
| 1kb (+) DNA ladder marker | Enzynomics | DM003 | |
| Alkaline Phosphatase | Millipore | SCR004 | |
| Tris base | Fisher Scientific | BP152-1 | Rinse Buffer |
| Sodium Chloride | Duchefa Biochemie | S0520.1000 | Rinse Buffer |
| Tween-20 | BIOSESANG | T1027 | Rinse Buffer |
| Hydrochloric Acid | Duksan | 1129 | Rinse Buffer |
参考文献
- Serra, M., Brito, C., Correia, C., Alves, P. M. Process engineering of human pluripotent stem cells for clinical application. Trends Biotechnol. 30 (6), 350-359 (2012).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78 (12), 7634-7638 (1981).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126 (4), 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Chun, Y. S., Byun, K., Lee, B. Induced pluripotent stem cells and personalized medicine: current progress and future perspectives. Anat Cell Biol. 44 (4), 245-255 (2011).
- Seki, T., Fukuda, K. Methods of induced pluripotent stem cells for clinical application. World J Stem Cells. 7 (1), 116-125 (2015).
- Churko, J. M., Burridge, P. W., Wu, J. C. Generation of human iPSCs from human peripheral blood mononuclear cells using non-integrative Sendai virus in chemically defined conditions. Methods Mol Biol. 1036, 81-88 (2013).
- Loh, Y. H., et al. Reprogramming of T cells from human peripheral blood. Cell Stem Cell. 7 (1), 15-19 (2010).
- Ohmine, S., et al. Induced pluripotent stem cells from GMP-grade hematopoietic progenitor cells and mononuclear myeloid cells. Stem Cell Res Ther. 2 (6), (2011).
- Mae, S., et al. Monitoring and robust induction of nephrogenic intermediate mesoderm from human pluripotent stem cells. Nat Commun. 4, 1367(2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。