Method Article
Transfeksiyon, Seçim ve İnsan uyarılmış pluripotent kök hücrelerin Colony-toplama AAVS1 Safe Harbor içine GFP geninin ile TALEN-hedefli
Bu Makalede
Özet
TALEN-mediated gene editing at the safe harbor AAVS1 locus enables high-efficiency transgene addition in human iPSCs. This protocol describes the procedures for preparing iPSCs for TALEN and donor vector delivery, transfecting iPSCs, and selecting and isolating iPSC clones to achieve targeted integration of a GFP gene to generate reporter lines.
Özet
Targeted transgene addition can provide persistent gene expression while circumventing the gene silencing and insertional mutagenesis caused by viral vector mediated random integration. This protocol describes a universal and efficient transgene targeted addition platform in human iPSCs based on utilization of validated open-source TALENs and a gene-trap-like donor to deliver transgenes into a safe harbor locus. Importantly, effective gene editing is rate-limited by the delivery efficiency of gene editing vectors. Therefore, this protocol first focuses on preparation of iPSCs for transfection to achieve high nuclear delivery efficiency. When iPSCs are dissociated into single cells using a gentle-cell dissociation reagent and transfected using an optimized program, >50% cells can be induced to take up the large gene editing vectors. Because the AAVS1 locus is located in the intron of an active gene (PPP1R12C), a splicing acceptor (SA)-linked puromycin resistant gene (PAC) was used to select targeted iPSCs while excluding random integration-only and untransfected cells. This strategy greatly increases the chance of obtaining targeted clones, and can be used in other active gene targeting experiments as well. Two weeks after puromycin selection at the dose adjusted for the specific iPSC line, clones are ready to be picked by manual dissection of large, isolated colonies into smaller pieces that are transferred to fresh medium in a smaller well for further expansion and genetic and functional screening. One can follow this protocol to readily obtain multiple GFP reporter iPSC lines that are useful for in vivo and in vitro imaging and cell isolation.
Giriş
embriyonik kök hücre benzeri uyarılmış pluripotent kök hücrelerin içine (iPSCs), insan somatik hücreleri yeniden programlamak için yeteneği ilk olarak Takahashi ve arkadaşları tarafından keşfedildi. 2007'de 1. retrovirüsler dört transkripsiyon faktörlerini ifade ile transdük İnsan dermal fibroblastlar (so-dublaj Yamanaka Oct3 faktörleri / 4, Sox2, c-Myc ve Klf4) morfoloji, çoğalması, gen ekspresyonu ve epigenetik durumuna göre, insan embriyonik kök hücreler (HESC) büyük ölçüde benzer olduğu gösterilmiştir; önemlisi, iPSCs da, tüm üç germ 1 hücrelerine ayrım yapabilmektedir. iPSCs çoğalma potansiyeli ve farklılaşma kapasitesi onlara çok cazip araçlar yapar; Belirli hastalıklara yakalanmış hastalardan alınan hücrelerin yeniden programlanması, iPSCs, in vitro bir hastalık modeli olarak ve potansiyel terapötik maddeler olarak hem de kullanılabilir.
İkinci amaçla, çeşitli konularda iPSCs tam potansiyeline önce ele alınmalıdırKlinik bir ortamda gerçekleştirilebilir; In vitro kültürlenmiş HESC ve iPSCs, yeniden programlama ve hücre bakım sırasında ksenojenik türevlerinin kullanımına tümörojenik potansiyeli ve in vivo olarak nakledilen hücrelerin izlemek için olan ihtiyaç en Hentze et tarafından yapılmıştır pluripotent kök hücrelerin klinik uygulama (tüm önemli engeller vardır. 2). Farklılaşmış hücreler transplantasyon sonrası izleme ihtiyacı için ideal bir çözüm ne olursa olsun uygulama susturulması ve renklilik direnen bir görsel tespit işaretleyici içerecektir. Eksojen DNA güvenli liman loci içine sokulduğunda entegre transgenlerin sağlam ve kalıcı sentezleme en kolayca elde edilebilir; yani, bir entegre vektör yeterli transkripsiyonunu sağlayacak genomik siteleri komşu genlerin 3 ifade düzensizlikler hafifletici aynı zamanda da. Çok iyi keşfedildiğinden beri karakterize edilmiştir Böyle bir site adeno-ilişkili virüs, Integr olanprotein fosfataz 1 düzenleyici alt birimi 12C (PPP1R12C) geninin ilk intronu içinde tirme Alanı 1 (AAVS1). Bu odağı sürekli ve genişletilmiş zaman içinde entegre transgenlerin sağlam ifade kültürü ve in vitro farklılaşma 3, aynı zamanda transkripsiyonel pertürbasyon 4 genlerin çevreleyen korumak için izin veren değil, sadece gösterilmiştir; Her iki özellik nedeniyle AAVS1 sitesini 5 yan endojen kromatin izolatör elemanlarının varlığı olduğu düşünülmektedir.
Sadece son on yılda genom mühendislik araçları gelişmeler büyük ölçüde herhangi bir hücre tipinde genetik manipülasyonlar elde edilebildiği kolaylığı ve verimliliği kolaylaştırmıştır. Erken başarılı deneyler EKH 6,7 hedefleme geni elde etmek için bir tanıttı donörü ile endojen homolog rekombinasyon (HR) olarak son derece düşük seviyelerde dayanıyordu ederken, çinko parmak nükleazlardır (ZFNs), signi ki gibi site-spesifik nükleazlara, kullanımıficantly, bu gibi deneylerin 8,9 verimliliğini arttırdı büyük bir çift-iplikçikli DNA kırılmasının nesil ile homolog rekombinasyonu teşvik eder. Her iki transkripsiyon aktivatörü gibi etkileyicilerin bitki patojeni xanthomanas cinslerin (Tales) ve prokaryotik kümelenmiş düzenli interspaced kısa palindromik tekrarlar (CRISPR) verimli site-spesifik tasarımcı nükleazlara içine / Cas9 sistemi yeniden amaç pluripotent kök hücreleri hedef geni yaptı erişilebilir ve Uygulanabilir metodoloji 10-13.
Yeni bir kağıt TACE'nin nükleazlar (TALENS) 14 kullanılarak insan iPSCs olarak AAVS1 güvenli liman lokusuna yeşil flüoresan raportör kaseti kararlı entegrasyonu için etkili bir yöntem açıklamıştır. Bunlar hedeflenen iPSCs böyle bir programı için güçlü kanıtlar sunan, hatta miyokard infarktüsü (MI) bir fare modeli kardiyomiyositlerinin ve transplantasyon yönelik farklılaşma sonra floresan devamstabil floresan pluripotent kök hücreler 14. Hedeflenen koloniler elde etmek için, bir gen trap yöntemi bir ekleme-alıcı (SA), 2A kendi kapanan peptid dizisi, endojen PPP1R12C promoterinin kontrolü altında puromisin, N-asetil-transferaz (PAC) geni yerleştirir, burada kullanıldı; Böylece, AAVS1 lokustaki DNA donör dahil yalnızca iPSCs puromycin direnci dayalı seçilebilir onları render, PAC ifade; (Şekil 1, 15). Bu protokole göre iPSCs, AAVS1 GFP iPSCs TALENS ile iPSCs transfekte süreci ve AAVS1 güvenli liman lokusunun bir 4.2kb DNA fragmanı entegre etmek için bir 9.8 kb verici de dahil olmak üzere, son kağıt 14 bildirilmiştir üreten seçilmesi işlemlerini detayları puromisin-dirençli ve klonal genişleme için çekme kolonileri. Burada tarif edilen teknikler bir çok genom mühendisliği deneylere uygulanabilir.
Protokol
1. Bodrum Membran Matrix hazırlanması ve Plasticware Kaplama
- Buz üzerine -20 ° dondurulmuş bazal membran matris stok yerleştirin ve 4 ° C'de bir gece eritin.
- Çözündükten sonra, önceden soğutulmuş Eppendorf tüpleri içine taban membran matrisi pipet 2 mg'lik parçalara. Gerekli olana kadar -20 ° C'de bu saklayın.
- , Bazal membran matris kaplı plakaları hazırlamak Eppendorf tüp kaybolana buz son parçası (genellikle 2 ~ içinde saat) kadar buz üzerinde bir kısım Çözülme için.
- Çözündükten sonra, bazal membran matris kaplama çözeltisi yapmak için soğuk (4 ° C), DMEM / F12 içinde 12 ml kadar bazal membran matrisi ekleyin.
- Uygun bir kültür teknesine bazal membran matris solüsyonu ekleyin. 6-çukurlu plaka için, oyuk başına 1 ml akıtın. Bazal membran matris çözümü tamamen her iyi kapsar emin olmak için plakayı girdap.
- Parafilm bazal membran matris kaplı plaka / çanak mühür ve roo inkübekullanımdan önce 1 saat m sıcaklığı. Seçenek olarak ise, mağaza bazal membran matris kaplı plakalar / 4 ° C'de yemekleri ve kaplamanın 2 hafta içinde kullanın.
NOT: kurumasını önlemek için bazal membran matris kaplı plaka / çanak ekstra DMEM / F12 ekleyin. 4 ° C 'de depolanmıştır bazal membran matris kaplı plaka / çanak kullanmadan önce, bir biyolojik güvenlik kabini içine koyun ve en az 30 dakika boyunca oda sıcaklığına gelmesine izin. - Tam ortam ve hücreler ilave edilmeden önce aspire taban membran matrisi.
E8 ortamının 2. Hazırlık
- 4 ° C'de gece boyunca E8 takviyesi çözülme E8 kültür ortamı hazırlayın.
- 500 ml stoktan E8 bazal ortam 10 ml çıkarın ve atın.
- Doğrudan E8 bazal ortam 490 ml E8 takviyesi tüm 10 ml flakon Pipet. Tekrarlanan sıcaklık dalgalanmaları comple içinde bFGF düşürebilir gibi, bir 37 ° C su banyosunda değil sıcak komple E8 orta yapınte E8 ortamı.
- Eki ek 2 hafta içinde tam E8 ortamı kullanın.
IPSCs 3. Çözülme
- Kuru buz üzerinde, sıvı azotun ve yerden dondurulmuş iPSCs bir şişe çıkarın.
- Hızla bir 37 ° C su banyosunda şişeyi çözülme; buz kalıntıları sadece küçük bir parçası kadar su banyosunda şişeyi girdap.
- Biyolojik güvenlik kabini% 70 etanol ve transferi ile şişeyi püskürtün.
- Doğrudan flakon oda sıcaklığı E8 orta damla damla 1 ml ekleyin.
- 2 ml'lik bir pipet kullanılarak, 15 ml konik bir tüp içinde E8 ortamın 9 ml hücre süspansiyonu, damla damla aktarın. Hücreler ve orta hızlı iyice karıştırın sağlamak için sık sık tüp girdap.
- 5 dakika süreyle 200 x g'de hücreleri santrifüjleyin.
- Süpernatanı havalandırın, ve 10 uM Y-27632 ile takviye E8 uygun hacimde bir hücre pelletini.
- Bodrum uygun sayıda hücrelerin ekleyin membrangecede 37 ° C,% 5 CO 2 inkübatör e matris kaplı kuyuları ve yer. Bu çözmeden sonra hızlı bir iyileşme sağlamak için, 6 gözlü bir plakanın her bir kuyucuğu başına en azından 0.2 x 10 6 IPSC plaka tavsiye edilir.
4. Bakım ve iPSCs rutin Pasajlanması
- Günlük E8 orta yenileyin.
- Bir inverted mikroskop ile morfolojisi ve hücre konfluent izleyin. yüksek kaliteli iPSCs farklı sınırları düz koloniler halinde büyür; Bireysel koloniler "Arnavut kaldırımı gibi" bir görünüm sahip.
- Passage iPSCs hücreler ~ 70% confluency ulaştığınızda.
- 0.9 g NaCI ve 500 ml DPBS 500 ul 0.5 M EDTA ilave ederek bir EDTA pasajı çözelti hazırlayın. Sterilize etmek NaCl ve vakum filtresi çözmek için iyice karıştırın. Pasajlayarak önce 37 ° C'lik bir su banyosu içerisinde pasajı çözeltisi bir kısım ısıtın.
- Geçit için, aspirat kültür ortamı geçirdi ve sıcak pas eşit hacimde ile bir kez hücreleri yıkayınçözelti saging. Kaplamak için aspire ve pipet yeterli EDTA pasajı çözeltisi hücreleri (6-çukurlu plaka içinde çukur başına 1 mi).
- Ters döndürülmüş bir mikroskop altında hücre yerleştirin ve iPSC kolonilerin. koloniler ve yükseltilmiş sınırları içinde delik görünümü 2 ila 5 dakika içinde belirgin hale gelmelidir.
- Dikkatle EDTA Pasajlanması çözüm aspire.
- Şirketinden de geçişli her içine yüksek basınç altında (6 çukurlu bir plaka kullanılarak varsa) 10 ml'lik bir pipet kullanılarak, E8 ortamının 4 ml dağıtmak.
- IPSC kümeleri toplamak, ve 1 ila bölme oranına bağlı olarak, deliklerin bir uygun sayıda bölünmüş: 01:12 ila 8. Aşırı pipet, hücre kümeleri parçalanma zayıf canlılığı neden olur vermeyin.
- Bir inkübatör plaka koyun, ve hücreleri dağıtmak için geri ve ileri-ve yan-yan birkaç kez plaka sallayın.
Tansfection için MEF'ler ve iPSCs 5. N-
- Transfectio 48 saat önceN, geçit iPSCs ~ 1 için: bir bazal membran matris ile kaplanmış 6-çukurlu plaka dört veya daha fazla kuyu içine 6 iki gün dolayısıyla% 70 konfluent olacak şekilde.
- Bir sonraki gün,% 10 FBS ve 1 x MEM-NEAA ile takviye edilmiş DMEM (yüksek glukoz) 'den oluşan MEF ortam içine DR4 MEFS eritin.
- • 2 x 10 4 hücre / cm2 de iki adet 10 cm'lik kaplar içine levhalar DR4 MEFS ve gece boyunca 37 ° C enkübe edilir.
- Transfeksiyondan bir gün, 30 dakika iPSCs üzerinde transfeksiyon gerçekleştirilmeden önce 10 uM Y-27632 ile takviye edilmiş E8 MEF aracını değiştirme.
- İsteğe bağlı: iPSCs transfeksiyondan akış sitometrik analizi, arzu edildiği takdirde, oda sıcaklığında, bir bazal membran matris ile kaplanmış 4 ° C plaka ve yer çıkarın.
- İsteğe bağlı 4 saat, transfeksiyondan önce, 10 uM nihai konsantrasyon-Y-27632 ile ön transfeksiyon iPSC kültür tamamlar.
6. Nazik-hücreli Ayrılma Reaktif Tedavind transfeksiyonu iPSCs bir Elektroporasyon Sistemi kullanılarak
- 4 ° C ve P3 birincil hücre transfeksiyon solüsyonu çıkarın ve ~ boyunca oda sıcaklığına 30 dk gelmesini sağlar. Kullanımdan önce transfeksiyon çözeltisine, tüm 100 ul ek ekleyin.
- 37 ° C'lik bir su banyosu içinde sıcak nazik-hücre ayrıştırma reaktifi.
- AAVS1 TALENS (PZT-AAVS1-L1 ve PZT-AAVS1-R1), -20 ° C ve AAVS1-CAG-EGFP donör elde edilir.
- Inkübatörden iPSCs çıkarın ve DPBS ile bir kez yıkanır.
- Oyuk başına nazik-hücre ayrıştırma reaktifi 1 ml ilave edilir, ve 5 dakika boyunca 37 ° C'de inkübe iPSCs veya hücrelerin% 50'den daha fazla kültür teknesine ayrışmış kadar.
- Yukarı ve kültür kabından kalan hücreleri ayırmak için, ve iPSC öbekler kırmak için bir P1000 pipet kullanarak birkaç kez aşağı hücreleri pipetle.
- Fürth için 10 ml'lik pipet kullanarak her bir kuyunun E8 orta 2 ml ekleyin ve pipet yukarı ve aşağı birkaç kezer tek hücre içine hücre kümeleri parçalara ayırma
NOT: hücre kümeleri yeterince ayrıştırılmış değilse Transfeksiyon verimliliği önemli ölçüde azalır. - 3 dakika boyunca 100 x g'de 15 ml konik bir tüp içinde iPSCs ve santrifüj toplayın.
- E8 ortamının en az bir miktarda aspire yüzer madde ve tekrar süspansiyon hücreleri.
- Bir canlı bir boya gibi% 0.4 tripan mavisi uygulanmasından sonra bir hemasitometre kullanarak hücreleri sayın. ("Küme" başına 1-3 hücre) sayım sırasında hücreler yeterince ayrışmış emin olun.
- İki 15 ml konik tüplerin her birine 3 x 10 6 hücre koyun ve 3 dakika boyunca 100 xg'de tekrar aşağı doğru döndürün.
NOT: Düşük hız santrifüj hücre stresi azaltır ve elektroporasyon önce iPSCs kolay yeniden asılmasını sağlıyor. - İnsan embriyonik kök hücre hattı H9 (Program CB-150) hücre tipi özel program elektroporasyon sistemi ayarlayın.
- Santrifüj işleminden sonra, cel süpernatant aspirel peletler. Bir pelet için, kontrol örneği olarak, sıcak verici 10 ug ekleyin. Diğer pelet 5 mikrogram ile birlikte İK donörün 10 ug, eklediğiniz her deney numune olarak TALEN (PZT-AAVS1-L1 ve PZT-AAVS1-R1).
- P3 birincil hücre transfeksiyon solüsyonundan 100 ul her bir hücre pelletini, bir küvete aktarılır.
- Transfeksiyon gerçekleştirin ve hemen her küvete oda sıcaklığı E8 orta 500 ul ekleyin.
- Adım 5.4 hazırlanan DR4 MEFS içeren bir 10 cm'lik çanak transfekte iPSCs damla damla aktarın.
- İsteğe bağlı: Transfeksiyon verimi analizlerinin nasıl sitometri akışı istendiği takdirde, bir bazal membran matris ile kaplanmış 6-çukurlu plaka içinde bir kuyuya her bir deney birkaç damla ekleyin.
- Tekrar her iki örnekleri bitirmek için 6,15-6,17 adımları. Ertesi gün, DPBS hücreleri iki kez yıkayın ve E8 daha besleyici daha iyi iPSC kültürünü desteklemek için görünür NutriStem, kültür ortamı geçmek.
- Tr48 saat sonrası transfeksiyon 72 en ansient EGFP ifade zirveleri; arzu edilen transfeksiyon etkinliğini değerlendirmek.
Hedefli iPSCs 7. puromisin seçimine
- IPSCs% 70 confluency ulaştığında puromisin Seçimi transfeksiyondan sonra 72 saat başlayın.
- NCRM5 iPSCs için NutriStem kültür ortamında seyreltilmiş 0.5 ug / ml puromisin (1/2 tam doz) ile puromisin seçimi başlar. Optimal puromisin konsantrasyonu 0.25 bazı iPSC hatları için 1 ug / MLL bağlı olarak değişebilir.
- Günlük olarak orta ferahlatıcı 3 gün NutriStem ± 0.5 ug / ml puromisin Kültür iPSCs.
- 3 gün sonra, 1 ug / ml puromisin konsantrasyonunun arttırılması için.
- / Ml puromısin seçimi 1 ug altında Kültür iPSCs başka bir 7 ila 8 gün için, ya kadar farklı koloniler koloni toplama için yeterince büyük görünür.
8. Koloni Toplama ve Hedeflenen iPSCs Yaygınlaştırılması
- Kullanım bazal membrankaplamak için matris, her oyuğa (12 mi DMEM / F12 içinde seyreltilmiş, 2 mg bazal membran matris) bazal membran matris kaplama solüsyonu 50 ul dağıtma ile 96 oyuklu plaka. 4 ° C'de bir gece boyunca, kullanımdan önce plaka saklayın.
- Bazal membran matris kaplı plaka, oda sıcaklığına gelmeye bırakıldıktan sonra, bazal membran matrisi aspire ve 10 uM Y-27632, her bir oyuğa ile takviye edilmiş 100 ul E8 dağıtın.
- Bir biyolojik güvenlik kabini içine ters bir mikroskop yerleştirin ve sterilize etmek için% 70 EtOH ile hafifçe sprey.
- Ucunda küçük bir "kanca" olan ideal bir koloni toplama aracı edinmek için Bunsen beki üzerinde cam Pasteur pipet çekin. % 70 EtOH ile sterilize ve kurumaya kaputun yerleştirmek.
- Inkübatör hedeflenen iPSC kolonileri içeren çanak çıkarın ve mikroskop altında kaputun içine yerleştirin.
- Koloni toplama aracı ile koloni sınır etrafında bir daire izleme tarafından iPSCs seçin.
- Hafifçe kazıyın ve plaka yüzeyinden iPSC kolonisi kaldırmak için koloni-toplama aracı "kanca" kullanın. Daha büyük koloniler için, koloni tekrar kaplamadan sonra hücre büyümesini kolaylaştıracak çeyrek koloni toplama aracı ile bir X çizim.
- Hücre kümeleri müstakil ve serbestçe yüzen sonra, iPSCs toplamak için ~ 30 ul set P200 pipet kullanın. Doğrudan 96 oyuklu bir plakaya Levha hücreleri.
- İsteğe bağlı: daha sonra 37 ° C'de 5 dakika boyunca sindirimi 50 ul nazik-hücre ayrışma reaktifmi, bir Eppendorf tüpüne iPSCs toplamak için ~ 5 ul ayarlanmış bir p20 pipet kullanın. Sindirimden sonra, yumuşak-hücre ayrıştırma reaktifi seyreltilmesi ve 5 dakika için standart bir masa üstü mikrosantrifüj 200 xg'de hücreleri yavaşlamalarını Eppendorf tüpüne, 500 ul E8 orta ekleyin. Daha sonra sıvı ortamı en iyi aspire ve • tekrar süspansiyon ve 96 oyuklu bir plakaya hücreleri aktarmak için 30 ul bırakın.
NOT: Buyaklaşım hücre küme ve aldı koloninin hızlı genişleme ayrışma kolaylaştıracaktır. - IPSC koloniler yeterli sayıda toplanmıştır kadar koloni toplama devam (kabaca deney başına 20-30 kolonileri tavsiye edilir).
- Koloni toplama sonra, gece boyunca bir kuluçka makinesi içinde 96 oyuklu plaka yerleştirilir. Tam E8 orta Ertesi gün, ve kültür 70 ~ kadar% konfluent ile yenileyin.
- Içine 96 oyuklu geçişin hücreleri, 24-çukurlu, daha sonra bir 6-çukurlu, adım 4,5-4,10 hazırlanır.
NOT: 6-çukurlu plaka daha küçük kuyu kullanıldığında EDTA çözeltisi ve E8 ortamının hacmi orantısal olarak azaltılmalıdır. - Rastgele eklenen vektörlerin 16 hedeflenmiş kaset entegrasyonu ve yokluğunu onaylamak için kavşak PCR ve Southern blot analizi ile hedefleme başarısını değerlendirmek.
Sonuçlar
Protokolün bir görselleştirme iPSCs NutriStem için ya E8, yeşil veya mavi tarafından vurgulanan farklı bir ortam içinde kültürlenir dönemlerin, Şekil 2'de verilmiştir. Sadece yüksek kaliteli iPSCs transfekte etmek önemlidir; Rutin bakım boyunca kültür yemekleri incelemek ve iPSC kültürleri bir Arnavut kaldırımı gibi morfoloji taşıyan başta farklı koloniler (Şekil 3A) içerdiğini doğrulayın; farklılaşmış hücre kültürünün% 10'dan fazla işgal edilmelidir. IPSCs bölgesinin Transfectability nedeniyle küçük boyutu, tipik olarak elde edilebilen maksimum verimin Pmax-GFP ile transfeksiyon küçük Pmax-GFP vektörü (Şekil 4A-B) kullanılarak değerlendirildi ve optimize edilir. Örneğin, Pmaks-GFP (Şekil 4B) ile% 68.6 transfeksiyon verimliliği elde etti. AAVS1 güvenli liman hedeflemek için iPSCs hafif bir tek hücre ayrıştırma reaktifi kullanılarak geçişli ve AAVS1-TALENS ve AAVS1- ile transfekte edilirCAG-EGFP (şekil 1A'da gösterilen plazmidler). Transfekte iPSCs sonra DR4 MEF'ler (Şekil 3B), uygun bir yoğunluğa plakalanmıştır. 48-72 saat sonra, transfeksiyon (Şekil 3C) en AAVS1-CAG-EGFP zirveleri geçici ifadesi; arzu edildiği takdirde, transfekte edilmiş iPSCs küçük bir kısmı, FACS analiz edilebilir. NCRM5 iPSCs AAVS1-CAG-EGFP verici (Şekil 4C) ile% 60.9 ve verim ile transfekte edilebilir. Transfeksiyon verimliliği büyük ölçüde değişebilir; GFP + fraksiyon daha düşük% 10 kadarı, burada deneyler için, puromisin seçimine devam etmektedir. Puromisin seçimi yapıldıktan sonra, homojen floresan gösteren tek tek klonlar, koloni toplama (Şekil 3D) için yeterince büyük olmalıdır. Klon almak için, uygun bir koloni düşük büyütme (Şekil 3E) altında bulunan ve ilk izleme izole ve (Şekil 3F-G) quartering olduğunu. dörde koloniler sonra yavaşça kazıyın edilirkültür kabı (Şekil 3H) d. P200 pipet kullanarak, hücre kümeleri daha sonra bir bazal membran matris ile kaplanmış 96-yuvalı plakanın bir oyuğuna transfer edilir. iPSCs kaplama 2-4 saat (Şekil 3I) içinde eklemek gerekir. Ek 24 saat içinde gözlenen değilse, temel zar matris kaplama ya da Y-27632 tedavi edilmesi optimumun altında; Bazal membran matris-ceket, yeni bir 96-plaka ve bir daha koloniler almadan önce taze E8 + 10 uM Y-27632 hazırlamak. Bir kez, 96 oyuklu bir formatta, iPSC klonlar genişletilmiş ve GFP (Şekil 4D-E), sabit ve homojen bir ifade sergilemelidir hedef almıştır.

Şekil 1: Gen hedefleme vektörleri ve şemasını hedef. Bu çalışmada kullanılan AAVS1-CAG-EGFP (A) temsilleri ve PZT-AAVS1-L1 / R1 TALENS plasmidler halinde ilerletilmektedir. SA-AAVS1-CAG-EGFP plasmid 2A eleman hedeflenen entegrasyon olaylara puromisin, N-asetil-transferaz (PAC), gen ekspresyonunu sınırlamak için kullanılan bağlayıcı alıcı ve 2A kendi kapanan peptidi temsil eder. Tavuk β-aktin globin (CAG) promoteri EGFP ekspresyonunu tahrik etmek için kullanılır. (B) 'PPP1R12C geninin Intron 1 içinde ihtiva AAVS1 güvenli liman, çift kollu bir DNA kırılmasını oluşturmak için TALENS kullanılarak hedeflenmektedir. Bu, daha sonra tamir için bir alt-tabaka olarak AAVS1-CAG-EGFP verici (kesme bölgesinin yanında taşıyan homoloji kolları) kullanan homolog rekombinasyon (HR) tamir amaçlı aktive eder. Kaset entegre olan ve PAC gen, endojen PPP1R12C promotörünün kontrolü altında yerleştirilir.
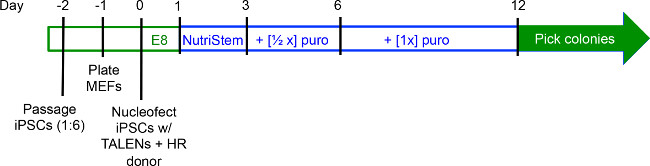
Şekil 2. Gen hedefleme deney Timeline. IPSCs kültürlü% 70 ortak akışkanlığa ve ~ 1 pasajlanır: günde 2 (d-2) 6. MEF'ler d-1 plakalanır ve iPSCs toplanmış ve d0 ile transfekte edilir. D1, vasıtalar NutriStem geçer ve puromisin d3 bu ortama ilave edilmeden önce iPSCs iki gün daha kültürlenmiştir. Koloniler genellikle D12 tarafından toplamak için hazırız. NutriStem kültür dönemleri mavi ise iPSCs E8 ortamında kültürlenir süreler, yeşil vurgulanır.

Şekil 3: temsili görüntüler hedefleyen iPSC geni yüksek kaliteli iPSCs (A) Faz görüntüsü.. Faz parlak sınır ve kaldırım taşı gibi morfoloji edin. (B), DR4 MEF'ler 2 yirmi dört saat çözme işleminden sonra, 2 x 10 4 hücre / cm kaplama. (C) Yetmiş iki saat sonra, transfeksiyon, EGFP + hücreleri net bir şekilde belirgindir flöresanlı bir MICR altında bakıldığındaOscope. 14 gün ~ için puromisin tabanlı seçiminden sonra (D) homojen GFP floresan gösteren koloniler toplanmış için yeterince büyüktür. (EH), koloni toplama işleminin Örnek görüntüler. Koloniler küçük hücre kümeleri elde etmek için bu quartering ile daha sonra koloni ana hatlarını ve ilk, çekilmiş bir Pasteur pipeti kullanılarak toplanır. (I) 'iPSC koloniler 2 içinde 96 oyuklu plakanın taban membran matrisi kaplı yüzeyine bağlanır aldı 4 saat. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 4: transfeksiyon verimi ve klonal hedef iPSCs FACS analizi. Herhangi bir plazmidin transfeksiyon olmayan (A) Kontrol NCRM5 iPSCs. (B) NCRM5küçük bir test vektörü Pmax-GFP ile transfekte edilmiş iPSCs (C) AAVS1-CAG-EGFP plasmid geçici ifadesi. FACS GFP ekspresyonu için analiz edilir FACS ile değerlendirilir. (D) Bir NCRM5-AAVS1-CAG-EGFP klon görüntüler FACS ile analiz edilmiş olarak eşit pozitif EGFP ifade. C karşılaştırıldığında) analiz iPSCs sıkı kümeleme not edin. (Genişletilmiş NCRM5-AAVS1-CAG-EGFP hedef klonun D) Floresans görüntüsü.
Tartışmalar
(1) verimli transfeksiyonla iPSCs içine TALEN ve donör plazmitlerini teslim;: AAVS1 güvenli liman başarılı nesil için en kritik adımlar insan iPSCs vardır hedefli (2) transfeksiyondan sonra transfeksiyon ve kaplama yoğunluğu önce tek hücre içine iPSCs ayrılmasını optimize; (3) doz ve iPSC hattının büyüme dayalı ilaç seçimi süresi optimize; (4) dikkatli diseksiyon ve hedeflenen koloniler toplama ve / kuyu yeni plaka transfer. Hockemeyer en kağıt 10 kullanılan benzer yöntemlerle karşılaştırıldığında, bu protokol kullanılan iPSCs sayısını azaltmak için yardımcı bir açık kaynak AAVS1-Talens çifti, farklı iPSC ayrışma ayıracı, ve Talens ve donör vektörleri sunmak için farklı transfeksiyon cihazı kullanıldı Deney yüksek transfeksiyon sağlanması ve verimlilik hedef alırken.
İnsan iPSCs yüksek etkili gen düzenleme elde etmek için, ilk gen EDI iletimini optimize etmek için gerekli olanAkut hücre ölümünü dağıtım yöntemi dengeleme ve süre ting reaktifler (DNA / RNA), reaktifler iPSCs neden. bir amaç, hücre ölümü, bir aşağı yukarı düşük seviyede muhafaza ederken, uygulama randımanını maksimize etmektir. Insan iPSCs ilaç seçimi yardımıyla>% 50 sıcak verim elde edilebilir AAVS1-TALEN plasmidlerin büyük miktarlarda hazırlanması için çok kolay olduğu için, bu TALEN plazmidlerden mRNA'ların için gerekli değildir. Teslimat zorluk bu durumda ~ 10 kb büyük donör plasmidlerden, gelir. PMaxGFP bir ~ 3.5 kb küçük bir plasmid ve bir hücre içine teslim etmek çok kolaydır, çünkü, belirli insan iPSC hatları yerine pMaxGFP transfeksiyon kiti içinde yer kullanarak verme etkinliğini test etmek için AAVS1-CAG-EGFP verici kullanılması önerilir. AAVS1-CAG-EGFP verici AAVS1 mahaline, farklı transgenlerin hedef Şekil 1A'da gösterilen kısıtlama enzimleri kullanılarak modifiye edilebilir. CAG-EGFP yerine 6,4 kb kaseti içeren bir başka 12 kb verici, olmak vardırtr içindeki transfeksiyon ve hedefleme verimini (veriler gösterilmemiştir), elde etmek için başarılı bir şekilde kullanılmıştır. Genel olarak, insan iPSCs zor transfekte hücre tipleri arasında ve GFP + hücrelerinin akış sitometri analizi ile ölçüldüğü gibi büyük plasmidler için uygulama randımanı% 5-10 kadar düşük olabilir. Hücre kümeleri, her bir hücre içine gen düzenleme reaktifleri teslim şansını azaltacaktır, çünkü transfeksiyon verimliliği daha fazla optimizasyonu, tek hücreler, insan iPSCs uygun ayrışma bağlıdır. Bu protokol, nazik ve hızlı çalışma hücre ayrışma reaktif kullanır, ama daha fazla 10 dakika iPSCs tedavi tavsiye edilmez. Genellikle iPSC kültürü% 80'den az birleşik ise, adım 5.1, yumuşak pipetleme ile tek bir hücre içine iPSCs ayırmak için tipik olarak yeterlidir önceden ısıtılmış nazik-hücre ayrıştırma reaktifi ile 5 dakikalık bir inkübasyon oluşturan aşağıdaki. Tüm hücreleri tedavi 10 dakika sonra tek hücre içine ayrışmış edilebilir ise hücre kültürü aşırı con çünküakıcı ya da koloniler çok kompakt hale, sadece daha fazla kuyu / plakaları tek hücre önerilen sayıda toplamak ve arkasında sıkıca bağlı hücreleri bırakın. Mekanik kesme enzimatik ayrışma daha hücrelere daha fazla zararlı olduğu için ağır pipetleme tavsiye edilmez. (Pasaj # 15 öncesi) erken geçiş iPSCs çalışırken hücreler zaten geç geçit iPSCs daha transfeksiyon strese karşı daha duyarlıdır, çünkü nazik ayrışma uygulama hücre hayatta kalmak için çok önemlidir. Hem transfeksiyon ve hücre canlılığı yüksek verim elde etmek zor ise, en yüksek transfeksiyon verimliliği sağlayan uygulama seçin. Transfeksiyondan sonra, hücreler, ilaç seçimi başladığında 3. günde% 50-80 konfluense ulaşacak yoğunlukta kaplama olmalıdır. Her iPSC hattı farklı yetişir beri, post-transfeksiyon kaplama yoğunluğu her hücre hattı için optimize edilmesi gerekebilir. Yüksek yoğunluklu kaplama dru etkinliğini azaltır aşırı konfluansa yol açabilirg-seçimi, aşırı düşük kaplama yoğunluğu gecikmeli kurtarma ve ilaca dirençli koloniler büyümesini neden olabilmektedir. Genellikle 3 milyon başlayan iPSCs hayatta kalma ve özel iPSCs büyümesine bağlı olarak ½ 2 10 cm tabakların için yeterli. Benzer bir şekilde, gerekli olabilir transfekte edilmemiş hücrelerde düşük etkili dozu belirlemek için bir puromisin öldürme eğrisi, bir yeni oluşturulan ya da henüz test edilmemiş iPSC hattı kullanılarak üretilmesi durumunda; iPSC hatları puromisin seçimine kendi duyarlılık önemli ölçüde değişebilir. Bu ilaç seçimi sırasında bazı hücre-dışı matrisler daha iPSC büyümesini desteklemek için görünür, çünkü MEF'ler seçimi için kullanılmıştır. Genel bir kural, ml'lik seçimi tamamlamak için gerekli olan 0.5 ug / 1 ug / ml veya 7 gün puromycin 5 gün en az olarak. Son olarak, koloni toplama tekniği ilaç seçiminden sonra hedeflenen tüm koloniler korumak için çok önemlidir. Nazik pipetleme veya ayrılma reaktif tedavisi eşit birden fazla parçaya koloniler kırmaya yardımcı olurYeni kuyuya dağıtılır ve bu nedenle koloni genişlemesi hızlandırabilir. Bir ayrışma ayıracı kullanılarak kaplama önce aldı koloniler parçalamak için ise gecede bırakılırsa kalan ayrışma reaktif transfer hücreleri öldürebilir, çünkü yeterince tedaviden sonra> 10x ortamı ile seyreltilmiş emin olun. Gerçek deneyler öncesinde toplama koloni pratik, kullanılan tekniği olursa olsun son derece teşvik edilmektedir.
Tarif edilen strateji önemli ölçüde çekme endojen PPP1R2C promoterinin kapalı PAC geninin sentezlenmesini tahrik etmek için bir gen tuzağı yöntemini kullanan zamanda 30 koloni gereği ortaya olmamalıdır. SA-2A PAC seçimi teorik rastgele entegrasyon sadece hücrelerini ortadan kaldırır bağlantılı, ancak ek rastgele entegrasyon (ler) başarılı hedeflenen entegrasyonları taşıyan iPSCs oluşabilir. Çoğu durumda, ilaç seçilmiş klonların yaklaşık% 100 entegrasyon hedef ve ~ bunların% 10-40 Ek rasgele integrati sahipEklentiler. >% 50 çift alel hedefleme meydana olup, burada deney rağmen hedeflenen klonların çoğunluğunun, tek alel hedefleme sahip olma eğilimindedir. Ek rasgele entegrasyon bölgesinin değişken frekanslı, hem de çift alel hedefleme karşı tek oranı kontrol etmek zordur. Bu nedenle, ~ 20 koloni çekme sadece hedefleme klon elde edilebilir tek ya da çift alel sağlamak için önerilir. Başarısız hedefleme deneyleri, hedef hücrelerin transfectability, hayatta kalma ve büyüme oranları yeniden değerlendirilmesi ışığında, belirli bir hücre hattında nükleazlara etkinliği ve donör ve nukleaz hazırlıkları kalitesi çok önce önerilir deneyi yeniden denemeden bütünüyle.
Bu, benzer bir genin tuzağı verici stratejiler diğer aktif genlerin hedeflenmesi için kullanılabilir, ancak seçilebilir gen sentezlenmesini tahrik etmek için, bağımsız bir geliştiriciye ihtiyaç sessiz gen hedefleme için uygun değildir edilebilir olduğu belirtilmelidir. Ayrıca, inci isee AAVS1 güvenli liman açık kromatin yapısı olduğu kabul edilir, bu herhangi bir transgen bu lokustaki güçlü ifade edilebilir garanti etmez. Nitekim, bizim son rapor birkaç zayıf destekleyiciler AAVS1 lokus 14 hedef entegrasyon sonra saptanabilir floresan raportör gen ifadesini harekete koyamadık olduğunu gösterdi.
Bu protokol, insan genomunda iyi okudu güvenli liman odağı hedef iyi valide Talens kullanarak odaklanır. teknikleri son derece tekrarlanabilir ve herhangi bir transgen içeren birçok uygulama kolayca uyarlanabilir. Rasgele entegrasyon kullanılarak genom mühendisliği yöntemleri ile karşılaştırıldığında, hedefleme AAVS1-TALEN aracılığıyla gen son derece etkili ve spesifik olduğunu ve iPSCs durumunda genişletmek ve herhangi bir insan hücre tipi içine ayırt etmek için bir potansiyele sahip stabil bir şekilde flöresanlı hücre ile sonuçlanır. Bu protokol tasarımı ve tasarımcı nükleazlara doğrulama ya da p için hedeflenen iPSC kolonilerinin değerlendirmesini tarif etmez ikenroper kaset entegrasyonu ve hedef dışı analizi, birkaç mükemmel protokolleri detaylı 16-18 metodoloji bu yönlerini tarif etmişlerdir. E8 orta kullanarak besleyici içermeyen iPSC kültür ve Pasajlanması teknikleri de önceki yayın 19 detaylı olarak anlatılmıştır. Yukarıdaki protokol, insan iPSCs arasında AAVS1 güvenli liman gen ilavesi için optimize ederken, herhangi bir hücre tipinde belirli bir homolog rekombinasyon verici kullanılarak sahaya özel nükleaz aracılı gen düzenleme / eklenmesini içeren deneyler için genel bir şablon olarak görev yapabilir.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarlarını olduğunu beyan ederim.
Teşekkürler
This research was supported by the NIH Common Fund and Intramural Research Program of the National Institute of Arthritis, Musculoskeletal, and Skin Diseases.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, *LDEV-Free, 10 ml | Corning | 354230 | Store at -20 °C. |
| DMEM/F-12 | Life Technologies | 11320-033 | Store at 4 °C. |
| Costar 6 Well Clear TC-Treated Multiple Well Plates | Corning | 3506 | |
| Essential 8 Medium | Life Technologies | A1517001 | Store basal medium at 4 °C. Store supplement at -20 °C. |
| Y-27632 dihydrochloride | Tocris | 1254 | Store at room temp. Once dissolved in H2O, store at -20 °C. |
| Sodium Chloride | Sigma | S5886-500G | |
| UltraPure 0.5 M EDTA, pH 8.0 | Life Technologies | 15575-020 | |
| DPBS, no calcium, no magnesium | Life Technologies | 14190-250 | |
| 100 mm TC-Treated Culture Dish | Corning | 430167 | |
| DR4 MEF 2M IRR - Academic | GlobalStem | GSC-6204G | Store in liquid Nitrogen. |
| DMEM, high glucose, pyruvate | Life Technologies | 11995-040 | Store at 4 °C. |
| Defined Fetal Bovine Serum, US Origin | HyClone | SH30070.03 | Store at -20 °C. Thaw at 4 °C overnight and aliquot. Store aliquots at -20 °C until needed. |
| MEM Non-Essential Amino Acids Solution (100X) | Life Technologies | 11140-050 | Store at 4 °C. |
| 4D-Nucleofector Core unit | Lonza | AAF-1001B | part of the electroporation system |
| 4D-Nucleofector X unit | Lonza | AAF-1001X | part of the electroporation system |
| P3 Primary Cell 4D-Nucleofector X Kit L (24 RCT) | Lonza | V4XP-3024 | Upon arrival, remove Primary Cell Solution and supplement and store at 4 °C. |
| StemPro Accutase Cell Dissociation Reagent | Life Technologies | A1110501 | Store at -20 °C. Thaw overnight at 4°C and warm an aliquot in a 37 °C water bath before use. |
| NutriStem XF/FF Culture Medium | Stemgent | 01-0005 | Store at -20 °C. Thaw overnight at 4 °C |
| AAVS1 TALENs (pZT-AAVS1-L1 and pZT-AAVS1-R1) | Addgene | 52637 and 52638 | |
| [header] | |||
| AAVS1-CAG-EGFP Homologous Recombination donor | Addgene | 22212 | |
| Puromycin Dihydrochloride | Life Technologies | A11138-03 | Store at -20 °C. Prepare working aliquots of 1 mg/ml in ddH2O. |
| Disposable Borosilicate Glass Pasteur Pipets | Fisher Scientific | 13-678-20A | |
| Sorvall Legend XTR (Refrigerated), 120 V 60 Hz | Thermo Scientific | 75-004-521 | |
| TX-750 4 × 750 ml Swinging Bucket Rotor | Thermo Scientific | 75003607 | |
| Trypan Blue Solution, 0.4% | Life Technologies | 15250-061 | |
Referanslar
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Hentze, H., Graichen, R., Colman, A. Cell therapy and the safety of embryonic stem cell-derived grafts. Trends Biotechnol. 25 (1), 24-32 (2007).
- Smith, J. R., et al. Robust, persistent transgene expression in human embryonic stem cells is achieved with AAVS1-targeted integration. Stem Cells. 26 (2), 496-504 (2008).
- Lombardo, A., et al. Site-specific integration and tailoring of cassette design for sustainable gene transfer. Nat Methods. 8 (10), 861-869 (2011).
- Ogata, T., Kozuka, T., Kanda, T. Identification of an insulator in AAVS1, a preferred region for integration of adeno-associated virus DNA. J Virol. 77 (16), 9000-9007 (2003).
- Zwaka, T. P., Thomson, J. A. Homologous recombination in human embryonic stem cells. Nat Biotechnol. 21 (3), 319-321 (2003).
- Urbach, A., Schuldiner, M., Benvenisty, N. Modeling for Lesch-Nyhan disease by gene targeting in human embryonic stem cells. Stem Cells. 22 (4), 635-641 (2004).
- Hockemeyer, D., et al. Efficient targeting of expressed and silent genes in human ESCs and iPSCs using zinc-finger nucleases. Nature biotechnology. 27 (9), 851-857 (2009).
- Zou, J., et al. Gene targeting of a disease-related gene in human induced pluripotent stem and embryonic stem cells. Cell stem cell. 5 (1), 97-110 (2009).
- Hockemeyer, D., et al. Genetic engineering of human pluripotent cells using TALE nucleases. Nature. 29 (8), 731-734 (2011).
- Sanjana, N. E., et al. A transcription activator-like effector toolbox for genome engineering. Nature protocols. 7 (1), 171-192 (2012).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Ding, Q., et al. Enhanced efficiency of human pluripotent stem cell genome editing through replacing TALENs with CRISPRs. Cell stem cell. 12 (4), 393-394 (2013).
- Luo, Y., et al. Stable Enhanced Green Fluorescent Protein Expression After Differentiation and Transplantation of Reporter Human. Induced Pluripotent Stem Cells Generated by AAVS1 Transcription Activator-Like Effector Nucleases. Stem Cells Transl Med. 3 (7), 821-835 (2014).
- Zou, J., et al. Oxidase-deficient neutrophils from X-linked chronic granulomatous disease iPS cells: functional correction by zinc finger nuclease-mediated safe harbor targeting. Blood. 117 (21), 5561-5572 (2011).
- Luo, Y., Rao, M., Zou, J. Generation of GFP Reporter Human Induced Pluripotent Stem Cells Using AAVS1 Safe Harbor Transcription Activator-Like Effector Nuclease. Curr Protoc Stem Cell Biol. 29, 5A.7.1-5A.7.18 (2014).
- Peters, D. T., Cowan, C. A., Musunuru, K. Genome editing in human pluripotent stem cells. StemBook. , Harvard Stem Cell Institute. Cambridge, MA. Available from: http://www.stembook.org/node/1438 (2008-2013).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Beers, J., et al. Passaging and colony expansion of human pluripotent stem cells by enzyme-free dissociation in chemically defined culture conditions. Nat Protoc. 7, 2029-2040 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır