Method Article
형질, 선택 및 인간 유도 만능 줄기 세포의 콜로니 따기는 AAVS1 세이프 하버 (Safe Harbor)에 GFP 유전자 TALEN는 타겟팅
요약
TALEN-mediated gene editing at the safe harbor AAVS1 locus enables high-efficiency transgene addition in human iPSCs. This protocol describes the procedures for preparing iPSCs for TALEN and donor vector delivery, transfecting iPSCs, and selecting and isolating iPSC clones to achieve targeted integration of a GFP gene to generate reporter lines.
초록
Targeted transgene addition can provide persistent gene expression while circumventing the gene silencing and insertional mutagenesis caused by viral vector mediated random integration. This protocol describes a universal and efficient transgene targeted addition platform in human iPSCs based on utilization of validated open-source TALENs and a gene-trap-like donor to deliver transgenes into a safe harbor locus. Importantly, effective gene editing is rate-limited by the delivery efficiency of gene editing vectors. Therefore, this protocol first focuses on preparation of iPSCs for transfection to achieve high nuclear delivery efficiency. When iPSCs are dissociated into single cells using a gentle-cell dissociation reagent and transfected using an optimized program, >50% cells can be induced to take up the large gene editing vectors. Because the AAVS1 locus is located in the intron of an active gene (PPP1R12C), a splicing acceptor (SA)-linked puromycin resistant gene (PAC) was used to select targeted iPSCs while excluding random integration-only and untransfected cells. This strategy greatly increases the chance of obtaining targeted clones, and can be used in other active gene targeting experiments as well. Two weeks after puromycin selection at the dose adjusted for the specific iPSC line, clones are ready to be picked by manual dissection of large, isolated colonies into smaller pieces that are transferred to fresh medium in a smaller well for further expansion and genetic and functional screening. One can follow this protocol to readily obtain multiple GFP reporter iPSC lines that are useful for in vivo and in vitro imaging and cell isolation.
서문
배아 줄기 세포와 유사한 유도 만능 줄기 세포로 (iPSCs)를 인간의 체세포를 재 프로그램 할 수있는 기능이 처음 다카하시 등에 의해 발견되었다. 2007 1. 레트로 바이러스는 네 개의 전사 인자를 발현하는 형질 도입 인간 피부 섬유 아세포 (소위 불리는 야마나카는 OCT3 요인 / 4, SOX2, C-Myc와, 그리고 Klf4)는 형태, 증식, 유전자 발현 및 후생 유전 학적 상태에 따라 인간 배아 줄기 세포 (인간 배아 줄기)에 매우 유사한 것으로 나타났다; 결정적 iPSCs 또한 모든 세 배엽 (1)의 세포로 분화 할 수있다. iPSCs의 증식 잠재력과 차별화 용량은 그들에게 매우 매력적인 도구를 만드는; 특정 질병을 앓고있는 환자로부터 세포를 재 프로그래밍함으로써 iPSCs 체외 질병 모델 시스템과 같은 잠재적 치료제로서 모두 사용될 수있다.
후자의 목적을 위해, 몇 가지 문제 iPSCs의 잠재력하기 전에 해결해야임상 환경에서 실현 될 수있다; 시험 관내 배양 된 인간 배아 줄기 및 iPSCs, 리 프로그래밍 및 세포 유지하는 동안 이종 유도체의 사용의 발암 가능성, 및 생체 내에서 이식 된 세포를 추적 할 필요성은 Hentze 외 의해 검토 다 능성 줄기 세포의 임상 적용 (모든 중요한 장애물이다. 2). 분화 된 세포를 이식 후 추적의 필요성에 이상적인 솔루션에 관계없이 응용 프로그램의 침묵과 잡색 레지스트 시각적으로 검출 마커를 포함한다. 외래 DNA가 안전한 항구 궤적에 도입 될 때 통합 된 유전자의 강력하고 지속적인 표현은 가장 쉽게 달성 할 수있다; 즉, 통합 벡터의 충분한 전사를 활성화 이웃 게놈 부위에서 유전자 발현의 3 교란을 완화하는 동시에. 아주 잘 그것의 발견 이후 특징으로 한 그러한 사이트는 아데노 관련 바이러스 integr입니다단백질 인산 가수 분해 효소 (1) 규제 서브 유닛 12C (PPP1R12C) 유전자의 첫 번째 인트론에 ATION 사이트 1 (AAVS1). 이 궤적 유지 및 연장 시간을 통해 통합 된 유전자의 강력한 표현 문화의 체외 분화 3뿐만 아니라, 전사 섭 4에서 유전자를 둘러싼 보호하기 위해 허용 할뿐만 아니라 보였다; 두 기능으로 인해 AAVS1 사이트 (5)의 측면에 내인성 염색질 절연체 요소의 존재에 의한 것으로 생각된다.
방금 지난 10 년간 게놈 엔지니어링 툴의 발전은 크게 임의의 세포 유형의 유전 조작이 달성 될 수있는 용이성 및 효율성을 촉진 하였다. 초기의 성공적인 실험는 ESC -6,7- 타겟팅 유전자를 달성하기 위해 도입 된 도너 내인성 상동 재조합 (HR)의 상당히 낮은 수준에 의존하지만, 예컨대 징크 핑거 뉴 클레아 제 (ZFNs), 유의 사항과 부위 - 특이 적 뉴 클레아 제의 사용ficantly 같은 실험 8,9의 효율성을 크게 증가 이중 가닥 DNA 휴식의 생성을 통해 상동 재조합을 유도한다. 모두 전사 활성제와 같은 이펙터 식물 병원성 크 산토 모나스 장군의 (이야기)와 원핵 클러스터 정기적으로 interspaced 짧은 회문 반복 (CRISPR) 효율적인 사이트 별 디자이너 클레아 제에 / Cas9 시스템의 용도 변경은 만능 줄기 세포에서 표적 유전자를했다 접근 실행 가능한 방법론 10-13.
최근의 논문은 이야기 클레아 제 (TALENs) (14)를 사용하여 인간 iPSCs의 AAVS1 안전 항구의 궤적에 녹색 형광 기자 카세트의 안정적 통합을위한 효율적인 방법을 설명했다. 이러한 목표 iPSCs는의 유용성에 대한 강력한 증거를 제공, 심지어 심근 경색 (MI)의 마우스 모델로 심근 세포 이식에 관한 분화 후 자신의 형광을 유지안정적으로 형광 만능 줄기 세포 (14). 타겟팅 콜로니를 수득하기 위해, 유전자 트랩 방법 플라이 싱 - 억 셉터 (SA)는, 2A 자체 절단 단백질 서열은 내인성 PPP1R12C 프로모터의 제어 하에서 퓨로 마이신 N- 아세틸 전이 효소 (PAC) 유전자를 배치 상기 사용 하였다; 따라서, AAVS1 유전자좌 DNA 공여체를 도입 한 경우에만 iPSCs는 퓨로 마이신 내성에 기초하여 선택 가능하게 이들을 렌더링 PAC 표현; (그림 1, 15). 이 프로토콜에 기반 iPSCs를 AAVS1-GFP iPSCs가 TALENs와 iPSCs를 형질 감염의 과정과 AAVS1 안전 항구의 궤적에 4.2kb DNA 단편을 통합 할 수있는 9.8 킬로바이트 기증자를 포함, 최근 종이 (14)에보고 생성 선택하는 절차의 자세한 사항 퓨로 마이신 저항 및 클론 확장을위한 따기 식민지. 본원에 설명 된 기술들은 많은 유전체 공학 실험에 적용 할 수있다.
프로토콜
1. 지하실 막 매트릭스의 준비 및 plasticware에의 코팅
- 얼음에 -20 ° C에서 냉동 기저막 매트릭스 스톡을 넣고 4 ℃에서 밤새 해동.
- 해동 후, 미리 차게 에펜 도르프 튜브에 기저막 매트릭스의 피펫 2 mg을 분취. 필요할 때까지 -20 ° C에서 이러한 보관하십시오.
- , 기저막 매트릭스 코팅 된 플레이트를 준비 에펜 도르프 튜브 사라 얼음의 마지막 조각 (보통 2 ~ 내 시간)까지 얼음에 하나 나누어 해동합니다.
- 해동 후, 기저막 매트릭스 코팅 용액을 차가운 (5 ° C) DMEM / F12 12 ml의 기저막 매트릭스를 추가한다.
- 적절한 배양 용기에 기저막 매트릭스 솔루션을 추가한다. 6 잘 플레이트를 들어, 잘 당 1 ml의 분배. 기저막 매트릭스 솔루션은 완전하게 잘 다루고 있는지 확인하기 위해 판을 소용돌이.
- 파라 필름은 기저막 매트릭스 코팅 플레이트 / 접시를 밀봉하고, 루 부화사용하기 전에 1 시간 동안 m 온도. 또한, 매장 기저막 매트릭스 코팅 플레이트 / 4 ° C에서 요리와 코팅 2 주 이내에 사용한다.
참고 : 건조를 방지하기 위해 기저막 매트릭스 코팅 플레이트 / 접시에 추가 DMEM / F12를 추가합니다. 39 ° C 보관 기저막 매트릭스 - 코팅판 / 접시를 사용하기 전에 생물학적 안전 캐비넷에 배치하고 적어도 30 분 동안 실온에 올 수있다. - 완전 배지 및 세포의 첨가 이전 대기음 기저막 매트릭스.
E8 매체의 제조 2
- 4 ℃에서 하룻밤 E8 보충을 해동하여 E8 문화 매체를 준비합니다.
- 500 ml의 재고에서 E8 기초 10 ml의 배지를 제거하고 폐기합니다.
- 직접 E8 기초 배지 490 ml의에 E8 보충의 전체 10 ml의 유리 병을 피펫. 반복 온도 변동 공단에서 bFGF에 저하 될 수로서, 37 ° C 물욕없는 따뜻한 완전한 E8 매체를 수행TE E8 매체.
- 보충 또한 2 주 이내에 완료 E8 매체를 사용합니다.
iPSCs 3. 해동
- 드라이 아이스에 액체 질소와 장소에서 냉동 iPSCs의 병을 제거합니다.
- 빠르게 37 ° C의 물을 욕조에 유리 병을 해동; 얼음 유적의 아주 작은 조각까지 수조의 유리 병을 소용돌이 친다.
- 생물 안전 캐비닛에 70 % 에탄올 및 전송을 유리 병 스프레이.
- 직접 유리 병에 실온 E8 매체 적가의 1 ML을 추가합니다.
- 2 ㎖를 피펫을 사용하여, 15ml의 원뿔형 튜브에 E8 배지 9 ㎖ 중에 세포 현탁액을 적가 옮긴다. 세포와 매체가 신속하게 잘 혼합되도록 자주 튜브를 소용돌이.
- 5 분 동안 200 XG에 세포를 원심 분리기.
- 상등액을 흡인하고, 10 μM Y-27632로 보충 E8의 적절한 부피 세포 펠렛을 재현 탁.
- 지하의 적절한 숫자로 셀을 추가 membran하룻밤 37 ° C, 5 % CO 2 배양기에서 전자 매트릭스 코팅 우물과 장소. 그것은 해동 후 신속한 복구를 가능하게하는 6 웰 플레이트의 웰 당 최소 0.2 × 10 6 IPSC을 도금하는 것이 좋습니다.
4. 유지 보수 및 iPSCs의 일상과 Passaging
- 매일 E8 매체를 새로 고칩니다.
- 거꾸로 현미경으로 형태와 세포의 포화 상태를 모니터링합니다. 높은 품질의 iPSCs는 별개의 테두리 평면 식민지에서 성장; 개별 식민지는 "조약돌 같은"모양을 가지고있다.
- 통로 iPSCs 세포들은 70 % ~ 포화 상태에 도달 할 때.
- 0.9 g의 NaCl 500 ML의 DPBS에 500 ㎕의 0.5 M EDTA를 추가하여 EDTA의 계대 솔루션을 준비합니다. NaCl을 살균하고, 진공 필터를 용해 잘 섞는다. 계대 이전에 37 ° C의 물을 용기에 계대 용액의 분취 량을 따뜻하게.
- 통로, 기음 문화 매체를 소비하고 따뜻한 싶어서 같은 부피로 한 번 세포를 씻어솔루션을 징. 코트에 대기음, 피펫 충분히 EDTA 계대 솔루션 세포 (6 웰 플레이트의 웰 당 1 mL)를 첨가 하였다.
- 거꾸로 현미경으로 세포를 놓고 IPSC 식민지를 관찰합니다. 자란 콜로니 테두리 내의 구멍의 모양은 2 내지 5 분 이내에 분명해질 것이다.
- 조심스럽게 EDTA의 계대 솔루션을 대기음.
- 직접 잘 계대 할 각에 고압 (6 웰 플레이트를 사용하는 경우) 10ml를 피펫을 사용하여, E8 매체의 4 ml의 분배.
- IPSC 덩어리를 수집하고, 1 ~ 분할 비에 따라 웰의 적절한 개수로 분할 : 1:12 8. 오버 피펫으로 세포 덩어리의 세분화는 가난한 생존 발생합니다하지 마십시오.
- 인큐베이터에서 플레이트를 배치하고, 세포를 분산시키는 전후 및 좌우로 수회 플레이트 바위.
Tansfection에 대한 MEFs에와 iPSCs 5. 준비
- transfectio하기 48 시간 전에N, 통로 iPSCs는 ~ 1 : 지하실 막 매트릭스 코팅 6 웰 플레이트의 네 개 이상의 우물에 6 그들은 이일 때문에 70 % 융합 될 수 있도록.
- 다음 날, 10 % FBS 및 1X MEM-NEAA 보충 DMEM (높은 포도당)로 구성된 MEF 매체에 DR4 MEFs에 해동.
- ~ 2 × 104 세포 / cm 2에서 2 개의 10-cm 요리에 플레이트 DR4 MEFs에와 하룻밤에 37 ° C를 품어.
- 형질의 날, 30 분 iPSCs에 형질 전환을 수행하기 전에 10 μM Y-27632 보충 E8에 MEF 매체를 변경합니다.
- 옵션 : iPSCs 후 형질의 유세포 분석이 필요한 경우, 실온에서 기저막 매트릭스 코팅 4 ° C 접시와 장소를 제거합니다.
- 선택적 : 4 시간에 형질 감염 전 10 μM의 최종 농도 Y-27632 미리 형질 IPSC 배양을 보충.
6. 부드러운 세포 해리 시약 처리차 형질은 iPSCs의 일렉트로 시스템을 사용하여
- 4 ° C에서 P3 일차 전지 형질 솔루션을 꺼내 ~ 실온에 30 분을 제공 할 수 있습니다. 사용하기 전에 형질 전환 솔루션으로 전체 100 μL 보충제를 추가합니다.
- 37 ° C의 물을 욕조에 따뜻한 부드러운 세포 분리 시약.
- AAVS1 TALENs (PZT-AAVS1-L1 및 PZT-AAVS1-R1) -20 ° C에서와 AAVS1 - CAG-EGFP 기증자를 구합니다.
- 인큐베이터에서 iPSCs를 제거하고 DPBS 한 번 씻는다.
- 웰 당 부드러운 세포 해리 시약 1 mL를 넣고 5 분 동안 37 ° C에서 배양 한 iPSCs, 또는 세포의 50 % 초과가 배양 용기로부터 해리 될 때까지.
- 위로 배양 용기에 남아있는 모든 세포를 해리하고, IPSC 덩어리를 깨고 P1000 피펫을 사용하여 몇 번 아래로 세포를 피펫.
- 푸르트에 10 ml의 피펫을 사용하여 각 웰에 E8 매체의 2 mL를 넣고 피펫 위아래로 여러 번어 하나의 세포로 세포 덩어리들을 분해
주 : 세포 덩어리가 충분히 세분화하지 않다면 형질 효율이 크게 감소한다. - 3 분 100 XG에 15 ML 원뿔 관에서 iPSCs, 원심 분리기를 수집합니다.
- E8 매체의 최소량 대기음 상등액과 세포를 재현 탁.
- 중요한 얼룩과 같은 0.4 % 트리 판 블루의 신청 후 혈구를 사용하여 세포를 계산합니다. ( "덩어리"1-3 셀)을 계산하는 동안 세포가 충분히 해리되어 있는지 확인합니다.
- 두 15 ML 원뿔 튜브에 각각 3 × 10 6 세포를 분배하고, 3 분 동안 100 XG에서 다시 스핀 다운.
주 : 저속 원심 분리 세포 스트레스를 줄이고 전기 전에 iPSCs 쉽게 재 현탁한다. - 인간 배아 줄기 세포주 H9 (프로그램 CB-150)에 대한 세포 형 특정 프로그램에 전기 천공 시스템을 설정한다.
- 원심 분리 후, CEL에서 뜨는을 대기음L 펠렛. 한 펠렛, 제어 샘플로 HR 기증자의 10 μg의를 추가합니다. 다른 펠렛의 5 μg의와 함께 HR 기증자의 10 μg의를 추가, 각 실험 시료로 TALEN (PZT-AAVS1-L1 및 PZT-AAVS1-R1).
- P3 일차 세포 형질 감염 용액 100 ㎕ 각각의 세포 펠렛을 재현 탁하고, 큐벳에 옮긴다.
- 형질 전환을 수행하고 즉시 각 큐벳에 실온 E8 매체의 500 μl를 추가합니다.
- 단계 5.4에서 준비 DR4의 MEFs에를 포함 한 10 cm 접시에 형질 전환 iPSCs 적하을 전송합니다.
- 옵션 : 형질 전환 효율의 anaylsis 유동 세포 계측법이 필요한 경우 기저막 매트릭스 코팅 6 웰 플레이트 잘 하나에 각 실험에서 몇 방울을 추가합니다.
- 반복은 모두 샘플을 완료 6.15-6.17 단계를 반복합니다. 다음 날, DPBS로 세포를 두 번 씻어 E8보다 피더에 더 IPSC 문화를 지원하기 위해 나타납니다 NutriStem에 문화 매체를 전환합니다.
- TR48 시간 포스트 형질 72에서 ansient EGFP 발현 피크; 원하는 형질 전환 효율을 평가.
표적으로 iPSCs 7. 퓨로 마이신 선택
- iPSCs는 70 % 포화 상태에 도달하면 퓨로 마이신 선택을 형질 전환 후 72 시간을 시작합니다.
- NCRM5 iPSCs를 들어, NutriStem 배양 배지로 희석하여 0.5 ㎍ / ㎖의 퓨로 마이신 (1/2 전체 용량)에서 퓨로 마이신 선택을 시작합니다. 최적의 퓨로 마이신 농도는 0.25에서 일부 IPSC 라인 1 ㎍ / MLL에 따라 달라질 수 있습니다.
- 매일 매체를 새로 고침 3 일간 NutriStem + 0.5 ㎍ / ㎖의 퓨로 마이신의 문화 iPSCs.
- 삼일 후, 1 ㎍ / ml의 퓨로 마이신의 농도를 증가시킨다.
- / ㎖의 퓨로 마이신 선택 1 μg의 아래 문화 iPSCs 다른 7~8일에 대한, 또는 때까지 별개의 식민지는 식민지 따기위한 충분 나타납니다.
8. 식민지 따기 및 대상 iPSCs의 확장
- 사용 기저막코팅하는 매트릭스로 각 웰 (12 ㎖의 DMEM / F12에 희석이 MG 기저막 매트릭스) 기저막 매트릭스 코팅 용액 50 μL를 분배하여 96- 웰 플레이트. 4 ° C에서 하룻밤 사용하기 전에 판을 보관하십시오.
- 기저막 기질 - 코팅 플레이트를 실온으로 온시킨 후, 기저막 매트릭스 대기음 10 μM Y-27632를 각 웰에 100 ㎕를 첨가하여 분배 E8.
- 생물 안전 캐비닛에 거꾸로 현미경을 배치하고 소독 70 % EtOH로 가볍게 스프레이.
- 끝에 작은 "훅"가 이상적인 식민지 따기 도구를 얻기 위해 분젠 버너 위에 유리 파스퇴르 피펫을 당깁니다. 70 % EtOH로 소독하고 건조 후드에 배치합니다.
- 인큐베이터에서 대상 IPSC 식민지를 포함하는 요리를 제거하고 현미경으로 후드에 배치합니다.
- 식민지 따기 도구를 사용하여 식민지 국경 주위에 원을 추적하여 iPSCs를 선택합니다.
- 부드럽게 긁어 판의 표면에서 IPSC 식민지를 제거 식민지 따기 도구의 "훅"를 사용합니다. 큰 콜로니를 들어, 콜로니 재 도금 후 세포 성장을 용이하게 분기에 콜로니 피킹 도구 X 드로잉.
- 세포 덩어리가 분리 자유롭게 떠되면, iPSCs를 수집 ~ 30 μl를 설정 P200의 피펫을 사용합니다. 직접 96 웰 플레이트에 플레이트 세포.
- 옵션 : 다음 37 ℃에서 5 분 동안 소화 50 μL 부드러운 세포 분리 시약을 추가, 에펜 도르프 튜브에 iPSCs를 수집 ~ 5 μL로 설정 P20 피펫을 사용합니다. 소화 후, 부드러운 세포 해리 시약 희석시키고 5 분 동안 표준 테이블 탑 마이크로 원심 200 XG에서 세포를 스핀 다운 에펜 도르프 튜브에 500 μL E8 배지를 추가한다. 그런 매체의 대부분을 대기음 ~ 재현 탁하고 96 웰 플레이트에 세포를 전달하는 30 μl를 떠난다.
참고 :이방법은 세포 덩어리와 촬상 콜로니의 빠른 팽창 해리를 촉진 할 것이다. - IPSC 식민지 충분한 수의 수집 될 때까지 식민지 따기 계속 (약 실험 당 20 ~ 30 식민지 권장).
- 식민지 따기 후, 하룻밤 인큐베이터에서 96 웰 플레이트를 배치합니다. 전체 E8 매체 다음날, 문화 ~ 70 %까지 합류로 새로 고칩니다.
- 로 96 웰에서 통과 세포를 24- 웰, 다음에 6 자, 단계 4.5-4.10에 설명 된대로.
주 : 6- 웰 플레이트 웰보다도 작은 사용시 EDTA 용액 및 E8 매체의 볼륨이 감소 될 비례한다. - 무작위로 삽입 된 벡터 (16)의 타겟 카세트 통합 및 부재를 확인하기 위해 접합 PCR 남부 오 점 분석에 의해 표적으로 성공을 평가합니다.
결과
프로토콜의 시각화는 iPSCs가 NutriStem에 대한 하나 E8 녹색 또는 청색에 의해 강조 다른 배지에서 배양있는 기간으로, 그림 2에서 제공됩니다. 그것은 단지 고품질 iPSCs를 형질 것이 중요하다; 일상적인 유지 보수 전반에 걸쳐 배양 접시를 검토하고 IPSC 문화는 조약돌 모양의 형태를 베어링 주로 별개의 식민지 (그림 3A)가 들어 있는지 확인; 분화 세포는 배양의 10 % 이상을 점유 안된다. iPSCs의 Transfectability 인해 작은 크기로 전형적으로 달성 가능한 최대의 효율을 나타낸다 PMAX-GFP로 형질 감염 작은 PMAX-GFP 벡터 (도 4A-B)를 사용하여 평가 및 최적화된다. 예를 들어, 우리는 PMAX-GFP (도 4b)로 68.6 %의 형질 전환 효율을 달성 하였다. AAVS1 안전한 항구를 대상으로 지정하려면, iPSCs는 부드러운 단일 셀 해리 시약을 사용하여 계대하고 AAVS1-TALENs 및 AAVS1-로 형질CAG-EGFP (그림 1A에 묘사 된 플라스미드). 형질 전환 된 iPSCs는 다음 DR4 MEFs에 (그림 3B)의 적절한 밀도에 도금되어있다. 48-72시간 후 형질 (그림 3C)에서 AAVS1 - CAG-EGFP 피크의 과도 발현; 원하는 경우, 형질 iPSCs의 작은 부분은 FACS 분석 될 수있다. NCRM5 iPSCs는 AAVS1-CAG-EGFP 공여체 (도 4C)를 사용하여 60.9 %의 효율로 형질 감염 될 수있다. 형질 전환 효율은 크게 다를 수 있습니다; GFP + 부분도 낮은 10 % 인 것을 특징으로 실험을 위해, 퓨로 마이신 선택으로 계속합니다. 퓨로 마이신 선택을 수행 한 후, 균일 한 형광을 표시하는 개별 클론 식민지 따기 (그림 3D) 충분히 커야합니다. 클론을 선택하려면 적절한 식민지 낮은 배율 (그림 3E) 아래에 먼저 추적에 의해 분리하고 (그림 3 층-G)를 등분한다. 등분 식민지 부드럽게 긁어된다배양 용기 (그림 3H)에서 D. P200 피펫을 사용하여, 세포 덩어리는 기저막 매트릭스 - 코팅 96- 웰 플레이트의 한 웰에 전사된다. iPSCs 도금 2-4시 (그림 3I) 내에 첨부해야합니다. 부착 24 시간 내에 관찰되지 않으면, 기저막 매트릭스 - 코팅 또는 Y-27632 치료 가능성 차선시켰다 지하실 막 매트릭스 코트 새로운 96 웰 플레이트와 더 이상 식민지를 따기 전에 신선한 E8 + 10 μM Y-27632를 준비합니다. 일단 96 웰 형식으로, IPSC 클론 확장하고 GFP (그림 4D-E)의 안정적이고 균일 한 표현을 보여야 대상.

그림 1 : 유전자가 벡터를 대상으로하고 개략적 인을 대상으로. 본 연구에 사용 AAVS1-CAG-EGFP의 (A) 표현 및 PZT-AAVS1-L1 / R1 TALENs 플라스미드. SA-AAVS1-CAG-EGFP 플라스미드의 2A 요소는 통합 타겟 이벤트에 퓨로 마이신 N- 아세틸 전이 효소 (PAC) 유전자 발현을 제한하는 데 사용 및 스플 라이스 - 수용체 2A 자체 절단 펩티드를 나타낸다. 닭 β 액틴 글로빈 (CAG) 프로모터 EGFP의 발현을 구동하기 위해 사용된다. (B)는 PPP1R12C 유전자의 인트론 1 내에 포함 AAVS1 안전 항구는, 이중 가닥 DNA 휴식을 생성하는 TALENs를 사용하여 타겟팅된다. 이 후 수리 기질로 AAVS1 - CAG-EGFP 기증자 (절단 사이트를 측면에서는 베어링 동성 무기)를 사용 상동 재조합 (HR) 수리 기계를 활성화합니다. 카세트 통합되어 PAC 유전자는 내인성 PPP1R12C 프로모터의 제어하에 배치된다.
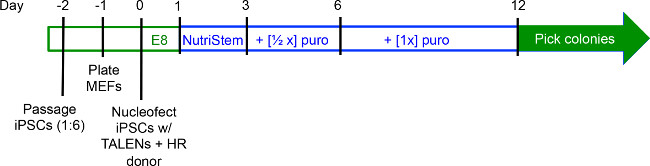
그림 2. 유전자 대상으로 실험 타임 라인. iPSCs는 배양70 %의 포화 상태와에 1 ~ 계대 : 1 일 -2 (D-2) 6. MEFs에 D-1은 플레이 팅하고, 수집하고, iPSCs D0에서 형질. D1에서 NutriStem 매체로 전환하고, 퓨로 마이신이 D3에서 배지에 첨가되기 전에, 두 iPSCs 일 이상 배양 하였다. 식민지는 일반적으로 D12에 의해 따기위한 준비가되어 있습니다. NutriStem 문화의 기간은 파란색에있는 동안 iPSCs는 E8 배지에서 배양하는 동안, 기간은, 녹색으로 강조 표시됩니다.

그림 3 : 대표 이미지를 대상으로 IPSC 유전자 고품질 iPSCs의 (A) 단계 이미지.. 위상 밝은 테두리와 조약돌 같은 형태를합니다. (B) DR4 MEFs에 2 이십사시간 해동 후 2 × 104 세포 / cm에서 도금. (C)를 72 시간이라 후 형질을 EGFP + 세포는 분명히 알 수 있습니다 형광 MICR 하에서 보았을 때oscope. 십사일 ~에 대한 퓨로 마이신 기반 선택 후 (D), 균일 한 GFP의 형광을 표시 식민지 뽑 정도로 크다. (EH) 식민지 따기 프로세스의 대표 이미지. 식민지 작은 세포 덩어리를 얻을 수를 등분하여 그 식민지의 개요,에 의해 먼저 뽑아 파스퇴르 피펫을 사용하여 선택됩니다. (나는) IPSC 식민지가 2에서 96 웰 플레이트의 기저막 매트릭스 코팅 표면에 부착 고른 4 시간. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 : 형질 전환 효율과 클론 대상 iPSCs의 FACS 분석. 임의의 플라스미드 형질 감염없이 (A) 대조군 NCRM5 iPSCs. (B) NCRM5작은 테스트 벡터 PMAX-GFP로 형질 iPSCs는 (C) AAVS1 - CAG-EGFP 플라스미드의 과도 식입니다. FACS는 GFP의 발현을 분석 FACS에 의해 평가된다. (D) NCRM5-AAVS1 - CAG-EGFP 클론 표시 FACS로 분석으로 균일하게 긍정적 인 EGFP 식입니다. C에 비해) 분석 iPSCs의 꽉 클러스터링을합니다. (확장 NCRM5-AAVS1 - CAG-EGFP 대상으로 클론의 E) 형광 이미지.
토론
(1) 효율적으로 형질 전환에 의해 iPSCs에 TALEN 및 기증자 플라스미드를 전달; AAVS1 안전 항구의 성공적인 세대를위한 가장 중요한 단계는 인간의 iPSCs가되는 대상 (2) 형질 전환 후 형질 전환 및 도금 밀도 전에 단일 세포로 iPSCs의 분리를 최적화; (3) 투여 량 및 IPSC 라인의 성장에 기초한 약물 - 선택 시간을 최적화; (4)주의 깊게 해부 및 대상 식민지를 따기와 / 웰 새 접시에 전송. Hockemeyer의 용지 (10)에 사용 된 유사한 방법에 비해,이 프로토콜에서 사용 iPSCs의 수를 줄이는 데 도움이 오픈 소스 AAVS1-TALENs 쌍 상이한 IPSC 해리 시약과, TALENs 및 도너 벡터를 제공하는 다른 형질 전환 장치를 사용 실험 높은 형질 전환을 달성하고 효율성을 대상으로한다.
인간 iPSCs에서 고효율 유전자 편집을 달성하기 위해, 제 EDI 유전자의 전달을 최적화하기 위해 필수적급성 세포 사멸에게 전달 방법의 균형을하면서 팅 시약 (DNA / RNA)이 시약은 iPSCs에 발생합니다. 목표는 세포 사멸의 참을 낮은 수준을 유지하면서 전달 효율을 최대화하는 것이다. 그것이 인간 iPSCs 약물 선택의 도움으로> 50 % HR 효율을 달성 할 수 AAVS1-TALEN 플라스미드를 대량 제조하는 것은 매우 용이하므로, TALEN 플라스미드로부터 mRNA를 할 필요는 없다. 배달의 도전이 경우 ~ 10 KB입니다 큰 기증자 플라스미드에서 온다. pMaxGFP가 ~ 3.5 킬로바이트 작은 플라스미드 및 세포로 전달하는 것은 매우 쉽습니다 때문에 그것은, 특정 인간의 IPSC 라인보다는 pMaxGFP는 형질 전환 키트에 포함 된 사용하여 전달 효율을 테스트 AAVS1-CAG-EGFP 기증자를 사용하는 것이 좋습니다. AAVS1-CAG-EGFP 공여체 AAVS1 궤적에 다른 유전자를 대상으로도 1a에 도시 된 제한 효소를 사용하여 변형 될 수있다. CAG-EGFP를 대체하는 6.4 킬로바이트 카세트를 포함하는 다른 12킬로바이트 기증자는 할 수있다EN 유사한 형질 및 타겟팅 효율 (데이터는 도시하지 않음)을 성공적으로 달성하기 위해 사용된다. 일반적으로, 인간이 iPSCs 어려운 세포 유형 트랜 들이며 GFP + 세포의 유세포 분석에 의해 측정 한 큰 플라스미드위한 전달 효율이 5 ~ 10 % 정도로 낮을 수있다. 세포 덩어리가 각 셀에 유전자 편집 시약을 전달하는 기회를 감소시킬 것이기 때문에 형질 전환 효율의 최적화는 또한, 단일 세포로 인간 iPSCs의 적절한 분리에 의존한다. 이 프로토콜은 부드럽고 빠르게 작동 세포 분리 시약을 사용하지만 10 분 이상 iPSCs를 치료하는 것은 권장되지 않습니다. 일반적으로 IPSC 문화가 80 % 미만 합류 인 경우 단계 5.1, 부드러운 피펫 단일 세포로 iPSCs를 해리 일반적으로 충분한 미리 예열 부드러운 세포 분리 시약 5 분 배양을 다음. 모든 세포를 10 분 처리 한 후 단일 세포로 해리 될 수있는 경우에는 세포 배양을 통해 콘이기 때문유창한 또는 식민지가 매우 컴팩트하게, 단순히 더 웰 / 플레이트에서 단일 세포의 추천 번호를 수집하고 뒤에 단단히 부착 된 세포를 둡니다. 기계 전단은 효소 분해보다 세포에 더 해로운 때문에 무거운 피펫 팅하지 않는 것이 좋습니다. (통로 # 15 전) 초기 통로 iPSCs로 작업 할 때 세포가 이미 늦은 통로 iPSCs보다 형질 스트레스에 더 민감하기 때문에, 부드러운 해리 방법은 세포 생존에 매우 중요합니다. 그것은 두 형질 세포 생존 고효율을 달성하기 어려운 경우에는, 가장 높은 형질 전환 효율을 제공하는 관행을 선택한다. 형질 전환 후, 세포는 약물 선택이 시작될 때 3 일에 50-80%의 포화 상태에 도달 할 것 밀도로 도금해야한다. 각 라인 IPSC 다르게 성장하기 때문에, 트랜 스펙 션 후 도금 밀도는 각각의 세포주에 대해 최적화 될 필요가 있습니다. 높은 밀도는 도금 DRU의 효능을 감소 과잉 포화 상태로 이어질 수있다g-선택, 매우 낮은 도금 밀도가 회복 지연 및 약제 내성 식민지의 성장을 일으킬 수있다. 일반적으로 3 백만 시작 iPSCs는 생존과 특정 iPSCs의 성장에 따라 ½ 2 10cm 접시에 도금하기에 충분하다. 이와 유사하게, 필요가있을 수있다 형질 감염되지 않은 세포의 최소 유효 용량을 설정하는 퓨로 마이신 연속 곡선을 새로 생성하거나 아직 검증되지 않은 IPSC 줄을 사용하여 생성하는 경우; IPSC 라인 퓨로 마이신 선택에 자신의 감도 상당히 다를 수 있습니다. 그들은 약물 선택시 일부의 세포 외 기질보다 더 IPSC 성장을 지원하기 때문에 나타나는 MEFs에이 선택에 사용 하였다. 엄지 손가락의 규칙, ml의 선택을 완료하는 데 필요한 0.5 ㎍ /에서 1 ㎍ / ㎖의 또는 칠일에서 퓨로 마이신 5 일의 최소한. 마지막으로, 식민지 따기 기술은 약물 선택 후 모든 대상 식민지를 유지하는 것이 매우 중요하다. 부드러운 피펫 또는 해리 시약 처리를 균등하게 여러 조각으로 식민지를 파괴하는 데 도움이새로운 웰에 분산되므로 콜로니 확장을 가속화 할 수있다. 해리 시약을 사용하여 도금하기 전에 고른 식민지를들을 분해 할 경우 하룻밤에두면 잔류 해리 시약 전송 된 세포를 죽일 수 있기 때문에, 그것은 충분히 치료 후> 10 배 매체로 희석되어 있는지 확인합니다. 실제 실험을하기 전에 따기 식민지 연습, 사용되는 기술에 상관없이 매우 권장된다.
기술 전략은 크게 따기, 내생 PPP1R2C 프로모터 오프 PAC 유전자의 발현을 구동하기 위해 유전자 트랩 방법을 이용하여 30 개 이상의 식민지 필요한 증명하지 않아야합니다. SA-2A는 PAC 선택이 이론적으로 임의의 통합 전용 세포를 제거 연결,하지만 추가 랜덤 통합 (들)을 성공적으로 대상 통합 베어링 iPSCs 발생할 수 있습니다. 대부분의 경우, 약물 - 선택된 클론의 거의 100 %가 통합을 타겟팅하고 그들 ~ 10-40 %가 추가로 임의 INTEGRATI있을기능. > 50 %의 두 대립 유전자 표적화가 발생하더라도 상기 실험 표적 클론의 대부분은 단일 대립 유전자 타겟팅을 갖는 경향이있다. 임의의 부가 통합 가변 주파수뿐만 아니라 이중 대립 유전자의 표적화 단일 - 비율 제어가 곤란하다. 따라서, ~ 20 식민지를 따기하는 전용 타겟팅 클론을 얻을 수 단일 또는 이중 대립 유전자를 확인하는 것이 좋습니다. 실패한 표적화 실험 대상 세포 'transfectability 생존 및 성장 속도의 재평가에 비추어, 특정 세포주 클레아의 효능, 및 도너 및 뉴 클레아 제 제제의 품질이 매우 전에 추천 실험을 재 시도 그 전체.
이는 유사한 유전자 트랩 도너 전략 다른 활성 유전자를 타겟팅 사용되지만 선택 가능한 유전자 발현을 구동하는 프로모터를 필요로 독립 자동 유전자 표적화에 적합하지 않다 될 수 있음에 유의해야한다. 또한, 일 동안전자 AAVS1 안전한 항구가 열린 크로 마틴 구조를 갖는 것으로 간주된다, 이것은 어떤 유전자가이 현장에서 강하게 표현 될 수 있음을 보증하지 않습니다. 사실, 우리의 최근 보고서는 여러 약한 발기인 AAVS1의 궤적 (14)을 대상으로 통합 한 후 검출 형광 리포터 유전자 발현을 구동 할 수 없음을 보여 주었다.
이 프로토콜은 인간 게놈에서 잘 연구 면책 궤적을 대상으로 잘 검증 TALENs 사용에 초점을 맞춘 것입니다. 기술은 높은 재현성 및 형질 전환 유전자를 포함하는 많은 응용 프로그램에 쉽게 적응할 수 있습니다. 랜덤 통합을 이용한 게놈 공학적 방법에 비해, 타겟팅 AAVS1-TALEN 매개 유전자는 매우 효율적이고 특이이며 iPSCs의 경우, 확장 및 인간 세포 유형으로 분화하는 잠재력을 가진다 안정 형광 세포를 초래한다. 이 프로토콜은 디자인과 디자이너 클레아 제의 유효성 검사 또는 페이지를 대상으로 IPSC 식민지의 평가를 설명하지 않지만로퍼 카세트 통합 및 오프 대상 분석은 여러 가지 우수한 프로토콜은 세부 16-18에서 방법론의 이러한 측면을 설명했다. E8 매체를 이용하여 피더 IPSC없는 배양 및 계대 기술들은 이전의 간행물 19에 상세하게 설명한다. 위의 프로토콜은, 인간 iPSCs의 AAVS1 안전한 항구로 유전자 또한에 최적화 된 반면, 어떤 세포 유형의 상동 재조합 기증자를 사용하여 사이트 별 클레아 제 매개 유전자 편집 / 추가와 관련된 실험에 대한 일반적인 템플릿 역할을 할 수 있습니다.
공개
저자는 그들이 더 경쟁 금융 이익이 없다는 것을 선언합니다.
감사의 말
This research was supported by the NIH Common Fund and Intramural Research Program of the National Institute of Arthritis, Musculoskeletal, and Skin Diseases.
자료
| Name | Company | Catalog Number | Comments |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix, *LDEV-Free, 10 ml | Corning | 354230 | Store at -20 °C. |
| DMEM/F-12 | Life Technologies | 11320-033 | Store at 4 °C. |
| Costar 6 Well Clear TC-Treated Multiple Well Plates | Corning | 3506 | |
| Essential 8 Medium | Life Technologies | A1517001 | Store basal medium at 4 °C. Store supplement at -20 °C. |
| Y-27632 dihydrochloride | Tocris | 1254 | Store at room temp. Once dissolved in H2O, store at -20 °C. |
| Sodium Chloride | Sigma | S5886-500G | |
| UltraPure 0.5 M EDTA, pH 8.0 | Life Technologies | 15575-020 | |
| DPBS, no calcium, no magnesium | Life Technologies | 14190-250 | |
| 100 mm TC-Treated Culture Dish | Corning | 430167 | |
| DR4 MEF 2M IRR - Academic | GlobalStem | GSC-6204G | Store in liquid Nitrogen. |
| DMEM, high glucose, pyruvate | Life Technologies | 11995-040 | Store at 4 °C. |
| Defined Fetal Bovine Serum, US Origin | HyClone | SH30070.03 | Store at -20 °C. Thaw at 4 °C overnight and aliquot. Store aliquots at -20 °C until needed. |
| MEM Non-Essential Amino Acids Solution (100X) | Life Technologies | 11140-050 | Store at 4 °C. |
| 4D-Nucleofector Core unit | Lonza | AAF-1001B | part of the electroporation system |
| 4D-Nucleofector X unit | Lonza | AAF-1001X | part of the electroporation system |
| P3 Primary Cell 4D-Nucleofector X Kit L (24 RCT) | Lonza | V4XP-3024 | Upon arrival, remove Primary Cell Solution and supplement and store at 4 °C. |
| StemPro Accutase Cell Dissociation Reagent | Life Technologies | A1110501 | Store at -20 °C. Thaw overnight at 4°C and warm an aliquot in a 37 °C water bath before use. |
| NutriStem XF/FF Culture Medium | Stemgent | 01-0005 | Store at -20 °C. Thaw overnight at 4 °C |
| AAVS1 TALENs (pZT-AAVS1-L1 and pZT-AAVS1-R1) | Addgene | 52637 and 52638 | |
| [header] | |||
| AAVS1-CAG-EGFP Homologous Recombination donor | Addgene | 22212 | |
| Puromycin Dihydrochloride | Life Technologies | A11138-03 | Store at -20 °C. Prepare working aliquots of 1 mg/ml in ddH2O. |
| Disposable Borosilicate Glass Pasteur Pipets | Fisher Scientific | 13-678-20A | |
| Sorvall Legend XTR (Refrigerated), 120 V 60 Hz | Thermo Scientific | 75-004-521 | |
| TX-750 4 × 750 ml Swinging Bucket Rotor | Thermo Scientific | 75003607 | |
| Trypan Blue Solution, 0.4% | Life Technologies | 15250-061 | |
참고문헌
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Hentze, H., Graichen, R., Colman, A. Cell therapy and the safety of embryonic stem cell-derived grafts. Trends Biotechnol. 25 (1), 24-32 (2007).
- Smith, J. R., et al. Robust, persistent transgene expression in human embryonic stem cells is achieved with AAVS1-targeted integration. Stem Cells. 26 (2), 496-504 (2008).
- Lombardo, A., et al. Site-specific integration and tailoring of cassette design for sustainable gene transfer. Nat Methods. 8 (10), 861-869 (2011).
- Ogata, T., Kozuka, T., Kanda, T. Identification of an insulator in AAVS1, a preferred region for integration of adeno-associated virus DNA. J Virol. 77 (16), 9000-9007 (2003).
- Zwaka, T. P., Thomson, J. A. Homologous recombination in human embryonic stem cells. Nat Biotechnol. 21 (3), 319-321 (2003).
- Urbach, A., Schuldiner, M., Benvenisty, N. Modeling for Lesch-Nyhan disease by gene targeting in human embryonic stem cells. Stem Cells. 22 (4), 635-641 (2004).
- Hockemeyer, D., et al. Efficient targeting of expressed and silent genes in human ESCs and iPSCs using zinc-finger nucleases. Nature biotechnology. 27 (9), 851-857 (2009).
- Zou, J., et al. Gene targeting of a disease-related gene in human induced pluripotent stem and embryonic stem cells. Cell stem cell. 5 (1), 97-110 (2009).
- Hockemeyer, D., et al. Genetic engineering of human pluripotent cells using TALE nucleases. Nature. 29 (8), 731-734 (2011).
- Sanjana, N. E., et al. A transcription activator-like effector toolbox for genome engineering. Nature protocols. 7 (1), 171-192 (2012).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Ding, Q., et al. Enhanced efficiency of human pluripotent stem cell genome editing through replacing TALENs with CRISPRs. Cell stem cell. 12 (4), 393-394 (2013).
- Luo, Y., et al. Stable Enhanced Green Fluorescent Protein Expression After Differentiation and Transplantation of Reporter Human. Induced Pluripotent Stem Cells Generated by AAVS1 Transcription Activator-Like Effector Nucleases. Stem Cells Transl Med. 3 (7), 821-835 (2014).
- Zou, J., et al. Oxidase-deficient neutrophils from X-linked chronic granulomatous disease iPS cells: functional correction by zinc finger nuclease-mediated safe harbor targeting. Blood. 117 (21), 5561-5572 (2011).
- Luo, Y., Rao, M., Zou, J. Generation of GFP Reporter Human Induced Pluripotent Stem Cells Using AAVS1 Safe Harbor Transcription Activator-Like Effector Nuclease. Curr Protoc Stem Cell Biol. 29, 5A.7.1-5A.7.18 (2014).
- Peters, D. T., Cowan, C. A., Musunuru, K. Genome editing in human pluripotent stem cells. StemBook. , Harvard Stem Cell Institute. Cambridge, MA. Available from: http://www.stembook.org/node/1438 (2008-2013).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Beers, J., et al. Passaging and colony expansion of human pluripotent stem cells by enzyme-free dissociation in chemically defined culture conditions. Nat Protoc. 7, 2029-2040 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유