Method Article
Aracı Olarak bir lipozomal-kapsüllü Yakın-Kızılötesi floroforun Floresan-söndürme
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
The use of fluorophores for in vivo imaging can be greatly limited by opsonization, rapid clearance, low detection sensitivity and cytotoxic effects on the host. Encapsulation of fluorophores in liposomes by film hydration and extrusion leads to fluorescence quenching and protection which enables in vivo imaging with high detection sensitivity.
Özet
Optical imaging offers a wide range of diagnostic modalities and has attracted a lot of interest as a tool for biomedical imaging. Despite the enormous number of imaging techniques currently available and the progress in instrumentation, there is still a need for highly sensitive probes that are suitable for in vivo imaging. One typical problem of available preclinical fluorescent probes is their rapid clearance in vivo, which reduces their imaging sensitivity. To circumvent rapid clearance, increase number of dye molecules at the target site, and thereby reduce background autofluorescence, encapsulation of the near-infrared fluorescent dye, DY-676-COOH in liposomes and verification of its potential for in vivo imaging of inflammation was done. DY-676 is known for its ability to self-quench at high concentrations. We first determined the concentration suitable for self-quenching, and then encapsulated this quenching concentration into the aqueous interior of PEGylated liposomes. To substantiate the quenching and activation potential of the liposomes we use a harsh freezing method which leads to damage of liposomal membranes without affecting the encapsulated dye. The liposomes characterized by a high level of fluorescence quenching were termed Lip-Q. We show by experiments with different cell lines that uptake of Lip-Q is predominantly by phagocytosis which in turn enabled the characterization of its potential as a tool for in vivo imaging of inflammation in mice models. Furthermore, we use a zymosan-induced edema model in mice to substantiate the potential of Lip-Q in optical imaging of inflammation in vivo. Considering possible uptake due to inflammation-induced enhanced permeability and retention (EPR) effect, an always-on liposome formulation with low, non-quenched concentration of DY-676-COOH (termed Lip-dQ) and the free DY-676-COOH were compared with Lip-Q in animal trials.
Giriş
Lipozomlar, yoğun bir şekilde araştırılmıştır ve klinik uygulamalarda 1,2 en, biyo-uyumlu biyomedikal ilaç verme sistemlerinden biri olarak hizmet edilmiştir. Bunlar ağırlıklı olarak doğal hücre zarlarının bölümleri taklit eden biyolojik olarak uyumlu bileşikler, her ikisi de fosfolipidler ile kolesterol, oluşmaktadır. Hidrofilik maddelerin sulu iç kısım içinde kalan edilebilir iken, lipofilik maddeler, lipozomal fosfolipid çift-katlı 3 içine dahil edilebilir. Lipozomların, sulu iç kısmında maddelerin kapsüllenmesi, in vivo bozulmaya karşı koruma sağlar ve aynı zamanda tümör hücreleri yok etmeyi amaçlayan, örneğin kemoterapi için hastalıkların tedavisi için kullanılan sitotoksik ilaçların toksik etkileri ana sistemi engeller. polietilenglikole gibi polimerler ile lipozomal yüzeyinin modifikasyonu (PEGylation) ayrıca nedeniyle sterik stabilizasyon 4 in vivo lipozomal kan dolaşımı süresini uzatır. Moreover, lipozomlar gibi proteinler 5,6, hidrofil maddeler 7,8 ve enzimler 9 gibi çeşitli maddelerin yüksek konsantrasyonları çekilmek olabilir. Bu nedenle kanser tedavisi 4 doksorubisin gibi sitotoksik ilaçların verilmesi için onların onayını hak güvenilir klinik tedavi ve tanı araçları hizmet vermektedir. Dolayı esneklik, lipozomlar da teşhis ve görüntü kılavuzluğunda cerrahi amaçlı fluorochromes ile yüklenebilir.
Floresan görüntüleme sağlayan bir maliyet-etkin ve ancak, bazı temel gereksinimleri talep in vivo teşhis aracı non-invaziv. Bu, in vivo görüntüleme için en uygun fluorokromun ışık dağılımı ve saçılma yanı sıra sudan kaynaklanan doku otofloresansı ve hemoglobin düşük aralıkta karakteristik absorpsiyon ve emisyon maksimum seviyesine sahip olduğu gösterilebilir. Böylece, bu tür sondalar 650 nm ve 10 900 arasında kendi abs / em maxima var. Opsonizasyon ve hızlı temizleme büyük ölçüde, in vivo görüntüleme 11 için bunların uygulanmasını kısıtlar; gibi bu yanı, in vitro ve in vivo olarak florokromlar stabilitesi çok önemlidir. Bu tür zayıf kararlılık ve düşük hassasiyet ya da indosiyanin yeşilinin (ICG) 12-16 görüldüğü gibi hedef organlarda üzerinde sitotoksik etkiler gibi diğer etkiler, istenmeyen ve in vivo görüntüleme için sondalar tasarlarken dikkate alınması gerekir. Bu gözlemler, birçok ön-klinik NIR florokromlar, nanopartiküller olarak enflamatuar süreçler, kanser, in vivo görüntüleme ve görüntü kılavuzlu ameliyat 17-20 için yeni teknikler aktif gelişmesine yol açmıştır. En klinik öncesi NIRF (yakın kızıl ötesi floresan) stabilitesi rağmen boyalar in vitro karaciğer ve böbrek yoluyla hızlı bir perfüzyon ve temizlik hastalıkları ve inflamatuar süreçlere in vivo optik görüntüleme kullanılmasını engellemektedir.
ntent "> Bu nedenle örneğin florokrom kapsüllenmesi için bir protokol mevcut iyi karakterize yakın kızılötesi lipozomlar içinde oldukça yüksek konsantrasyonlarda 21 kendi kendini söndürme eğiliminden bilinen fluoresan boya DY-676-COOH. Yüksek konsantrasyonlarda H dimer oluşumu ve / veya bir pi-istiflenmesi, flüorofor molekülleri artışı arasındaki düşük bir konsantrasyonda. alan florokrom moleküller arasında Förster rezonans enerji transferi (FRET) birbirlerinin Förster yarıçapı sonucu içinde bulunan florofor molekülleri arasındaki etkileşimi ve böylece bir pi-istifleme etkileşimi önleme ve 'H-dimer oluşumu ve yüksek floresan emisyonu. Yüksek ve düşük konsantrasyonu ve eşlik eden floresans ve aktivasyonu arasında geçiş optik görüntüleme 22 yararlanılabilir gelecek vaat eden bir stratejidir. NIRF boyanın yüksek konsantrasyonlarda Bu bağlamda, sarma Lipozomlar, sulu iç DY-676-COOH daha falıdırserbest boya daha in vivo görüntüleme için vorable. Yöntemin meydan boya yüksek konsantrasyonlarda kapsüllenmesi kaynaklanan faydaların doğrulama, ikincisi doğru kapsülleme tüm ilk ve yatıyor. Boya düşük konsantrasyonlarda olmayan bir söndürüldü lipozom formülasyonu ile ücretsiz boya o ile söndürüldü lipozomlann görüntüleme özelliklerinin karşılaştırılması ve vazgeçilmezdir. Biz lipozomlarda DY-676-COOH söndürme konsantrasyonlarının kapsülleme mümkündür alternatif donma ve çözülme döngüleri ile birlikte basit, ama son derece etkili bir film hidrasyon ve ekstrüzyon protokolü tarafından gösteriyor. Bu tür ters fazlı buharlaştırma yöntemi 23 olarak etanol enjeksiyon metoduna 24 gibi lipozomlar elde etmek için kullanılan diğer yöntemler, bir çok hidrofilik madde için yüksek bir kapsülleme randımanı olan lipozom preparatı sağlamaktadır. Bununla birlikte, maddenin doğası kapsülleme etkinliğini etkileyebilir haline getirilir. Sonuç olarak,Burada sunulan film, hidrasyon ve ekstrüzyon protokolü DY-676-COOH enkapsülasyonunda en yüksek verimi ortaya çıkardı. Birkaç saat içinde iltihap işlemlerinin çalışmasına izin verir DY-676-COOH, bir zimosan kaynaklı ödem modelinde, lipozomal kapsülleme yararlarını göstermek için kullanılmıştır. Burada, bu kapsüllenmiş DY-676-COOH konsantrasyonu yüksek olan lipozomlar, serbest boya ya da düşük boya konsantrasyonları olmayan söndürüldü lipozom formülasyonuna göre ateşli süreçlerin ve in vivo optik görüntüleme bütün vücut için daha uygun olduğu gösterilmiştir. Böylece, alt protokol söndürüldü floresan lipozomlar ve in vitro ve in vivo olarak hem aktivasyonu ve görüntüleme potansiyelinin doğrulama üretmek için hızlı ve basit bir yöntem temin etmektedir.Protokol
NOT: Tüm işlemler, bölgesel hayvan komitesi tarafından ve hayvanların etik kullanımı ile ilgili uluslararası kurallara uygun olarak onaylanmıştır.
Malzeme ve Araçların 1. Hazırlık
- Kendiliğinden oluşan kese dağılımının hazırlanması (SFV)
- Aşağıdaki fosfolipidlerin stok çözelti çözülür ve hazırlanması: 214 mg / ml, yumurta fosfatidilkolini (EPC), 134 mg / ml kolesterol, 122 mg / ml 1,2-distearoil, sn -glisero-3-phosphoethanolamine- A ^ - [metoksi (polietilen glikol) -2000] (amonyum tuzu) (mPEG 2000 -DSPE) ve 2 mg / ml 1,2-dioleoil-sn--glisero-3-phosphoethanolamine- A ^ - (7-nitro-2-1,3-benzoksadiazol-4 Cam şişeler içinde kloroform ve mağaza il) (amonyum tuzu) (NBD-DOPE).
- Yuvarlak tabanlı bir şişe içinde, yaklaşık 3 mi kloroform vermek ve EP oluşan lipozomlar elde etmek için yuvarlak dipli bir şişeye fosfolipid stok çözeltisinin uygun hacim transferiC: 3: 0.5 Kol: 6.5 bir mol oranında, mPEG 2000 -DSPE. Lipozomlar çift floresan etiketleme için lipit çözeltisine 0,3 mol% NBD-DOPE ekleyin.
- Bir döner buharlaştırıcı kullanılarak 55 ° C'de indirgenmiş basınç altında (300 mbar) altında organik fosfolipid çözeltisinden kloroform buharlaştırın.
- Homojen bir fosfolipid filmi oluşturulduktan sonra, kalıntı kloroform para çıkarmak için 1-2 saat boyunca 10 mbar basınç azaltır.
- Kloroform buharlaştırılır iken, 10 mM Tris tamponu pH 7.4 içinde DY-676-COOH (6,181 uM) çözülür ve sıvı azot ile birlikte bir Dewar kabı doldururlar. Ultrasonik banyoda açınız ve 50 ° C'ye ayarlanmış.
- DY-676-COOH (6,181 uM) bir kendiliğinden oluşan kese (SFV) dağılım oluşana kadar kuru fosfolipid filmi ve kuvvetli bir şekilde girdap hidrat yuvarlak tabanlı bir şişeye çözeltinin uygun hacmi (0.5-1 mi) aktarın. Fosfolipidlerin tüm lipit kaybını önlemek için dağınık emin olun.
- Dikkatle transfer yuvarlak dipli sıvı azot içine SFV dağılımını içeren şişe ve 3-5 dakika dağılımını dondurma. Daha sonra dağılım çözülme 1-2 dakika boyunca kuvvetli bir şekilde dağılmasını vorteks 50 ° C'de ultrasonik bir banyo içine tabanı yuvarlak bir şişe yerleştirin. Yedi dondurma ve çözülme döngüleri toplam yapım, bu prosedürü altı kez tekrarlayın.
- SFV'nin Ekstrüzyon homojen lipozom veziküller oluşturmak için
- 1 ml şırınga (enjektör-a) içine SFV dispersiyon aktarın ve şırınga-b bir LiposoFast-Temel ekstrüder kullanılarak 100 nm'lik polikarbonat zardan dispersiyon a'ya.
- Geri şırınga-a içine şırınga-b dağılımını a'ya, sonra döngüden on kez tekrarlayın. Nedeniyle ekstrüzyon, zaman ile belirgin bir dispersiyona bulanık bir görünüm şırınga değişir çözelti. On döngüleri (yirmi tek ekstrüzyon adım) cihazdan şırınga-b kaldırmak ve steril içine şırınga doğrudan son kez dağılımını a'ya sonra1.5 ml'lik tepkime tüpü.
- Lipozomal saflaştırılması serbest boyadan DY-676-COOH kapsüllü
- 10 mM Tris tamponu, pH 7.4 (kolon uzunluğu 28 cm, çap 0.8 sm), batırılmış G25 boncuklar kullanılarak, bir jel kromatografi kolonu hazırlayın.
- Jel matrisi içine örnek drenaj jel yatağa çekilmiş vezikül dağılımı 0.5 ml aktarın ve izin.
- 10 mM Tris tamponu pH 7.4 (Şekil 1A) ile lipozomlar Zehir ve sütun tamamen ücretsiz boya drene kadar sütun yıkayın. Ihtiyaç olması halinde, toplamak ve üreticinin talimatlarına göre tuzsuzlaştırma ve dehidrasyon ile ücretsiz boya geri dönüşüm.
- Daha sonra 10 steril mM Tris tamponu, pH 7.4 içinde yeterli hacim içinde eritilmek, ultra santrifüje (200,000 x g, 8 ° C 'de 2 saat) ile elüte lipozomlar konsantre edilir.
- Kapsüllenmiş DY-676-COOH konsantrasyonunun miktarının belirlenmesi
- DY-676-COOH (0, 82, 124 eritilmesi ile bir kalibrasyon eğrisi hazırlamak,, 10 mM Tris tampon maddesi içinde 247, 494, 988 nM), pH 7.4,% 0.1 Triton X100 ihtiva etmektedir.
- Veziküller yok etmek ve kapsüllenmiş boya serbest bırakmak için% 1 Triton X100 içeren 100 ul Tris tamponu içinde oda sıcaklığında 5 dakika boyunca lipozomların, 2 ul (50 mmol / lt stokunun, 100 nmol son lipid) içinde çözülür. Daha sonra% 0.1 bir son Triton-X100 konsantrasyonda 10 mM Tris tamponu, pH 7.4 ile seyreltilmiş numuneleri (h / h) 1 ml'lik bir toplam hacim adrestir. Nüsha halinde tüm örnekleri hazırlayın.
- Bir uyarma λ = 645 nm ve emisyon λ = 700 nm emilimi ve emisyon tüm numunelerin (ücretsiz DY-676-COOH ve Triton-X100 tedavi lipozomlar) ölçün. Kurmak ve kapsüllenmiş boyanın konsantrasyonu belirlemek için serbest bir boya kalibrasyon eğrisi kullanır.
- Lipozom karakterizasyonu
- Dinamik ışık saçılması ile lipozomların boyutları ve zeta potansiyeli belirlemek. Ac steril filtre (0.2 um), 10 mM Tris tamponu, pH 7.4 ile lipozomal örnekleri seyreltin100-300 uM (lipit) olarak oncentration. Düşük hacimli tek kullanımlık bir küvet içinde seyreltilmiş örnekleri aktarın ve üretici talimatlarına göre numune ölçer.
- Standart protokollere göre lipozomal veziküllerin boyutu, bütünlüğünü ve homojenliği kanıtlamak için elektron mikroskobu ile lipozomlar karakterize etmektedir.
2. Floresan-söndürme Doğrulama ve Hazırlanmış Liposome'lara Aktivasyon
- Floresans ve aktivasyon fiziko kimyasal analizi
- Dudak-Q iki 1.5 ml tüpler ve ücretsiz DY-676-COOH için 2 tüpleri hazırlayın. Aktarım, 100 nmol toplam lipitler uygun tüplere (kapsül haline DY-676-COOH 138 ug / ml içeren 42 mmol / L olarak Dudak-S stok çözeltisi 2.38 ul). Dudak-Q boya içeriği (138 ug / 1.000 ul kullanılan Dudak-Q ul x 2.38 örneğin sonuçları 0.38 mikrogram) ücretsiz DY-676-COOH eşdeğer aktarın. Bir küvet inkübe4 ° C 'de her bir prob e ve -80 ° C'de gece boyunca (16 saat), ikinci boru dondurma.
- 30 ° C bir ısıtma bloğu ısıtın. Ezilmiş buz ile soğutma kutusu doldurun ve oda sıcaklığına kadar, 10 mM Tris tampon maddesi pH 7.4 bir kısım dengeye getirin.
- 4 ° C ila probları çıkarın ve 5 dakika boyunca 30 ° C 'de -80 ° C ila problar (ışıktan korunması için bir alüminyum folyo ile sarılmış) ve hızlı bir şekilde çözülme oda sıcaklığında dengeye getirin. (Ayrıca ışıktan korumak için aliminyum folyoya sarılmıştır), oda sıcaklığında aktarmadan önce 1 dakika boyunca buz üzerinde eritildi probları soğutun.
- 100 ul son hacim olması için sondaların her biri için, 10 mM Tris tampon (pH 7.4) ilave edilir ve 10 dakika boyunca oda sıcaklığında bütün sondalar dengeye getirin.
- Pipet 80 düşük hacimli cam küvetin içine her sonda ul ve bir spektrometre üzerinde 400-900 nm her sonda emilimini ölçmek. Bunlara karşılık gelen tüplere probu dönün.
- Uygun bir cam küvet içinde her bir prob 80 ul transferve 674 nm heyecan verici prob tarafından spektroflorometre floresan emisyon ölçümü ve 694-800 nm floresan ölçüm.
- Bir hücresel kabul etme ve floresan aktivasyon
- Standart koşullar (37 ° C,% 5 CO2 ve% 95 nemlendirilmiş atmosfer içinde) 'e uygun mukabil kültür ortamı aşağıdaki hücre çizgileri almak ve kültür. Burada, mürin makrofaj hücre çizgisi J774A.1 kullanımı (Dulbecco tadil edilmiş Eagle ortamı,% 10 (h / h) fetal dana serumu ile takviye edilmiş), insan glioblastoma hücre çizgisi olan U-118 mg (temel vitaminler ve% 10 gliserol içeren MEM (h / h) fetal dana serumu) ve insan fibrosarkoma hücre çizgisi, HT-1080 (% 5 FCS ile RPMI).
- Poli-L-lisin ile kaplayın 8 oyuklu bölmeli lamlar (her bir oyuğa 100 ul% 0.001 poli-L-lisin ilave edin ve 10 dakika boyunca 37 ° C'de inkübe edilir. Aspire çözeltisi ve bölmeli lamlar en az 4 için kuruması steril bir tezgah üzerinde oda sıcaklığında saat. odacık slaytları durulayın 3gerekli kadar 200 ul Hank tamponlu salin solüsyonu ile katı daha sonra 4 ° C de parafin, alüminyum folyo ve mağaza ile kapatın.
- Odası slaytlar kuruyor iken gerekli kadar, 4 ° C'de lipozomlar ve boya çözüm ve mağaza filtre sterilize.
- In vivo, NIR floresan görüntüleme sisteminde tüm vücutla sistemi alım analizi için 3 test hücre çizgilerinin her biri için 5, küçük kültür şişeleri (toplam 15 şişeler) hazırlanması. Tohum, 2 x 10 6 J774A.1 U-118 mg ve (beşe olarak) ilgili kültür ortamına 5 ml kültür şişesi başına HT-1080 hücreleri ve 16-24 saat süre ile büyür. , Kültür şişeleri paralel sırasıyla odası slayt 2 kuyuları her hücre hattı (J774A.1 ve HT-1080) veya 20.000 hücreleri (U-118 mg) 30.000 hücrelerini tohum ve 16-24 saat 500 ul kültür ortamında büyümek .
- Bir sonraki gün, hücre hattı başına slaytı üzerinde her bir hücre hattı bir oyuğuna 2 şişelere Dudak-Q, 100 nmol (nihai yağ miktarı) ekleyin.Hemen 1 4 ° C'ye hücre hattı başına şişeyi geri inkübatör ikinci şişeyi aktarmak.
NOT: odacık slaytlar üzerinde konsantrasyon yapma, prob hacmi şişelere ilave ve oda slaytlar aynı 10 kat daha yüksek (5 ml 500 ul kültür ortamı için). Mikroskobik algılama şişeler hücre topakları görüntülü NUR floresan görüntüleme sistemi daha az duyarlı olduğu için bu gereklidir. - Hücre hattı başına slaytı üzerinde her bir hücre hattı bir oyuğuna 2 şişelerinde hücrelere Dudak-Q boya içeriğinin eşdeğer bir konsantrasyonda serbest DY-676-COOH eklenmekte, daha sonra, hemen hücre çizgisi başına 1 bir balona 4 ° C'de (enerji tüketimi) ve arka inkübatör slaytı ile birlikte başka bir şişeye alın. Karşılık gelen koşullar altında, 24 saat süre ile, tüm hücreleri inkübe edin. prob olmadan şişede hücreler işlemden geçirilmemiş kontrol vermektedir.
- NIRF görüntüleme ve yarı-kantitatif analizi
- 24 saatlik bir bekletme süresinden sonra, Hanks ile hücreler 2 defa yıkayarak şişelerinde hücreler hasat 500 ul tüplerinde tuz çözeltisi (HBSS), daha sonra santrifüj (200 xg 5 dakika) ile 500 ul HBSS içinde hücreleri ve pelet kazıma tamponlu.
- Uyarma (615-665 nm) ve emisyon (> 700 nm olarak kesme) için hücre pelet (ve HBSS) bir NIRF görüntüleyici ve görüntü kullanarak filtreleri tüpleri yerleştirin.
- Otofloresans düşeriz ve üretici talimatlarına göre otofloresansı karşı hedefin yoğunluğunu değerlendirmek. Bu ölçümler birbirleri arasında karşılaştırılabilir, böylece pozlama süresi, kamera kazanç, binning ve bit derinliği ölçeklendirme sonra sayım düzeylerini temsil eden ortalama sinyali olarak floresan yoğunluğu (ölçekli sayım / sn), yarı-kantitatif seviyelerini verecektir.
- Konfokal mikroskopik analizler
- 24 saat inkübasyondan sonra, 500 ul HBSS ile 2 kez yıkayarak odası slaytlar üzerinde hücreleri hasat.
- Ce Fix200 ul HBSS, oda sıcaklığında 30 dakika boyunca% 3.7 (h / h) formaldehid içeren rf.
- Fiksasyon devam ederken, DNA leke montaj çözümü ile, Hoechst-33258 01:50 sulandırmak.
- Tespit edildikten sonra, daha sonra HBSS ile hücreleri 2 kez yıkayın cam slaytlar gelen odaları ayrı. Kamara slayt kuyulara gelen her yerinde DNA leke içeren 50 ul montaj çözümü ekleyin. RT (karanlık) saydam tırnak cilası ve havada kurumaya 10 dakika boyunca kenarları mühür, cam kapak slipleri ile hücreleri örtün.
- Uygun bir floresan mikroskop veya konfokal mikroskop görüntü hücreleri. Çekirdekler (Hoechst-33258: Uyarma 405 nm, emisyon 420-480 nm) karşılık gelen bileşenlerin görünüm için aşağıdaki uyarma ve emisyon ayarlarını kullanın. NBD-DOPE (lipozom, lipid: eksitasyon 488 nm, emisyon 530 nm). DY-676-COOH (NUR floresan boya: Uyarma 633-645 nm, emisyon 650-700 nm).
NOT: emin olun floresan mikroskop birgurupları yüksek 630 nm'den daha dalga boylarının uyarılma ve emisyon izin uygun filtreler ile donatılmıştır.
3. iltihabın canlı Floresans görüntülenmesi Lipozom temelli
- Hayvanlar ve malzemelerin hazırlanması
- Ev 8-12 haftalık yiyecek ve su ad libitum ile, standart koşullar altında, yaklaşık 36 g ağırlığında, erkek NMRI fareleri.
- Yedi gün önce deney başlamadan önce, doku otoflüoresan azaltmak için tüm fareler düşük pheophorbide diyet verir.
- Yirmi dört saat, her bir deney başlamadan önce, arzu edilen alanda, fareler tıraş (örneğin, arka ayak ödemi görüntüleme arzu edildiği takdirde, tüm arka bölge).
- Hayvanlar tartılır ve prob miktarını hesaplamak Dudak-Q kullanılan içeriğini boya ağırlık ve ücretsiz DY-676-COOH (eşdeğeri kg başına) 10 ľmol (lipit konsantrasyonda fare (Dudak-Q ve Dudak-dK'un başına enjekte edilecek) .
- Resim hayvanlardaHücre pelet için kullanılan aynı ayarlarla bir tüm vücut NUR Floresan görüntüleyici. Bu ölçüm, hayvanların otoflüoresanı içerir.
- 1 ml izotonik tuzlu su çözeltisi, 10 mg zimosan-A çözülür ve 4 ° C de bir gece boyunca muhafaza ediniz.
- Enflamasyon ve in vivo NIRF görüntüleme İndüksiyon
- Aşağıdaki çözümleri içeren fare başına 3 şırınga hazırlayın. 50 ul zimosan-bir (10 mg / ml) ve 50 ul izotonik tuzlu su çözeltisi ile ikinci şırınga ile bir şırınga doldurun. Kontrol hayvanlar için Dudak-Q ve Dudak-dK (10 mmol / kg ağırlık (lipit)) (Dudak-Q gibi konsantrasyon) deney hayvanlarında ve ücretsiz DY-676-COOH için belirlenmiş sayede sondalar, üçüncü şırınga doldurun. Sondalar 150 ul son hacim olması için steril HBSS ile seyreltildi olduğundan emin olun.
- (Kuruluğu önlemek ve derinden uykuda kadar% 2 izofluran ile hayvanları uyutmak ve pençeleri üzerinde dokunulduğunda tepki yok etmek için hayvanların gözleri göz kremi uygulayınBu) yaklaşık 2 dakika sürer.
- (Hala anestezi altında) sıcak minder üzerinde fareyi yerleştirin ve sağ arka bacağında zimosan-A çözüm deri altına ve sol arka bacak üzerinde tuzlu su çözeltisi enjekte. (T 0 saat = gibi) enjeksiyonu / ölçüm kayıt süresi hemen intravenöz prob enjekte ve daha sonra sonra görüntü hayvan. Görüntü küp olarak ortaya çıkan görüntüleri kaydetmek ve tüm diğer hayvanlar ve ilgili problar için yukarıdaki adımları tekrarlayın.
- Görüntü hayvanlar ölçüm odasının aşaması (örneğin, altında sıcak mat koyarak) sıcak olduğundan emin her 10 saat sonrası enjeksiyon için 2 saat ve daha sonra 24 saat sonrası enjeksiyon, hipotermi önlemek için. Her ölçümden sonra, yiyecek ve su ad libitum bir kafese hayvanları yerleştirin ve ılıman bir hayvan odasında kafes yerleştirin. Hayvanlar artık dokunmak tepki kadar, daha sonra, 5-10 dakika boyunca karbon dioksit ile euthanize yapma% 2 izofluran ile ilk anestezi ile hayvanlar EuthanizeEmin hayvanlar tamamen nefes durdurmak ve rigor mortis oluşur.
- Standart çevrimiçi değerlendirilebilir protokoller (http://www.freebookez.com/mouse-dissection-lab-report/) ve görüntü organları göre fareler parçalara ayır.
- İlk hayvanlarda (karışmama) (serum fizyolojik ile arka bacak sol) otofloresansı ilgi ve iltihaplı bölgenin hedef floresan (zimosan-A ile sağ arka bacak) sonra atama bölgelerin genel floresan indirilmesiyle üreticinin talimatlarına göre ölçüm sonuçlarını değerlendirmek.
Sonuçlar
lipozomlar, sulu iç Burada kullanılan NIRF boya DY676-COOH gibi floresan boyalar yüksek konsantrasyonlarda kapsülleme floresans yüksek bir seviyeye neden olur. Floresan söndürme, yüksek konsantrasyonda birçok floroforlar görülen bir fenomen, hedef alan bir yüksek hassasiyet ve güvenilir algılama talep edilen in vivo görüntüleme uygulamalarında çeşitli istismar edilebilir. Lipozomların kullanımı, aynı zamanda, in vivo uygulamalar için gerekli olan boya koruma sağlar. Lipozomların ayrıntılı bir karakterizasyonu gereklidir ve bu in vivo görüntüleme amacıyla boya kapsüllenmiş, kararlılık ve lipozomların boyutu, floresans ve in vitro olarak kapsüllenmiş boyanın aktivitesi ve uygulanabilirlik düzeyinde gibi çeşitli faktörleri kapsar. Serbest boya bir karşılaştırma DY-676-COOH ve söndürüldü lipozomlar (Dudak-S) ve aynı zamanda çok düşük konsantrasyonlarda olmayan bir söndürüldü lipozom (Dudak-dQ)kapsüllü boya oranı, özellikle in vivo karakterizasyonu için kritiktir.
Ekstrüzyondan önce art arda dondurma ve çözme döngüleri film nemlendirme ve ekstrüzyon tekniği kullanılarak hazırlanan lipozomlar, daha hızlı elute lipozomlar (göre, başarılı bir şekilde jel filtrasyon matrisi içinde, daha uzun tutma nedeniyle lipozomlardan ayrılabilir artık serbest boya molekülünü içeren Şekil 1B). Jel filtrasyonu sonrası seyreltme seviyesine bağlı olarak, isteğe bağlı bir ultrasantrifüj aşamasından sonra (Şekil 1C) gösterildiği gibi, lipozomlar konsantrasyonunun elde edilmesini sağlar. Kapsüllenmiş boyanın absorpsiyon ve emisyon özellikleri temel kapsüllenmiş boya konsantrasyonunun serbest boya (Şekil 1D) bir kalibrasyon eğrisi yardımıyla belirlenir. Kapsüllenmiş boya konsantrasyonu yanı sıra, lipozomların kıç büyüklüğü ve homojenlik belirlemek için önemlidirer hazırlanması. Şekil 1E de görüldüğü gibi, alttaki yöntemi ile hazırlanan lipozomlar elektron mikroskop entravsekiler DY-676-COOH ihtiva eden, söndürme bir konsantrasyon aralığında (Dudak-Q ya da lipozom vezikül çoğunlukla tek katmanlı bir morfolojiye ortaya koymuştur 606-846 uM DY-676 ) veya non-söndürüldü boya konsantrasyonu (Dudak-dK'un de; 25 uM DY-676). Bundan başka, bunlar çok 1 (Tablo 1) altına, yaklaşık 120 nm ve polidispersite endeksleri, homojen bir boyut dağılımına ortaya koymaktadır. Floresans sayesinde, dudak-Q, tepe mavi dalga boyu yönünde bir değişiklik ile karakterize edilir, burada sulu tampon içinde iki maksimum absorpsiyon göstermektedir. Bu doğrultuda, floresan emisyon ücretsiz boya (Şekil 2A ve B, sağ) göre çok düşüktür. Çevre çözelti içinde seyreltilmiş alır boya, serbest olarak lipozomlar, sonuç-Don zararı. Mavi-kaymıştır emme zirve dolayısıyla disappears Dudak-Q, tek bir emme zirve ile sonuçlanmaktadır. Buna uygun olarak, dondurularak hasar Dudak-Q, flüoresans yoğunluğunda bir artış, açığa çıkan boyanın moleküllerden floresan aktivasyonu meydana gelen işaret eden, görülmektedir. ücretsiz boya bakılmaksızın dondurma (Şekil 2A ve B, sol) aynı seviyede kalması sadece tek bir absorpsiyon maksimum ve yüksek floresan yoğunluğu, ortaya koymaktadır. , Çevreden boya koruma, yüksek konsantrasyon ve ilgili floresan söndürmeyi korumak ve hedef tetikleyiciler tarafından aktive floresan artış nedeniyle algılamayı etkinleştirmek ederdi Dudak-Q Bu bulgu, lipozomlar boyanın o kapsüllenmesini göstermektedir.
Altta yatan lipit bileşimiyle lipozomal probları enerji tüketimi ile engellenir baskın fagositik alımını göstermektedir. Bu son derece fagositik sıçangil makrofaj hücresi soyu, J774A.1 Dudak-Q alımından ile görülen edilebilir vehafif fagositik insan glioblastoma hücre çizgisi, U-118 mg, 37 ° C'de ve inhibisyon 4 ° C'de (Şekil 3A ve B). serbest boya DY-676-COOH fagositik hücre çizgilerinin her ikisi de 37 ° C 'de ve lipozomal sistemi Dudak-Q, çözelti içinde herhangi bir artık serbest boya içerir ve aktif bir alımını sadece tabi gösterir 4 ° C' de alımını göstermektedir. Konfokal lazer tarama mikroskobu görüntüler ayrıca fagositik hücreler (Şekil 3C) Dudak-Q alımını ve aktivasyonunu kanıtlamaktadır. Ayrıca, fagositik olmayan insan fibrosarkoma hücre çizgisinde floresan eksikliği, HT-1080 fagositik monositler / makrofajlar söz konusu inflamasyon görüntüleme için uygun olacaktır, Dudak-Q alımı ağırlıklı fagositoz ile ve dolayısıyla olduğunu gösterir.
Kültürlü hücre hatlarında görülen lipozomlarının fagositik alımı ile tutarlı ve belirli bir zaman için Dudak-Q yol açar intravenöz enjeksiyon söndürme floresan sayesindeÇok düşük eşiğe ile fare modellerinde ödem (Şekil 4A, dudak-Q), flüoresan yoğunluğundaki bağlı bir artış. ödem maksimum floresan yoğunluğu Dudak-Q 8-10 saat sonrası enjeksiyon tespit edilir. Bütün fare aksine, göreli olarak güçlü NIR floresan ücretsiz DY-676-COOH (Şekil 4A, DY-676-COOH) veya her zaman açık lipozom, Dudak-dK (Şekil 4A, Dudak-dK'un uygulamasından sonra görülür ). Ödem, güvenilir bir tespit (Şekil 4A, DY-676-COOH mümkün değildir, böylece 0-4 saat sonra enjeksiyon görüldüğü gibi Dudak-Q, hızlı perfüzyon ve serbest DY-676-COOH temizlenmesine kıyasla, görüntüleme müdahale ). Ayrıca, sigara söndürülmüş lipozom, Dudak-dK 8 saat kadar hemen hemen sabit kalır 2-4 saat sonrası enjeksiyon içinde ödem maksimum floresan ortaya, sonra yavaş yavaş söndürülür Dudak-Q-tabanlı ödem floresan benzer azalır. Yarı-kantitatif anal Sahneçok açık bir ilgi bölgeleri (ROI) arka plan karşı ödem için belirlenen sayede, bir farklı prob ile algılama farklı düzeylerde ilgili sonuçlar yapabilirsiniz. Grubu (prob) içinde 5 hayvan olacak yarı-nicel analizine göre, ödem (p = 0.001) serbest DY-676-COOH ya da olmayan söndürüldü Dudak-dQ ile daha Dudak-Q ile tespit edildi (Şekil daha belirgin olabilir 4B).
Farelerin görüntüleme organları prob 24 saat sonrası enjeksiyon ortadan kaldırılması için delil olarak hizmet karaciğer / safra kesesi ve böbrekler ve çok düşük ya da dalak hiçbir floresan, akciğerler ve kalp (Şekil 5), hafif ex vivo floresan ortaya ötenazi hepatobilier güzergahı üzerinden prob.

Şekil 1: DY-676-COOH yüklü lipozom hazırlanmasıs. (AC) ilgili sentez adımları şematik bakış. (A) yakın kızılötesi boya DY-676-COOH film hidrasyon ve ekstrüzyon Kur. (B) interfazda gösteren self-made jel filtrasyon kurulum resmi kapsüllenmemiş (serbest) boya maddesi ve lipozomlar arasındadır. Lipozomlar ilk Zehir nedeniyle kapsüllü DY-676-COOH (mavi) mavi-yeşil görünür ve dahil yeşil fosfolipid, NBD-DOPE. (C) lipozom-sediman (Dudak-Q) Temsilcisi görüntü Ultrasantrifügasyon ile konsantrasyon sonrası. ( D) lipozomal boya ölçümü için kullanılan 10 mM Tris pH 7.4 (% 1 Triton X100 içeren). (E) Dudak-Q Cryo-transmisyon elektron mikroskobu DY-676-COOH Temsilcisi kalibrasyon eğrisi. görüntülemek için buraya tıklayınız Şeklin büyük bir versiyonu.
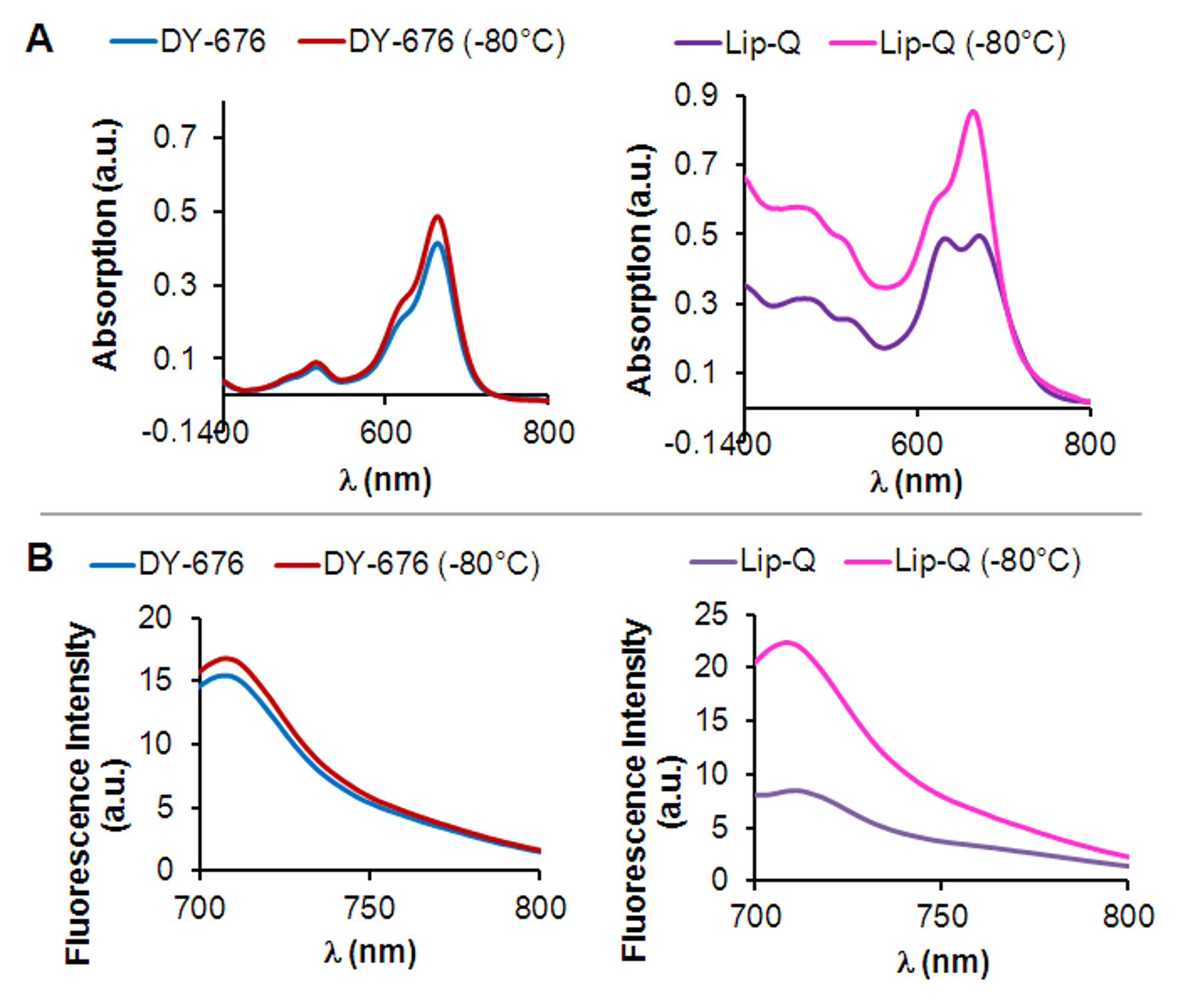
Şekil 2:., In vitro olarak floresans ve aktivasyon fiziko kimyasal belirlenmesi Dudak-Q (sağ) ve (A) absorpsiyon spektrumları serbest DY-676-COOH, 10 mM Tris tamponu pH 7.4 içinde ölçülmüştür (solda), daha önce ya da dondurma işleminden sonra - 80 ° C. . Ücretsiz DY-676-COOH ve Dudak-Q dondurularak hasar sonrası mavi-kaymıştır zirve kaybolması ile karşılaştırıldığında Dudak-Q karakteristik çift tepe Not (B) (sağ) Dudak-Q floresan emisyon spektrumları Sorumlu ve serbest DY-676-COOH (solda) önce ya da -80 ° C'de dondurma işleminden sonra, 10 mM Tris tamponu pH 7.4 içinde ölçülmüştür.

Şekil 3: dudak hücresel alımı ve floresan aktivasyon osomes. görüntüler (A) belirtilen sıcaklıklarda, 24 saat için ilgili araştırmalara tabi tutulmadan sonra hücre peleti, NIR floresan görüntüleme ile hazırlanmıştır. HT-1080 hücreleri, 4 ° C'de 24 saat kuluçka dönemleri hayatta değildi. (B) 'de çubuklu şemalar Her çubuk ± SD, n = 3 deney ortalama yoğunlukları temsil eder, A, hücre peletlerine ROI atayarak var floresan sinyalleri yarı-kantitatif düzeylerini temsil eder. (C) görüntüleri, 37 ° C'de 24 saat süre ile kültür oda slaytlar üzerinde prob maruz kalan hücrelerin odaklı lazer tarama mikroskobu ile elde edildi. Yüksek fagositik sıçangil makrofaj hücresi soyu, J774A.1 floresans yüksek düzeyde ve hafif fagositik insan glioblastoma hücre hattı, U-118 mg orta floresan edin. fagositik olmayan insan fibrosarkoma hücre çizgisi HT-1080 prob herhangi bir floresan gösterir. NBD-DOPE: yeşil floresan fosfolipid.yük / 52.136 / 52136fig3highres.jpg "target =" _ blank "> rakamın daha büyük bir versiyonunu görmek için burayı tıklayınız.
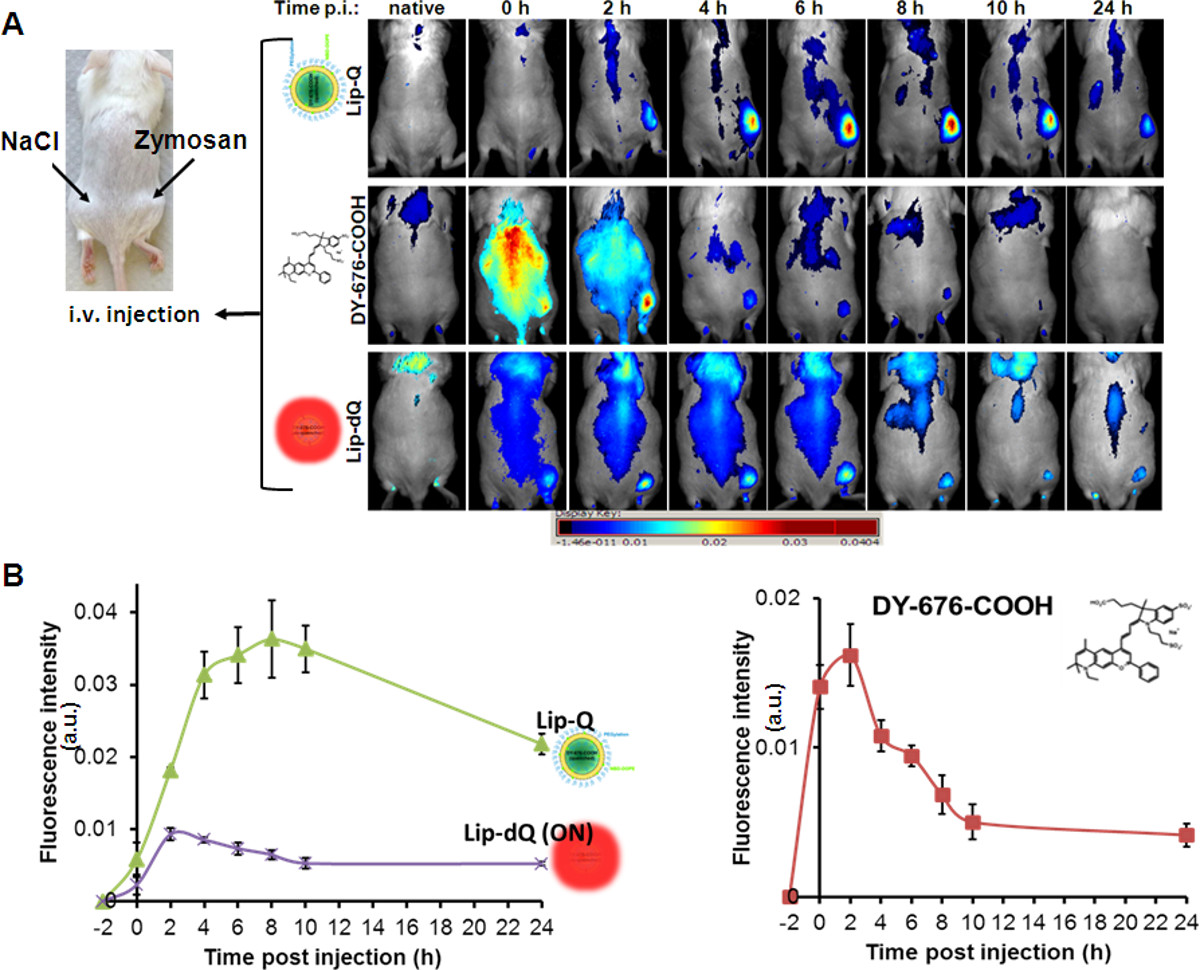
Farelerde zimosan kaynaklı ödemin in vivo optik görüntüleme Şekil 4. (A). Soldaki fare resim deri altından pozisyonları zimosan-A (500 ug ul tuzlu su içinde 50) ve kontrol tuzlu su çözeltisi tatbik gösterir (50 ul) Sol kanatta. Belirtilen zaman noktalarında gösterilen prob ve tüm vücut NIR floresan görüntüleme damardan enjeksiyon kademeli ortaya, ama 8 saat sonra enjeksiyon maksimum bir floresan özelliğine sahip olan Dudak-Q (üst panel), ödem ve düşük arka plan sinyallerinin floresan sinyalleri yüksek artış. ücretsiz boya 4 saat sonrası enjeksiyon içinde perfüzyon ve hızlı temizlenmesini (orta bölme ortayal), Dudak-dK düşük sinyal şiddetleri ve genel yüksek eşiğe ile ödem tespit ortaya oysa. (B) 'de bir grafik sunumu n kontrol bölgesi (tuzlu su) = grup başına 5 hayvan ile karşılaştırıldığında her bir prob ile tespit edilen ödem, gözlenen floresans sinyalleri vurgulamak. Her arsa (n = 5) SEM ± ortalama floresan sinyallerini temsil eder. Grafikler ile, her sonda ile tespit ödem maksimum floresan sinyali (; Dudak-dK 2-4 saat ve ücretsiz DY-676-COOH, 2 saat sonrası enjeksiyon Dudak-Q, 8 saat) kolayca ayırt edilir. Orada t Dudak-dK'un karşı Dudak-Q = 0-24 saat ile ödem anlamlı (p = 0.001) daha yüksek floresan yoğunluğu ve t ücretsiz DY-676-COOH karşı Dudak-Q = 4-24 saat ile. Şeklin büyük halini görmek için lütfen buraya tıklayınız.

Şekil 5: fareler 24 saat sonrası sonda uygulaması organlarının Bio-optik ex vivo görüntüleri ve organların floresan yoğunluklarının gelen yarı-kantitatif analiz. Her çubuk floresan yoğunlukları ortalamasını temsil (n = 4) SEM ±. rakamın daha büyük bir versiyonunu görmek için burayı tıklayınız.
| Lipozom formülasyonu | Boyut [nm] | Polidispersite İndisi (PI) | Zeta Potansiyel [mV] |
| Dudak-dK (dequenched) | 123.4 ± 0.6 | 0.055 ± 0.02 | -10,6 ± 0,4 |
| Dudak-S (söndürüldü) | 118.5 ± 0.7 | 0.04 ± 0.02 | -9 ± 2 |
| Dudak-NBD (ağırlık / DY-676-COOH), | 123.0 ± 1.4 | 0.04 ± 0.03 | -11 ± 1 |
Tablo 1: Dinamik ışık saçılımı lipozomlar karakterizasyonu.
Tartışmalar
Lipozomlar aynı zamanda flüoresan boyalar için iletim sistemleri olarak kullanılabilir olduğundan, bunlar hedef hastalıklar görüntüleme sağlar. örneğin NIRF boya, burada kullanılan DY676-COOH, gibi floresan boyalar yüksek konsantrasyonlarda kapsülleme tutulmuş boyanın flüoresan söndürme yüksek düzeyde olur. Floresan söndürme, yüksek konsantrasyonda birçok floroforlar görülen bir olgu hedef alan bir yüksek hassasiyet ve güvenilir algılama talep edilen in vivo görüntüleme uygulamaları, birkaç istismar edilebilir. Lipozomların kullanımı, aynı zamanda, in vivo uygulamalar için gerekli olan boya koruma sağlar.
Film hidrasyon ve ekstrüzyon tekniği ihtiyaca göre farklı boyut aralıkları ile lipozomlar başarılı hazırlanmasını sağlayan yaygın olarak kullanılan bir yöntemdir ve bu farklı maddelerin 25 bir çokluğun kapsülleme gibi değişiklikler izin verir. Bu nedenle, bu dudak hazırlanması için uygundurosomes görüntüleme amacıyla, NIR floresan boya, DY-676-COOH ile kapsül haline getirilir. yöntem boyanın söndürüldü konsantrasyonu içindedir 600-840 uM entravsekiler boya konsantrasyonları, lipozomlar elde edilir. Kendiliğinden oluşan kese dispersiyonun homojenizasyon için kullanılan LiposoFast-Basit el ekstrüzyon presi 1 ml hacme kadar şırınga nedeniyle cihazın uyumluluğu, küçük laboratuar ölçekli lipozom preparatı için uygundur. Büyük ölçekli hazırlıkları için saat başına 1,000 L kapasiteli vezikül dağılımlarını homojenize edebiliyoruz büyük yüksek basınçlı homojenizatör kullanılması tavsiye edilir. Jel filtreleme (büyüklük hariç tutularak) kromatografisine kapsüllenmemiş (serbest) boya molekülleri 26 kapsüllenmiş lipozomal boya ayrılmasını sağlayan çok önemli bir adımdır. jel süzme kolonunun uzunluğu serbest boyadan lipozomların verimli bir şekilde dağıtmak için hayati önem taşımaktadır. Bu durumda, en az 28 cm uzunluğunda t sütun hazırlamak için gerekli olano başarıyla Burada kullanılan serbest DY-676-COOH gelen lipozomlar ayrı. İlginçtir, bu uzunluk sürece serbest karboksifloresan gelen carboxyfluorescein (CF) liposomları arındırmak için kullanılan iki katıdır. Jel filtrelemesi için önemli bir dezavantajı, saflaştırılmış numune 5-6 kat bir dilüsyonudur. Çok konsantre lipozomlar ihtiyaç vardır, bu, ultra-santrifüj ile telafi edilebilir. Ultrasantrifügasyon sırasında lipozomlar çöktürmek ve süpernatant kolayca 27 kaldırılabilir. Böyle diyaliz 28 ile olduğu gibi lipozomlar konsantre diğer yolları daha fazla zaman Ultrasantrifügasyon daha alıcıdır.
Film hidrasyon ve ekstrüzyon yöntemin yanı sıra, ters fazlı buharlaştırma yöntemi 23 olarak etanol enjeksiyon yöntemi 24 bir çok hidrofilik madde için yüksek bir kapsülleme etkinliği olan lipozom preparatı sağlamaktadır. Ancak, bizim soruşturma donma ve çözülme döngüsü ile birlikte filmin hidrasyon ortayas DY-676-COOH yeterli bir intraliposomal kapsüllenmesi için en uygun yöntem olarak. Film hidratasyonu için kullanılan başlangıç DY-676-COOH konsantrasyonunun artırılması etkinlik ve 30 mM sabit bir lipit konsantrasyonu kullanılır intraliposomal boya konsantrasyonunu arttırır. Dondurma ve çözme yöntemi ile bu kapsülleme etkinliğine rağmen kullanılan başlangıç boya konsantrasyonu% 10'un altında, ama bununla birlikte görüntüleme için gerekli söndürme konsantrasyonu kapsüllenmesi için yeterlidir. Bundan başka, jel süzme ile lipozomların, ayrılmış serbest boya tuzdan arındırma ve dehidrasyon üretici talimatlarına göre, mümkün ve genel olarak en az bir boya kaybı yeniden kapsülleme yaparak geri dönüştürülebilir. polidispersite endeksleri ve Dudak-Q elektron mikroskobu ile görüldüğü gibi altta yatan protokolü tarafından boyanın kapsülleme büyüklüğü ve lipozomlar morfolojisi üzerinde hiçbir etkisi yoktur.
Çeşitli basit yöntemler ve değerlendirme, için kullanılabilirE hazırlanmış fluoresan liposomes.DY-676-COOH aktivitesi büyük olasılıkla, H-dimer oluşumu ve boya molekülleri arasında bir pi-istifleme etkileşimi sonucu meydana gelen yüksek konsantrasyonlarda 21,29 kendi kendini söndürme için yüksek eğilimi vardır. Yüksek konsantrasyonlarda boya moleküllerinin Förster yarıçapı yakınlık nedeniyle meydana Bu etkileşimler, seyreltme 30 ile imha edilebilir. Bu nedenle, DY-676-COOH yüksek konsantrasyonlarda kapsülleme ancak bu şekilde yüksek bir konsantrasyon, bakım ve mavi-kaydırılmış absorpsiyon olarak saptanabilir flüoresans söndürme tutma, in vivo olarak, aynı zamanda çevredeki tampon opsonitasyonunu gelen boya korumaz tepe ve Şekil 2'de görüldüğü gibi, düşük floresan emisyonu. -80 ° C de yavaş yavaş lipozomlar Donma düşünmeden 30 ° C'de eritildiğinde lipozomal zarın zarar verir, sulu iç 31, buz kristallerinin oluşumuna yol açar. serbest, seyreltme ve floresan ActiDudak-Q, böylece, yüksek bir su verme konsantrasyon tecrit eder gösteren, tek bir emme zirve ortaya dondurma sonra tampon içinde içi lipozomal DY-676-COOH gözlem ve floresan yoğunluğu yaklaşık 2.5 kat bir artış (Şekil 2), DY-676-COOH ve aktive edilebilir bir. Her ikisi de, birçok floresan boyalar 32 spektral özelliklerini etkileyen çünkü diğer yöntemler, örneğin serbest boya ve lipozomal kapsüllenmiş boya arasındaki belirgin farklar ortaya olmayan deterjan ya da organik çözücülerin kullanımı Lipozomal lipit ikili tabakasına zarar. yavaş dondurma ve bu nedenle burada bildirilen sert eritme yöntemi lipozomlar içinde florofor yüksek kapsülleme ve bunun sonucu bir floresanlık sönmesini doğrulamak için daha güvenilir ve gelecek vaat eden bir yöntem olarak hizmet eder. Sağlam Dudak-Q (Şekil 2) absorpsiyon ve emisyon spektrumlarına kaynaktan, artık floresan belli bir düzeyde tespit edilebilir. Bu lipo içinde olmayan söndürüldü boya monomerlerden neden olabilirsomes ve aynı zamanda elektrostatik etkileşim ve fosfolipid polar baş grupları 33 ile kapsüllü boya etkisinden.
Şekil 3'te görüldüğü gibi, oldukça fagositik sıçangil makrofaj ve hafif fagositik insan glioblastoma hücre çizgisinde Dudak-Q ayrı bir birikim, U 118 mg 34, ancak fagositik olmayan insan fibrosarkoma hücre çizgisi HT-1080 dahi, fagositler inflamatuvar süreçlerin kilit oyuncuları beri inflamasyon Dudak-Q tabanlı görüntüleme, olumlu olacaktır. Enerji tüketimi serbest DY-676-COOH alımı değil Dudak-Q alımını ortadan kaldıran, ancak aslında Dudak-Q fagositik alımının özgünlüğünü alındığına dair ve Dudak-S, deney sırasında bozulmadan kalır ortaya koymaktadır boyanın başka serbest bırakılması ve Enerji-bağımsız alım algılama floresan lider yer alacaktı. Yeşil floresan fosfolipid gömülmesi, lipozom çift tabakalı NBD-DOPE mikroskobik görüntüleme ve discriminatio sağlarN arasında daha önce belirtildiği gibi 32 zamana bağlı alımı deneyleri yapılması, özellikle hücresel bozulmuş lipozomlardan olmayan azaldı. Mikroskobik resim, 37 ° C'de inkübasyondan sonra, yarı-kantitatif analizi ile tespit edildiği üzere, hücre peletlerinin floresan yoğunlukları seviyeleri ile bağlantılı olmasına karşın, DY-676-COOH NIR floresan ortaya koymaktadır. Insan glioblastoma DY-676-COOH ve ilkinden daha NBD DOPE iki alt floresan ortaya ise Buna uygun olarak, murin makrofaj hücre dizileri en yüksek floresan göstermemektedir. İnsan fibrosarkoma hücre hattı beklendiği gibi, HT-1080 lipozomal boyalar veya Dudak-Q alımı, fagositozla ağırlıklı olduğu gerçeğini güçlendirir ücretsiz DY-676-COOH, ya hiçbir floresan ortaya koymaktadır.
Potansiyelini araştırmak fagositoz odaklı inflamasyon in vivo görüntüleme, çeşitli kontroller kabul edildi Dudak-Q-tabanlı. Ücretsiz DY-676-COOH phagocyt tarafından alınabilir göz önüne alındığındaataklar, Dudak-Q opsonizasyon fagositler tarafından alınabilir boya, serbest bırakmak için neden olabilir. Bunu önlemek için, dudak-S% 5 mol PEGilasyon hazırlanmıştır. Ayrıca, bağlı iltihap bazlı EPR etkisi ve aktif alımı ve floresan aktivasyonuna alımı arasında ayrım gereklidir. Bu adres için, değerlendirme ve zimosan kaynaklı ödem taşıyan farelerde üç farklı prob, yani her zaman açık, Lip-dK'un, söndürülür Dudak-Q ve ücretsiz DY-676-COOH karşılaştırılması gerekliydi. Saccharomyces cerevisiae ve Candida albicans hücre duvarlarından hazırlanır zymosan A dectin-1 ve Toll benzeri reseptör 2/6 (TLR 2/6) ile sitokin salgılanmasının doğal bir uyarıcıdır. Bu da salgılanan sitokinler ve böylece bir dalak hazne 35 gibi nötrofil ve inflamasyon bölgelerinde kendi göç monosit / makrofaj içeri geçiş / ekstravazasyon hızı, vasküler sızıntı neden aşağı akan uyarmamaktadır(Ödem) 36-39. zimosan-tabanlı monositler / makrofaj ekstravazasyon ve göç süreci zymosan inflamatuar süreçleri 36-39 çalışmak için stratejik bir araç yapar sadece 4,5-6 saat gerekir. Nedeniyle inflamasyon sırasında neden vasküler sızıntılara, intravenöz sondalar ya inflamasyon sitesi veya extravasate onların göç sırasında monosit / makrofajlar (fagositler) tarafından alınabilir ve ödem sitesinde (EPR etkisi) 40 kadar alınacak enjekte. olmayan söndürüldü Dudak-dQ kullanımı Dudak-Q daha ödem sinyallerine genel güçlü bir arka plan ve monositler ve makrofajlar göçünü yansıtan ödem flöresanlı bir artış ortaya koymaktadır. Aslında, ödem maksimum floresan zaten Dudak-dK'un 2-4 saat sonrası uygulama görmüş ve 8 saat kadar hemen hemen sabit kalır. Dudak-dK'un ve Dudak-Q Karşılıklı, ücretsiz DY-676-COOH enjeksiyonundan sonra hızlı perfüzyon uğrar ve ödem farklı görüntüleme mümkün olmayacak şekilde, 4 saat içinde temizlenir. Içindeilginç şekilde, ödem floresan yoğunluğu ve çok düşük arka plan sinyalleri sürekli artış Dudak-S sonuçlanır. Dudak-Q ile floresan yoğunlukları bu kalıcı artış, lipozomal yayımlanan boya aktivasyonunu floresan atfedilir. Birlikte ele alındığında, bu Dudak-dK 4 saat sonrası enjeksiyon maksimum bir floresan (EPR etkisi ve monosit göçü) ortaya beri Dudak-Q tabanlı görüntüleme EPR-etkisi katkısı az olduğu sonucuna varılabilir. Bu nedenle, lipozomal kapsülleme koruma ve buna karşılık sadece fagositik hücreler tarafından internalizasyondan ve bozulma (floresans aktivasyonu) sonra ödem in vivo görüntüleme daha güvenilir bir sağlar DY-676-COOH, ayrı iletir. Şimdiye kadar, floresan lipozomlar görüntüleme özelliklerini doğrulamak için zimosan kaynaklı arka bacak ödemi kullanımı yenidir. Burada rapor edilen protokol farklı floresan boyalar kapsüllenmesi ve farklı inhibitör dru etkisini görüntüleme hem genişletilebilirenflamasyon indüksiyonuna GS, ve bu nedenle hazırlanması ve biyomedikal görüntüleme için uygun problar karakterizasyonu için yararlı bir araç oluşturmaktadır.
Uygun görüntüleme probları tanımlayan yolunda bir başka önemli adım, farmakolojik özellikleri ve eliminasyon yollarının doğrulama. Bu tür organlardan karaciğer ve böbrekler gibi kısa tutma ve uygun bir eleme salgı içinde önemli bir rol oynamaktadır organlarda sondaların dağıtım sondaları daha büyük olasılıkla hasta üzerinde herhangi bir olumsuz etki gösterir ki, genellikle bir göstergesidir. Buna göre, farelerin organları aracılığıyla lipozomal floroforun bir tercih eleme anlamına Dudak-Q veya serbest DY-676-COOH ortaya sadece hafif karaciğer / safra kesesi floresan ve böbreklerde, 24 saat sonrası enjeksiyon hazırlanan hepatobilier rota. Bu organlarda prob ve etkili biçimde yok kısa konaklama 7-fol tarafından doğrulanmıştırorganların d yüksek floresan sinyalleri Dudak-Q veya serbest DY-676-COOH 32 6 saat sonrası enjeksiyon hazırladı. Bu gözlemler lipozomlar 41 ortadan kaldırılması uygun ve sondalar karakterize ederken biyolojik dağılım çalışmaları da dahil olmak üzere önemini yedekler. Bu tür aktivasyonu 42,43 tamamlayıcı ve cilt tahrişi gibi olumsuz yan etkiler, klinik uygulamalarda kullanılan lipozomal formülasyonlar için rapor edilmiştir, ancak, bu tür etkiler altında yatan lipozomlar ile tespit edilememiştir. Ayrıca fareler organlardan sondaların arındırılması için yol sistemi enjeksiyondan sonra iki hafta içinde bağışıklık eksikliği olan farelerde gözlenmesi (gösterilmemiştir).
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Bu çalışma, Deutsche Forschungsgemeinschaft HI-698 / 10-1 hibe ve RU-1652 / 1-1 ile desteklenmiştir. Biz mükemmel teknik yardım ve destekleri için şirket DYOMICS GmbH, Jena için Doreen Mayıs teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Materials and equipments for preparation of liposomes | |||
| egg phospahtidylcholine | Avanti Polar Lipids | 840051P | Dissolve in chloroform and store in glass vials (214 mg/ml) |
| cholesterol | Sigma | C8667 | Dissolve in chloroform and store in glass vials (134 mg/ml) |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt) | Avanti Polar Lipids | 880120P | Dissolve in chloroform and store in glass vials (122 mg/ml) |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt) | Avanti Polar Lipids | 810145P | Dissolve in chloroform and store in glass vials (2 mg/ml) |
| Sartorius MC1 (d = 0.01 mg) | Sartorius AG | Research RC 210 P | used for weighing the phospholipids |
| Rotavapor | Büchi Labortechnik AG | R-114 | used for hydration of phospholipid film |
| Waterbath | Büchi Labortechnik AG | R-481 | used for hydration of phospholipid film |
| Vacuum Controller | Büchi Labortechnik AG | B-720 | used for hydration of phospholipid film |
| Vacobox | Büchi Labortechnik AG | B-177 | used for hydration of phospholipid film |
| Circulation Chiller | LAUDA DR. R. WOBSER GMBH & CO. KG | WKL 230 | used for hydration of phospholipid film |
| DY-676-COOH | Dyomics GmbH | 676-00 | Dissolve in 10 mM Tris and store stock at -20°C |
| Tris-(Hydroxymethyl)-aminomethan | Applichem | A1086 | buffer 10 mM, pH 7.4 |
| Trichlormethan | Carl Roth GmbH + Co. KG | Y015.2 | used for liposome preparation |
| Sonicator | Merck Eurolab GmbH | USR 170 H | used for liposome preparation |
| Vortex Genie 2 (Pop-off Cup, No. 146-3011-00) | Scientific Industries Inc. | SI-0256 | used for liposome preparation |
| Sephadex G25 medium | GE Healthcare Europe GmbH | 17-0033-01 | used for liposome purification |
| Triton X100 | Ferak Berlin GmbH | 505002 | used to destruct liposomes for dye quantification |
| LiposoFast-Basic | Avestin Inc. | used for the extrusion of liposomes | |
| Polycarbonate filter membrane, 100 nm (Whatman Nucleopore Trans Etch Membrane, NUCLEPR PC 19 MM, 0.1 U) | VWR | used for the extrusion of liposomes via LiposoFast-Basic | |
| Fluostar Optima | BMG Labtech | used for dye quantification | |
| Zetasizer Nano ZS | Malvern | used for the determination of liposome size and zetapotential | |
| Ultracentrifuge | Beckmann Coulter GmbH | XL 80 | used for concentration of the samples |
| Rotor | Beckmann Coulter GmbH | SW 55 TI | used for concentration of the samples |
| Materials and equipments for the evaluation of liposome and optical imaging | |||
| Zymosan-A from Saccharomyces cereviciae | Sigma | Z4250-250MG | used for induction of inflammation |
| Isotonic Saline (0.9%) | Fresenius GmbH | PZN-2159621 | used for the dilution of Zymosan-A |
| Isoflurane vaporizer | Ohmeda Isotec 4 | used for anesthesizing animals | |
| Isoflurane | Actavis GmbH | PZN-7253744 | anesthesia |
| Thermo Mat Pro 20 W | Lucky Reptile | 61202-HTP-20 | used to keep animals warm during anesthesia |
| Omnican-F (1 ml injection) | Braun | PZN-3115465 | used for subcutaneous and intravenous application of probes |
| Panthenol eye cream | Jenapharm | PZN-3524531 | used to prevent dryness of the eyes of animals during anesthesia |
| Hanks buffered saline solution | PAA Laboratories /Biochrom AG | L2045 | w/o Mg2+, Ca2+ and phenol red. For dilution of probes and for washing of cells |
| 8-Well chamber slides | BD Biosciences | 354108 | used for cell culture followed by microscopy |
| Cell culture flasks | Greiner BioOne | ||
| Cell culture media | Gibco (life technologies GmbH) | ||
| Fetal calf serum | Invitrogen | ||
| Poly-L-Lysine solution (0.01%, 50 ml) | Sigma | P4832 | used to coat cell culture chamber slides |
| Mountant Permafluor | ThermoScientific | S21022-3 | Mounting solution for microscopy |
| Hoechst-33258 | AppliChem | DNA stain for microscopy | |
| Hera-Safe | Heraeus Instruments | sterile work bench used for cell culture | |
| HERA cell | Heraeus Instruments | Incubator used for cell culture | |
| LSM510-Meta | Zeiss | used for confocal microscopy | |
| Maestro-TM in vivo fluorescence imaging system | CRi, Woburn | used for whole body fluorescence imaging of small animals | |
| Spectrophotometer (Ultrospec 4300 pro UV) | GE Healthcare | used for measurement of absorption | |
| Spectrofluorometer (Jasco FP-6200) | Jasco | used for measurement of fluorescence emission | |
| Animals | |||
| NMRI mice (8-12 weeks old, male) | Elevage Janvier, France | used for inflammation trials | |
Referanslar
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers). Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Cabanes, A., et al. Enhancement of antitumor activity of polyethylene glycol-coated liposomal doxorubicin with soluble and liposomal interleukin 2. Clinical cancer research : an official journal of the American Association for Cancer Research. 5, 687-693 (1999).
- Gabizon, A., Shmeeda, H., Grenader, T. Pharmacological basis of pegylated liposomal doxorubicin: impact on cancer therapy. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 45, 388-398 (2012).
- Balasubramanian, S. V., Bruenn, J., Straubinger, R. M. Liposomes as formulation excipients for protein pharmaceuticals: a model protein study. Pharmaceutical research. 17, 344-350 (2000).
- Meyer, J., Whitcomb, L., Collins, D. Efficient encapsulation of proteins within liposomes for slow release in vivo. Biochemical and biophysical research communications. 199, 433-438 (1994).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochimica et biophysica acta. 858, 161-168 (1986).
- Mayer, L. D., Bally, M. B., Hope, M. J., Cullis, P. R. Techniques for encapsulating bioactive agents into liposomes. Chemistry and physics of lipids. 40, 333-345 (1986).
- Walde, P., Ichikawa, S. Enzymes inside lipid vesicles: preparation, reactivity and applications. Biomolecular engineering. 18, 143-177 (2001).
- Weissleder, R., Ntziachristos, V. Shedding light onto live molecular targets. Nature medicine. 9, 123-128 (2003).
- Licha, K., Riefke, B., Ebert, B., Grotzinger, C. Cyanine dyes as contrast agents in biomedical optical imaging. Academic radiology. 9 Suppl 2, S320-S322 (2002).
- Pauli, J., et al. Novel fluorophores as building blocks for optical probes for in vivo near infrared fluorescence (NIRF) imaging. Journal of fluorescence. 20, 681-693 (2010).
- Holzer, W., et al. Photostability and thermal stability of indocyanine green. Journal of photochemistry and photobiology. B, Biology. 47, 155-164 (1998).
- Gandorfer, A., Haritoglou, C., Kampik, A. Retinal damage from indocyanine green in experimental macular surgery. Investigative ophthalmology & visual science. 44, 316-323 (2003).
- Saxena, V., Sadoqi, M., Shao, J. Degradation kinetics of indocyanine green in aqueous solution. Journal of pharmaceutical. 92, 2090-2097 (2003).
- Kodjikian, L., et al. Toxic effects of indocyanine green, infracyanine green, and trypan blue on the human retinal pigmented epithelium. Graefe's archive for clinical and experimental ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle Ophthalmologie. 243, 917-925 (2005).
- Sevick-Muraca, E. M., Houston, J. P., Gurfinkel, M. Fluorescence-enhanced, near infrared diagnostic imaging with contrast agents. Current opinion in chemical biology. 6, 642-650 (2002).
- Bremer, C., Ntziachristos, V., Weissleder, R. Optical-based molecular imaging: contrast agents and potential medical applications. European radiology. 13, 231-243 (2003).
- Hilderbrand, S. A., Kelly, K. A., Weissleder, R., Tung, C. H. Monofunctional near-infrared fluorochromes for imaging applications. Bioconjugate chemistry. 16, 1275-1281 (2005).
- Langhals, H., et al. Cyanine dyes as optical contrast agents for ophthalmological surgery. Journal of medicinal chemistry. 54, 3903-3925 (2011).
- Pauli, J., et al. An in vitro characterization study of new near infrared dyes for molecular imaging. European journal of medicinal chemistry. 44, 3496-3503 (2009).
- Ogawa, M., Kosaka, N., Choyke, P. L., Kobayashi, H. H-type dimer formation of fluorophores: a mechanism for activatable, in vivo optical molecular imaging. ACS chemical biology. 4, 535-546 (2009).
- Szoka, F., Papahadjopoulos, D. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation. Proc.Natl.Acad.Sci.U.S.A. 75, 4194-4198 (1978).
- Batzri, S., Korn, E. D. Single bilayer liposomes prepared without sonication. Biochimica et biophysica acta. 298, 1015-1019 (1973).
- Fahr, A., van Hoogevest, P., May, S., Bergstrand, N., ML, S. L. Transfer of lipophilic drugs between liposomal membranes and biological interfaces: consequences for drug delivery. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 26, 251-265 (2005).
- New, R. R. C. Liposomes a practical approach. , IRL Press at Oxford University Press. (1990).
- Barenholz, Y., et al. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16, 2806-2810 (1977).
- Schwendener, R. A. The preparation of large volumes of homogeneous, sterile liposomes containing various lipophilic cytostatic drugs by the use of a capillary dialyzer. Cancer drug delivery. 3, 123-129 (1986).
- Pauli, J., et al. Suitable labels for molecular imaging--influence of dye structure and hydrophilicity on the spectroscopic properties of IgG conjugates. Bioconjugate chemistry. 22, 1298-1308 (2011).
- Wu, P., Brand, L. Resonance energy transfer: methods and applications. Analytical biochemistry. 218, 1-13 (1994).
- Stark, B., Pabst, G., Prassl, R. Long-term stability of sterically stabilized liposomes by freezing and freeze-drying: Effects of cryoprotectants on structure. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 41, 546-555 (2010).
- Tansi, F. L., et al. Liposomal encapsulation of a near-infrared fluorophore enhances fluorescence quenching and reliable whole body optical imaging upon activation in vivo. Small. 9, 3659-3669 (2013).
- Chen, R. F., Knutson, J. R. Mechanism of fluorescence concentration quenching of carboxyfluorescein in liposomes: energy transfer to nonfluorescent dimers. Analytical biochemistry. 172, 61-77 (1988).
- Windler-Hart, S. L., Chen, K. Y., Chenn, A. A cell behavior screen: identification, sorting, and enrichment of cells based on motility. BMC cell biology. 6, 14(2005).
- Swirski, F. K., et al. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
- Erdo, F., Torok, K., Aranyi, P., Szekely, J. I. A new assay for antiphlogistic activity: zymosan-induced mouse ear inflammation. Agents and actions. 39, 137-142 (1993).
- Ajuebor, M. N., et al. Endogenous monocyte chemoattractant protein-1 recruits monocytes in the zymosan peritonitis model. Journal of leukocyte biology. 63, 108-116 (1998).
- Ajuebor, M. N., Das, A. M., Virag, L., Szabo, C., Perretti, M. Regulation of macrophage inflammatory protein-1 alpha expression and function by endogenous interleukin-10 in a model of acute inflammation. Biochemical and biophysical research communications. 255, 279-282 (1999).
- Ajuebor, M. N., et al. Role of resident peritoneal macrophages and mast cells in chemokine production and neutrophil migration in acute inflammation: evidence for an inhibitory loop involving endogenous IL-10. J Immunol. 162, 1685-1691 (1999).
- Binstadt, B. A., et al. Particularities of the vasculature can promote the organ specificity of autoimmune attack. Nature. 7, 284-292 (2006).
- Ishida, T., Harashima, H., Kiwada, H. Liposome clearance. Bioscience reports. 22, 197-224 (2002).
- Dobrovolskaia, M. A., McNeil, S. E. Understanding the correlation between in vitro and in vivo immunotoxicity tests for nanomedicines. Journal of controlled release : official journal of the Controlled Release Society. 172, 456-466 (2013).
- Szebeni, J., et al. Prevention of infusion reactions to PEGylated liposomal doxorubicin via tachyphylaxis induction by placebo vesicles: a porcine model. Journal of controlled release : official journal of the Controlled Release Society. 160, 382-387 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır