Method Article
הקרינה-מרווה של Fluorophore הקרוב אינפרא אדום-כמוס liposomal ככלי ל
* These authors contributed equally
In This Article
Summary
The use of fluorophores for in vivo imaging can be greatly limited by opsonization, rapid clearance, low detection sensitivity and cytotoxic effects on the host. Encapsulation of fluorophores in liposomes by film hydration and extrusion leads to fluorescence quenching and protection which enables in vivo imaging with high detection sensitivity.
Abstract
Optical imaging offers a wide range of diagnostic modalities and has attracted a lot of interest as a tool for biomedical imaging. Despite the enormous number of imaging techniques currently available and the progress in instrumentation, there is still a need for highly sensitive probes that are suitable for in vivo imaging. One typical problem of available preclinical fluorescent probes is their rapid clearance in vivo, which reduces their imaging sensitivity. To circumvent rapid clearance, increase number of dye molecules at the target site, and thereby reduce background autofluorescence, encapsulation of the near-infrared fluorescent dye, DY-676-COOH in liposomes and verification of its potential for in vivo imaging of inflammation was done. DY-676 is known for its ability to self-quench at high concentrations. We first determined the concentration suitable for self-quenching, and then encapsulated this quenching concentration into the aqueous interior of PEGylated liposomes. To substantiate the quenching and activation potential of the liposomes we use a harsh freezing method which leads to damage of liposomal membranes without affecting the encapsulated dye. The liposomes characterized by a high level of fluorescence quenching were termed Lip-Q. We show by experiments with different cell lines that uptake of Lip-Q is predominantly by phagocytosis which in turn enabled the characterization of its potential as a tool for in vivo imaging of inflammation in mice models. Furthermore, we use a zymosan-induced edema model in mice to substantiate the potential of Lip-Q in optical imaging of inflammation in vivo. Considering possible uptake due to inflammation-induced enhanced permeability and retention (EPR) effect, an always-on liposome formulation with low, non-quenched concentration of DY-676-COOH (termed Lip-dQ) and the free DY-676-COOH were compared with Lip-Q in animal trials.
Introduction
ליפוזומים נחקרו באינטנסיביות ויהוו את אחד ממערכות אספקת הסמים ביו-רפואיות ביולוגית ביותר עבור יישומים קליניים 1,2. הם מורכבים בעיקר מפוספוליפידים וכולסטרול, אשר שניהם תרכובות ביולוגית מחקה חלקים של קרום תא טבעי. אילו יכולים לנפול בפח חומרים הידרופילי בפנים המימי, ניתן לשלב סוכני lipophilic בתוך bilayer פוספוליפידים liposomal 3. Encapsulation של חומרים בתוך הפנים מימיים של יפוזומים מעניק הגנה מפני השפלה in vivo וגם מונע המערכת המארחת מהשפעות רעילות של תרופות ציטוטוקסיות המשמשות לטיפול במחלות, לדוגמא chemotherapeutics נועד להשמיד תאים סרטניים. השינוי של פני השטח liposomal עם פולימרים כמו polyethylenglycol (PEGylation) מרחיב עוד יותר את זמן זרימת דם liposomal in vivo בשל התייצבות sterical 4. Moreovאה, ליפוזומים יכולים לעקל ריכוזים גבוהים של מספר חומרים כגון חלבונים 5,6, חומרים הידרופילי 7,8 ואנזימים 9. לכן הם משמשים כלים טיפוליים ואבחון קליניים אמינות כמו שיזכו לאישורם למשלוח של תרופות ציטוטוקסיות כגון דוקסורוביצין לטיפול בסרטן 4. בשל הגמישות שלהם, יכולים גם להיות טעונים יפוזומים עם fluorochromes למטרות אבחון וניתוחיים מונחות הדמיה.
הדמיה הקרינה מספקת חסכוני ולא פולשנית בכלי אבחון vivo שלעומת זאת, דורשים כמה דרישות בסיסיות. זה יכול להיות הוכיח כי יש לי fluorochromes שיתאים להדמית in vivo קליטה אופיינית ומקסימום פליטה בטווח שבי פיזור האור והפיזור, כמו גם autofluorescence רקמות שמקורן במים והמוגלובין נמוך. לפיכך, יש בדיקות כאלה מקסימום שרירי הבטן / em בין 650 ל 900 ננומטר 10. חוץ מזה, את היציבות של fluorochromes הן במבחנה in vivo היא קריטית, כמו opsonization ופינוי מהיר יכולים להגביל את בקשתם לin vivo הדמיה 11 מאוד. השפעות אחרות כגון יציבות עניה ורגישות נמוכה או תופעות רעילות לתאים באברי מטרה כפי שניתן לראות בירוק Indocyanine (ICG) 12-16, אינן רצויות ויש לקחת בחשבון בעת תכנון בדיקות הדמיה in vivo. תצפיות אלה הובילו לפיתוח הפעיל של כמה fluorochromes פרה-קליני NIR, חלקיקים, כמו גם טכניקות חדשות להדמית in vivo של תהליכים דלקתיים, סרטן ולניתוחי מונחי תמונה 17-20. למרות היציבות ביותר (הקרינה תת-אדום הקרובה) NIRF פרה-קליני צבעים במבחנה, זלוף המהיר והסליקה דרך הכבד והכליות לעכב את השימוש שלהם בהדמיה האופטית in vivo של מחלות ותהליכים דלקתיים.
ntent "> לכן אנו מציגים פרוטוקול לאנקפסולציה של fluorochromes כגון מאופיין היטב קרוב אינפרא אדום צבע פלואורסצנטי DY-676-COOH, ידוע בנטייתה להרוות עצמי בריכוזים גבוהים יחסית 21 ביפוזומים. בריכוזים גבוהים H- היווצרות ו / או דימר ואינטראקציות בין מולקולות fluorophore ממוקמות בתוך תוצאת רדיוס פורסטר של זה בהעברת פורסטר אנרגיית תהודה (סריג) בין מולקולות fluorochrome. בריכוז נמוך המרחב שבין עליות מולקולות fluorophore, ובכך למנוע אינטראקציה לערום-pi לערום-pi H-דימר היווצרות וכתוצאה מכך פליטת הקרינה גבוהה. מעבר בין ריכוז הגבוה ונמוך ומרווית הקרינה הליווי וההפעלה הוא אסטרטגיה מבטיחה שניתן לנצל להדמיה אופטית 22. במובן זה, אנקפסולציה של ריכוזים גבוהים של צבע NIRF DY-676-COOH בפנים המימי של יפוזומים הוא יותר favorable הדמיה in vivo מהצבע החופשי. האתגר של השיטה טמונה קודם כל באנקפסולציה הנכונה ושנית, באימות של היתרונות הנובעים ממתמצתים ריכוזים גבוהים של הצבע. השוואת תכונות ההדמיה של יפוזומים הרווה עם זה של הצבע החופשי וגם עם ניסוח liposome-הרווה אינה עם ריכוזים נמוכים של הצבע היא הכרחית. אנחנו מראים בפרוטוקול לחות סרט וחול פשוט, אך יעיל מאוד בשילוב עם מחזורי הקפאה והפשרה חלופיים שאנקפסולציה של ריכוזי מרווה של DY-676-COOH ביפוזומים אינה ריאלי. שיטות אחרות המשמשות להכנה ליפוזומים כגון שיטת השלב ההפוך אידוי 23, כמו גם את שיטת הזרקת אתנול 24 לאפשר הכנת liposome עם יעילות אנקפסולציה גבוהה עבור רבים חומרים הידרופילי. עם זאת, טבעו של החומר להיות במארז יכול להשפיע על יעילות אנקפסולציה. למעשה,פרוטוקול לחות סרט וחול שהוצג כאן גילה את היעילות הגבוהה ביותר לאנקפסולציה של DY-676-COOH. כדי להמחיש את היתרונות של אנקפסולציה liposomal של DY-676-COOH, מודל בצקת נגרם על zymosan, המאפשר חקר תהליכים דלקתיים בתוך כמה שעות, היה בשימוש. כאן, הוא הוכיח כי ליפוזומים עם ריכוזים גבוהים של DY-676-COOH במארז מתאימים יותר לכל גוף בהדמיה אופטית vivo של תהליכים דלקתיים מאשר לצבוע בחינם או ניסוח liposomal-הרווה אינה עם ריכוזי צבע נמוכים. כך הפרוטוקול הבסיסי מספק שיטה פשוטה ומהירה כדי לייצר ליפוזומים ניאון הרווה והאימות של פוטנציאל ההפעלה והדמיה שלהם הן במבחנה in vivo.Protocol
הערה: כל הנהלים אושרו על ידי ועדת בעלי החיים האזורית ובהתאם להנחיות בינלאומיות על השימוש האתי בבעלי חיים.
1. הכנת חומרים ומכשירים
- הכנת פיזור שלפוחית נוצר באופן ספונטני (SFV)
- לפזר ולהכין מלאי של פתרונות פוספוליפידים הבאים: 214 מ"ג / מיליליטר phosphatidylcholine ביצה (EPC), 134 מ"ג / מיליליטר כולסטרול, 122 מ"ג / מיליליטר 1,2-distearoyl- SN N -glycero-3-phosphoethanolamine- - [methoxy (פוליאתילן גליקול) -2000] (מלח אמוניום) (MPEG 2,000 -DSPE) ו- 2 מ"ג / מיליליטר 1,2-dioleoyl- SN N -glycero-3-phosphoethanolamine- - (7-ניטרו-2-1,3-benzoxadiazol-4 -yl) (מלח אמוניום) (NBD-DOPE) בכלורופורם וחנות בבקבוקוני זכוכית.
- לרהט כלורופורם כ 3 מיליליטר בבקבוק תחתון עגול ולהעביר את הנפח המתאים של פתרון מניות פוספוליפידים לתוך הבקבוק התחתון העגול להכין ליפוזומים מורכבים מEPC: -DSPE MPEG 2000 ביחס טוחנת של 6.5:: חול 3: 0.5. לתיוג הקרינה הכפול של יפוזומים להוסיף 0.3% mol NBD-DOPE לפתרון השומנים.
- להתאדות כלורופורם מהפתרון אורגני פוספוליפידים תחת לחץ מופחת (300 mbar) על 55 מעלות צלזיוס באמצעות מאייד סיבובי.
- לאחר סרט פוספוליפידים הומוגנית נוצר, להפחית את הלחץ עד 10 mbar במשך 1-2 שעות כדי להסיר הפקדת כלורופורם שיורית.
- בעוד כלורופורם הוא מתאדה, לפזר DY-676-COOH (6.181 מיקרומטר) ב 10 pH חיץ מ"מ טריס 7.4 ולמלא כלי דיואר עם חנקן נוזלי. לעבור על אמבטיה קולית ונקבע על 50 מעלות צלזיוס.
- העבר את הנפח מתאים (0.5-1 מיליליטר) של DY-676-COOH (6.181 מיקרומטר) פתרון לבקבוק התחתון העגול כדי ללחלח את הסרט היבש פוספוליפידים והמערבולת במרץ עד שלפוחית נוצרה באופן ספונטני (SFV) צורות פיזור. ודא שכל פוספוליפידים הם התפזרו כדי למנוע אובדן של שומנים.
- tra זהירותnsfer הבקבוק התחתון העגול מכיל את פיזור SFV לחנקן נוזלי ולהקפיא את הפיזור במשך 3-5 דקות. מניחים את הבקבוק התחתון העגול לאמבטיה קולית על 50 מעלות צלזיוס להפשיר הפיזור אז מערבולת הפיזור מרץ במשך 1-2 דקות. חזור על תהליך זה שש פעמים, ובסך הכל שבעה מחזורי הקפאה והפשרה.
- חול של SFV ליצור שלפוחית liposome הומוגנית
- העבר את פיזור SFV לתוך מזרק 1 מיליליטר (מזרק) וextrude הפיזור דרך קרום פוליקרבונט 100 ננומטר באמצעות מכבש LiposoFast-יסוד לתוך מזרק-ב.
- Extrude הפיזור מהמזרק-b, חזרה למזרק, ואז לחזור על המחזור עשר פעמים. בשל חול, הפתרון בשינויים המזרק ממראה מעורפל לפיזור ברור עם זמן. לאחר עשרה מחזורים (עשרים צעדים שחול יחידים) להסיר מזרק-ב מההתקן ולמתוח את הפיזור בפעם האחרונה ממזרק ישירות לתוך סטרילי1.5 מיליליטר צינור תגובה.
- טיהור liposomal כמוס DY-676-COOH מצבע חופשי
- הכן עמודת כרומטוגרפיה ג'ל באמצעות חרוזים G25 הספוגים ב( 10 סנטימטר אורך עמודה 28, קוטר 0.8 סנטימטרים) pH חיץ מ"מ טריס 7.4.
- העבר 0.5 מיליליטר של פיזור שלפוחית extruded על מיטת ג'ל ולתת לטמיון המדגם לתוך מטריצת ג'ל.
- Elute יפוזומים עם 10 7.4 (איור 1 א) מ"מ טריס חיץ pH ולשטוף את הטור עד מתנקז צבע החופשי לגמרי מחוץ לטור. אם יהיה בכך צורך, לאסוף ולמחזר את הצבע בחינם על ידי desalting והתייבשות על פי הוראות היצרן.
- להתרכז יפוזומים eluted ידי ultracentrifugation (200,000 XG, שעת 2 ב 8 ° C) ולאחר מכן לפזר אותם בנפח מספק של pH סטרילי 10 מ"מ טריס חיץ, 7.4.
- כימות של ריכוז DY-676-COOH במארז
- הכן עקומת כיול על ידי המסת DY-676-COOH (0, 82, 124,247, 494, 988 ננומטר) ב 10 חיץ מ"מ טריס, pH 7.4 המכיל 0.1% טריטון X100.
- לפזר 2 μl (100 nmol שומנים סופיים של מניית / L 50 mmol) של יפוזומים במשך 5 דקות בטמפרטורת חדר 100 μl חיץ טריס המכיל 1% טריטון X100 להרוס את שלפוחית ולשחרר את הצבע במארז. ואז לדלל דגימות עם 10 חיץ מ"מ טריס, pH 7.4 לריכוז Triton-X100 סופי של 0.1% (V / V) מה שהופך את נפח כולל של 1 מיליליטר. הכן את כל הדגימות בשני עותקים.
- מדוד את הבליעה ופליטה של כל הדגימות (חינם DY-676-COOH וTriton-X100 טופל יפוזומים) בעירור λ = 645 nm ופליטה λ = 700 nm. להקים ולהשתמש עקומת כיול של הצבע החופשי כדי לקבוע את הריכוז של צבע במארז.
- אפיון Liposome
- לקבוע את פוטנציאל הגדלים וzeta של יפוזומים על ידי פיזור אור דינאמי. לדלל את דגימות liposomal עם המסנן מעוקר (0.2 מיקרומטר) pH חיץ 10 מ"מ טריס 7.4 לaconcentration של 100-300 מיקרומטר (שומנים בדם). העברת הדגימות מדוללת לקובט חד פעמי בנפח נמוך ולמדוד את המדגם על פי הוראות היצרן.
- לאפיין את יפוזומים על ידי מיקרוסקופי אלקטרונים על מנת לבסס את הגודל, היושרה וההומוגניות של שלפוחית liposomal על פי פרוטוקולים סטנדרטיים.
2. אישור של הקרינה-מרווה והפעלה של יפוזומים מוכנים
- ניתוח physicochemical של מרווה הקרינה והפעלה
- הכן שני צינורות 1.5 מיליליטר לLip-Q ו- 2 צינורות לDY-676-COOH החופשי. 100 nmol שומני ההעברה כולל (2.38 μl של פתרון מניות / L Lip-Q 42 mmol, המכיל 138 מיקרוגרם / מיליליטר של DY-676-COOH במארז) לצינורות המתאימים. העבר את המקבילה DY-676-COOH חופשי לתוכן הצבע של השפתיים-Q (0.38 מיקרוגרם שהתוצאה למשל מ 138 מיקרוגרם / μl 1000 x 2.38 μl Lip-Q בשימוש). דגירה אמבטיה אחדדואר של כל בדיקה על 4 מעלות צלזיוס ולהקפיא את הצינור השני ב -80 מעלות צלזיוס למשך הלילה (16 שעות).
- לחמם בלוק חימום עד 30 מעלות צלזיוס. מלא תיבת קירור עם קרח כתוש ולאזן aliquot של pH חיץ 10 מ"מ טריס 7.4 לטמפרטורת חדר.
- הסר בדיקות מ4 ° C ולאזן בטמפרטורת חדר (עטופה בנייר אלומיניום כדי להגן מפני אור) ובמהירות להפשיר בדיקות מ-80 ° C ב 30 מעלות צלזיוס למשך 5 דקות. צ'יל הבדיקות מופשרות על קרח דק 1 לפני העברתן לטמפרטורת חדר (גם עטופה בנייר אלומיניום כדי להגן מפני אור).
- הוסף 10 חיץ מ"מ טריס (pH 7.4) לכל אחד מהבדיקות עד 100 נפח סופי μl ולאזן את כל הבדיקות בבית RT במשך 10 דקות.
- פיפטה 80 μl של כל בדיקה לקובט זכוכית בנפח נמוך ולמדוד את הספיגה של כל בדיקה 400-900 ננומטר בספקטרומטר. להחזיר את הבדיקה לצינורות המתאימים שלהם.
- העבר את 80 μl של כל בדיקה לקובט זכוכית מתאימהולמדוד את פליטת הקרינה על ידי spectrofluorometer מרגשות הבדיקות בבית 674 ננומטר ומדידת הקרינה 694-800 ננומטר.
- ספיגת הקרינה סלולרית והפעלה
- קבל ותרבות שורות התאים הבאות בתקשורת והתרבות המקבילה שלהם בהתאם לתנאים סטנדרטיים (37 ° C, 5% CO 2 ו -95% אווירת humidified). כאן, השתמש בJ774A.1 שורת תאי מקרופאג העכברית (שונה הבינוני של הנשר בתוספת 10% (V / V) בסרום עגל עוברי של Dulbecco), קו תא גליובלסטומה אדם, U-118MG (ממ המכיל ויטמינים חיוניים ו -10% (v / v) בסרום עוברי עגל) וקו תא fibrosarcoma האנושי, HT-1080 (RPMI עם 5% FCS).
- שקופיות קאמריות מעיל 8-גם עם פולי-L ליזין (להוסיף 100 μl 0.001% פולי-L ליזין היטב כל אחד ולדגור על 37 מעלות צלזיוס למשך 10 דקות. פתרון לשאוב ולתת השקופיות קאמריות להתייבש לפחות 4 hr ב RT על שולחן עבודה סטרילית. יש לשטוף את השקופיות קאמריות 3פעמים עם תמיסת מלח שנאגרו של 200 μl האנק אז לאטום אותם עם פרפין ורדיד אלומיניום ולאחסן ב 4 ° C עד צורך.
- בעוד השקופיות קאמריות מתייבשות, המסנן לעקר יפוזומים ופתרון צבע ולאחסן ב 4 ° C עד הצורך.
- לניתוח ספיגת בדיקה עם כל הגוף במערכת ההדמיה הקרינה vivo NIR, להכין 5 צלוחיות קטנות תרבות לכל אחת משורות תאי 3 מבחן (15 צלוחיות בסך הכל). הזרע 2 x 10 6 J774A.1, U-118MG ותאי HT-1080 לכל בקבוק תרבות עם 5 מיליליטר של מדיום תרבות בהתאמה (בquintuples) ולגדול במשך 16-24 שעות. במקביל לצלוחיות התרבות, זרע 30,000 תאים של כל שורת תא (J774A.1 וHT-1080) או 20,000 תאים (U-118MG) 2 בארות של חדר שקופיות בהתאמה ולגדול במדיום תרבות 500 μl במשך 16-24 שעות .
- ביום שלמחרת, להוסיף 100 nmol (כמות שומנים סופית) של Lip-Q 2 צלוחיות בכל שורת תא וגם אחד מכל שורת תאים בתא השקופיות.מייד להעביר בקבוק 1 בכל שורת תא עד 4 מעלות צלזיוס והבקבוק השני חזרה לחממה.
(5 מיליליטר הוא 500 מדיום תרבות μl) הנפח של הבדיקות נוספות לצלוחיות והשקופיות קאמריות הן אותו הדבר, מה שהופך את הריכוז בתא שקופיות גבוה פי 10: הערה. זה נחוץ משום הגילוי מיקרוסקופי הוא פחות רגיש ממערכת ההדמיה הקרינה NIR בי כדורי תא מהצלוחיות הם צילמו. - הוסף את DY-676-COOH החופשי במקביל ריכוז לתוכן הצבע של השפתיים-Q לתאים בכל שורת 2 צלוחיות תא וגם אחד מכל שורת תאים בתא השקופיות, ולאחר מכן להעביר בקבוק 1 בכל שורת תאים באופן מיידי ל4 ° C (דלדול אנרגיה) והבקבוק האחר יחד עם השקופיות קאמריות חזרה לחממה. דגירה כל התאים למשך 24 שעות בתנאים המקביל. תאי הבקבוק בלי בדיקה ישמשו כקבוצה ביקורת.
- הדמיה NIRF וניתוח חצי כמותית
- לאחר 24 משך דגירה שעה, לקצור את התאים בצלוחיות על ידי שטיפת תאים 2 פעמים עם הנקס שנאגרו תמיסת מלח (HBSS) ולאחר מכן לגרד תאים ב 500 μl HBSS וגלול על ידי צנטריפוגה (5 דק 'ב 200 XG) ב 500 צינורות μl.
- מניחים את הצינורות עם כדורי התא (וHBSS) בתרמי NIRF ומסננים באמצעות תמונה לעירור (615-665 ננומטר) ופליטה (חתך ב> 700 ננומטר).
- לנכות autofluorescence ולהעריך את עוצמת היעד לעומת autofluorescence בהתאם להוראות יצרן. זה ייתן לי הרמות חצי כמותית של עוצמת הקרינה כאות ממוצעת (ספירה טיפסה / sec), המייצגת את רמות ספירה לאחר שינוי קנה המידה לזמן חשיפה, רווח מצלמה, binning ועומק סיבית, כך שהמדידות הן להשוות בין זה לזה.
- ניתוח מיקרוסקופי confocal
- אחרי 24 שעות דגירה, לקצור את התאים על שקופיות קאמריות על ידי שטיפת 2 פעמים עם 500 μl HBSS.
- תקן CELLS עם 200 μl HBSS המכיל 3.7% (v / v) פורמלדהיד למשך 30 דקות ב RT.
- בעוד הקיבעון קורה, לדלל את כתם DNA, Hoechst-33258 1:50 פתרון הרכבה.
- לאחר קיבוע, לשטוף את התאים 2 פעמים עם HBSS אז להפריד את התאים משקופיות הזכוכית. הוספת פתרון הרכבה 50 μl המכיל DNA-הכתם על כל נקודה המתאימה לבארות של השקופיות קאמריות. לכסות את התאים עם coverslips זכוכית, לאטום קצוות עם לק השקוף ואוויר יבש במשך 10 דקות ב RT (כהה).
- תאי תמונה על מיקרוסקופ פלואורסצנטי מתאים או מיקרוסקופ confocal. השתמש בהגדרות הבאות העירור ופליטה להדמיה של הרכיבים המקביל: הגרעינים (Hoechst-33258: עירור 405 ננומטר, פליטה 420-480 ננומטר). NBD-DOPE (שומנים בדם liposomal: ננומטר עירור 488, פליטת 530 ננומטר). DY-676-COOH (צבע פלואורסצנטי NIR: nm 633-645 העירור, פליטת 650-700 ננומטר).
הערה: ודא שמיקרוסקופ פלואורסצנטיvailable מצויד במסננים מתאימים המאפשרים עירור ופליטה של אורכי גל גבוה יותר מאשר 630 ננומטר.
3. Liposome מבוסס בVivo דימות פלואורסצנטי של דלקת
- הכנה של בעלי חיים וחומרים
- בית 8-12 שבועות בן עכברי זכרי NMRI במשקל כ 36 גרם בתנאים סטנדרטיים עם כרצונך מזון ומים.
- שבעה ימים לפני תחילת ניסויים, לתת את כל עכברי דיאטת pheophorbide נמוכה על מנת לצמצם autofluorescence רקמות.
- עשרים וארבע שעות לפני תחילת כל ניסוי, לגלח עכברים באזור הרצוי (למשל, אזור גב כל אם הדמיה של בצקת רגל האחורית היא רצויה).
- לשקול את בעלי החיים ולחשב את כמות הבדיקה כדי להיות מוזרק לכל עכבר (Lip-Q וLip-DQ ב 10 μmol (ריכוז שומנים בדם) לכל קילוגרם משקל וחופשי DY-676-COOH (שווה ערך ל לצבוע תוכן של-Q שפתיים בשימוש) .
- תמונת בעלי החיים בתרמי NIR הקרינה גוף כולו עם אותן ההגדרות המשמשות לכדורי התא. מדידה זו מספקת autofluorescence של בעלי החיים.
- לפזר 10 מ"ג zymosan-ב 1 מיליליטר תמיסת מלח איזוטוני ולאחסן לילה ב 4 מעלות צלזיוס.
- אינדוקציה של דלקת ובהדמית NIRF vivo
- הכן 3 מזרקים לכל עכבר המכילים את הפתרונות הבאים. מלא מזרק אחד עם 50 zymosan-פתרון μl (10 מ"ג / מיליליטר) ואת המזרק השני עם תמיסת מלח איזוטוני 50 μl. מלא את המזרק השלישי עם הבדיקות, לפי Lip-Q וLip-DQ (10 μmol / משקל קילוגרם (שומנים בדם)) מיועדים לבעלי חיים בדיקה וחופשי DY-676-COOH (ריכוז כמו בשפות-Q) לבעלי חיים שליטה. ודא שהבדיקות הן בדילול עם HBSS סטרילי 150 נפח סופי μl.
- החל קרם עיניים בעיניים של בעלי חיים כדי למנוע יובש ולהרדים חיות עם isoflurane 2% עד שהם שקועים בשינה עמוקה ולא מגיב כאשר נגעו בכפות (זה לוקח בערך 2 דקות).
- מניחים את העכבר על מחצלת חמה (עדיין תחת הרדמה) ולהזריק zymosan-תת עורי פתרון ברגל האחורית הימנית ותמיסת מלח על הרגל האחורית השמאלית. מייד להזריק לוריד ובדיקת תמונת החיה לאחר מכן לאחר מכן זמן שיא של הזרקה / מדידה (כt = 0 שעה). שמור את התמונות וכתוצאה מכך כקוביות תמונה וחזור על השלבים לעיל עבור כל בעלי החיים האחרים והבדיקות המתאימות.
- תמונת בעלי החיים בכל שעה 2 לאחר הזרקה לשעה 10 ולאחר מכן ב 24 שעות לאחר הזרקה, ולוודא כי השלב של חדר המדידה הוא חם (למשל, על ידי הצבת מחצלת חמה מתחת), על מנת להימנע מהיפותרמיה. לאחר כל מדידה, למקם את החיות בכלוב עם כרצונך מזון ומי מודעה ולמקם את הכלוב בתא בעלי חיים ממוזג. להרדים בעלי החיים על ידי ההרדמה הראשונה עם 2% isoflurane עד בעלי החיים כבר לא מגיבים למגע, ואז להרדים עם פחמן דו חמצני למשך 5-10 דקות, מה שהופך אתבטוח שבעלי החיים להפסיק לנשום לחלוטין וצפידים מתרחש.
- לנתח את העכברים על פי פרוטוקולים סטנדרטיים שניתן להעריך באינטרנט (http://www.freebookez.com/mouse-dissection-lab-report/) ותמונת האיברים.
- להעריך את תוצאות המדידה על פי הוראות יצרן על ידי ניכוי הקרינה הכוללת של בעלי החיים (unmixing) אז אזורי הקצאה של העניין לautofluorescence (משמאל רגל אחורית עם מי מלח) וקרינת היעד של אזור המודלק (רגל אחורית תקין עם zymosan-) הראשון.
תוצאות
אנקפסולציה של ריכוזים גבוהים של צבעי ניאון כגון DY676-COOH צבע NIRF משמש כאן בפנים המימי של יפוזומים מובילה לרמה גבוהה של הקרינה מרווה. מרווה הקרינה, תופעה ראתה עם fluorophores רבות בריכוז גבוה, ניתן לנצל בכמה יישומי ההדמיה vivo בי רגישות גבוהה וזיהוי אמין של אזור היעד הם דרשו. השימוש ביפוזומים מספק גם הגנה של הצבע שהיא חיונית ליישומי in vivo. אפיון יסודי של יפוזומים הוא הכרחי וכולל מספר גורמים כגון הרמה של צבע במארז, יציבות וגודל של יפוזומים, מרווה הקרינה ופעילות של צבע במארז במבחנה וגם תחולה למטרות הדמיה in vivo. השוואה של הצבע החופשי, DY-676-COOH ויפוזומים הרווה (Lip-Q) וכן liposome-הרווה אינה (Lip-DQ) עם concent נמוך מאודמנה של הצבע במארז לכן קריטית במיוחד עבור אפיוני in vivo.
ליפוזומים שהוכנו על ידי שימוש בלחות הסרט וטכניקת שחול עם מחזורי הקפאה והפשרה רצופות לפני שחול מכילים מולקולות צבע חופשיות שייר אשר ניתן להפריד בהצלחה מיפוזומים בשל ההחזקה ארוכה יותר שלהם במטריצת סינון ג'ל, בהשוואה ליפוזומים אותם elute מהר יותר ( איור 1). בהתאם לרמה של דילול לאחר סינון ג'ל, צעד ultracentrifugation אופציונאלי מאפשר הריכוז של יפוזומים כפי שמודגם (איור 1 ג). על בסיס תכונות בליעה ופליטה של הצבע במארז, הריכוז של צבע במארז נחוש בעזרת עקומת כיול של הצבע החופשי (1D איור). מלבד הריכוז של הצבע במארז, חשוב כדי לקבוע את הגודל וההומוגניות של אחורי ליפוזומיםהכנה אה. כפי שניתן לראות באיור 1E, micrographs אלקטרונים של יפוזומים שהוכנו על ידי השיטה הבסיסית לחשוף מורפולוגיה בעיקר unilamellar של שלפוחית liposomal, המכיל DY-676-COOH intravesicular גם בטווח ריכוז מרווה (Lip-Q; 606-846 מיקרומטר DY-676 ) או בריכוז שאינו הרווה צבע (Lip-DQ; 25 מיקרומטר DY-676). יתר על כן, הם חושפים התפלגות גודל אחידה של כ -120 מדדים ננומטר וpolydispersity הרבה מתחת 1 (טבלת 1). בשל מרווה הקרינה, Lip-Q מראה שני מקסימום קליטה בחיץ המימי, לפיה שיא אחד מאופיין במעבר לכיוון אורכי הגל הכחול. בקנה אחד עם זה, פליטת הקרינה נמוכה מאוד בהשוואה לצבע החופשי (איור 2 א 'וב', מימין). להקפיא-נזק של התוצאות ליפוזומים בשחרורו של הצבע, אשר מקבל בדילול מלא בפתרון שמסביב. השיא ספיגה העביר הכחול לכן disappears, וכתוצאה מכך לשיא ספיגה יחיד של Lip-Q. מתאים לזה, עלייה בעוצמת הקרינה של פגוע הקפאת Lip-Q נראית, אשר מציינת כי הפעלת הקרינה של מולקולות צבע שוחררו התקיימה. הצבע החופשי מגלה רק מרבי יחידה קליטה ועוצמת הקרינה גבוהה שתישארנה באותה הרמה, ללא קשר ל( איור 2 א 'וב', משמאל) הקפאה. ממצא זה מרמז כי אנקפסולציה של הצבע ביפוזומים, כמו בשפות-Q יגן הצבע מהסביבה, לשמור על ריכוז גבוה ומרווית הקרינה קשורה ואם הופעל על ידי גורמי יעד יאפשר זיהוי בשל עלייה בקרינה.
בדיקות liposomal עם הרכב שומנים בדם הבסיסי לחשוף ספיגת phagocytic העיקרית המעוכבת על ידי דלדול אנרגיה. ניתן לראות זאת באמצעות הספיגה של Lip-Q ידי J774A.1 שורת תאי מקרופאג העכברי phagocytic מאוד, ושורת תאי גליובלסטומה אדם U-118MG המעטה phagocytic על 37 מעלות צלזיוס ועיכוב ב 4 ° C (איור 3 א 'וב'). הצבע החופשי DY-676-COOH מגלה ספיגה בשורות תאי phagocytic שני על 37 מעלות צלזיוס ועל 4 מעלות צלזיוס אשר מציינת כי הבדיקה liposomal Lip-Q אינו מכיל צבע חופשי שייר בפתרון ורק יכול לעבור ספיגה פעילה. תמונות מיקרוסקופיות סריקת לייזר Confocal נוספת לבסס את הספיגה והפעלה של Lip-Q בתאי phagocytic (איור 3 ג). יתר על כן, חוסר הקרינה בשורת תאי fibrosarcoma אדם שאינו phagocytic, HT-1080 מצביע על כך שהספיגה של Lip-Q היא בעיקר על ידי phagocytosis וכך, יהיה מתאים להדמיה של דלקת בי מונוציטים phagocytic / מקרופאגים מעורבים.
עולה בקנה אחד עם ספיגת phagocytic של יפוזומים ראו בשורות תאים בתרבית, ובשל הקרינה מרווה הזרקה תוך ורידית של מוביל Lip-Q ל- זמןגידול תלוי בעוצמת הקרינה של בצקת במודלים בעכברים (איור 4 א, Lip-Q), עם הקרינה רקע נמוכה מאוד. עוצמת הקרינה המרבית של בצקת מזוהה 8-10 שעות לאחר הזרקה של Lip-Q. ניר-הקרינה לעומת זאת, חזקה יחסית של כל העכבר נראית לאחר היישום של DY-676-COOH החופשי (איור 4 א, DY-676-COOH) או תמיד על liposome, Lip-DQ (איור 4 א, Lip-DQ ). בהשוואה לשפות-Q, זלוף המהיר ופינוי DY-676-COOH החופשי כפי שניתן לראות 0-4 שעות לאחר הזרקה, מפריע להדמיה, כך שזיהוי אמין של בצקת אינו אפשרי (איור 4 א, DY-676-COOH ). יתר על כן, liposome-הרווה עישון, Lip-DQ מגלה הקרינה המרבית של בצקת בתוך 2-4 שעות לאחר הזרקה שנשארה כמעט קבוע עד 8 שעות, לאחר מכן יורד דומה לקרינת הבצקת מבוססת Lip-Q הרווה בהדרגה. ביצוע אנאלי חצי כמותיתyses, לפיה אזורים של עניין (ROIs) נקבעים על בצקת לעומת רקע, אפשר להסיק מסקנות על הרמות השונות של זיהוי עם בדיקות שונות. על פי ניתוח חצי כמותית של 5 חיות לכל קבוצה (בדיקה), בצקת יכולה להיות יותר משמעותית (P = 0.001) זוהה עם Lip-Q מאשר עם DY-676-COOH בחינם או-הרווה עישון, Lip-DQ (איור 4 ב).
איברי הדמיה של עכברים מורדמים 24 שעות לאחר הזרקה של בדיקות הקרינה לחשוף קלה vivo לשעבר של הכבד / כיס מרה וכליות ונמוכה מאוד, אם בכלל, הקרינה של הטחול, ריאות ולב (איור 5), המשמשת כראיה לחיסול של הבדיקות באמצעות מסלול hepatobiliary.

איור 1: הכנת liposome הטעון-DY-676-COOH s. (AC) סקירה סכמטי של שלבי הסינתזה מעורבים. (א) התקנה של לחות סרט וחול עם הצבע DY-676-COOH קרוב אינפרא אדום. (ב) תמונה של התקנת סינון ג'ל מתוצרת העצמית המציגה את שלבי ביניים בין צבע-כמוס שאינם (חינם) ויפוזומים. ליפוזומים elute הראשון ויופיעו בכחול-ירוק בשל DY-676-COOH (הכחול) במארז ופוספוליפידים הירוקים המשולבים, NBD-סמים. (C) תמונת נציג liposome-משקעים (Lip-Q) לאחר ריכוז על ידי ultracentrifugation. ( D) עקומת כיול נציג של DY-676-COOH ב 10 מ"מ טריס pH 7.4 (המכיל 1% טריטון X100) המשמש לכימות של צבע liposomal. (E) מיקרוסקופ האלקטרונים קריו העברת Lip-Q. אנא לחץ כאן לצפייה גרסה גדולה יותר של הדמות.
n-page = "תמיד"> 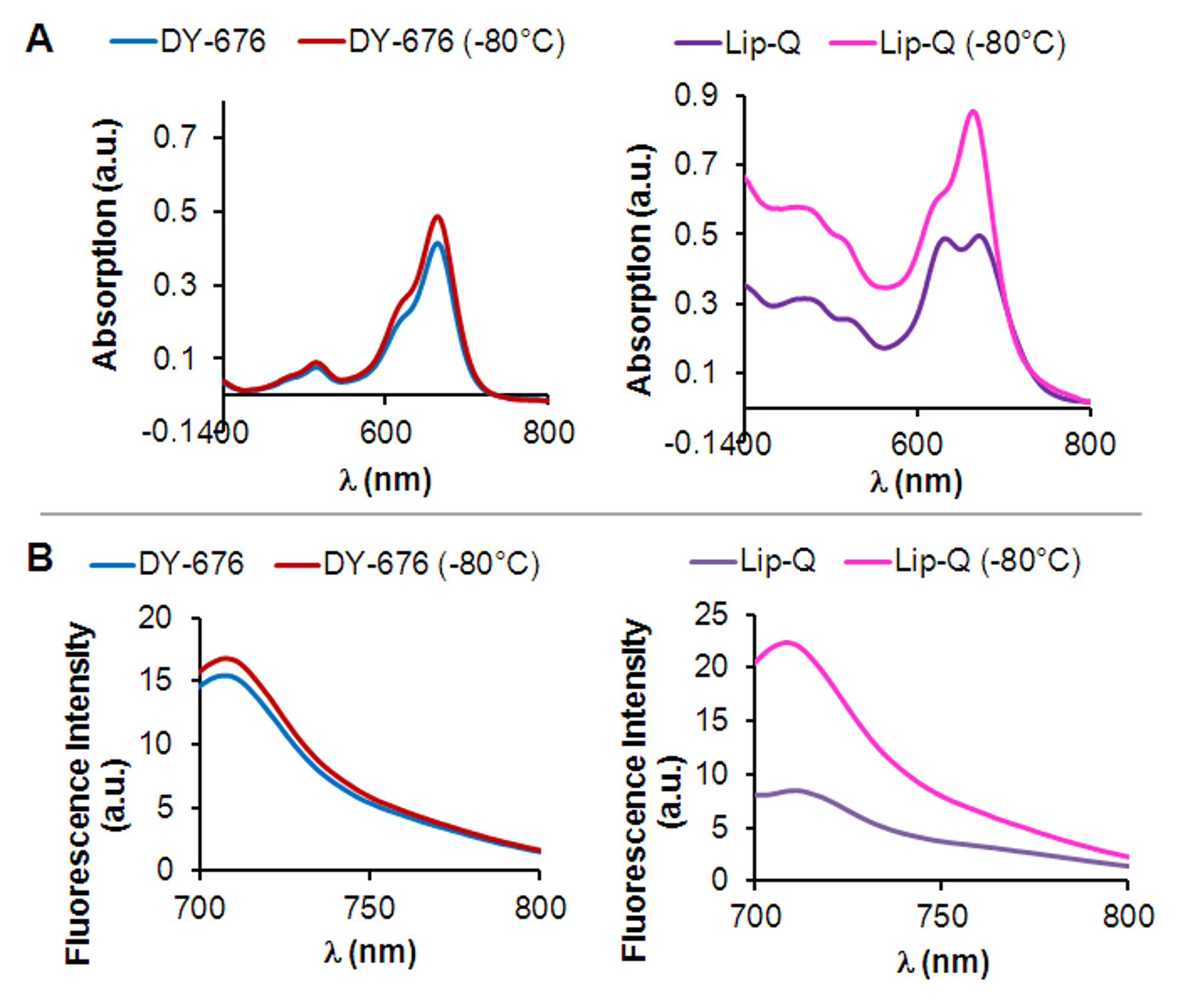
איור 2:. נחישות physicochemical של מרווה הקרינה והפעלה במבחנה () ספקטרום קליטה של השפתיים-Q (מימין) וחופשי DY-676-COOH (משמאל) שנמדד ב -10 pH חיץ מ"מ טריס 7.4, לפני או אחרי הקפאה ב-- 80 ° C. שים לב לשיא הכפול האופייני לשפות-Q בהשוואה לDY-676-COOH החופשי והיעלמותה של השיא-עבר הכחול לאחר הקפאה-נזק של Lip-Q. (B) מקבילים ספקטרום פליטת הקרינה של Lip-Q (מימין) ו DY-676-COOH החופשי (משמאל) שנמדד ב -10 pH חיץ מ"מ טריס 7.4 לפני או אחרי ההקפאה ב -80 מעלות צלזיוס.

איור 3: ספיגה סלולרית וקרינת הפעלה של שפה osomes. התמונות ב() הוכנו על ידי ההדמיה הקרינה NIR של כדורי תא לאחר חשיפה לבדיקות המתאימות למשך 24 שעות בטמפרטורה מצויינים. תאי HT-1080 לא שרדו את תקופות הדגירה 24 שעות ב 4 מעלות צלזיוס. התרשימים בר ב( B) מייצגים את הרמות חצי כמותית של אותות הקרינה קיבלו על ידי הקצאת ROIs לכדורי התא בא כל בר מציין את העוצמות הממוצעת של n = 3 ניסויים ± SD. תמונות ב( C) נרכשו על ידי מיקרוסקופי סריקת לייזר confocal של תאים שנחשפו לבדיקות בשקופיות קאמריות תרבות למשך 24 שעות על 37 מעלות צלזיוס. שים לב לרמה הגבוהה של הקרינה בJ774A.1 העכברי phagocytic הגבוה קו תא מקרופאג והקרינה המתונה בשורת תאי גליובלסטומה אדם phagocytic קלה U-118MG. HT-1080 שורת תאי fibrosarcoma אדם שאינו phagocytic לא מראה הקרינה של הבדיקות. NBD-DOPE: פוספוליפידים ניאון ירוקים.עומס / 52,136 52136fig3highres.jpg "target =" / _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של הדמות.
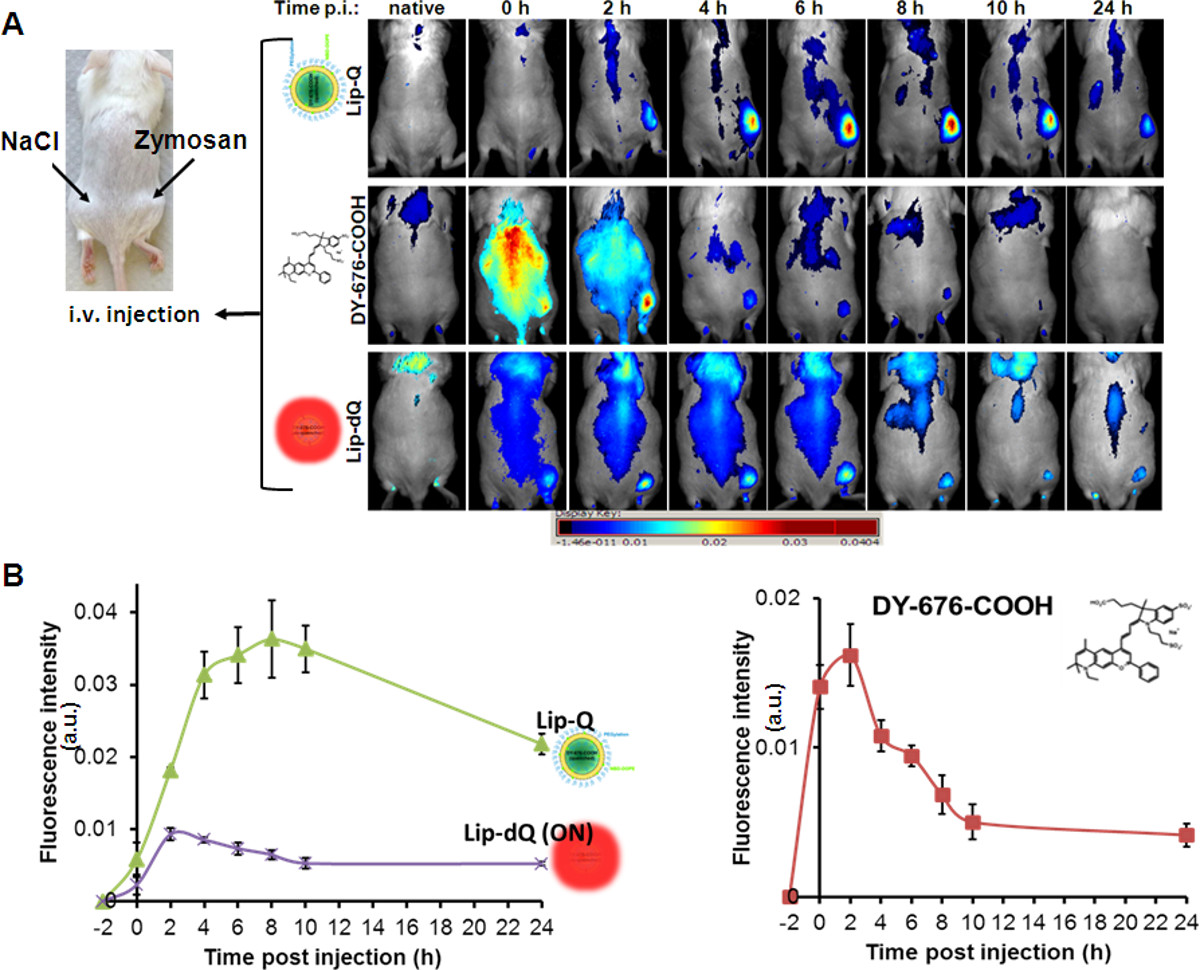
איור 4. בהדמיה אופטית vivo של בצקת נגרם על zymosan בעכברים. (א) תמונת העכבר משמאל מציגה את העמדות של תת-עורית מיושמות zymosan-A (500 מיקרוגרם ב -50 מלוח μl) ותמיסת מלח שליטה (50 μl) בכנף השמאל. הזרקה תוך ורידית של בדיקות מצויינים וכל גוף ההדמיה הקרינה NIR בנקודות זמן המצוין לחשוף הדרגתית, אך עלייה גבוהה באותות הקרינה של אותות בצקת ורקע נמוך של Lip-Q (פנל עליון) עם הקרינה מרבי שבלאחר הזרקה 8 שעות. הצבע החופשי חושף זלוף ופינוי מהיר בתוך לאחר הזרקת 4 שעות (חלונית אמצעיתיב), ואילו שפתיים-DQ מגלה זיהוי של בצקת עם עוצמות אות נמוכות וקרינת רקע גבוהה בכללותה. ההצגה הגרפית ב( B) חוזרת אותות הקרינה נצפו בצקת מזוהות עם כל בדיקה בהשוואה לאזור השליטה (מלוח) בn = 5 חיות לכל קבוצה. כל חלקה מייצגת את אותות הקרינה הממוצעים של (n = 5) ± SEM. עם הגרפים, אות הקרינה המרבית של בצקת מזוהות עם כל בדיקה היא להבחין בקלות (ליפ-Q, 8 שעות; Lip-DQ 2-4 שעות וDY-676-COOH החופשי, לאחר הזרקת שעה 2). יש עוצמת הקרינה באופן משמעותי (P = 0.001) גבוהה יותר של בצקת בשפות-Q לעומת Lip-DQ בt = 0-24 שעות, ועם השפתיים-Q לעומת DY-676-COOH החופשי בזמן t = 4-24 שעות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של הדמות.
איור 5: תמונות ביו-אופטיות vivo לשעבר של איברים מעכברי יישום פוסט בדיקה 24 שעות, וניתוח חצי כמותית המקבילה של עוצמות הקרינה של האיברים. כל עמודה מייצגת הממוצעת של עוצמות הקרינה (n = 4) ± SEM. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של הדמות.
| ניסוח Liposome | גודל [nm] | Polydispersity מדד (PI) | [MV] פוטנציאל זטה |
| Lip-DQ (dequenched) | 123.4 ± 0.6 | 0.055 ± 0.02 | -10.6 ± 0.4 |
| Lip-Q (הרווה) | 118.5 ± 0.7 | 0.04 ± 0.02 | -9 ± 2 |
| Lip-NBD (w / o DY-676-COOH) | 123.0 ± 1.4 | 0.04 ± 0.03 | -11 ± 1 |
טבלה 1: אפיון יפוזומים על ידי פיזור אור דינאמי.
Discussion
מאז יפוזומים גם יכולים לשמש כמערכות אספקה לצבעי ניאון, הם מאפשרים הדמיה של מחלות יעד. אנקפסולציה של ריכוזים גבוהים של צבעי ניאון כגון צבע NIRF, DY676-COOH משמש כאן, מובילה לרמה גבוהה של מרווה הקרינה של הצבע וממולכד. מרווה הקרינה, תופעה ראתה עם fluorophores רבות בריכוז גבוה יכולה להיות מנוצלת בכמה יישומי ההדמיה vivo, שבו רגישות גבוהה וזיהוי אמין של אזור היעד היא דרשו. השימוש ביפוזומים מספק גם הגנה של הצבע שהיא חיונית ליישומי in vivo.
טכניקת לחות סרט והחול היא שיטה נפוצה המאפשרת הכנה מוצלחת של יפוזומים עם טווחי גודל שונים בהתאם לצורך, ומאפשרת שינויים כגון אנקפסולציה של מספר רב של חומרים שונים 25. לפיכך, הוא מתאים להכנת שפהosomes במארז עם צבע NIR הניאון, DY-676-COOH למטרות הדמיה. השיטה מניבה ליפוזומים עם ריכוזי 600-840 מיקרומטר intravesicular צבע, הנמצאים בריכוז הרווה של הצבע. יד מכבש LiposoFast בסיסי המשמש להומוגניזציה של פיזור שלפוחית נוצר באופן ספונטני מתאים להכנת liposome בקנה מידת מעבדה קטנה, בשל התאימות של המכשיר, עם מזרקים עד 1 מיליליטר נפח. להכנות בקנה מידה גדולות את השימוש בhomogenizers לחץ גבוה יותר אשר מסוגלים homogenize תפוצות שלפוחית עם קיבולת של 1,000 L לשעה מומלץ. כרומטוגרפיה סינון ג'ל (הדרת גודל) היא צעד חיוני המבטיח הפרדת צבע liposomal כמוס ממולקולות-כמוס שאינם צבע (חינם) 26. אורכו של טור סינון ג'ל הוא חיוני להפרדה יעילה של יפוזומים מצבע חופשי. לפיכך, יש צורך להכין את טור של t אורך סנטימטר לפחות 28o להפריד בהצלחה ליפוזומים מDY-676-COOH החופשי משמש כאן. מעניין, אורך זה הוא פי שניים כל עוד שמשמש לטיהור ליפוזומים טעונים carboxyfluorescein (CF) מcarboxyfluorescein החופשי. החסרון העיקרי של סינון ג'ל הוא דילול 05:55 פי של הדגימות המטוהרת. זה יכול להיות מתוגמל על ידי ultracentrifugation, אם יש צורך ליפוזומים מרוכזים מאוד. במהלך ultracentrifugation יפוזומים המשקעים וsupernatant ניתן להסיר בקלות 27. דרכים אחרות כדי להתרכז יפוזומים כגון על ידי דיאליזה 28 הן זמן רב יותר מאשר ultracentrifugation.
מלבד שיטת הידרציה סרט וחול, שיטת השלב התהפך אידוי 23, כמו גם את שיטת הזרקת אתנול 24 לאפשר הכנת liposome ביעילות אנקפסולציה גבוהה עבור רבים חומרים הידרופילי. עם זאת, החקירות שלנו חשפו את לחות סרט בשילוב עם מחזור ההקפאה והפשרהשל להיות בשיטה המתאימה ביותר לאנקפסולציה intraliposomal מספקת של DY-676-COOH. הגדלת ריכוז DY-676-COOH התחלת שימוש לטיפול בהתייבשות סרט מגבירה את היעילות והריכוז של צבע intraliposomal, כאשר ריכוז שומנים בדם קבוע של 30 מ"מ משמש. למרות יעילות אנקפסולציה זה עם שיטת ההקפאה והפשרה הוא מתחת ל -10% מהריכוז לצבוע מתחיל בשימוש, אך עם זאת הוא מספק לאנקפסולציה של ריכוז מרווה נדרש הדמיה. יתר על כן, הצבע החופשי הופרד מיפוזומים על ידי סינון ג'ל ניתן למחזר על ידי desalting והתייבשות על פי הוראות יצרן, מה שהופך מחדש אנקפסולציה אפשרית ואובדן צבע מינימאלי כולל. אנקפסולציה של הצבע על ידי הפרוטוקול הבסיסי אין לו השפעה על הגודל והמורפולוגיה של יפוזומים כפי שניתן לראות במדדי polydispersity ומיקרוסקופ האלקטרונים של Lip-Q.
כמה שיטות פשוטות ניתן להשתמש כדי evaluatדואר הפעילות של liposomes.DY-676-COOH ניאון מוכן יש נטייה גבוהה ללהרוות עצמי בריכוזים גבוהים 21,29 כנראה כתוצאה מהיווצרות H-דימר ואינטראקציות לערום-pi בין מולקולות צבע. אינטראקציות אלה, שנוצרו כתוצאת קרבתו של רדיוס פורסטר של מולקולות צבע בריכוזים גבוהים, יכולות להיות מושמדות על ידי דילול 30. לכן, אנקפסולציה של ריכוזים גבוהים של DY-676-COOH לא רק להגן על הצבע מopsonization in vivo, אלא גם מהחיץ שמסביב, ובכך שמירה על הריכוז הגבוה שלה ושמירה על מרווה הקרינה ש, יכול להתגלות כקליטה העבירה כחולה שיא ופליטת הקרינה נמוכה כפי שניתן לראות באיור 2. הקפאה ליפוזומים בהדרגה ב -80 ° C מובילים להיווצרות של גבישי קרח בתוך הפנים מימיים 31 הגורמים לניזק לקרום liposomal כאשר הפשירו בפזיזות על 30 מעלות צלזיוס. Acti השחרור, הדילול והקרינהvation של DY-676-COOH התוך liposomal במאגר לאחר ההקפאה מתגלה בשיא ספיגה אחת ועלייה כמעט פי 2.5 בעוצמת הקרינה (איור 2), אשר מציין כי Lip-Q כך sequesters ריכוז גבוה, מרווה של DY-676-COOH וactivatable. שיטות אחרות לניזק bilayer השומנים liposomal כגון שימוש בממסים אורגניים או חומר ניקוי לא חושפים הבדלים ברורים בין הצבע החופשי וצבע liposomal במארז, שכן שניהם להשפיע על המאפיינים ספקטרליים של צבעי ניאון רבים 32. ההקפאה האיטית ושיטת הפשרה קשה שדווחה כאן לכן משמש כשיטת יותר אמינה ומבטיחה כדי לאמת הגבוהה אנקפסולציה של fluorophores ביפוזומים ומרווית הקרינה נובעת מכך. מספקטרום הבליעה ופליטה של Lip-Q שלם (איור 2), רמה מסוימת של הקרינה שייר ניתן לאתרם. זה יכול לנבוע ממונומרים צבע-הרווה אינה בשאיבת השומןsomes וגם מאינטראקציה וההשפעה של צבע במארז ידי קבוצות ראש קוטב פוספוליפידים 33 אלקטרוסטטי.
כפי שניתן לראות באיור 3, הצטברות מובהקת של Lip-Q במקרופאג העכברי phagocytic מאוד וקו מתון phagocytic אדם גליובלסטומה תא, U-118MG 34, אך לא בHT-1080 שורת תאי fibrosarcoma אדם שאינו phagocytic, מציינת כי ההדמיה מבוססת Lip-Q- של דלקת תהיה חיובית, מאז phagocytes הם שחקני המפתח של תהליכים דלקתיים. העובדה שדלדול אנרגיה מבטל ספיגה של Lip-Q אבל לא ספיגה של DY-676-COOH החופשי ממחישה את הספציפיות של ספיגת phagocytic של Lip-Q ומגלה כי Lip-Q נותר בשלמותה במהלך הניסוי, שחרור אחר של הצבע ו ספיגת אנרגיה עצמאית תתקיים מוביל לקרינת זיהוי. הטבעת פוספוליפידים ניאון הירוקים, NBD-סמים בbilayer liposome מאפשר הדמיה וdiscriminatio מיקרוסקופיותn-מושפל שאינם מיפוזומים מושפלים סלולריים במיוחד אם ניסויי ספיגה תלוי זמן נעשים כפי שדווחו קודם לכן 32 בין. התמונות המיקרוסקופיות לחשוף NIR-הקרינה של DY-676-COOH ש, בקורלציה עם רמות עוצמות הקרינה של כדורי תא, כפי שנקבעו על ידי ניתוח חצי כמותית לאחר דגירה על 37 מעלות צלזיוס. בהתאם לכך, שורות תאי מקרופאג העכבריות להראות את הקרינה הגבוהה ביותר, ואילו גליובלסטומה האדם לחשוף הקרינה נמוכה של שני DY-676-COOH וNBD-DOPE מ לשעבר. כצפוי שורת תאי fibrosarcoma האנושית, HT-1080 מגלים שום הקרינה של שני צבעי liposomal או DY-676-COOH החופשי, מה שמחזק את העובדה שספיגת Lip-Q, הוא בעיקר על ידי phagocytosis.
כדי לחקור את הפוטנציאל של Lip-Q-מבוסס בתחום ההדמיה vivo של דלקת מונע phagocytosis, כמה פקדים נחשבו. בהתחשב בכך שDY-676-COOH החופשי יכול להיות נלקח על ידי phagocytתטיס, opsonization של Lip-Q עלול להוביל לשחרור של הצבע, אשר עשוי להיות נלקח על ידי phagocytes. כדי להימנע מכך, ליפ-Q הוכן עם PEGylation% 5 mol. יתר על כן, יש צורך להבחין בין הספיגה בשל השפעה מבוססת דלקת EPR וספיגה פעילה והפעלת הקרינה. כדי לטפל בזה, ההערכה והשוואה של שלוש בדיקות שונות, כלומר, ליפ-DQ תמיד-על, Lip-Q הרווה וDY-676-COOH החופשי בעכברי נושאי בצקת נגרם על zymosan הייתה צורך. Zymosan-שהוכן מקירות התא של Saccharomyces cerevisiae וקנדידה אלביקנס הוא מעורר טבעית של הפרשת ציטוקינים באמצעות dectin-1 והקולט חיוג כמו 2/6 (TLR 2/6). ציטוקינים מופרשים בתורו גורמים להפעלה של מפלים במורד הזרם שיגרמו לדליפה של כלי דם, ובכך להקל על intravasation / extravasation של מונוציטים / מקרופאגים ממאגר טחול 35 כמו גם נויטרופילים, והגירתם לאתרי דלקת(בצקת) 36-39. תהליך מונוציטים מבוסס zymosan / extravasation מקרופאג וההגירה צריך רק 4.5-6 שעות שהופך zymosan כלי אסטרטגי ללימוד תהליכים דלקתיים 36-39. בשל דליפות כלי הדם שתגרומנה במהלך דלקת, דרך הווריד הזריק יכולות גם לקחת בדיקות על ידי מונוציטים / מקרופאגים (phagocytes) במהלך נדידתם לאתר הדלקת או extravasate ותילקחנה באתר הבצקת (השפעת EPR) 40. השימוש בשפות-DQ שאינו הרווה מגלה רקע כללי לחזק יותר לאותות בצקת מ Lip-Q, ועליית הקרינה של בצקת המשקפת את ההגירה של מונוציטים ומקרופאגים. למעשה, הקרינה המרבית של בצקת נראית כבר לאחר יישום 2-4 שעות של Lip-DQ ונשארה כמעט קבוע עד 8 שעות. בניגוד ליפ-DQ וLip-Q, DY-676-COOH החופשי עובר זלוף המהיר לאחר הזרקה ומנוקית בתוך 4 שעות, כך שההדמיה ברורה של בצקת אינה אפשרית. בterestingly, השימוש בתוצאות Lip-Q בעלייה מתמדת בעוצמת הקרינה של בצקת ואותות רקע נמוכים מאוד. עלייה המתמשכת בעוצמות הקרינה עם Lip-Q מיוחסת לקרינת הפעלה של הצבע liposomal שוחרר. יחדיו, ניתן להסיק כי התרומה של EPR-השפעה בתחום ההדמיה מבוססת Lip-Q היא מינימאלית מאז Lip-DQ לחשוף הקרינה מרבי (השפעת EPR והגירה מונוציטים) בשעה לאחר הזרקת 4 שעות. לפיכך, אנקפסולציה liposomal מספקת הגנה ומסירה מובחנת של DY-676-COOH, אשר בתורו מאפשר יותר אמין בתחום ההדמיה vivo של בצקת, באופן בלעדי לאחר הפנמה והשפלה (הפעלת הקרינה) על ידי תאי phagocytic. עד כה, השימוש בבצקת רגל אחורית מושרה zymosan כדי לאמת את מאפייני ההדמיה של יפוזומים ניאון הוא חדשה. ניתן להרחיב את הפרוטוקול דיווח בזאת הן על ידי אנקפסולציה של צבעי ניאון שונים ועל ידי ההדמיה השפעת DRU המעכב שונהGS באינדוקציה של דלקת, ולכן מהווה כלי שימושי להכנה ואפיון של בדיקות מתאימות להדמיה ביו-רפואית.
עוד צעד מכריע לקראת הגדרת בדיקות הדמיה מתאימות הוא האימות של התכונות פרמקולוגיות שלהם ומסלולים חיסול. ההפצה של בדיקות באיברים אשר ממלאים תפקידים חיוניים בהפרשה, כגון כבד וכליות, כמו גם השימור שלהם קצר וחיסול מתאים מאיברים אלה היא בדרך כלל אינדיקציה, כי הבדיקות יהיו הרבה סיכוי לא מראות השפעות שליליות על המטופל. בהתאם לכך, האיברים של עכברים שהוכנו 24 שעות לאחר הזרקה של Lip-Q או DY-676-COOH החופשי לחשוף רק הקרינה מתונה של הכבד / כיס מרה והכליות, אשר מסמן חיסול מועדף של fluorophore liposomal דרך מסלול hepatobiliary. האירוח הקצר של הבדיקות באיברים אלה והחיסול יעיל שלהם תימוכין 7-folד אותות הקרינה גבוהים יותר של איברים הכינו 6 שעות לאחר הזרקה של Lip-Q או DY-676-COOH החופשי 32. תצפיות אלה הן בהתאם לחיסול יפוזומים 41 ומגבות את החשיבות של הכללת מחקרי biodistribution כאשר אפיון בדיקות. למרות שתופעות לוואי שליליות, כגון גירויים בעור ומשלים הפעלה 42,43 כבר דיווחו על הניסוחים liposomal בשימוש ביישומים קליניים, תופעות כאלה לא התגלו עם יפוזומים הבסיס. יתר על כן, תצפית של עכברים חסרים חיסוניים במשך שבועיים לאחר הזרקת הבדיקה הובילה להשלמת פינוי של הבדיקות מאיברי העכברים (לא מוצגת).
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי מענקי HI-698 / 10-1 Deutsche Forschungsgemeinschaft וRU-1,652 / 1-1. אנו מודים לדורין מאי לקבלת סיוע טכני מעולה והחברה DYOMICS GmbH, Jena על תמיכתם.
Materials
| Name | Company | Catalog Number | Comments |
| Materials and equipments for preparation of liposomes | |||
| egg phospahtidylcholine | Avanti Polar Lipids | 840051P | Dissolve in chloroform and store in glass vials (214 mg/ml) |
| cholesterol | Sigma | C8667 | Dissolve in chloroform and store in glass vials (134 mg/ml) |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt) | Avanti Polar Lipids | 880120P | Dissolve in chloroform and store in glass vials (122 mg/ml) |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt) | Avanti Polar Lipids | 810145P | Dissolve in chloroform and store in glass vials (2 mg/ml) |
| Sartorius MC1 (d = 0.01 mg) | Sartorius AG | Research RC 210 P | used for weighing the phospholipids |
| Rotavapor | Büchi Labortechnik AG | R-114 | used for hydration of phospholipid film |
| Waterbath | Büchi Labortechnik AG | R-481 | used for hydration of phospholipid film |
| Vacuum Controller | Büchi Labortechnik AG | B-720 | used for hydration of phospholipid film |
| Vacobox | Büchi Labortechnik AG | B-177 | used for hydration of phospholipid film |
| Circulation Chiller | LAUDA DR. R. WOBSER GMBH & CO. KG | WKL 230 | used for hydration of phospholipid film |
| DY-676-COOH | Dyomics GmbH | 676-00 | Dissolve in 10 mM Tris and store stock at -20°C |
| Tris-(Hydroxymethyl)-aminomethan | Applichem | A1086 | buffer 10 mM, pH 7.4 |
| Trichlormethan | Carl Roth GmbH + Co. KG | Y015.2 | used for liposome preparation |
| Sonicator | Merck Eurolab GmbH | USR 170 H | used for liposome preparation |
| Vortex Genie 2 (Pop-off Cup, No. 146-3011-00) | Scientific Industries Inc. | SI-0256 | used for liposome preparation |
| Sephadex G25 medium | GE Healthcare Europe GmbH | 17-0033-01 | used for liposome purification |
| Triton X100 | Ferak Berlin GmbH | 505002 | used to destruct liposomes for dye quantification |
| LiposoFast-Basic | Avestin Inc. | used for the extrusion of liposomes | |
| Polycarbonate filter membrane, 100 nm (Whatman Nucleopore Trans Etch Membrane, NUCLEPR PC 19 MM, 0.1 U) | VWR | used for the extrusion of liposomes via LiposoFast-Basic | |
| Fluostar Optima | BMG Labtech | used for dye quantification | |
| Zetasizer Nano ZS | Malvern | used for the determination of liposome size and zetapotential | |
| Ultracentrifuge | Beckmann Coulter GmbH | XL 80 | used for concentration of the samples |
| Rotor | Beckmann Coulter GmbH | SW 55 TI | used for concentration of the samples |
| Materials and equipments for the evaluation of liposome and optical imaging | |||
| Zymosan-A from Saccharomyces cereviciae | Sigma | Z4250-250MG | used for induction of inflammation |
| Isotonic Saline (0.9%) | Fresenius GmbH | PZN-2159621 | used for the dilution of Zymosan-A |
| Isoflurane vaporizer | Ohmeda Isotec 4 | used for anesthesizing animals | |
| Isoflurane | Actavis GmbH | PZN-7253744 | anesthesia |
| Thermo Mat Pro 20 W | Lucky Reptile | 61202-HTP-20 | used to keep animals warm during anesthesia |
| Omnican-F (1 ml injection) | Braun | PZN-3115465 | used for subcutaneous and intravenous application of probes |
| Panthenol eye cream | Jenapharm | PZN-3524531 | used to prevent dryness of the eyes of animals during anesthesia |
| Hanks buffered saline solution | PAA Laboratories /Biochrom AG | L2045 | w/o Mg2+, Ca2+ and phenol red. For dilution of probes and for washing of cells |
| 8-Well chamber slides | BD Biosciences | 354108 | used for cell culture followed by microscopy |
| Cell culture flasks | Greiner BioOne | ||
| Cell culture media | Gibco (life technologies GmbH) | ||
| Fetal calf serum | Invitrogen | ||
| Poly-L-Lysine solution (0.01%, 50 ml) | Sigma | P4832 | used to coat cell culture chamber slides |
| Mountant Permafluor | ThermoScientific | S21022-3 | Mounting solution for microscopy |
| Hoechst-33258 | AppliChem | DNA stain for microscopy | |
| Hera-Safe | Heraeus Instruments | sterile work bench used for cell culture | |
| HERA cell | Heraeus Instruments | Incubator used for cell culture | |
| LSM510-Meta | Zeiss | used for confocal microscopy | |
| Maestro-TM in vivo fluorescence imaging system | CRi, Woburn | used for whole body fluorescence imaging of small animals | |
| Spectrophotometer (Ultrospec 4300 pro UV) | GE Healthcare | used for measurement of absorption | |
| Spectrofluorometer (Jasco FP-6200) | Jasco | used for measurement of fluorescence emission | |
| Animals | |||
| NMRI mice (8-12 weeks old, male) | Elevage Janvier, France | used for inflammation trials | |
References
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers). Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Cabanes, A., et al. Enhancement of antitumor activity of polyethylene glycol-coated liposomal doxorubicin with soluble and liposomal interleukin 2. Clinical cancer research : an official journal of the American Association for Cancer Research. 5, 687-693 (1999).
- Gabizon, A., Shmeeda, H., Grenader, T. Pharmacological basis of pegylated liposomal doxorubicin: impact on cancer therapy. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 45, 388-398 (2012).
- Balasubramanian, S. V., Bruenn, J., Straubinger, R. M. Liposomes as formulation excipients for protein pharmaceuticals: a model protein study. Pharmaceutical research. 17, 344-350 (2000).
- Meyer, J., Whitcomb, L., Collins, D. Efficient encapsulation of proteins within liposomes for slow release in vivo. Biochemical and biophysical research communications. 199, 433-438 (1994).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochimica et biophysica acta. 858, 161-168 (1986).
- Mayer, L. D., Bally, M. B., Hope, M. J., Cullis, P. R. Techniques for encapsulating bioactive agents into liposomes. Chemistry and physics of lipids. 40, 333-345 (1986).
- Walde, P., Ichikawa, S. Enzymes inside lipid vesicles: preparation, reactivity and applications. Biomolecular engineering. 18, 143-177 (2001).
- Weissleder, R., Ntziachristos, V. Shedding light onto live molecular targets. Nature medicine. 9, 123-128 (2003).
- Licha, K., Riefke, B., Ebert, B., Grotzinger, C. Cyanine dyes as contrast agents in biomedical optical imaging. Academic radiology. 9 Suppl 2, S320-S322 (2002).
- Pauli, J., et al. Novel fluorophores as building blocks for optical probes for in vivo near infrared fluorescence (NIRF) imaging. Journal of fluorescence. 20, 681-693 (2010).
- Holzer, W., et al. Photostability and thermal stability of indocyanine green. Journal of photochemistry and photobiology. B, Biology. 47, 155-164 (1998).
- Gandorfer, A., Haritoglou, C., Kampik, A. Retinal damage from indocyanine green in experimental macular surgery. Investigative ophthalmology & visual science. 44, 316-323 (2003).
- Saxena, V., Sadoqi, M., Shao, J. Degradation kinetics of indocyanine green in aqueous solution. Journal of pharmaceutical. 92, 2090-2097 (2003).
- Kodjikian, L., et al. Toxic effects of indocyanine green, infracyanine green, and trypan blue on the human retinal pigmented epithelium. Graefe's archive for clinical and experimental ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle Ophthalmologie. 243, 917-925 (2005).
- Sevick-Muraca, E. M., Houston, J. P., Gurfinkel, M. Fluorescence-enhanced, near infrared diagnostic imaging with contrast agents. Current opinion in chemical biology. 6, 642-650 (2002).
- Bremer, C., Ntziachristos, V., Weissleder, R. Optical-based molecular imaging: contrast agents and potential medical applications. European radiology. 13, 231-243 (2003).
- Hilderbrand, S. A., Kelly, K. A., Weissleder, R., Tung, C. H. Monofunctional near-infrared fluorochromes for imaging applications. Bioconjugate chemistry. 16, 1275-1281 (2005).
- Langhals, H., et al. Cyanine dyes as optical contrast agents for ophthalmological surgery. Journal of medicinal chemistry. 54, 3903-3925 (2011).
- Pauli, J., et al. An in vitro characterization study of new near infrared dyes for molecular imaging. European journal of medicinal chemistry. 44, 3496-3503 (2009).
- Ogawa, M., Kosaka, N., Choyke, P. L., Kobayashi, H. H-type dimer formation of fluorophores: a mechanism for activatable, in vivo optical molecular imaging. ACS chemical biology. 4, 535-546 (2009).
- Szoka, F., Papahadjopoulos, D. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation. Proc.Natl.Acad.Sci.U.S.A. 75, 4194-4198 (1978).
- Batzri, S., Korn, E. D. Single bilayer liposomes prepared without sonication. Biochimica et biophysica acta. 298, 1015-1019 (1973).
- Fahr, A., van Hoogevest, P., May, S., Bergstrand, N., ML, S. L. Transfer of lipophilic drugs between liposomal membranes and biological interfaces: consequences for drug delivery. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 26, 251-265 (2005).
- New, R. R. C. Liposomes a practical approach. , IRL Press at Oxford University Press. (1990).
- Barenholz, Y., et al. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16, 2806-2810 (1977).
- Schwendener, R. A. The preparation of large volumes of homogeneous, sterile liposomes containing various lipophilic cytostatic drugs by the use of a capillary dialyzer. Cancer drug delivery. 3, 123-129 (1986).
- Pauli, J., et al. Suitable labels for molecular imaging--influence of dye structure and hydrophilicity on the spectroscopic properties of IgG conjugates. Bioconjugate chemistry. 22, 1298-1308 (2011).
- Wu, P., Brand, L. Resonance energy transfer: methods and applications. Analytical biochemistry. 218, 1-13 (1994).
- Stark, B., Pabst, G., Prassl, R. Long-term stability of sterically stabilized liposomes by freezing and freeze-drying: Effects of cryoprotectants on structure. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 41, 546-555 (2010).
- Tansi, F. L., et al. Liposomal encapsulation of a near-infrared fluorophore enhances fluorescence quenching and reliable whole body optical imaging upon activation in vivo. Small. 9, 3659-3669 (2013).
- Chen, R. F., Knutson, J. R. Mechanism of fluorescence concentration quenching of carboxyfluorescein in liposomes: energy transfer to nonfluorescent dimers. Analytical biochemistry. 172, 61-77 (1988).
- Windler-Hart, S. L., Chen, K. Y., Chenn, A. A cell behavior screen: identification, sorting, and enrichment of cells based on motility. BMC cell biology. 6, 14(2005).
- Swirski, F. K., et al. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
- Erdo, F., Torok, K., Aranyi, P., Szekely, J. I. A new assay for antiphlogistic activity: zymosan-induced mouse ear inflammation. Agents and actions. 39, 137-142 (1993).
- Ajuebor, M. N., et al. Endogenous monocyte chemoattractant protein-1 recruits monocytes in the zymosan peritonitis model. Journal of leukocyte biology. 63, 108-116 (1998).
- Ajuebor, M. N., Das, A. M., Virag, L., Szabo, C., Perretti, M. Regulation of macrophage inflammatory protein-1 alpha expression and function by endogenous interleukin-10 in a model of acute inflammation. Biochemical and biophysical research communications. 255, 279-282 (1999).
- Ajuebor, M. N., et al. Role of resident peritoneal macrophages and mast cells in chemokine production and neutrophil migration in acute inflammation: evidence for an inhibitory loop involving endogenous IL-10. J Immunol. 162, 1685-1691 (1999).
- Binstadt, B. A., et al. Particularities of the vasculature can promote the organ specificity of autoimmune attack. Nature. 7, 284-292 (2006).
- Ishida, T., Harashima, H., Kiwada, H. Liposome clearance. Bioscience reports. 22, 197-224 (2002).
- Dobrovolskaia, M. A., McNeil, S. E. Understanding the correlation between in vitro and in vivo immunotoxicity tests for nanomedicines. Journal of controlled release : official journal of the Controlled Release Society. 172, 456-466 (2013).
- Szebeni, J., et al. Prevention of infusion reactions to PEGylated liposomal doxorubicin via tachyphylaxis induction by placebo vesicles: a porcine model. Journal of controlled release : official journal of the Controlled Release Society. 160, 382-387 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved