Method Article
Fluorescência-têmpera de um Fluoróforo encapsulado em lipossomas Near-infrared como ferramenta para
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
The use of fluorophores for in vivo imaging can be greatly limited by opsonization, rapid clearance, low detection sensitivity and cytotoxic effects on the host. Encapsulation of fluorophores in liposomes by film hydration and extrusion leads to fluorescence quenching and protection which enables in vivo imaging with high detection sensitivity.
Resumo
Optical imaging offers a wide range of diagnostic modalities and has attracted a lot of interest as a tool for biomedical imaging. Despite the enormous number of imaging techniques currently available and the progress in instrumentation, there is still a need for highly sensitive probes that are suitable for in vivo imaging. One typical problem of available preclinical fluorescent probes is their rapid clearance in vivo, which reduces their imaging sensitivity. To circumvent rapid clearance, increase number of dye molecules at the target site, and thereby reduce background autofluorescence, encapsulation of the near-infrared fluorescent dye, DY-676-COOH in liposomes and verification of its potential for in vivo imaging of inflammation was done. DY-676 is known for its ability to self-quench at high concentrations. We first determined the concentration suitable for self-quenching, and then encapsulated this quenching concentration into the aqueous interior of PEGylated liposomes. To substantiate the quenching and activation potential of the liposomes we use a harsh freezing method which leads to damage of liposomal membranes without affecting the encapsulated dye. The liposomes characterized by a high level of fluorescence quenching were termed Lip-Q. We show by experiments with different cell lines that uptake of Lip-Q is predominantly by phagocytosis which in turn enabled the characterization of its potential as a tool for in vivo imaging of inflammation in mice models. Furthermore, we use a zymosan-induced edema model in mice to substantiate the potential of Lip-Q in optical imaging of inflammation in vivo. Considering possible uptake due to inflammation-induced enhanced permeability and retention (EPR) effect, an always-on liposome formulation with low, non-quenched concentration of DY-676-COOH (termed Lip-dQ) and the free DY-676-COOH were compared with Lip-Q in animal trials.
Introdução
Os lipossomas têm sido intensivamente investigados e servir como um dos sistemas de fornecimento de drogas biomédicas mais biocompatíveis para aplicações clínicas 1,2. Eles são compostos principalmente de fosfolípidos e colesterol, ambos os quais são compostos que imitam biocompatíveis partes de membranas celulares naturais. Considerando que as substâncias hidrofílicas podem ser encapsulados no interior aquoso, agentes lipofilicos podem ser incorporados no interior da bicamada fosfolipídica lipossomal 3. A encapsulação de substâncias no interior aquoso dos lipossomas concede protecção contra a degradação in vivo e também evita que o sistema hospedeiro contra os efeitos tóxicos de fármacos citotóxicos utilizados para a terapia de doenças como, por exemplo, agentes quimioterapêuticos destinados a destruir as células tumorais. A modificação da superfície de lipossomas com polímeros como o polietilenoglicol (PEGuilação) estende-se ainda mais o tempo de circulação no sangue de lipossomas in vivo devido à estabilização estérico 4. Moreover, os lipossomas podem sequestrar concentrações elevadas de várias substâncias, tais como proteínas, substâncias hidrófilas 5,6 7,8 9 e enzimas. Eles, portanto, servir de instrumentos terapêuticos e diagnósticos clínicos como confiáveis que merecem a sua aprovação para a entrega de medicamentos citotóxicos, como a doxorrubicina para terapia de câncer 4. Devido à sua flexibilidade, os lipossomas podem também ser carregadas com fluorocromos para fins cirúrgicos de diagnóstico e guiada por imagem.
Imagens de fluorescência fornece uma relação custo-benefício e não-invasivo em ferramenta de diagnóstico vivo que, no entanto, exige alguns requisitos básicos. Pode ser demonstrado que fluorocromos que se adequar melhor para a imagem in vivo têm absorção característica e máximos de emissão na faixa onde a dispersão de luz e espalhando bem como autofluorescência de tecidos de origem a partir da água e hemoglobina é baixo. Assim, tais sondas têm a sua maxima abs / em entre 650 e 900 nm 10. Além disso, a estabilidade de fluorocromos tanto in vitro como in vivo é crítico, como a opsonização rápida depuração e pode limitar muito a sua aplicação para a imagem in vivo 11. Outros efeitos como a má estabilidade e baixa sensibilidade ou efeitos citotóxicos em órgãos-alvo, como visto com indocianina verde (ICG) 12-16, não são desejadas e devem ser levados em consideração na concepção de sondas para a imagem in vivo. Estas observações conduziram ao desenvolvimento activo de vários fluorocromos NIR pré-clínicos, nanopartículas assim como novas técnicas de imagiologia in vivo de processos inflamatórios, cancro e para cirurgia guiada por imagens 17-20. Apesar de a estabilidade de mais (de fluorescência no infravermelho próximo) NIRF pré corantes in vitro, a sua perfusão rápida depuração e através do fígado e do rim impedir a sua utilização na imagiologia óptica in vivo de doenças e processos inflamatórios.
ntent "> Por isso, apresentam um protocolo para a encapsulação de fluorocromos tais como o bem caracterizado no infravermelho próximo corante fluorescente DY-676-COOH, conhecida pela sua tendência para a auto-arrefecimento rápido em concentrações relativamente elevadas 21 em lipossomas. A altas concentrações de H- a formação de dímeros e / ou interações entre as moléculas de fluoróforo localizados dentro resultado do outro raio Förster em Förster transferência de energia de ressonância (FRET) entre as moléculas de fluorocromo. Em baixas concentrações no espaço entre as moléculas de fluoróforo aumenta, impedindo assim a interacção de empilhamento de pi-empilhamento pi formação e resultando na emissão de fluorescência elevada H-dímero. O interruptor de entre alta e baixa concentração e a extinção da fluorescência de acompanhamento e de activação é uma estratégia promissora, que pode ser explorada para a imagiologia óptica 22. A este respeito, a encapsulação de concentrações elevadas de corante NIRF DY-676-COOH no interior aquosa de lipossomas é mais fafavorá- para geração de imagens in vivo do que o corante livre. O desafio do método situa-se em primeiro lugar no encapsulamento correcta e em segundo lugar, na validação dos benefícios resultantes de elevadas concentrações de encapsulação do corante. Comparando as propriedades de imagem de lipossomas desactivada com o do corante livre e também com uma formulação de lipossomas não-temperada com baixas concentrações do corante é indispensável. Mostramos por um protocolo de hidratação do filme e extrusão simples, mas altamente eficaz combinado com congelamento e descongelamento ciclos alternados que o encapsulamento das concentrações de extinção de DY-676-COOH em lipossomas é viável. Outros métodos utilizados para preparar lipossomas, tais como o método de evaporação de fase inversa 23 bem como o método de injecção de etanol 24 permitir a preparação dos lipossomas com elevadas eficiências de encapsulação para muitas substâncias hidrófilas. No entanto, a natureza da substância a ser encapsulada pode influenciar a eficiência de encapsulação. Com efeito,o protocolo de hidratação do filme e extrusão aqui apresentados revelaram a maior eficiência para o encapsulamento de DY-676-COOH. Para ilustrar os benefícios de encapsulamento lipossomal de DY-676-COOH, um modelo de edema induzido pelo zimosano, que permite o estudo de processos inflamatórios no interior de algumas horas, foi usado. Aqui, demonstra-se que os lipossomas com concentrações elevadas do encapsulado DY-676-COOH são mais adequados para o corpo inteiro em imagiologia óptica vivo de processos inflamatórios do que a do corante livre ou a formulação lipossomal não-temperada com baixas concentrações de corantes. Assim, o protocolo subjacente proporciona um método simples e rápido para a produção de lipossomas fluorescentes temperados e a validação da sua activação e imagiologia potencial tanto in vitro como in vivo.Protocolo
NOTA: Todos os procedimentos são aprovados pelo comitê de animais regional e de acordo com as diretrizes internacionais sobre o uso ético de animais.
1. Elaboração de Materiais e Instrumentos
- Preparação da dispersão vesicular formam-se espontaneamente (SFV)
- Dissolve-se e preparar-se soluções de reserva dos seguintes fosfolípidos: 214 mg / mL de fosfatidilcolina de ovo (EPC), 134 mg / ml de colesterol e 122 mg / ml de 1,2-distearoyl- sn-glicero-3-phosphoethanolamine- N - [metoxi (polietileno glicol) -2000] (sal de amónio) (mPEG 2000 -DSPE) e 2 mg / ml de 1,2-dioleoyl- sn-glicero-3-phosphoethanolamine- N - (7-nitro-2-1,3-benzoxadiazol-4 il) (sal de amônio) (NBD-DOPE) em clorofórmio e armazenar em frascos de vidro.
- Fornecer cerca de 3 ml de clorofórmio, num balão de fundo redondo e transferir o volume apropriado de solução de estoque de fosfolípido para o balão de fundo redondo para preparar lipossomas compostos de EPC: Chol: mPEG 2000 -DSPE a uma razão molar de 6,5: 3: 0,5. Para a rotulagem de fluorescência dupla de lipossomas adicionar 0,3 mol% NBD-DOPE à solução lipídica.
- Evapora-se o clorofórmio a partir da solução de fosfolípido orgânica sob pressão reduzida (300 mbar) a 55 ° C utilizando um evaporador rotativo.
- Depois de uma película homogénea fosfolípido é formado, reduzir a pressão para 10 mbar durante 1-2 h para remover o depósito de clorofórmio residual.
- Enquanto o clorofórmio é evaporação, dissolve-se DY-676-COOH (6.181 uM) em tampão Tris 10 mM pH 7,4 e encher um recipiente Dewar com azoto líquido. Ligar um banho de ultra-sons e é ajustado a 50 ° C.
- Transferir um volume adequado (0,5-1 ml) de solução para o balão de fundo redondo para hidratar o filme de fosfolípido seco e vortex vigorosamente até que a vesícula formada espontaneamente (SFV) formas de dispersão DY-676-COOH (6.181 uM). Certifique-se de que todos os fosfolipídios são dispersas para evitar a perda de lipídios.
- Cuidadosamente transfer o balão de fundo redondo contendo a dispersão de SFV em azoto líquido e congelar a dispersão durante 3-5 min. Colocar o balão de fundo redondo em um banho de ultra-sons a 50 ° C para descongelar a dispersão, em seguida, a dispersão vortex vigorosamente durante 1-2 min. Repetir este processo seis vezes, perfazendo um total de sete ciclos de congelamento e descongelamento.
- Extrusão de SFV para formar vesículas de lipossomas homogéneos
- Transferir a solução de SFV em uma seringa de 1 ml (uma seringa) e expulse a dispersão através de uma membrana de policarbonato de 100 nm, utilizando uma extrusora LiposoFast-básico em seringa-b.
- Expulse a dispersão de seringa-b, de volta para a seringa-a, em seguida, repita o ciclo de dez vezes. Devido ao processo de extrusão, a solução em que as alterações de seringa de um aspecto turvo a uma dispersão límpida com o tempo. Depois de dez ciclos (vinte passos individuais de extrusão) remover seringa-b a partir do dispositivo de extrusão da dispersão e pela última vez a partir de uma seringa directamente para uma estéril1,5 ml dos tubos de reacção.
- A purificação do encapsulado em liposomas DY-676-COOH a partir de corante livre
- Prepara-se uma coluna de cromatografia em gel, utilizando G25 grânulos embebidos em 10 mM Tris pH 7,4 (coluna de comprimento 28 cm, diâmetro de 0,8 centímetros).
- Transferir 0,5 ml de dispersão vesicular extrudido sobre a camada de gel e deixar o ralo amostra na matriz de gel.
- Elui-se os lipossomas com tampão Tris 10 mM pH 7,4 (Figura 1A) e lava-se a coluna até os drenos de corantes completamente livres para fora da coluna. Se necessário, recolher e reciclar o corante livre por dessalinização e desidratação de acordo com as instruções do fabricante.
- Concentra-se os lipossomas eluídas por ultracentrifugação (200.000 x g, 2 horas a 8 ° C), em seguida, dispersá-los em volume adequado de solução estéril de 10 mM de Tris, pH, 7,4.
- Quantificação da concentração encapsulada DY-676-COOH
- Prepare uma curva de calibração, dissolvendo DY-676-COOH (0, 82, 124,247, 494, 988 nM) em tampão Tris 10 mM, pH 7,4 contendo 0,1% de Triton X100.
- Dissolve-se 2 ul (100 nmol de lípido final de 50 mmol / L de estoque) dos lipossomas durante 5 min à temperatura ambiente em tampão 100 ul de Tris contendo 1% de Triton X-100 para destruir as vesículas e libertar o corante encapsulado. Depois dilui-se as amostras com tampão Tris 10 mM, pH 7,4 para uma concentração final de Triton-X100 a 0,1% (v / v) fazendo um volume total de 1 ml. Preparar todas as amostras em duplicado.
- Medir a absorção e emissão de todas as amostras (livre DY-676-COOH e Triton-X100 tratada lipossomas) a uma excitação λ = 645 nm e uma emissão λ = 700 nm. Estabelecer e utilizar uma curva de calibração do corante livre para determinar a concentração de corante encapsulado.
- Caracterização Liposome
- Determine o tamanho e potencial zeta de lipossomas por espalhamento dinâmico de luz. Diluir as amostras de lipossomas com filtro esterilizados (0,2 um) de tampão Tris 10 mM, pH 7,4 a aconcentration de 100-300 uM (lípido). Transferem-se as amostras diluídas numa cuvete descartável de baixo volume e medir a amostra de acordo com as instruções do fabricante.
- Caracterizar os lipossomas por microscopia electrónica para substanciar o tamanho, a integridade e a homogeneidade de vesículas lipossomais de acordo com os protocolos normalizados.
2. Validação de Fluorescência-têmpera e Ativação de lipossomas preparados
- Análise físico-química de extinção da fluorescência e ativação
- Preparar dois tubos de 1,5 ml para o Lip-Q e 2 tubos para a livre DY-676-COOH. Transferir 100 nmol lípidos totais (2,38 ul de uma solução de estoque / L Lip-Q 42 mmol, contendo 138 ug / ml do encapsulado DY-676-COOH) para os tubos correspondentes. Transferência livre equivalente DY-676-COOH ao teor de corante de Lip-Q (0,38 mg o que resulta, por exemplo, a partir de 138 mg / l 1.000 x 2,38 ul Lip-Q usado). Incubar uma banheirae de cada sonda, a 4 ° C e congelar o segundo tubo a -80 ° C durante a noite (16 h).
- Aquece-se um bloco de aquecimento a 30 ° C. Encha uma caixa de arrefecimento com gelo moído e equilibrar-se uma alíquota de tampão 10 mM Tris pH 7,4 à temperatura ambiente.
- Remover sondas de 4 ° C e equilibrar à temperatura ambiente (envolvido em folha de alumínio para proteger da luz) e descongelar rapidamente as sondas de -80 ° C a 30 ° C durante 5 min. Relaxar as sondas descongeladas em gelo durante 1 min antes de os transferir para a temperatura ambiente (também envolvido em folha de alumínio para proteger da luz).
- Adicionar tampão Tris 10 mM (pH 7,4) a cada uma das sondas ao volume final de 100 uL e equilibrar todas as sondas à temperatura ambiente durante 10 min.
- Pipeta 80 mL de cada sonda em um volume baixo tina de vidro e medir a absorção de cada sonda 400-900 nm em um espectrômetro. Retorne a sonda para seus tubos correspondentes.
- Transferir 80 mL de cada sonda em uma tina de vidro adequadoe medir a emissão de fluorescência em um espectrofluorómetro por excitantes as sondas a 674 nm, e medir a fluorescência de 694-800 nm.
- A absorção celular e a activação de fluorescência
- Obter e cultura as seguintes linhas de células no seu meio de cultura correspondente de acordo com condições padrão (37 ° C, 5% CO 2 e 95% de atmosfera humidificada). Aqui, o uso J774A.1 linha celular de macrófagos de murino (meio Dulbecco modificado de Eagle suplementado com 10% (v / v) de soro fetal de vitelo), a linha celular de glioblastoma humano, L-118 mg (MEM contendo vitaminas essenciais e 10% (v / v) de soro fetal de bezerro) e a linha de células de fibrossarcoma humano, HT-1080 (RPMI com 5% de FCS).
- Casaco-8 bem lâminas de câmaras com poli-L-lisina (adicionar 100 ul 0,001% poli-L-lisina a cada poço e incubar a 37 ° C durante 10 min. Aspirar solução e deixar que as lâminas de câmara para secar-se durante pelo menos 4 h à temperatura ambiente sobre uma bancada de trabalho estéril. Lavar as lâminas de câmara 3vezes com solução salina 200 mL de Hank, em seguida, feche-os com parafina e folha de alumínio e armazenar a 4 ° C até necessário.
- Enquanto as lâminas de câmara estão secando, filtro de esterilizar os lipossomas e solução de corante e armazenar a 4 ° C até necessário.
- Para a análise de absorção da sonda com todo o corpo in vivo NIR sistema de imagiologia por fluorescência, preparar 5 pequenos frascos de cultura de cada uma das três linhas de células de ensaio (frascos de 15 no total). Semente de 2 x 10 6 J774A.1, L-118 mg e células HT-1080 por frasco de cultura com 5 mL do respectivo meio de cultura (em quíntuplos) e crescer durante 16-24 horas. Paralelas aos frascos de cultura, 30.000 células sementes de cada linha celular (J774A.1 e HT-1080) ou 20.000 células (L-118 mg) de 2 poços da corrediça câmara, respectivamente, e crescer em 500 ul de meio de cultura durante 16-24 hr .
- No dia seguinte, adicionar 100 nmol (montante final lipídica) de Lip-Q para 2 frascos por linha celular e para um bem de cada linha celular no slide câmara.Transferir imediatamente um balão por linha de células a 4 ° C e o segundo frasco de volta para a incubadora.
NOTA: O volume das sondas adicionado aos frascos e as lâminas de câmara são o mesmo, tornando a concentração em lâminas de câmara de 10 vezes maior (5 ml é de 500 ul de meio de cultura). Isto é necessário porque a detecção microscópica é menos sensível do que o sistema de imagiologia NIR de fluorescência em que os grânulos de células a partir de balões são gravadas. - Adicionar o livre DY-676-COOH em uma concentração equivalente ao conteúdo de corante Lip-Q para as células em 2 frascos por linha de células e a um poço de cada linha de células na câmara de corrediça, em seguida, imediatamente transferir um balão por linha de células a 4 ° C (depleção de energia) e o outro balão em conjunto com a lâmina de câmara de novo na incubadora. Incubar todas as células durante 24 horas nas condições correspondentes. As células no frasco sem sonda servir como controlo não tratado.
- Imagiologia NIRF e análise semi-quantitativa
- Após 24 h de incubação duração, colher as células em frascos por lavagem as células 2 vezes com solução salina tamponada de Hanks (HBSS), em seguida, raspar células em 500 ul de HBSS e pelete por centrifugação (5 min a 200 xg) em 500 ul tubos.
- Colocar os tubos com os sedimentos celulares (e HBSS) em um imager NIRF e de imagem usando filtros para excitação (615-665 nm) e emissão (corte em> 700 nm).
- Deduzir autofluorescência e avaliar a intensidade do alvo contra autofluorescência de acordo com as instruções do fabricante. Isso dará aos níveis semi-quantitativas de intensidade de fluorescência como sinal médio (contagem escalados / s), o que representa níveis de contagem após a escala de tempo de exposição, o ganho de câmera, binning e profundidade de bits, de modo que as medições são comparáveis entre si.
- Análise microscópica confocal
- Após 24 h de incubação, a colheita das células sobre lâminas de câmara por lavagem duas vezes com 500 uL de HBSS.
- Fixar o cells com 200 ul de HBSS contendo 3,7% (v / v) de formaldeído, durante 30 min à TA.
- Enquanto fixação está acontecendo, diluir a mancha DNA, Hoechst-33258 1:50 com solução de montagem.
- Após a fixação, lavar as células duas vezes com HBSS, em seguida, separar as câmaras de lâminas de vidro. Adicionar a solução de montagem 50 ul contendo o ADN-mancha em cada mancha correspondente ao das cavidades das lâminas de câmara. Cubra as células com lamelas de vidro, selar bordas com transparente unha polonês e por 10 min de ar seco à temperatura ambiente (escuro).
- Células imagem em um microscópio de fluorescência adequado ou microscópio confocal. Use as seguintes configurações de excitação e emissão para a visualização dos componentes correspondentes: núcleos (Hoechst-33258: excitação 405 nm, emissão 420-480 nm). NBD-DOPE (lipídico lipossómico: excitação 488 nm, emissão 530 nm). DY-676-COOH (corante fluorescente NIR: excitação 633-645 nm, emissão de 650-700 nm).
NOTA: Certifique-se de que o microscópio de fluorescência umvailable está equipado com filtros adequados que permitam a excitação e emissão de comprimentos de onda superior a 630 nm.
3. Liposome baseada-In Vivo imagens de fluorescência de Inflamação
- Preparação dos animais e dos materiais
- Casa de 8-12 semanas de idade, ratinhos NMRI machos, pesando aproximadamente 36 g, em condições normalizadas, com alimentos e água ad libitum.
- Sete dias antes do início das experiências, todos os ratinhos dar uma dieta baixa feoforbida a fim de reduzir a autofluorescência de tecidos.
- Vinte e quatro horas antes do início de cada experiência, os ratos barbear na área desejada (por exemplo, toda a área de volta se a imagiologia do edema da perna posterior é desejado).
- Pese os animais e calcular a quantidade de sonda a ser injetado por rato (Lip-Q e Lip-dQ a 10 nmol (concentração de lipídios) por kg de peso e livre DY-676-COOH (equivalente a tingir o conteúdo de Lip-Q usado) .
- Imagem dos animais emum corpo inteiro NIR gerador de imagens de fluorescência com os mesmos parâmetros utilizados para as pelotas celulares. Esta medição fornece autofluorescência dos animais.
- Dissolvem-se 10 mg de zimosan-A em 1 ml de solução salina isotónica e armazenar durante a noite a 4 ° C.
- A indução da inflamação in vivo e NIRF imagiologia
- Prepare 3 seringas por rato que contenham as seguintes soluções. Encher uma seringa com 50 ul zimosan-se uma solução (10 mg / mL) e a segunda seringa com 50 mL de solução salina isotónica. Encha a terceira seringa com as sondas, sendo que Lip-Q e Lip-DQ (10 mmol / kg de peso (lípidos)) são designados para animais de teste e livre DY-676-COOH (concentração como em Lip-Q) para animais de controle. Certifique-se que as sondas são diluídas com HBSS estéril a 150 volume final ul.
- Aplique o creme de olho nos olhos dos animais para evitar a secura e anestesiar animais com 2% de isoflurano até que eles estão dormindo profundamente e não reagem quando tocado nas patas (isto leva de cerca de 2 min).
- Posicione o mouse sobre um tapete quente (ainda sob anestesia) e injetar o zymosan-A via subcutânea solução na perna traseira direita e a solução salina sobre a perna esquerda. Injectar imediatamente a sonda intravenosa e imagem do animal, posteriormente, em seguida, tempo recorde de injeção / medição (como t = 0 h). Salve as imagens resultantes como cubos de imagem e repita os passos acima para todos os outros animais e respectivas sondas.
- Imagem os animais todos os 2 hr para 10 horas após injecção e às 24 horas após a injecção, assegurando-se que a fase da câmara de medição está quente (por exemplo, pela colocação de uma esteira quente por baixo), a fim de evitar a hipotermia. Após cada medição, colocar os animais numa gaiola com comida e água ad libitum e colocar a gaiola numa câmara de animais temperado. Eutanásia os animais por primeira anestesia com isoflurano a 2%, até os animais já não reagem ao toque, então sacrificá com dióxido de carbono para 5-10 min, fazendoCertifique-se de que os animais parar de respirar completamente e rigor mortis ocorre.
- Dissecar os ratos de acordo com protocolos padrão que podem ser avaliadas em linha (http://www.freebookez.com/mouse-dissection-lab-report/) e imagem dos órgãos.
- Avaliar os resultados da medição de acordo com as instruções do fabricante pela primeira dedução da fluorescência geral dos animais (desmistura), em seguida, as regiões atribuição de interesse para autofluorescência (esquerda perna com soro fisiológico) e alvo de fluorescência da área inflamada (pata traseira direita com zymosan-A).
Resultados
A encapsulação de concentrações elevadas de corantes fluorescentes, tais como o corante NIRF DY676-COOH utilizado aqui no interior aquoso dos lipossomas leva a um elevado nível de extinção de fluorescência. Supressão de fluorescência, um fenômeno visto com muitos fluorophores em alta concentração, pode ser explorada em vários em aplicações de imagem in vivo, onde a alta sensibilidade e detecção confiável da área-alvo são exigidas. O uso de lipossomas também fornece protecção do corante que é indispensável para as aplicações in vivo. Uma caracterização completa dos lipossomas é necessário e inclui vários factores tais como o nível de corante encapsulado, estabilidade e tamanho dos lipossomas, e a actividade de extinção de fluorescência de corante encapsulado in vitro e também aplicabilidade para fins de imagiologia in vivo. Uma comparação do corante livre, DY-676-COOH e lipossomas extinta (Lip-Q), bem como um lipossoma não extinta (Lip-dQ) com muito baixo concentração do corante encapsulado é, portanto, fundamental especialmente para in vivo caracterizações.
Os lipossomas preparados usando a hidratação do filme e técnica de extrusão com sucessivos ciclos de congelamento e descongelamento antes da extrusão conter moléculas de corante livres residuais que podem ser separadas com sucesso a partir dos lipossomas, devido a sua maior retenção na matriz de filtração em gel, em comparação com os lipossomas que se eluem mais depressa ( Figura 1B). Dependendo do nível de diluição, após filtração através de gel, um passo de ultracentrifugação opcional permite que a concentração dos lipossomas, tal como ilustrado (Figura 1C). Com base nas propriedades de absorção e de emissão do corante encapsulado, a concentração de corante encapsulado é determinado com a ajuda de uma curva de calibração do corante livre (Figura 1D). Além da concentração de corante encapsulado, que é importante para determinar o tamanho e homogeneidade dos lipossomas répreparação er. Como se pode ver na Figura 1E, micrografias electrónicas de lipossomas preparados pelo método subjacente revelam uma morfologia principalmente unilamelar das vesículas lipossómicas, contendo intravesicular DY-676-COOH ou na gama de concentrações de têmpera (Lip-Q; 606-846 uM DY-676 ) ou a concentração de corante não-temperada (Lip-dQ; 25 uM DY-676). Além disso, eles revelam uma distribuição de tamanho homogénea de cerca de 120 nm e os índices de polidispersão muito abaixo de 1 (Tabela 1). Devido à extinção de fluorescência, Lip-Q apresenta dois máximos de absorção em tampão aquoso, em que um pico é caracterizada por uma mudança no sentido de comprimentos de onda azul. Em linha com esta, a emissão de fluorescência é muito baixo quando comparado com o corante livre (Figura 2 A e B, à direita). Congela-danos dos lipossomas resulta na libertação do corante, que se dilui na solução circundante. O deslocou-blue absorção de pico, portanto, disappears, resultando em um único pico de absorção de Lip-Q. Em concordância com isto, um aumento na intensidade de fluorescência de danificado por congelação Lip-Q é visto, o que indica que a activação de fluorescência de moléculas de corante libertado teve lugar. O corante livre revela apenas um único máximo de absorção e de alta intensidade de fluorescência, que permanecem no mesmo nível, independentemente de congelação (Figura 2A e B, esquerda). Este achado sugere que o encapsulamento do corante em lipossomas, como em Lip-Q iria proteger o corante do meio ambiente, manter alta concentração ea extinção da fluorescência associada e, se for ativado por disparadores alvo permitiria a detecção devido ao aumento da fluorescência.
Sondas de lipossomas com a composição lipídica subjacente revela uma absorção fagocítica predominante que é inibida pelo esgotamento de energia. Isto pode ser visto através da captação de Lip-Q pela altamente fagocítica murino linha celular de macrófagos J774A.1, eolevemente fagocítica linha celular de glioblastoma humano U-118 mg a 37 ° C e de inibição a 4 ° C (Figura 3A e B). O corante livre DY-676-COOH revela a absorção nas linhas de células fagocíticas, tanto a 37 ° C e a 4 ° C, o que indica que a sonda lipossomal Lip-Q não está presente corante livre contém residual na solução e apenas pode submeter-se a absorção activa. Laser scanning confocal imagens microscópicas fundamentar ainda mais a absorção e a activação de Lip-Q em células fagocíticas (Figura 3C). Além disso, a falta de fluorescência na linha de células de fibrossarcoma humano não fagocítica, HT-1080 indica que a absorção de Lip-Q é predominantemente por fagocitose e, assim, seria adequado para imagiologia de inflamação onde fagocíticas monócitos / macrófagos estão envolvidos.
Consistente com a absorção de lipossomas fagocítica vistos em linhas de células cultivadas, e devido à extinção de fluorescência injecção intravenosa de Lip-Q conduz a um tempo-aumento dependente da intensidade de fluorescência de edema em modelos de ratos (Figura 4A, Lip-Q), com muito baixa fluorescência de fundo. A intensidade máxima de fluorescência de edema é detectado 8-10 horas após a injeção de Lip-Q. Contrariamente, relativamente forte NIR fluorescência de todo o rato é observada após a aplicação do livre DY-676-COOH (Figura 4A, DY-676-COOH) ou o sempre em lipossoma, Lip-dQ (Figura 4A, Lip-dQ ). Em comparação com Lip-Q, a perfusão rápida e liberação do livre DY-676-COOH como visto de 0-4 horas após a injecção, interfere com a imagem, de modo que a detecção confiável de edema não é possível (Figura 4A, DY-676-COOH ). Além disso, o lipossoma não saciada, Lip-dQ revela uma fluorescência máxima de edema dentro de 2-4 horas após a injeção que permanece quase constante até 8 horas, em seguida, diminui gradualmente semelhante à fluorescência edema baseada-Lip-Q saciada. Realizando anal semi-quantitativaYses, em que regiões de interesse (ROI) são definidas para edema contra fundo, pode-se tirar conclusões sobre os diferentes níveis de detecção com diferentes sondas. De acordo com a análise semi-quantitativa de 5 animais por grupo (sonda), edema pode ser mais significativa (P = 0,001) detectado com Lip-Q do que com o livre DY-676-COOH ou o não-temperada, Lip-dQ (Figura 4B).
Órgãos de imagem de ratinhos sacrificados 24 horas após a injecção de sondas de revelar fluorescência leve ex vivo de fígado / vesícula biliar e nos rins e uma muito baixa ou nenhuma fluorescência do baço, pulmões e coração (Figura 5), que serve como prova para a eliminação das sondas, através da via hepatobiliar.

Figura 1: Preparação de lipossomas DY-676-COOH-carregados. (AC) Visão esquemática das etapas de síntese envolvidos. (A) Setup da hidratação do filme e extrusão com o near-infrared corante DY-676-COOH. (B) Imagem da instalação de filtração em gel self-made mostrando a interfase entre (gratuito) corante não-encapsulado e lipossomas. Os lipossomas eluir primeiro e aparecem em azul-esverdeado devido ao encapsulado DY-676-COOH (azul) e o fosfol�ido verde incorporada, NBD-DOPE. (C) Imagem representativa de lipossoma-sedimento (Lip-Q), após concentração por ultracentrifugação. ( D) curva de calibração Representante da DY-676-COOH em 10 mM Tris pH 7,4 (contendo 1% de Triton X100) utilizado para a quantificação do corante lipossomal. (E) micrografia eletrônica de transmissão de Cryo-Lip-Q. Por favor, clique aqui para ver uma versão maior da figura.
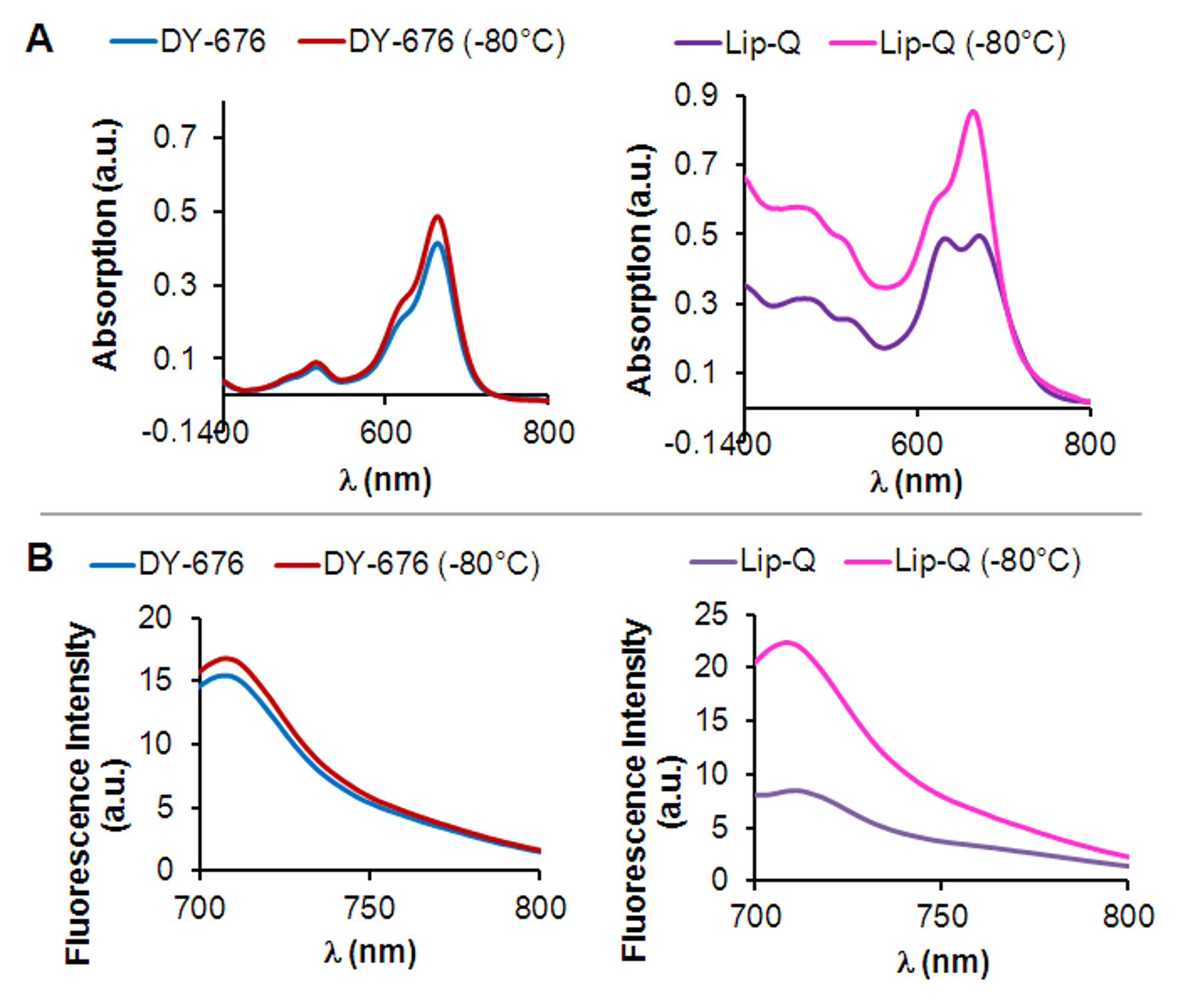
Figura 2:. Determinação físico-química de extinção da fluorescência e activação in vitro (A) Espectro de absorção de Lip-Q (direita) e livre DY-676-COOH (esquerda) medido em tampão Tris 10 mM pH 7,4, antes ou após congelamento a - 80 ° C. Note-se a dupla característica de pico Lip-Q para livre DY-676-COOH e o desaparecimento do pico de azul-deslocada após congelação-danos de Lip-Q. (B) correspondentes espectros de emissão de fluorescência de Lip-Q (direita) e livre DY-676-COOH (esquerda) medido em tampão Tris 10 mM pH 7,4, antes ou após a congelação a -80 ° C.

Figura 3: a absorção celular e a activação de fluorescência lábio osomes. As imagens em (A) foram preparadas por NIR imagens de fluorescência de sedimentos de células após exposição às sondas correspondentes de 24 horas às temperaturas indicadas. As células HT-1080 não sobreviveu aos períodos de incubação de 24 h a 4 ° C. Os diagramas de barras em (B) representam os níveis semi-quantitativa de sinais de fluorescência obtido, atribuindo as ROI para os sedimentos celulares em A. Cada barra indica as intensidades médias de n = 3 experiências ± desvio padrão. Imagens em (C) foram obtidos por microscopia confocal de varrimento laser de células expostas a sondas em lâminas de câmara de cultura durante 24 horas a 37 ° C. Nota o elevado nível de fluorescência na alta fagocítica linha celular de macrófagos de murino J774A.1 e a fluorescência moderada na linha celular de glioblastoma humano U-fagocítica ligeira 118mg. A linha de células de fibrossarcoma humano HT-1080 não fagocítica mostra nenhuma fluorescência das sondas. NBD-DOPE: fosfolipídio verde fluorescente.carga / 52136 / "target =" _ 52136fig3highres.jpg blank "> Clique aqui para ver uma versão maior da figura.
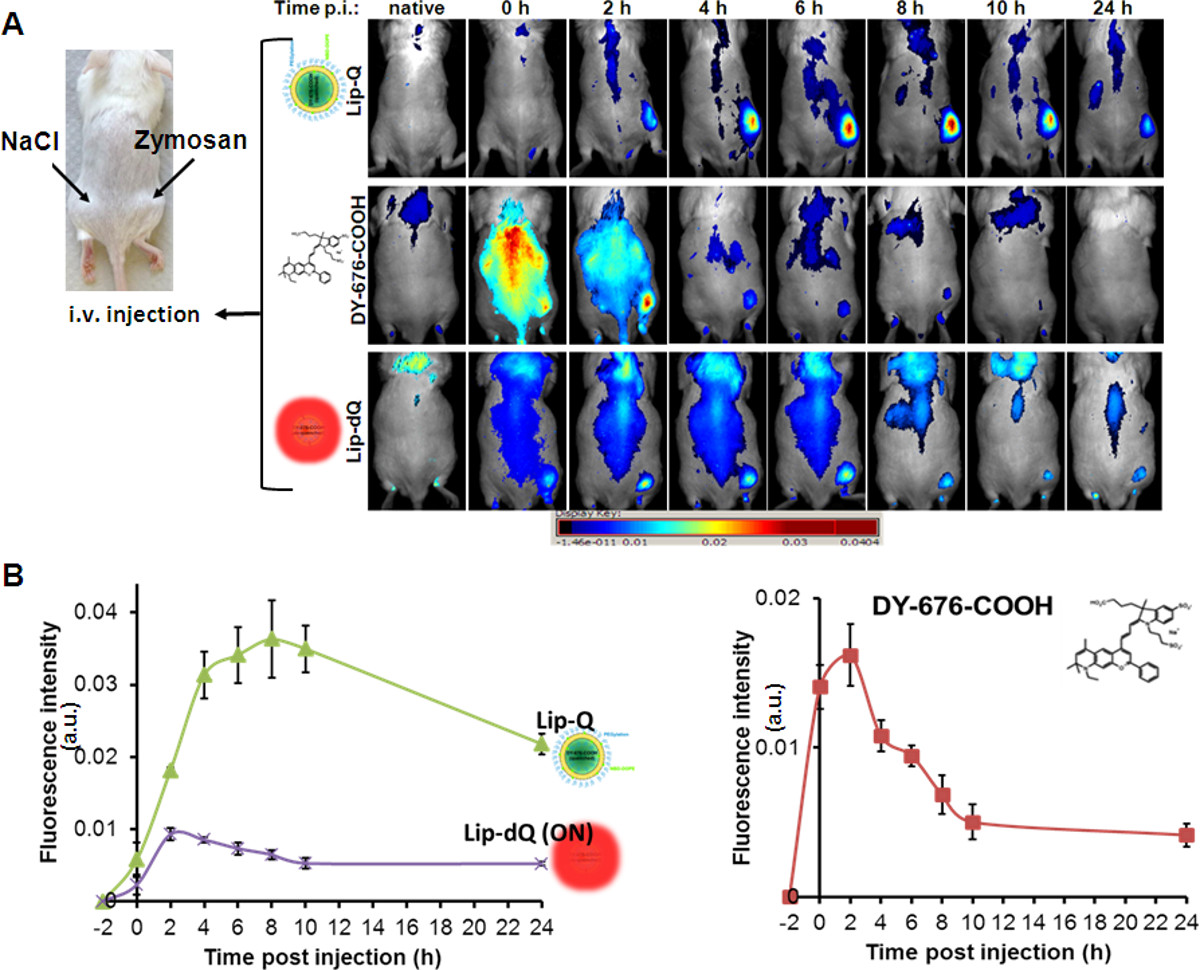
Figura 4. Na imagiologia óptica vivo do edema induzido por zimosano em ratos. (A) A imagem de ratinho da esquerda mostra as posições de subcutaneamente aplicado zimosan-A (500 ug em 50 uL de solução salina) e a solução salina de controlo (50 ul) no flanco esquerdo. A injecção intravenosa de as sondas indicadas e corpo inteiro NIR imagens de fluorescência nos pontos de tempo indicados revelam gradual, mas elevado aumento nos sinais de fluorescência de sinais de edema e baixo fundo de Lip-Q (painel superior) com um máximo de fluorescência a 8 h após a injecção. O corante livre revela perfusão e eliminação rápida dentro de 4 horas após a injecção (painel do meiol), enquanto Lip-dQ revela detecção de edema com baixas intensidades de sinal e uma maior fluorescência de fundo geral. A apresentação gráfica em (B) reiteram os sinais de fluorescência observada de edema detectado com cada sonda em comparação com a região de controlo (solução salina) em n = 5 animais por grupo. Cada gráfico representa os sinais de fluorescência médios de (n = 5) ± SEM. Com os gráficos, o sinal máximo de fluorescência de edema detectado com cada sonda é facilmente distinguida (Lip-Q, 8 horas; Lip-dQ 2-4 hr e livre DY-676-COOH, 2 horas após a injecção). Há uma intensidade de fluorescência significativamente (P = 0,001) maior de edema com Lip-Q contra Lip-dQ em t = 0-24 horas, e com Lip-Q versus Livre DY-676-COOH em t = 4-24 horas. Por favor, clique aqui para ver uma versão maior da figura.
Figura 5: ex vivo imagens Bio-ópticos de órgãos de ratos 24 hr aplicação sonda pós, e correspondente análise semi-quantitativa de intensidades de fluorescência dos órgãos. Cada barra representa a média de intensidade de fluorescência (n = 4) ± SEM. Por favor, clique aqui para ver uma versão maior da figura.
| Formulação de lipossomas | Tamanho [nm] | Índice de polidispersibilidade (PI) | Potencial Zeta [mV] |
| Lip-DQ (dequenched) | 123,4 ± 0,6 | 0,055 ± 0,02 | -10,6 ± 0.4 |
| Lip-Q (extinta) | 118,5 ± 0,7 | 0,04 ± 0,02 | -9 ± 2 |
| Lip-NBD (w / o DY-676-COOH) | 123,0 ± 1,4 | 0,04 ± 0,03 | -11 ± 1 |
Tabela 1: Caracterização dos lipossomas por dispersão dinâmica de luz.
Discussão
Uma vez que os lipossomas também podem servir como sistemas de entrega de corantes fluorescentes, que permitem imagiologia de doenças alvo. A encapsulação de concentrações elevadas de corantes fluorescentes, tais como o corante NIRF, DY676-COOH usado aqui, leva a um elevado nível de extinção de fluorescência do corante aprisionado. Extinção da fluorescência, um fenómeno observado com diversos fluoróforos em concentração elevada pode ser explorada em diversas aplicações em imagiologia in vivo, em que uma alta sensibilidade e detecção fiável da área de destino é exigido. O uso de lipossomas também fornece protecção do corante que é indispensável para as aplicações in vivo.
A técnica de hidratação do filme e extrusão é um método amplamente utilizado que permite a preparação de lipossomas bem sucedido com diferentes gamas de tamanhos, dependendo da necessidade, e permite modificações tais como encapsulação de uma grande variedade de diferentes substâncias 25. Assim, ele é adequado para a preparação de lábioosomes encapsulado com o corante fluorescente NIR, DY-676-COOH para fins de imagiologia. O método origina lipossomas com concentrações de corantes intravesicular 600-840 uM, que estão dentro da concentração extinta pelo corante. A extrusora de mão-LiposoFast básica utilizada para a homogeneização da dispersão vesicular formam-se espontaneamente é adequado para a preparação de lipossomas em pequena escala laboratorial, devido à compatibilidade do dispositivo, com seringas até 1 ml de volume. Para preparações em grande escala é recomendado o uso de maiores homogeneizadores de alta pressão, que são capazes de homogeneizar dispersões de vesículas com uma capacidade de 1.000 litros por hora. A cromatografia de filtração em gel (exclusão de tamanho) é um passo crucial que assegura a separação do corante encapsulado em liposomas a partir de moléculas de corante não-encapsulado (livre) 26. O comprimento da coluna de filtração em gel é vital para a separação eficiente dos lipossomas do presente corante livre. Assim, é necessário preparar uma coluna de comprimento, pelo menos, 28 centímetros to separar com sucesso os lipossomas do livre DY-676-COOH usados aqui. Curiosamente, este comprimento é duas vezes mais tempo do que o usado para purificar carboxyfluorescein (CF) lipossomas carregados de carboxyfluorescein livre. A principal desvantagem da filtração em gel é uma diluição 5:55 vezes das amostras purificadas. Isto pode ser compensado por ultracentrifugação, se são necessários lipossomas altamente concentradas. Durante ultracentrifugação dos lipossomas sedimentar e o sobrenadante pode ser removido facilmente 27. Outras formas de concentrar tais como lipossomas por diálise 28, são mais demorado do que ultracentrifugação.
Além disso o método de hidratação do filme e extrusão, o método de evaporação de fase reversa, 23, bem como o método de injecção de etanol 24 permitir a preparação dos lipossomas com elevada eficiência de encapsulação, para muitas substâncias hidrófilas. No entanto, as nossas investigações revelaram a hidratação do filme combinado com o ciclo de congelação e descongelaçãos ser o método mais adequado para um encapsulamento intralipossómico suficiente de DY-676-COOH. Aumentando a concentração de partida DY-676-COOH utilizado para a hidratação do filme aumenta a eficácia e a concentração do corante intralipossómico, quando uma concentração lipídica de 30 mM fixo é utilizado. Apesar desta eficácia da encapsulação com o método de congelação e descongelação é inferior a 10% da concentração de corante de partida utilizado, mas no entanto é suficiente para a encapsulação de têmpera a concentração necessária para a imagiologia. Além disso, o corante livre separado de lipossomas por filtração através de gel pode ser reciclado por dessalinização e a desidratação de acordo com as instruções do fabricante, fazendo re-encapsulamento possível e uma perda total de corante mínima. A encapsulação do corante pelo protocolo subjacente não tem qualquer influência sobre o tamanho e a morfologia dos lipossomas como visto pelos índices de polidispersão e a micrografia de electrões de Lip-Q.
Vários métodos simples pode ser usado para Avaliado come a atividade de preparado fluorescente liposomes.DY-676-COOH tem uma alta tendência para a auto-têmpera em altas concentrações 21,29 provavelmente resultantes de formação H-dímero e interações de empilhamento de pi entre moléculas de corante. Essas interações, que ocorrem devido à proximidade dos raios Förster de moléculas de corante em altas concentrações, pode ser aniquilada por diluição de 30. Portanto, a encapsulação de concentrações elevadas de DY-676-COOH não apenas proteger o corante de opsonização in vivo, mas também a partir do tampão circundante, mantendo assim a sua alta concentração de retenção e extinção de fluorescência, que, pode ser detectado como uma absorção azul-deslocada pico e baixa emissão de fluorescência como pode ser visto na Figura 2. Congelar lipossomas gradualmente a -80 ° C conduz à formação de cristais de gelo no interior aquoso 31, que provoca danos à membrana lipossomal quando precipitadamente descongeladas a 30 ° C. A liberação, diluição e fluorescência activação da intra-lipossomal DY-676-COOH em tampão após a congelação é revelada em um único pico de absorção e aumento de quase 2,5 vezes na intensidade de fluorescência (Figura 2), o que indica que sequestra Lip-Q, assim, uma alta concentração de têmpera, DY-676-COOH e é activável. Outros métodos para danificar bicamada lipídica lipossómica, tais como o uso de detergentes ou solventes orgânicos não revelam diferenças claras entre o corante livre e o corante encapsulado em liposomas, uma vez que ambos influenciar as propriedades espectrais de diversos corantes fluorescentes 32. O congelamento lento e método de descongelamento duras aqui relatado, por conseguinte, serve como um método mais fiável e promissora para validar a alta encapsulação em lipossomas de fluoróforos e a consequente extinção da fluorescência. A partir dos espectros de absorção e emissão de intacta Lip-Q (Figura 2), algum nível residual de fluorescência pode ser detectada. Isto pode resultar a partir de monómeros não-temperada corante dentro do liposomes e também de interação eletrostática e influência de corante encapsulado por fosfolipídios grupos de cabeça polar 33.
Como pode ser visto na Figura 3, uma acumulação distinta de Lip-Q no macrófago murino altamente fagocítica e humano linha fagocítica ligeira célula de glioblastoma, 118 mg de U-34, mas não na linha celular de fibrossarcoma humano HT-1080 não fagocítica, indica que a imagem baseado Lip-Q- de inflamação seria favorável, uma vez que os fagócitos são os principais agentes de processos inflamatórios. O fato de que a depleção de energia elimina a absorção de Lip-Q, mas não aceitação da livre DY-676-COOH, demonstrando a especificidade da captação phagocytic de Lip-Q e revela que Lip-Q permanece intacta durante o experimento, outra liberação do corante e captação independente de energia teria lugar levando a fluorescência de detecção. Incorporando o fosfolipídio verde fluorescente, NBD-DOPE na bicamada de lipossomas permite imagens microscópicas e discrimination entre não-degradado de lipossomas degradadas celulares especialmente se experiências de incorporação dependentes do tempo são feitas como noticiado anteriormente 32. As imagens microscópicas de fluorescência revelar-NIR de DY-676-COOH que, correlaciona-se com os níveis de intensidade de fluorescência das peletes de células, como determinado por análise semi-quantitativa depois de incubação a 37 ° C. Em conformidade com isso, as linhas celulares de macrófagos murinos mostram a maior fluorescência, enquanto que o glioblastoma humano revelam menor fluorescência de ambos DY-676-COOH e NBD-DOPE do que o anterior. Como esperado, a linha de células de fibrossarcoma humano, HT-1080 de fluorescência não revelam quer corantes lipossomais ou a livre DY-676-COOH, o que reforça o facto de que a captação Lip-Q, é predominantemente por fagocitose.
Para investigar o potencial de Lip-Q-baseado em imagiologia in vivo de inflamação impulsionado-fagocitose, vários controlos foram considerados. Considerando que a livre DY-676-COOH pode ser retomada por phagocytOsis, opsonização de Lip-Q pode levar à liberação do corante, o que pode ser tomada pelos fagócitos. Para evitar isso, Lip-Q foi preparada com 5 mol% de PEGuilação. Além disso, é necessário distinguir entre a absorção, devido ao efeito EPR baseados em inflamação e de absorção activo de activação e de fluorescência. Para resolver isso, a avaliação e comparação das três sondas diferentes, nomeadamente o always-on, Lip-DQ, a extinta Lip-Q e à livre DY-676-COOH em ratinhos portadores de edema induzida por zymosan era necessário. Zymosan-A, que é preparada a partir das paredes de células de Saccharomyces cerevisiae e Cândida albicans é um estimulante da secreção de citocinas naturais por meio da dectina-1 e o receptor? Toll-like 2/6 (TLR 2/6). Citocinas secretadas por sua vez induzem a activação de cascatas a jusante, que resultam em fugas vasculares, facilitando assim a intravasamento / extravasamento de monócitos / macrófagos a partir de um reservatório 35 do baço, bem como os neutrófilos, e a sua migração para sítios de inflamação(Edema) 36-39. O processo de monócitos à base de zymosan / extravasamento de macrófagos e migração precisa apenas 4,5-6 hr que torna zymosan uma ferramenta estratégica para o estudo de processos inflamatórios 36-39. Devido às fugas vasculares que resultam durante a inflamação, por via intravenosa injetada sondas pode ser retomada por monócitos / macrófagos (fagócitos) durante a sua migração para o local da inflamação ou extravasate e ser absorvido no local edema (efeito EPR) 40. O uso do não-temperada Lip-dQ revela um fundo global mais forte do que para os sinais de edema Lip-Q, e um aumento de fluorescência de edema que reflecte a migração de monócitos e macrófagos. Com efeito, a fluorescência máxima de edema é visto já aplicação pós 2-4 hr de Lip-DQ e permanece quase constante até 8 horas. Contrapondo-se a Lip-DQ e Lip-Q, a livre DY-676-COOH sofre perfusão rápida após a injeção e é eliminada dentro de 4 horas, de modo que a imagem distinta de edema não é possível. EmCuriosamente, a utilização dos resultados Lip-Q em aumento persistente na intensidade de fluorescência de edema e muito baixos sinais de fundo. É atribuída Este aumento persistente em intensidades de fluorescência com Lip-Q para fluorescência ativação do corante lipossomal liberado. Tomados em conjunto, pode concluir-se que a contribuição de EPR-efeito baseada na imagiologia Lip-Q é mínima, uma vez Lip-dQ revelar uma fluorescência máxima (efeito EPR e migração de monócitos) a 4 h após a injecção. Assim, a encapsulação lipossomal fornece protecção e entrega distinta de DY-676-COOH, o qual por sua vez permite uma forma mais fiável imagiologia in vivo de edema, exclusivamente após a internalização e degradação (activação de fluorescência) por células fagocíticas. Até agora, o uso de perna edema induzido pelo zimosano para validar as propriedades de imagem de lipossomas fluorescentes é nova. O protocolo aqui referida pode ser expandido tanto por encapsulação de diferentes corantes fluorescentes e de imagiologia do efeito inibidor de diferentes Drugs sobre a indução da inflamação, e, portanto, representa um instrumento útil para a preparação e caracterização de sondas adequadas para imagiologia biomédica.
Outro passo crucial para a definição de sondas de imagem adequados é a verificação de suas propriedades farmacológicas e vias de eliminação. A distribuição de sondas em órgãos que desempenham um papel vital na excreção, tais como o fígado e rins, bem como a sua curta retenção e eliminação adequado a partir destes órgãos é geralmente uma indicação, que as sondas irão muito provavelmente não apresentam efeitos adversos sobre o paciente. De acordo com isso, os órgãos de ratos preparados 24 horas após a injecção de Lip-Q ou a livre DY-676-COOH revelam apenas fluorescência ligeira do fígado / vesícula e nos rins, o que significa uma eliminação preferida do fluorophore lipossomal através via hepatobiliar. O curta alojamento das sondas nesses órgãos e sua eliminação eficiente é apoiada por um 7-fold sinais de fluorescência mais elevados de órgãos preparado 6 horas após a injecção de Lip-Q ou a livre DY-676-COOH 32. Estas observações estão em conformidade com a eliminação dos lipossomas 41 e faz o backup a importância de incluir estudos de biodistribuição quando caracterizando sondas. Embora os efeitos colaterais adversos, tais como irritações da pele e a activação do complemento 42,43 têm sido relatados para as formulações lipossomais utilizadas em aplicações clínicas, tais efeitos não foram detectadas com os lipossomas subjacentes. Além disso, a observação de ratinhos imunodeficientes durante duas semanas após a injecção sonda levou a concluir a limpeza das sondas de os órgãos de ratos (não mostrado).
Divulgações
The authors have nothing to disclose.
Agradecimentos
Este trabalho foi financiado pelas subvenções Deutsche Forschungsgemeinschaft HI-698 / 10-1 e RU-1652 / 1-1. Agradecemos Doreen maio para assistência técnica excelente ea empresa DYOMICS GmbH, Jena por seu apoio tipo.
Materiais
| Name | Company | Catalog Number | Comments |
| Materials and equipments for preparation of liposomes | |||
| egg phospahtidylcholine | Avanti Polar Lipids | 840051P | Dissolve in chloroform and store in glass vials (214 mg/ml) |
| cholesterol | Sigma | C8667 | Dissolve in chloroform and store in glass vials (134 mg/ml) |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt) | Avanti Polar Lipids | 880120P | Dissolve in chloroform and store in glass vials (122 mg/ml) |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt) | Avanti Polar Lipids | 810145P | Dissolve in chloroform and store in glass vials (2 mg/ml) |
| Sartorius MC1 (d = 0.01 mg) | Sartorius AG | Research RC 210 P | used for weighing the phospholipids |
| Rotavapor | Büchi Labortechnik AG | R-114 | used for hydration of phospholipid film |
| Waterbath | Büchi Labortechnik AG | R-481 | used for hydration of phospholipid film |
| Vacuum Controller | Büchi Labortechnik AG | B-720 | used for hydration of phospholipid film |
| Vacobox | Büchi Labortechnik AG | B-177 | used for hydration of phospholipid film |
| Circulation Chiller | LAUDA DR. R. WOBSER GMBH & CO. KG | WKL 230 | used for hydration of phospholipid film |
| DY-676-COOH | Dyomics GmbH | 676-00 | Dissolve in 10 mM Tris and store stock at -20°C |
| Tris-(Hydroxymethyl)-aminomethan | Applichem | A1086 | buffer 10 mM, pH 7.4 |
| Trichlormethan | Carl Roth GmbH + Co. KG | Y015.2 | used for liposome preparation |
| Sonicator | Merck Eurolab GmbH | USR 170 H | used for liposome preparation |
| Vortex Genie 2 (Pop-off Cup, No. 146-3011-00) | Scientific Industries Inc. | SI-0256 | used for liposome preparation |
| Sephadex G25 medium | GE Healthcare Europe GmbH | 17-0033-01 | used for liposome purification |
| Triton X100 | Ferak Berlin GmbH | 505002 | used to destruct liposomes for dye quantification |
| LiposoFast-Basic | Avestin Inc. | used for the extrusion of liposomes | |
| Polycarbonate filter membrane, 100 nm (Whatman Nucleopore Trans Etch Membrane, NUCLEPR PC 19 MM, 0.1 U) | VWR | used for the extrusion of liposomes via LiposoFast-Basic | |
| Fluostar Optima | BMG Labtech | used for dye quantification | |
| Zetasizer Nano ZS | Malvern | used for the determination of liposome size and zetapotential | |
| Ultracentrifuge | Beckmann Coulter GmbH | XL 80 | used for concentration of the samples |
| Rotor | Beckmann Coulter GmbH | SW 55 TI | used for concentration of the samples |
| Materials and equipments for the evaluation of liposome and optical imaging | |||
| Zymosan-A from Saccharomyces cereviciae | Sigma | Z4250-250MG | used for induction of inflammation |
| Isotonic Saline (0.9%) | Fresenius GmbH | PZN-2159621 | used for the dilution of Zymosan-A |
| Isoflurane vaporizer | Ohmeda Isotec 4 | used for anesthesizing animals | |
| Isoflurane | Actavis GmbH | PZN-7253744 | anesthesia |
| Thermo Mat Pro 20 W | Lucky Reptile | 61202-HTP-20 | used to keep animals warm during anesthesia |
| Omnican-F (1 ml injection) | Braun | PZN-3115465 | used for subcutaneous and intravenous application of probes |
| Panthenol eye cream | Jenapharm | PZN-3524531 | used to prevent dryness of the eyes of animals during anesthesia |
| Hanks buffered saline solution | PAA Laboratories /Biochrom AG | L2045 | w/o Mg2+, Ca2+ and phenol red. For dilution of probes and for washing of cells |
| 8-Well chamber slides | BD Biosciences | 354108 | used for cell culture followed by microscopy |
| Cell culture flasks | Greiner BioOne | ||
| Cell culture media | Gibco (life technologies GmbH) | ||
| Fetal calf serum | Invitrogen | ||
| Poly-L-Lysine solution (0.01%, 50 ml) | Sigma | P4832 | used to coat cell culture chamber slides |
| Mountant Permafluor | ThermoScientific | S21022-3 | Mounting solution for microscopy |
| Hoechst-33258 | AppliChem | DNA stain for microscopy | |
| Hera-Safe | Heraeus Instruments | sterile work bench used for cell culture | |
| HERA cell | Heraeus Instruments | Incubator used for cell culture | |
| LSM510-Meta | Zeiss | used for confocal microscopy | |
| Maestro-TM in vivo fluorescence imaging system | CRi, Woburn | used for whole body fluorescence imaging of small animals | |
| Spectrophotometer (Ultrospec 4300 pro UV) | GE Healthcare | used for measurement of absorption | |
| Spectrofluorometer (Jasco FP-6200) | Jasco | used for measurement of fluorescence emission | |
| Animals | |||
| NMRI mice (8-12 weeks old, male) | Elevage Janvier, France | used for inflammation trials | |
Referências
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers). Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Cabanes, A., et al. Enhancement of antitumor activity of polyethylene glycol-coated liposomal doxorubicin with soluble and liposomal interleukin 2. Clinical cancer research : an official journal of the American Association for Cancer Research. 5, 687-693 (1999).
- Gabizon, A., Shmeeda, H., Grenader, T. Pharmacological basis of pegylated liposomal doxorubicin: impact on cancer therapy. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 45, 388-398 (2012).
- Balasubramanian, S. V., Bruenn, J., Straubinger, R. M. Liposomes as formulation excipients for protein pharmaceuticals: a model protein study. Pharmaceutical research. 17, 344-350 (2000).
- Meyer, J., Whitcomb, L., Collins, D. Efficient encapsulation of proteins within liposomes for slow release in vivo. Biochemical and biophysical research communications. 199, 433-438 (1994).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochimica et biophysica acta. 858, 161-168 (1986).
- Mayer, L. D., Bally, M. B., Hope, M. J., Cullis, P. R. Techniques for encapsulating bioactive agents into liposomes. Chemistry and physics of lipids. 40, 333-345 (1986).
- Walde, P., Ichikawa, S. Enzymes inside lipid vesicles: preparation, reactivity and applications. Biomolecular engineering. 18, 143-177 (2001).
- Weissleder, R., Ntziachristos, V. Shedding light onto live molecular targets. Nature medicine. 9, 123-128 (2003).
- Licha, K., Riefke, B., Ebert, B., Grotzinger, C. Cyanine dyes as contrast agents in biomedical optical imaging. Academic radiology. 9 Suppl 2, S320-S322 (2002).
- Pauli, J., et al. Novel fluorophores as building blocks for optical probes for in vivo near infrared fluorescence (NIRF) imaging. Journal of fluorescence. 20, 681-693 (2010).
- Holzer, W., et al. Photostability and thermal stability of indocyanine green. Journal of photochemistry and photobiology. B, Biology. 47, 155-164 (1998).
- Gandorfer, A., Haritoglou, C., Kampik, A. Retinal damage from indocyanine green in experimental macular surgery. Investigative ophthalmology & visual science. 44, 316-323 (2003).
- Saxena, V., Sadoqi, M., Shao, J. Degradation kinetics of indocyanine green in aqueous solution. Journal of pharmaceutical. 92, 2090-2097 (2003).
- Kodjikian, L., et al. Toxic effects of indocyanine green, infracyanine green, and trypan blue on the human retinal pigmented epithelium. Graefe's archive for clinical and experimental ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle Ophthalmologie. 243, 917-925 (2005).
- Sevick-Muraca, E. M., Houston, J. P., Gurfinkel, M. Fluorescence-enhanced, near infrared diagnostic imaging with contrast agents. Current opinion in chemical biology. 6, 642-650 (2002).
- Bremer, C., Ntziachristos, V., Weissleder, R. Optical-based molecular imaging: contrast agents and potential medical applications. European radiology. 13, 231-243 (2003).
- Hilderbrand, S. A., Kelly, K. A., Weissleder, R., Tung, C. H. Monofunctional near-infrared fluorochromes for imaging applications. Bioconjugate chemistry. 16, 1275-1281 (2005).
- Langhals, H., et al. Cyanine dyes as optical contrast agents for ophthalmological surgery. Journal of medicinal chemistry. 54, 3903-3925 (2011).
- Pauli, J., et al. An in vitro characterization study of new near infrared dyes for molecular imaging. European journal of medicinal chemistry. 44, 3496-3503 (2009).
- Ogawa, M., Kosaka, N., Choyke, P. L., Kobayashi, H. H-type dimer formation of fluorophores: a mechanism for activatable, in vivo optical molecular imaging. ACS chemical biology. 4, 535-546 (2009).
- Szoka, F., Papahadjopoulos, D. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation. Proc.Natl.Acad.Sci.U.S.A. 75, 4194-4198 (1978).
- Batzri, S., Korn, E. D. Single bilayer liposomes prepared without sonication. Biochimica et biophysica acta. 298, 1015-1019 (1973).
- Fahr, A., van Hoogevest, P., May, S., Bergstrand, N., ML, S. L. Transfer of lipophilic drugs between liposomal membranes and biological interfaces: consequences for drug delivery. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 26, 251-265 (2005).
- New, R. R. C. Liposomes a practical approach. , IRL Press at Oxford University Press. (1990).
- Barenholz, Y., et al. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16, 2806-2810 (1977).
- Schwendener, R. A. The preparation of large volumes of homogeneous, sterile liposomes containing various lipophilic cytostatic drugs by the use of a capillary dialyzer. Cancer drug delivery. 3, 123-129 (1986).
- Pauli, J., et al. Suitable labels for molecular imaging--influence of dye structure and hydrophilicity on the spectroscopic properties of IgG conjugates. Bioconjugate chemistry. 22, 1298-1308 (2011).
- Wu, P., Brand, L. Resonance energy transfer: methods and applications. Analytical biochemistry. 218, 1-13 (1994).
- Stark, B., Pabst, G., Prassl, R. Long-term stability of sterically stabilized liposomes by freezing and freeze-drying: Effects of cryoprotectants on structure. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 41, 546-555 (2010).
- Tansi, F. L., et al. Liposomal encapsulation of a near-infrared fluorophore enhances fluorescence quenching and reliable whole body optical imaging upon activation in vivo. Small. 9, 3659-3669 (2013).
- Chen, R. F., Knutson, J. R. Mechanism of fluorescence concentration quenching of carboxyfluorescein in liposomes: energy transfer to nonfluorescent dimers. Analytical biochemistry. 172, 61-77 (1988).
- Windler-Hart, S. L., Chen, K. Y., Chenn, A. A cell behavior screen: identification, sorting, and enrichment of cells based on motility. BMC cell biology. 6, 14(2005).
- Swirski, F. K., et al. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
- Erdo, F., Torok, K., Aranyi, P., Szekely, J. I. A new assay for antiphlogistic activity: zymosan-induced mouse ear inflammation. Agents and actions. 39, 137-142 (1993).
- Ajuebor, M. N., et al. Endogenous monocyte chemoattractant protein-1 recruits monocytes in the zymosan peritonitis model. Journal of leukocyte biology. 63, 108-116 (1998).
- Ajuebor, M. N., Das, A. M., Virag, L., Szabo, C., Perretti, M. Regulation of macrophage inflammatory protein-1 alpha expression and function by endogenous interleukin-10 in a model of acute inflammation. Biochemical and biophysical research communications. 255, 279-282 (1999).
- Ajuebor, M. N., et al. Role of resident peritoneal macrophages and mast cells in chemokine production and neutrophil migration in acute inflammation: evidence for an inhibitory loop involving endogenous IL-10. J Immunol. 162, 1685-1691 (1999).
- Binstadt, B. A., et al. Particularities of the vasculature can promote the organ specificity of autoimmune attack. Nature. 7, 284-292 (2006).
- Ishida, T., Harashima, H., Kiwada, H. Liposome clearance. Bioscience reports. 22, 197-224 (2002).
- Dobrovolskaia, M. A., McNeil, S. E. Understanding the correlation between in vitro and in vivo immunotoxicity tests for nanomedicines. Journal of controlled release : official journal of the Controlled Release Society. 172, 456-466 (2013).
- Szebeni, J., et al. Prevention of infusion reactions to PEGylated liposomal doxorubicin via tachyphylaxis induction by placebo vesicles: a porcine model. Journal of controlled release : official journal of the Controlled Release Society. 160, 382-387 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados