Method Article
のためのツールとしてのリポソームカプセル化された近赤外蛍光体の蛍光消光
* これらの著者は同等に貢献しました
要約
The use of fluorophores for in vivo imaging can be greatly limited by opsonization, rapid clearance, low detection sensitivity and cytotoxic effects on the host. Encapsulation of fluorophores in liposomes by film hydration and extrusion leads to fluorescence quenching and protection which enables in vivo imaging with high detection sensitivity.
要約
Optical imaging offers a wide range of diagnostic modalities and has attracted a lot of interest as a tool for biomedical imaging. Despite the enormous number of imaging techniques currently available and the progress in instrumentation, there is still a need for highly sensitive probes that are suitable for in vivo imaging. One typical problem of available preclinical fluorescent probes is their rapid clearance in vivo, which reduces their imaging sensitivity. To circumvent rapid clearance, increase number of dye molecules at the target site, and thereby reduce background autofluorescence, encapsulation of the near-infrared fluorescent dye, DY-676-COOH in liposomes and verification of its potential for in vivo imaging of inflammation was done. DY-676 is known for its ability to self-quench at high concentrations. We first determined the concentration suitable for self-quenching, and then encapsulated this quenching concentration into the aqueous interior of PEGylated liposomes. To substantiate the quenching and activation potential of the liposomes we use a harsh freezing method which leads to damage of liposomal membranes without affecting the encapsulated dye. The liposomes characterized by a high level of fluorescence quenching were termed Lip-Q. We show by experiments with different cell lines that uptake of Lip-Q is predominantly by phagocytosis which in turn enabled the characterization of its potential as a tool for in vivo imaging of inflammation in mice models. Furthermore, we use a zymosan-induced edema model in mice to substantiate the potential of Lip-Q in optical imaging of inflammation in vivo. Considering possible uptake due to inflammation-induced enhanced permeability and retention (EPR) effect, an always-on liposome formulation with low, non-quenched concentration of DY-676-COOH (termed Lip-dQ) and the free DY-676-COOH were compared with Lip-Q in animal trials.
概要
リポソームは、集中的に調査し、臨床応用1,2に最も生体適合性の生物医学的な薬物送達システムの一つとして機能してきた。これらは、主に天然の細胞膜の一部を模倣する生体適合性化合物であり、その両方が、リン脂質およびコレステロールから構成されている。親水性物質は水性内部内に捕捉することができるが、親油性薬剤は、リポソームのリン脂質二重層3内に組み込むことができる。リポソームの水性内部内の 物質のカプセル化は、 インビボでの分解に対する保護を付与し、また、腫瘍細胞を破壊することを目的とし、例えば化学療法のための疾患の治療のために使用される細胞毒性薬剤の毒性作用からホストシステムを防ぐ。ポリエチレングリコール(PEG化)のようなポリマーとリポソーム表面の修飾は、さらにによる立体安定化を、インビボでのリポソームの血液循環時間を延長4。 Moreov小胞体、リポソームは、タンパク質、5,6-、親水性物質7,8および酵素9のようないくつかの物質の高濃度を隔離することができる。したがって、それらは、そのような癌治療のための4ドキソルビシンなどの細胞毒性薬剤の送達のための彼らの承認に値するとして信頼性の高い臨床治療および診断ツールを提供しています。それらの柔軟性のために、リポソームは、診断および画像誘導外科的目的のために蛍光色素をロードすることができる。
蛍光イメージングは、しかしながら、いくつかの基本的な要件を要求するインビボでの診断ツールでコスト効果の高い、非侵襲的に提供する。これは、in vivoイメージングのための最高に合う蛍光色素は、光分散及び散乱ならびに水由来の組織の自己蛍光およびヘモグロビンが低い範囲の特性吸収と発光極大を有することが証明できた。したがって、そのようなプローブは、650と900 nmの10の間に彼らのABS /全角最大を持っている。オプソニン化および急速なクリアランスが大きくインビボ画像11のためのそれらの適用を制限することができ、この他に、in vitroおよびin vivoの両方での蛍光色素の安定性は、重要である。そのような貧しい安定性と低感度やインドシアニングリーン(ICG)12-16で見られるように標的器官に細胞毒性作用などの他の効果は、望ましくないとin vivoイメージングのためのプローブを設計する際に考慮に入れなければならない。これらの観察は、いくつかの前臨床NIR蛍光色素、ナノ粒子、ならびに炎症プロセス、癌のin vivoイメージングのための、画像誘導手術17-20のための新しい技術の開発が活発につながっている。ほとんどの前臨床NIRF(近赤外蛍光)の安定性にもかかわらず、染料インビトロ 、肝臓および腎臓を介してそれらの迅速な灌流およびクリアランス疾患および炎症プロセスのインビボ光学イメージングにおけるそれらの使用を妨げる。
ntentは">したがって、我々はそのようなよく特徴付け近赤外蛍光色素DY-676-COOH、比較的高濃度のリポソームで21で自己クエンチする傾向のために知られているような蛍光色素のカプセル化のためのプロトコルを提示する。高濃度でH-二量体形成および/または蛍光色素分子間の蛍光共鳴エネルギー移動(FRET)に互いのフェルスター半径結果内に位置するフルオロフォア分子間のπスタッキング相互作用、低濃度では、フルオロフォア分子の間隔が増大し、それによって、πスタッキング相互作用を防止しHダイマー形成および高い蛍光発光をもたらす。高および低濃度および添付蛍光消光及び活性化との間のスイッチは、光学イメージング22に利用することができる有望な戦略である。この点で、NIRF染料高濃度のカプセル化DY-676-COOHリポソームの水性内部には多くのFAです遊離色素よりもin vivoイメージングのためのvorable。この方法の課題は、染料を高濃度でカプセル化から生じる利益の検証において、第二に、正しいカプセル内のすべての第ある。遊離色素のそれでクエンチしたリポソームの結像特性を比較し、また、色素の濃度が低い非クエンチリポソーム製剤とすることが不可欠である。私たちは、リポソーム中DY-676-COOHの消光濃度のカプセル化が可能であり、代替凍結融解サイクルと組み合わせるシンプルな、しかし非常に効果的なフィルムの水和と押し出しプロトコルによって示している。そのような逆相蒸発法23と同様にエタノール注入法24としてのリポソームを調製するために使用される他の方法は、多くの親水性物質のための高い封入効率を有するリポソーム製剤を可能にする。しかし、カプセル化される物質の性質は、カプセル化効率に影響を与えることができる。実際には、ここで紹介するフィルムの水和と押し出しプロトコルは、DY-676-COOHのカプセル化のための最高の効率を明らかにした。 DY-676-COOH、数時間以内に、炎症過程の研究を可能にするザイモサン誘導浮腫モデルのリポソームカプセル化の利点を説明するために、使用された。ここでは、カプセル化されたDY-676-COOHの高濃度を有するリポソームが遊離色素または低染料濃度を有する非クエンチリポソーム製剤よりも炎症過程のインビボ光学イメージングに全身に適していることが実証される。したがって、基本的なプロトコルは、 インビトロおよびインビボの両方でクエンチし、蛍光リポソームおよびそれらの活性化およびイメージング可能性の検証を生成するための簡単かつ迅速な方法を提供する。プロトコル
注:すべての手順は、地域の動物委員会や動物の倫理的な使用に関する国際的なガイドラインに従って承認されている。
材料と楽器の作製
- 自然発生的に形成された小胞分散液の調製(SFV)
- 溶解すると、以下のリン脂質のストック溶液を調製する:214 mg / mlの卵ホスファチジルコリン(EPC)、134 mg / mlのコレステロール、122 mg / mlの1,2- distearoyl- のsn -glycero -3- phosphoethanolamine- N - [メトキシ(ポリエチレングリコール)-2000](アンモニウム塩)(のmPEG 2000 -DSPE)および2mg / mlの1,2- dioleoyl- のsn -glycero -3- phosphoethanolamine- N - (7-ニトロ- 2-1,3-benzoxadiazol-4ガラスバイアル中でクロロホルムストア内イル)(アンモニウム塩)(NBD-DOPE)。
- 丸底フラスコ中で約3ミリリットルのクロロホルムを提出し、EPからなるリポソームを調製する丸底フラスコに、リン脂質のストック溶液の適切な容量を転送するC:3:0.5のChol:6.5のモル比でのmPEG 2000 -DSPE。リポソームの二重蛍光標識のために脂質溶液に0.3モル%NBD-DOPEを追加します。
- ロータリーエバポレーターを用いて55℃で減圧(300ミリバール)下で、有機リン脂質溶液からクロロホルムを蒸発させる。
- 均一なリン脂質膜を形成した後、残留クロロホルム堆積物を除去するために1〜2時間10ミリバールの圧力を低下させる。
- クロロホルムが蒸発している間、10 mMトリス緩衝液(pH7.4)にDY-676-COOH(6.181μM)を溶解し、液体窒素デュワー瓶を埋める。超音波浴に切り替え、50℃に設定。
- DY-676-COOH(6.181μM)自然発生的に形成された小胞(SFV)の分散が形成されるまでドライリン脂質フィルム、激しく渦を水和する丸底フラスコに、溶液の適切な容量(0.5〜ml)を転送します。リン脂質の全てが脂質の損失を回避するために、分散していることを確認してください。
- 慎重にTRA液体窒素中SFV分散体を含有する丸底フラスコnsferと3-5分間分散をフリーズ。その後分散を解凍1-2分間激しく分散を渦に50℃の超音波浴に丸底フラスコを置きます。 7凍結融解サイクルの合計を作り、この手順を6回繰り返します。
- 均質なリポソーム小胞を形成するためのSFVの押出
- 1mlシリンジ(注射器-a)の中SFV分散液を移し、シリンジ-bの中にLiposoFastベーシック押出機を用いて100nmのポリカーボネート膜を通して分散液を押し出す。
- サイクルを10回繰り返した後、バックシリンジ-Aに、注射器-bから分散を押し出す。押し出し、時間との明確な分散物に曇った外観から注射器の変化で溶液に起因する。 10サイクル(20シングル押し出しステップ)した後、デバイスから注射器-Bを削除し、直接、滅菌シリンジ-から最後の時間のための分散を押し出す1.5ミリリットルの反応管。
- リポソームの精製は、無料の色素からDY-676-COOHをカプセル化
- 10 mMトリス緩衝液pH 7.4(カラム長28センチメートル、直径0.8センチメートル)に浸しG25ビーズを用いたゲルクロマトグラフィーカラムを準備する。
- ゲル床の上に押し出された小胞体分散液の0.5ミリリットルを転送し、ゲルマトリックス内に試料の消耗をしましょう。
- 10mMトリス緩衝液(pH7.4)( 図1A)を有するリポソームを溶出し、カラムから完全に遊離色素ドレンまでカラムを洗浄する。必要であれ場合は、収集し、製造業者の説明書に従って脱塩し、脱水によって遊離色素をリサイクルする。
- 超遠心により溶出リポソームを濃縮する(20万×gで、8℃で2時間)、その後、滅菌10mMトリス緩衝液の適切な容積でそれらを分散させる、7.4。
- カプセル化されたDY-676-COOH濃度の定量
- DY-676-COOH(0、82、124を溶解することにより検量線を作成し、10mMトリス緩衝液、0.1%トリトンX100を含有するpH7.4の247、494、988 nM)を有する。
- 小胞を破壊し、封入された染料を放出するように、1%トリトンX100を含有する100μlのトリス緩衝液中、室温で5分間リポソームを2μl(50ミリモル/ Lのストックの100 nmolの最終脂質)を溶解する。 0.1%の最終のTriton-X100濃度を10mMトリス緩衝液、pH7.4中の試料を希釈(v / v)の全量1mlを作る。重複してすべてのサンプルを準備します。
- 励起λ= 645 nmおよび放出λ= 700 nmで(無料DY-676-COOHおよびTriton-X100は、リポソームを処理したもの)すべてのサンプルの吸収および発光を測定します。確立し、封入された染料の濃度を決定するために、遊離色素の検量線を使用する。
- リポソーム特性評価
- 動的光散乱法によりリポソームのサイズとゼータ電位を決定します。交流の滅菌フィルター(0.2μm)を10 mMトリス緩衝液(pH7.4)とリポソームサンプルを希釈100から300μM(脂質)のoncentration。低容量の使い捨てキュベットに希釈した試料を移し、製造業者の説明書に従って、サンプルを測定する。
- 標準的なプロトコルに従ってリポソーム小胞のサイズ、完全性および均一性を実証するために、電子顕微鏡でリポソームを特徴付ける。
2.蛍光消光の検証と調製されたリポソームの活性化
- 蛍光消光及び活性化の物理化学的分析
- リップ-Qのための2つの1.5ミリリットルチューブ、無料のDY-676-COOHのための2のチューブを準備します。転送100ナノモルの全脂質対応するチューブに(カプセル化されたDY-676-COOHの138μg/ mlのを含む42ミリモル/ Lリップ-Q原液の2.38μL、)。リップ-Q(使用されるX 2.38μlのリップ-Q 138μgの/ 1,000μLから例の結果0.38μgの)の染料含有量に無料でDY-676-COOH相当を転送します。 1タブをインキュベート4℃での各プローブのeおよび-80℃で一晩(16時間)で第2のチューブを凍結する。
- 30℃に加熱ブロックを加熱する。砕いた氷で冷却ボックスを充填し、室温に10 mMトリス緩衝液(pH7.4)のアリコートを平衡化。
- 4℃からプローブを除去し、5分間、30℃で-80℃からプローブ(光から保護するためにアルミホイルで包まれた)、すぐに解凍し、室温で平衡化。 (また、光から保護するためにアルミホイルで包まれた)を室温にそれらを転送する前に1分間氷上で解凍したプローブを冷やす。
- 100μlの最終容量にプローブの各々に10mMトリス緩衝液(pH7.4)を加え、室温で10分間、すべてのプローブを平衡化する。
- ピペット80の低容量のガラスキュベットに各プローブμlの分光計400~900ナノメートルから各プローブの吸収を測定する。それらに対応するチューブにプローブを返します。
- 適切なガラスキュベットに各プローブの80μlのを転送674 nmで励起するプローブによる蛍光光度計での蛍光発光を測定し、694-800ナノメートルの蛍光を測定する。
- 細胞取り込みおよび蛍光活性化
- 標準条件(37℃、5%CO 2および95%加湿雰囲気)に応じて、それらの対応する培養培地中で以下の細胞株を取得し、培養する。ここで、U-118MG(必須ビタミンを含有するMEMおよび10%(体積/(ダルベッコ改変イーグル培地、10%(v / v)ウシ胎児血清を補充した)、ヒト膠芽腫細胞株をマウスマクロファージ細胞株J774A.1を使用v)のウシ胎児血清)およびヒト線維肉腫細胞株、HT-1080(5%FCSを含むRPMI)。
- コートポリ-L-リジンとの8ウェルチャンバースライド(各ウェルに100μlの0.001%ポリ-L-リシンを追加し、10分間37℃でインキュベートする。吸引除去液とチャンバースライドは、少なくとも4用に乾燥させ無菌作業台上で、室温で時間。チャンバースライドをすすぐ3必要とされるまで、200μlのハンクス緩衝食塩水回、その後、4℃でパラフィン及びアルミ箔とストアでそれらを密封する。
- チャンバースライドが枯渇している間に必要とするまで、4℃でリポソームと染料溶液とストアをフィルター滅菌する。
- インビボでの NIR蛍光イメージングシステムにおける全身プローブ取り込み分析のために、3つの試験細胞株の各々について5小さな培養フラスコ(合計15フラスコ)を準備する。シード2×10 6 J774A.1、U-118MGおよび(5倍に)のそれぞれの培地を5 mlの培養フラスコ当たりのHT-1080細胞および16-24時間成長する。 、培養フラスコに平行なそれぞれのチャンバースライドの2ウェルに各細胞株(J774A.1およびHT-1080)または20,000細胞(U-118MG)の30,000細胞を播種し、16〜24時間、500μlの培養培地中で増殖。
- 翌日、細胞株につき2フラスコに、チャンバースライド上の各細胞株の1つのウェルにリップ-Qの100ナノモル(最終脂質量)を追加します。直ちに4℃、バックインキュベーターに第二のフラスコに細胞株あたり1フラスコを転送する。
NOTE:チャンバースライド上の濃度作り、プローブの容量がフラスコに添加し、チャンバースライドが同じである10倍高い(5 mlを500μlの培養培地である)。顕微鏡的検出をフラスコからの細胞ペレットを結像さNIR蛍光イメージングシステムよりも感度が低いので、これが必要である。 - その後直ちに細胞株あたり1フラスコを転送する、細胞株当たり2フラスコ中の細胞へとチャンバースライド上の各細胞株の1つのウェルにリップ-Q染料含有量に相当する濃度でフリーDY-676-COOHを追加4℃(エネルギー枯渇)とバックインキュベーターにチャンバースライドと一緒に他のフラスコに。対応する条件で24時間、すべての細胞をインキュベートする。プローブなしのフラスコ中の細胞を未処理の対照として役立つ。
- NIRFイメージングと半定量分析
- 24時間のインキュベーション期間の後、ハンクスで細胞を2回洗浄することによってフラスコ中で細胞を採取、その後500μlのチューブ内で遠心分離(200×gで5分間)で、500μlのHBSS、ペレット中の細胞をこすり取る塩溶液(HBSS)をバッファリング。
- 励起(615から665 nm)を放出(> 700 nmのカット)のフィルタを使用して、NIRFイメージャと画像内の細胞ペレット(及びHBSS)でチューブを置きます。
- 自家蛍光を控除し、製造者の指示に従って、自家蛍光対ターゲットの強さを評価する。これは、測定値が互いの間で比較可能となるように、露光時間、カメラゲイン、ビニングおよびビット深度のためのスケーリング後のカウントレベルを表す平均信号として蛍光強度(スケーリングされたカウント/秒)の半定量的レベルを与える。
- 共焦点顕微鏡分析
- 24時間のインキュベーションの後、500μlのHBSSで2回洗浄することにより、チャンバースライド上で細胞を回収。
- CEを修正RTで30分間、3.7%(v / v)のホルムアルデヒドを含む200μlのHBSSとLLS。
- 固定が起こっている間、DNA染色マウントソリューションで、ヘキスト-33258 1:50に希釈する。
- 固定後、その後HBSSで細胞を2回洗浄したスライドガラスからチャンバーを分離する。チャンバースライドのウェルに対応する各スポット上のDNA染色を含む50μlのマウントソリューションを追加します。ガラスカバースリップで細胞をカバーし、室温で10分間(暗い)用の透明なマニキュアと空気乾燥でエッジをシールする。
- 適切な蛍光顕微鏡または共焦点顕微鏡上で画像セル。核(ヘキスト-33258:励起405nmで、放射420から480 nm)で対応するコンポーネントの可視化のための以下の励起および発光の設定を使用します。 NBD-DOPE(リポソーム脂質:励起488nmで、放射530 nm)を。 DY-676-COOH(NIR蛍光色素:励起633から645 nmの、放射650〜700ナノメートル)。
注:いることを確認して蛍光顕微鏡Availableは、より高い630 nmより波長の励起および発光を可能にする適切なフィルターが装備されている。
3.リポソームベースの炎症のin vivo蛍光イメージングで
- 動物や材料の調製
- 食物および水を自由に標準条件下で約36 250gのハウスは、8-12週齢の雄性NMRIマウス。
- 実験の開始前7日間の組織自己蛍光を低減するために、すべてのマウスを低フェオフォルビド食を与える。
- 二十四時間後、各実験の開始前に、所望の領域にマウスを削る( 例えば、後肢浮腫のイメージングを使用する場合に、裏面全体面積)。
- 動物の重量を測定し、体重kg当たり10マイクロモル(脂質濃度)で(リップ-Qとリップ-DQマウスあたりに噴射されるプローブの量を計算し、無料のDY-676-COOH使用リップ-Qのコンテンツを染色する(等価) 。
- 画像の動物細胞ペレットを使用したのと同じ設定で全身NIR蛍光イメージャ。この測定は、動物の自己蛍光を提供しています。
- 1mlの等張生理食塩水を10 mgのザイモサンAを溶解し、4℃で一晩保存する。
- 炎症のおよびin vivo NIRFイメージングにおける誘導
- 次の解決策を含むマウスあたり3注射器を準備します。 50μlのザイモサン溶液(10mg / ml)と50μlの等張食塩水で第2のシリンジを有する1つのシリンジを充填する。対照動物のためのリップ-Qとリップ-DQ(10マイクロモル/ kgの体重(脂質))(LIP-Qのように濃度)試験動物とフリーDY-676-COOHのために指定されていることにより、プローブを、第3注射器を埋める。プローブは、150μlの最終容量に無菌のHBSSで希釈することを確認してください。
- (乾燥を避けるため、彼らは深く眠っているまで2%のイソフルランで動物を麻酔し、足に触れたときに反応しないように動物の眼にアイクリームを適用しますこれは)約2分かかります。
- (まだ麻酔下)暖かいマットの上にマウスを置き、右後肢にザイモサン - 溶液を皮下と左後脚に生理食塩水を注入する。 (tは0時間を=のように)注入/測定の記録時間をすぐに静脈内にプローブを注入して、その後の画像動物。画像キューブなどの結果の画像を保存し、他のすべての動物とそれぞれのプローブのための上記の手順を繰り返します。
- 画像動物測定室の段階(たとえば、下に暖かいマットを置くことによって)、ウォームであることを確認し、10時間後に注入するための2時間、次いで、24時間後の注射、低体温を回避するためである。各測定後、餌と水を自由にケージに動物を配置し、温帯動物チャンバー内にケージを置く。動物はもはや触れなくなるまで反応し、その後、5〜10分間、二酸化炭素で安楽死させる2%イソフルランで麻酔第によって動物を安楽死させる動物が完全に呼吸が停止し、死後硬直が発生していることを確認してください。
- 標準のオンライン評価することが可能なプロトコル(http://www.freebookez.com/mouse-dissection-lab-report/)と画像の臓器に応じてマウスを解剖。
- 最初の自己蛍光のために関心領域を割り当て、その後、動物の全体的な蛍光(非混合)を控除することにより、製造業者の指示に従って測定した結果を評価する(生理食塩水後肢左)および炎症領域(ザイモサンAと右後肢)の蛍光を標的とする。
結果
そのようなNIRF染料DY676-COOHのような蛍光色素、高濃度のカプセル化は、リポソームの水性内部にここで使用される蛍光消光の高いレベルをもたらす。蛍光消光、高濃度で、多くのフルオロフォアで見られる現象は、標的領域の高感度で信頼性の高い検出が要求されるインビボイメージング用途のいくつかで利用することができる。リポソームの使用はまた、in vivoでの適用のために不可欠である染料の保護を提供する。リポソームの完全な特徴付けが必要であり、そのようなリポソームのカプセル化された染料、安定性およびサイズのレベルなどの要因、 インビトロでもインビボ画像化の目的のために適用可能でカプセル化された色素の蛍光消光及び活性を含む。遊離色素の比較、DY-676-COOH及び急冷リポソーム(リップ-Q)、並びに非常に低いコンセント非クエンチリポソーム(リップのdQ)カプセル化された染料の比は、特にin vivoでの特徴付けのためにきわめて重要である。
押出前に、連続する凍結融解サイクルの膜水和及び押出技術を用いて調製されたリポソームは、速く溶出するリポソーム(と比較して、正常にゲル濾過マトリックスでの長い滞留によるリポソームから分離することができ、残留遊離染料分子を含んで図1B)。図示のようにゲル濾過した後、希釈のレベルに応じて、任意の超遠心分離工程( 図1C)、リポソームの濃度を可能にする。カプセル化された染料の吸収及び発光特性に基づいて、カプセル化された色素の濃度は、遊離色素( 図1D)の検量線を利用して決定される。カプセル化された染料の濃度に加えて、それはリポソーム後方のサイズおよび均一性を決定することが重要であるERの準備。 図1Eに見られるように、基礎となる方法によって調製されたリポソームの電子顕微鏡写真は、膀胱内DY-676-COOHを含有する、消光濃度範囲内(リップ-Qのいずれかをリポソーム小胞の大部分は単層の形態を明らかにし、606から846μMのDY-676 )または非急冷色素濃度(リップ-DQで、25μMDY-676)。さらに、それらははるかに1( 表1)について約120nmであり、多分散性指数の均一なサイズ分布を明らかにする。蛍光消光のために、リップ-Qは、一つのピークが青色波長の方へシフトすることを特徴とすることにより、水性緩衝液中の2つの吸収極大を示す。これに伴い、蛍光発光は、遊離色素( 図2AおよびB、 右 )と比較して非常に低い。周囲の溶液中に希釈されます染料、のリリースでは、リポソーム結果の損傷をフリーズします。ブルーシフト吸収ピークしたがってジsappears、リップ-Qの単一の吸収ピークを生じる。これに対応して、凍結破損リップ-Qの蛍光強度の増加が解除色素分子の蛍光活性化が起こったことを示し、見られている。遊離色素に関係なく凍結( 図2A及びB、 左 )と同じレベルのままである、単一の吸収極大および高い蛍光強度を明らかにする。この知見は、リップ-Qのように、リポソーム中の染料のカプセル化は、環境から染料を保護する高濃度と関連する蛍光消光を保持し、ターゲット·トリガで起動される場合は、蛍光の増加により検出を可能にするであろうことを示唆している。
基礎となる脂質組成物を用いたリポソームのプローブは、エネルギー枯渇により阻害される支配的な食細胞への取り込みを明らかにする。これは、高度に食作用性ネズミマクロファージ細胞株J774A.1によってリップ-Qの取り込みを介して見られることができ、軽度貪食ヒト膠芽腫細胞系37℃でU-118MG、4℃( 図3AおよびB)における阻害。遊離色素DY-676-COOHは、食細胞株の両方で37℃、リポソームプローブリップ-Qは、溶液中の残留遊離染料を含まず、能動的取り込みだけを受けることができることを示し、4℃での取り込みを明らかにする。共焦点レーザー走査顕微鏡画像さらに食細胞( 図3C)にリップ-Qの取り込みおよび活性化を実証する。また、非食ヒト線維肉腫細胞株における蛍光の欠如、HT-1080は、リップ-Qの取り込みは食作用によって主であり、したがって、食細胞、単球/マクロファージが関与する炎症のイメージングのために適しているであろうことを示している。
培養細胞株に見られるリポソームの貪食取り込みと一致し、かつ、時間にリップQリードの静脈注射蛍光消光により非常に低いバックグラウンド蛍光を有するマウスモデルにおける浮腫の蛍光強度の依存性増加( 図4A、 リップ-Q)。浮腫の最大蛍光強度は、リップ-Qの8-10時間後に注射を検出する。逆に、全体のマウスの比較的強いNIR蛍光は、フリーDY-676-COOH( 図4A、DY-676-COOH)またはリポソーム常時オン、リップ-DQ( 図4A、 リップ-DQの適用後に見られている)。浮腫の確実な検出が可能でないように、図4A、DY-676-COOH は、(0-4時間後に注射から分かるように、リップ-Q、高速の潅流および遊離DY-676-COOHのクリアランスに比べイメージングに干渉する)。さらに、非急冷リポソーム、リップ-DQは8時間までほぼ一定のまま2-4時間後に注入内の浮腫の最大蛍光を明らかにし、その後徐々に急冷リップ-Qベースの浮腫蛍光と同様に減少。半定量肛門の実行yses、関心領域(ROI)は、バックグラウンドに対する浮腫のために設定されていることによって、人は異なるプローブを用いた検出の異なるレベルについての結論を出すことができます。グループ(プローブ)あたり5匹の動物の半定量分析によると、浮腫は無料のDY-676-COOHまたは非急冷、リップ-DQ( 図よりもリップ-Qで検出した(P = 0.001)より大幅にすることができます図4(b))。
マウスのイメージングの臓器は、プローブの24時間後噴射を排除するための証拠となって肝臓/胆嚢、腎臓、非常に低いまたは脾臓の蛍光なし、肺と心臓( 図5)、軽度のex vivoでの蛍光を明らかに安楽死肝胆ルートを通じてプローブの。

図1:DY-676-COOH-ロードされたリポソームの調製sの近赤外色素DY-676-COOHを有するフィルムの水和及び押出の(AC)関連する合成工程の概略概観。(A)の設定。(B)間期を示す自作ゲル濾過セットアップの写真非封入(無料)染料およびリポソーム間。リポソームは、最初に溶出に起因カプセル化されたDY-676-COOH(青)に青緑色に表示され、組み込まれた緑のリン脂質、NBD-DOPE。(C)リポソーム-堆積物(リップ-Q)の代表画像超遠心分離によって濃縮した後。( D)リポソーム色素の定量化のために使用される10 mMトリスpHが7.4(1%トリトンX100を含む)。(E)リップ-Qのクライオ透過型電子顕微鏡写真でDY-676-COOHの代表的な検量線。 見るにはこちらをクリックしてください図の拡大版。
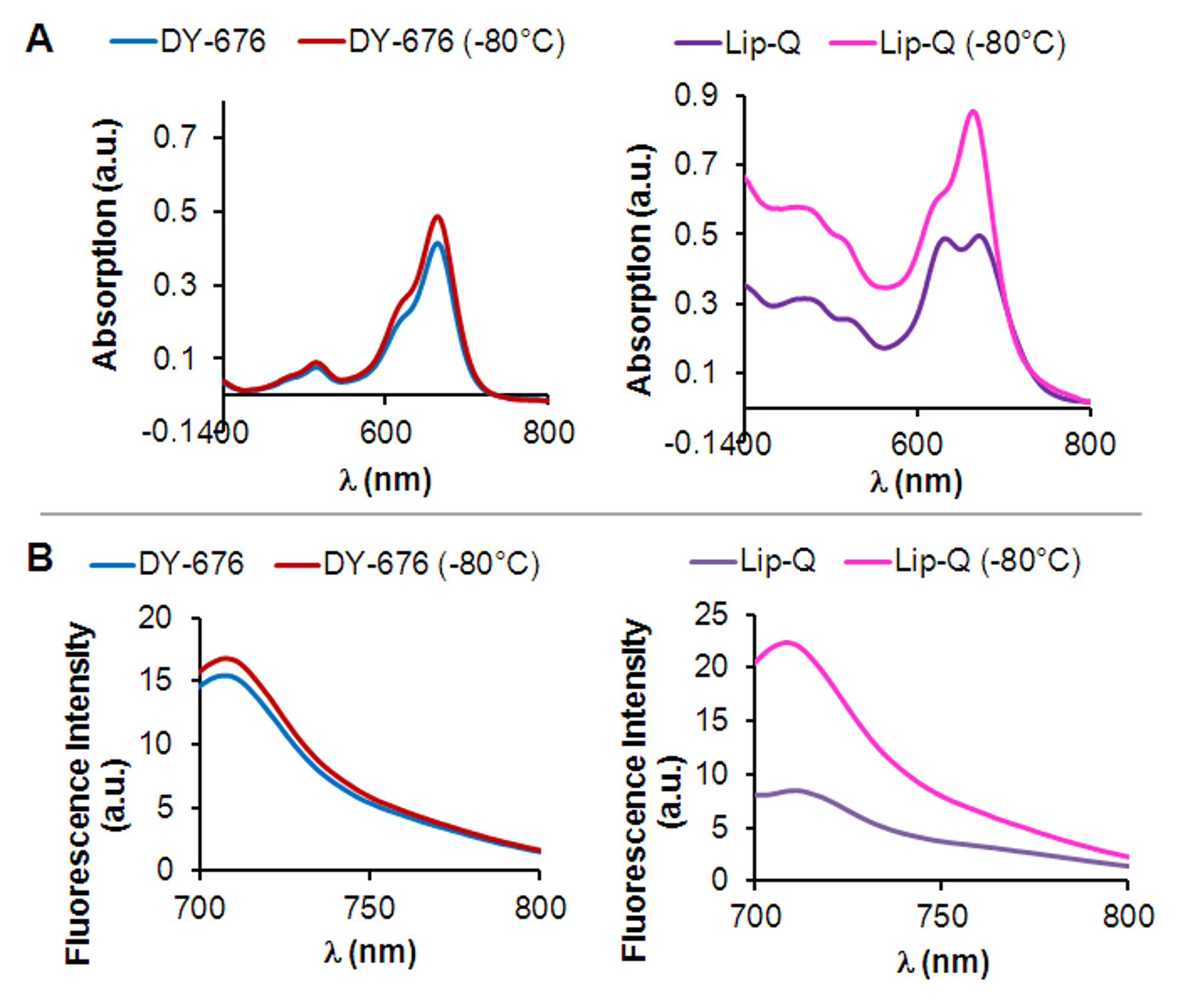
図2: インビトロでの蛍光消光及び活性化の物理化学的決定リップ-Qの(A)吸収スペクトル(右)と自由DY-676-COOH(左)の前またはで凍結した後、10mMトリス緩衝液(pH7.4)中で測定- 80°C。フリーDY-676-COOHとリップ-Qの凍結損傷後のブルーシフトピークの消失と比較して、リップ-Qの特徴的な二重ピークを注(B)(右)リップ-Qの蛍光発光スペクトルに対応しフリーDY-676-COOH(左)の前または-80℃で凍結した後、10mMトリス緩衝液(pH7.4)中で測定した。

図3:リップの細胞取り込みおよび蛍光活性化 osomes。の画像(A)は、示した温度で24時間、対応するプローブへの曝露後の細胞ペレットのNIR蛍光画像化によって調製した。 HT-1080細胞を4℃で24時間のインキュベーション期間を生存しなかった。 (B)において、棒グラフは、各バーは平均±SD、n = 3での実験の平均強度を示し、Aの細胞ペレットへのROIを割り当てることによって得た蛍光信号の半定量的レベルを表す。 (C)の画像を37°Cで24時間培養チャンバースライド上のプローブに曝露された細胞の共焦点レーザー走査顕微鏡により得られた。高い貪食マウスマクロファージ細胞株J774A.1と穏やかな貪食ヒト膠芽腫細胞株U-118MGの緩やかな蛍光の蛍光の高いレベルに注意してください。非食ヒト線維肉腫細胞株HT-1080は、プローブの蛍光を示さない。 NBD-DOPE:緑色蛍光リン脂質。ロード/ 52136 / 52136fig3highres.jpg「ターゲット= "_空白">図の拡大版をご覧になるにはこちらをクリックしてください。
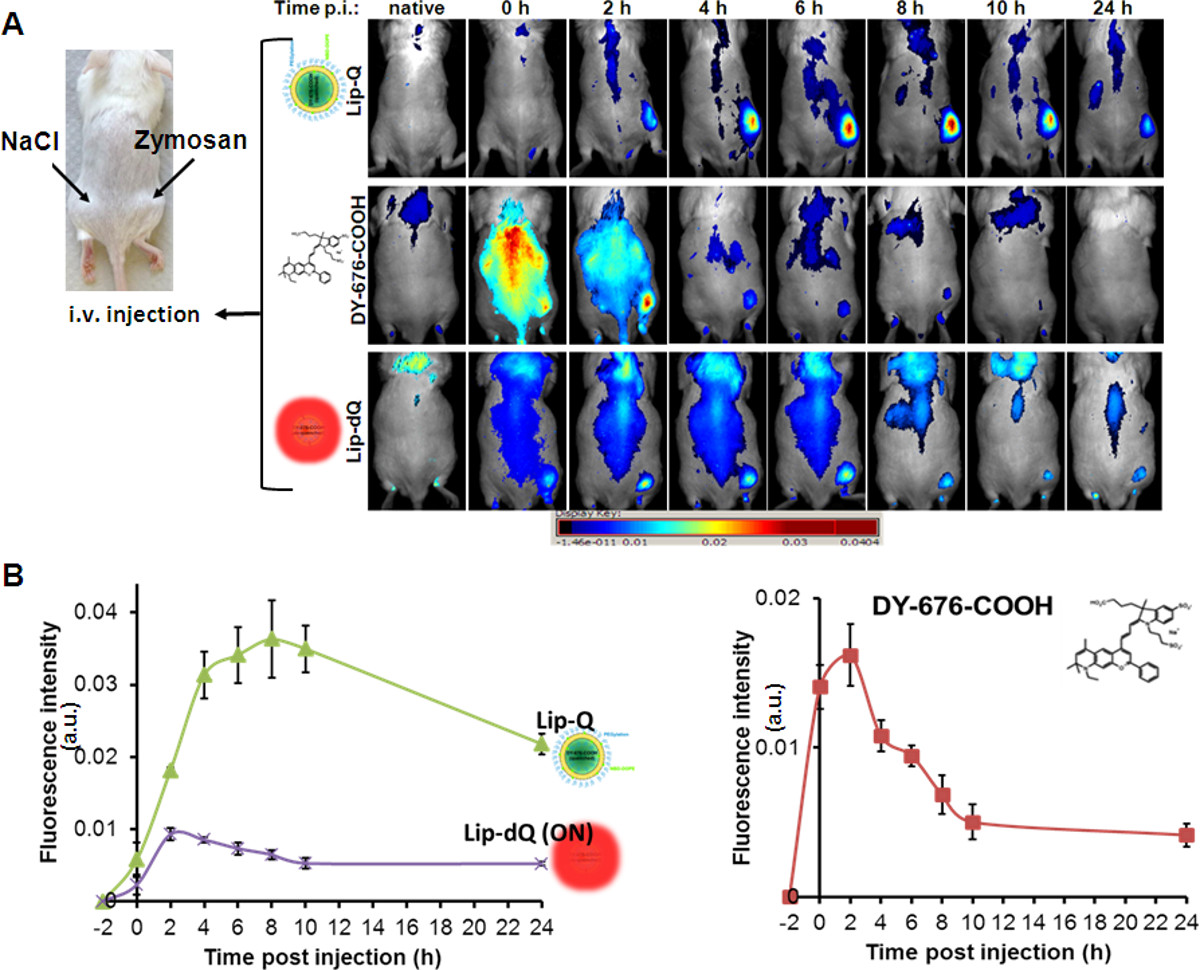
マウスにおけるザイモサン誘発性浮腫のインビボ光学イメージングにおいては 、図4(A)左のマウスの画像は皮下の位置は、ザイモサンA(50μlの生理食塩水中の500μg)および対照食塩水(50μl)を適用示す左脇腹に。示された時点で示されるプローブおよび全身NIR蛍光イメージングの静脈内注射は緩やか明らかにするが、8時間のポスト噴射での最大蛍光を有するリップ-Q(上パネル)の浮腫および低いバックグラウンドシグナルの蛍光シグナルの高い増加。遊離色素は、4時間のポスト噴射(中央のペイン内灌流および迅速なクリアランスを明らかにl)は、リップdQが低信号強度と全体的により高いバックグラウンド蛍光と浮腫の検出を明らかにする一方。 (B)中のグラフィカル表示は、nにおける制御領域(生理食塩水)=グループあたり5匹の動物と比較して、各プローブで検出浮腫の観察された蛍光シグナルを繰り返す。各プロットは、(5のn =)±SEMの平均蛍光シグナルを表す。グラフでは、各プローブで検出浮腫の最大蛍光シグナルが(;リップ-DQ 2-4時間と自由DY-676-COOH、2時間後に注射リップ-Q、8時間)を簡単に区別される。そこtにおけるリップのdQ対リップQ = 0〜24時間と浮腫の有意(P = 0.001)より高い蛍光強度であり、tにおける自由DY-676-COOH対リップQ = 4〜24時間である。 図の拡大版をご覧になるにはこちらをクリックしてください。

図5:マウスを24時間後にプローブアプリケーションからの臓器の生体光エキソビボ画像 、および器官の蛍光強度の半定量分析を対応する。各バーは(n = 4)の平均±SEM蛍光強度の平均を表す。 図の拡大版をご覧になるにはこちらをクリックしてください。
| リポソーム製剤 | サイズ[nm]の | 多分散性指数(PI) | ゼータ電位[MV] |
| リップ-DQ(脱消光) | 123.4±0.6 | 0.055±0.02 | -10.6±0.4 |
| リップ-Q(急冷) | 118.5±0.7 | 0.04±0.02 | -9±2 |
| リップ-NBD(W / O DY-676-COOH) | 123.0±1.4 | 0.04±0.03 | -11±1 |
表1:動的光散乱法によるリポソームの特徴付け。
ディスカッション
リポソームはまた、蛍光色素のための送達システムとして機能することができるので、それらは、標的疾患の画像化を可能にする。このようなここで使用NIRF染料、DY676-COOHのような蛍光色素、高濃度の封入は、封入された色素の蛍光消光の高いレベルをもたらす。蛍光消光、高濃度で、多くのフルオロフォアで見られる現象は、対象領域の高感度で信頼性の高い検出が要求されるインビボイメージング用途のいくつかで利用することができる。リポソームの使用はまた、in vivoでの適用のために不可欠である染料の保護を提供する。
膜水和及び押出技術は、必要に応じて、異なるサイズ範囲を有するリポソームの成功した製造を可能に広く用いられている方法であり、そのような異なる物質25の多数のカプセル化などの修飾を可能にする。従って、リップの調製に適しているosomes画像化目的のためにNIR蛍光色素DY-676-COOHでカプセル。この方法は、染料の急冷濃度の範囲内である600から840μM膀胱内色素濃度、を有するリポソームが得られます。自然発生的に形成された小胞分散物の均質化のために使用LiposoFastベーシックハンド押出機は1ml容量まで注射器によるデバイスの互換性のために、小さな実験室規模でのリポソーム製剤に適している。大規模調製のために時間あたり千Lの容量を持つ小胞分散液を均質化することができます大きな高圧ホモジナイザーの使用が推奨されます。ゲル濾過(サイズ排除)クロマトグラフィーは、非カプセル化された(フリー)色素分子26からカプセル化されたリポソームの色素の分離を確実にする重要なステップである。ゲルろ過カラムの長さは、遊離色素からのリポソームの効率的な分離のために不可欠です。したがって、少なくとも28センチの長さtの列を用意する必要があるO成功し、ここで使用されるフリーDY-676-COOHからリポソームを分離する。興味深いことに、この長さがあればそれは自由カルボからカルボキシフルオレセイン(CF)充填されたリポソームを精製するために使用されるように2倍である。ゲル濾過の主な欠点は、精製されたサンプルの五時五十五倍希釈である。高度に濃縮されたリポソームは、必要とされる場合、これは、超遠心分離によって補償することができる。超遠心分離の間、リポソームは沈降し、上清を容易に27を除去することができる。透析28によりリポソームを濃縮する他の方法は、超遠心分離法よりも時間がかかる。
膜水和及び押出法、逆相蒸発法23と同様にエタノール注入法24以外にも多くの親水性物質のための高いカプセル化効率を有するリポソーム製剤を可能にする。しかし、私たちの調査は、凍結融解サイクルと組み合わせたフィルムの水和を明らかにしたS DY-676-COOHの十分なリポソーム内のカプセル化に最も適した方法であると。フィルムの水和のために使用される出発DY-676-COOHの濃度を増加させると、有効性および30mMの固定の脂質濃度が使用されるリポソーム内の染料の濃度を増加させる。凍結融解方法でこのカプセル化の有効性にもかかわらず、使用される出発色素濃度の10%未満であるが、しかし、画像化に必要な消光濃度のカプセル化のために十分である。さらに、ゲル濾過によってリポソームから分離した遊離染料は、製造業者の使用説明書、再カプセル化を可能にし、全体的な最小の染料の損失に応じて脱塩し、脱水によってリサイクルすることができる。多分散性指数とリップ-Qの電子顕微鏡写真に見られるように、基礎となるプロトコルによって色素のカプセル化は、リポソームのサイズおよび形態に影響を及ぼさない。
いくつかの単純な方法はつの評価に使用することができる電子準備蛍光liposomes.DY-676-COOHの活性は、おそらくHダイマー形成と色素分子の間のπスタッキング相互作用に起因する高濃度21,29における自己クエンチする傾向が高い。高濃度の色素分子のフェルスター半径の近さに起因し発生するこれらの相互作用は、希釈30によって消滅させることができる。したがって、DY-676-COOHの高濃度のカプセル化は、それによって高濃度を維持し、ブルーシフト吸収として検出することができる蛍光消光を保持し、in vivoではなく、周囲のバッファからオプソニンから染料を保護しないピーク及び図2に示すように、低蛍光発光。-80℃で徐々にリポソームを凍結は軽率30℃で解凍するとき、リポソーム膜への損傷を引き起こす水性内部31内の氷結晶の形成をもたらす。リリース、希釈および蛍光ACTI凍結後のバッファ内のイントラリポソームDY-676-COOHのvation単一の吸収ピークで明らかにされ、リップ-Qは、このように高い、濃度消光を隔離することを示して蛍光強度のほぼ2.5倍の増加( 図2) DY-676-COOHとは、活性化可能である。どちらも多くの蛍光色素32のスペクトル特性に影響を与えるので、このような界面活性剤または有機溶媒の使用などのリポソーム脂質二重層を損傷する他の方法は、遊離色素およびリポソームカプセル化色素との間の明確な違いを明らかにしない。緩慢凍結ので、ここで報告された過酷な融解法は、リポソーム中の蛍光体の高いカプセル化とその結果としての蛍光消光を検証するためのより信頼性が高く、有望な方法として機能します。インタクトリップ-Q( 図2)の吸収スペクトルおよび発光スペクトルから、残留蛍光のある程度のレベルを検出することができる。これは、リポ内の非クエンチ色素モノマーから生じ得るサムスとも静電相互作用とリン脂質極性頭部基33によってカプセル化された染料の影響から。
図3に見られるように、高度に食作用マウスマクロファージおよび軽度貪食ヒト膠芽腫細胞株、U-118MG 34ではなく、非食作用性ヒト線維肉腫細胞株HT-1080におけるリップ-Qの別個の蓄積は、示してい食細胞は、炎症プロセスの重要なプレーヤーであるため、炎症のリップ-Q-ベースのイメージングは、有利になります。エネルギー枯渇がリップ-Qの取り込みを廃止、フリーDY-676-COOHの取り込みではないリップ-Qの貪食取り込みの特異性を実証し、リップ-Qは実験中の無傷のままでいることを明らかにしているという事実、染料の他のリリースとエネルギー非依存性の取り込みは、蛍光検出につながる場所を取る。緑色蛍光リン脂質を埋め込み、リポソーム二重層におけるNBD-DOPEは、顕微鏡イメージングとdiscriminatioを可能にnは32以前に報告されているように、時間依存取り込み実験が行われている場合は特に、携帯劣化したリポソームからの非分解の間。顕微鏡画像は、37℃でインキュベーションした後、半定量的分析によって決定されるように、細胞ペレットの蛍光強度のレベルと相関し、DY-676-COOHのNIR蛍光を明らかにする。ヒト膠芽はDY-676-COOHと前者よりNBD-DOPEの両方の低い蛍光を明らかにする一方、これに応じて、マウスのマクロファージ細胞株は、最も高い蛍光を示す。ヒト線維肉腫細胞株の予想されたように、HT-1080、リポソーム染料またはリップ-Q取り込み、食作用によって主にあるという事実を強化フリーDY-676-COOHのいずれかの蛍光を示さない。
リップ-Qベース貪食駆動の炎症のin vivoイメージングの可能性を調査するために、いくつかのコントロールを検討した。無料のDY-676-COOHがphagocytによって取り込まれ得ることを考慮すると、OSIS、リップ-Qのオプソニンは、食細胞に取り込まれる染料、の解放につながる可能性があります。これを回避するために、リップ-Qは、5モル%のPEG化を用いて調製した。また、炎症によるベースEPR効果と能動的取り込みおよび蛍光活性化に取り込みを区別する必要がある。これに対処するために、評価およびザイモサン誘導浮腫を有するマウス3つの異なるプローブ、すなわち常時オン、リップ-DQ、急冷リップ-Qおよび無料のDY-676-COOHの比較が必要であった。 サッカロマイセス·セレビシエおよびカンジダ·アルビカンスの細胞壁から調製されるザイモサン-Aは、デクチン1とToll様受容体2/6(TLR 2/6)を介してサイトカイン分泌の自然な興奮剤である。順番に分泌されたサイトカインは、それによって、脾臓、リザーバ35、ならびに好中球、および炎症部位 への移行から、単球/マクロファージの血管内/血管外遊出を容易にし、血管の漏れにつながる下流カスケードの活性化を誘導する(浮腫)36〜39。ザイモサンベースの単球/マクロファージの血管外漏出と移行プロセスがザイモサン炎症過程を36〜39を研究するための戦略的ツールになるだけ4.5-6時間を必要とします。による炎症の間に生じる血管漏出に、静脈内にプローブがその炎症部位 への遊走または浸出中に単球/マクロファージ(食細胞)によって取り込まれることができるいずれかおよび浮腫部位(EPR効果)に取り込まれることに注射40。非急冷リップ-DQの使用はリップ-Qより浮腫信号に全体的な強い背景、そして単球およびマクロファージの遊走を反映した浮腫の蛍光増加を明らかにしている。実際には、浮腫の最大蛍光は、既にリップ-DQの2-4時間後アプリケーションを見て8時間までほぼ一定のままである。リップ-DQとリップ-Qとは対照的に、無料のDY-676-COOHは、注射後の迅速な灌流を受け、浮腫の明瞭な画像化が不可能であるように、4時間以内にクリアされます。でterestingly、浮腫の蛍光強度の持続的な増加と非常に低いバックグラウンドシグナルのリップ-Q結果の使用。リップ-Qとの蛍光強度のこの持続的な増加は、リポソーム放出され、染料の活性化を蛍光に起因する。一緒になって、それがリップdQが4時間のポスト噴射での最大蛍光(EPR効果および単球遊走)を明らかにするので、リップ-QベースのイメージングにおけるEPR効果の寄与が最小であると結論付けることができる。このように、リポソームカプセル化は、保護と順番に排他的に食細胞による内在化および分解(蛍光活性化)した後、浮腫のin vivoイメージングで 、より信頼性を可能にDY-676-COOH、別個の配信を提供します。これまでのところ、蛍光リポソームの撮像特性を検証するためのザイモサン誘導後肢浮腫の使用が新しく追加されました。本明細書で報告プロトコルが異なる蛍光色素をカプセル化することによって、異なる阻害DRUの効果を撮像することにより、両方の拡張することができ炎症の誘発にGSので、生物医学イメージングに適したプローブの調製と特性評価のための便利なツールを表します。
適切なイメージングプローブの定義に向けたもう一つの重要なステップは、それらの薬理学的特性と除去ルートの検証です。これらのような器官から肝臓および腎臓、ならびにそれらの短い保持し、適切な脱離などの排泄に重要な役割を果たしている器官におけるプローブの分布は、プローブが非常に可能性が高い患者に悪影響を示さないことを、通常の指標である。これに応じて、マウスの器官はリップ-QまたはフリーDY-676-COOHの24時間のポスト噴射を通じてリポソームフォアの好ましい除去を意味肝臓/胆嚢、腎臓の軽度の蛍光を明らかにする調製肝胆ルート。これらの器官におけるプローブとその効率的な除去の短い施設は7-FOLによって実証されている臓器のDより高い蛍光シグナルはリップ-QまたはフリーDY-676-COOH 32の6時間後に注射を用意しました。これらの観察は、リポソーム41の除去によるものであるプローブを特徴付ける際に生体内分布研究を含むことの重要性をバックアップする。このような活性化42,43を補完し、皮膚の炎症などの有害な副作用は、臨床用途に使用されるリポソーム製剤のために報告されているが、このような効果は、基礎となるリポソームでは検出されなかった。また、プローブの注射後2週間の免疫欠損マウスの観察は(図示せず)マウス器官からのプローブのクリアランスを完了するために導いた。
開示事項
The authors have nothing to disclose.
謝辞
この作品は、ドイツ学術振興助成 HI-698 / 10-1とRU-1652 / 1-1によってサポートされていました。私たちは、彼らの親切なサポートのための優れた技術支援と会社DYOMICS社、イエナのためのドリーン·メイに感謝。
資料
| Name | Company | Catalog Number | Comments |
| Materials and equipments for preparation of liposomes | |||
| egg phospahtidylcholine | Avanti Polar Lipids | 840051P | Dissolve in chloroform and store in glass vials (214 mg/ml) |
| cholesterol | Sigma | C8667 | Dissolve in chloroform and store in glass vials (134 mg/ml) |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt) | Avanti Polar Lipids | 880120P | Dissolve in chloroform and store in glass vials (122 mg/ml) |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt) | Avanti Polar Lipids | 810145P | Dissolve in chloroform and store in glass vials (2 mg/ml) |
| Sartorius MC1 (d = 0.01 mg) | Sartorius AG | Research RC 210 P | used for weighing the phospholipids |
| Rotavapor | Büchi Labortechnik AG | R-114 | used for hydration of phospholipid film |
| Waterbath | Büchi Labortechnik AG | R-481 | used for hydration of phospholipid film |
| Vacuum Controller | Büchi Labortechnik AG | B-720 | used for hydration of phospholipid film |
| Vacobox | Büchi Labortechnik AG | B-177 | used for hydration of phospholipid film |
| Circulation Chiller | LAUDA DR. R. WOBSER GMBH & CO. KG | WKL 230 | used for hydration of phospholipid film |
| DY-676-COOH | Dyomics GmbH | 676-00 | Dissolve in 10 mM Tris and store stock at -20°C |
| Tris-(Hydroxymethyl)-aminomethan | Applichem | A1086 | buffer 10 mM, pH 7.4 |
| Trichlormethan | Carl Roth GmbH + Co. KG | Y015.2 | used for liposome preparation |
| Sonicator | Merck Eurolab GmbH | USR 170 H | used for liposome preparation |
| Vortex Genie 2 (Pop-off Cup, No. 146-3011-00) | Scientific Industries Inc. | SI-0256 | used for liposome preparation |
| Sephadex G25 medium | GE Healthcare Europe GmbH | 17-0033-01 | used for liposome purification |
| Triton X100 | Ferak Berlin GmbH | 505002 | used to destruct liposomes for dye quantification |
| LiposoFast-Basic | Avestin Inc. | used for the extrusion of liposomes | |
| Polycarbonate filter membrane, 100 nm (Whatman Nucleopore Trans Etch Membrane, NUCLEPR PC 19 MM, 0.1 U) | VWR | used for the extrusion of liposomes via LiposoFast-Basic | |
| Fluostar Optima | BMG Labtech | used for dye quantification | |
| Zetasizer Nano ZS | Malvern | used for the determination of liposome size and zetapotential | |
| Ultracentrifuge | Beckmann Coulter GmbH | XL 80 | used for concentration of the samples |
| Rotor | Beckmann Coulter GmbH | SW 55 TI | used for concentration of the samples |
| Materials and equipments for the evaluation of liposome and optical imaging | |||
| Zymosan-A from Saccharomyces cereviciae | Sigma | Z4250-250MG | used for induction of inflammation |
| Isotonic Saline (0.9%) | Fresenius GmbH | PZN-2159621 | used for the dilution of Zymosan-A |
| Isoflurane vaporizer | Ohmeda Isotec 4 | used for anesthesizing animals | |
| Isoflurane | Actavis GmbH | PZN-7253744 | anesthesia |
| Thermo Mat Pro 20 W | Lucky Reptile | 61202-HTP-20 | used to keep animals warm during anesthesia |
| Omnican-F (1 ml injection) | Braun | PZN-3115465 | used for subcutaneous and intravenous application of probes |
| Panthenol eye cream | Jenapharm | PZN-3524531 | used to prevent dryness of the eyes of animals during anesthesia |
| Hanks buffered saline solution | PAA Laboratories /Biochrom AG | L2045 | w/o Mg2+, Ca2+ and phenol red. For dilution of probes and for washing of cells |
| 8-Well chamber slides | BD Biosciences | 354108 | used for cell culture followed by microscopy |
| Cell culture flasks | Greiner BioOne | ||
| Cell culture media | Gibco (life technologies GmbH) | ||
| Fetal calf serum | Invitrogen | ||
| Poly-L-Lysine solution (0.01%, 50 ml) | Sigma | P4832 | used to coat cell culture chamber slides |
| Mountant Permafluor | ThermoScientific | S21022-3 | Mounting solution for microscopy |
| Hoechst-33258 | AppliChem | DNA stain for microscopy | |
| Hera-Safe | Heraeus Instruments | sterile work bench used for cell culture | |
| HERA cell | Heraeus Instruments | Incubator used for cell culture | |
| LSM510-Meta | Zeiss | used for confocal microscopy | |
| Maestro-TM in vivo fluorescence imaging system | CRi, Woburn | used for whole body fluorescence imaging of small animals | |
| Spectrophotometer (Ultrospec 4300 pro UV) | GE Healthcare | used for measurement of absorption | |
| Spectrofluorometer (Jasco FP-6200) | Jasco | used for measurement of fluorescence emission | |
| Animals | |||
| NMRI mice (8-12 weeks old, male) | Elevage Janvier, France | used for inflammation trials | |
参考文献
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers). Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Cabanes, A., et al. Enhancement of antitumor activity of polyethylene glycol-coated liposomal doxorubicin with soluble and liposomal interleukin 2. Clinical cancer research : an official journal of the American Association for Cancer Research. 5, 687-693 (1999).
- Gabizon, A., Shmeeda, H., Grenader, T. Pharmacological basis of pegylated liposomal doxorubicin: impact on cancer therapy. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 45, 388-398 (2012).
- Balasubramanian, S. V., Bruenn, J., Straubinger, R. M. Liposomes as formulation excipients for protein pharmaceuticals: a model protein study. Pharmaceutical research. 17, 344-350 (2000).
- Meyer, J., Whitcomb, L., Collins, D. Efficient encapsulation of proteins within liposomes for slow release in vivo. Biochemical and biophysical research communications. 199, 433-438 (1994).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochimica et biophysica acta. 858, 161-168 (1986).
- Mayer, L. D., Bally, M. B., Hope, M. J., Cullis, P. R. Techniques for encapsulating bioactive agents into liposomes. Chemistry and physics of lipids. 40, 333-345 (1986).
- Walde, P., Ichikawa, S. Enzymes inside lipid vesicles: preparation, reactivity and applications. Biomolecular engineering. 18, 143-177 (2001).
- Weissleder, R., Ntziachristos, V. Shedding light onto live molecular targets. Nature medicine. 9, 123-128 (2003).
- Licha, K., Riefke, B., Ebert, B., Grotzinger, C. Cyanine dyes as contrast agents in biomedical optical imaging. Academic radiology. 9 Suppl 2, S320-S322 (2002).
- Pauli, J., et al. Novel fluorophores as building blocks for optical probes for in vivo near infrared fluorescence (NIRF) imaging. Journal of fluorescence. 20, 681-693 (2010).
- Holzer, W., et al. Photostability and thermal stability of indocyanine green. Journal of photochemistry and photobiology. B, Biology. 47, 155-164 (1998).
- Gandorfer, A., Haritoglou, C., Kampik, A. Retinal damage from indocyanine green in experimental macular surgery. Investigative ophthalmology & visual science. 44, 316-323 (2003).
- Saxena, V., Sadoqi, M., Shao, J. Degradation kinetics of indocyanine green in aqueous solution. Journal of pharmaceutical. 92, 2090-2097 (2003).
- Kodjikian, L., et al. Toxic effects of indocyanine green, infracyanine green, and trypan blue on the human retinal pigmented epithelium. Graefe's archive for clinical and experimental ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle Ophthalmologie. 243, 917-925 (2005).
- Sevick-Muraca, E. M., Houston, J. P., Gurfinkel, M. Fluorescence-enhanced, near infrared diagnostic imaging with contrast agents. Current opinion in chemical biology. 6, 642-650 (2002).
- Bremer, C., Ntziachristos, V., Weissleder, R. Optical-based molecular imaging: contrast agents and potential medical applications. European radiology. 13, 231-243 (2003).
- Hilderbrand, S. A., Kelly, K. A., Weissleder, R., Tung, C. H. Monofunctional near-infrared fluorochromes for imaging applications. Bioconjugate chemistry. 16, 1275-1281 (2005).
- Langhals, H., et al. Cyanine dyes as optical contrast agents for ophthalmological surgery. Journal of medicinal chemistry. 54, 3903-3925 (2011).
- Pauli, J., et al. An in vitro characterization study of new near infrared dyes for molecular imaging. European journal of medicinal chemistry. 44, 3496-3503 (2009).
- Ogawa, M., Kosaka, N., Choyke, P. L., Kobayashi, H. H-type dimer formation of fluorophores: a mechanism for activatable, in vivo optical molecular imaging. ACS chemical biology. 4, 535-546 (2009).
- Szoka, F., Papahadjopoulos, D. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation. Proc.Natl.Acad.Sci.U.S.A. 75, 4194-4198 (1978).
- Batzri, S., Korn, E. D. Single bilayer liposomes prepared without sonication. Biochimica et biophysica acta. 298, 1015-1019 (1973).
- Fahr, A., van Hoogevest, P., May, S., Bergstrand, N., ML, S. L. Transfer of lipophilic drugs between liposomal membranes and biological interfaces: consequences for drug delivery. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 26, 251-265 (2005).
- New, R. R. C. Liposomes a practical approach. , IRL Press at Oxford University Press. (1990).
- Barenholz, Y., et al. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16, 2806-2810 (1977).
- Schwendener, R. A. The preparation of large volumes of homogeneous, sterile liposomes containing various lipophilic cytostatic drugs by the use of a capillary dialyzer. Cancer drug delivery. 3, 123-129 (1986).
- Pauli, J., et al. Suitable labels for molecular imaging--influence of dye structure and hydrophilicity on the spectroscopic properties of IgG conjugates. Bioconjugate chemistry. 22, 1298-1308 (2011).
- Wu, P., Brand, L. Resonance energy transfer: methods and applications. Analytical biochemistry. 218, 1-13 (1994).
- Stark, B., Pabst, G., Prassl, R. Long-term stability of sterically stabilized liposomes by freezing and freeze-drying: Effects of cryoprotectants on structure. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 41, 546-555 (2010).
- Tansi, F. L., et al. Liposomal encapsulation of a near-infrared fluorophore enhances fluorescence quenching and reliable whole body optical imaging upon activation in vivo. Small. 9, 3659-3669 (2013).
- Chen, R. F., Knutson, J. R. Mechanism of fluorescence concentration quenching of carboxyfluorescein in liposomes: energy transfer to nonfluorescent dimers. Analytical biochemistry. 172, 61-77 (1988).
- Windler-Hart, S. L., Chen, K. Y., Chenn, A. A cell behavior screen: identification, sorting, and enrichment of cells based on motility. BMC cell biology. 6, 14(2005).
- Swirski, F. K., et al. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
- Erdo, F., Torok, K., Aranyi, P., Szekely, J. I. A new assay for antiphlogistic activity: zymosan-induced mouse ear inflammation. Agents and actions. 39, 137-142 (1993).
- Ajuebor, M. N., et al. Endogenous monocyte chemoattractant protein-1 recruits monocytes in the zymosan peritonitis model. Journal of leukocyte biology. 63, 108-116 (1998).
- Ajuebor, M. N., Das, A. M., Virag, L., Szabo, C., Perretti, M. Regulation of macrophage inflammatory protein-1 alpha expression and function by endogenous interleukin-10 in a model of acute inflammation. Biochemical and biophysical research communications. 255, 279-282 (1999).
- Ajuebor, M. N., et al. Role of resident peritoneal macrophages and mast cells in chemokine production and neutrophil migration in acute inflammation: evidence for an inhibitory loop involving endogenous IL-10. J Immunol. 162, 1685-1691 (1999).
- Binstadt, B. A., et al. Particularities of the vasculature can promote the organ specificity of autoimmune attack. Nature. 7, 284-292 (2006).
- Ishida, T., Harashima, H., Kiwada, H. Liposome clearance. Bioscience reports. 22, 197-224 (2002).
- Dobrovolskaia, M. A., McNeil, S. E. Understanding the correlation between in vitro and in vivo immunotoxicity tests for nanomedicines. Journal of controlled release : official journal of the Controlled Release Society. 172, 456-466 (2013).
- Szebeni, J., et al. Prevention of infusion reactions to PEGylated liposomal doxorubicin via tachyphylaxis induction by placebo vesicles: a porcine model. Journal of controlled release : official journal of the Controlled Release Society. 160, 382-387 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved