Method Article
Fluorescenza tempra di un vicino infrarosso Fluoroforo incapsulata all'interno di liposomi come strumento per
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
The use of fluorophores for in vivo imaging can be greatly limited by opsonization, rapid clearance, low detection sensitivity and cytotoxic effects on the host. Encapsulation of fluorophores in liposomes by film hydration and extrusion leads to fluorescence quenching and protection which enables in vivo imaging with high detection sensitivity.
Abstract
Optical imaging offers a wide range of diagnostic modalities and has attracted a lot of interest as a tool for biomedical imaging. Despite the enormous number of imaging techniques currently available and the progress in instrumentation, there is still a need for highly sensitive probes that are suitable for in vivo imaging. One typical problem of available preclinical fluorescent probes is their rapid clearance in vivo, which reduces their imaging sensitivity. To circumvent rapid clearance, increase number of dye molecules at the target site, and thereby reduce background autofluorescence, encapsulation of the near-infrared fluorescent dye, DY-676-COOH in liposomes and verification of its potential for in vivo imaging of inflammation was done. DY-676 is known for its ability to self-quench at high concentrations. We first determined the concentration suitable for self-quenching, and then encapsulated this quenching concentration into the aqueous interior of PEGylated liposomes. To substantiate the quenching and activation potential of the liposomes we use a harsh freezing method which leads to damage of liposomal membranes without affecting the encapsulated dye. The liposomes characterized by a high level of fluorescence quenching were termed Lip-Q. We show by experiments with different cell lines that uptake of Lip-Q is predominantly by phagocytosis which in turn enabled the characterization of its potential as a tool for in vivo imaging of inflammation in mice models. Furthermore, we use a zymosan-induced edema model in mice to substantiate the potential of Lip-Q in optical imaging of inflammation in vivo. Considering possible uptake due to inflammation-induced enhanced permeability and retention (EPR) effect, an always-on liposome formulation with low, non-quenched concentration of DY-676-COOH (termed Lip-dQ) and the free DY-676-COOH were compared with Lip-Q in animal trials.
Introduzione
I liposomi sono stati intensamente studiato e servire come uno dei sistemi di rilascio di farmaci biomedici più biocompatibili per applicazioni cliniche 1,2. Essi sono composti principalmente di fosfolipidi e colesterolo, che sono entrambi composti biocompatibili mimano parti di membrane cellulari naturali. Considerando sostanze idrofile possono essere intrappolati all'interno acquosa, agenti lipofili possono essere incorporati all'interno liposomiale doppio strato fosfolipidico 3. Incapsulamento di sostanze entro l'interno acquosa di liposomi garantisce la protezione contro la degradazione in vivo e impedisce anche il sistema host da effetti tossici di farmaci citotossici utilizzati per la terapia di malattie, per esempio chemioterapici volti a distruggere le cellule tumorali. La modifica della superficie liposomiale con polimeri come polietilenglicole (PEGylation) si estende ulteriormente il tempo di circolazione sanguigna liposomiale in vivo a causa di stabilizzazione sterica 4. Moreover, liposomi possono sequestrare elevate concentrazioni di varie sostanze quali proteine, sostanze idrofile 5,6 7,8 e 9 enzimi. Servono pertanto strumenti terapeutici e diagnostici clinici affidabili che meritano la loro approvazione per la consegna di farmaci citotossici, come doxorubicina per la terapia del cancro 4. Grazie alla loro flessibilità, liposomi possono essere caricati con fluorocromi per uso chirurgico di diagnostica e di immagine-guidata.
Imaging di fluorescenza prevede un costo-efficace e non invasivo in strumento diagnostico vivo che però, richiede alcuni requisiti di base. Si potrebbe dimostrare che fluorocromi che si adattano meglio per l'imaging in vivo hanno assorbimento caratteristico e massimi delle emissioni nel range in cui dispersione della luce e dispersione, nonché autofluorescenza dei tessuti d'origine da acqua ed emoglobina è bassa. Pertanto, tali sonde hanno il loro massimi abs / em tra 650 e 900 nm 10. Oltre a questo, la stabilità di fluorocromi sia in vitro che in vivo è critica, come opsonizzazione e rapida clearance possono limitare notevolmente la loro applicazione per imaging in vivo 11. Altri effetti quali la scarsa stabilità e bassa sensibilità o effetti citotossici sugli organi bersaglio come si è visto con verde di indocianina (ICG) 12-16, sono indesiderati e devono essere presi in considerazione quando si progetta le sonde per l'imaging in vivo. Queste osservazioni hanno portato allo sviluppo attivo di diversi fluorocromi NIR preclinici, nanoparticelle nonché nuove tecniche di imaging in vivo di processi infiammatori, cancro e per immagine guidata chirurgia 17-20. Nonostante la stabilità di più (fluorescenza vicino infrarosso) NIRF preclinico coloranti in vitro, la perfusione rapida e passaggio attraverso il fegato ei reni impediscono il loro uso in imaging ottico in vivo di malattie e processi infiammatori.
S copi "> Abbiamo quindi presentiamo un protocollo per l'incapsulamento di fluorocromi come il ben caratterizzato vicino infrarosso colorante fluorescente DY-676-COOH, noto per la sua tendenza ad auto-estinzione alle concentrazioni relativamente elevate di 21 in liposomi. Ad alte concentrazioni H- formazione di dimero e / o-pi stacking interazioni tra molecole fluoroforo situate all'interno di ciascun altro risultato raggio Förster in Förster trasferimento di energia di risonanza (FRET) tra le molecole fluorocromi. In bassa concentrazione lo spazio tra le molecole fluoroforo aumenta, impedendo in tal modo l'interazione-pi impilamento e H-dimero formazione e la conseguente elevata emissione di fluorescenza. La commutazione tra alta e bassa concentrazione e l'accompagnamento della fluorescenza e l'attivazione è una strategia promettente che può essere sfruttata per l'imaging ottico 22. A questo proposito, incapsulamento di alte concentrazioni di colorante NIRF DY-676-COOH all'interno acquosa di liposomi è più favorable per l'imaging in vivo che il colorante libera. La sfida del metodo consiste innanzitutto nel incapsulamento corretta e in secondo luogo, la validazione dei benefici derivanti da incapsulare alte concentrazioni di colorante. Confrontando le proprietà di imaging di liposomi bonifica con quello del colorante libero ed anche con una formulazione non quenched liposomi con basse concentrazioni di colorante è indispensabile. Mostriamo da un protocollo pellicola idratazione ed estrusione semplice, ma molto efficace in combinazione con gelo e disgelo alternative che l'incapsulamento delle concentrazioni tempra di DY-676-COOH in liposomi è fattibile. Altri metodi utilizzati per preparare liposomi come il metodo di evaporazione a fase inversa 23 nonché il metodo di iniezione di etanolo 24 consentono la preparazione di liposomi con alte efficienze di incapsulamento per molte sostanze idrofile. Tuttavia, la natura della sostanza da incapsulare può influenzare l'efficienza di incapsulamento. In effetti,il protocollo pellicola idratazione ed estrusione presentato qui ha rivelato la più alta efficienza per l'incapsulamento di DY-676-COOH. Per illustrare i vantaggi di incapsulamento liposomiale di DY-676-COOH, un modello edema zymosan indotta, che consente lo studio dei processi infiammatori in poche ore, è stato utilizzato. Qui, è dimostrato che liposomi con alte concentrazioni della incapsulato DY-676-COOH sono più adatti per tutto il corpo in imaging ottico vivo di processi infiammatori rispetto colorante libero o la formulazione liposomiale non quenched con concentrazioni basse colorante. Così il protocollo sottostante fornisce un metodo semplice e veloce per produrre liposomi fluorescenti bonifica e la validazione della loro attivazione e di imaging potenziale sia in vitro che in vivo.Protocollo
NOTA: Tutte le procedure sono approvate dal Comitato regionale animali e in conformità con le linee guida internazionali sull'uso etico degli animali.
1. Preparazione dei Materiali e strumenti
- Preparazione della dispersione delle vescicole spontaneamente formate (SFV)
- Sciogliere e preparare le soluzioni madre delle seguenti fosfolipidi: 214 mg / ml fosfatidilcolina d'uovo (EPC), 134 mg / ml di colesterolo, 122 mg / ml 1,2-distearoyl- sn -glycero-3-phosphoethanolamine- N - [metossi (polietilene glicole) -2000] (sale di ammonio) (mPEG 2000 -DSPE) e 2 mg / ml di 1,2-dioleoyl- sn -glycero-3-phosphoethanolamine- N - (7-nitro-2-1,3-benzoxadiazol-4 -yl) (sale di ammonio) (NBD-DOPE) in cloroformio e conservare in fiale di vetro.
- Furnish circa 3 ml di cloroformio in un pallone a fondo rotondo e trasferire il volume appropriato di fosfolipidi magazzino soluzione nel pallone a fondo tondo di preparare liposomi composti da EPC: Chol: mPEG 2000 -DSPE ad un rapporto molare di 6,5: 3: 0.5. Per l'etichettatura doppia fluorescenza di liposomi aggiungere 0,3 mol% NBD-DOPE alla soluzione lipidica.
- Si evapora il cloroformio dalla soluzione fosfolipide organica a pressione ridotta (300 mbar) a 55 ° C utilizzando un evaporatore rotante.
- Dopo si forma una pellicola fosfolipide omogenea, ridurre la pressione a 10 mbar per 1-2 ore per rimuovere depositi cloroformio residuo.
- Mentre il cloroformio evapora, sciogliere DY-676-COOH (6,181 mM) in Tris 10 mM pH 7,4 e riempire un contenitore Dewar con azoto liquido. Accendere un bagno ad ultrasuoni e impostare a 50 ° C.
- Trasferire un volume adeguato (0,5-1 ml) di DY-676-COOH (6,181 micron) soluzione del pallone a fondo tondo per idratare la pellicola fosfolipide asciutto e vortice vigorosamente fino a vescicole spontaneamente formate (SFV) forme di dispersione. Assicurarsi che tutti i fosfolipidi sono dispersi per evitare la perdita dei lipidi.
- Tra attenzionensfer il pallone a fondo rotondo contenente la dispersione SFV in azoto liquido e congelare la dispersione per 3-5 min. Posizionare il pallone a fondo tondo in un bagno ad ultrasuoni a 50 ° C per scongelare la dispersione quindi agitare la dispersione vigorosamente per 1-2 min. Ripetere questa procedura sei volte, per un totale di sette cicli di gelo e disgelo.
- Estrusione di SFV per formare vescicole di liposoma omogenei
- Trasferire la dispersione SFV in una siringa da 1 ml (siringa a) e estrudere la dispersione attraverso una membrana di policarbonato 100 nm con un estrusore LiposoFast-Basic nella siringa-b.
- Estrudere la dispersione dalla siringa-b, di nuovo in una siringa, quindi ripetere il ciclo di dieci volte. A causa di estrusione, la soluzione nei cambiamenti siringa da un aspetto opalescente a una dispersione chiara con il tempo. Dopo dieci cicli (venti singoli gradini estrusione) rimuovere la siringa-b dal dispositivo e estrudere la dispersione per l'ultima volta da una siringa direttamente in un sterile1,5 ml tubo di reazione.
- Purificazione di liposomiale incapsulato DY-676-COOH dal colorante libero
- Preparare una colonna cromatografica di gel utilizzando G25 perline imbevuti di 10 Tris mM tampone pH 7.4 (colonna lunghezza 28 cm, diametro 0,8 centimetri).
- Trasferire 0,5 ml di estrusi di dispersione delle vescicole sul letto di gel e lasciare che la fuga del campione nella matrice gel.
- Eluire liposomi con Tris 10 mM pH 7,4 (Figura 1A) e lavare la colonna fino scarichi colorante libero completamente dalla colonna. Se necessario, raccogliere e riciclare il colorante libero da dissalazione e disidratazione secondo le istruzioni del produttore.
- Concentrare liposomi eluiti mediante ultracentrifugazione (200.000 xg, 2 ore a 8 ° C) poi disperdono in adeguato volume di 10 mM Tris sterile tampone di pH, 7,4.
- Quantificazione dei incapsulato concentrazione DY-676-COOH
- Preparare una curva di calibrazione sciogliendo DY-676-COOH (0, 82, 124,247, 494, 988 nM) in tampone Tris 10 mM, pH 7,4 contenente 0,1% Triton X100.
- Sciogliere 2 microlitri (100 nmol finale lipidi del 50 mmol / L stock) dei liposomi per 5 minuti a temperatura ambiente in 100 microlitri tampone Tris contenente 1% Triton X100 per distruggere le vescicole e rilasciare il colorante incapsulato. Poi diluire campioni con tampone Tris 10 mM, pH 7,4 ad una concentrazione finale Triton-X100 del 0,1% (v / v) fare un volume totale di 1 ml. Preparare tutti i campioni in duplicato.
- Misurare l'assorbimento e l'emissione di tutti i campioni (gratuito DY-676-COOH e Triton-X100 trattati liposomi) ad una eccitazione λ = 645 nm e un'emissione λ = 700 nm. Stabilire e utilizzare una curva di taratura del colorante libero per determinare la concentrazione di colorante incapsulato.
- Caratterizzazione Liposome
- Determinare la dimensione e zeta potenziale di liposomi di dispersione della luce dinamica. Diluire i campioni liposomiali con filtro sterilizzato (0,2 micron) Tris 10 mM a pH 7,4 per aconcentration di 100-300 micron (lipidi). Trasferire i campioni diluiti in un volume basso cuvetta monouso e misurare il campione in base alle istruzioni del produttore.
- Caratterizzare i liposomi mediante microscopia elettronica a sostegno delle dimensioni, l'integrità e l'omogeneità delle vescicole liposomiali secondo protocolli standard.
2. Convalida della fluorescenza tempra e attivazione di liposomi preparati
- Analisi fisico-chimiche di fluorescenza tempra e l'attivazione
- Preparare due da 1,5 ml tubi per il Lip-Q e 2 tubi per la libera DY-676-COOH. Trasferire 100 nmol lipidi totali (2.38 microlitri di una / L Lip-Q soluzione stock 42 mmol, contenenti 138 mg / ml di incapsulato DY-676-COOH) nelle provette corrispondenti. Trasferimento libero DY-676-COOH equivalente al contenuto di colorante di Lip-Q (0.38 mg che risulta ad esempio da 138 mg / ml 1,000 x 2,38 microlitri Lip-Q utilizzato). Incubare una vascae di ogni sonda a 4 ° C e congelare il secondo tubo a -80 ° C per una notte (16 ore).
- Riscaldare un blocco riscaldante a 30 ° C. Riempire una scatola di raffreddamento con ghiaccio tritato e equilibrare una aliquota di 10 mM Tris pH 7,4 tampone a temperatura ambiente.
- Rimuovere le sonde da 4 ° C ed equilibrare a temperatura ambiente (avvolti in carta stagnola per proteggere dalla luce) e rapidamente scongelare sonde da -80 ° C a 30 ° C per 5 min. Raffreddare le sonde scongelati in ghiaccio per 1 minuto prima di trasferirli a temperatura ambiente (anche avvolti in carta stagnola per proteggere dalla luce).
- Aggiungere 10 mM tampone Tris (pH 7,4) per ciascuna delle sonde al volume finale di 100 microlitri ed equilibrare tutte le sonde a RT per 10 min.
- Pipettare 80 ml di ciascuna sonda in un bicchiere provetta basso volume e misurare l'assorbimento di ogni sonda 400-900 nm su uno spettrometro. Ritorna la sonda di loro tubi corrispondenti.
- Trasferire 80 ml di ciascuna sonda nella cuvetta bicchiere adattoe misurare l'emissione di fluorescenza su un spettrofluorimetro eccitando le sonde a 674 nm e misurando la fluorescenza 694-800 nm.
- Assorbimento cellulare e l'attivazione di fluorescenza
- Prendi e cultura le seguenti linee cellulari in loro terreni di coltura corrispondente in base alle condizioni standard (37 ° C, 5% di CO 2 e il 95% atmosfera umidificata). Qui, usare la linea cellulare murina J774A.1 macrofagi (Dulbecco modificati su terreno di Eagle integrato con 10% (v / v) di siero fetale di vitello), la linea cellulare glioblastoma umano, U-118mg (MEM contenente vitamine essenziali e 10% (v / v) di siero fetale di vitello) e la linea cellulare fibrosarcoma umano, HT-1080 (RPMI con FCS 5%).
- Cappotto 8-ben diapositive camera con poli-L-lisina (aggiungere 100 ml 0,001% poli-L-lisina in ciascun pozzetto e incubare a 37 ° C per 10 min. Soluzione Aspirare e lasciare che i vetrini camera ad asciugare per almeno 4 ore a RT su un banco di lavoro sterile. Sciacquare i vetrini camera 3volte con soluzione salina tamponata 200 microlitri di Hank poi sigillare con paraffina e un foglio di alluminio e conservare a 4 ° C fino al necessario.
- Mentre le diapositive da camera si stanno prosciugando, filtro sterilizzare i liposomi e soluzione colorante e conservare a 4 ° C fino al necessario.
- Per l'analisi della sonda assorbimento con tutto il corpo in vivo sistema di imaging di fluorescenza NIR, preparare 5 piccole fiasche di coltura per ciascuna delle linee cellulari 3 di prova (15 boccette in totale). Seed 2 x 10 6 J774A.1, U-118mg e cellule HT-1080 per pallone di coltura con 5 ml del rispettivo mezzo di coltura (in quintuplica) e crescere per 16-24 ore. Parallelamente alla cultura palloni, sementi 30.000 cellule di ciascuna linea cellulare (J774A.1 e HT-1080) o 20.000 celle (U-118mg) per 2 pozzi della slitta da camera rispettivamente e crescere in 500 microlitri terreno di coltura per 16-24 ore .
- Il giorno successivo, aggiungere 100 nmol (importo lipidi finale) di Lip-Q per 2 palloni per linea cellulare e ad un pozzo di ciascuna linea cellulare sul vetrino della camera.Immediatamente trasferire 1 pallone per linea cellulare a 4 ° C e il secondo pallone indietro al incubatore.
NOTA: Il volume delle sonde aggiunto nei flaconi e le diapositive camera sono gli stessi, rendendo la concentrazione su vetrini camera 10 volte superiore (5 ml è di 500 microlitri terreno di coltura). Questo è necessario perché la rilevazione microscopica è meno sensibile rispetto al sistema di imaging di fluorescenza NIR dove vengono esposte pellet cellulari dai fiaschi. - Aggiungere libera DY-676-COOH in concentrazione pari al contenuto di colorante di Lip-Q alle cellule in 2 palloni per linea cellulare e ad un pozzetto di ciascuna linea cellulare sul vetrino camera, poi trasferire immediatamente 1 pallone per linea cellulare a 4 ° C (svuotamento di energia) e l'altra beuta con la slitta camera posteriore al incubatore. Incubare tutte le cellule per 24 ore nelle condizioni corrispondenti. Le cellule nel pallone senza sonde servono come controllo non trattato.
- NIRF imaging e di analisi semi-quantitativa
- Dopo 24 ore la durata dell'incubazione, raccogliere le cellule in fiaschi lavando cellule 2 volte con Hanks tamponata soluzione salina (HBSS) poi raschiare le cellule in 500 microlitri HBSS e pellet per centrifugazione (5 min a 200 xg) in tubi microlitri 500.
- Posizionare i tubi con il pellet di cellule (e HBSS) in un imager NIRF e immagini utilizzando filtri di eccitazione (615-665 nm) e l'emissione (taglio> 700 nm).
- Sottrarre autofluorescenza e valutare l'intensità del target rispetto autofluorescenza secondo le istruzioni del produttore. Questo darà i livelli semi-quantitativi della intensità di fluorescenza come segnale medio (conteggi scalati / sec), che rappresenta i livelli di conteggio dopo la scalatura per tempo di esposizione, guadagno della telecamera, binning e profondità di bit, in modo che le misurazioni sono confrontabili tra loro.
- Analisi microscopica confocale
- Dopo 24 ore di incubazione, raccogliere le cellule su vetrini da camera lavando 2 volte con 500 microlitri HBSS.
- Fissare il cells con 200 microlitri HBSS contenente 3,7% (v / v) di formaldeide per 30 minuti a RT.
- Mentre è in corso di fissazione, diluire la macchia DNA, Hoechst-33258 1:50 con soluzione di montaggio.
- Dopo la fissazione, lavare le cellule due volte con HBSS quindi separare le camere dai vetrini. Aggiungere soluzione di montaggio 50 ml contenente il DNA-macchia su ogni posto corrispondente ai pozzi delle diapositive da camera. Coprire le cellule con vetrino, sigillare i bordi con smalto trasparente e asciugare per 10 minuti a RT (scuro).
- Celle di immagine su un microscopio a fluorescenza adatto o microscopio confocale. Utilizzare le seguenti impostazioni di eccitazione e di emissione per la visualizzazione dei componenti corrispondenti: nuclei (Hoechst-33258: eccitazione 405 nm, emissione 420-480 nm). NBD-DOPE (liposomiale lipidico: eccitazione 488 nm, emissione 530 nm). DY-676-COOH (colorante fluorescente NIR: eccitazione 633-645 nm, emissione 650-700 nm).
NOTA: Assicurarsi che la fluorescenza del microscopio available è dotato di filtri idonei che consentono di eccitazione ed emissione di lunghezze d'onda superiore a 630 nm.
3. liposomi a base di In Vivo imaging di fluorescenza di infiammazione
- Preparazione degli animali e materiali
- Casa 8-12 week-old topi NMRI maschi di peso di circa 36 g in condizioni standard con cibo e acqua ad libitum.
- Sette giorni prima dell'inizio della sperimentazione, invia tutti i topi una dieta povera pheophorbide per ridurre autofluorescenza tessuti.
- Ventiquattro ore prima dell'inizio di ogni esperimento, radere topi nella zona desiderata (ad esempio, l'intera area del lotto se si desidera l'imaging di edema hind gamba).
- Pesare gli animali e calcolare la quantità di sonde da iniettare per mouse (Lip-Q e Lip-DQ a 10 micromol (concentrazione di lipidi) per kg di peso e senza DY-676-COOH (equivalente a tingere contenuto di Lip-Q utilizzata) .
- Immagine gli animali inun corpo intero NIR Fluorescenza imager con le stesse impostazioni utilizzate per i pellet cellulari. Questa misurazione fornisce autofluorescenza degli animali.
- Disciogliere 10 mg zymosan-A in 1 ml di soluzione salina isotonica e memorizzare una notte a 4 ° C.
- Induzione di infiammazione e in vivo NIRF immagini
- Preparare 3 siringhe per topo contenenti le seguenti soluzioni. Riempire una siringa con 50 microlitri zymosan-Una soluzione (10 mg / ml) e la seconda siringa con 50 microlitri di soluzione salina isotonica. Riempire la terza siringa con le sonde, per cui Lip-Q e Lip-DQ (10 mmol / kg di peso (lipidi)) sono designati per gli animali di prova e la connessione DY-676-COOH (concentrazione in Lip-Q) per gli animali di controllo. Assicurarsi che le sonde sono diluiti con sterili HBSS a 150 microlitri volume finale.
- Applicare la crema occhio gli occhi degli animali per evitare secchezza e anestetizzare gli animali con il 2% isoflurano fino a quando non sono profondamente addormentati e non reagiscono al tocco sulle zampe (questo richiede circa 2 minuti).
- Posizionare il mouse su una stuoia calda (ancora sotto anestesia) e iniettare il zymosan-A sottocutanea soluzione sul zampa posteriore destra e la soluzione salina sulla zampa posteriore sinistra. Iniettare immediatamente la sonda per via endovenosa e l'immagine dell'animale, successivamente poi tempo record di iniezione / misura (come t = 0 ore). Salvare le immagini risultanti come cubetti di immagine e ripetere i passi precedenti per tutti gli altri animali e le rispettive sonde.
- Fotografia gli animali ogni 2 hr per 10 ore dopo l'iniezione e poi a 24 ore dopo l'iniezione, facendo in modo che la fase della camera di misura è caldo (per esempio, posizionando una stuoia calda sotto), al fine di evitare l'ipotermia. Dopo ogni misura, mettere gli animali in una gabbia con cibo e acqua ad libitum e posizionare la gabbia in una camera di animali temperato. Eutanasia gli animali di primo anestetizzante con il 2% isoflurano fino gli animali reagiscono più a toccare, poi eutanasia con anidride carbonica per 5-10 minuti, rendendoAssicurarsi che gli animali smettono di respirare completamente e si verifica rigor mortis.
- Staccare i topi secondo protocolli standard che possono essere valutati online (http://www.freebookez.com/mouse-dissection-lab-report/) e l'immagine gli organi.
- Valutare i risultati delle misure secondo le istruzioni del produttore per la prima sottraendo la fluorescenza complessiva degli animali (unmixing) poi regioni assegnazione di interesse per autofluorescenza (sinistra zampa posteriore con soluzione salina) e l'obiettivo di fluorescenza di zona infiammata (destra zampa posteriore con zymosan-A).
Risultati
L'incapsulamento di alte concentrazioni di coloranti fluorescenti come la NIRF dye DY676-COOH qui utilizzato all'interno acquosa di liposomi porta ad un elevato livello di estinzione della fluorescenza. Fluorescenza tempra, un fenomeno visto con molti fluorofori ad alta concentrazione, può essere sfruttata in diversi in applicazioni di imaging in vivo in cui una elevata sensibilità e rilevamento affidabile dell'area di destinazione sono richiesti. L'uso di liposomi fornisce anche una protezione del colorante che è indispensabile per applicazioni in vivo. Una caratterizzazione completa dei liposomi è necessario e comprende diversi fattori quali il livello di colorante incapsulato, la stabilità e la dimensione dei liposomi, estinzione della fluorescenza e l'attività di colorante incapsulato in vitro e anche applicabilità per scopi di imaging in vivo. Un confronto del colorante libero, DY-676-COOH e liposomi bonifica (Lip-Q) così come un liposoma non quenched (Lip-dQ) a bassissima concentrazione del colorante incapsulato è quindi cruciale soprattutto per caratterizzazioni in vivo.
I liposomi preparati utilizzando l'idratazione pellicola e la tecnica di estrusione con cicli di congelamento e successivo scongelamento prima dell'estrusione contengono molecole residue colorante libero che possono essere separati con successo dai liposomi a causa della loro conservazione più lungo nella matrice gel filtrazione, rispetto ai liposomi che eluiscono veloce ( Figura 1B). A seconda del livello di diluizione dopo filtrazione su gel, un passo ultracentrifugazione opzionale consente la concentrazione dei liposomi come illustrato (Figura 1C). Sulla base delle proprietà di assorbimento ed emissione del colorante incapsulato, la concentrazione di colorante incapsulato è determinato con l'aiuto di una curva di taratura del colorante libero (Figura 1D). Inoltre la concentrazione del colorante incapsulato, è importante determinare la dimensione e omogeneità dei liposomi poppaPreparazione er. Come si vede nella Figura 1E, micrografie elettroniche di liposomi preparati con il metodo sottostante rivelano una morfologia prevalentemente unilamellare delle vescicole liposomiali, contenente intravesicular DY-676-COOH sia entro l'intervallo di concentrazione quenching (Lip-Q; 606-846 pM DY-676 ) o ad una concentrazione di colorante non spento (Lip-DQ, 25 micron DY-676). Inoltre, rivelano una distribuzione omogenea dimensione di circa 120 nm e indici polidispersità molto inferiore 1 (Tabella 1). A causa di estinzione della fluorescenza, Lip-Q mostra due massimi di assorbimento in tampone acquoso, per cui un picco è caratterizzata da uno spostamento verso le lunghezze d'onda blu. In linea con questo, l'emissione di fluorescenza è molto basso rispetto alla tintura libera (Figura 2A e B, a destra). Freeze-danno dei liposomi determina un rilascio del colorante, che viene diluito in soluzione circostante. Il picco di assorbimento-blu spostata quindi disappears, risultando in un singolo picco di assorbimento di Lip-Q. Corrispondenti a questo, un aumento di intensità di fluorescenza di freeze-danneggiato Lip-Q è visto, il che indica che l'attivazione di fluorescenza di molecole di colorante rilasciate avvenuta. Il colorante libero rivela solo un singolo massimo assorbimento e alta intensità di fluorescenza che rimangono allo stesso livello, indipendentemente congelamento (Figura 2A e B, sinistra). Questa scoperta suggerisce che l'incapsulamento del colorante in liposomi, come in Lip-Q proteggerebbe il colorante dall'ambiente, mantenere elevata concentrazione e l'estinzione della fluorescenza associata e se attivato da trigger bersaglio consentirebbe rilevamento causa di aumento della fluorescenza.
Sonde liposomiale con la composizione lipidica sottostante rivelano un assorbimento fagocitaria predominante che è inibito da esaurimento dell'energia. Questo può essere visto attraverso la captazione di Lip-Q dal altamente fagocitica murino linea cellulare macrofagica J774A.1, eleggermente fagocitica linea cellulare glioblastoma umano U-118mg a 37 ° C e l'inibizione a 4 ° C (Figura 3A e B). Il colorante libero DY-676-COOH assorbimento rivela nelle linee cellulari fagocitiche sia a 37 ° C ed a 4 ° C che indica che la sonda liposomiale Lip-Q non contiene colorante libero residuo nella soluzione e può subire solo assorbimento attiva. Scansione laser confocale immagini microscopiche confermano ulteriormente l'assorbimento e l'attivazione di Lip-Q in fagociti (Figura 3C). Inoltre, la mancanza di fluorescenza della linea umana non fagocitica cellule fibrosarcoma, HT-1080 indica che l'assorbimento di Lip-Q è prevalentemente da fagocitosi e quindi, sarebbe adatto per l'imaging di infiammazione dove monociti fagocitiche / macrofagi sono coinvolti.
Coerentemente con l'assorbimento fagocitaria dei liposomi visto in linee cellulari in coltura, e causa la fluorescenza tempra iniezione endovenosa di Lip-Q porta ad un tempo-dipendente aumento di intensità di fluorescenza di edema in modelli murini (4A, Lip-Q), con sfondo molto bassa fluorescenza. L'intensità massima di fluorescenza di edema è rilevato 8-10 ore dopo l'iniezione di Lip-Q. Al contrario, relativamente forte NIR-fluorescenza del complesso del mouse è visto dopo l'applicazione della libera DY-676-COOH (Figura 4A, DY-676-COOH) o sempre attiva liposomi, Lip-dQ (Figura 4A, Lip-dQ ). Rispetto al Lip-Q, rapida perfusione e la clearance della libera DY-676-COOH come si è visto 0-4 ore dopo l'iniezione, interferisce con le immagini, in modo che il rilevamento affidabile di edema non è possibile (4A, DY-676-COOH ). Inoltre, il liposomi non spento, Lip-DQ rivela una fluorescenza massimo di edema entro 2-4 ore dopo l'iniezione, che rimane pressoché costante fino a 8 ore, quindi si riduce gradualmente simile al temprato edema fluorescenza a base di Lip-Q. Esecuzione anal semi-quantitativale analisi di tipo, per cui le regioni di interesse (ROI) sono fissati per edema contro sfondo, si possono trarre conclusioni circa i diversi livelli di rilevamento con diverse sonde. Secondo l'analisi semi-quantitativa di 5 animali per gruppo (sonda), edema può essere più significativo (p = 0,001) rilevato con Lip-Q che con la libera DY-676-COOH o non temprato, Lip-DQ (Figura 4B).
Imaging organi di topi sacrificati 24 ore dopo l'iniezione di sonde rivelare lieve ex vivo di fluorescenza del fegato / cistifellea e reni e molto bassa o nessuna fluorescenza della milza, polmoni e cuore (Figura 5), che serve come prova per l'eliminazione delle sonde attraverso la via epatobiliare.

Figura 1: Preparazione di liposomi DY-676-COOH-caricatas. (AC) Schema dei passaggi di sintesi coinvolti. (A) Impostazione della idratazione pellicola e di estrusione con il vicino infrarosso dye DY-676-COOH. (B) Immagine del setup self-made gel filtrazione mostra la interfase tra (gratuito) dye non incapsulato e liposomi. I liposomi eluiscano prima e appaiono blu-verde a causa della incapsulato DY-676-COOH (blu) e il fosfolipide verde incorporato, NBD-DOPE. (C) immagine Rappresentante di liposomi-sedimenti (Lip-Q), dopo la concentrazione per ultracentrifugazione. ( D) Rappresentante curva di calibrazione di DY-676-COOH in 10 mM Tris pH 7.4 (contenente 1% Triton X100) utilizzati per la quantificazione di liposomiale dye. (E) di elettroni Cryo-trasmissione al microscopio di Lip-Q. Clicca qui per vedere una versione più grande della figura.
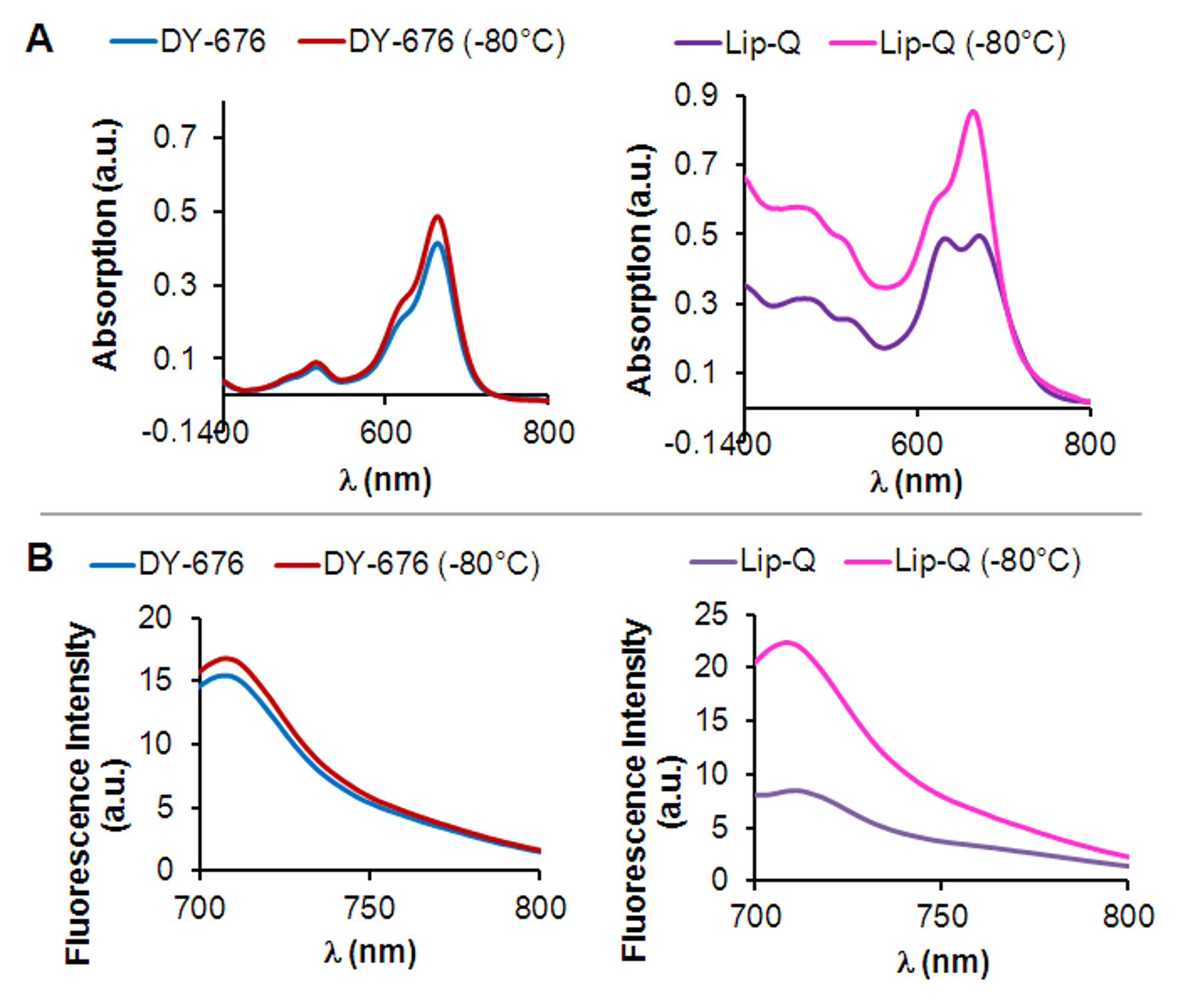
Figura 2:. Determinazione Physicochemical di estinzione della fluorescenza e l'attivazione in vitro (A) Assorbimento spettri di Lip-Q (a destra) e connessione DY-676-COOH (sinistra) misurata in 10 mM Tris pH 7,4 tampone, prima o dopo il congelamento a - 80 ° C. Nota la caratteristica doppio picco di Lip-Q rispetto alla libera DY-676-COOH e la scomparsa del picco blu spostato dopo freeze-danni di Lip-Q. (B) corrispondente spettri di emissione di fluorescenza di Lip-Q (a destra) e libera DY-676-COOH (sinistra) misurata in 10 mM Tris pH 7,4 tampone prima o dopo il congelamento a -80 ° C.

Figura 3: captazione cellulare e fluorescenza attivazione del labbro osomes. Le immagini in (A) sono stati preparati NIR imaging di fluorescenza di pellet cellulari dopo esposizione alle sonde corrispondenti per 24 ore alle temperature indicate. Le cellule HT-1080 non sono sopravvissuti ai periodi di incubazione 24 hr a 4 ° C. I diagrammi a barre (B) rappresentano i livelli semi-quantitativa di segnali di fluorescenza ottenuto assegnando ROI ai pellet cellulari in A. Ogni barra indica le intensità media di n = 3 esperimenti ± SD. Immagini in (C) sono stati acquisiti con laser confocale microscopia a scansione di cellule esposte a sonde sulla cultura diapositive da camera per 24 ore a 37 ° C. Nota l'elevato livello di fluorescenza in alta fagocitica murino linea cellulare macrofagica J774A.1 e la fluorescenza moderata nel mite fagocitica linea di cellule di glioblastoma umano U-118mg. La non-fagocitica linea cellulare fibrosarcoma umano HT-1080 non mostra fluorescenza delle sonde. NBD-DOPE: fosfolipidi verde fluorescente.Carico / 52136 / 52136fig3highres.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande della figura.
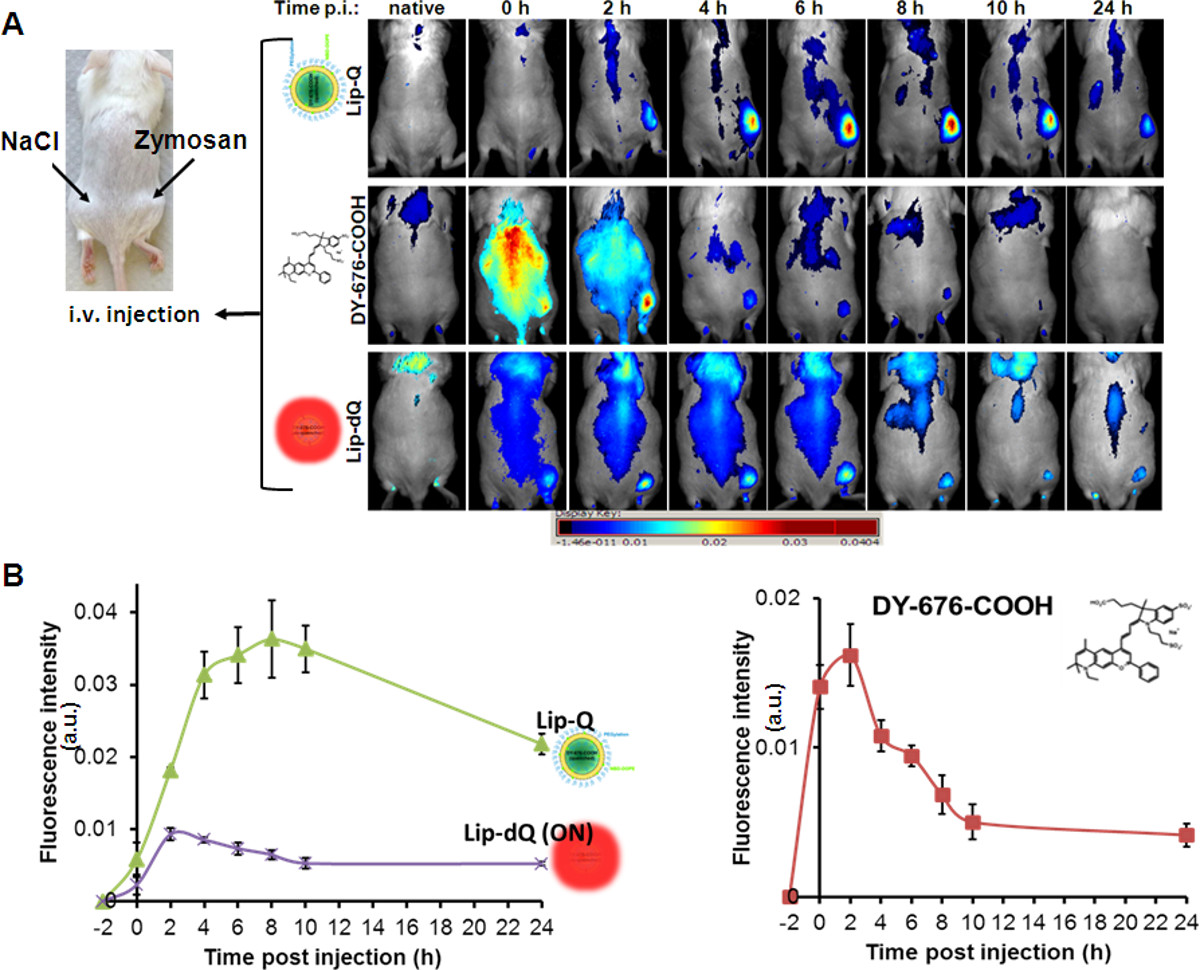
Figura 4. In vivo imaging ottico di edema zymosan indotta nei topi. (A) L'immagine mouse sulla sinistra mostra le posizioni di applicazione sottocutanea zymosan-A (500 mg in 50 ml di soluzione salina) e la soluzione salina di controllo (50 microlitri) sul fianco sinistro. L'iniezione endovenosa di sonde indicati e tutto il corpo NIR imaging di fluorescenza ai momenti indicati rivelare graduale, ma forte aumento in segnali di fluorescenza di edema e di basso fondo segnali di Lip-Q (pannello superiore) con una fluorescenza massimo a 8 ore dopo l'iniezione. Il colorante libero rivela perfusione e rapida clearance entro 4 ore dopo l'iniezione (pannello centralel), mentre Lip-DQ rivela rilevamento di edema con basse intensità di segnale e uno sfondo più elevato di fluorescenza generale. La presentazione grafica in (B) ribadire i segnali di fluorescenza osservati dell'edema rilevata con ogni sonda rispetto alla regione di controllo (soluzione fisiologica) n = 5 animali per gruppo. Ogni trama rappresenta i segnali di fluorescenza media di (n = 5) ± SEM. Con i grafici, il massimo segnale di fluorescenza di edema rilevato con ogni sonda è facilmente riconoscibile (Lip-Q, 8 ore; Lip-DQ 2-4 ore e senza DY-676-COOH, 2 ore dopo l'iniezione). C'è una intensità di fluorescenza significativamente (P = 0,001) maggiore di edema con Lip-Q contro Lip-DQ a t = 0-24 ore, e con Lip-Q contro libero DY-676-COOH a t = 4-24 ore. Clicca qui per vedere una versione più grande della figura.
Figura 5: ex vivo immagini Bio-ottiche di organi da topi 24 ore di applicazione della sonda posta, e le relative analisi semi-quantitativa di intensità di fluorescenza degli organi. Ogni barra rappresenta la media delle intensità di fluorescenza (n = 4) ± SEM. Clicca qui per vedere una versione più grande della figura.
| Formulazione liposomiale | Dimensioni [nm] | Polidispersità Index (PI) | Zeta Potenziale [mV] |
| Lip-DQ (dequenched) | 123.4 ± 0.6 | 0,055 ± 0.02 | -10,6 ± 0,4 |
| Lip-Q (spento) | 118.5 ± 0.7 | 0.04 ± 0.02 | -9 ± 2 |
| Lip-NBD (w / o DY-676-COOH) | 123.0 ± 1.4 | 0.04 ± 0.03 | -11 ± 1 |
Tabella 1: Caratterizzazione dei liposomi di dispersione della luce dinamica.
Discussione
Dal liposomi possono anche servire come sistemi di consegna per tinture fluorescenti, che permettono l'imaging di malattie in questione. L'incapsulamento di alte concentrazioni di coloranti fluorescenti come il colorante NIRF, DY676-COOH usato qui, porta ad un elevato livello di estinzione della fluorescenza del colorante intrappolato. Fluorescenza tempra, un fenomeno visto con molti fluorofori ad alta concentrazione può essere sfruttata in diversi in applicazioni di imaging in vivo, dove è richiesta una elevata sensibilità e rilevamento affidabile della zona di destinazione. L'uso di liposomi fornisce anche una protezione del colorante che è indispensabile per applicazioni in vivo.
La tecnica pellicola idratazione e l'estrusione è un metodo ampiamente utilizzato che consente la preparazione di liposomi con successo intervalli di dimensioni diverse a seconda delle necessità, e consente modifiche come l'incapsulamento di una moltitudine di differenti sostanze 25. Così, è adatto per la preparazione di labbroosomes incapsulato con il colorante fluorescente NIR, DY-676-COOH per scopi di imaging. Il metodo produce liposomi con 600-840 mM concentrazioni di colorante intravesicular, che sono all'interno della concentrazione spento del colorante. L'estrusore mano LiposoFast-Basic utilizzato per l'omogeneizzazione della dispersione vescicole spontaneamente formatosi è adatto per la preparazione di liposomi in piccola scala di laboratorio, a causa della compatibilità del dispositivo, con siringhe fino a 1 volume ml. Per preparazioni su larga scala è consigliabile l'uso di grandi omogeneizzatori ad alta pressione in grado di omogeneizzare dispersioni vescicole con una capacità di 1000 L all'ora. La cromatografia gel filtrazione (esclusione dimensioni) è un passo fondamentale che assicura la separazione del colorante liposomiale incapsulata da molecole non incapsulato (gratuito) tintura 26. La lunghezza della colonna di gel filtrazione è essenziale per la separazione efficiente dei liposomi dal colorante libero. Pertanto, è necessario preparare una colonna di almeno il 28 cm Lunghezza to separare correttamente i liposomi dal libero DY-676-COOH usato qui. È interessante notare che questa lunghezza è due volte più a lungo di quello utilizzato per purificare carbossifluoresceina (CF) liposomi caricati da carbossifluoresceina gratuito. Il principale inconveniente di gel filtrazione è una diluizione 5:55 volte dei campioni purificati. Questo può essere compensato mediante ultracentrifugazione, se sono necessarie liposomi altamente concentrati. Durante ultracentrifugazione liposomi sedimento e il surnatante possono essere rimossi facilmente 27. Altri modi per concentrare i liposomi, come per la dialisi sono 28 più tempo rispetto ultracentrifugazione.
Oltre al metodo pellicola idratazione ed estrusione, il metodo di evaporazione fase inversa 23 nonché il metodo di iniezione di etanolo 24 consentono la preparazione di liposomi con alta efficienza di incapsulamento per molte sostanze idrofile. Tuttavia, le nostre indagini hanno rivelato l'idratazione pellicola combinato con il ciclo di congelamento e scongelamentos di essere il metodo più adatto per un incapsulamento intraliposomal sufficiente di DY-676-COOH. Aumentando la concentrazione di partenza DY-676-COOH utilizzato per la pellicola idratazione aumenta l'efficacia e la concentrazione del colorante intraliposomal, quando viene utilizzata una concentrazione lipidica fissa di 30 mM. Nonostante questa efficacia l'incapsulamento con il metodo di congelamento e scongelamento è inferiore al 10% della concentrazione di colorante di partenza usato, ma è comunque sufficiente per incapsulamento della concentrazione tempra necessaria per l'imaging. Inoltre, il colorante libero separato da liposomi mediante gel filtrazione può essere riciclato per la demineralizzazione e disidratazione secondo le istruzioni del produttore, facendo ri-incapsulamento possibile e una perdita complessiva colorante minima. L'incapsulamento del colorante dal protocollo sottostante non ha alcuna influenza sulla dimensione e morfologia dei liposomi come visto dagli indici polidispersità e il microscopio elettronico di Lip-Q.
Diversi metodi semplici possono essere utilizzati per evaluate l'attività di preparati fluorescenti liposomes.DY-676-COOH è una forte tendenza ad auto-estinzione alle alte concentrazioni 21,29 probabilmente derivanti dalla formazione di H-dimero e interazioni-pi stacking tra le molecole di colorante. Queste interazioni, che si verificano a causa di vicinanza dei raggi Förster di molecole di colorante in alte concentrazioni, possono essere annientati per diluizione 30. Pertanto, incapsulamento di elevate concentrazioni di DY-676-COOH non solo protegge il colorante da opsonizzazione in vivo, ma anche dal buffer circostante, mantenendo quindi la sua alta concentrazione e trattenere estinzione della fluorescenza che può essere rilevato come un assorbimento blue-spostata picco e bassa emissione di fluorescenza come si vede nella figura 2. congelamento liposomi gradualmente a -80 ° C porta alla formazione di cristalli di ghiaccio nell'interno acquosa 31 che provoca danni alla membrana liposomiale quando rashly scongelati a 30 ° C. Il rilascio, la diluizione e la fluorescenza actizione del intra-liposomiale DY-676-COOH in tampone dopo il congelamento è rivelato in un unico picco di assorbimento e quasi 2,5 volte maggiore intensità di fluorescenza (Figura 2), che indica che Lip-Q sequestra così un elevato, tempra concentrazione DY-676-COOH ed è attivabile. Altri metodi per danneggiare liposomiale doppio strato lipidico come l'uso di solventi o detergenti organici non rivelano differenze nette tra colorante libero e liposomiale incapsulata tintura, poiché entrambi influenzano le proprietà spettrali di molti coloranti fluorescenti 32. Il congelamento lento e metodo scongelamento duro riportato qui quindi serve come un metodo più affidabile e promettente per convalidare l'alto incapsulamento di fluorofori in liposomi e una conseguente estinzione della fluorescenza. Dalla spettri di assorbimento ed emissione di intatta Lip-Q (figura 2), un certo livello di fluorescenza residua può essere rilevato. Ciò può derivare da monomeri non quenched colorante all'interno della lipoSomes e anche dalla interazione elettrostatica e l'influenza di colorante incapsulato da fosfolipidi gruppi di testa polari 33.
Come si vede in figura 3, un accumulo distinto di Lip-Q nel macrofago murino altamente fagocitica e mite linea cellulare glioblastoma umano fagocitica, U-34 118mg, ma non nel non-fagocitica linea cellulare fibrosarcoma umano HT-1080, indica che Lip-Q di imaging basata dell'infiammazione sarebbe favorevole, dal momento che i fagociti sono i protagonisti dei processi infiammatori. Il fatto che la deplezione di energia abolisce assorbimento di Lip-Q, ma non assorbimento della libera DY-676-COOH sostanzia la specificità di assorbimento fagocitaria di Lip-Q e rivela che Lip-Q rimane intatto durante l'esperimento, altrimenti il rilascio del colorante e assorbimento di energia indipendente avrà luogo che porta alla fluorescenza di rilevamento. Incorporare il fosfolipide verde fluorescente, NBD-DOPE nel doppio strato liposomi permette l'imaging microscopico e discrimination tra non degradati da liposomi degradati cellulari, soprattutto se gli esperimenti di assorbimento dipendenti dal tempo sono fatti come riportato in precedenza 32. Le immagini microscopiche rivelano NIR-fluorescenza DY-676-COOH, che correla con i livelli di intensità di fluorescenza di pellet di cellule, come determinato mediante analisi semiquantitativa dopo incubazione a 37 ° C. In accordo con ciò, le linee cellulari di macrofagi murini mostrano la massima fluorescenza, mentre il glioblastoma umano rivela minore fluorescenza sia DY-676-COOH e NBD-DOPE del primo. Come previsto la linea cellulare fibrosarcoma umano, HT-1080 rivelano alcuna fluorescenza di coloranti né liposomiali o la libera DY-676-COOH, che rafforza il fatto che Lip-Q assorbimento, è prevalentemente da fagocitosi.
Per studiare il potenziale di Lip-Q-base fagocitosi-driven imaging in vivo di infiammazione, sono stati considerati diversi controlli. Considerando che la libera DY-676-COOH può essere ripreso da phagocytOsis, opsonizzazione di Lip-Q può portare al rilascio di colorante, che può essere occupato da fagociti. Per evitare questo, Lip-Q è stato preparato con 5 mol% PEGylation. Inoltre, è necessario distinguere tra assorbimento dovuto alla base dell'infiammazione effetto EPR e uptake attivo e l'attivazione di fluorescenza. Per far fronte a questo, la valutazione e il confronto di tre diverse sonde, vale a dire l'always-on, Lip-DQ, il spento Lip-Q e la libera DY-676-COOH in topi portatori di edema zymosan indotto era necessario. Zymosan-A che viene preparato dalle pareti cellulari di Saccharomyces cerevisiae e Candida albicans è uno stimolante naturale della secrezione di citochine tramite il Dectin-1 e il recettore toll-like 2/6 (TLR 2/6). Citochine secrete a loro volta inducono l'attivazione di cascate a valle che si traducono in perdite vascolari, facilitando in tal modo la intravasation / stravaso di monociti / macrofagi da un serbatoio splenica 35 così come neutrofili, e la loro migrazione verso siti di infiammazione(Edema) 36-39. Il processo di monociti basato zymosan-/ macrofagi stravaso e migrazione deve solo 4,5-6 ore che rende zymosan uno strumento strategico per lo studio dei processi infiammatori 36-39. A causa delle perdite vascolari che risultano durante l'infiammazione, per via endovenosa iniettato sonde possono sia essere prese da monociti / macrofagi (fagociti) durante la loro migrazione verso il sito infiammazione o stravaso e risolte presso il sito edema (effetto EPR) 40. L'uso del non-quenched Lip-dQ rivela uno sfondo complessiva forte per segnali edema rispetto Lip-Q, e un aumento della fluorescenza di edema che riflette la migrazione di monociti e macrofagi. In effetti, la fluorescenza massimo di edema è visto già 2-4 ore applicazione posto di Lip-DQ e rimane pressoché costante fino a 8 ore. Opposto a Lip-DQ e Lip-Q, la libera DY-676-COOH subisce una rapida perfusione dopo l'iniezione e viene cancellata entro 4 ore, in modo che l'imaging distinte di edema non è possibile. Interestingly, l'uso dei risultati Lip-Q in persistente aumento di intensità di fluorescenza di edema e molto bassi segnali di fondo. Questo persistente aumento delle intensità di fluorescenza con Lip-Q è attribuita a fluorescenza attivazione del liposomiale rilasciato colorante. Presi insieme, si può concludere che il contributo di EPR effetto nell'imaging Lip-Q base è minimo poiché Lip-dQ rivelano una fluorescenza massima (effetto EPR e migrazione monociti) a 4 ore dopo l'iniezione. Così, incapsulamento liposomiale fornisce protezione e consegna distinta DY-676-COOH, che a sua volta consente un più affidabile immagini in vivo di edema, esclusivamente dopo internalizzazione e la degradazione (attivazione fluorescenza) da parte delle cellule fagocitiche. Finora, l'uso di zymosan indotta zampa posteriore edema per convalidare le proprietà di imaging di liposomi fluorescenti è nuovo. Il protocollo qui riportate può essere espansa sia da incapsulamento di diversi coloranti fluorescenti e di imaging effetto della diversa dru inibitoriogs sulla induzione di infiammazione, e rappresenta quindi un utile strumento per la preparazione e caratterizzazione di sonde adatte per l'imaging biomedico.
Un altro passo importante verso la definizione di sonde di imaging idonei è la verifica delle loro proprietà farmacologiche e vie di eliminazione. La distribuzione delle sonde di organi che svolgono un ruolo fondamentale nel escrezione, come il fegato ei reni così come loro breve ritenzione e adatto eliminazione di questi organi è di solito l'indicazione che le sonde molto probabilmente non mostrano effetti negativi sul paziente. In accordo con ciò, gli organi di topi preparati 24 ore dopo l'iniezione di Lip-Q o libera DY-676-COOH rivelare fluorescenza solo lieve del fegato / cistifellea e reni, che significa un'eliminazione preferita del fluoroforo liposomiale tramite la via epatobiliare. La sistemazione a corto di sonde in questi organi e la loro eliminazione efficiente è suffragata da un 7-fold segnali di fluorescenza elevati di organi preparati 6 ore dopo l'iniezione di Lip-Q o la libera DY-676-COOH 32. Queste osservazioni sono in accordo con l'eliminazione dei liposomi 41 e sostiene l'importanza di includere studi di biodistribuzione nella caratterizzazione di sonde. Anche se gli effetti collaterali, come irritazioni della pelle e l'attivazione del complemento 42,43 sono stati riportati per le formulazioni liposomiali utilizzati in applicazioni cliniche, tali effetti non sono stati rilevati con i liposomi sottostanti. Inoltre, l'osservazione di topi immunodeficienti per due settimane dopo l'iniezione sonda portato a completare la clearance delle sonde da organi topi (non mostrato).
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni Deutsche Forschungsgemeinschaft HI-698 / 10-1 e RU-1652 / 1-1. Ringraziamo Doreen maggio per l'eccellente assistenza tecnica e la società DYOMICS GmbH, Jena per il loro supporto gentile.
Materiali
| Name | Company | Catalog Number | Comments |
| Materials and equipments for preparation of liposomes | |||
| egg phospahtidylcholine | Avanti Polar Lipids | 840051P | Dissolve in chloroform and store in glass vials (214 mg/ml) |
| cholesterol | Sigma | C8667 | Dissolve in chloroform and store in glass vials (134 mg/ml) |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt) | Avanti Polar Lipids | 880120P | Dissolve in chloroform and store in glass vials (122 mg/ml) |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt) | Avanti Polar Lipids | 810145P | Dissolve in chloroform and store in glass vials (2 mg/ml) |
| Sartorius MC1 (d = 0.01 mg) | Sartorius AG | Research RC 210 P | used for weighing the phospholipids |
| Rotavapor | Büchi Labortechnik AG | R-114 | used for hydration of phospholipid film |
| Waterbath | Büchi Labortechnik AG | R-481 | used for hydration of phospholipid film |
| Vacuum Controller | Büchi Labortechnik AG | B-720 | used for hydration of phospholipid film |
| Vacobox | Büchi Labortechnik AG | B-177 | used for hydration of phospholipid film |
| Circulation Chiller | LAUDA DR. R. WOBSER GMBH & CO. KG | WKL 230 | used for hydration of phospholipid film |
| DY-676-COOH | Dyomics GmbH | 676-00 | Dissolve in 10 mM Tris and store stock at -20°C |
| Tris-(Hydroxymethyl)-aminomethan | Applichem | A1086 | buffer 10 mM, pH 7.4 |
| Trichlormethan | Carl Roth GmbH + Co. KG | Y015.2 | used for liposome preparation |
| Sonicator | Merck Eurolab GmbH | USR 170 H | used for liposome preparation |
| Vortex Genie 2 (Pop-off Cup, No. 146-3011-00) | Scientific Industries Inc. | SI-0256 | used for liposome preparation |
| Sephadex G25 medium | GE Healthcare Europe GmbH | 17-0033-01 | used for liposome purification |
| Triton X100 | Ferak Berlin GmbH | 505002 | used to destruct liposomes for dye quantification |
| LiposoFast-Basic | Avestin Inc. | used for the extrusion of liposomes | |
| Polycarbonate filter membrane, 100 nm (Whatman Nucleopore Trans Etch Membrane, NUCLEPR PC 19 MM, 0.1 U) | VWR | used for the extrusion of liposomes via LiposoFast-Basic | |
| Fluostar Optima | BMG Labtech | used for dye quantification | |
| Zetasizer Nano ZS | Malvern | used for the determination of liposome size and zetapotential | |
| Ultracentrifuge | Beckmann Coulter GmbH | XL 80 | used for concentration of the samples |
| Rotor | Beckmann Coulter GmbH | SW 55 TI | used for concentration of the samples |
| Materials and equipments for the evaluation of liposome and optical imaging | |||
| Zymosan-A from Saccharomyces cereviciae | Sigma | Z4250-250MG | used for induction of inflammation |
| Isotonic Saline (0.9%) | Fresenius GmbH | PZN-2159621 | used for the dilution of Zymosan-A |
| Isoflurane vaporizer | Ohmeda Isotec 4 | used for anesthesizing animals | |
| Isoflurane | Actavis GmbH | PZN-7253744 | anesthesia |
| Thermo Mat Pro 20 W | Lucky Reptile | 61202-HTP-20 | used to keep animals warm during anesthesia |
| Omnican-F (1 ml injection) | Braun | PZN-3115465 | used for subcutaneous and intravenous application of probes |
| Panthenol eye cream | Jenapharm | PZN-3524531 | used to prevent dryness of the eyes of animals during anesthesia |
| Hanks buffered saline solution | PAA Laboratories /Biochrom AG | L2045 | w/o Mg2+, Ca2+ and phenol red. For dilution of probes and for washing of cells |
| 8-Well chamber slides | BD Biosciences | 354108 | used for cell culture followed by microscopy |
| Cell culture flasks | Greiner BioOne | ||
| Cell culture media | Gibco (life technologies GmbH) | ||
| Fetal calf serum | Invitrogen | ||
| Poly-L-Lysine solution (0.01%, 50 ml) | Sigma | P4832 | used to coat cell culture chamber slides |
| Mountant Permafluor | ThermoScientific | S21022-3 | Mounting solution for microscopy |
| Hoechst-33258 | AppliChem | DNA stain for microscopy | |
| Hera-Safe | Heraeus Instruments | sterile work bench used for cell culture | |
| HERA cell | Heraeus Instruments | Incubator used for cell culture | |
| LSM510-Meta | Zeiss | used for confocal microscopy | |
| Maestro-TM in vivo fluorescence imaging system | CRi, Woburn | used for whole body fluorescence imaging of small animals | |
| Spectrophotometer (Ultrospec 4300 pro UV) | GE Healthcare | used for measurement of absorption | |
| Spectrofluorometer (Jasco FP-6200) | Jasco | used for measurement of fluorescence emission | |
| Animals | |||
| NMRI mice (8-12 weeks old, male) | Elevage Janvier, France | used for inflammation trials | |
Riferimenti
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers). Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Cabanes, A., et al. Enhancement of antitumor activity of polyethylene glycol-coated liposomal doxorubicin with soluble and liposomal interleukin 2. Clinical cancer research : an official journal of the American Association for Cancer Research. 5, 687-693 (1999).
- Gabizon, A., Shmeeda, H., Grenader, T. Pharmacological basis of pegylated liposomal doxorubicin: impact on cancer therapy. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 45, 388-398 (2012).
- Balasubramanian, S. V., Bruenn, J., Straubinger, R. M. Liposomes as formulation excipients for protein pharmaceuticals: a model protein study. Pharmaceutical research. 17, 344-350 (2000).
- Meyer, J., Whitcomb, L., Collins, D. Efficient encapsulation of proteins within liposomes for slow release in vivo. Biochemical and biophysical research communications. 199, 433-438 (1994).
- Mayer, L. D., Hope, M. J., Cullis, P. R. Vesicles of variable sizes produced by a rapid extrusion procedure. Biochimica et biophysica acta. 858, 161-168 (1986).
- Mayer, L. D., Bally, M. B., Hope, M. J., Cullis, P. R. Techniques for encapsulating bioactive agents into liposomes. Chemistry and physics of lipids. 40, 333-345 (1986).
- Walde, P., Ichikawa, S. Enzymes inside lipid vesicles: preparation, reactivity and applications. Biomolecular engineering. 18, 143-177 (2001).
- Weissleder, R., Ntziachristos, V. Shedding light onto live molecular targets. Nature medicine. 9, 123-128 (2003).
- Licha, K., Riefke, B., Ebert, B., Grotzinger, C. Cyanine dyes as contrast agents in biomedical optical imaging. Academic radiology. 9 Suppl 2, S320-S322 (2002).
- Pauli, J., et al. Novel fluorophores as building blocks for optical probes for in vivo near infrared fluorescence (NIRF) imaging. Journal of fluorescence. 20, 681-693 (2010).
- Holzer, W., et al. Photostability and thermal stability of indocyanine green. Journal of photochemistry and photobiology. B, Biology. 47, 155-164 (1998).
- Gandorfer, A., Haritoglou, C., Kampik, A. Retinal damage from indocyanine green in experimental macular surgery. Investigative ophthalmology & visual science. 44, 316-323 (2003).
- Saxena, V., Sadoqi, M., Shao, J. Degradation kinetics of indocyanine green in aqueous solution. Journal of pharmaceutical. 92, 2090-2097 (2003).
- Kodjikian, L., et al. Toxic effects of indocyanine green, infracyanine green, and trypan blue on the human retinal pigmented epithelium. Graefe's archive for clinical and experimental ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle Ophthalmologie. 243, 917-925 (2005).
- Sevick-Muraca, E. M., Houston, J. P., Gurfinkel, M. Fluorescence-enhanced, near infrared diagnostic imaging with contrast agents. Current opinion in chemical biology. 6, 642-650 (2002).
- Bremer, C., Ntziachristos, V., Weissleder, R. Optical-based molecular imaging: contrast agents and potential medical applications. European radiology. 13, 231-243 (2003).
- Hilderbrand, S. A., Kelly, K. A., Weissleder, R., Tung, C. H. Monofunctional near-infrared fluorochromes for imaging applications. Bioconjugate chemistry. 16, 1275-1281 (2005).
- Langhals, H., et al. Cyanine dyes as optical contrast agents for ophthalmological surgery. Journal of medicinal chemistry. 54, 3903-3925 (2011).
- Pauli, J., et al. An in vitro characterization study of new near infrared dyes for molecular imaging. European journal of medicinal chemistry. 44, 3496-3503 (2009).
- Ogawa, M., Kosaka, N., Choyke, P. L., Kobayashi, H. H-type dimer formation of fluorophores: a mechanism for activatable, in vivo optical molecular imaging. ACS chemical biology. 4, 535-546 (2009).
- Szoka, F., Papahadjopoulos, D. Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation. Proc.Natl.Acad.Sci.U.S.A. 75, 4194-4198 (1978).
- Batzri, S., Korn, E. D. Single bilayer liposomes prepared without sonication. Biochimica et biophysica acta. 298, 1015-1019 (1973).
- Fahr, A., van Hoogevest, P., May, S., Bergstrand, N., ML, S. L. Transfer of lipophilic drugs between liposomal membranes and biological interfaces: consequences for drug delivery. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 26, 251-265 (2005).
- New, R. R. C. Liposomes a practical approach. , IRL Press at Oxford University Press. (1990).
- Barenholz, Y., et al. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16, 2806-2810 (1977).
- Schwendener, R. A. The preparation of large volumes of homogeneous, sterile liposomes containing various lipophilic cytostatic drugs by the use of a capillary dialyzer. Cancer drug delivery. 3, 123-129 (1986).
- Pauli, J., et al. Suitable labels for molecular imaging--influence of dye structure and hydrophilicity on the spectroscopic properties of IgG conjugates. Bioconjugate chemistry. 22, 1298-1308 (2011).
- Wu, P., Brand, L. Resonance energy transfer: methods and applications. Analytical biochemistry. 218, 1-13 (1994).
- Stark, B., Pabst, G., Prassl, R. Long-term stability of sterically stabilized liposomes by freezing and freeze-drying: Effects of cryoprotectants on structure. European journal of pharmaceutical sciences : official journal of the European Federation for Pharmaceutical Sciences. 41, 546-555 (2010).
- Tansi, F. L., et al. Liposomal encapsulation of a near-infrared fluorophore enhances fluorescence quenching and reliable whole body optical imaging upon activation in vivo. Small. 9, 3659-3669 (2013).
- Chen, R. F., Knutson, J. R. Mechanism of fluorescence concentration quenching of carboxyfluorescein in liposomes: energy transfer to nonfluorescent dimers. Analytical biochemistry. 172, 61-77 (1988).
- Windler-Hart, S. L., Chen, K. Y., Chenn, A. A cell behavior screen: identification, sorting, and enrichment of cells based on motility. BMC cell biology. 6, 14(2005).
- Swirski, F. K., et al. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 325, 612-616 (2009).
- Erdo, F., Torok, K., Aranyi, P., Szekely, J. I. A new assay for antiphlogistic activity: zymosan-induced mouse ear inflammation. Agents and actions. 39, 137-142 (1993).
- Ajuebor, M. N., et al. Endogenous monocyte chemoattractant protein-1 recruits monocytes in the zymosan peritonitis model. Journal of leukocyte biology. 63, 108-116 (1998).
- Ajuebor, M. N., Das, A. M., Virag, L., Szabo, C., Perretti, M. Regulation of macrophage inflammatory protein-1 alpha expression and function by endogenous interleukin-10 in a model of acute inflammation. Biochemical and biophysical research communications. 255, 279-282 (1999).
- Ajuebor, M. N., et al. Role of resident peritoneal macrophages and mast cells in chemokine production and neutrophil migration in acute inflammation: evidence for an inhibitory loop involving endogenous IL-10. J Immunol. 162, 1685-1691 (1999).
- Binstadt, B. A., et al. Particularities of the vasculature can promote the organ specificity of autoimmune attack. Nature. 7, 284-292 (2006).
- Ishida, T., Harashima, H., Kiwada, H. Liposome clearance. Bioscience reports. 22, 197-224 (2002).
- Dobrovolskaia, M. A., McNeil, S. E. Understanding the correlation between in vitro and in vivo immunotoxicity tests for nanomedicines. Journal of controlled release : official journal of the Controlled Release Society. 172, 456-466 (2013).
- Szebeni, J., et al. Prevention of infusion reactions to PEGylated liposomal doxorubicin via tachyphylaxis induction by placebo vesicles: a porcine model. Journal of controlled release : official journal of the Controlled Release Society. 160, 382-387 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon