Method Article
İnsan Thymus ile myeloid dendritik hücreleri ve epitel hücreleri İzolasyonu
Bu Makalede
Özet
Bu protokol, antijen yoğunluğuna tek bir hücre süspansiyonu santrifüj ve ilgi hücre popülasyonlarının son olarak manyetik ve / veya FACS ayıklama, ardından doku enzimatik sindirimi farklı adımları ile insan timus hücreleri sunan izole etmek için bir yöntem göstermektedir.
Özet
Bu protokolde, insan timus dendritik hücreler (DC) ve epitel hücreleri (TEC) izole etmek için bir yöntem sağlar. DC ve TEC büyük antijen sunan hücre normal timus bulundu (APC) türleri vardır ve iyi onlar timus seçimi sırasında farklı rolleri oynadığı kurulmuştur. Bu hücreler, timus ayrı mikroçevrelerde lokalize ve her APC tür hücrelerin sadece küçük bir popülasyonu oluşturan vardır. Bundan başka, bu hücre tiplerinin biyolojisi anlamak için, bu hücre popülasyonlarının tanımlanması oldukça tercih edilir ama nedeniyle düşük bir frekansa, bu hücre tiplerinin herhangi birinden izolasyonu etkili ve yeniden üretilebilir bir prosedürü gerektirir. Bu protokol, çeşitli hücresel özellikleri karakterizasyonu için uygun hücrelerin elde edilmesi için bir yöntem göstermektedir. Timus doku mekanik olarak bozulur ve enzimatik sindirme farklı adımları sonra, elde edilen hücre süspansiyonu bir Percoll yoğunluk santrifüjleme aşaması kullanılarak zenginleştirilmiştir. Miyeloid DC (CD11c'nin izolasyonu için <sup> +), düşük yoğunluklu kısmıyla (LDF) gelen hücreler, manyetik hücre sıralama ile immunoselected edilir. TEC popülasyonlar (MTec, CTEC) zenginleştirilmesi spesifik hücre markörleri kullanılarak (FACS) floresan aktive hücre aracılığı ile daha sonra izole edilmesini sağlayan düşük yoğunluklu Percoll hücre fraksiyonundan hematopoietik (CD45 hi) hücrelerinin tükenmesi ile elde edilir. Izole edilmiş hücreler, farklı alt uygulamalar için kullanılabilir.
Giriş
Timus T hücresi gelişme cereyan ettiği bir organdır. Timik aktivitesi hala yaşlılıkta tespit edilebilir, ancak bu durumda sürekli olarak yağ ile ikame olur zaman onun nispi ve mutlak büyüklüğü yaşla birlikte azalır. Immün tepkisi için önemi 1960'ların 1 'de gösterilmiştir.
T hücresi işlevsel bir repertuar ve büyük ölçüde kendi kendine dayanıklı T hücresi repertuarının 2 ile sonuçlanan T hücrelerinin gelişmekte olan hayatta kalma ya da ölüm ipuçları sağlamak timik APC farklı ilgili MHC-peptid kompleksleri ile T hücresi reseptörlerinin etkileşimi yoluyla şekillenir.
Insan timus hücrelerin yaklaşık% 98 timositlerde olarak adlandırılan T hücreleri geliştirmektedir. Geriye kalan,% 2, bir TEC çeşitli (kortikal, medüller, subkapsüler), miyeloid ve plazmasitoid DC (MDC, pDC), makrofajlar, B hücreleri, olgun yeniden dolaşan T hücreleri, granülositler gibi farklı hücre tipleri, bir dizi oluşmaktadır fbir ekspresyon fenotipli ibroblasts, endotelyal hücrelerin ve çok nadir epitel hücreleri, kas, nöronlar ve solunum yolu epitel gibi diğer dokuların (Şekil 1) gelen hücre benzeyen. Bunlardan, TEC ve DC normal timus bulunan başlıca APC türleridir. Son yıllarda, kültür ve moleküler profili çıkartmak için, bu tip APC saflaştırılması daha fazla ilgi görmüştür. Nedeniyle düşük bir frekansa, ayrıntılı analiz için, bu hücre tiplerinin herhangi birinin izolasyonu etkin, tekrarlanabilir ve maliyet-etkin bir prosedürü gerektirir. Burada sunulan yöntem, daha önce yayınlanmış çalışmalar 3,4 'den bir modifikasyonudur.
Başka bir doku gibi, timüs hücre ekstre enzimatik olarak tek bir hücre süspansiyonu elde etmek için, hücre-hücre ve hücre-matris etkileşim ağları ayırmak ile elde edilebilir. Iyi ayrışma verimliliği, hücre verimi, hücre canlılığı ve hücre s tutma gibi bazı parametreler vardırönemli olan ve sert bir yere belirteçler bu nadir hücre popülasyonlarının başarılı bir şekilde izole edilmesi için optimize edilmesi gerekir.
Bu protokol, DC ve alt-TEC izolasyonu mekanik parçalama ve enzimatik sindirme ile doku tek hücre süspansiyonu yaparak gerçekleştirilir. Biz doku bir arada tutan yerli kolajen yıkmak için, farklı enzim aktiviteleri dengeli bir orana sahiptir Clostridium histolyticum'dan, gelen Kolajenaz A kullanın. DNase I (timositleri çok hassastır). Ayrıca bir doku ayrıştırıcı yardımıyla mekanik ve enzimatik doku tedavi ile ilgili tipik bir enzimatik Doku sindirimi için alternatif bir yaklaşım sağlar nedeniyle ölü hücrelerden serbest DNA hücre agregasyonunu azaltmak için enzim çözeltisi dahildir. Tek hücre süspansiyonu daha sonra hücre düşük yoğunluklu kısmıyla (LDF) zenginleştirilmesi için tek bir Percoll yoğunluk santrifüj işlemine tabi tutulur. Hücrelerin bu fraksiyondan DC f boyama izole edilebilirya da DC-yüzey belirteçleri (örneğin, CD11c +) ve manyetik ayırma veya floresan aktive hücre sınıflandırma (FACS) kullanılarak. Timus hücrelerin büyük bir çoğunluğu içeren lenfoid hücrelerinin aksine, TEC yüksek seviyelerde CD45 eksprese ancak epitelyal hücre yapışma molekülü EpCAM pozitif olan yoktur. CTEC CDR-2 (kortikal dendritik retikülosit-2) antikoru 4,5 ve daha düşük EpCAM ifadesi tarafından tanınan bir henüz tanımlanmamış antijeninin ekspresyonu ile medüller TEC ayırt edilebilir. Diferansiyel EpCAM ve CDR2 eş ifadesi, yüksek hızlı bir hücre ile bu alt-TEC etkin yalıtım 6 ayırma sağlar.
Burada sunulan protokol, insan timus dokusu için optimize edilmiştir. FACS kullanılması halinde, prosedürün süresi, doku miktarı ve deneyi yeteneği hem de hücre sıralayıcı hızına bağlıdır. Normal olarak, DC izolasyonu için protokol 5 içinde tamamlanabilir-6 Hr ve 8-10 saat içinde TEC izolasyonu için. Timik doku DC ve TEC altkümelerin izolasyon zaman duyarlı. Daha hızlı izolasyon prosedürü, hücrelerin durumu daha iyi. Son olarak, izole edilmiş hücreler mRNA karşılaştırmalı çalışmalar ve protein ifadesi, PCR deneyleri, protein izolasyon, moleküler profili (yani transkriptomik, mikro RNA analizi) yanı sıra hücre kültürü 6 gibi daha ileri araştırmalar için de kullanılabilir.
Etik Bildirimi
Insan timus dokusu ile çalışmak edebilmek amacıyla araştırmacı doku genellikle reşit elde beri yerel etik kurul veya sorumlu makamlar yanı sıra donörün bilinçli bir yazılı izni (ya da genellikle kendi anne, onay almak gerekiyor çocuklar). Ayrıca, tüm insan dokuları potansiyel bulaşıcı ve uygun önlemlerin vb, eldiven ile çalışma gibi, alınmalıdır olarak ele alınmalıdır.
Protokol
1.. Araçlar, Enzim Çözümleri ve Tamponlar hazırlanması
Protokol başlamadan önce aşağıdaki hazırlık adımları gerçekleştirin.
- Araçlar
Temiz, kuru ve aşağıdaki araçları otoklav ve kullanıma kadar steril bir paket içinde saklayın.- Timus doku kesmek için kavisli veya düz ya da ipuçları ile küçük keskin makas. Doku kullanımı için tırtıklı ipuçları ile küçük kavisli forseps.
- Percoll yoğunluklu santrifüjleme aşaması için 50 ml Oak Ridge Santrifüj Tüpleri, PC,.
- Enzim çözeltiler
Aşağıdaki gibi (2 mg Kollajenaz / ml ve 0.1 mg DNase I / ml) karışımı enzim kolajenaz / DNase hazırlanması:- , Bir 2 mg / ml kollajenaz çözelti elde etmek için RPMI 1640 Düz (FCS) 250 ml kollajenaz liyofilize A (Roche) içinde çözülür, 500 mg. Kolajenaz çözmek oldukça zordur, bu nedenle oda sıcaklığında bir roller-çalkalayıcı üzerinde biraz zaman bırakmak tavsiye edilir.
- 100 mg DNase I (Roche) içinde çözülürSteril damıtılmış su içinde 10 mi. 2.5 ml lik bir kısmı -20 ° C'de saklanabilir 2 mg Kollajenaz bir çözelti içinde 10 mg DNase I çözeltisinin 2.5 ml ilave edilir.
- Steril filtre Stericup filtre birimi (0.22 um) kullanılarak kollajenaz / DNase karışımı. -20 ° C'de kullanıma kadar 10-20 ml şişelerde saklayın.
- Tamponlar ve Çözümler
- 1.5 M NaCl stok solüsyonu: oda sıcaklığında 0.22 um filtresi ve mağaza üzerinden solüsyonu filtre 1.5 M bir son konsantrasyona kadar damıtılmış steril su içinde NaCI eritin.
- 10x MACS tamponu: 1x PBS (Ca 2 + / Mg2 + içermeyen),% 5 BSA ve 20 mM EDTA ihtiva eden. Steril filtre, 4 ° C'de bir 0.22 mikron filtre ve mağaza ile çözelti Önce soğuk steril 1x PBS 1x 10x stok seyreltilmesi ile 1x çözeltisi hazırlamak kullanmak için.
- FACS Tampon: 1x PBS (Ca 2 + / Mg2 + içermeyen),% 1 BSA ve% 0.02 NaN3 içeren.
- FACS Tampon hücre sıralama için: 1x PBS (Ca 2 + / Mg 2 + içermeyen),% 2 BSA içeren. 0.22 um bir şırınga filtresi kullanılarak sterilize edin ve 4 ° C'de saklayın
2. Doku hazırlanması
Dokunun işleme, düzgün akış kabininde steril reaktifler ve iş kullanılarak yapılmalıdır. Prosedürü başlamadan önce, aşağıdaki reaktifler ve ekipman hazırlamak:
- , Oda sıcaklığına kadar aşağıdaki Isınma: RPMI 1640 tam ortamı (RPMI 1640,% 10 fetal inek serumu,% 1 pen / strep), RPMI 1640, düz, Ca2 + / Mg2 +-serbest PBS ile 2x kollajenaz / DNase enzim çözeltisi.
- 37 ° C'ye dönüş birimi ve 4 ° C'ye soğutun sabit açılı rotor santrifüj ile sıcak ısı kuluçka
- Buz ile bir kutu hazırlayın.
Not: Bu aşamanın süresi doku durumuna ve büyüklüğüne bağlıdır. Yaklaşık 20-30 dk ti orta boy bir parça için makul bir süre gereklidiriyi durumda ssue (~ 5 cm genişliğinde).
- Steril PBS içeren bir Petri kabındaki doku yerleştirin ve herhangi bir kalıntı kan durulayın.
- Kurutma ve forseps ve makas kan pıhtıları, bağ ve yağ dokusu ve sağlıklı görünmüyor herhangi bir yerinden doku temizlemek kullanarak doku önlemek için taze PBS ekleyin.
- Enkaz miktarı artacak nekrotik doku kaldırmak için özen gösterin.
- Temizlikten sonra, başvuru için doku tartın.
- Yaklaşık 1 cm 3 adet / blok içinde doku kesti. Doku karşılamak için yeterli PBS ilave edin.
Not: Sonuçların tekrarlanabilirlik, doku muntazam boyutta parçalar halinde kesilmiş olmalıdır.
- Steril bir şırınga (10-20 mi) içinde geri kullanarak timik doku parçalarının üzerine basınç (çok güçlü ve uzun süreli değildir) uygulanır. Bu prosedür, böylece daha sonra sindirilmiş edilecek olan doku hacmini azaltır, timositlerin kısmını kaldırır. Buz üzerinde bu adımı uygulayın ve hızlı çalışır.
- Timositleri çıktıkça çözüm gözle bulutlu olacak. 5 ml'lik bir pipet yardımıyla veya bir cam aspiratör yanlışlıkla doku parçaları aspire için özen timositlerin içeren süpernatant kaldırmak yavaşça ve daha sonra çanak karıştırın.
Kriteri: Bir steril hücre kültürü kazıyıcı sonra çanak (45 ° açı) eğim ve süpernatant aspire yemeğin bir tarafında, tüm doku parçaları konsantre kullanılabilir. Taze PBS ile değiştirin ve yüzer nispeten saydam oluncaya kadar bu işlemi tekrarlayın. RPMI ova ile son yıkama yapın.
- Keskin bir makas kullanarak doku parçaları sakınmadan (ince mümkün olduğunca, fragmanlar en az 2-4 mm olmalıdır). Parçalar, 5 ml'lik pipet girmek için yeterince küçük olmalıdır.
3. Thymus Dokusundan Tek Hücre Süspansiyon Hazırlanması
Burada,Bu aşama için iki alternatif yaklaşımlar açıklanmıştır. Ikinci bir doku dissociator (bölüm 3.2) yardımıyla mekanik ve enzimatik doku tedavi gerektirir ise ilk yaklaşım tipik bir enzimatik doku sindirim (bölüm 3.1) açıklanmaktadır.
Bu protokol, 5 g ağırlığında doku numunelerinin işlenmesi için optimize edilmiştir. Daha büyük ya da daha küçük doku örnekleri için, buna göre enzim seviyesini ayarlamak.
Tek bir hücre süspansiyonu elde etmek için 3,1 tipik doku enzimatik sindirim
- Doku 5 g başına 10 ml kolajenaz / DNase çözeltisi ile 50 ml tüplere doku püresi yerleştirin. 20 ml'lik toplam hacim elde RPMI düz ekleyin.
Not: Bir 50 ml'lik bir tüp içinde 10 g doku kadar sindirimi. Buna göre enzim seviyesini ayarlayın.
- Termal bir kuluçka makinesi içinde yavaş dönme altında, 37 ° C'de 40 dk için doku süspansiyonu inkübe edin.
Not: inkübasyon adımları dönme birimi ile bir termal inkübatör veya bir çalkalama ile 37 ° C kuluçka makinesi içinde, bakteriyel ya da gerçekleştirilebilir.
- Hücreler içine serbest olarak enzim çözeltisi bulanık olacaktır. Doku parçaları çökeltmek için 2 dakika boyunca 110 xg'de sindirim, santrifüj tüpünün ucunda.
- Bu sindirim turdan süpernatant toplayın. 400 x g de 10 dakika boyunca hücre süspansiyonu Pelet. Hücre peleti boyutuna bağlı olarak RPMI tam 10-50 ml süpernatan aspire ve tekrar süspansiyon hücreleri.
- Gevşek kapak ile 37 ° C kuluçka makinesi içinde hücre süspansiyonu tutun.
- Daha büyük hücre sayıları istenirse, sindirim aşaması, kalan doku parçaları ile tekrar tekrar ve birinci ve ikinci sindirimi toplanmış olabilir. TEC izole edilmelidir Ayrıca, eğer, sindirimler iki tur yapılmalıdır.
- Tripan mavisi (1:10-1:100) 'de, hücre süspansiyonunun bir alikotu seyreltin ve hemasitometre kullanarak canlı hücreler sayılır.
- Percoll yoğunluk santrifüj (bölüm 4) devam etmek için hazır olana kadar, bir inkübatör içinde 37 ° C'de hücreler tutun. DC alt kümelerinden (bölüm 5) sonraki izolasyon bu hücrelerden yapılacaktır.
Not: timik dokular tek hücre süspansiyonu sindirim etkinliği ve üretimi etkiler, özellikle yaşla birlikte, kendi bileşim içinde değişebilir.
- Timik epitelial hücreler (TEC) müteakip izolasyonu için enzimatik sindirme bir üçüncü tur gereklidir. 10 taze Kolajenaz / DNaz çözüm ml artı 10 ml RPMI düz ve süspanse doku kalıntıları çözeltide tripsin / EDTA (01:50 dan 2.5% stok) ekleyin.
- Hafif bir dönme ile, 40 dakika boyunca 37 ° C'de inkübe edilir. Son 10 sırasında - kuluçkalama 15 dakika Tripsin aktivitesini nötralize etme FCS (01:05) ekleyin.
- Doku parçaları çökeltmek için, oda sıcaklığında 2 dakika boyunca 110 x g'de santrifüjleyin.
Not: doku tamamen sindirimler bu üç tur sonra sindirilir olmayabilir. Yaş ve doku genel durumu timus dokusunun ayrışma etkinliği etkileyen iki parametredir.
- Hücre süpernatan toplamak ve tortulaşmış doku parçaları atın.
- 10 dakika boyunca 400 x g'de hücre süpernatan santrifüjleyin. RPMI tam aspire süpernatant ve tekrar süspansiyon hücre pelet.
İpucu: Hücre topakları oldukça gevşek, yani süpernatant aspire / atarken dikkat.
- Hemasitometre kullanarak canlı hücreleri saymak. Ayırma (bölüm 4) Percoll geçmeden kadar bir 37 ° C kuluçka makinesi içinde hücreleri yerleştirin. CD45 hi hücrelerinin tükenmesi TEC hücrelerinin sonraki ön-zenginleştirme bu hücrelerin (bölüm 6) dan yapılacaktır.
Bir doku dissociator Asisti 3.2 Mekanik ve enzimatik doku tedavi
. Aşağıdaki protokol TEC 7,8 izolasyonu için fare timusundan doku ayırmak için kullanılan modifiye edilmiş bir versiyonudur.
- Kolajenaz / DNase çözeltisi 10 ml ihtiva eden bir C tüp içine aktarın kıyılmış doku parçaları (adım 2.5) içinde 5 g.
- Doku dissociator ve çalıştırma programı m_spleen_02 (10 sn) üzerine C tüp uyarlayın. Bu programı 4-5x (40-50 sn) tekrarlayın.
- 37 ° C'de 20 dakika boyunca hafif bir dönme ile inkübe
- Oda sıcaklığında 2 dakika boyunca 110 x g'de santrifüjleyin.
- Süpernatant toplayın ve adım 3.1.4 olarak devam edin. Taze Kolajenaz / DNaz çözeltisi 10 ml ekleyin.
- Doku dissociator ve çalıştırma programı m_spleen_01 (56 sn) üzerine C tüp uyarlayın.
- Hafif bir döndürme ile 20 dakika boyunca 37 ° C'de inkübe edin.
- Oda sıcaklığında 2 dakika boyunca 110 x g'de santrifüjleyin.
- ToplamaT hücre süpernatanı ve 400 x g de 10 dakika boyunca hücre süspansiyonu pelet. Adım 3.1.4 olarak devam edin.
- 3.1.9 tarif edildiği gibi sindirim üçüncü tur timik epitelial hücreler (TEC) ve daha sonra izole edilmesi için gereklidir. Bunun için, 10 taze Kolajenaz / DNaz çözüm ml artı Tripsin / EDTA tekrar süspansiyon doku kalıntıları (stokta 1:50 seyreltme% 2.5)
- Hafif bir döndürme ile 20 dakika boyunca 37 ° C'de inkübe edilir. FCS (1:5) ilave edin ve 10 dakika daha inkübe edilir.
Not: Bu yaklaşımı kullanarak, bu son sindirim doku genellikle tam olarak ayrışmış ve herhangi bir sindirilmemiş doku fragmanları gözlenmiştir aşama sonra.
- Adımlar olarak devam 3.1.11-3.1.14.
4. Percoll-yoğunluk Separation Hücrelerinin LDF Zenginleştirme
Dokunun enzimatik sindirimden sonra toplam timik tek hücre süspansiyonları, tek bir Percoll yoğunluk centrifugat tabi tutulurLDF hücreleri zenginleştirmek üzere iyon adım. Hücrelerin LDF yüksek APC için zenginleştirilmiştir. DC ve TEC hem de hücrelerin bu kısmını tespit edilir.
- (TEC izolasyonu için) veya 3. özet (3.1.14) (adım 3.1.8 bakınız toplanmış hücreler) MDC izolasyonu için sindirir nd 1. ve 2. elde edilen tek hücre süspansiyonu kullanın. 10 dakika boyunca 400 x g'de her sindirim aşamasından elde edilen tek bir hücre süspansiyonu santrifüj.
- Bu yıkama adımı (aşağıdaki tabloda örnek) içinde 1.07 g / ml 'lik bir son yoğunluğa sahip bir Percoll çözeltisi hazırlayın.
1.07 lik bir nihai yoğunluğa Percoll çözeltisi hazırlanması g / ml (ρ = 1.07) Tüp No 1 2 3 4 Sulandırılmamış Perkol (ρ = 1.130) (ml) 2.96 5.92 8.88 11.84 1.5 M NaCl (ml) 0.6 1.20 1.8 2.4 damıtık H2O (ml) 2.44 4.88 7.32 9.76 Son işleme seyreltme Cilt 6 mi 12 mi 18 mi 24 mi - Percoll tüplerin sayısı adımları 3.1.8 ve / veya 3.1.14 belirlenen hücre sayıları bağlıdır. Steril çözümleri birleştirin ve iyice karıştırın. Optimum izolasyonu için, 0,6-1 x 10 9 hücreleri Percoll tüp başına yüklenebilir. Steril çözümleri birleştirin ve iyice karıştırın.
İpucu: Perkol ışığa duyarlı ve ek olarak soğuk tutulmalıdır. İlk NaCI ve H2O (RT) ihtiva eden bir karışım hazırlayın ve sadece Percoll çözeltisi içindeki hücrelerin tekrar asılı tutulmasından önce, son sulandırılmamış Percoll ekleyin.
çadır "> Not:! Perkol yoğunluğu farklı tedarikçiler ve gruplar arasında değişebilir sulandırılmamış Perkol çözeltisinin yoğunluğu 1,130 eşit değilse g / ml, Percoll'un ve H 2 kesin miktarlarını hesaplamak için üreticisi tarafından sağlanan yönergeleri kullanın O 1.07 g / ml 'lik bir nihai yoğunluk elde etmek için gereklidir.- , Hazırlanan Percoll çözeltisi (ρ = 1.07) içinde 6 ml 1 x 10 9 hücreleri kadar yeniden süspanse edin, homojen bir süspansiyon elde etmek için yeteri kadar karıştırın ve 50 ml Oak Ridge polikarbonat vida kapaklı bir santrifüj tüpüne transfer.
- Dikkatlice Percoll çözeltisi / hücre süspansiyonu üzerinde bir pipet ile tüp başına tam RPMI içinde 30 ml katman. Bu süspansiyonun üstünde kalır ve tabakası rahatsız özen böylece, yavaş yavaş orta yükleyin.
- Onlar santrifüj sırasında dengeli, böylece eşit ağırlıklara sahip olduğundan emin olmak için tüpler tartılır. Onlar değilse, dikkatli st altında (hafif tüp daha orta eklemekerile şartları).
- Dikkatlice fren kapalı ile 4 ° C'de, 35 dakika boyunca 3500 x g'de, sabit açılı rotor ve spin ile önceden soğutulmuş bir santrifüj tüpleri aktarın. Emin olun yüksek olmayan, 4 ° C 'de santrifüj sıcaklığı
- Santrifüj tüpleri çıkarın ve dikkatli bir şekilde, steril bir Pasteur pipeti kullanılarak her bir tüpten ve Percoll ortamında (düşük yoğunluklu fraksiyonu) arasındaki interfazda bulunan zenginleştirilmiş APC, toplar. Soğuk RPMI tam ihtiva eden bir 50 ml tüp içine hücreleri aktarın. Kalan Percoll sulandırmak amacıyla tüp doldurun.
- 4 ° C'de 300 x g'de 10 dakika boyunca bir hücre süspansiyonu santrifüj Süpernatant ve tekrar yıkama atın.
- Ortam içindeki hücre pelletini ve (tripan mavi ve hemasitometre kullanarak), hücre sayısını belirler. Deneyimlerimize göre, LDF hücre yüzdesi enzimi sindirimi, daha sonra, elde edilen toplam tek bir hücre süspansiyonu, yaklaşık% 2-20 olduğu. Tipik bir ydüşük yoğunluklu zenginleştirilmiş hücrelerin ield (genç timüs, aralık 1 gün-2 yıl) toplam tek hücre süspansiyonu hücreler% 10 temsil eden, x 10 9 1 başına 1x10 8 hücredir.
Not: Bu aşamada, hücreler (özellikle ileri yaşta çocukların örnekleri ile) süspansiyon toplanmış olduğunu gözlemleyebiliriz. Hücre kümeleri hücreleri birlikte sopa ölen hücrelerin DNA serbest hücre ölümü ve sonucu göstergesidir. Böyle bir durumda, numune (50 ug / mi) içine DNase I ekleyin ve serbest DNA molekülleri sindirimi oda sıcaklığında (her 5 dakikada yavaşça ters) en fazla 20 dakika için inkübe edilir.
5. Timik MDC İzolasyonu
(Percoll ayırma ile) APC zenginleştirme sonra MDC verimli bir şekilde enzimatik sindirimler birinci ve ikinci tur sonra LDF izole edilebilir. Aşağıdaki protokol MDC (CD11c'nin izolasyonu için manyetik hücre ayırma değiştirilmiş bir versiyonu +).
- Santrifüj APC 10 7 hücre başına 100 ul MACS tamponu içinde 10 ° C'de 4 dakika ve tekrar süspansiyon hücre peleti boyunca 300 xg'de araya getirilmiş birinci ve ikinci enzimatik sindiriminden elde edilen tek bir hücre süspansiyonu izole edilmiş hücreler zenginleştirilmiş.
- 10 7 hücre başına CD11c-PE antikoru 5 ul ekleyin.
Not: Titrasyon deneyleri optimum sonuçlar için tavsiye edilir.
- İyice karıştırın ve ışıksız bir ortamda 4 ° C'de 15 dakika boyunca inkübe edin.
- 10 dakika boyunca 300 x g'de 10 7 hücreleri ve santrifüj başına MACS tamponu eklenerek 1-2 ml hücreleri yıkayın.
- Süpernatant aspire tamamen ve MACS tampon 80 ul 10 7 hücrelerine kadar tekrar süspansiyon.
- 10 7 hücre başına 20 ul anti-PE mikroboncuklarm ekleyin.
- İyice karıştırın (vorteks) ve ışıksız bir ortamda 4 ° C'de 15 dakika boyunca inkübe edin.
- Adım 5.4 olarak tekrarlayın.
- Tampon maddesinin 500 ul hücre 10 8 kadar yeniden süspanse edin.
- Gerekirse, sütunun akış engelleyebilecek yıkıntıları ve hücre agregatları uzaklaştırmak için, bir 40 mikron hücre süzgeci kullanılarak filtre hücre süspansiyonu.
- Timus hücre süspansiyonları LS sütunları ile daha iyi akışı beri LS sütunu kullanın. Üreticinin talimatlarına göre LS kolonu hazırlayın. Yavaş bir hava kabarcığı oluşumunu önleyen sütuna Pipet hücre süspansiyonu. Her 1 x 10 8 hücre için, bir sütunu kullanın.
- Üreticinin talimatlarına aşağıdaki kolon yıkayın. Mıknatıstan sütun çıkarın ve bir yuvarlak steril 12 ml alt polipropilen tüp içine koyun. 3 ml MACS kolonu üzerine tampon ekleme ve ekleme ve sıkıca sütuna pistonu iterek manyetik olarak etiketlenmiş hücreleri toplamak.
- 6 dakika boyunca 400 xg'de CD11c + MDC ve santrifüj temsil elüt fraksiyonu toplamak.
- Hücre sayısını belirlemek ve seçilen hücre populasyondan al saflığını doğrulayınflow sitometri ile ilgili. Önerilen belirteçler CD45, CD11c, ve HLA-DR içerir.
Not: CD11c + MDC da FACS sıralayıcı kullanılarak izole edilebilir.
6. TEC Hücre Sıralama için CD45 lo / negatif Hücrelerinin Zenginleştirme
TEC izolasyonu için, hücreler, hücre sıralama yoluyla izole edilmesini hızlandırmak amacıyla, CD45, mikro-boncuklar kullanılarak CD45 hi hücrelerinin tükenmesi ile önceden zenginleştirilebilir.
3. sindirim aşama (3.1.14) elde edilir ve daha sonra Percoll santrifüj ile ayrılmış tek bir hücre süspansiyonu kullanın.
- 300, 4 ° C'de 10 dakika boyunca x g ve 80 ul MACS tekrar süspansiyon hücre peleti santrifüjleyin hücre süspansiyonu 10 7 hücre başına tampon.
- 10 7 hücre başına tavsiye edilen miktar (6.7 ul) 1/3 CD45 mikroboncuklarm kullanın.
Not: daha düşük bir miktarda kullanarakmikrotaneciklerin biz CD45 lo ve CD45 negatif hücreleri için hücreler önceden zenginleştirmek. Titrasyon optimum sonuçlar için önerilir.
- Tüp hafifçe (Do Not Vortex) getirerek, 4 ° C'de 15 dakika boyunca inkübe ile iyice karıştırın
- 4 ° C'de 300 x g'de 10 dakika boyunca santrifüj MACS tamponu ve 10 ml ilave etmek suretiyle yıkama bağlanmamış mikro- Aspire tamamen yüzer.
- Tampon maddesinin 500 ul hücre 10 8 kadar yeniden süspanse edin.
- Gerekirse, sütunun akış engelleyebilecek yıkıntıları ve hücre agregatları uzaklaştırmak için, bir 70 mikron hücre süzgeci kullanılarak filtre hücre süspansiyonu.
- Timus hücre süspansiyonları LS sütunları ile daha iyi akışı beri LS sütunu kullanın. Üreticinin talimatlarına göre LS kolonu hazırlayın. Yavaş bir hava kabarcığı oluşumunu önleyen sütuna Pipet hücre süspansiyonu. Her 10 8 hücreler için, bir sütunu kullanın.
- Içeren etiketsiz hücreleri (akış ve yıkar) toplayınCD45 lo / negatif hücre fraksiyonu ve üreticinin talimatlarına göre sütun yıkayın.
- 10 4 ° C'de dakika ve hücre sayısını belirlemek ve hücre sıralama için boyama devam etmek için steril FACS tampon tekrar süspansiyon hücre pelet için 300 xg santrifüj.
7. Floresan Aktif Hücre Sıralama için Leke Hücreleri
- FcR spesifik olmayan antikor azaltmak amacıyla, önceki hücre boyama için bloke gerçekleştirin. Oda sıcaklığında 15 dakika boyunca toplanmış insan immunoglobülin çözeltisi ile hücre süspansiyonu inkübe edin. Bu reaktifler (örneğin Gammunex% 10 çözelti), ticari olarak mevcuttur.
- Soğuk steril FACS tampon ekleyerek hücreleri yıkayın. 4 ° C'de 6 dakika boyunca 400 x g'de santrifüje
- Soğuk steril FACS tampon süpernatant ve tekrar süspansiyon hücreleri atın. , Aşağıdaki örneğe göre 5 örnekleri hazırlanması:
Örnek Numune türü Antikor Hücre sayısı Toplam hacmi 1.. lekesiz kontrol 1 x 10 6 50 ul 2.scc *-Pacific Blue kontrol CD45-Pacific Blue 1 x 10 6 50 ul 3. SCC-APC kontrol CD3-APC 1 x 10 6 50 ul 4.scc-Alexa 488 kontrol CD8-Alexa 488 1 x 10 6 50 ul 5. Hücre sıralama analit CD45-Pacific Blue
EpCAM-APC
CDR2-Alexa 48810 x 10 6-50 x 10 6 500 ul
10 x 10 6 hücre/100 ul* SCC; tek renk kontrolü
- Karanlıkta buz üzerinde, 30 dakika boyunca antikorlar ile inkübe hücreleri.
- 4 ° C'de 6 dakika boyunca 400 xg'de santrifüj ile hücreler FACS tamponu ile iki kere yıkayın
- (NaN 3 olmadan örneğin) steril sıralama FACS hücre için tampon kullanarak (hücre ayırma tesisi tarafından ya da konsantrasyonuna) 1 x10 7 hücre / ml 'ye kriteri edilecek numunenin hücre konsantrasyonu ayarlayın.
- Sıralama sırasında Sitometreyi tıkayabilir herhangi bir hücre kümeleri kaldırmak için 70 mikron hücre süzgecinden hücre örneği geçmektedir.
- Tampon 200-400 ul kontrol örnekleri tekrar. Tüpler buz üzerinde tutun ve ışıktan korunmuştur.
- Orta ile toplama tüpleri hazırlayın.
Notlar:
- Uygun boyama için de antikorların titrasyonu yapın.
- Sıralama için, bir örnek olarak, en fazla 50 x 10 6 hücre bir toplam reaksiyon hacmi içinde boyanmış olabilir500 ul.
- 5 ml Falcon polistiren yuvarlak tabanlı tüplerde kriteri edilecek numunenin boyanmasını yapın. Tek bir renk kontrolü, 96 oyuklu bir plakanın ayrı kuyularda boyanmış olabilir.
- TEC alt kümeleri nadir popülasyonları olduğundan, bu doğru FACS ayarların belirlenmesini kolaylaştırmak ve fluorochromes seçim tazminat gerektirir eğer uygun tazminat sahip emin olmak için her florokrom için (yüksek frekans) bir başka olumlu marker kullanmak için tavsiye edilir. CD45 + fraksiyondan hücreler, CD45, CD3 veya farklı fluorochromes için CD8 gibi belirteçleri ile boyanmış olabilir ve boyama sonrası lekesiz CD45 + hücreleri, numuneye ilave edilebilir.
8. Floresan Aktif Hücre sıralayarak TEC izolasyonu
(Mtec) veya EpCAM lo CDR2'de + (CTEC) - TEC altkümeler EpCAM merhaba CDR2'de olarak CD45 lo / negatif fraksiyonu sıralanabilir.
- Örnek zekâ çalıştırınh lekelenmemiş hücreler ve ölçek ilgi nüfusu yerleştirmek için ileri ve yan dağılım ayarlayın. Hücreler görünür ancak histogramın en sol el kısmına yerleştirilir, böylece her bir detektör üzerindeki voltajı ayarlayın.
- Her bir lekeli örnek çalıştırın ve her renk için tazminat ayarlayın.
- Lekesiz ve tek lekeli kontrolleri için gerilim ve tazminat ayarladıktan sonra örnek sıralanabilir çalıştırmak ve ilgi nüfusu tanımlamak için kullanılması yolluk araçları. Hücre enkaz hariç ise, tüm stromal hücre boyutları dahil olmak üzere geniş bir ileri ve yan dağılım kapıyı kullanın.
- CD45 düşük ve CD45 negatif hücrelerde Forward Scatter kapısı karşı CD45-Pasifik Mavisi ile nokta arsa üzerinde.
- CDR2'ye nokta grafiği bir EpCAM Bu kapı uygulamak ve sıralanması için popülasyonları yolluk belirler.
- Kapıları tespit edildikten sonra, ilgilenilen popülasyonları içeren kapıları seçin ve sıralama başlar.
- kere sıralanmış hücreler santrifüj hücre süspansiyonu, tahsil edilmiş, ve seçim orta ya da tampon içinde tekrar süspansiyon hücreleri amaçlanan downstream uygulamaya bağlı.
Not: toplama tüpü yanlarına hücrelerin yapışmasını önlemek amacıyla sıralama sırasında, tüp PBS içinde% 50 FCS ile doldurarak önceden kaplanabilir ve oda sıcaklığında 30 dakika inkübe edildi. Toplama ortamı eklemeden önce kaplama çözümü atın.
Sonuçlar
Bu protokolde, başlangıç malzemesi olarak biz bilgilendirilmiş rıza sonra ve kurumsal kurallar altında elde edilen düzeltici kardiyovasküler cerrahi (Bölüm Göğüs Kalp ve Damar Cerrahisi, Üniversite Kliniği Tuebingen) geçiren çocuklarda çıkarılan timus doku kullanın. Bu atılan malzeme 2-30 g veya daha fazla boyutu büyük ölçüde değişebilir. Elde edilir MDC sayısı ve TEC alt-gruplar (CTEC ve MTec) boyut olarak hem de izolasyonu için kullanılan timus doku örneğinin yaşına bağlıdır.
Şekil 2 (~ 9 cm) altı yaşındaki bir çocukta elde edilen doku oldukça büyük bir parçasını gösterir. Bu protokolde önemli bir ilk hazırlayıcı aşama (beyaz oklar ile gösterilmektedir) arzu edilmeyen bölgelerinden gelen doku temizlenmesidir.
Tek bir Percoll yoğunluk santrifüjleme s kullanılarak ayrıldı tek bir hücre süspansiyonu elde etmek için 2 ve protokol 3.1 'de belirtildiği gibi Thymus doku işlenditek bir hücre süspansiyonu HLA-DR + hücrelerinin yaklaşık% 3 (Şekil 3A) ihtiva ederken tep, Percoll uygulanan santrifüj işlemi sonrasında bu oran% 15-40 kadar, büyük ölçekli hücreleri içeren, düşük yoğunluklu kısmıyla (LDF) artmış iken esas olarak muntazam küçük boyutlu timositlerin oluşan yüksek yoğunluklu fraksiyon (HDF) hemen hemen hiç bu tür hücreleri (Şekil 3B) içerir. İlgi (LDF) fraksiyonu içeren zenginleştirilmiş APC, daha sonra toplandı ve daha sonra izolasyon adımda kullanım için hücreleri toplamak için yıkanmıştır.
Timik MDC CD11c9, 10 dahil olmak üzere, yüzey belirteçleri, bir dizi ekspresyonu ile tespit edilebilir olsa da, bu tür pDC BDCA-2, BDCA-4, CD45RA ve CD123 11,12 gibi belirteçler ifade eder. LDF hücrelerin zenginleştirilmesi sonra, her iki hücre tipleri + manyetik hücre ayırma ile veya CD11c'nin sıralama akış + veya BDCA-4 ya da, daha fazla sayıda aynı zamanda etkili izolasyonunu sağlayan, bu fraksiyonun% 2-10 teşkilhücreler 6.
Şekil 4, bölüm 5'de tarif edilen tadil edilmiş bir manyetik hücre ayrıştırma protokolü kullanılarak CD11c + hücrelerinin etkili izolasyonunu gösterir. Izole edilmiş hücreler tarafından oluşturulan imüno olarak izole edilmesinden sonra, CD11c + DC saflığı% 93 olmuştur. Ortalama olarak, izole edilmiş CD11c + DC kurtarma 5 x 10 5 -5 x 10 6 MDC 10 9, toplam timik hücre başına tek bir giriş, bir dizi farklı yaş doku ağırlığının birkaç ayrı timus örneklerinden elde edilmiştir. Tablo 1 verileri hücre süspansiyonları, hem de total LDF sayıları ve onu takip eden CD11c + verim ve saflık.
APC zenginleştirilmiş fraksiyon olarak, hücrelerin sadece yaklaşık% 0.5 'i lo EpCAM CD45 + veya CD45 negatif EpCAM + bulunmaktadır. CTEC ve Mtec EpCAM l olarak tripsin-sindirilmiş CD45 lo / negatif zenginleştirilmiş stromal hücrelerden sıralanabilir o + CDR2 ve EpCAM hi CDR2 -, sırasıyla, Şekil 5'te gösterildiği gibi.
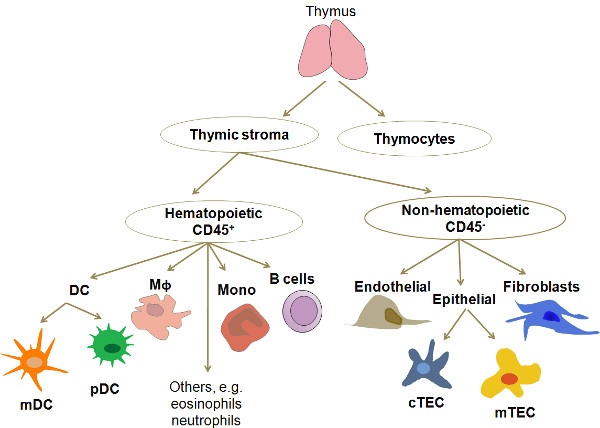
Şekil 1. Hücresel organizasyon ve insan timus kompozisyonun basitleştirilmiş bir diyagram. Timus farklı olgunlaşma aşamalarında, timositlerin oluşur ve heterojen hücresel ağ timik ortamı oluşturarak timik stroma olarak anılacaktır. Ve makrofajlar Kısaltmalar: timik stromaya ana hücre tipleri MDC ve pDC, epitel (kortikal ve medüller lobülü içindeki yerleşimine göre iki ana kategoriye ayrılır): hücreler DC, dendritik hücreler, MDC, miyeloid dendritik hücreler;. pDC, plazmasitoid dendritik hücreleri Mφ, makrofaj, mono, monositler, CTEC, kortikal epitel hücreleri; MTec, medüller epitel hücreleri.
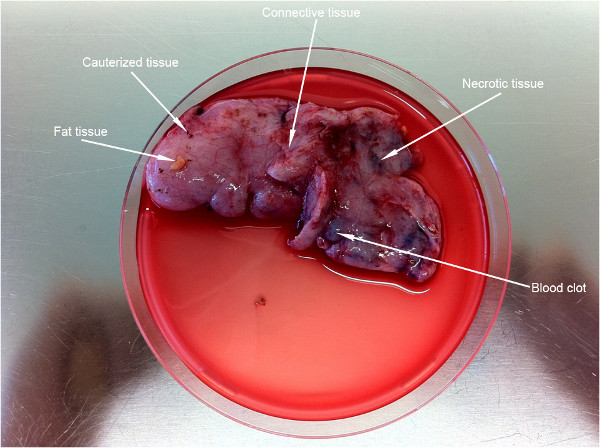
Şekil 2. Önceki protokol çalıştırılmasına atılması gereken istenmeyen doku bölümlerine tek hücre hazırlanması. Oklar noktası için doku ilk hazırlayıcı bir adım.

Şekil 3,. Saflaştırma işleminin farklı aşamalarında timik APC., FACS analizi ile saflaştırılması. Timus dokusunun tek hücre süspansiyonları, mekanik parçalama ve seri enzim sindirimleri ile elde edilmiştir ve APC Percoll yoğunluklu ayırma ile (LDF hücreleri) zenginleştirilmiş. (A) önce ve (B) sonra, hücreler Percoll yoğunluklu ayırma APC zenginleştirme kontrol etmek için HLA-DR antikoru-PE ile boyandı. Tipik olarak gözlenen HLA-DR + hücrelerin yüzdesi aralığı değil Göstergeler olduğunu ed.

Şekil 4. CD11c + MDC. Thymus doku izolasyonu tek bir hücre süspansiyonu elde etmek üzere kollajenaz A / DNase kullanılarak sindirilmiştir. CD11c + MDC tek bir hücre süspansiyonu (% 0.6) arasında sadece küçük bir popülasyonu temsil etmektedir. Percoll yoğunluklu ayırma ile LDF hücrelerin zenginleştirilmesi sonra ~% 9 CD11c + hücrelerinin yüzdesi artmaktadır. LDF hücreler, CD11c-PE antikor ile etiketlenir ve daha sonra manyetik boncuk (anti-PE) kullanılarak izole edilmiştir. Doğrudan FACS manyetik hücre ayrılmasından sonra CD11c'nin + nüfusun Reanalysis% 93 saflığa işaret. büyük rakam görmek için buraya tıklayın .
0951/50951fig5.jpg "/>
Şekil 5,. CD45 lo / negatif hücre zenginleştirme ve TEC altkümelerinde CD45 yüzdelerini gösteren. A) Temsilcisi nokta araziler sonraki sıralama negatif / sırasıyla Perkol yoğunluk ayırma (% 9 ve% 16.2) önce ve sonra toplam tek hücre süspansiyonları düşük timik stromal hücreleri. (Mtec) veya EpCAM lo CDR2'de + (CTEC) - B) LDF hücreleri manyetik boncuk ve EpCAM hi CDR2'de olarak tükenmiş fraksiyonu sıralanır TEC alt kümelerini kullanarak CD45 hi hücreleri tükenmiş oldu.
| CD11c + MDC frekansları, hücre verimleri ve farklı donörlerin saflıkları | |||||||
| Verici | Yaş | Doku ağırlık | Örnek başına toplam hücre | Örnek başına hücre LDF | CD11c+% | CD11c + Örnek başına izole | CD11c + saflık |
| 1 | 5 gün | 7 g | 1.45 x 10 9 | 9,5 x10 7 | 12.6 | 2.4 x 10 6 | % 89 |
| 2 | 3 yıl | 15 g | 2 x 10 9 | 6,5 x10 7 | 4.3 | 1.9 x 10 6 | 81% |
| 3 | 21 gün | 9 g | 2.6 x 10 9 | 22 x10 7 | 10.3 | 3.6 x 10 6 | 93% |
| 4 | 6 yıl | 13 g | 1.4 x 10 9 | 25.4 x10 7 | 4.2 | 5.7 x 10 6 | 82% |
| 5 | 5 gün | 6.5 g | 1.3 x 10 9 | 16.2 x10 7 | 6 | 2.9 x 10 6 | % 91 |
| 6 | 39 gün | 3 g | 0.6 x 10 9 | 8 x10 7 | 3.4 | 1.3 x 10 6 | % 80 |
Tablo 1. İki sindirim mermi gibi Percoll ayrıldıktan sonra LDF hücre verimi sonra serbest tek bir hücre süspansiyonu, toplam hücre sayıları farklı yaş doku ağırlığının altı bireylerin timus örneklerinde yapılan izolasyon için gösterilmiştir. MDC Sıklıkları göre akış sitometrisi ile tespit edilmiştir Toplam LDF hücrelerde CD11c ifadesi üzerindeki (APC zenginleştirilmiş). Verim ve CD11c + hücrelerinin saflığı manyetik boncuk ayırma sonra her donör için gösterilmiştir.
Tartışmalar
Burada açıklanan protokol Götter ve arkadaşları tarafından yayımlanan 4 protokol bir modifikasyonudur. Protokolde kritik adım durumu ve doku ilk hazırlanması hem de Percoll yoğunluk ayrılması bulunmaktadır. Önemle kısa sürede toplandıktan sonra doku işlemek için tavsiye. Bu temizlik ve doku keserken hızlı ama iyice çalışmak önemlidir. Adım 2.3 'de tarif edilen timosit yıkama sırasında, stromal hücrelere zarar verebilir çok güçlü ve uzun süreli basınç doku parçaları üzerinde, şırınga pistonunun arka basınç uygularken, doğru denge bulmak için çok önemlidir. Bozulmaları neden olmadan Percoll çözeltisi / hücre süspansiyonu üzerine orta katman aynı zamanda, bazı uygulama gerektirebilir. Santrifüj işleminden sonra, bu mümkün olduğu kadar çabuk Percoll çözeltisi, minimum miktarda Percoll tabakanın tüm düşük yoğunluklu fraksiyon hücreleri toplamak için önemlidir.
genel hücre verimleri ve nispi APC numaralar (bkz. Tablo 1) çok değişken olabilir ve (özellikle yaşa göre) donör ve deneyci hazırlık becerilerine bağlıdır. Kısa bir bakış için, hücre süspansiyonları istediğiniz gibi protokol farklı adımlar aşağıdaki HLA-DR ve / veya diğer işaretleri ile boyanmış olabilir. Fenotipik analizi için kullanılan tüm antikorlar, en iyi sonuçları elde etmek için titre edilmelidir.
Izole edilmiş hücreler daha fazla sayıda arzu edildiği takdirde dolayı thymoctyes göre timus APC türlerine nispeten düşük bolluğu nedeniyle, timus daha büyük parçalar gerekli olabilir.
Bir doku ayıracı laboratuarda mevcut ise, bu ölçüde doku işleme hızlandırır, ama burada açıklanan her iki varyasyonları eşit derecede iyi çalışır. Nispeten sık görülen bir sorun, özellikle de ayırma ve Percoll MACS / FACS tasnifi arasındaki adımları sırasında, hücrelerin topaklanma olabilir. Bu durumda, kısa bir DNase I kazmakprotokol açıklandığı gibi estion genellikle sorunu çözecektir. Timus doku arda büyük vericiden yaşlanma, Thymi farklı sindirim aşamalarından elde edilen tek hücre süspansiyonları santrifüjden sonra tüp üstünde yüzer bazı yağ içerebilir sırasında yağ dokusu ile değiştirilir beri. Böyle bir durumda, yağ protokolü devam etmeden önce, bir pipet ile çıkarılmalıdır. En iyi sonuçlar hem de biz antikorları değil, aynı zamanda anti-PE, mikro-boncuklar, sadece titre etmek için tavsiye ekonomi nedenleriyle (bölüm 5 ve 6). Fare timüs TEC izolasyonu için, alternatif enzim karışımları TEC verimi 8,13 geliştirmek için tarif edilmiştir, ama biz insan dokusu ile onları test etmedim.
Prensip olarak, B hücreleri ve timus pDC gibi diğer APC ve stromal hücreler de ilgili işaretleyiciler bilinen durumunda FACS ayıklama / MACS ile (kolajenaz / DNase sindirim ve Percoll takip edilerek) LDF hücrelerden izole edilebilir. Örneğin, Pd-C, BDCA-2-BDCA için4 ve CD123 belirteçler 6,14 olarak tarif edilmiştir. Timosit alt kümelerinin analizi veya izolasyonu isteniyorsa oldukça saf ve minimal manipülasyon geçirmiş beri, biz, (adım 2.3) sıkarak yayımlanan hücreleri kullanarak öneririz.
Açıklamalar
Hiçbir çıkar çatışması ilan etti.
Teşekkürler
Biz CDR2 antikorun sağlanması için timus örnekler ve Bruno Kyewski (DKFZ, Heidelberg, Almanya) ile bize sağlamak için Göğüs Kalp ve Damar Cerrahisi Anabilim Dalı, Üniversite Kliniği Tuebingen cerrahlar için minnettarız. Biz de sıralama tesisinin (Tübingen Üniversitesi) Hans-Jörg Bühring ve Sabrina Grimm teşekkür etmek istiyorum. Bu çalışma SFB 685 ve hertie Vakfı tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents and Materials | |||
| RPMI 1640 | PAA | E15-842 | |
| Dulbecco's PBS | PAA | H15-002 | |
| Fetal Bovine Serum-Gold | PAA | A15-151 | |
| Bovine Serum Albumin | PAA | K41-001 | |
| Collagenase A | Roche | 10 103 586 001 | |
| DNase I, grade II bovine pancreatic | Roche | 10 104 159 001 | |
| Trypsin-EDTA 10x in PBS | PAA | L11-001 | stock conc. 20 mg/ml |
| Alexa Fluor 488 Protein Labelling kit | Molecular Probes | A-10235 | |
| anti-human CDR2 (purified) | Bruno Kyewski, DKFZ- Heidelberg, Germany | labeled with Alexa Fluor 488 | |
| anti-human CD45 (Pacific Blue) | Biolegend | 304022 | |
| anti-human EpCAM (APC) | Miltenyi Biotec | 130-091-254 | |
| anti-human CD11c (PE) | Miltenyi Biotec | 130-092-411 | |
| anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| anti-CD45 Microbeads, human | Miltenyi Biotec | 130-045-801 | |
| LS columns | Miltenyi Biotec | 130-042-401 | |
| gentleMACS C Tubes | Miltenyi Biotec | 130-093-237 | for tissue dissociator |
| Percoll (density 1.130 g/ml) | GE Healthcare, Life Sciences | 17-0891-01 | |
| Sterile distilled Water (DNAse/ RNAse free) | GIBCO | 10977-035 | |
| Gamunex 10% | Tajecris-Biotherapeutics | G120052 | 1:10 pre-dilution, use 20 μl/1 x 106cells |
| 0.22 μm filter | Millex GS | SLGS033SS | Syringe driven |
| Stericup filter unit | Millipore | SCGPU05RE | Pump driven |
| 50 ml PC oak ridge centrifuge tubes | Nalgene | 3118-0050 | 50 ml |
| 50 ml PP conical tubes | Becton Dickinson | 352070 | |
| 12 mm x 75 mm 5 ml test tubes | Becton Dickinson | 352058 | FACS stainings |
| Cell strainer 70 μm | Becton Dickinson | 352350 | |
| INSTRUMENTS | |||
| Flow Cytometer-Sorter (BD FACSAriaTMIIu) | Becton Dickinson | ||
| Sorvall Evolution R6 (rotor) | Kendro | ||
| Rotator REAX 2 | Heidolph | ||
| gentleMACS Dissociator | Miltenyi Biotec | 130-093 235 | tissue dissociator |
Referanslar
- Miller, J. F. A. P. The discovery of thymus function and of thymus-derived lymphocytes. Immunological Reviews. 185, 7-14 (2002).
- Klein, L., Hinterberger, M., Wirnsberger, G., Kyewski, B. Antigen presentation in the thymus for positive selection and central tolerance induction. Nat Rev Immunol. 9, 833-844 (2009).
- Vandenabeele, S., Hochrein, H., Mavaddat, N., Winkel, K., Shortman, K. Human thymus contains 2 distinct dendritic cell populations. Blood. 97, 1733-1741 (2001).
- Gotter, J., Brors, B., Hergenhahn, M., Kyewski, B. Medullary Epithelial Cells of the Human Thymus Express a Highly Diverse Selection of Tissue-specific Genes Colocalized in Chromosomal Clusters. The Journal of Experimental Medicine. 199, 155-166 (2004).
- Rouse, R. V., Bolin, L. M., Bender, J. R., Kyewski, B. A. Monoclonal antibodies reactive with subsets of mouse and human thymic epithelial cells. Journal of Histochemistry & Cytochemistry. 36, 1511-1517 (1988).
- Stoeckle, C., et al. Cathepsin S dominates autoantigen processing in human thymic dendritic cells. Journal of Autoimmunity. 38, 332-343 (2012).
- Woods Ignatoski, K. M., Bingham, E. L., Frome, L. K., Doherty, G. M. Directed trans-differentiation of thymus cells into parathyroid-like cells without genetic manipulation. Tissue Eng Part C Methods. 17, 1051-1059 (2011).
- Williams, K. M., et al. Single Cell Analysis of Complex Thymus Stromal Cell Populations: Rapid Thymic Epithelia Preparation Characterizes Radiation Injury. Clinical and Translational Science. 2, 279-285 (2009).
- Bendriss-Vermare, N., et al. Human thymus contains IFN-α-producing CD11c-, myeloid CD11c+, and mature interdigitating dendritic cells. The Journal of Clinical Investigation. 107, 835-844 (2001).
- Schmitt, N., et al. Ex vivo characterization of human thymic dendritic cell subsets. Immunobiology. 212, 167-177 (2007).
- Dzionek, A., et al. BDCA-4: Three Markers for Distinct Subsets of Dendritic Cells in Human Peripheral Blood. The Journal of Immunology. 165, 6037-6046 (2000).
- Wu, L., Shortman, K. Heterogeneity of thymic dendritic cells. Seminars in Immunology. 17, 304-312 (2005).
- Seach, N., Wong, K., Hammett, M., Boyd, R. L., Chidgey, A. P. Purified enzymes improve isolation and characterization of the adult thymic epithelium. Journal of Immunological Methods. 385, 23-34 (2012).
- Adamopoulou, E., Tenzer, S., Hillen, N., Klug, P., Rota, I. A., Tietz, S., Gebhardt, M., Stevanovic, S., Schild, H., et al. Exploring the MHC-peptide matrix of central tolerance in the human thymus. Nature Communications. , (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır