Method Article
Изоляция миелоидных дендритных клеток и эпителиальных клеток из человеческого тимуса
В этой статье
Резюме
Этот протокол детали способа, чтобы изолировать антиген представляющих клеток из человеческого тимуса через различные этапы ферментативного расщепления ткани с последующим плотности центрифугированием суспензии отдельных клеток и, наконец, магнитного и / или сортировки FACS клеточных популяций, представляющих интерес.
Аннотация
В этом протоколе мы предлагаем способ, чтобы изолировать дендритные клетки (ДК) и эпителиальные клетки (TEC) из человеческого тимуса. DC и TEC являются основным антигенпрезентирующие клеток (APC) типы найдено в нормальном тимусе и это хорошо известно, что они играют различные роли в процессе тимуса выбора. Эти клетки локализованы в отдельных микросреды в тимусе, и каждый тип APC составляет лишь незначительную популяцию клеток. Для дальнейшего понимания биологии этих типов клеток, характеристика этих клеточных популяций является весьма желательным, но из-за их низкой частоты, выделение любой из этих типов клеток требует эффективного и воспроизводимого процедуру. Этот протокол детали метод получения клеток, пригодных для характеризации различных свойств клеток. Тимуса ткани механически нарушается и после различных этапов ферментативного расщепления, в результате суспензию клеток обогащается с помощью центрифугирования шаг плотности Перколла. Для выделения миелоидной постоянного тока (CD11c <SUP> +), клетки из низкой плотности фракции (ЛДФ) являются immunoselected магнитным сортировки клеток. Обогащение ТИК населения (Mtec, CTEC) достигается за счет истощения гемопоэтических (CD45 привет) клеток из низкой плотности Перколла фракции клеток, позволяя их последующую изоляцию через флуоресценции Активированный сортировки клеток (FACS) с использованием специфических клеточных маркеров. Выделенные клетки могут быть использованы для различных последующих применений.
Введение
Тимус является органом, в котором происходит развитие Т-клеток. Его относительное и абсолютное размер уменьшается с возрастом, когда она становится последовательно заменены жира, хотя все еще активность тимуса могут быть обнаружены в пожилом возрасте. Его значение для иммунной реакции было продемонстрировано в начале 1960-х годов 1.
Ячейка репертуар T имеет форму при взаимодействии Т-клеточных рецепторов с пептид-МНС комплексов на разных видов тимуса APC, которые обеспечивают выживание или смерть сигналы к развитию Т-клеток, в результате чего в значительной степени функциональной и само-толерантный Т-клеток репертуара 2.
Приблизительно 98% клеток в человеческом тимуса разрабатывают Т-клетки, называемые тимоцитов. Оставшиеся 2% состоят из нескольких различных типов клеток, в том числе различные TEC (корковый, медуллярный, субкапсулярной), миелоидных и плазмацитоидных DC (MDC, PDC), макрофаги, В-клетки, зрелые повторно циркулирующих Т-клетки, гранулоциты, еibroblasts, эндотелиальные клетки и очень редкие эпителиальные клетки с фенотипом экспрессии напоминающий клеток из других тканей, таких как мышцы, нейроны и респираторном эпителии (рис. 1). Из них TEC и DC основные виды APC найдено в нормальном тимусе. В последние годы, очистка этих типов APC для культуры и молекулярной профилирования приобрел все больший интерес. Из-за их низкой частоты, изоляция любой из этих типов клеток для детального анализа требует эффективного, воспроизводимый и экономичную процедуру. Метод, представленный здесь является модификацией от ранее опубликованных исследований 3,4.
Как и в любой другой ткани, извлечение клеток из тимуса может быть достигнуто путем дезагрегирования ферментативно клетка-клетка и клетка-сетей матрицы взаимодействия, с тем чтобы получить суспензию единичных клеток. Есть определенные параметры, такие как хорошая эффективность диссоциации, выход клеток, жизнеспособность клеток и удержания клеток сПоверхность маркеры, которые имеют решающее значение и должны быть оптимизированы для успешного выделения этих редких клеточных популяций.
В этом протоколе, выделение постоянного тока и TEC подмножеств выполняется, сделав одной клеточной суспензии ткани с помощью механического разрушения и ферментативного расщепления. Мы используем коллагеназы А из Clostridium histolyticum, который имеет сбалансированное соотношение различных видов деятельности ферментных, чтобы сломать родной коллаген, который удерживает ткани вместе. ДНКазы I входит в ферментного раствора для снижения агрегации клеток за счет свободной ДНК от мертвых клеток (тимоцитов очень чувствительны). Мы также предлагаем альтернативный подход к типичному ферментативного переваривания ткани с участием механическую и ферментативную обработку тканей при содействии ткани диссоциатора. Одноклеточной суспензии затем подвергают одной Перколла плотности центрифугирования для обогащения низкой плотности фракции (LDF) клеток. С этой фракции клеток, DC, могут быть выделены путем окрашивания еили DC-поверхностные маркеры (т.е. CD11c +) и с помощью магнитной сепарации или флуоресценции Активированный сортировки клеток (FACS). В отличие от лимфоидных клеток, составляющих подавляющее большинство клеток в тимусе, TEC не выражают CD45 на высоких уровнях, но положительны для ЕрСАМ молекулы эпителиальной клеточной адгезии. CTEC можно отличить от мозгового TEC по экспрессии еще неопределенной антигена, признанной CDR-2 (коркового дендритных ретикулоцитов-2) антител 4,5 и несколько ниже выражения EpCAM. Дифференциальный коэкспрессия ЕрСАМ и CDR2 позволяет эффективно выделение этих ТИК подмножеств через высокоскоростной сортировки клеток 6.
Протокол, представленные здесь оптимизирован для человеческого тимуса ткани. Длительность процедуры зависит от количества ткани и способности экспериментатора, а также от скорости клеточного сортера, если используется FACS сортировки. Как правило, протокол для выделения DC может быть завершена в течение 5-6 Ч и для выделения TEC в 8-10 час. Изоляция постоянного и ТИК подмножеств из тимуса ткани чувствительным временем. Чем быстрее процедура изоляции, тем лучше состояние клеток. Наконец, изолированные клетки могут быть использованы для дальнейших исследований, таких как сравнительных исследований мРНК и белка, ПЦР экспериментов, изоляции белка, молекулярной профилирования (т.е. транскриптомика, микро-анализа РНК), а также клеточной культуре 6.
Заявление по этике
Для того, чтобы иметь возможность работать с человеческой ткани тимуса исследователь должен получить одобрение от местным комитетом по этике или ответственными органами, а также информированного письменного согласия донора (или обычно его или ее родителей, так как ткани, как правило, получают из несовершеннолетних детей). Кроме того, все ткани человека следует обращаться как с потенциально инфекционные и соответствующие меры должны быть приняты, такие как работа в перчатках, и т.д..
протокол
1. Подготовка Инструменты, растворы ферментов и буферов
Выполните следующие препаративные шаги до начала протокола.
- Инструментарий
Чистый, сухой и автоклав следующие инструменты и держать их в стерильной упаковке до их использования.- Небольшие острые ножницы с либо изогнутыми или прямыми советами для резки ткани тимуса. Небольшие пинцетов с зубчатыми советов для обработки ткани.
- 50 мл Oak Ridge Центрифуга Трубы, PC, для стадии центрифугирования Перколла плотности.
- Фермент решения
Подготовьте коллагеназы / ДНКазы I ферментной смеси (2 мг коллагеназы / мл и 0,1 мг ДНКазы I / мл) следующим образом:- Растворить 500 мг лиофилизированного коллагеназы A (Roche) в 250 мл RPMI 1640 простом (без FCS) с получением раствора 2 мг / мл коллагеназы. Коллагеназа довольно трудно растворяются, поэтому рекомендуется, чтобы оставить ему некоторое время на роликах шейкере при комнатной температуре.
- Растворите 100 мг ДНКазы I (Roche) в10 мл стерильной дистиллированной воды. 2,5 мл аликвоты можно хранить при -20 ° С. Добавить 2,5 мл 10 мг-аз I решения в растворе 2 мг коллагеназы A.
- Стерильный фильтр коллагеназы / ДНКазы смесь с помощью фильтра блока Stericup (0,22 мкм). Хранить в 10-20 мл аликвотах при -20 ° С до использования.
- Буферы и растворы
- 1,5 М NaCl раствор: растворить NaCl в дистиллированной стерильной воде до конечной концентрации 1,5 М. Раствор фильтруют через 0,22 мкм фильтр и хранят при комнатной температуре.
- 10x MACS буфер: 1x PBS (Са 2 + / Mg 2 +-бесплатно), содержащий 5% BSA и 20 мМ ЭДТА. Стерильный фильтр решение с фильтром 0,22 мкм и хранить при 4 ° С. Перед использованием приготовить раствор 1x разбавлением 10x акции, чтобы 1x в холодной стерильной 1x PBS.
- СУИМ буфера: 1x PBS (Са 2 + / Mg 2 +-бесплатно), содержащим 1% BSA и 0,02% NaN 3.
- СУИМ буфер для сортировки клеток: 1x PBS (Са 2 + / Mg 2 +-свободный), содержащего 2% БСА. Стерилизовать помощью шприц-фильтра 0,22 мкм и хранить при температуре 4 ° C.
2. Подготовка ткани
Обработка ткани должна быть выполнена с использованием стерильных реагенты и работу в шкафу с ламинарным потоком. Перед началом процедуры, подготовить следующие реагенты и оборудование:
- Теплый следующее до комнатной температуры: RPMI 1640 полную среду (RPMI 1640, 10% эмбриональной телячьей сыворотки, 1% перо / стрептококк), RPMI 1640 обычная, Са 2 + / Mg 2 + без PBS и 2x коллагеназы / ДНКаза раствор фермента.
- Теплый тепловых инкубатор с вращением блока до 37 ° С и прохладном Ротор с фиксированным углом центрифуге до 4 ° С.
- Подготовьте коробку со льдом.
Примечание: продолжительность этого этапа зависит от состояния и размера ткани. Примерно 20-30 минут будет достаточно времени, необходимое для среднего размера куска тиSSUE в хорошем состоянии (~ 5 см в ширину).
- Поместите ткань в чашке Петри, содержащей стерильную PBS и смыть все остатки крови.
- Добавить свежий PBS, чтобы предотвратить ткани от высыхания и с помощью щипцов и ножниц очистки ткани от сгустков крови, соединительной и жировой ткани и любой части, которая не выглядит здоровым.
- Позаботьтесь, чтобы удалить некротические ткани, что позволит увеличить количество мусора.
- После очистки, весят ткани для справки.
- Разрежьте ткань примерно в 1 см 3 части / блоки. Добавьте достаточно PBS, чтобы покрыть ткань.
Примечание: Для воспроизводимости результатов, ткань должна быть разрезана на куски одинакового размера.
- Используя спину стерильный шприц (10-20 мл) оказать давление (не слишком энергичную или продолжительное) на тимуса куски ткани. Эта процедура будет удалить большую часть тимоцитов, тем самым уменьшая объем тканей к быть переварены позже. Выполните этот шаг на льду и работать быстро.
- Решение станет визуально мутными, как тимоциты освобождаются. Размешайте блюдо осторожно, а затем с помощью 5 мл пипетки или стеклянной аспиратором удалить супернатант, содержащий тимоцитов, стараясь не случайно аспирации Кусочки ткани.
Подсказка: стерильный культуры клеток скребок может быть использован сосредоточить все кусочки ткани на одной стороне тарелки затем наклонить тарелку (45 °) углом и аспирации супернатант. Замените свежим PBS и повторите эту процедуру до тех пор, как супернатант относительно прозрачной. Выполните последнюю промывку с RPMI равнине.
- Фарш кусочки ткани с использованием острыми ножницами (как тонко, как это возможно, фрагменты должно быть не менее 2-4 мм). Фрагменты должны быть достаточно малыми, чтобы ввести 5-мл пипетки.
3. Подготовка Единой клеточной суспензии из ткани тимуса
Здесь,два альтернативных подхода для этого шага описаны. Первый подход описывает типичный ферментативную ткани пищеварение (раздел 3.1) а второй включает в себя механическую и ферментативную обработку тканей при содействии ткани диссоциатора (раздел 3.2).
Этот протокол оптимизирован для обработки образцов тканей весом 5 г. Для образцов больших или меньших ткани, отрегулируйте объемы фермента соответственно.
3.1 Типичные ткани пищеварения ферментативная получить суспензии отдельных клеток
- Поместите пюре ткани в 50 мл пробирки с 10 мл коллагеназы / ДНКазы раствора на 5 г ткани. Добавить RPMI равнину, чтобы дать общий объем 20 мл.
Примечание: в 50 мл пробирку переваривать до 10 г ткани. Регулировка громкости фермента соответственно.
- Инкубируйте тканевой суспензии в течение 40 мин при 37 ° С при медленном вращении в тепловом инкубаторе.
Примечание: этапов инкубации могут быть выполнены либо в тепловом инкубаторе с блоком вращения, или в 37 ° C инкубаторе с бактериальной шейкере.
- Раствор фермента будет мутнеет как клетки попадают в него. В конце варки, центрифужную пробирку при 110 х г в течение 2 мин в осадок фрагментов ткани.
- Сбор супернатант из этой пищеварения раунде. Гранул клеточной суспензии в течение 10 мин при 400 х г. Аспирируйте супернатант и ресуспендирования клеток в 10-50 мл RPMI комплектные в зависимости от размера клеточного осадка.
- Держите клеточной суспензии в 37 ° С инкубатор с крышкой рыхлой.
- Если большие количества клеток желательно, шаг пищеварение могут быть повторены с остальными фрагментов ткани и первый и второй переварить объединяли. Кроме того, если TEC должны быть изолированы, должны быть выполнены два раунда пищеварения.
- Развести аликвоту клеточной суспензии в трипанового синего (1:10-1:100) и подсчет жизнеспособных клеток с помощью гемоцитометра.
- Держать клетки при 37 ° С в инкубаторе, пока готов приступить к плотности центрифугирования Перколла (раздел 4). Последующее выделение подмножеств постоянного тока (раздел 5) будет выполняться из этих клеток.
Примечание: тимуса ткани может меняться в их составе, особенно с возрастом, что влияет на эффективность пищеварения и генерацию одного клеточной суспензии.
- Для последующего выделения тимуса эпителиальных клеток (TEC) третий раунд ферментативного расщепления не требуется. Ресуспендируйте ткани остатки в 10 мл свежего раствора коллагеназы / аз плюс 10 мл RPMI простой и добавить трипсин / EDTA (1:50 от 2,5% акций) в растворе.
- Инкубируют при 37 ° С в течение 40 мин при осторожном вращении. В течение последнего 10 - 15 мин инкубации добавить FCS (1:5), чтобы нейтрализовать активность трипсина.
- Центрифуга при 110 х г в течение 2 мин при комнатной температуре дл осаждени фрагментов ткани.
Примечание: ткань не может быть полностью переваривается после этих трех раундов пищеварения. Возраст и общее состояние ткани два параметра, которые влияют на эффективность диссоциации вилочковой ткани.
- Соберите клеток супернатант и отказаться от осевших фрагментов тканей.
- Центрифуга клеточного супернатанта при 400 х г в течение 10 мин. Аспирируйте супернатант и осадок ресуспендируют клеток в RPMI полной.
Совет: Клеточные осадки довольно свободные, так что будьте аккуратнее при отбрасывая / аспирационных супернатант.
- Подсчет жизнеспособных клеток с помощью гемоцитометра. Поместите клетки в инкубаторе 37 ° C до приступить к Перколла разделение (раздел 4). После предварительного обогащения ТИК клеток истощения CD45 привет клеток будет производиться из этих клеток (раздел 6).
3.2 Механические и ферментативная обработка ткани оказывает помощь ткани диссоциатора
Использование ткани Диссоциатор подойти шаги ткани пищеварения может быть уменьшена до половины времени, необходимого с подходом, описанным выше (раздел 3.1). Следующий протокол представляет собой модифицированную версию того, что используется для диссоциации мыши тимуса ткани для выделения TEC 7,8.
- Передача 5 г измельченных кусков ткани (шаг 2.5) в C Tube, содержащую 10 мл коллагеназы / ДНКазы раствора.
- Адаптация C трубки на диссоциатора тканей и программы выполнения m_spleen_02 (10 сек). Повторите эту программу 4-5x (40-50 сек).
- Выдержите с легким вращением в течение 20 мин при 37 ° С
- Центрифуга при 110 х г в течение 2 мин при комнатной температуре.
- Сбор супернатант и действуйте в шаге 3.1.4. Добавьте 10 мл свежего раствора коллагеназы / ДНКазы.
- Адаптация C трубки на диссоциатора тканей и программы выполнения m_spleen_01 (56 сек).
- Инкубируют при 37 ° С в течение 20 мин при осторожном вращении.
- Центрифуга при 110 х г в течение 2 мин при комнатной температуре.
- Сборник принципиальныхТ-клеток супернатанта и осадка клеточной суспензии в течение 10 мин при 400 х г. Действуйте в шаге 3.1.4.
- Как описано в 3.1.9 третий раунд пищеварения необходима для последующего выделения тимуса эпителиальных клеток (TEC). Для этого, ресуспендируют ткани остатки в 10 мл свежего раствора коллагеназы / ДНКазы плюс трипсина / EDTA (1:50 разбавление в наличии 2,5%)
- Инкубировать при 37 ° С в течение еще 20 мин при осторожном вращении. Добавить FCS (1:5) и выдержать в течение еще 10 мин.
Примечание: Используя этот подход, после этого в прошлом пищеварение шаг ткань, как правило, полностью диссоциирует и не наблюдается непереваренные фрагменты ткани.
- Действуйте с шагом 3.1.11-3.1.14.
4. Обогащение LDF ячеек, используя Перколла плотности Разделение
После ферментативного расщепления ткани, всего тимуса одноклеточные суспензии подвергают одной Перколла плотности centrifugatионный шаг, чтобы обогатить для ЛДФ клеток. LDF клеток высоко обогащенные для АПК. Оба DC и TEC обнаружены в этой фракции клеток.
- Используйте суспензии отдельных клеток, полученной из 1-й и 2-й переваривает для изоляции MDC (объединенных ячеек, см. шаг 3.1.8) или 3-й сборник (для изоляции TEC) (3.1.14). Центрифуга суспензии отдельных клеток получают из каждой стадии варки при 400 х г в течение 10 мин.
- Приготовьте раствор Перколла с конечной плотности 1,07 г / мл в течение этого мыть стадии (см. пример в таблице ниже).
Подготовка Перколла раствора до конечной концентрации 1,07 г / мл (ρ = 1,07) Труба номер 1 2 3 4 Неразведенный Перколла (ρ = 1,130) (мл) 2.96 5.92 8.88 11.84 1,5 М NaCl (мл) 0,6 1.20 1.8 2.4 дистиллированной H 2 O (мл) 2.44 4.88 7.32 9.76 Объем конечного готового раствора 6 мл 12 мл 18 мл 24 мл - Количество Перколл труб зависит от количества клеток, определяемых с шагом 3.1.8 и / или 3.1.14. Объедините стерильные растворы и тщательно перемешать. Для оптимальной изоляции, 0.6-1 х 10 9 клеток может быть загружен в трубке Перколла. Объедините стерильные растворы и тщательно перемешать.
Совет: Перколла является светочувствительным и, кроме того следует иметь холодно. Подготовка сначала смеси, содержащей NaCl и H 2 O (RT) и добавить в неразбавленном Перколла последним, непосредственно перед ресуспендирования клеток в растворе Перколла.
палатка "> Примечание: плотность Перколла может варьироваться от различных поставщиков и партиями Если плотность неразбавленном растворе Перколла не равна 1,130 г / мл, используйте инструкции, предоставленные производителем, чтобы вычислить точное количество Перколла и Н 2 О требуется, чтобы получить конечную плотность 1,07 г / мл.- Ресуспендируют до 1 х 10 9 клеток в 6 мл приготовленного раствора Перколла (ρ = 1,07), смешать достаточно, чтобы получить однородную суспензию, и трансфер в 50 мл Oak Ridge поликарбонат винтовой крышкой трубки центрифуги.
- Осторожно слой 30 мл RPMI полной на трубе с помощью пипетки на верхней части решение Перколла / клеточной суспензии. Загрузите среду медленно, так что он остается на верхней части подвески и заботиться, чтобы не нарушить слой.
- Взвесьте трубок, чтобы убедиться, что они имеют равные веса так, чтобы они были сбалансированы во время центрифугирования. Если это не так, осторожно добавить больше среды в легкой трубки (под улусловия erile).
- Тщательно передачи трубки в предварительно охлажденной центрифуге с ротором фиксированным углом, и спина в 3500 х г в течение 35 мин при 4 ° С с тормозом выключен. Убедитесь, что температура центрифуги в не больше, чем 4 ° С.
- Снимите трубки из центрифуги и тщательно собирать обогащенного APC, найденный в интерфазе между Перколла и среды (низкой плотности фракции) из каждой пробирки с помощью стерильного пипетки Пастера. Передача клеток в 50 мл пробирку, содержащую холодный RPMI полной. Заполните трубку для того, чтобы разбавить из оставшегося Перколла.
- Центрифуга клеточной суспензии в течение 10 мин при 300 х г при 4 ° С. Удалите супернатант и повторите мытье.
- Ресуспендируют осадок клеток в среде и определить количество клеток (с использованием трипанового синего и гемоцитометра). По нашему опыту, процент клеток LDF примерно 2-20% от общего суспензии отдельных клеток, полученной после ферментативного расщепления. Типичный удно сть из низкой плотности, обогащенных клеток (из молодой тимуса, диапазон 1 день-2 лет) является 1x10 8 клеток на 1 х 10 9, что составляет 10% от совокупного отдельных клеток клеточной суспензии.
Примечание: На данном этапе, вы можете заметить, что клетки объединяются в суспензии (особенно с образцами от детей старшего возраста). Сотовые сгустки являются признаком гибели клеток и результат от выпуска ДНК из умирающих клеток, которые могут придерживаться клетки вместе. В таком случае, добавьте ДНКазы I в образце (50 мкг / мл) и инкубировали в течение его до 20 мин при комнатной температуре (осторожно инвертируют каждые 5 мин) переварить свободные молекулы ДНК.
5. Выделение тимуса MDC
После APC обогащения (через отделения Перколла), MDC могут быть эффективно изолированы от LDF после первого и второго раунда ферментативных расщеплений. Следующий протокол представляет собой модифицированную версию разделения магнитного клеток для выделения MDC (CD11c +).
- Центрифуга APC обогащенный клетки, выделенные из суспензии отдельных клеток, полученной из объединенных первого и второго ферментативного расщепления при 300 х г в течение 10 мин при 4 ° С и гранулы ресуспендируют клеток в 100 мкл буфера MACS на 10 7 клеток.
- Добавьте 5 мкл CD11c-PE антитела на 10 7 клеток.
Примечание: титрования эксперименты рекомендованы для достижения оптимальных результатов.
- Все хорошо перемешать и выдержать в течение 15 мин при 4 ° С, в защищенном от света.
- Вымойте клеток путем добавления 1-2 мл MACS буфера на 10 7 клеток и центрифуге при 300 мкг в течение 10 мин.
- Аспирируйте супернатант полностью и ресуспендируйте до 10 7 клеток в 80 мкл MACS буфера.
- Добавить 20 мкл анти-PE микрошарики на 10 7 клеток.
- Хорошо перемешать (не Vortex) и выдержать в течение 15 мин при 4 ° С в защищенном от света.
- Повторите, как в пункте 5.4.
- Ресуспендируют до 10 8 клеток в 500 мкл буфера.
- При необходимости фильтр суспензию клеток с использованием 40 мкм ячейки фильтра для удаления мусора и клеточных агрегатов, которые могут препятствующих свободному прохождению колонны.
- Используйте столбец LS с тимус клеточные суспензии поток лучше через колонки LS. Подготовить колонку LS в соответствии с инструкциями изготовителя. Внесите клеточной суспензии медленно в колонке избегая образования пузырьков. Используйте одну колонку на каждые 1 х 10 8 клеток.
- Промывной колонны в соответствии с инструкциями изготовителя. Удалить столбец из магнита и поместить его в стерильные 12 мл с круглым дном полипропиленовую трубку. Добавить 3 мл буфера MACS на колонку и собирают магнитно-меченых клеток путем вставки и прочно толкает поршень в колонку.
- Соберите элюированную долю, представляющую CD11c + MDC и центрифуги при 400 мкг в течение 6 мин.
- Определение количества клеток и подтвердить чистоту выбранной ячейки populatiна с помощью анализа проточной цитометрии. Предлагаемые маркеры включают CD45, CD11c и HLA-DR.
Примечание: CD11c + MDC также могут быть выделены с помощью FACS сортировщик.
6. Обогащение CD45 вот / нег клеток для сортировки клеток ТЭМ
Для выделения TEC, клетки могут быть предварительно обогащен истощения CD45 привет клеток с использованием CD45 микрошарики, для того, чтобы ускорить их изоляции через сортировки клеток.
Использование суспензии отдельных клеток, полученную из пищеварения шаге 3-м (3.1.14), а затем разделенные Перколла центрифугированием.
- Центрифуга клеточной суспензии при 300 х г в течение 10 мин при 4 ° С и гранулы ресуспендируют клеток в 80 мкл буфера MACS на 10 7 клеток.
- Используйте CD45 микрошарики на 1/3 рекомендуемого количества (6,7 мкл) на 10 7 клеток.
Примечание: При использовании меньшего количестваиз микросфер мы предварительно обогатить клетки как для CD45 Ло и CD45 нег клеток. Титрование рекомендуется для достижения оптимальных результатов.
- Хорошо перемешать, аккуратно стряхивая трубку (не Vortex) и инкубировать 15 мин при 4 ° С.
- Вымойте несвязанные микросферы, добавив 10 мл буфера MACS и центрифуги в течение 10 мин при 300 х г при 4 ° С. Аспирируйте супернатант полностью.
- Ресуспендируют до 10 8 клеток в 500 мкл буфера.
- При необходимости фильтр суспензию клеток с использованием 70 мкм ячейки фильтра для удаления мусора и клеточных агрегатов, которые могут препятствующих свободному прохождению колонны.
- Используйте столбец LS с тимус клеточные суспензии поток лучше через колонки LS. Подготовить колонку LS в соответствии с инструкциями изготовителя. Внесите клеточной суспензии медленно в колонке избегая образования пузырьков. Используйте одну колонку на каждые 10 8 клеток.
- Сбор немеченые клетки (проточный, автомойки), содержащиеCD45 вот / нег фракция клеток и мыть колонку в соответствии с инструкциями изготовителя.
- Центрифуга при 300 х г в течение 10 мин при 4 ° С и осадок клеток ресуспендируют в стерильном буфере FACS с целью определения количества клеток и приступить к окрашиванию для сортировки клеток.
7. Пятно Клетки для сортировки клеток с возбуждением флуоресценции
- Выполните FcR блокирование до окрашивания клеток, с тем чтобы уменьшить неспецифическую связывания антитела. Инкубируйте клеточной суспензии с объединенной иммуноглобулинов раствор в течение 15 мин при комнатной температуре. Эти реагенты коммерчески доступны (например, Gammunex 10% раствор).
- Вымойте клеток путем добавления холодной стерильной буфер FACS. Центрифуга при 400 х г в течение 6 мин при 4 ° С.
- Удалите супернатант и ресуспендирования клеток в холодной стерильной буфера FACS. Подготовьте 5 образцов в соответствии со следующим примером:
Образец Тип пробы Антитело Количество сотовых Общий объем 1. незапятнанный контроль 1 х 10 6 50 мкл 2.scc *-Pacific Blue контроль CD45-Pacific Blue 1 х 10 6 50 мкл 3. SCC-APC контроль CD3-APC 1 х 10 6 50 мкл 4.scc-Alexa 488 контроль CD8-Alexa 488 1 х 10 6 50 мкл 5. Сотовый сортировка анализируемого CD45-Pacific Blue
EpCAM-APC
CDR2-Alexa 48810 х 10 6 - 50 х 10 6 500 мкл
10 х 10 6 клеток/100 мкл* SCC; единый орган управления, цвет
- Инкубируйте клетки с антителами в течение 30 мин, на льду в темноте.
- Промыть два раза FACS буфере клетки центрифугированием при 400 х г в течение 6 мин при 4 ° С.
- Отрегулируйте концентрацию клеток пробы должны быть отсортированы по 1 x10 7 клеток / мл (или к концентрации, рекомендованной сортировки объекта клеток) с использованием стерильных СУИМ буфер для сортировки клеток (т.е. без NaN 3).
- Pass образец клеток через 70 мкм ячейки фильтра, чтобы удалить любые клеточные скопления, которые могут засорить цитометра во время сортировки.
- Ресуспендируют контрольные образцы в 200-400 мкл буфера. Хранить пробирки на лед и защищенном от света месте.
- Подготовка сбора трубки со средой.
Примечания:
- Выполните титрование антител для оптимального окрашивания.
- В одном образце для сортировки, до 50 х 10 6 клеток могут быть окрашены в общем реакционном объеме500 мкл.
- Выполните окрашивание образца, чтобы быть отсортированы в 5 мл сокола полистирола круглым дном трубки. Отдельные средства управления цвета могут быть окрашены в отдельных лунках 96-луночного планшета с.
- С TEC подмножества редкие популяции, целесообразно использовать еще один положительный маркер (высокой частоты) для каждого флуорохромом чтобы облегчить определение правильной настройки FACS и чтобы убедиться, что у вас есть надлежащую компенсацию, если выбор флуорохромами требует компенсации. Клетки из фракции CD45 + могут быть окрашены с маркеров, таких как CD45, CD3 или CD8 для различных флюорохромами и после окрашивания неокрашенные клетки CD45 + могут быть добавлены к пробе.
8. Выделение TEC с помощью флуоресцентной сортировки клеток с активированным
TEC подмножества могут быть отсортированы от CD45 вот / нег фракции как EpCAM привет CDR2 - (Mtec) или EpCAM вот CDR2 + (CTEC).
- Запустите образец остроумияч, что неокрашенные клетки и отрегулировать вперед и стороной разброс тем, чтобы разместить население интерес к шкале. Отрегулируйте напряжение на каждого детектора, так что клетки могут видеть, но находится в дальнем левом ручной части гистограммы.
- Запуск каждого отдельного окрашенных образец и отрегулировать коррекцию для каждого цвета.
- После регулировки напряжения и компенсации за неокрашенных и отдельных окрашенных управления запустить образец должны быть отсортированы и использование стробирующие инструменты для определения население интерес. Используйте широкий вперед и стороны разброса ворота обеспечить включение всех размеров клеток стромы, в то время как без учета остатков клеток.
- На точечной участок с CD45-Pacific Blue против рассеяния вперед ворот на CD45 с низким и CD45 клеток нег.
- Применить эти ворота к ЕрСАМ против CDR2 точка участка и определить путем стробирования популяции, которые необходимо отсортировать.
- После того, как ворота были определены, выберите ворота, содержащие популяции интерес и начать сортировку.
- После сортировки клетки были собраны, центрифуге суспензию клеток, и ресуспендирования клеток в среде или буфера выбора в зависимости предполагаемого ниже по потоку приложения.
Примечание: В процессе сортировки, чтобы предотвратить клетки от прилипания к сторонам пробирку, пробирку может быть предварительно покрыты путем заполнения его с 50% FCS в PBS и инкубируют при комнатной температуре в течение 30 мин. Отменить решение покрытия, прежде чем добавлять медиа-коллекцией.
Результаты
В качестве исходного материала в этом протоколе мы используем ткани тимуса удалены из детей, которые проходят по исправлению сердечно-сосудистой хирургии (Отделение торакальной и сердечно-сосудистой хирургии, университетской клинике Тюбинген), полученных после информированного согласия и под ведомственным руководящим принципам. Это отбрасываются материал может сильно варьироваться в размере от 2-30 г или более. , Которые получены число MDC и TEC подмножества (CTEC и Mtec) зависит от размера, а также от возраста образца ткани вилочковой используемого для изоляции.
Рисунок 2 показывает довольно большой кусок ткани (~ 9 см), полученный из шестилетнего ребенка. Важным первым препарат шагом в этом протоколе является очистка ткани от нежелательных частей (обозначенных белыми стрелками).
Тимус ткани обрабатывали, как описано в разделах 2 и 3.1 протокола для получения суспензии отдельных клеток, которая была отделена с помощью одного плотности Перколла центрифугирования секТЭП В то время как суспензии отдельных клеток содержит приблизительно 3% HLA-DR + клеток (фиг. 3A), после центрифугирования Перколла этот процент возрастает в низкой плотности (LDF фракции), содержащий крупногабаритных клетки, в то время как 15-40% высокой плотности доля (HDF), которая состоит в основном из единых малогабаритных тимоцитов содержит практически нет таких клеток (рис. 3б). Фракцию интерес (LDF), содержащая обогащенный APC впоследствии собирают и промывают, чтобы собрать клетки для использования в последующих стадий выделения.
В то время как MDC тимуса можно определить по выражению ряда поверхностных маркеров, в том числе CD11c9, 10, PDC выразить маркеры, такие как BDCA-2, BDCA-4, CD45RA и CD123 11,12. После обогащения LDF клеток, оба типа клеток составляют 2-10% этой фракции, что позволяет их эффективное выделение также в больших количествах, либо путем разделения магнитного потока клеток или сортировки CD11c + или BDCA-4 +клетки 6.
Рисунок 4 показывает эффективную изоляцию CD11c + клеток с помощью модифицированного протокола разделения магнитная ячейка, описанный в разделе 5. После выделения, чистота CD11c + DC составил 93%, как установлено иммунным окрашиванием изолированных клеток. В среднем, восстановление изолированной CD11c + DC составляет 5 × 10 5 -5 × 10 6 MDC на 10 9 общих клеток тимуса. Таблица 1 показывает данные, полученные из нескольких отдельных тимуса образцов разного возраста и веса ткани с диапазоном входных одной клеточные суспензии, а также общее количество LDF и последующее CD11c + выход и чистота.
В APC обогащенную фракцию, только около 0,5% клеток являются CD45 + ло EpCAM или CD45 + отр EpCAM. CTEC и Mtec могут быть отсортированы от трипсиноподобных переваривается CD45 вот / нег обогащенных стромальных клеток как EpCAM л о CDR2 + и EpCAM привет CDR2 - соответственно, как показано на рисунке 5.
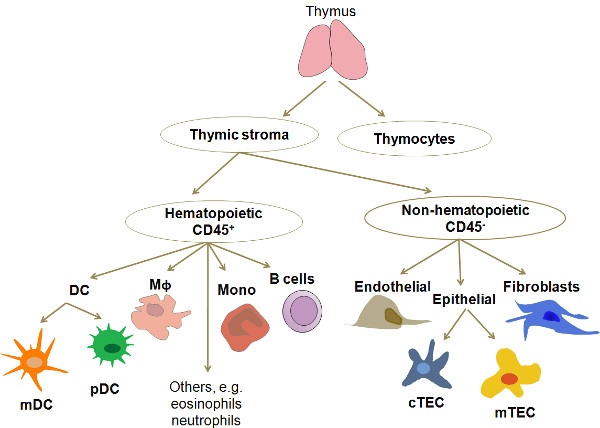
Рисунок 1. Упрощенная схема клеточной организации и состава человеческого тимуса. Тимус состоит из тимоцитов, на разных этапах созревания и гетерогенный сотовой сети называют тимуса стромы тимуса, образующей окружающую среду. Основные типы клеток тимуса стромы являются MDC и PDC, эпителиальные клетки (разделить на две основные категории в соответствии с их локализации в мочке: корковых и мозговое) и макрофаги Сокращения: DC, дендритные клетки; MDC, миелоидных дендритных клеток;. PDC, плазмацитоидных дендритные клетки; М ^, макрофагов; моно, моноциты; CTEC, корковых эпителиальные клетки; Mtec, медуллярные эпителиальные клетки.
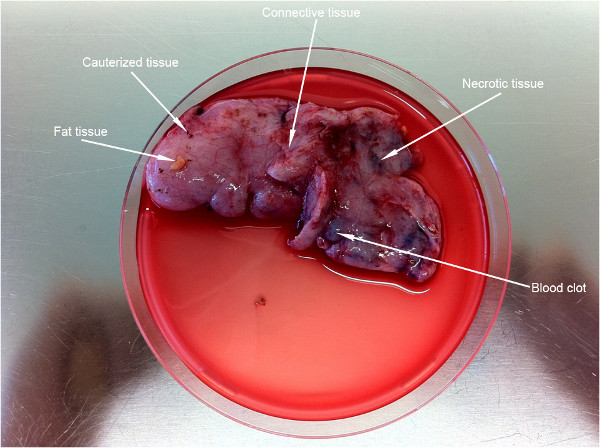
Рисунок 2. Первый шаг препаративной ткани для одноклеточных препарата. Стрелки указывают на части нежелательных тканей, которые должны быть отброшены до выполнения протокола.

Рисунок 3. Очистка тимуса APC. FACS анализа различных этапах процедуры очистки. Холост клеточные суспензии из ткани тимуса были получены путем механического разрушения и серийных ферментативных пищеварения и APC обогащенный (LDF клетки) путем разделения Перколла плотности. Клетки до (а) и после (B) отделение Перколла плотности окрашивали HLA-DR-PE антителами, чтобы проверить для обогащения APC. Процент спектр HLA-DR + клеток обычно наблюдаемых является индикации издание

Рисунок 4. Выделение CD11c + MDC. Ткани тимуса расщепляли с помощью коллагеназы A / ДНКазу я создать суспензии отдельных клеток. CD11c + MDC представляют лишь незначительную население суспензии отдельных клеток (0,6%). После обогащения ЛДФ клеток через отделения Перколла плотности процент CD11c + клеток увеличивается до ~ 9%. В LDF клетки метили CD11c-PE антителами, а затем выделена с использованием магнитных шариков (анти-PE). Повторный анализ CD11c + населением непосредственно после отделения магнитно-клеток с помощью FACS указано 93% чистоты. Нажмите здесь, чтобы увеличить рисунок .
0951/50951fig5.jpg "/>
Рисунок 5. Обогащение CD45 вот / нег клеток и последовательная сортировка ТИК подмножеств. A) Характерные точечные участки, показывающие процент CD45 отрицательный / LOW тимуса стромальных клеток при общей одноклеточных суспензий до и после разделения Перколла плотности (9% и 16,2%, соответственно). Б) LDF клетки был исчерпан из CD45 привет клеток с использованием магнитных шариков и ТИК подмножества Начиная от обедненного фракции как EpCAM привет CDR2 - (Mtec) или EpCAM вот CDR2 + (CTEC).
| CD11c + MDC частоты, выходы клеток и чистота различных доноров | |||||||
| Донор | Возраст | Вес ткани | Всего клеток на образце | LDF клеток на образце | CD11c+% | CD11c + изолированы на образец | CD11c + чистота |
| 1 | 5 дней | 7 г | 1,45 х 10 9 | 9.5 x10 7 | 12.6 | 2,4 х 10 6 | 89% |
| 2 | 3 года | 15 г | 2 х 10 9 | 6.5 x10 7 | 4.3 | 1,9 х 10 6 | 81% |
| 3 | 21 дней | 9 г | 2,6 х 10 9 | 22 x10 7 | 10.3 | 3,6 х 10 6 | 93% |
| 4 | 6 лет | 13 г | 1,4 х 10 9 | 25,4 x10 7 | 4.2 | 5,7 х 10 6 | 82% |
| 5 | 5 дней | 6,5 г | 1,3 х 10 9 | 16.2 x10 7 | 6 | 2,9 х 10 6 | 91% |
| 6 | 39 дней | 3 г | 0,6 х 10 9 | 8 x10 7 | 3.4 | 1,3 х 10 6 | 80% |
Таблица 1. Числа от общего числа одиноких клеточной суспензии клеток, выпущенных после двух туров пищеварения, а также выходами ЛДФ клеток после разделения Перколла показаны для выделений, выполненных в тимуса образцов шести особей разного возраста и веса ткани. Частоты MDC были определены с помощью проточной цитометрии основе на CD11c экспрессии в общем объеме LDF клеток (АРС обогащенный). Выход и чистота CD11c + клетки после разделения магнитного бисера показаны для каждого отдельного донора.
Обсуждение
Протокол, описанный здесь, является модификацией протокола опубликован Götter и др. 4. Критические шаги в протоколе являются состояние и начальная подготовка ткани, а также разделение плотность Перколла. Мы настоятельно рекомендуем, чтобы обработать ткань как можно скорее после сбора. Важно работать быстро, но тщательно при очистке и резки ткани. Во время тимоцитов стирки, описанной в шаге 2.3, очень важно найти правильный баланс при применении давления с задней поршень шприца на ткани куски, как слишком энергичной и продолжительной давления может привести к повреждению стромальных клеток. Расслоение среды в верхней части Перколла раствора / суспензии клеток, не вызывая возмущения также может потребоваться некоторая практика. После центрифугирования, важно, чтобы собрать все фракции низкой плотности клеток как можно быстрее от слоя Перколла с минимальным количеством раствора перколла.
общий выход клеток и относительные числа APC могут быть самыми разными (см. таблицу 1) и зависят от донора (особенно с учетом возраста) и препаративных навыков экспериментатора. Для краткого обзора, клеточные суспензии могут быть окрашены с HLA-DR и / или других маркеров следующее различных этапах протокола по желанию. Все антитела, используемые для фенотипического анализа следует подбирать для достижения оптимальных результатов.
Из-за относительно низкой численности видов APC в тимусе по сравнению с thymoctyes, более крупные куски тимуса может потребоваться, если более высокие числа изолированных клеток желательны.
Если ткань Диссоциатор доступна в лаборатории, это значительно ускорить обработку тканей, но обе вариации, описанные здесь одинаково хорошо работать. Относительно частое проблема может быть слипания клеток, особенно во время стадий разделения между Перколла и MACS / FACS сортировки. В этом случае, в нескольких минутах ДНКаза я роюestion, как описано в протоколе, как правило, решить эту проблему. Так как тимус ткань последовательно заменены жировой ткани во время старения, Thymi от старых доноров может содержать некоторое количество жира, который будет плавать на верхней части трубки после центрифугирования одноклеточных суспензий, полученных из различных этапов пищеварения. В таком случае, жир должны быть удалены с помощью пипетки, прежде чем продолжить протокол. Для получения оптимальных результатов, а также соображениям экономии мы рекомендуем для титрования не только антитела, но и микрошарики анти-PE (разделы 5 и 6). Для выделения TEC от мыши тимуса, альтернативные смеси ферментов, были описаны для повышения TEC выход 8,13, но мы не проверяли их с человеческой ткани.
В принципе, другие тимуса APC и стромальные клетки, такие как В-клетки и PDC также могут быть выделены из клеток (LDF следующих коллагеназа / ДНКазы пищеварения и перколлом) по FACS / MACS сортировки если соответствующие маркеры известны. Например, для PDC, BDCA-2, BDCA-4 и CD123 были описаны в качестве маркеров 6,14. Если анализ или изоляция тимоцитов подмножеств желательно, мы рекомендуем использовать клетки, выпущенные сжимая (шаг 2.3), так как они довольно чистый и претерпели минимальные манипуляции.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы благодарны хирургов кафедрой торакальной и сердечно-сосудистой хирургии, университетской клинике Тюбинген за предоставление нам образцов тимуса и Бруно Kyewski (DKFZ, Гейдельберг, Германия) за предоставление антитела CDR2. Мы также хотели бы поблагодарить Ханс-Йорг Bühring и Сабрина Гримм от сортировочной установки (Университет Тюбинген). Эта работа была поддержана SFB 685 и Херти.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents and Materials | |||
| RPMI 1640 | PAA | E15-842 | |
| Dulbecco's PBS | PAA | H15-002 | |
| Fetal Bovine Serum-Gold | PAA | A15-151 | |
| Bovine Serum Albumin | PAA | K41-001 | |
| Collagenase A | Roche | 10 103 586 001 | |
| DNase I, grade II bovine pancreatic | Roche | 10 104 159 001 | |
| Trypsin-EDTA 10x in PBS | PAA | L11-001 | stock conc. 20 mg/ml |
| Alexa Fluor 488 Protein Labelling kit | Molecular Probes | A-10235 | |
| anti-human CDR2 (purified) | Bruno Kyewski, DKFZ- Heidelberg, Germany | labeled with Alexa Fluor 488 | |
| anti-human CD45 (Pacific Blue) | Biolegend | 304022 | |
| anti-human EpCAM (APC) | Miltenyi Biotec | 130-091-254 | |
| anti-human CD11c (PE) | Miltenyi Biotec | 130-092-411 | |
| anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| anti-CD45 Microbeads, human | Miltenyi Biotec | 130-045-801 | |
| LS columns | Miltenyi Biotec | 130-042-401 | |
| gentleMACS C Tubes | Miltenyi Biotec | 130-093-237 | for tissue dissociator |
| Percoll (density 1.130 g/ml) | GE Healthcare, Life Sciences | 17-0891-01 | |
| Sterile distilled Water (DNAse/ RNAse free) | GIBCO | 10977-035 | |
| Gamunex 10% | Tajecris-Biotherapeutics | G120052 | 1:10 pre-dilution, use 20 μl/1 x 106cells |
| 0.22 μm filter | Millex GS | SLGS033SS | Syringe driven |
| Stericup filter unit | Millipore | SCGPU05RE | Pump driven |
| 50 ml PC oak ridge centrifuge tubes | Nalgene | 3118-0050 | 50 ml |
| 50 ml PP conical tubes | Becton Dickinson | 352070 | |
| 12 mm x 75 mm 5 ml test tubes | Becton Dickinson | 352058 | FACS stainings |
| Cell strainer 70 μm | Becton Dickinson | 352350 | |
| INSTRUMENTS | |||
| Flow Cytometer-Sorter (BD FACSAriaTMIIu) | Becton Dickinson | ||
| Sorvall Evolution R6 (rotor) | Kendro | ||
| Rotator REAX 2 | Heidolph | ||
| gentleMACS Dissociator | Miltenyi Biotec | 130-093 235 | tissue dissociator |
Ссылки
- Miller, J. F. A. P. The discovery of thymus function and of thymus-derived lymphocytes. Immunological Reviews. 185, 7-14 (2002).
- Klein, L., Hinterberger, M., Wirnsberger, G., Kyewski, B. Antigen presentation in the thymus for positive selection and central tolerance induction. Nat Rev Immunol. 9, 833-844 (2009).
- Vandenabeele, S., Hochrein, H., Mavaddat, N., Winkel, K., Shortman, K. Human thymus contains 2 distinct dendritic cell populations. Blood. 97, 1733-1741 (2001).
- Gotter, J., Brors, B., Hergenhahn, M., Kyewski, B. Medullary Epithelial Cells of the Human Thymus Express a Highly Diverse Selection of Tissue-specific Genes Colocalized in Chromosomal Clusters. The Journal of Experimental Medicine. 199, 155-166 (2004).
- Rouse, R. V., Bolin, L. M., Bender, J. R., Kyewski, B. A. Monoclonal antibodies reactive with subsets of mouse and human thymic epithelial cells. Journal of Histochemistry & Cytochemistry. 36, 1511-1517 (1988).
- Stoeckle, C., et al. Cathepsin S dominates autoantigen processing in human thymic dendritic cells. Journal of Autoimmunity. 38, 332-343 (2012).
- Woods Ignatoski, K. M., Bingham, E. L., Frome, L. K., Doherty, G. M. Directed trans-differentiation of thymus cells into parathyroid-like cells without genetic manipulation. Tissue Eng Part C Methods. 17, 1051-1059 (2011).
- Williams, K. M., et al. Single Cell Analysis of Complex Thymus Stromal Cell Populations: Rapid Thymic Epithelia Preparation Characterizes Radiation Injury. Clinical and Translational Science. 2, 279-285 (2009).
- Bendriss-Vermare, N., et al. Human thymus contains IFN-α-producing CD11c-, myeloid CD11c+, and mature interdigitating dendritic cells. The Journal of Clinical Investigation. 107, 835-844 (2001).
- Schmitt, N., et al. Ex vivo characterization of human thymic dendritic cell subsets. Immunobiology. 212, 167-177 (2007).
- Dzionek, A., et al. BDCA-4: Three Markers for Distinct Subsets of Dendritic Cells in Human Peripheral Blood. The Journal of Immunology. 165, 6037-6046 (2000).
- Wu, L., Shortman, K. Heterogeneity of thymic dendritic cells. Seminars in Immunology. 17, 304-312 (2005).
- Seach, N., Wong, K., Hammett, M., Boyd, R. L., Chidgey, A. P. Purified enzymes improve isolation and characterization of the adult thymic epithelium. Journal of Immunological Methods. 385, 23-34 (2012).
- Adamopoulou, E., Tenzer, S., Hillen, N., Klug, P., Rota, I. A., Tietz, S., Gebhardt, M., Stevanovic, S., Schild, H., et al. Exploring the MHC-peptide matrix of central tolerance in the human thymus. Nature Communications. , (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены