Method Article
从人类胸腺髓样树突状细胞和上皮细胞的分离
摘要
这个协议的细节的方法来分离抗原通过不同的步骤的组织随后在单细胞悬浮液的密度离心和感兴趣的细胞群的最后磁和/或FACS分选的酶消化从人胸腺呈递细胞。
摘要
在这个协议中,我们提供了一个方法,从人胸腺分离的树突状细胞(DC)和上皮细胞(TEC)。 DC和TEC是主要的抗原呈递细胞在正常的胸腺发现(APC)的类型,它是公认的,他们胸腺选择过程中扮演不同的角色。这些细胞被定位在不同的微环境中的胸腺和各APC型拼成细胞中,只有轻微的人口。为了进一步了解这些类型的细胞生物学,这些细胞群的特征是非常可取的,但由于它们的低频率,任何这些类型的细胞分离需要一个高效的和可再现的过程。这个协议的细节的方法,以获得适合不同的细胞特性表征细胞。胸腺组织被机械破坏和之后各个步骤的酶消化,将所得细胞悬浮液用Percoll密度离心步骤富集。对于髓样DC(CD11c的隔离<SUP> +),从低密度部分(LDF)细胞通过磁性细胞分选免疫选择。 TEC人群(MTEC,CTEC)的富集是通过从低密度的Percoll细胞部分,允许其通过荧光激活细胞分选(FACS),使用特定细胞标志物随后分离耗尽造血(CD45 hi)条的细胞来实现。将分离的细胞可以用于不同的下游应用。
引言
胸腺是在T细胞发育发生器官。随着年龄的增长其相对和绝对尺寸减小,当它变得先后被脂肪取代,虽然胸腺活性仍然可以在旧时代被检测到。其对免疫反应的重要性表现在20世纪60年代初1。
对T细胞库是通过T细胞受体与不同种类的胸腺的APC,其提供生存或死亡的线索来发展T细胞,导致功能性,在很大程度上自耐受T细胞库2肽-MHC复合物的相互作用形成的。
约98%的细胞在人类胸腺正在开发称为胸腺T细胞。剩余的2%由许多不同的细胞类型,包括各种TEC的(皮质,延髓,囊下),粒细胞和浆细胞样DC(MDC,PDC)的巨噬细胞,B细胞,成熟重新循环T细胞,粒细胞, fibroblasts,内皮细胞和用表达的表型非常罕见的上皮细胞类似,从其他组织如肌肉,神经和呼吸上皮( 图1)的细胞。这些中,TEC和DC处于正常胸腺中发现的主要的APC类型。近年来,这些APC类型的文化和分子分析的净化已经获得了越来越多的关注。由于其低频率中的任进行详细的分析,这些细胞类型的分离需要高效的,可重现的和成本有效的方法。这里介绍的方法是从先前公布的研究3,4的修改。
与任何其他组织,从胸腺细胞提取可以通过酶促解聚的细胞 - 细胞和细胞 - 基质相互作用的网络,以便获得单细胞悬浮液来实现。有一定的参数,如良好的分离效率,细胞产量,细胞活力和保持细胞的S需要urface标记物是至关重要的,并为这些稀有细胞群的成功分离进行优化。
在这个协议中,直流和TEC亚群分离是通过使由机械破碎和酶消化组织的单细胞悬浮液进行。我们用胶原酶溶组织梭菌 ,其中有不同的酶活性比例的平衡,打破了保持组织在一起的天然胶原。 DNA酶I包括在酶溶液,以减少细胞聚集由于从死细胞的游离DNA(胸腺是非常敏感的),我们还提供了另一种方法,在典型的酶消化组织,涉及机械和酶组织治疗由组织离解的协助。单细胞悬浮液,然后进行单Percoll密度离心细胞的低密度部分(LDF)的富集。从细胞中的该级分,DC可以通过染色F是孤立或DC表面标记物( 即表面CD11c +)和使用磁性分离或荧光激活细胞分选(FACS)。不像含有细胞在胸腺中的绝大多数的淋巴样细胞,TEC不以高水平表达CD45,但正对上皮细胞粘附分子EpCAM的。 CTEC可以从髓质TEC通过对CDR-2(皮质树突网状细胞-2)抗体4,5和稍低的EpCAM表达识别的尚未定义的抗原的表达来区分。差动共表达的EpCAM和CDR2的允许这些TEC的子集通过高速细胞的高效分离排序6。
这里介绍的协议被优化用于人类胸腺组织。该过程的持续时间取决于组织的量和实验者的能力以及细胞分选器的速度,如果FACS分选被使用。通常情况下,该协议的直流隔离可以在5完成-6小时和TEC在8-10小时的隔离。直流和TEC亚群的胸腺组织中分离对时间很敏感。更快的分离过程中,细胞的状况就越好。最后,可以用于进一步调查喜欢的mRNA和比较研究蛋白的表达,PCR实验,蛋白分离,分子图谱( 即转录,微RNA分析),以及细胞培养物6的分离的细胞。
操守准则
为了能够与人体胸腺组织工作,研究人员需要自组织通常是由未成年人获得了当地伦理委员会或主管部门以及捐助者的知情同意书(或通常是他或她的父母,获得批准孩子)。此外,所有人体组织应作为应采取潜在的传染和适当的措施,如戴手套工作, 等处理。
研究方案
1。工具,酶溶液和缓冲液的制备
执行开始的协议之前,可用以下制备步骤。
- 工具
清洁,干燥,高压灭菌下列工具,让他们在无菌包装备用。- 小尖剪刀切割的胸腺组织或者弯曲或直的提示。小弯钳与处理组织锯齿状的提示。
- 50毫升橡树岭离心管,PC,对珀密度离心步骤。
- 酶溶液
准备胶原酶/ DNA酶I酶混合物(2毫克胶原酶/ ml和0.1毫克的DNase I /毫升),如下所示:- 溶解在250毫升的RPMI 1640普通(无FCS)的500毫克的冻干胶原酶A(罗氏公司)获得2毫克/毫升胶原酶溶液。胶原酶是相当难溶解,所以建议把它留一些时间在滚筒振动筛在室温。
- 溶解100毫克的DNase I(罗氏)在将10ml无菌蒸馏水。 2.5毫升等分可存放于-20℃。加入2.5倍毫升2毫克胶原酶溶液10毫克的DNase I溶液中。
- 无菌过滤器使用Stericup过滤器单元(0.22微米)的胶原酶/ DNA酶的组合。贮存于10-20毫升分装在-20°C,直到使用。
- 缓冲器和解决方案
- 1.5 M氯化钠原液:蒸馏水的无菌水溶解氯化钠的1.5 M的最终浓度通过0.22微米的过滤器,并储存在室温过滤溶液。
- 10倍的MACS缓冲液:1×PBS中(的Ca 2 + / Mg 2 +的自由)含有5%BSA和20mM EDTA中。无菌过滤器在4℃下用0.22微米的过滤器和存储该溶液使用前稀释10倍的股票在无菌冷的1X PBS为1x准备1X解决方案。
- FACS缓冲液:1×PBS中(的Ca 2 + / Mg 2 +的自由)含有1%BSA和0.02%的NaN 3。
- FACS缓冲的细胞分选:1×PBS中(Ca 2 +的/镁 2 +自由)含有2%BSA。消毒用0.22μm的注射器过滤器,并存储于4℃。
2。该组织的制备
在层流柜用无菌试剂和工作要执行的组织的处理。该过程开始之前,请准备以下试剂和仪器:
- 温热以下至RT:RPMI 1640完全培养基(RPMI 1640培养液,10%胎牛血清,1%青霉素/链霉素),RPMI 1640平纹,的Ca 2 + / Mg 2 +的PBS中自由和2x胶原酶/ DNA酶的酶溶液。
- 与旋转单元至37℃,阴凉固定角度转子离心机4°C热保暖孵化器
- 准备用冰盒。
注意:该步骤的持续时间取决于组织的状况和大小。约20-30分钟是合理的时间需要一个中等大小的一块钛SSUE状况良好(〜5厘米宽)。
- 将组织中含有无菌PBS的培养皿中,并冲洗掉任何残留的血液。
- 加入新鲜的PBS,以防止组织干燥,使用镊子和剪刀清除血液凝块,结缔组织和脂肪组织和任何部分看起来并不健康的组织。
- 小心除去坏死组织,这将增加碎屑的量。
- 清洁后,权衡组织以供参考。
- 切割组织中大约1cm 3片/块。加入足够的PBS覆盖组织。
注意:对于结果的再现性,组织应切成大小均匀的块。
- 使用无菌注射器(10-20毫升)的背面施加压力(不要太剧烈或长期)到胸腺组织片。此过程将除去大部分胸腺细胞,从而减少了组织体积后面将要消化。冰上执行此步骤和工作速度快 。
- 该解决方案将变得明显混浊如胸腺细胞被释放。轻轻地,然后搅拌均匀的菜用5毫升吸管的帮助或玻璃抽吸去除含注意不要无意中吸出组织块的胸腺细胞上清液。
提示:无菌细胞培养刮刀可以用来集中所有的组织块在盘子的一边,然后倾斜盘(45°角),并吸出上清液。更换新鲜的PBS,并重复这一过程,直到上清液是相对透明的。用RPMI平原进行最后一次洗涤。
- 使用锋利的剪刀切碎组织片(如细越好,片段至少应为2-4毫米)。所述片段应足够小,以输入一个5毫升的移液管。
3。的单细胞悬液从胸腺组织准备
在这里,此步骤2的替代方法进行了描述。第一种方法描述了一个典型的酶消化组织(3.1节),而第二个涉及机械和酶组织处理由组织离解器(3.2节)的协助。
这个协议是优化组织样品称重5克的处理。对于更大或更小的组织样本,相应地调整酶量。
3.1典型的酶消化组织,得到单细胞悬浮液
- 将组织捣碎成50ml试管用每5克组织10毫升胶原酶/ DNA酶的解决方案。加的RPMI纯,得到20ml的总体积。
注意:在一个50毫升管消化高达10克组织。相应地调整酶量。
- 孵育组织悬液40分钟在热培养箱37℃下缓慢转动。
注意: 温育步骤可以在与旋转单元的热培养箱,或在37℃的细菌培养箱摇床中进行。
- 酶溶液会变得浑浊随着细胞被释放到它。在以110×g离心2分钟以沉淀的组织碎片的消化,离心管的端部。
- 从这个消化一轮收集上清液。沉淀的细胞悬浮液10分钟,在400×g下。吸出上清,重悬的细胞在10-50毫升RPMI完全取决于细胞沉淀的大小。
- 保持细胞悬液在37℃培养箱与帽松动。
- 如果较大的细胞数目是理想的,消化步骤可以重复使用,其余的组织碎片和所述第一和第二消化池。此外,如果TEC应隔离,两轮消化的应该被执行。
- 稀释细胞悬浮液的等分试样中的台盼蓝(1:10-1:100),并使用血细胞计数器计数活细胞。
- 细胞保持在37℃的恒温箱,直到准备继续进行Percoll密度离心法(第4节)。随后的DC亚群(第5节)的隔离会从这些细胞中进行。
注意:胸腺组织可在其组成会发生变化,尤其是随着年龄的增长,这会影响消化效率和产生的单细胞悬液。
- 对于胸腺上皮细胞(TEC)的随后分离的第三轮酶消化是必需的。重悬组织残余势力在10毫升的新鲜胶原酶/ DNA酶液加10毫升的RPMI平原和在溶液中加入胰蛋白酶/ EDTA(1:50从2.5%的股份)。
- 在37℃下40分钟,轻轻旋转。在过去的10 - 温育15分钟,加FCS(1:5),以中和胰蛋白酶的活性。
- 离心机在110×g离心2分钟,在室温以沉淀的组织碎片。
的说明:组织可能不是这些三轮消化后可完全消化。年龄和组织的总体条件是两个参数影响胸腺组织的解离效率。
- 收集细胞上清液并弃去沉淀的组织碎片。
- 离心细胞上清液,在400×g离心10分钟。吸上清,重悬细胞沉淀在RPMI完全。
提示:细胞沉淀是相当宽松的,所以丢弃/吸取上清液时要小心。
- 使用血细胞计数器计数活细胞。将细胞在37℃培养箱中培养,直到进行到珀分离(第4节)。由喜 CD45细胞的耗竭后续预富集TEC细胞会从这些细胞(第6节)进行。
3.2机械和酶组织处理由组织离解器辅助
使用离解接近组织消化步骤可以降低到一半所需与上述(第3.1节)中描述的方法时的组织。下面的协议是与用于分离小鼠胸腺组织为TEC 7,8的分离的修改版本。
- 转让5克碎组织块(步骤2.5)到含10毫升胶原酶/ DNA酶液一个C管。
- 适应Ç管到组织离解和运行程序m_spleen_02(10秒)。重复此程序4-5倍(40-50秒)。
- 用20分钟温和转动37°C。
- 离心机在110×g下在室温下2分钟。
- 收集上清,进行如下步骤3.1.4。加10ml新鲜胶原酶/ DNA酶溶液。
- 适应Ç管到组织离解和运行程序m_spleen_01(56秒)。
- 在37℃下20分钟,轻轻旋转。
- 离心机在110×g下在室温下2分钟。
- 集电极T细胞的上清液和沉淀的细胞悬浮液10分钟,在400×g下。请按步骤3.1.4。
- 如在3.1.9中描述了第三轮的消化是需要胸腺上皮细胞(TEC)的后续分离。对于这一点,重悬组织残存在10毫升新鲜胶原酶/脱氧核糖核酸酶溶液加胰蛋白酶/ EDTA(1:50稀释的股票2.5%)
- 在37℃下进行20分钟,轻轻旋转。添加FCS(1:5),孵育另外10分钟。
注意:使用这种方法,在此之后最后消化步骤的组织通常被完全解离,并没有未消化的组织碎片被观察。
- 请按照步骤3.1.11-3.1.14。
4。单元格中使用的Percoll密度分离LDF的富集
所述组织的酶消化后,总胸腺单细胞悬浮液经受单个Percoll密度centrifugat离子的步骤,以丰富的LDF细胞。细胞的LDF是高度浓缩的APC。 DC和TEC在细胞这个分数检测。
- 使用从第 1 次和第2 次消化对于MDC分离获得单细胞悬液(细胞汇集,见步骤3.1.8)或第三摘要(用于TEC隔离)(3.1.14)。从在400×g离心10分钟,每消化步骤中获得的离心分离单细胞悬液。
- 在此洗涤步骤(请参阅下面的表中的例子)准备的Percoll溶液为1.07克/毫升的最终密度。
的珀溶液至1.07的最终密度制备微克/毫升(ρ= 1.07) 管号 1 2 3 4 未稀释珀(ρ= 1.130)(毫升) 2.96 5.92 8.88 11.84 1.5M的NaCl的量(毫升) 0.6 1.20 1.8 2.4 蒸馏水H 2 O的(毫升) 2.44 4.88 7.32 9.76 最后工作稀释量 6毫升 12毫升 18毫升 24毫升 - 珀管的数量依赖于在步骤3.1.8和/或3.1.14确定的细胞数。结合无菌溶液调匀。为了获得最佳的隔离,0.6-1×10 9细胞可以每珀的管被加载。结合无菌溶液调匀。
提示:珀对光敏感,此外它应该保持冷。首先准备含有氯化钠和H 2 O(RT)的混合物,并添加稀释珀最后,只是在珀液重悬细胞前。
帐篷“> 注:Percoll密度可能不同的供应商和批次之间变化如果未稀释的Percoll溶液的密度不等于1.130克/毫升,使用制造商提供的说明来计算珀和H 2的确切金额Ø得到1.07克/毫升的最终密度必需的。- 重悬至1×10 9细胞在6ml的制备的Percoll溶液(ρ= 1.07)的,充分混合,以得到均匀的悬浮液中,并转移至50ml橡树岭聚碳酸酯螺旋盖离心管中。
- 仔细层30毫升的RPMI完全每管上的Percoll溶液/悬浮液中的细胞的顶端的吸移管。加载培养基缓慢,所以它仍保持在悬浮液的上方并注意不要扰乱层。
- 称量管,以确保他们有平等的权重,使它们平衡离心过程中。如果它们不是,小心地添加更多的介质,以较轻的管(ST下erile条件)。
- 小心以3,500×g离心与制动切断管子转移到预冷的离心机有一个固定角转子和旋转35分钟,在4℃下。确保离心机在不高于4℃的温度
- 从离心机中取出试管,小心地用无菌巴斯德移液管从每个试管收集富集的APC,在珀和介质(低密度部分)之间的相间找到。转移细胞到50ml的管中冷RPMI完全。填补了管以稀释掉其余珀。
- 离心细胞悬浮液10分钟,在300×g离心在4℃下弃上清,重复洗涤。
- 重悬细胞沉淀在培养基中并测定细胞数(使用台盼蓝和血细胞计数器)。在我们的经验中,LDF细胞的百分比为约2-20%的酶消化后得到的总的单细胞悬浮液。一个典型的ÿ低密度富集细胞的IELD(从年轻胸腺,取值范围为1天2年)为每1×10 9 1×10 8个细胞,占总单细胞悬液的细胞的10%。
注意:在这个阶段,你可能会发现聚集的细胞悬浮液中(尤其是与年龄较大的儿童样本)。细胞团块是从DNA的垂死的细胞,它可以粘在一起的细胞释放的细胞死亡和结果的指示。在这种情况下,添加的DNase I到样品(50微克/毫升)和孵化,最多持续20分钟,在RT(轻轻颠倒每隔5分钟),以消化游离的DNA分子。
5。胸腺的mDC的隔离
APC的浓缩(通过Percoll密度分离)后,的mDC,可以有效地从LDF以下所述第一和第二轮酶消化的隔离。下面的协议是磁性细胞分离为的mDC(CD11c的隔离的修改版 +)。
- 离心机APC富集的细胞从汇集的第一和第二酶消化在100μlMACS缓冲液每10 7个细胞得到在300×g下在4℃下10分钟,重悬细胞沉淀的单细胞悬浮液中分离。
- 加入5微升的CD11c-PE抗体每10 7个细胞。
注意:滴定实验被推荐为最佳的效果。
- 拌匀,静置15分钟,在4℃,避光。
- 通过加入1-2毫升的MACS缓冲液每10 7个细胞,离心,在300×g离心10分钟,洗涤细胞。
- 吸上清完全和悬浮高达10 7细胞在80微升的MACS缓冲液。
- 每添加10 7细胞20微升抗-PE微珠。
- 拌匀(不要旋涡 )孵育15分钟,在4℃下避光。
- 如重复步骤5.4。
- 悬浮高达10 8个细胞于500μl缓冲液中。
- 如果需要的话,使用40微米的细胞过滤网来去除碎片和细胞聚集体,可能会妨碍塔的流过滤细胞悬浮液。
- 使用LS列,因为胸腺细胞悬液流过更好的LS列。准备LS列以下制造商的说明。吸取细胞悬液缓慢入列,避免产生气泡。使用一列,每1×10 8个细胞。
- 按照制造商的说明洗涤柱。从磁铁除去柱,并将其放置在无菌12毫升圆底聚丙烯管中。加3毫升MACS缓冲液上柱,并通过插入并牢牢推柱塞压入列收集磁标记的细胞。
- 收集代表的CD11c +的mDC和离心机在400×g离心6分钟洗脱的馏分。
- 确定细胞数量,并确认所选择的小区populati的纯度由流式细胞仪分析。建议的标记物包括CD45,CD11c的,和HLA-DR。
注意:表面CD11c +的mDC也可使用FACS分选仪分离得到。
6。 CD45 低/负细胞TEC的细胞分选的富集
对于TEC的分离,细胞可以预先富集利用CD45微珠喜 CD45细胞的消耗,以便通过细胞分选,以加快其隔离。
使用从第三消化步骤(3.1.14)中获得,并随后通过Percoll密度离心法分离单细胞悬液。
- 离心细胞悬浮液以300×g离心10分钟,在4℃,并在80微升的MACS重悬细胞沉淀每10 7个细胞缓冲液。
- 使用CD45微珠为每10 7个细胞的1/3推荐量(6.7微升)的。
注意:通过使用较低金额微珠,我们预富集的细胞为CD45 LO和CD45 负细胞。滴定是推荐的最佳结果。
- 轻轻弹管(不要旋涡 )孵育15分钟,在4°C拌匀
- 洗涤未结合的微珠通过加入10ml的MACS缓冲液和离心机在300×g离心10分钟,在4℃下吸上清完全。
- 悬浮高达10 8个细胞于500μl缓冲液中。
- 如果需要的话,使用70微米的细胞过滤网来去除碎片和细胞聚集体,可能会妨碍塔的流过滤细胞悬浮液。
- 使用LS列,因为胸腺细胞悬液流过更好的LS列。准备LS列以下制造商的说明。吸取细胞悬液缓慢入列,避免产生气泡。使用一列,每10 8个细胞。
- 收集含有未标记的细胞(流过和洗涤液)依照制造商的指示,CD45 低/负细胞级分和洗柱。
- 离心机在300×g下在4℃下10分钟,重悬细胞沉淀在无菌的FACS缓冲液中,以确定细胞数量和进行染色用于细胞分选。
7。染色的细胞进行荧光激活细胞分选
- 执行的FcR阻断前的细胞染色,以减少非特异性抗体结合。孵育细胞悬浮液用15分钟,在室温下混合的人免疫球蛋白溶液。这些试剂是市售的( 即 Gammunex 10%溶液)。
- 加入冷无菌FACS缓冲液洗细胞。离心机在400×g离心6分钟,在4℃下
- 弃上清,重悬细胞于无菌冷流式细胞仪缓冲。根据下面的示例制备5个样品:
样品 样品类型 抗体 手机号码 总成交量 1。未染色 控制 1×10 6个 50微升 2.scc * - 太平洋蓝 控制 CD45 - 太平洋蓝 1×10 6个 50微升 3。 SCC-APC 控制 CD3-APC 1×10 6个 50微升 4.scc-Alexa的488 控制 CD8-Alexa的488 1×10 6个 50微升 5。细胞分选 分析 CD45 - 太平洋蓝
的EpCAM-APC
CDR2-Alexa的48810×10 6 - 50×10 6个 500微升
10×10 6个细胞微升* SCC;单一色彩控制
- 孵育细胞与抗体一起30分钟后,在冰上于黑暗中。
- 用FACS缓冲液,在400×g离心在4℃下离心分离细胞6分钟洗两次
- 调整样品的细胞浓度,用无菌的FACS缓冲液的细胞分选( 即没有的NaN 3)进行排序,以1×10 7个细胞/ ml(或浓度所建议的细胞分拣设施)。
- 通过一个70微米的细胞过滤器细胞样本,以消除任何细胞团块,可能会在排序过程中堵塞流式细胞仪。
- 悬浮控制样品在200-400微升缓冲。保持管在冰上,避光。
- 准备收集管具有中等。
注意事项:
- 进行抗体的最佳染色滴定。
- 在一个样本进行排序,高达50×10 6细胞可以在总反应体积为被污染500微升。
- 进行样品在5毫升猎鹰聚苯乙烯圆底管进行排序的染色。单一的色彩控制,可染色在96孔板的不同孔中。
- 由于TEC的子集是罕见的人群,建议使用另一种阳性标记(高频),每个荧光染料,以方便确定适当的流式细胞仪的设置,并确保你有适当的补偿,如果荧光染料的选择要求赔偿。从CD45 +细胞级分可以被染色的标记物,如CD45,CD3和CD8的不同荧光染料和染色后未染色的CD45 +细胞可以被添加到样品中。
8。 TEC的荧光激活细胞分选分离
(MTEC)或EpCAM的LO CDR2 +(CTEC) - TEC的子集可以从CD45 LO /负分数作为EpCAM的喜 CDR2进行排序。
- 运行示例机智h时未染色的细胞和调整前向和侧向散射,以便放置在秤感兴趣的种群。调整各检测器上的电压,使得所述细胞是可见的,但位于直方图的最左边的手部。
- 运行每个单独的彩色样品和调整补偿每种颜色。
- 调节电压和补偿未染色和单染控制后运行示例进行排序,并使用门控工具来定义感兴趣的人群。使用宽正向和侧向散射门,以确保把所有基质细胞的大小,同时排除细胞碎片。
- 上点图与CD45 -太平洋蓝与在低 CD45和CD45 负细胞前向散射门。
- 这门应用到的EpCAM与CDR2点图,并确定由门要排序的人群。
- 一旦城门被确定,选择包含感兴趣的人群的大门,并开始排序。
- 一旦选的细胞已收集,离心细胞悬浮液,重悬细胞于培养基中的选择或缓冲取决于预期的下游应用。
注意:在以防止细胞粘到收集管的侧面排序,该管可被预先涂覆有50%FCS的PBS中填充它,并在室温下培养30分钟。加入收藏媒体面前丢弃的涂料解决方案。
结果
如本协议的原料,我们使用胸腺组织从知情同意后,并根据机构准则得到孩子接受矫正心血管外科(胸心血管外科杂志,大学诊所图宾根处)除去。这个废弃的材料可以大大的大小从2-30 g以上而有所不同。得到了的mDC的数量和TEC的子集(CTEC和MTEC)取决于大小,以及用于隔离的胸腺组织样品的寿命。
图2显示了(〜9cm)中从一个六岁的孩子获得了相当大的一块组织。在这个协议中重要的制备步骤是不希望有的零件(白箭头)的组织的清洁。
胸腺组织被视为在第二部分和该协议的3.1概述,以获得单细胞悬浮液,其使用一个单一的Percoll密度离心s分隔TEP虽然单细胞悬液包含HLA-DR +细胞的约3%( 图3A),Percoll密度离心后这一比例是在低密度部分(LDF)增加时,含有大尺寸的单元,以15〜40%,而高密度级分(HDF)是主要由均匀的小尺寸的胸腺细胞实际上不包含这样的细胞( 图3B)。利息(LDF)的部分,含有丰富的APC随后收集和洗涤,收集细胞用于后续分离步骤中使用。
而胸腺的mDC可以通过一些表面标记物,包括CD11c9,10的表达来鉴定的pDC表达标记物如BDCA-2,BDCA-4,CD45RA和CD123 11,12。在LDF细胞富集后,这两种细胞类型构成这部分的2-10%,使他们有效地隔离也是在更大的数字,无论是通过磁性细胞分离或流动的CD11c的分拣+和BDCA-4 +细胞6。
图4显示的CD11c +中使用在第5节中描述的修饰磁性细胞分离协议细胞的有效隔离。分离后,将表面CD11c + DC的纯度为93%的分离的细胞的免疫染色的建立。平均而言,孤立的CD11c + DC恢复为5×10 5 -5×10 6%10 9总胸腺细胞的mDC不同年龄及组织的重量,射程输入单的几个单独的胸腺样品中获得。 表1所示的数据细胞悬浮液,以及总的LDF号码和随后的CD11c +率和纯度。
在APC的浓缩部分,只有大约0.5%的细胞是CD45 EpCAM的LO +或CD45 负的EpCAM +。 CTEC和MTEC可以从胰蛋白酶消化CD45 低/负富集的基质细胞的EpCAM 升排序 ØCDR2 +和EpCAM的喜 CDR2 - ,分别如图5。
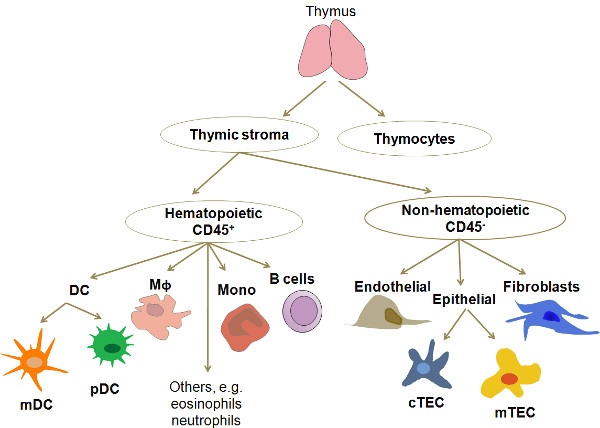
图1。蜂窝组织和人胸腺的组合物的简化框图。胸腺包括胸腺细胞,在不同的发育阶段,异构蜂窝网络被称为胸腺基质形成胸腺环境。胸腺基质的主要细胞类型是的mDC和pDC的,上皮细胞(分为根据小叶内的本地化两大类:皮质,延髓和)和巨噬细胞的缩写:DC,树突细胞;的mDC,髓样树突状细胞;的pDC,浆细胞样树突细胞;Mφ,巨噬细胞;单,单核细胞; CTEC,皮质上皮细胞; MTEC,髓上皮细胞。
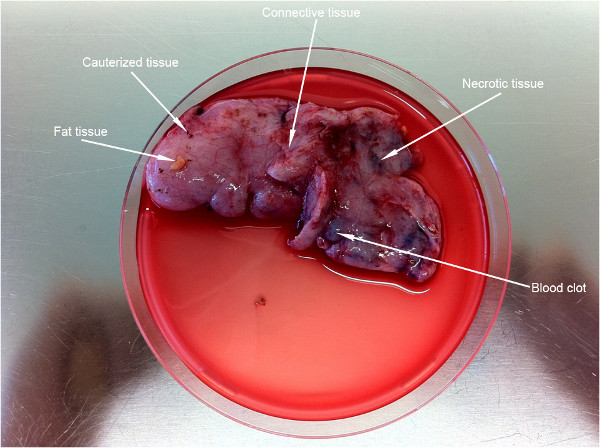
图2。需要该协议的执行之前,被丢弃的不良组织部位的组织单细胞制备。箭头指向的第一个制备步骤 。

图3。纯化的纯化过程中不同阶段的胸腺APC。FACS分析 。胸腺组织的单细胞悬液通过机械破碎和串行酶消化获得的APC和富集(LDF细胞)采用Percoll密度分离。前(A)和(B)后细胞的Percoll密度分离沾满HLA-DR-PE抗体检查APC富集。 HLA-DR +细胞通常观察到的比例范围为indicat编辑。

图4。采用胶原酶A / DNA酶I创建一个单细胞悬液的CD11c +的mDC。胸腺组织中分离消化。的CD11c +的mDC代表的单细胞悬浮液(0.6%)的一小群。通过珀密度分离LDF细胞富集后的CD11c +细胞增大到〜9%的比例。该LDF细胞标记的CD11c-PE抗体,并随后使用磁珠(抗-PE)的隔离。后直接磁性细胞分离用流式细胞仪的表面CD11c +人口再分析表明93%的纯度。 点击这里查看大图 。
0951/50951fig5.jpg“/>
图5。 CD45 低/负细胞的富集和TEC子集A)代表散点图显示CD45的百分比后续分选负/低胸腺基质细胞的前,后Percoll密度分离(9%和16.2%,分别)总单细胞悬液。 B)本LDF细胞被耗尽使用磁珠和TEC子集来分类从贫化馏分作为EpCAM的CDR2 喜喜的CD45细胞- (MTEC)或EpCAM的LO CDR2 +(CTEC)。
| 表面CD11c +的mDC频率,细胞产量和不同捐赠者的纯度 | |||||||
| 捐赠者 | 年龄 | 组织重量 | 每个样本的总细胞 | 每个样品LDF细胞 | 表面CD11c+% | 每个样品的CD11c +隔离 | CD11c +细胞纯度 |
| 1 | 5天 | 7克 | 1.45×10 9 | 9.5×10 7 | 12.6 | 2.4×10 6个 | 89% |
| 2 | 3年 | 15克 | 2×10 9个 | 6.5×10 7 | 4.3 | 1.9×10 6个 | 81% |
| 3 | 21天 | 9克 | 2.6×10 9个 | 22×10 7 | 10.3 | 3.6×10 6个 | 93% |
| 4 | 6年 | 13克 | 1.4×10 9个 | 25.4×10 7 | 4.2 | 5.7×10 6个 | 82% |
| 5 | 5天 | 6.5克 | 1.3×10 9个 | 16.2×10 7 | 6 | 2.9×10 6个 | 91% |
| 6 | 39天 | 3克 | 0.6×10 9个 | 8×10 7 | 3.4 | 1.3×10 6个 | 80% |
表1中。两轮消化以及珀分离后的LDF细胞的产量之后发布的总单细胞悬液的细胞数量都显示为不同年龄和组织重量的六个人胸腺样品进行隔离。的mDC的频率由基于流动测定仪在总LDF细胞CD11c的表达(APC丰富)。产量和表面CD11c +细胞的纯度磁珠分离后,显示为每个单独的捐赠者。
讨论
这里所描述的协议是协议由Gotter 等 4公布了修改。在协议中的关键步骤是条件和组织的初始准备以及Percoll密度分离。我们强烈建议尽快收集处理后的组织中。在清洗和切割组织时,工作速度快,但是彻底是很重要的。在步骤2.3中所述的胸腺细胞洗涤,至关重要的是将压力施加与对组织片注射器柱塞的背面过于剧烈和长时间的压力会损坏基质细胞时,以找到合适的平衡。分层介质上的Percoll溶液/悬浮液中的细胞的顶部,而不会造成干扰也可能需要一些练习。离心后,收集所有的低密度部分细胞尽快从珀层的珀解决方案的最低金额是很重要的。
该总细胞产量和相对APC号码可以是非常可变的( 见表1),并依赖于供体(特别是相对于年龄)和实验者的制备技术。为简要概述,细胞悬浮液可以按照不同的步骤随意的协议被污染与HLA-DR和/或其它标记。用于表型分析的所有抗体应该滴定以达到最佳效果。
由于APC类型在胸腺相比,胸腺细胞的相对丰度低,则可能需要更大的片胸腺如果更高的数字分离细胞是期望的。
如果一个组织离解器可在实验室,这将大大加快组织处理,但这里描述两者的变化也同样有效。一个比较常见的问题可能是细胞的聚集,尤其是在珀分离和MACS / FACS分选的步骤。在这种情况下,一个短的DNA酶I挖如在协议中所述estion通常就能解决问题。因为胸腺组织是在从旧的供体老化,thymi可能含有一些脂肪,离心从不同消化步骤中获得的单细胞悬浮液后,将游在管的顶部依次取代脂肪组织。在这种情况下,脂肪应具有持续的协议之前的移液管除去。为了达到最佳效果,以及经济的原因,我们建议,滴定不仅抗体,而且抗-PE微珠(第5和6)。从小鼠胸腺TEC的隔离,另一种酶混合物进行了描述,以提高产量TEC 8,13,但我们还没有与人体组织测试它们。
原则上,其他胸腺APC和基质细胞像B细胞和pDC的,也可以从该LDF细胞(以下胶原酶/ DNA酶消化和Percoll密度)通过FACS / MACS如果各自的标记物是已知的分选分离。例如,为的pDC,BDCA-2,BDCA-4和CD123已经被描述为标记6,14。如果分析胸腺细胞亚群或隔离需要,我们建议您使用受挤压(步骤2.3)公布的细胞,因为他们是有相当纯净,经历了最少的操作。
披露声明
没有利益冲突声明。
致谢
我们感谢胸心血管外科系,大学医院图宾根的外科医生提供的CDR2抗体为我们提供了胸腺样品和布鲁诺Kyewski(DKFZ,海德堡,德国)。我们还要感谢汉斯 - 约尔格Bühring和萨布丽娜格林从分拣设施(图宾根大学)。这项工作是由SFB 685和Hertie基金会的支持。
材料
| Name | Company | Catalog Number | Comments |
| Reagents and Materials | |||
| RPMI 1640 | PAA | E15-842 | |
| Dulbecco's PBS | PAA | H15-002 | |
| Fetal Bovine Serum-Gold | PAA | A15-151 | |
| Bovine Serum Albumin | PAA | K41-001 | |
| Collagenase A | Roche | 10 103 586 001 | |
| DNase I, grade II bovine pancreatic | Roche | 10 104 159 001 | |
| Trypsin-EDTA 10x in PBS | PAA | L11-001 | stock conc. 20 mg/ml |
| Alexa Fluor 488 Protein Labelling kit | Molecular Probes | A-10235 | |
| anti-human CDR2 (purified) | Bruno Kyewski, DKFZ- Heidelberg, Germany | labeled with Alexa Fluor 488 | |
| anti-human CD45 (Pacific Blue) | Biolegend | 304022 | |
| anti-human EpCAM (APC) | Miltenyi Biotec | 130-091-254 | |
| anti-human CD11c (PE) | Miltenyi Biotec | 130-092-411 | |
| anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| anti-CD45 Microbeads, human | Miltenyi Biotec | 130-045-801 | |
| LS columns | Miltenyi Biotec | 130-042-401 | |
| gentleMACS C Tubes | Miltenyi Biotec | 130-093-237 | for tissue dissociator |
| Percoll (density 1.130 g/ml) | GE Healthcare, Life Sciences | 17-0891-01 | |
| Sterile distilled Water (DNAse/ RNAse free) | GIBCO | 10977-035 | |
| Gamunex 10% | Tajecris-Biotherapeutics | G120052 | 1:10 pre-dilution, use 20 μl/1 x 106cells |
| 0.22 μm filter | Millex GS | SLGS033SS | Syringe driven |
| Stericup filter unit | Millipore | SCGPU05RE | Pump driven |
| 50 ml PC oak ridge centrifuge tubes | Nalgene | 3118-0050 | 50 ml |
| 50 ml PP conical tubes | Becton Dickinson | 352070 | |
| 12 mm x 75 mm 5 ml test tubes | Becton Dickinson | 352058 | FACS stainings |
| Cell strainer 70 μm | Becton Dickinson | 352350 | |
| INSTRUMENTS | |||
| Flow Cytometer-Sorter (BD FACSAriaTMIIu) | Becton Dickinson | ||
| Sorvall Evolution R6 (rotor) | Kendro | ||
| Rotator REAX 2 | Heidolph | ||
| gentleMACS Dissociator | Miltenyi Biotec | 130-093 235 | tissue dissociator |
参考文献
- Miller, J. F. A. P. The discovery of thymus function and of thymus-derived lymphocytes. Immunological Reviews. 185, 7-14 (2002).
- Klein, L., Hinterberger, M., Wirnsberger, G., Kyewski, B. Antigen presentation in the thymus for positive selection and central tolerance induction. Nat Rev Immunol. 9, 833-844 (2009).
- Vandenabeele, S., Hochrein, H., Mavaddat, N., Winkel, K., Shortman, K. Human thymus contains 2 distinct dendritic cell populations. Blood. 97, 1733-1741 (2001).
- Gotter, J., Brors, B., Hergenhahn, M., Kyewski, B. Medullary Epithelial Cells of the Human Thymus Express a Highly Diverse Selection of Tissue-specific Genes Colocalized in Chromosomal Clusters. The Journal of Experimental Medicine. 199, 155-166 (2004).
- Rouse, R. V., Bolin, L. M., Bender, J. R., Kyewski, B. A. Monoclonal antibodies reactive with subsets of mouse and human thymic epithelial cells. Journal of Histochemistry & Cytochemistry. 36, 1511-1517 (1988).
- Stoeckle, C., et al. Cathepsin S dominates autoantigen processing in human thymic dendritic cells. Journal of Autoimmunity. 38, 332-343 (2012).
- Woods Ignatoski, K. M., Bingham, E. L., Frome, L. K., Doherty, G. M. Directed trans-differentiation of thymus cells into parathyroid-like cells without genetic manipulation. Tissue Eng Part C Methods. 17, 1051-1059 (2011).
- Williams, K. M., et al. Single Cell Analysis of Complex Thymus Stromal Cell Populations: Rapid Thymic Epithelia Preparation Characterizes Radiation Injury. Clinical and Translational Science. 2, 279-285 (2009).
- Bendriss-Vermare, N., et al. Human thymus contains IFN-α-producing CD11c-, myeloid CD11c+, and mature interdigitating dendritic cells. The Journal of Clinical Investigation. 107, 835-844 (2001).
- Schmitt, N., et al. Ex vivo characterization of human thymic dendritic cell subsets. Immunobiology. 212, 167-177 (2007).
- Dzionek, A., et al. BDCA-4: Three Markers for Distinct Subsets of Dendritic Cells in Human Peripheral Blood. The Journal of Immunology. 165, 6037-6046 (2000).
- Wu, L., Shortman, K. Heterogeneity of thymic dendritic cells. Seminars in Immunology. 17, 304-312 (2005).
- Seach, N., Wong, K., Hammett, M., Boyd, R. L., Chidgey, A. P. Purified enzymes improve isolation and characterization of the adult thymic epithelium. Journal of Immunological Methods. 385, 23-34 (2012).
- Adamopoulou, E., Tenzer, S., Hillen, N., Klug, P., Rota, I. A., Tietz, S., Gebhardt, M., Stevanovic, S., Schild, H., et al. Exploring the MHC-peptide matrix of central tolerance in the human thymus. Nature Communications. , (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。