Method Article
Isolement des cellules dendritiques myéloïdes et les cellules épithéliales du thymus humain
Dans cet article
Résumé
Ce protocole décrit en détail une méthode pour isoler des cellules présentant l'antigène à partir de thymus humain par l'intermédiaire de différentes étapes de digestion enzymatique du tissu suivie d'une centrifugation de densité de la suspension de cellules individuelles et enfin le tri magnétique et / ou FACS des populations de cellules d'intérêt.
Résumé
Dans ce protocole, nous fournissons un procédé pour isoler des cellules dendritiques (DC) et les cellules épithéliales (TEC) à partir du thymus humain. DC et TEC sont la principale cellule présentatrice d'antigène (APC) de types trouvés dans un thymus normal et il est bien établi que ils jouent des rôles distincts lors de la sélection thymique. Ces cellules sont localisées dans des micro-environnements distincts dans le thymus et chaque type APC ne constitue qu'une petite population de cellules. Pour mieux comprendre la biologie de ces types de cellules, la caractérisation de ces populations de cellules est très souhaitable, mais en raison de leur basse fréquence, l'isolement de l'un de ces types de cellules nécessite une procédure efficace et reproductible. Ce protocole détaille une méthode pour obtenir des cellules appropriées pour la caractérisation des propriétés cellulaires divers. Tissu thymique est mécaniquement perturbé et après différentes étapes de digestion enzymatique, la suspension de cellules résultante est enrichi à l'aide d'une étape de centrifugation par densité de Percoll. Pour l'isolement des myéloïde DC (CD11c <sup> +), des cellules provenant de la fraction de faible densité (LDF) sont immunosélectionné par tri cellulaire magnétique. Enrichissement des populations de TEC (mTEC, la technologie cTEC) est réalisé par déplétion des hématopoïétiques (CD45 hi) des cellules de la fraction cellulaire de faible densité Percoll permettant leur isolement subséquent par tri cellulaire activé par fluorescence (FACS) en utilisant des marqueurs cellulaires spécifiques. Les cellules isolées peuvent être utilisées pour différentes applications en aval.
Introduction
Le thymus est l'organe dans lequel le développement des cellules T se produit. Sa taille relative et absolue diminue avec l'âge quand il est remplacé successivement par de la graisse bien que l'activité du thymus peut encore être détecté dans la vieillesse. Son importance pour la réponse immunitaire a été démontrée dans le début des années 1960 1.
Le répertoire des cellules T est façonnée par l'interaction des récepteurs des cellules T avec des complexes peptide-MHC sur les différents types de thymus APC, qui assurent la survie ou la mort des indices de développement de cellules T, ce qui entraîne un répertoire fonctionnel et largement auto-tolérance des lymphocytes T 2.
Environ 98% des cellules dans le thymus humain développent des lymphocytes T appelés thymocytes. Les 2% restants se composent d'un certain nombre de différents types de cellules, y compris une variété de TEC (corticale, médullaire, sous-capsulaire), myéloïde et CD plasmacytoïdes (MDC, PDC), les macrophages, les lymphocytes B, les cellules matures re-circulation T, les granulocytes, faibroblasts, les cellules endothéliales et les cellules épithéliales de très rares avec un phénotype d'expression qui ressemble à celle des cellules provenant d'autres tissus tels que les muscles, les neurones et de l'épithélium des voies respiratoires (Figure 1). Parmi ceux-ci, TEC et DC sont les principaux types d'APC présents dans un thymus normal. Au cours des dernières années, la purification de ces types d'APC pour la culture et le profilage moléculaire a gagné de plus en plus d'intérêt. En raison de leur basse fréquence, l'isolement de l'un de ces types de cellules pour une analyse détaillée nécessite une procédure efficace, reproductible et économique. La méthode présentée ici est une modification d'études publiées antérieurement 3,4.
Comme avec n'importe quel autre tissu, l'extraction des cellules du thymus peut être obtenue en décomposant par voie enzymatique de la cellule-cellule et les réseaux d'interactions cellule-matrice, pour obtenir une suspension de cellules uniques. Il existe certains paramètres comme la bonne efficacité de dissociation, le rendement cellulaire, la viabilité des cellules et le maintien des cellules smarqueurs de urface qui sont cruciales et doivent être optimisées pour l'isolement réussi de ces populations de cellules rares.
Dans ce protocole, l'isolement des sous-ensembles de DC et TEC est réalisée par formation d'une suspension à cellule unique du tissu par rupture mécanique et la digestion enzymatique. Nous utilisons la collagénase A de Clostridium histolyticum, qui a un rapport équilibré des différentes activités enzymatiques, à briser le collagène natif qui détient le tissu ensemble. DNase I est inclus dans la solution enzymatique pour réduire l'agrégation cellulaire en raison de l'ADN libre à partir de cellules mortes (thymocytes sont très sensibles). Nous fournissons également une approche alternative à la digestion du tissu enzymatique typique impliquant un traitement de tissu mécanique et enzymatique assistée par un dissociateur de tissu. La suspension cellulaire unique est ensuite soumis à une centrifugation unique de densité Percoll pour l'enrichissement de la fraction de faible densité (LDF) de cellules. A partir de cette fraction de cellules, DC peut être isolé par coloration fou marqueurs DC-surface (c.-à-CD11c +) et en utilisant une séparation magnétique ou une cellule activé par fluorescence (FACS). A la différence des cellules lymphoïdes comprenant la grande majorité des cellules dans le thymus, les TEC n'expriment pas CD45 à des niveaux élevés, mais sont positifs pour le adhésion cellulaire épithéliale molécule EpCAM. Ctec peut être distingué du TEC médullaire par l'expression d'un antigène reconnu non encore défini par le CDR-2 (cortical dendritique réticulocytes-2) un anticorps de 4,5 et l'expression d'EpCAM un peu plus faible. L'écart-co-expression de EpCAM et CDR2 permet l'isolement efficace de ces sous-ensembles de TEC par l'intermédiaire de la cellule à grande vitesse de tri 6.
Le protocole présenté ici est optimisée pour les tissus du thymus humain. La durée de la procédure dépend de la quantité de tissu et de la capacité de l'expérimentateur, ainsi que la vitesse du trieur de cellules, si tri FACS est utilisé. Normalement, le protocole pour l'isolement de CC peut être achevée dans un délai de 5-6 H et à l'isolement des TEC en 8-10 heures. L'isolement des DC et des sous-ensembles de TEC de tissu thymique est sensible au temps. Plus la procédure d'isolement, meilleure est l'état des cellules. Enfin, les cellules isolées peuvent être utilisées pour d'autres investigations, comme des études comparatives de l'ARNm et l'expression des protéines, des expériences de PCR, l'isolement de la protéine, le profilage moléculaire (à savoir les transcriptomique, micro-analyse de l'ARN), ainsi que la culture de la cellule 6.
Déclaration d'éthique
Afin d'être en mesure de travailler avec le tissu de thymus humain, le chercheur doit obtenir l'approbation du comité d'éthique local ou les autorités responsables ainsi que d'un consentement écrit du donneur (ou habituellement ses parents, puisque le tissu est généralement obtenu à partir de mineurs les enfants). En outre, tous les tissus humains doivent être traités comme étant potentiellement infectieux et des mesures appropriées doivent être prises, telles que le travail avec des gants, etc.
Protocole
Une. Préparation des outils, des solutions enzymatiques, et tampons
Effectuez les étapes suivantes de préparation avant de commencer le protocole.
- Outils
Propre, sec et à l'autoclave les outils suivants et les conserver dans un emballage stérile jusqu'à l'utilisation.- Petits ciseaux pointus avec des conseils soit courbes ou droites pour couper le tissu de thymus. Petites pinces courbes avec des pointes crantées pour la manipulation du tissu.
- 50 ml d'Oak Ridge Tubes à centrifuger, PC, pour l'étape de centrifugation Percoll-densité.
- solutions d'enzymes
Préparer la collagénase / DNase I enzyme de mélange (2 mg de collagénase / ml et 0,1 mg de DNase I / ml) comme suit:- Dissoudre 500 mg de collagénase A lyophilisée (Roche) dans 250 ml de RPMI 1640 brut (pas de FCS) pour obtenir une solution à 2 mg / ml de collagénase. Collagénase est assez difficile à dissoudre, il est donc recommandé de laisser un peu de temps sur un rouleau vibrant à la température ambiante.
- Dissoudre 100 mg de DNase I (Roche) dans10 ml d'eau distillée stérile. 2,5 ml aliquotes peuvent être stockées à -20 ° C. Ajouter 2,5 ml de la solution de 10 mg de DNase I dans la solution 2 mg de collagénase A.
- Filtre stérile le mélange de collagénase / DNase en utilisant une unité de filtre Stericup (0,22 um). Magasin à 10-20 ml aliquotes à -20 ° C jusqu'à utilisation.
- Tampons et solutions
- 1,5 M de NaCl solution stock: Dissoudre NaCl dans de l'eau distillée stérile à une concentration finale de 1,5 M. Filtrer la solution à travers un filtre de 0,22 um et stocker à température ambiante.
- 10x tampon MACS: 1x PBS (Ca 2 + / Mg 2 +-libre) contenant 5% de BSA et 20 mM EDTA. Filtre stérile la solution avec un filtre de 0,22 um et stocker à 4 ° C. Avant d'utiliser préparer une solution 1x par dilution de la langue 10x à 1x au froid stérile 1x PBS.
- Tampon FACS: 1x PBS (Ca 2 + / Mg 2 +-libre) contenant 1% de BSA et 0,02% de NaN3.
- FACS tampon pour le tri de cellules: 1x PBS (Ca 2 + / Mg 2 + sans) contenant 2% de BSA. Stériliser à l'aide d'un filtre à seringue de 0,22 um et stocker à 4 ° C.
2. Préparation du Tissue
Le traitement du tissu doit être effectuée en utilisant des réactifs stériles et des travaux dans une hotte à flux laminaire. Avant le début de la procédure, préparer les réactifs et les équipements suivants:
- Chauffer le suivant pour RT: milieu RPMI 1640 complet (RPMI 1640, 10% sérum de veau fœtal, 1% pénicilline / streptomycine), RPMI 1640 plaine, Ca 2 + / Mg 2 + sans PBS et 2x solution enzymatique collagénase / DNase.
- Incubateur thermale chaude avec l'unité de rotation à 37 ° C et laisser refroidir angle fixe rotor de la centrifugeuse à 4 ° C.
- Préparer une boîte avec de la glace.
Remarque: la durée de cette étape dépend de l'état et la taille du tissu. Environ 20-30 minutes est un délai raisonnable nécessaire pour une pièce de taille moyenne tissu en bon état (~ 5 cm de largeur).
- Placez le tissu dans une boîte de Pétri contenant du PBS stérile et rincer tout le sang résiduel.
- Ajouter du PBS frais pour empêcher le tissu de séchage et l'aide de pinces et ciseaux nettoyer le tissu de caillots de sang, du tissu conjonctif et la graisse et de toute partie qui ne semble pas en bonne santé.
- Prendre soin d'enlever les tissus nécrosés qui permettra d'augmenter la quantité de débris.
- Après le nettoyage, peser tissu pour référence.
- Coupez le tissu en environ 1 cm 3 morceaux / blocs. Ajouter suffisamment de PBS pour couvrir le tissu.
Remarque: Pour la reproductibilité des résultats, le tissu doit être coupé en morceaux de taille uniforme.
- Utilisation de l'arrière d'une seringue stérile (10-20 ml) appliquer une pression (pas trop vigoureux ou prolongée) sur les morceaux de tissu thymique. Cette procédure va supprimer la majeure partie des thymocytes, réduisant ainsi le volume du tissu qui doit être digéré par la suite. Effectuez cette étape sur la glace et travailler rapidement.
- La solution sera visiblement nuageux comme thymocytes sont libérés. Remuer doucement le plat et ensuite à l'aide d'une pipette de 5 ml ou un aspirateur de verre éliminer le surnageant contenant les thymocytes en prenant soin de ne pas aspirer accidentellement les morceaux de tissu.
Conseil: Racloir de culture cellulaire stérile peut être utilisé pour concentrer l'ensemble des morceaux de tissu sur un côté de la cuvette puis incliner l'antenne (angle de 45 °) et aspirer le surnageant. Remplacez-le par du PBS frais et répétez cette procédure jusqu'à ce que le surnageant est relativement transparent. Effectuer dernier lavage avec du RPMI plaine.
- Émincer les morceaux de tissu avec des ciseaux aiguisés (aussi finement que possible, des fragments doivent être d'au moins 2-4 mm). Les fragments doivent être suffisamment petits pour entrer dans une pipette de 5 ml.
3. Préparation de l'unité cellulaire Suspension de Thymus tissus
Ici,deux approches alternatives pour cette étape sont décrits. La première approche décrit une digestion enzymatique de tissu typique (section 3.1) tandis que le second implique le traitement de tissu mécanique et enzymatique assistée par un dissociateur de tissu (section 3.2).
Ce protocole est optimisé pour le traitement d'échantillons de tissus d'un poids de 5 g. Pour les échantillons de tissus plus ou moins, ajuster les volumes de l'enzyme en conséquence.
3,1 digestion enzymatique de tissu typique pour obtenir une suspension cellulaire unique
- Placez le tissu purée en tubes de 50 ml avec 10 ml de solution de collagénase / DNase par 5 g de tissu. Ajouter RPMI plaine pour donner un volume total de 20 ml.
Note: dans un tube de 50 ml à digérer jusqu'à 10 g de tissu. Régler le volume de l'enzyme en conséquence.
- Incuber la suspension de tissu pendant 40 min à 37 ° C sous rotation lente dans une étuve thermique.
Remarque: les étapes d'incubation peuvent être réalisés soit dans un incubateur thermique avec une unité de rotation, ou dans un incubateur à 37 ° C de bactéries avec un agitateur.
- La solution d'enzyme devient trouble que les cellules sont libérés en elle. A la fin de la digestion, tube à centrifuger à 110 g pendant 2 min pour sédimenter les fragments de tissu.
- Recueillir le surnageant de cette ronde de digestion. Sédimenter la suspension de cellules pendant 10 min à 400 x g. Aspirer le surnageant et remettre les cellules dans 10 à 50 ml de milieu RPMI complet en fonction de la taille du culot cellulaire.
- Gardez la suspension cellulaire dans 37 ° C incubateur avec le bouchon lâche.
- Si les nombres de cellules plus importants sont désirés, l'étape de digestion peut être répétée avec les fragments de tissus restants et la première et la seconde digérer mis en commun. En outre, si TEC devrait être isolée, deux séries de digestions doivent être effectués.
- Diluer une partie aliquote de la suspension de cellules dans du bleu trypan (1:10-1:100) et compter les cellules viables en utilisant un hémocytomètre.
- Maintenir les cellules à 37 ° C dans l'incubateur jusqu'à ce que prêt à passer à la densité centrifugation Percoll (section 4). Isolement subséquent de sous-ensembles DC (section 5) sera effectuée à partir de ces cellules.
Remarque: Les tissus thymiques peuvent varier dans leur composition, en particulier avec l'âge, ce qui affecte l'efficacité de la digestion et de la génération d'une suspension à cellule unique.
- Pour l'isolation ultérieure des cellules épithéliales thymiques (TEC) un troisième tour de digestion enzymatique est nécessaire. restes de tissus de remettre en suspension dans 10 ml de solution fraîche collagénase / DNase plus 10 ml de RPMI plaine et ajouter la trypsine / EDTA (01h50 de 2,5% stock) dans la solution.
- Incuber à 37 ° C pendant 40 minutes avec une légère rotation. Pendant les 10 dernières - 15 min de l'incubation ajouter FCS (01h05) pour neutraliser l'activité de la trypsine.
- Centrifuger à 110 g pendant 2 min à température ambiante dans les sédiments les fragments de tissus.
Remarque: Le tissu peut pas être complètement digéré après ces trois tours de digestions. L'âge et l'état général du tissu sont deux paramètres qui influent sur l'efficacité de dissociation du tissu thymique.
- Recueillir le surnageant cellulaire et jeter les fragments de tissus sédimentées.
- Centrifuger le surnageant de cellules à 400 xg pendant 10 min. Aspirer le surnageant et remettre en suspension dans culot cellulaire RPMI complet.
Astuce: Les culots cellulaires sont assez lâche, afin de prendre soin lors de l'élimination / l'aspiration surnageant.
- Compter les cellules viables à l'aide d'un hémocytomètre. Placez les cellules dans un incubateur à 37 ° C jusqu'à ce que de procéder à la séparation de Percoll (section 4). Pré-enrichissement ultérieur de cellules TEC par la déplétion des cellules CD45 hi sera effectuée à partir de ces cellules (article 6).
3.2 traitement des tissus mécanique et enzymatique assistée par un dissociateur de tissu
Utilisation du tissu dissociateur abordent les étapes de la digestion des tissus peuvent être réduites à la moitié du temps nécessaire à l'approche décrite ci-dessus (section 3.1). Le protocole suivant est une version modifiée de celle qui est utilisée pour dissocier le tissu de thymus de souris pour l'isolement de 7,8 TEC.
- Transférer 5 g de morceaux de tissu haché (étape 2.5) dans un tube de C contenant 10 ml de solution de collagénase / DNase.
- Adapter C tube sur la dissociateur de tissus et d'exécution du programme m_spleen_02 (10 sec). Répétez ce programme 4-5x (40-50 sec).
- Incuber avec une légère rotation pendant 20 min à 37 ° C.
- Centrifuger à 110 g pendant 2 min à température ambiante.
- Recueillir le surnageant et procédez comme à l'étape 3.1.4. Ajouter 10 ml de solution fraîche collagénase / DNase.
- Adapter C tube sur la dissociateur de tissus et d'exécution du programme m_spleen_01 (56 sec).
- Incuber à 37 ° C pendant 20 minutes avec une légère rotation.
- Centrifuger à 110 g pendant 2 min à température ambiante.
- Collect surnageant et un culot de cellules de la suspension cellulaire pendant 10 minutes à 400 x g. Procédez comme à l'étape 3.1.4.
- Comme décrit dans 3.1.9 un troisième cycle de digestion est nécessaire pour l'isolation ultérieure des cellules épithéliales thymiques (TEC). Pour cela, des restes de tissus de remettre en suspension dans 10 ml de solution fraîche collagénase / DNase ainsi trypsine / EDTA (dilution 1:50 de stock de 2,5%)
- Incuber à 37 ° C pendant 20 minutes avec une légère rotation. Ajouter FCS (1:5) et incuber pendant encore 10 min.
Remarque: En utilisant cette approche, après cette dernière étape digestion du tissu est généralement complètement dissocié et aucun des fragments de tissus non digérés sont observés.
- Procédez comme dans les étapes 3.1.11-3.1.14.
4. Enrichissement de FDL de cellules utilisant la séparation Percoll densité
Après une digestion enzymatique du tissu, le total des suspensions de cellules individuelles thymiques sont soumis à un seul centrifugat de densité Percolll'étape d'ions pour enrichir en cellules de FDL. Le FDL de cellules est fortement enrichi pour APC. Les deux DC et TEC sont détectés dans cette fraction de cellules.
- Utilisez suspension cellulaire unique obtenu à partir de la 1 ère et 2 ème digère pour mDC isolement (cellules regroupées, voir l'étape 3.1.8) ou 3 ème digest (pour l'isolement du TEC) (3.1.14). Centrifuger la suspension à cellule unique obtenue à partir de chaque étape de digestion à 400 xg pendant 10 min.
- Préparer une solution de Percoll avec une densité finale de 1,07 g / ml au cours de cette étape de lavage (voir exemple dans le tableau ci-dessous).
Préparation d'une solution de Percoll à une densité finale de 1,07 g / ml (ρ = 1,07) Tube n ° 1 2 3 4 Non dilué Percoll (ρ = 1.130) (ml) 2.96 5,92 8.88 11,84 NaCl 1,5 M (ml) 0,6 1.20 1.8 2.4 H 2 O distillée (ml) 2.44 4,88 7.32 9,76 Volume de dilution de travail final 6 ml 12 ml 18 ml 24 ml - Le nombre de tubes dépend de Percoll les nombres de cellules déterminées dans les étapes 3.1.8 et / ou 3.1.14. Combiner les solutions stériles et bien mélanger. Pour l'isolation optimale, 0,6-1 x 10 9 cellules peuvent être chargés par tube de Percoll. Combiner les solutions stériles et bien mélanger.
Astuce: Percoll est sensible à la lumière et en plus il doit être conservé au froid. Préparer d'abord le mélange contenant le NaCl et H 2 O (RT) et d'ajouter, non dilué Percoll dernière, juste avant la remise en suspension des cellules dans la solution de Percoll.
tente "> Note: densité Percoll peut varier entre les différents fournisseurs et les lots Si la densité de la solution non diluée Percoll n'est pas égale à 1,130 g / ml, suivez les instructions fournies par le fabricant pour calculer les quantités exactes de Percoll et H 2 O nécessaire pour obtenir une densité finale de 1,07 g / ml.- Reprendre jusqu'à 1 x 10 9 cellules dans 6 ml de la solution de Percoll préparé (ρ = 1.07), mélanger suffisamment pour obtenir une suspension homogène, et le transfert à un bouchon à vis en polycarbonate tube de centrifugeuse de 50 ml d'Oak Ridge.
- Superposer soigneusement 30 ml de milieu RPMI complet par tube avec une pipette sur le dessus de la suspension une solution de Percoll / cellule. Charger lentement le milieu, de sorte qu'il reste sur le haut de la suspension et de prendre soin de ne pas perturber la couche.
- Peser les tubes pour s'assurer qu'ils ont des poids égaux de sorte qu'ils sont équilibrés pendant la centrifugation. Si elles ne sont pas, ajouter prudemment plus moyen de le tube léger (moins de stconditions de erile).
- Transférer soigneusement les tubes dans une centrifugeuse préalablement refroidie avec un rotor à angle fixe, et centrifuger à 3500 g pendant 35 min, à 4 ° C avec le frein hors tension. Assurez-vous que la température de la centrifugeuse en ne dépassant pas 4 ° C.
- Retirer les tubes de la centrifugeuse et le soin de recueillir APC enrichi, trouvé à l'interphase entre Percoll et moyenne (fraction de basse densité) de chaque tube en utilisant une pipette Pasteur stérile. Transfert des cellules dans un tube de 50 ml contenant du RPMI complet froid. Remplir le tube afin de diluer le Percoll restant.
- Centrifuger la suspension cellulaire pendant 10 minutes à 300 xg à 4 ° C. Rejeter le surnageant et lavage de répétition.
- Remettre en suspension le culot de cellules dans du milieu et de déterminer le numéro de cellule (à l'aide du bleu trypan et un hémocytomètre). Dans notre expérience, le pourcentage des cellules de FDL est d'environ 2-20% de la suspension cellulaire unique total obtenu après digestion enzymatique. A y typiqueDOMAINE DE cellules enrichies de faible densité (à partir d'un jeune thymus, portée un jour-2 ans) est 1x10 8 cellules par 1 x 10 9, soit 10% du total des cellules en suspension de cellules simples.
Remarque: A ce stade, vous pouvez observer que les cellules regroupées dans la suspension (en particulier avec des échantillons d'enfants de plus âgés). amas cellulaires sont une indication de la mort cellulaire et le résultat de la libération de l'ADN des cellules mortes qui peuvent coller les cellules. Dans un tel cas, ajouter de la DNase I dans l'échantillon (50 ug / ml) et incuber pendant jusqu'à 20 min à température ambiante (inverser doucement toutes les 5 min) pour digérer les molécules d'ADN libres.
5. Isolement du thymus mDC
Après enrichissement APC (par l'intermédiaire de Percoll séparation), le MDC peut être efficacement isolé de la LDF suite de la première et deuxième série de digestions enzymatiques. Le protocole suivant est une version modifiée de la séparation magnétique de cellules pour l'isolement de mDC (CD11c +).
- Centrifugeuse APC enrichie de cellules isolées à partir de la suspension de cellules individuelles obtenues à partir de la mise en commun des premier et deuxième digestion enzymatique à 300 xg pendant 10 min à 4 ° C et remettre en suspension le culot dans la cellule tampon MACS 100 ul pour 10 7 cellules.
- Ajouter 5 ul d'anticorps CD11c-PE par 10 7 cellules.
Note: les expériences de titrage est recommandé pour des résultats optimaux.
- Bien mélanger et incuber pendant 15 min à 4 ° C, à l'abri de la lumière.
- Laver les cellules en ajoutant 1-2 ml de tampon MACS par 10 7 cellules et centrifuger à 300 g pendant 10 min.
- Aspirer le surnageant complètement et remettre en suspension jusqu'à 10 7 cellules dans 80 ul de tampon MACS.
- Ajouter 20 ul anti-PE microbilles par 10 7 cellules.
- Bien mélanger (ne pas Vortex) et incuber pendant 15 min à 4 ° C à l'abri de la lumière.
- Répétez l'opération à l'étape 5.4.
- Remettre en suspension à 10 8 cellules dans 500 ul de tampon.
- Si nécessaire, la suspension de cellules de filtre à l'aide d'un tamis de 40 um de la cellule pour éliminer les débris cellulaires et des agrégats qui peuvent obstruer l'écoulement de la colonne.
- Utilisez une colonne LS puisque les suspensions de cellules du thymus meilleure circulation à travers les colonnes LS. Préparer la colonne de LS en suivant les instructions du fabricant. Pipette suspension cellulaire lentement dans la colonne en évitant les bulles de production. Utilisez une colonne pour chaque 1 x 10 8 cellules.
- Laver la colonne suivant les instructions du fabricant. Retirer la colonne de l'aimant et le placer dans un stériles 12 ml rondes tube en polypropylène fond. Ajouter 3 ml de tampon MACS sur la colonne et de recueillir des cellules magnétiquement marquées en insérant et en poussant fermement le piston dans la colonne.
- Recueillir la fraction élue représentant le CD11c + MDC et centrifuger à 400 g pendant 6 min.
- Déterminer le nombre de cellules et de confirmer la pureté de la populati de cellules sélectionnéepar analyse par cytométrie de flux. Marqueurs suggérées comprennent CD45, CD11c, et HLA-DR.
Remarque: CD11c + mDC peut également être isolé en utilisant un trieur FACS.
6. Enrichissement de cellules CD45 lo / neg pour portable tri des TEC
Pour l'isolement de TEC, les cellules peuvent être pré-enrichis par la déplétion des cellules CD45 hi utilisant des microbilles CD45, afin d'accélérer leur isolement grâce au tri cellulaire.
Utilisation suspension cellulaire unique obtenu à partir de l'étape de digestion de 3 rd (03/01/14), et ensuite séparé par centrifugation Percoll.
- suspension de cellules de Centrifuger à 300 g pendant 10 min à 4 ° C et remettre le culot cellulaire dans 80 ul de tampon MACS pour 10 7 cellules.
- Utiliser les microbilles de CD45 à 1/3 de la quantité recommandée (6,7 pi) pour 10 7 cellules.
Remarque: En utilisant une quantité inférieuredes microbilles nous pré-enrichissons cellules à la fois CD45 lo et cellules CD45 neg. Titrage est recommandé pour des résultats optimaux.
- Mélangez bien en feuilletant délicatement le tube (ne pas Vortex) et incuber pendant 15 min à 4 ° C.
- Laver les microbilles non liés en ajoutant 10 ml de tampon MACS et centrifuger pendant 10 min à 300 g à 4 ° C. Aspirer le surnageant complètement.
- Remettre en suspension à 10 8 cellules dans 500 ul de tampon.
- Si nécessaire, la suspension de cellules de filtre à l'aide d'un tamis de 70 um de la cellule pour éliminer les débris cellulaires et des agrégats qui peuvent obstruer l'écoulement de la colonne.
- Utilisez une colonne LS puisque les suspensions de cellules du thymus meilleure circulation à travers les colonnes LS. Préparer la colonne de LS en suivant les instructions du fabricant. Pipette suspension cellulaire lentement dans la colonne en évitant les bulles de production. Utilisez une colonne pour chaque 10 8 cellules.
- Recueillir des cellules non marquées (accréditives et lave) contenantla fraction de cellules lo / neg CD45 et laver la colonne suivant les instructions du fabricant.
- Centrifuger à 300 g pendant 10 min à 4 ° C et remettre le culot cellulaire dans du tampon FACS stérile en vue de déterminer le nombre de cellules et de procéder à la coloration pour le tri de cellules.
7. Les cellules de taches de fluorescence tri cellulaire activé
- Effectuer des FcR blocage avant la coloration des cellules, afin de réduire la liaison d'anticorps non spécifique. Incuber la suspension de cellules mises en commun avec des immunoglobulines humaines de la solution pendant 15 min à température ambiante. Ces réactifs sont disponibles dans le commerce (à savoir Gammunex solution à 10%).
- Laver les cellules en ajoutant un tampon FACS stérile froid. Centrifuger à 400 g pendant 6 min à 4 ° C.
- Rejeter le surnageant et remettre les cellules dans un tampon FACS stérile froid. 5 Préparer les échantillons selon l'exemple suivant:
Échantillon Type d'échantillon Anticorps Nombre de cellules Le volume total Une. sans tache contrôle 1 x 10 6 50 pl 2.scc *-Pacific Blue contrôle CD45-Pacific Blue 1 x 10 6 50 pl 3. scc-APC contrôle CD3-APC 1 x 10 6 50 pl 4.scc-Alexa 488 contrôle CD8-Alexa 488 1 x 10 6 50 pl 5. Tri cellulaire analyte CD45-Pacific Blue
EpCAM-APC
CDR2-Alexa 48810 x 10 6 à 50 x 10 6 500 pl
10 x 10 6 ul de cellules/100* Scc; contrôle de la couleur unique
- Incuber les cellules avec des anticorps pendant 30 minutes, sur de la glace dans l'obscurité.
- Laver deux fois avec du tampon FACS des cellules par centrifugation à 400 g pendant 6 min à 4 ° C.
- Ajuster la concentration de cellules de l'échantillon à trier à 1 x10 7 cellules / ml (ou à la concentration recommandée par le centre de tri de cellules) en utilisant FACS stériles tampon pour le tri cellulaire (c'est à dire sans NaN 3).
- Passez échantillon de cellules à travers un tamis de 70 um cellule pour enlever les amas de cellules qui peuvent obstruer le cytomètre lors du tri.
- Remettre en suspension les échantillons de contrôle à 200-400 ul de tampon. Garder les tubes sur la glace et à l'abri de la lumière.
- Préparer les tubes de prélèvement avec le milieu.
Notes:
- Effectuer le titrage des anticorps pour la coloration optimale.
- Dans un échantillon de tri, de jusqu'à 50 x 10 6 cellules peuvent être colorées dans un volume réactionnel total de500 pi.
- Effectuer une coloration de l'échantillon à trier dans 5 ml Falcon polystyrène tubes à fond rond. Les contrôles simples de couleur peuvent être colorées dans des puits séparés d'une plaque à 96 puits.
- Depuis des sous-ensembles de TEC sont les populations rares, il est conseillé d'utiliser un autre marqueur positif (de haute fréquence) pour chaque fluorochrome de faciliter la détermination des paramètres appropriés de FACS et vous assurer que vous avez une indemnisation appropriée si le choix de fluorochromes exige une compensation. Les cellules provenant de la fraction CD45 + peuvent être colorés avec des marqueurs tels que CD45, CD3 ou CD8 pour les différents fluorochromes et CD45 + après coloration des cellules non colorées peuvent être ajoutés à l'échantillon.
8. Isolement du TEC par fluorescence tri cellulaire activé
Sous-ensembles TEC peuvent être triés de la fraction lo / neg CD45 comme EpCAM salut CDR2 - (mTEC) ou EpCAM lo CDR2 + (CTEC).
- Exécutez l'exemple d'esprith, les cellules non colorées et ajuster vers l'avant et la diffusion latérale afin de placer la population d'intérêt à l'échelle. Ajuster la tension sur chaque détecteur de sorte que les cellules sont visibles, mais située dans la partie de la main gauche de l'histogramme.
- Exécutez chaque échantillon teinté unique et ajuster la rémunération pour chaque couleur.
- Après le réglage de la tension et de l'indemnisation pour les contrôles non colorées colorées et simples exécuter l'exemple à trier et utiliser des outils de déclenchement de définir la population d'intérêt. Utilisez un porte large et avant la diffusion latérale pour assurer l'inclusion de toutes les tailles de cellules stromales, tout en excluant les débris cellulaires.
- Sur le tracé de points avec Blue CD45-Pacifique contre Forward Scatter porte sur les cellules faibles et CD45 neg CD45.
- Appliquer cette porte à un EpCAM contre CDR2 en points et déterminer par séparer les populations à trier.
- Une fois les portes ont été déterminées, sélectionnez les portes contenant les populations d'intérêt et commencer à trier.
- Une fois les cellules triées ont été collectés, centrifuger la suspension cellulaire, et remettre les cellules dans un milieu ou un tampon de choix en fonction de l'application en aval prévu.
Remarque: Au cours de tri afin d'empêcher les cellules de se coller aux parois du tube de collecte, le tube peut être pré-revêtu en le remplissant avec 50% de FCS dans du PBS et incubé à température ambiante pendant 30 min. Jeter la solution de revêtement avant d'ajouter les médias de collecte.
Résultats
Comme matière première dans ce protocole, nous utilisons des tissus thymus enlevé des enfants subissant une chirurgie cardiovasculaire correctives (ministère de la chirurgie thoracique et cardiovasculaire, Clinique universitaire de Tübingen) obtenus après consentement éclairé et sous les directives institutionnelles. Ce produit rejeté peut varier considérablement en taille 2-30 g ou plus. Le nombre de MDC et des sous-ensembles de TEC (technologie cTEC et MTEC) qui sont obtenus dépend de la taille ainsi que l'âge de l'échantillon de tissu de thymus utilisé pour l'isolation.
La figure 2 montre un assez grand morceau de tissu (~ 9 cm) obtenue à partir d'un enfant de six ans. Une première étape importante dans la préparation de ce protocole est le nettoyage du tissu de parties indésirables (indiquées par les flèches blanches).
Tissu thymus a été traitée comme décrit dans les sections 2 et 3.1 du protocole d'obtenir une suspension cellulaire unique qui a été séparée à l'aide d'une seule densité Percoll centrifugation step Bien que la suspension cellulaire unique contient environ 3% des cellules HLA-DR + (figure 3A), après centrifugation Percoll ce pourcentage est augmentée dans la fraction basse densité (LDF), contenant des cellules de grande taille, de 15 à 40%, tandis que le fraction de haute densité (HDF) qui se compose principalement de petite taille uniformes thymocytes contient pratiquement pas de ces cellules (figure 3B). La fraction d'intérêt (LDF), contenant enrichi APC a ensuite été recueilli et lavé à prélever des cellules à utiliser dans les étapes d'isolement ultérieurs.
Bien que thymique mDC peut être identifiée par l'expression d'un certain nombre de marqueurs de surface, y compris CD11c9, 10, pDC expriment des marqueurs tels que BDCA-2, BDCA-4, CD45RA et CD123 11,12. Après enrichissement des cellules de FDL, les deux types de cellules constituent 2-10% de cette fraction, ce qui permet leur isolement efficace également en plus grand nombre, soit par séparation magnétique de cellules ou de tri de s'écouler CD11c + ou BDCA-4 +6 cellules.
La figure 4 montre l'isolement efficace de CD11c + cellules en utilisant le protocole de séparation magnétique des cellules modifié décrit dans la section 5. Après isolement, la pureté du CD11c + DC est de 93% établie par immunomarquage des cellules isolées. En moyenne, la reprise de isolé CD11c + DC est de 5 x 10 5 -5 x 10 6 mDC par 10 9 cellules thymiques totales données. Tableau 1 les émissions obtenues à partir de plusieurs échantillons thymus individuelles de différents âges et poids de tissu avec une gamme de l'entrée unique suspensions cellulaires ainsi que les numéros de FDL totaux et le rendement ultérieur de + CD11c et de pureté.
Dans la fraction enrichie en APC, seulement environ 0,5% des cellules sont CD45 + ou EpCAM lo CD45 + neg EpCAM. CTEC et mTEC peuvent être triés à partir des cellules digérés par la trypsine CD45 lo / neg enrichis stromales que EpCAM l o + CDR2 et EpCAM salut CDR2 -, respectivement, comme indiqué sur la figure 5.
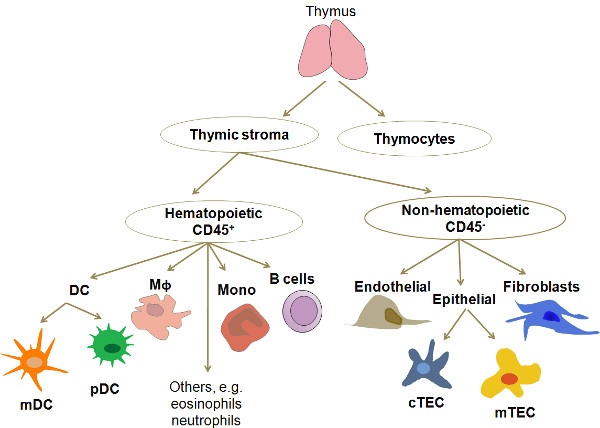
Figure 1. Un schéma simplifié de l'organisation cellulaire et la composition du thymus humain. Le thymus est constitué de thymocytes, à différents stades de maturation, et un réseau cellulaire hétérogène appelé le stroma thymique formant l'environnement thymique. Les principaux types de stroma thymique cellulaires sont MDC et PDC, les cellules épithéliales (divisés en deux grandes catégories en fonction de leur localisation dans le lobule: corticales et médullaire) et les macrophages abréviations: DC, les cellules dendritiques; MDC, les cellules dendritiques myéloïdes. pDC, les cellules dendritiques plasmacytoïdes; Mφ, macrophages, mono, monocytes; CTEC, les cellules épithéliales corticales; mTEC, les cellules épithéliales médullaires.
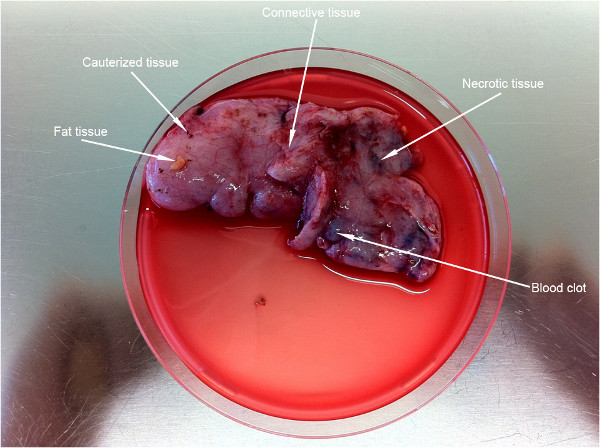
Figure 2. Première étape de préparation du tissu pour une seule cellule de préparation. Flèches indiquent les parties de tissus indésirables qui doivent être éliminés avant l'exécution du protocole.

Figure 3. Purification de l'analyse thymique APC. FACS des différentes étapes de la procédure de purification. Des suspensions monocellulaires de tissu de thymus ont été obtenus par rupture mécanique et les digestions enzymatiques série et enrichis APC (cellules de FDL) séparation par densité de Percoll-. Cellules avant (A) et après (B) la séparation de Percoll-densité ont été colorées avec anticorps anti-HLA-DR-PE pour vérifier l'enrichissement APC. gamme de pourcentage de HLA-DR + cellules généralement observés est INDICAT ed.

Figure 4. Isolation de CD11c + mDC. Tissu thymique a été digéré à l'aide de la collagénase A / DNase I pour créer une suspension cellulaire unique. CD11c + mDC représentent seulement une population mineure de la suspension de cellules individuelles (0,6%). Après enrichissement des cellules par l'intermédiaire d'une séparation de FDL densité Percoll le pourcentage de cellules CD11c + augmente à environ 9%. Les cellules ont été marquées avec FDL anticorps CD11c-PE et ensuite isolés en utilisant des billes magnétiques (anti-PE). Une nouvelle analyse de l'CD11c + population directement après la séparation magnétique des cellules par FACS a indiqué 93% de pureté. Cliquez ici pour agrandir la figure .
0951/50951fig5.jpg "/>
Figure 5. Enrichissement de CD45 des cellules lo / neg et le tri ultérieur des sous-ensembles de TEC.) Représentant parcelles de points montrant les pourcentages de CD45 négatif / bas cellules stromales thymiques dans le total des suspensions de cellules individuelles avant et après la séparation de Percoll densité (9% et 16,2%, respectivement). B) Les cellules de FDL a été appauvries en cellules CD45 hi utilisant des billes magnétiques et les sous-ensembles de TEC triés de la fraction appauvrie en EpCAM salut CDR2 - (MTEC) ou EpCAM lo CDR2 + (CTEC).
| Fréquences CD11c + MDC, les rendements des cellules et des puretés de différents bailleurs de fonds | |||||||
| Donneur | Âge | poids des tissus | Nombre de cellules par échantillon | FDL cellules par échantillon | CD11c+% | CD11c + isolé par échantillon | CD11c + pureté |
| 1 | 5 jours | 7 g | 1,45 x 10 9 | 9,5 x10 7 | 12,6 | 2.4 x 10 6 | 89% |
| 2 | 3 années | 15 g | 2 x 10 9 | 6,5 x10 7 | 4.3 | 1,9 x 10 6 | 81% |
| 3 | 21 jours | 9 g | 2,6 x 10 9 | 22 x10 7 | 10.3 | 3,6 x 10 6 | 93% |
| 4 | 6 années | 13 g | 1,4 x 10 9 | 25,4 x10 7 | 4.2 | 5,7 x 10 6 | 82% |
| 5 | 5 jours | 6,5 g | 1,3 x 10 9 | 16,2 x10 7 | 6 | 2,9 x 10 6 | 91% |
| 6 | 39 jours | 3 g | 0,6 x 10 9 | 8 x10 7 | 3.4 | 1,3 x 10 6 | 80% |
Tableau 1. Nombre de cellules en suspension de cellules simples totaux libérés après deux tours de digestion ainsi que les rendements des cellules FDL après Percoll séparation sont présentés pour les isolements effectués dans des échantillons de thymus de six personnes d'âge différent et le poids du tissu. Fréquences de MDC ont été déterminés par cytométrie de flux sur la base sur l'expression de CD11c dans les cellules de FDL totales (APC enrichi). rendement et la pureté de CD11c + cellules après la séparation des billes magnétiques sont indiqués pour chaque donateur.
Discussion
Le protocole décrit ici est une modification du protocole publié par Gotter et al 4. Les étapes critiques dans le protocole sont la condition et la préparation initiale du tissu ainsi que la séparation de densité Percoll. Nous vous recommandons fortement de traiter le tissu le plus tôt possible après la collecte. Il est important de travailler vite mais bien lors du nettoyage et couper le tissu. Lors du lavage des thymocytes décrit à l'étape 2.3, il est essentiel de trouver le juste équilibre dans l'application de pression à l'arrière du piston de la seringue sur les morceaux de tissu comme une pression trop forte et prolongée peut endommager les cellules stromales. Superposition de la moyenne au-dessus de la solution / suspension cellulaire Percoll sans causer de perturbations peut également exiger un peu de pratique. Après centrifugation, il est important de recueillir toutes les cellules de la fraction de faible densité aussi rapidement que possible à partir de la couche de Percoll avec un minimum de solution de Percoll.
Larendements cellulaires globaux et des chiffres relatifs APC peuvent être très variables (voir le tableau 1) et dépendent du donneur (surtout par rapport à l'âge) et les compétences de préparation de l'expérimentateur. Pour un bref aperçu, suspensions de cellules peuvent être colorées avec HLA-DR et / ou d'autres marqueurs qui suit différentes étapes du protocole comme vous le souhaitez. Tous les anticorps utilisés pour l'analyse phénotypique doit être adaptée pour obtenir des résultats optimaux.
En raison de la relativement faible abondance des types d'APC dans le thymus par rapport à thymoctyes, de gros morceaux de thymus pourraient être nécessaires si un plus grand nombre de cellules isolées sont souhaitées.
Si un dissociateur de tissu est disponible dans le laboratoire, ce sera considérablement accélérer le traitement des tissus, mais les deux variantes décrites ici fonctionnent aussi bien. Un problème relativement fréquent pourrait être l'agglutination des cellules, en particulier pendant les étapes entre la séparation de Percoll et MACS / tri FACS. Dans ce cas, une courte DNase je creuseestion tel que décrit dans le protocole général de résoudre le problème. Depuis tissu thymique est successivement remplacé par du tissu adipeux au cours du vieillissement, thymi de donneurs plus âgés pourrait contenir un peu de gras, qui nagera sur le dessus du tube après centrifugation des suspensions de cellules individuelles obtenues à partir des différentes étapes de la digestion. Dans un tel cas, la graisse doit être retiré avec une pipette avant de continuer le protocole. Pour des résultats optimaux, ainsi que des raisons d'économie nous vous conseillons de titrer non seulement les anticorps, mais aussi les microbilles anti-PE (articles 5 et 6). Pour l'isolement des TEC de thymus de la souris, des mélanges d'enzymes de remplacement ont été décrites pour améliorer le rendement de 8,13 TEC, mais nous ne les avons pas testé avec les tissus humains.
En principe, d'autres cellules APC et stromales thymiques, comme les cellules B et les pDC peuvent également être isolés à partir des cellules de FDL (ci-après digestion de collagénase / DNase et Percoll) par FACS / MACS tri si les marqueurs sont connus respectifs. Par exemple, pour les pDC, BDCA-2, BDCA-4 et CD123 ont été décrits en tant que marqueurs 6,14. Si l'analyse ou l'isolement des sous-ensembles de thymocytes est souhaitée, nous recommandons d'utiliser les cellules libérées en serrant (étape 2.3), car ils sont tout à fait pur et ont subi une manipulation minimale.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous sommes reconnaissants envers les chirurgiens du département de chirurgie thoracique et cardiovasculaire, Clinique universitaire de Tübingen pour nous fournir les échantillons de thymus et Bruno Kyewski (DKFZ, Heidelberg, Allemagne) pour fournir l'anticorps CDR2. Nous tenons également à remercier Hans-Jörg Bühring et Sabrina Grimm du centre de tri (Université de Tübingen). Ce travail a été soutenu par le SFB 685 et la Fondation Hertie.
matériels
| Name | Company | Catalog Number | Comments |
| Reagents and Materials | |||
| RPMI 1640 | PAA | E15-842 | |
| Dulbecco's PBS | PAA | H15-002 | |
| Fetal Bovine Serum-Gold | PAA | A15-151 | |
| Bovine Serum Albumin | PAA | K41-001 | |
| Collagenase A | Roche | 10 103 586 001 | |
| DNase I, grade II bovine pancreatic | Roche | 10 104 159 001 | |
| Trypsin-EDTA 10x in PBS | PAA | L11-001 | stock conc. 20 mg/ml |
| Alexa Fluor 488 Protein Labelling kit | Molecular Probes | A-10235 | |
| anti-human CDR2 (purified) | Bruno Kyewski, DKFZ- Heidelberg, Germany | labeled with Alexa Fluor 488 | |
| anti-human CD45 (Pacific Blue) | Biolegend | 304022 | |
| anti-human EpCAM (APC) | Miltenyi Biotec | 130-091-254 | |
| anti-human CD11c (PE) | Miltenyi Biotec | 130-092-411 | |
| anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| anti-CD45 Microbeads, human | Miltenyi Biotec | 130-045-801 | |
| LS columns | Miltenyi Biotec | 130-042-401 | |
| gentleMACS C Tubes | Miltenyi Biotec | 130-093-237 | for tissue dissociator |
| Percoll (density 1.130 g/ml) | GE Healthcare, Life Sciences | 17-0891-01 | |
| Sterile distilled Water (DNAse/ RNAse free) | GIBCO | 10977-035 | |
| Gamunex 10% | Tajecris-Biotherapeutics | G120052 | 1:10 pre-dilution, use 20 μl/1 x 106cells |
| 0.22 μm filter | Millex GS | SLGS033SS | Syringe driven |
| Stericup filter unit | Millipore | SCGPU05RE | Pump driven |
| 50 ml PC oak ridge centrifuge tubes | Nalgene | 3118-0050 | 50 ml |
| 50 ml PP conical tubes | Becton Dickinson | 352070 | |
| 12 mm x 75 mm 5 ml test tubes | Becton Dickinson | 352058 | FACS stainings |
| Cell strainer 70 μm | Becton Dickinson | 352350 | |
| INSTRUMENTS | |||
| Flow Cytometer-Sorter (BD FACSAriaTMIIu) | Becton Dickinson | ||
| Sorvall Evolution R6 (rotor) | Kendro | ||
| Rotator REAX 2 | Heidolph | ||
| gentleMACS Dissociator | Miltenyi Biotec | 130-093 235 | tissue dissociator |
Références
- Miller, J. F. A. P. The discovery of thymus function and of thymus-derived lymphocytes. Immunological Reviews. 185, 7-14 (2002).
- Klein, L., Hinterberger, M., Wirnsberger, G., Kyewski, B. Antigen presentation in the thymus for positive selection and central tolerance induction. Nat Rev Immunol. 9, 833-844 (2009).
- Vandenabeele, S., Hochrein, H., Mavaddat, N., Winkel, K., Shortman, K. Human thymus contains 2 distinct dendritic cell populations. Blood. 97, 1733-1741 (2001).
- Gotter, J., Brors, B., Hergenhahn, M., Kyewski, B. Medullary Epithelial Cells of the Human Thymus Express a Highly Diverse Selection of Tissue-specific Genes Colocalized in Chromosomal Clusters. The Journal of Experimental Medicine. 199, 155-166 (2004).
- Rouse, R. V., Bolin, L. M., Bender, J. R., Kyewski, B. A. Monoclonal antibodies reactive with subsets of mouse and human thymic epithelial cells. Journal of Histochemistry & Cytochemistry. 36, 1511-1517 (1988).
- Stoeckle, C., et al. Cathepsin S dominates autoantigen processing in human thymic dendritic cells. Journal of Autoimmunity. 38, 332-343 (2012).
- Woods Ignatoski, K. M., Bingham, E. L., Frome, L. K., Doherty, G. M. Directed trans-differentiation of thymus cells into parathyroid-like cells without genetic manipulation. Tissue Eng Part C Methods. 17, 1051-1059 (2011).
- Williams, K. M., et al. Single Cell Analysis of Complex Thymus Stromal Cell Populations: Rapid Thymic Epithelia Preparation Characterizes Radiation Injury. Clinical and Translational Science. 2, 279-285 (2009).
- Bendriss-Vermare, N., et al. Human thymus contains IFN-α-producing CD11c-, myeloid CD11c+, and mature interdigitating dendritic cells. The Journal of Clinical Investigation. 107, 835-844 (2001).
- Schmitt, N., et al. Ex vivo characterization of human thymic dendritic cell subsets. Immunobiology. 212, 167-177 (2007).
- Dzionek, A., et al. BDCA-4: Three Markers for Distinct Subsets of Dendritic Cells in Human Peripheral Blood. The Journal of Immunology. 165, 6037-6046 (2000).
- Wu, L., Shortman, K. Heterogeneity of thymic dendritic cells. Seminars in Immunology. 17, 304-312 (2005).
- Seach, N., Wong, K., Hammett, M., Boyd, R. L., Chidgey, A. P. Purified enzymes improve isolation and characterization of the adult thymic epithelium. Journal of Immunological Methods. 385, 23-34 (2012).
- Adamopoulou, E., Tenzer, S., Hillen, N., Klug, P., Rota, I. A., Tietz, S., Gebhardt, M., Stevanovic, S., Schild, H., et al. Exploring the MHC-peptide matrix of central tolerance in the human thymus. Nature Communications. , (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon