Method Article
Aislamiento de células dendríticas mieloides y células epiteliales de timo humano
En este artículo
Resumen
Este protocolo detalla un método para aislar células presentadoras de antígeno de timo humano a través de diferentes etapas de la digestión enzimática del tejido seguido por centrifugación de densidad de la suspensión de células individuales y la clasificación finalmente magnético y / o FACS de las poblaciones de células de interés.
Resumen
En este protocolo se proporciona un método para aislar células dendríticas (DC) y células epiteliales (TEC) de la timo humano. DC y TEC son la principal célula presentadora de antígeno (APC) tipos que se encuentran en un timo normal y está bien establecido que desempeñan papeles distintos durante la selección tímica. Estas células se localizan en distintos microambientes en el timo y cada tipo de APC constituye sólo una población menor de células. Para entender mejor la biología de estos tipos de células, la caracterización de estas poblaciones de células es altamente deseable, pero debido a su baja frecuencia, el aislamiento de cualquiera de estos tipos de células requiere un procedimiento eficaz y reproducible. Este protocolo detalla un método para obtener células adecuadas para la caracterización de diversas propiedades celulares. Tejido tímico se interrumpe mecánicamente y después de diferentes pasos de la digestión enzimática, la suspensión de células resultante se enriquece usando una etapa de centrifugación de densidad de Percoll. Para el aislamiento de CC mieloide (CD11c <sup> +), las células de la fracción de baja densidad (LDF) se inmunoselecciona por clasificación celular magnética. Enriquecimiento de las poblaciones de TEC (MTEC, ctec) se logra por el agotamiento de las células hematopoyéticas (CD45 hi) de la fracción de células de Percoll de baja densidad que permite su posterior aislamiento a través de células activadas por fluorescencia (FACS) utilizando marcadores de células específicos. Las células aisladas se pueden utilizar para diferentes aplicaciones posteriores.
Introducción
El timo es el órgano en el que se produce el desarrollo de células T. Su tamaño relativo y absoluto disminuye con la edad cuando se convierte sustituido sucesivamente por la grasa a pesar de la actividad del timo todavía se puede detectar en la vejez. Su importancia para la respuesta inmune se demostró a principios del decenio de 1960 1.
El repertorio de células T se forma a través de la interacción de receptores de células T con complejos de péptido-MHC en diferentes tipos de timo de APC, que proporcionan señales de supervivencia o muerte para el desarrollo de las células T, lo que resulta en un repertorio de células T funcionales y en gran medida auto-tolerante 2.
Aproximadamente el 98% de las células en el timo humano están desarrollando células T que se hace referencia como timocitos. El 2% restante consiste de un número de diferentes tipos de células, incluyendo una variedad de TEC (cortical, medular, subcapsular), mieloide y plasmocitoide DC (MDC, PDC), macrófagos, células B, células T re-circulantes maduras, granulocitos, Fibroblasts, células endoteliales y células epiteliales muy raras con un fenotipo de expresión se asemeja a la de las células de otros tejidos tales como músculo, neuronas y epitelio respiratorio (Figura 1). De éstos, TEC y DC son los principales tipos de APC se encuentran en un timo normal. En los últimos años, la purificación de estos tipos de APC para la cultura y el perfil molecular ha ganado cada vez más interés. Debido a su baja frecuencia, el aislamiento de cualquiera de estos tipos de células para el análisis detallado requiere un procedimiento eficaz, reproducible y rentable. El método que aquí se presenta es una modificación de los estudios publicados previamente 3,4.
Al igual que con cualquier otro tejido, la extracción de células del timo se puede lograr por enzimáticamente la desagregación de la célula-célula y las redes de interacción célula-matriz, con el fin de obtener una suspensión de células individuales. Hay ciertos parámetros como la buena eficiencia de disociación, rendimiento celular, la viabilidad celular y la retención de s célulasmarcadores urface que son cruciales y necesitan ser optimizado para el aislamiento con éxito de estas poblaciones celulares raras.
En este protocolo, el aislamiento de la CC y subconjuntos TEC se realiza haciendo una suspensión de una sola célula del tejido por rotura mecánica y digestión enzimática. Utilizamos colagenasa A de Clostridium histolyticum, que tiene una relación equilibrada de las diferentes actividades de la enzima, para romper el colágeno natural que mantiene el tejido juntos. DNasa I se incluye en la solución de la enzima para reducir la agregación celular debido a ADN libre de células muertas (timocitos son muy sensibles). Nosotros también ofrecemos un enfoque alternativo para la digestión enzimática del tejido típico que implica el tratamiento de tejidos mecánica y enzimática asistida por un disociador tejido. La suspensión de células individuales se somete entonces a una sola centrifugación de densidad de Percoll para el enriquecimiento de la fracción de baja densidad (LDF) de las células. A partir de esta fracción de células, DC puede ser aislado por tinción fo marcadores CC-superficie (es decir, CD11c +) y mediante separación magnética o células activadas por fluorescencia (FACS). A diferencia de las células linfoides que comprenden la gran mayoría de las células en el timo, TCE no expresan CD45 en niveles altos, pero son positivos para la molécula de adhesión celular epitelial EpCAM. ctec se puede distinguir de TCE medular por la expresión de un antígeno aún sin definir reconocido por el CDR-2 (dendrítica de reticulocitos-2 cortical) de anticuerpos 4,5 y algo menor expresión de EpCAM. El diferencial de la co-expresión de EpCAM y CDR2 permite el aislamiento eficiente de estos subconjuntos TEC a través de células de alta velocidad de clasificación 6.
El protocolo que se presenta aquí está optimizado para el tejido del timo humano. La duración del procedimiento depende de la cantidad de tejido y la capacidad del experimentador, así como la velocidad del clasificador de células, si se utiliza la separación FACS. Normalmente, el protocolo para el aislamiento de CC puede ser completado dentro de 5HR -6 y para el aislamiento de TCE en 8-10 horas. El aislamiento de la CC y subconjuntos TEC a partir de tejido del timo es sensible al tiempo. Cuanto más rápido el procedimiento de aislamiento, mejor la condición de las células. Por último, las células aisladas se pueden utilizar para investigaciones posteriores como estudios comparativos de ARNm y la expresión de proteínas, los experimentos de PCR, aislamiento de las proteínas, el perfil molecular (es decir, transcriptómica, análisis de micro ARN), así como el cultivo de células 6.
Declaración de Ética
Con el fin de ser capaz de trabajar con el tejido del timo humana que el investigador tiene que obtener la aprobación del comité de ética local o las autoridades responsables, así como un consentimiento informado por escrito del donante (o por lo general sus padres, ya que el tejido se obtiene generalmente de menor de edad los niños). Por otra parte, todos los tejidos humanos deben ser manejados como se deben tomar medidas potencialmente infecciosos y apropiadas, tales como trabajar con guantes, etc.
Protocolo
1. Preparación de herramientas, soluciones de enzimas y tampones
Lleve a cabo los siguientes pasos de preparación antes de comenzar el protocolo.
- Instrumentos
Limpio, seco y autoclave las siguientes herramientas y mantenerlos en envases estériles hasta su uso.- Tijeras afiladas pequeños con puntas curvo o recto para cortar el tejido del timo. Pinzas curvas pequeñas con puntas estriadas para la manipulación de los tejidos.
- 50 ml de la Oak Ridge Tubos de centrífuga, PC, para la etapa de centrifugación Percoll densidad.
- Las soluciones enzimáticas
Preparar la colagenasa / DNasa I mezcla de enzimas (2 mg de colagenasa / ml y 0,1 mg de DNasa I / ml) de la siguiente manera:- Disolver 500 mg de liofilizado de colagenasa A (Roche) en 250 ml de RPMI 1640 sin formato (sin FCS) para obtener una solución 2 mg / ml de colagenasa. La colagenasa es bastante difícil de disolver, por lo que se recomienda dejar un poco de tiempo en una montaña agitador a temperatura ambiente.
- Disolver 100 mg de DNasa I (Roche) en10 ml de agua destilada estéril. 2,5 ml de alícuotas se pueden almacenar a -20 ° C. Añadir 2,5 ml de la solución de 10 mg de DNasa I en la solución de 2 mg de colagenasa A.
- Filtro estéril la mezcla colagenasa / DNasa usando una unidad de filtro Stericup (0,22 m). Tienda en 10-20 ml de alícuotas a -20 ° C hasta su uso.
- Buffers y Soluciones
- 1,5 M NaCl solución madre: Disolver NaCl en agua destilada estéril a una concentración final de 1,5 M. Se filtra la solución a través de un filtro de 0,22 micras y se almacena a temperatura ambiente.
- Tampón 10x MACS: 1x PBS (Ca 2 + / Mg 2 + libre) que contiene 5% de BSA y EDTA 20 mM. Filtro estéril la solución con un filtro de 0,22 micras y se almacenan a 4 ° C. Antes de utilizar preparar una solución 1x diluyendo el 10x a 1x en frío 1 × PBS estéril.
- FACS buffer 1x PBS (Ca 2 + / Mg 2 + libre) que contiene 1% de BSA y 0,02% NaN 3.
- FACS buffer para la clasificación de células: 1x PBS (Ca 2 + / Mg 2 + libre) que contiene 2% de BSA. Esterilice utilizando un filtro de jeringa de 0,22 micras y almacenar a 4 ° C.
2. Preparación del tejido
El procesamiento del tejido se debe realizar utilizando reactivos estériles y trabajar en una cabina de flujo laminar. Antes de comenzar el procedimiento, se preparan los siguientes reactivos y equipos:
- Caliente el siguiente para RT: RPMI 1640 completo (RPMI 1640, 10% suero bovino fetal, 1% penicilina / estreptomicina), RPMI 1640 sin formato, Ca 2 + / Mg 2 + sin solución de la enzima colagenasa / DNasa 2x PBS y.
- Incubadora térmica caliente con unidad de rotación de 37 ° C y enfriar ángulo fijo rotor de centrifugación a 4 ° C.
- Prepare una caja con hielo.
Nota: la duración de este paso depende de la condición y tamaño del tejido. Aproximadamente 20 a 30 min se necesita tiempo razonable para una pieza de tamaño medio de tincidencia en buen estado (~ 5 cm de ancho).
- Coloque el tejido en una placa de Petri que contiene PBS estéril y enjuagar cualquier sangre residual.
- Añadir PBS fresca para evitar que el tejido se seque y el uso de fórceps y tijeras limpiar el tejido de coágulos de sangre, el tejido conjuntivo y la grasa y cualquier parte que no se ve saludable.
- Tenga cuidado de eliminar el tejido necrótico que aumentará la cantidad de escombros.
- Después de la limpieza, se pesa el tejido para referencia.
- Cortar el tejido de aproximadamente 1 cm 3 pedazos / bloques. Añadir suficiente PBS para cubrir el tejido.
Nota: Para la reproducibilidad de los resultados, el tejido debe ser cortado en trozos de tamaño uniforme.
- El uso de la parte posterior de una jeringa estéril (10-20 ml) aplicar presión (no demasiado vigorosa o prolongada) sobre las piezas de tejido del timo. Este procedimiento eliminará la mayor parte de los timocitos, reduciendo así el volumen de tejido a ser digerido más tarde. Realice este paso en el hielo y trabajar rápido.
- La solución se volverá visiblemente turbia como timocitos son liberados. Se agita la placa suavemente y luego con la ayuda de una pipeta de 5 ml o un aspirador de vidrio eliminar el sobrenadante que contiene los timocitos teniendo cuidado de no aspirar accidentalmente las piezas de tejido.
Consejo: Un raspador de cultivo celular estéril se puede utilizar para concentrar todos los trozos de tejido en un lado del plato y luego inclinar el plato (45 ° de ángulo) y aspirar el sobrenadante. Reemplazar con PBS fresco y repita este procedimiento hasta que el sobrenadante es relativamente transparente. Realice último lavado con RPMI sin formato.
- Picar las piezas de tejido con unas tijeras afiladas (lo más fino posible, los fragmentos deben ser de al menos 2-4 mm). Los fragmentos deben ser lo suficientemente pequeño para entrar en una pipeta de 5 ml.
3. Preparación de la suspensión de células individuales de tejido del timo
Aquí,se describen dos enfoques alternativos para este paso. El primer enfoque se describe una digestión enzimática de tejidos típicos (sección 3.1), mientras que el segundo consiste en el tratamiento de tejidos mecánica y enzimática asistida por un disociador de tejido (sección 3.2).
Este protocolo está optimizado para el procesamiento de muestras de tejido que pesan 5 g. Para muestras de tejido más grandes o más pequeñas, ajustar los volúmenes de la enzima en consecuencia.
3,1 Típica digestión enzimática de tejido para obtener una suspensión de células individuales
- Coloque puré de tejido en tubos de 50 ml con una solución de 10 ml de colagenasa / DNasa por 5 g de tejido. Añadir RPMI sin formato para obtener un volumen total de 20 ml.
Nota: en un tubo de 50 ml de digerir hasta 10 g de tejido. Ajuste el volumen de la enzima en consecuencia.
- Incubar la suspensión de tejido durante 40 min a 37 ° C bajo rotación lenta en una incubadora térmica.
Nota: los pasos de incubación se pueden realizar ya sea en un incubador térmica con una unidad de rotación, o en una incubadora bacteriana 37 ° C con un agitador.
- La solución enzimática se convertirá nublado como las células se liberan en él. Al final de la digestión, el tubo se centrifuga a 110 xg durante 2 min para sedimentar los fragmentos de tejido.
- Recoger el sobrenadante de esta ronda de la digestión. Pellet la suspensión de células durante 10 min a 400 x g. Aspirar el sobrenadante y volver a suspender las células en 10-50 ml de medio RPMI completo, dependiendo del tamaño del sedimento celular.
- Guarde la suspensión celular en 37 ° C incubadora con la tapa suelta.
- Si se desean el número de células más grandes, la etapa de digestión se puede repetir con los fragmentos de tejido restantes y la primera y la segunda digerir agruparon. Además, si TEC debe ser aislado, dos rondas de las digestiones se deben realizar.
- Diluir una alícuota de la suspensión celular en azul tripán (1:10-1:100) y contar las células viables utilizando un hemocitómetro.
- Mantener las células a 37 ° C en la incubadora hasta que esté listo para pasar a la centrifugación de densidad de Percoll (sección 4). Aislamiento posterior de los subgrupos de CD (sección 5) se realizará a partir de estas células.
Nota: los tejidos tímicos pueden variar en su composición, especialmente con la edad, que afecta a la eficiencia de la digestión y la generación de una suspensión de una sola célula.
- Para el posterior aislamiento de las células epiteliales del timo (TEC) es necesaria una tercera ronda de la digestión enzimática. Restos de tejido Volver a suspender en 10 ml de solución de colagenasa / DNasa fresco más 10 ml de medio RPMI normal y añadir tripsina / EDTA (01:50 de 2,5% de stock) en la solución.
- Incubar a 37 ° C durante 40 minutos con rotación suave. Durante los últimos 10 - 15 min de la incubación añadir FCS (01:05) para neutralizar la actividad de la tripsina.
- Centrifugar a 110 xg durante 2 minutos a temperatura ambiente para sedimentar los fragmentos de tejido.
Nota: El tejido no puede ser digerido por completo después de estas tres rondas de las digestiones. La edad y el estado general del tejido son dos parámetros que influyen en la eficiencia de disociación del tejido del timo.
- Recoger el sobrenadante celular y descartar los fragmentos de tejido sedimentadas.
- Centrifugar el sobrenadante de las células a 400 xg durante 10 min. Aspirar el sobrenadante y resuspender el sedimento de células en medio RPMI completo.
Consejo: Los sedimentos celulares son bastante flojo, así que tenga cuidado cuando deseche / aspiración sobrenadante.
- Contar las células viables usando un hemocitómetro. Coloque las células en una incubadora a 37 ° C hasta que proceder a la separación de Percoll (sección 4). Con posterioridad pre-enriquecimiento de células TEC por el agotamiento de las células CD45 hi se realizará a partir de estas células (sección 6).
3.2 de tratamiento del tejido mecánico y enzimático asistido por un disociador tejido
Uso del tejido disociador aproximan los pasos de digestión del tejido se pueden reducir a la mitad el tiempo necesario con el enfoque descrito anteriormente (sección 3.1). El siguiente protocolo es una versión modificada de la utilizada para disociar tejido del timo de ratón para el aislamiento de TCE 7,8.
- Transferencia de 5 g de trozos de tejido picado (paso 2,5) en un tubo de C que contiene 10 ml de solución de colagenasa / DNasa.
- Adaptar tubo C en el disociador tejidos y m_spleen_02 ejecución del programa (10 seg.) Repita este programa de 4-5x (40-50 seg).
- Incubar con rotación suave durante 20 min a 37 ° C.
- Se centrifuga a 110 g durante 2 minutos a temperatura ambiente.
- Recoger el sobrenadante y proceder como en el paso 3.1.4. Añadir 10 ml de solución de colagenasa / DNasa fresco.
- Adaptar tubo C en el disociador tejidos y m_spleen_01 ejecución del programa (56 seg.)
- Incubar a 37 ° C durante 20 minutos con rotación suave.
- Se centrifuga a 110 g durante 2 minutos a temperatura ambiente.
- Collecsobrenadante de células T y sedimentar la suspensión de células durante 10 min a 400 x g. Proceder como en el paso 3.1.4.
- Como se describe en 3.1.9 se necesita una tercera ronda de la digestión para el posterior aislamiento de las células epiteliales del timo (TEC). Para esto, restos de tejido volver a suspender en 10 ml de solución de colagenasa / DNasa frescas, además de tripsina / EDTA (1:50 dilución de 2,5% de stock)
- Incubar a 37 ° C durante otros 20 minutos con rotación suave. Añadir FCS (01:05) y se incuba durante 10 min adicionales.
Nota: Utilizando este enfoque, después de esta última digestión paso el tejido es generalmente completamente disociado y no se observan fragmentos de tejido no digerido.
- Proceder como en los pasos 3.1.11-3.1.14.
4. Enriquecimiento de LDF de las células con separación Percoll densidad
Después de la digestión enzimática del tejido, el total de suspensiones de células individuales tímicos se someten a un solo centrifugat densidad de Percollpaso de iones para enriquecer las células LDF. El LDF de las células es altamente enriquecido para APC. Tanto DC y TEC se detectan en esta fracción de las células.
- Utilice suspensión de células individuales obtenidos a partir de la 1 ª y 2 ª digiere para aislamiento mDC (células agrupadas, consulte el paso 3.1.8) o 3 rd digest (para el aislamiento TEC) (3.1.14). Centrifugar la suspensión de una sola célula obtenida de cada etapa de digestión a 400 xg durante 10 min.
- Prepare una solución de Percoll con una densidad final de 1,07 g / ml durante esta etapa de lavado (ver ejemplo en la tabla de abajo).
Preparación de la solución de Percoll a una densidad final de 1,07 g / ml (ρ = 1,07) Tubo Número 1 2 3 4 Sin diluir Percoll (ρ = 1,130) (ml) 2.96 5.92 8.88 11.84 NaCl 1,5 M (ml) 0.6 1.20 1.8 2.4 H 2 O destilada (ml) 2.44 4.88 7.32 9.76 Volumen de dilución final de trabajo 6 ml 12 ml 18 ml 24 ml - El número de tubos de Percoll depende de los números de células determinados en los pasos 3.1.8 y / o 3.1.14. Combinar las soluciones estériles y mezclar bien. Para el aislamiento óptimo, 0,6-1 x 10 9 células se pueden cargar por tubo de Percoll. Combinar las soluciones estériles y mezclar bien.
Consejo: Percoll es sensible a la luz y, además, hay que tener frío. Preparar primero la mezcla que contiene el NaCl y H2O (RT) y añadir sin diluir de Percoll pasado, justo antes de resuspender las células en la solución de Percoll.
tienda "> Nota: la densidad de Percoll puede variar entre los diferentes proveedores y lotes Si la densidad de la solución de Percoll sin diluir no es igual a 1,130 g / ml, siga las instrucciones proporcionadas por el fabricante para calcular las cantidades exactas de Percoll y H 2 O requerida para conseguir una densidad final de 1,07 g / ml.- Resuspender hasta 1 x 10 9 células en 6 ml de la solución de Percoll preparado (ρ = 1.07), mezclar lo suficiente como para obtener una suspensión homogénea, y transferir a un tubo de centrífuga de tapón de rosca de policarbonato de 50 ml de Oak Ridge.
- Capa con cuidado 30 ml de medio RPMI completo por tubo con una pipeta en la parte superior de la suspensión de la solución de Percoll / célula. Cargar el medio lentamente, de modo que permanezca en la parte superior de la suspensión y tener cuidado de no perturbar la capa.
- Pesar los tubos para asegurarse de que tienen el mismo peso para que estén equilibrados durante la centrifugación. Si no lo son, añadir cuidadosamente más medio al tubo más ligero (bajo Stcondiciones erile).
- Transferir cuidadosamente los tubos a una centrífuga de pre-enfriado con un rotor de ángulo fijo, y centrifugado a 3500 xg durante 35 min, a 4 ° C con el freno desconectado. Asegúrese de que la temperatura de la centrífuga no superior a 4 ° C.
- Retire los tubos de la centrífuga y cuidadosamente recoger el enriquecida de APC, que se encuentra en la interfase entre el Percoll y el medio (fracción de baja densidad) de cada tubo utilizando una pipeta Pasteur estéril. Células de transferencia en un tubo de 50 ml que contiene frío RPMI completo. Llenar el tubo con el fin de diluir el restante Percoll.
- Centrifugar la suspensión celular durante 10 min a 300 xg a 4 ° C. Desechar el sobrenadante y repetir el lavado.
- Resuspender el sedimento celular en medio y determinar el número de células (utilizando azul de tripano y un hemocitómetro). En nuestra experiencia, el porcentaje de las células LDF es de aproximadamente 2-20% de la suspensión de células individuales total obtenido después de la digestión de la enzima. A y típicaield de células enriquecidas de baja densidad (de un joven timo, rango de años 1 día-2) es 1x10 8 células por 1 x 10 9, lo que representa un 10% de las células en suspensión de células individuales en total.
Nota: En esta etapa, es posible observar que las células agregadas en la suspensión (especialmente con muestras de niños de mayor edad). Grupos de células son indicación de la muerte celular y el resultado de la liberación de ADN de las células que mueren que se pueden pegar las células juntas. En tal caso, añadir DNasa I en la muestra (50 g / ml) y se incuba durante un máximo de 20 min a TA (invertir suavemente cada 5 min) para digerir las moléculas de ADN libre.
5. Aislamiento de tímico mDC
Después del enriquecimiento de APC (a través de la separación de Percoll), MDC se puede aislar de manera eficiente desde el LDF después de la primera y segunda ronda de digestiones enzimáticas. El siguiente protocolo es una versión modificada de la separación celular magnética para el aislamiento de MDC (CD11c +).
- Centrífuga de APC enriquecido células aisladas de la suspensión de células individuales obtenidos a partir de la primera y segunda agrupada la digestión enzimática a 300 xg durante 10 min a 4 ° C y sedimento de células se resuspende en tampón MACS 100 l por 10 7 células.
- Añadir 5 l de anticuerpo CD11c-PE por 10 7 células.
Nota: Los experimentos de titulación se recomienda para obtener resultados óptimos.
- Mezclar bien e incubar durante 15 min a 4 ° C, protegido de la luz.
- Lavar las células mediante la adición de 1-2 ml de tampón de MACS por 10 7 células y centrifugar a 300 xg durante 10 min.
- Aspirar el sobrenadante y resuspender completamente hasta 10 7 células en 80 l de tampón MACS.
- Añadir 20 l de microperlas anti-PE por 10 7 células.
- Mezclar bien (No Vortex) e incubar durante 15 min a 4 ° C protegido de la luz.
- Repita como en el paso 5.4.
- Resuspender hasta 10 8 células en 500 l de tampón.
- Si es necesario, la suspensión de células del filtro utilizando un filtro de 40 micras de células para eliminar los residuos y agregados de células que puedan obstruir el flujo de la columna.
- Utilice una columna LS desde las suspensiones de células del timo fluyen mejor a través de las columnas LS. Preparar la columna LS siguiendo las instrucciones del fabricante. Pipeta suspensión celular lentamente en la columna evitando la generación de burbujas. Utilice una columna por cada 1 x 10 8 células.
- Lavar la columna siguiendo las instrucciones del fabricante. Retire la columna de imán y colóquelo en un recipiente estéril 12 ml redondas tubo de polipropileno de fondo. Añadir 3 ml de tampón MACS en la columna y recoger las células marcadas magnéticamente-insertando y empujando firmemente el émbolo en la columna.
- Recoger la fracción eluida que representa el CD11c + MDC y centrifugar a 400 xg durante 6 min.
- Determinar el número de células y confirmar la pureza de la població celda seleccionadaen por análisis de citometría de flujo. Se sugieren los siguientes marcadores CD45, CD11c, y HLA-DR.
Nota: CD11c + MDC también se puede aislar utilizando un clasificador FACS.
6. El enriquecimiento de las células CD45 altas / neg para la clasificación de células de TEC
Para el aislamiento de TCE, las células pueden ser pre-enriquecidos por agotamiento de las células CD45 hi utilizando microperlas CD45, con el fin de acelerar su aislamiento a través de la clasificación de células.
Utilice suspensión de células individuales obtenidos a partir de la etapa de digestión 3 ª (3.1.14) y posteriormente separados por centrifugación de Percoll.
- Suspensión de células Centrifugar a 300 xg durante 10 min a 4 ° C y sedimento de células se resuspende en 80 mu l de tampón MACS por 10 7 células.
- Utilice microperlas CD45 a 1/3 de la cantidad recomendada (6,7 l) por 10 7 células.
Nota: Mediante el uso de una menor cantidadde las microperlas que pre-enriquecemos células tanto para CD45 lo y neg células CD45. Se recomienda titulación para obtener resultados óptimos.
- Mezclar bien agitando suavemente el tubo (No Vortex) y se incuba durante 15 min a 4 ° C.
- Lave las microperlas no unidos mediante la adición de 10 ml de tampón de MACS y se centrifuga durante 10 minutos a 300 xga 4 º C. Aspirar el sobrenadante por completo.
- Resuspender hasta 10 8 células en 500 l de tampón.
- Si es necesario, la suspensión de células del filtro utilizando un filtro de 70 micras de células para eliminar los residuos y agregados de células que puedan obstruir el flujo de la columna.
- Utilice una columna LS desde las suspensiones de células del timo fluyen mejor a través de las columnas LS. Preparar la columna LS siguiendo las instrucciones del fabricante. Pipeta suspensión celular lentamente en la columna evitando la generación de burbujas. Utilice una columna por cada 10 8 células.
- Recoger las células no marcadas (flujo continuo y lava) que contienenla fracción de células y más altas / neg CD45 lavar la columna siguiendo las instrucciones del fabricante.
- Centrifugar a 300 xg durante 10 min a 4 ° C y sedimento de células se resuspende en tampón FACS estéril con el fin de determinar el número de células y proceder a la tinción para la clasificación de células.
7. Las células de la mancha para la clasificación de células de fluorescencia Activado
- A realizar la operación de FcR de bloqueo antes de la tinción celular, con el fin de reducir anticuerpo unión no específica. Incubar suspensión de células con agregados de inmunoglobulinas humanas solución durante 15 min a TA. Estos reactivos están comercialmente disponibles (es decir, Gammunex solución al 10%).
- Lavar las células mediante la adición de tampón FACS frío estéril. Se centrifuga a 400 g durante 6 min a 4 ° C.
- Desechar el sobrenadante y volver a suspender las células en tampón FACS frío estéril. Preparar 5 muestras de acuerdo con el siguiente ejemplo:
Muestra Tipo de muestra Anticuerpo Número de la célula Volumen total 1. sin mancha control 1 x 10 6 50 l 2.scc *-Pacific Blue control CD45-Pacific Blue 1 x 10 6 50 l 3. scc-APC control CD3-APC 1 x 10 6 50 l 4.scc-Alexa 488 control CD8-Alexa 488 1 x 10 6 50 l 5. Célula de clasificación analito CD45-Pacific Blue
EpCAM-APC
CDR2-Alexa 48810 x 10 6 - 50 x 10 6 500 l
10 x 10 6 l células/100* Scc, solo control de color
- Se incuban las células con anticuerpos durante 30 minutos, en hielo en la oscuridad.
- Lavar dos veces con tampón FACS mediante la centrifugación de las células a 400 xg durante 6 min a 4 ° C.
- Ajustar la concentración de células de la muestra a ser ordenados a 1 x 10 7 células / ml (o a la concentración recomendada por el centro de clasificación celular) usando FACS estériles tampón para la clasificación de células (es decir, sin NaN 3).
- Pase muestra de células a través de un colador de 70 micras de células para eliminar los grumos de células que pueden obstruir el citómetro durante la clasificación.
- Resuspender las muestras de control en 200-400 l de tampón. Mantener los tubos en hielo y protegido de la luz.
- Preparar los tubos de recogida con el medio.
Notas:
- Realizar la titulación de los anticuerpos para la tinción óptima.
- En una muestra de clasificar, de hasta 50 x 10 6 células pueden teñirse en un volumen total de reacción de500 l.
- Realizar tinción de la muestra a ser ordenados en tubos de 5 ml de fondo redondo Falcon de poliestireno. Los controles de color individuales se pueden teñir en pocillos separados de una placa de 96 pocillos.
- Desde subconjuntos TEC son poblaciones raras, es aconsejable utilizar otro marcador positivo (de alta frecuencia) para cada fluorocromo para facilitar la determinación de los ajustes adecuados de FACS y para asegurarse de que tiene una indemnización adecuada si la elección de fluorocromos requiere compensación. Las células de la fracción CD45 + se pueden teñir con marcadores tales como CD45, CD3 o CD8 para los diferentes fluorocromos y después de la tinción de células no teñidas CD45 + se pueden añadir a la muestra.
8. Aislamiento de TCE por fluorescencia la clasificación de células Activado
Subconjuntos TEC pueden ser ordenadas por la fracción más altas / neg CD45 como hi EpCAM CDR2 - (MTEC) o EpCAM lo CDR2 + (CTEC).
- Ejecute el ingenio de la muestrah las células no teñidas y ajustar la dispersión frontal y lateral con el fin de colocar la población de interés en la escala. Ajustar la tensión en cada detector de manera que las células son visibles, pero situado en la parte de la mano izquierda del histograma.
- Ejecute cada muestra única de colores y ajustar la compensación para cada color.
- Después de ajustar el voltaje y la compensación por los controles de colores sin teñir y solteras ejecutar el ejemplo a clasificar y utilizar herramientas de activación periódica para definir la población de interés. Utilice una amplia puerta de adelante y dispersión lateral para asegurar la inclusión de todos los tamaños de células del estroma, mientras que excluye los desechos celulares.
- En el gráfico de puntos con Blue CD45-Pacífico frente a la dispersión de compuerta en los neg células bajos y CD45 CD45.
- Aplicar esta puerta a un EpCAM frente CDR2 gráfico de puntos y determinar colocando puertas a las poblaciones a ser ordenados.
- Una vez que las puertas se han determinado, seleccione las puertas que contienen las poblaciones de interés y empezar a ordenar.
- Una vez ordenados células han sido recogidos, centrifugar la suspensión de células, y las células se resuspenden en medio o tampón de elección en función de la aplicación posterior previsto.
Nota: Durante la clasificación con el fin de evitar que las células se adhieran a los lados del tubo de recogida, el tubo puede ser pre-recubierto por llenándolo con 50% de FCS en PBS y se incubó a TA durante 30 min. Deseche la solución de revestimiento antes de la adición de medios de cobro.
Resultados
Como material de partida en este protocolo se utiliza tejido del timo retirado de los niños sometidos a cirugía cardiovascular correctiva (Departamento de Cirugía Torácica y Cardiovascular, Clínica Universitaria de Tubinga) obtenidas después de consentimiento informado y bajo las directrices del centro. Este material de desecho puede variar mucho en tamaño de 2 a 30 g o más. El número de MDC y subconjuntos TEC (ctec y MTEC) que se obtienen dependen del tamaño, así como la edad de la muestra de tejido de timo usada para el aislamiento.
La Figura 2 muestra una pieza bastante grande de tejido (~ 9 cm) obtenido a partir de un niño de seis años de edad. Una primera etapa preparativa importante en este protocolo es la limpieza del tejido de las partes no deseables (indicadas por las flechas blancas).
El tejido del timo fue tratado como se indica en las secciones 2 y 3.1 del protocolo para obtener una suspensión de células que se separó utilizando una sola densidad Percoll centrifugación sTEP mientras que la suspensión de una sola célula contiene aproximadamente el 3% de las células HLA-DR + (Figura 3A), después de la centrifugación de Percoll este porcentaje se incrementa en la fracción de baja densidad (LDF), que contiene células de gran tamaño, a 15-40%, mientras que el fracción de alta densidad (HDF) que se compone principalmente de uniformes de pequeño tamaño timocitos contiene prácticamente ningún tipo de células (Figura 3B). La fracción de interés (LDF), que contiene enriquecido de APC se recogió y se lavó para recoger las células para su uso en etapas de aislamiento posteriores posteriormente.
Mientras tímico MDC puede ser identificado por la expresión de un número de marcadores de superficie, incluyendo CD11c9, 10, PDC expresan marcadores tales como BDCA-2, BDCA-4, CD45RA y CD123 11,12. Después del enriquecimiento de las células LDF, ambos tipos de células constituyen 2-10% de esta fracción, lo que permite su aislamiento eficiente también en grandes cantidades, ya sea por separación celular magnética o el flujo de clasificación de CD11c + o BDCA-4 +células 6.
La figura 4 muestra el aislamiento eficiente de células CD11c + utilizando el protocolo de separación celular magnética modificado descrito en la sección 5. Después del aislamiento, la pureza de la CD11c + CC fue del 93% según lo establecido por la inmunotinción de las células aisladas. En promedio, la recuperación de los aislados CD11c + DC es de 5 x 10 5 x 10 -5 6 mDC por 10 9 células del timo total de datos. Tabla 1 muestra los obtenidos a partir de varias muestras de timo individuales de diferente edad y el peso del tejido con un rango de entrada única Las suspensiones de células, así como el número total de LDF y el CD11c + posterior rendimiento y pureza.
En la fracción enriquecida de APC, sólo aproximadamente el 0,5% de las células son CD45 Lo EpCAM + o CD45 + Neg EpCAM. CTEC y MTEC pueden ser ordenadas por los CD45 altas / neg células estromales enriquecidos tripsina digerido como EpCAM l O CDR2 + y EpCAM de alta CDR2 -, respectivamente, como se muestra en la Figura 5.
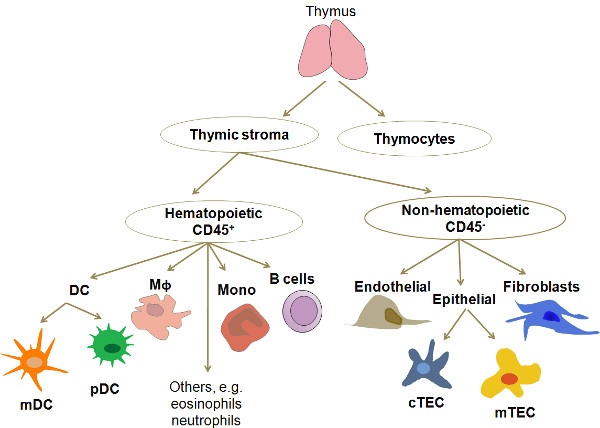
Figura 1. Un diagrama simplificado de la organización celular y la composición del timo humano. El timo consiste en timocitos, en las diferentes etapas de maduración, y una red celular heterogénea conoce como el estroma tímico que forman el medio ambiente tímico. Los principales tipos de células del estroma del timo, las células son MDC y PDC epiteliales (divididas en dos categorías principales en función de su localización dentro del lóbulo: cortical y medular) y macrófagos Abreviaturas: CC, células dendríticas, células dendríticas mieloides, MDC;. pDC, las células dendríticas plasmocitoides; Mφ, macrófagos; mono, monocitos; CTEC, las células epiteliales corticales; MTEC, las células epiteliales medulares.
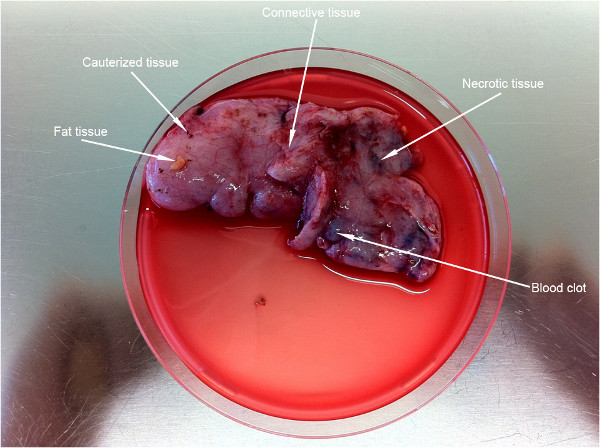
Figura 2. Primera etapa preparativa del tejido de una sola célula de preparación. Punto de flechas para las partes de tejido indeseables que necesitan ser desechado antes de la ejecución del protocolo.

Figura 3. La purificación de tímico análisis de APC. FACS de las diferentes etapas del procedimiento de purificación. Suspensiones celulares individuales de tejido del timo se obtuvieron mediante rotura mecánica y digestiones enzimáticas de serie y APC enriquecidos (células LDF) por separación de Percoll-densidad. Las células antes (A) y después (B) de la separación Percoll densidad se tiñeron con anticuerpos HLA-DR-PE para comprobar el enriquecimiento APC. Rango de porcentaje de células HLA-DR + observadas normalmente es mó ed.

Figura 4. Aislamiento de CD11c + MDC. Tejido del timo se digirió utilizando colagenasa A / DNasa I para crear una suspensión de células individuales. CD11c + mDC representan sólo una población menor de la suspensión de células individuales (0,6%). Después del enriquecimiento de las células LDF a través de la separación de Percoll densidad el porcentaje de células CD11c + aumenta a ~ 9%. Las células LDF se marcaron con anticuerpo CD11c-PE y posteriormente aislarse usando perlas magnéticas (anti-PE). El reanálisis del CD11c + población directamente después de la separación magnética de células por FACS indicó 93% de pureza. Haga clic aquí para ver más grande la figura .
0951/50951fig5.jpg "/>
Figura 5. El enriquecimiento de las células más altas / neg CD45 y la posterior clasificación de los subconjuntos TEC. A) Representante gráficos de puntos que muestran porcentajes de CD45 negativa / células estromales tímicas bajos en el total de suspensiones de células individuales antes y después de la separación de Percoll densidad (9% y 16,2%, respectivamente). B) Las células LDF se agotan las células CD45 hi usando perlas magnéticas y los subconjuntos TEC ordenados de la fracción empobrecido como hi EpCAM CDR2 - (MTEC) o EpCAM lo CDR2 + (CTEC).
| Frecuencias CD11c + MDC, los rendimientos celulares y purezas de diferentes donantes | |||||||
| Donante | Edad | Peso de tejido | Células totales por muestra | LDF células por muestra | CD11c+% | CD11c + aislado por muestra | CD11c + pureza |
| 1 | 5 días | 7 g | 1.45 x 10 9 | 9,5 x10 7 | 12.6 | 2.4 x 10 6 | 89% |
| 2 | 3 años | 15 g | 2 x 10 9 | 6,5 x10 7 | 4.3 | 1,9 x 10 6 | 81% |
| 3 | 21 días | 9 g | 2,6 x 10 9 | 22 x10 7 | 10.3 | 3.6 x 10 6 | 93% |
| 4 | 6 años | 13 g | 1,4 x 10 9 | 25,4 x10 7 | 4.2 | 5.7 x 10 6 | 82% |
| 5 | 5 días | 6,5 g | 1,3 x 10 9 | 16,2 x10 7 | 6 | 2.9 x 10 6 | 91% |
| 6 | 39 días | 3 g | 0,6 x 10 9 | 8 x 10 7 | 3.4 | 1.3 x 10 6 | 80% |
Tabla 1. Números de células en suspensión de células individuales total liberado después de dos rondas de la digestión, así como los rendimientos de células LDF después de la separación de Percoll se muestran para aislamientos realizados en muestras de timo de seis individuos de diferente edad y el peso del tejido. Frecuencias de MDC se determinaron por citometría de flujo basada en la expresión de CD11c en células totales LDF (APC enriquecido). rendimiento y pureza de células CD11c + después de la separación de perlas magnéticas se muestran para cada donante individual.
Discusión
El protocolo aquí descrito es una modificación del protocolo publicado por Gotter et al 4. Los pasos críticos en el protocolo son la condición y la preparación inicial del tejido, así como la separación por densidad de Percoll. Recomendamos para procesar el tejido tan pronto como sea posible después de su recolección. Es importante trabajar rápido pero bien al limpiar y cortar el tejido. Durante el lavado de timocitos se describe en el paso 2.3, es fundamental encontrar el equilibrio adecuado en la aplicación de presión con la parte posterior del émbolo de la jeringa en las piezas de tejido como una presión demasiado fuerte y prolongado puede dañar las células del estroma. Estratificación del medio en la parte superior de la solución / suspensión celular Percoll sin causar perturbaciones también puede requerir un poco de práctica. Después de la centrifugación, es importante recoger todas las células de la fracción de baja densidad lo más rápidamente posible a partir de la capa de Percoll con una cantidad mínima de solución de Percoll.
Lalos rendimientos celulares totales y cantidades relativas de APC pueden ser muy variables (véase la Tabla 1) y dependerá del donante (especialmente con respecto a la edad) y las habilidades preparativas del experimentador. Para una breve descripción, las suspensiones de células se pueden teñir con el HLA-DR y / u otros marcadores siguiendo diferentes etapas del protocolo, según se desee. Todos los anticuerpos utilizados para el análisis fenotípico se deben titular para lograr resultados óptimos.
Debido a la abundancia relativamente baja de los tipos de APC en el timo en comparación con thymoctyes, podrían ser necesarias grandes piezas de timo si se desean un mayor número de células aisladas.
Si un disociador tejido está disponible en el laboratorio, lo que acelerará considerablemente el procesamiento de tejidos, pero ambas variaciones descritas aquí funciona igual de bien. Un problema relativamente frecuente podría ser la aglutinación de las células, especialmente durante las etapas entre la separación de Percoll y MACS / FACS clasificación. En este caso, un corto DNasa I cavarestion como se describe en el protocolo suele resolver el problema. Dado que el tejido del timo se sustituye sucesivamente por el tejido graso durante el envejecimiento, los timos de donantes mayores puede contener un poco de grasa, que nadar en la parte superior del tubo después de la centrifugación de las suspensiones de células individuales obtenidos a partir de los diferentes pasos de digestión. En tal caso, la grasa debe eliminarse con una pipeta antes de continuar el protocolo. Para obtener resultados óptimos, así como razones de economía aconsejamos para valorar no sólo los anticuerpos, sino también a las microperlas anti-PE (secciones 5 y 6). Para el aislamiento de TEC de timo de ratón, mezclas alternativas de enzimas se han descrito para mejorar el rendimiento TEC 8,13, pero no las hemos probado con el tejido humano.
En principio, otras APC y células estromales tímicas como las células B y el PDC también se pueden aislar de las células (LDF siguientes digestión con colagenasa / DNasa y de Percoll) por FACS / MACS de clasificación si se conocen los respectivos marcadores. Por ejemplo, para el PDC, BDCA-2, BDCA-4 y CD123 se han descrito como marcadores 6,14. Si se desea un análisis o aislamiento de subconjuntos de timocitos, se recomienda utilizar las células liberadas apretando (paso 2.3), ya que son bastante pura y han sido sometidos a una manipulación mínima.
Divulgaciones
Ningún conflicto de interés declarado.
Agradecimientos
Estamos muy agradecidos a los cirujanos del Departamento de Cirugía Torácica y Cardiovascular, Clínica Universitaria de Tubinga por proporcionarnos las muestras de timo y Bruno Kyewski (DKFZ, Heidelberg, Alemania) para proporcionar el anticuerpo CDR2. También nos gustaría dar las gracias a Hans-Jörg Bühring y Sabrina Grimm de las instalaciones de clasificación (Universidad de Tubinga). Este trabajo fue apoyado por el SFB 685 y la Fundación Hertie.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagents and Materials | |||
| RPMI 1640 | PAA | E15-842 | |
| Dulbecco's PBS | PAA | H15-002 | |
| Fetal Bovine Serum-Gold | PAA | A15-151 | |
| Bovine Serum Albumin | PAA | K41-001 | |
| Collagenase A | Roche | 10 103 586 001 | |
| DNase I, grade II bovine pancreatic | Roche | 10 104 159 001 | |
| Trypsin-EDTA 10x in PBS | PAA | L11-001 | stock conc. 20 mg/ml |
| Alexa Fluor 488 Protein Labelling kit | Molecular Probes | A-10235 | |
| anti-human CDR2 (purified) | Bruno Kyewski, DKFZ- Heidelberg, Germany | labeled with Alexa Fluor 488 | |
| anti-human CD45 (Pacific Blue) | Biolegend | 304022 | |
| anti-human EpCAM (APC) | Miltenyi Biotec | 130-091-254 | |
| anti-human CD11c (PE) | Miltenyi Biotec | 130-092-411 | |
| anti-PE Microbeads | Miltenyi Biotec | 130-048-801 | |
| anti-CD45 Microbeads, human | Miltenyi Biotec | 130-045-801 | |
| LS columns | Miltenyi Biotec | 130-042-401 | |
| gentleMACS C Tubes | Miltenyi Biotec | 130-093-237 | for tissue dissociator |
| Percoll (density 1.130 g/ml) | GE Healthcare, Life Sciences | 17-0891-01 | |
| Sterile distilled Water (DNAse/ RNAse free) | GIBCO | 10977-035 | |
| Gamunex 10% | Tajecris-Biotherapeutics | G120052 | 1:10 pre-dilution, use 20 μl/1 x 106cells |
| 0.22 μm filter | Millex GS | SLGS033SS | Syringe driven |
| Stericup filter unit | Millipore | SCGPU05RE | Pump driven |
| 50 ml PC oak ridge centrifuge tubes | Nalgene | 3118-0050 | 50 ml |
| 50 ml PP conical tubes | Becton Dickinson | 352070 | |
| 12 mm x 75 mm 5 ml test tubes | Becton Dickinson | 352058 | FACS stainings |
| Cell strainer 70 μm | Becton Dickinson | 352350 | |
| INSTRUMENTS | |||
| Flow Cytometer-Sorter (BD FACSAriaTMIIu) | Becton Dickinson | ||
| Sorvall Evolution R6 (rotor) | Kendro | ||
| Rotator REAX 2 | Heidolph | ||
| gentleMACS Dissociator | Miltenyi Biotec | 130-093 235 | tissue dissociator |
Referencias
- Miller, J. F. A. P. The discovery of thymus function and of thymus-derived lymphocytes. Immunological Reviews. 185, 7-14 (2002).
- Klein, L., Hinterberger, M., Wirnsberger, G., Kyewski, B. Antigen presentation in the thymus for positive selection and central tolerance induction. Nat Rev Immunol. 9, 833-844 (2009).
- Vandenabeele, S., Hochrein, H., Mavaddat, N., Winkel, K., Shortman, K. Human thymus contains 2 distinct dendritic cell populations. Blood. 97, 1733-1741 (2001).
- Gotter, J., Brors, B., Hergenhahn, M., Kyewski, B. Medullary Epithelial Cells of the Human Thymus Express a Highly Diverse Selection of Tissue-specific Genes Colocalized in Chromosomal Clusters. The Journal of Experimental Medicine. 199, 155-166 (2004).
- Rouse, R. V., Bolin, L. M., Bender, J. R., Kyewski, B. A. Monoclonal antibodies reactive with subsets of mouse and human thymic epithelial cells. Journal of Histochemistry & Cytochemistry. 36, 1511-1517 (1988).
- Stoeckle, C., et al. Cathepsin S dominates autoantigen processing in human thymic dendritic cells. Journal of Autoimmunity. 38, 332-343 (2012).
- Woods Ignatoski, K. M., Bingham, E. L., Frome, L. K., Doherty, G. M. Directed trans-differentiation of thymus cells into parathyroid-like cells without genetic manipulation. Tissue Eng Part C Methods. 17, 1051-1059 (2011).
- Williams, K. M., et al. Single Cell Analysis of Complex Thymus Stromal Cell Populations: Rapid Thymic Epithelia Preparation Characterizes Radiation Injury. Clinical and Translational Science. 2, 279-285 (2009).
- Bendriss-Vermare, N., et al. Human thymus contains IFN-α-producing CD11c-, myeloid CD11c+, and mature interdigitating dendritic cells. The Journal of Clinical Investigation. 107, 835-844 (2001).
- Schmitt, N., et al. Ex vivo characterization of human thymic dendritic cell subsets. Immunobiology. 212, 167-177 (2007).
- Dzionek, A., et al. BDCA-4: Three Markers for Distinct Subsets of Dendritic Cells in Human Peripheral Blood. The Journal of Immunology. 165, 6037-6046 (2000).
- Wu, L., Shortman, K. Heterogeneity of thymic dendritic cells. Seminars in Immunology. 17, 304-312 (2005).
- Seach, N., Wong, K., Hammett, M., Boyd, R. L., Chidgey, A. P. Purified enzymes improve isolation and characterization of the adult thymic epithelium. Journal of Immunological Methods. 385, 23-34 (2012).
- Adamopoulou, E., Tenzer, S., Hillen, N., Klug, P., Rota, I. A., Tietz, S., Gebhardt, M., Stevanovic, S., Schild, H., et al. Exploring the MHC-peptide matrix of central tolerance in the human thymus. Nature Communications. , (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados