Method Article
Göç İnsan T Lenfosit İzolasyon, Kültür ve Analiz In Vitro
Bu Makalede
Özet
T lenfosit göç homing lenfoid organlar, damar çıkış sırasında oluşur ve periferik dokularda girmeden. Burada, T lenfosit göçü analiz etmek için kullanılan bir protokol tarif In vitro.
Özet
T lenfositlerin göçü, diğer hücrelere veya ekstraselüler matriks proteinleri ile ifade ligandlar hücre yüzeyinde integrinler yapışkan bir etkileşim içerir. Düşük bir yakınlık durumuna hücre öncü afinitesi yüksek bir devlet İntegrinlerin hassas uzaysal aktivasyonu, T lenfosit geçiş için önemli
Protokol
1. İnsan T Lenfositler izolasyonu
- Insan sağlıklı bir donörden kan alın. Kan, bir sonraki adıma geçmeden önce oda sıcaklığında (~ 30 dk) soğumasını bekleyin.
- 8 ml yuvarlak alt polistiren tüp yavaşça içine oda sıcaklığında polimorf yoğunluk gradiyenti medya 3 mL pipetle. Polimorf medya üstüne 3 ml tam kan yavaşça ekleyin. Iki reaktifler karışmasını önlemek için önemlidir.
- Tüpler oda sıcaklığında 45 dakika boyunca 500 xg'de santrifüjleyin.
- Santrifüj sonrasında, periferik kan mononükleer hücreleri (hücre) üst hücre katmanı içine diğer kan bileşenleri ayırdığım. Hücre katmanı, ilk bulutlu grup olarak, yukarıdan aşağıya doğru görünür.
- PBMC katmanının üstüne kan açık sarı renkli üst faz, dikkatlice çıkarın ve sonra bir 15 ml veya 50 ml konik tüp PBMC tabaka transfer etmek için P1000 mikropipet kullanın.
- 5 dakika her zaman için 500 xg'de hücreler santrifüj, PBMC PBS ile iki kez yıkayın. Süpernatant her yıkamadan sonra biraz bulutlu olacak.
2. İnsan T Lenfositler Kültür
- Bir pipet kullanarak,% 10 FBS içeren 20 ml RPMI 1640 medya T-75 kültür şişelerinde PBMC transferi,% 1 penisilin / streptomisin ve 1 mcg / ml fitohemaglütininle (PHA).
- 37 ° ° C'de ve% 5 CO 2 için en az 1 saat ve 24 saate kadar. Bu adım, monositler, süspansiyon kalır lenfositler ayrılmış, balon yüzeye yapışık olacak sağlar. Bu aşamada kısa bir inkübasyon (1 saat) kullanılması durumunda, adım 2.1 'de belirtilen PHA ile ilave% 10 FBS ve% 1 penisilin / streptomisin içeren RPMI 1640 medya kullanımı için kabul edilebilir.
- Dikkatle şişesi tüm medya kaldırmak 50 ml konik tüp ekleyin ve 5 dakika boyunca 500 xg'de santrifüj.
- Şimdi öncelikle lenfositler içeren hücre pelet, süspanse edin ve% 10 FBS içeren 25 ml RPMI 1640 medya içeren yeni bir T-75 balon hücreleri transferi,% 1 penisilin / streptomisin ve 1 mcg / ml PHA.
- 3 gün (2 gün hücre ilk kuluçka gecede ise) 37 ° C'de inkübe edin. 24 saat sonra büyüme, 15-20 ml taze medya ve daha büyük bir T-175 şişesi transfer için gerekli olabilir.
- 3 gün sonra, 50 ml konik tüp şişesi ve transfer askıya medya ve lenfositler kaldırmak için bir pipet kullanın. 5 dakika boyunca 500 xg'de santrifüjleyin.
- % 10 FBS ile 25 ml (T-75) veya 50 ml RPMI 1640 (T-175) içeren yeni bir T-75 veya T-175 şişesi hücre pelet ve transfer hücreleri tekrar süspansiyon hale getirin,% 1 penisilin / streptomisin ve 20 ng / ml insan IL-2 veya IL-15.
- 4-7 gün lenfositler büyütün. Eğer bir T-75 şişesi ile başlayan, kültür, 1-2 gün sonra genişletilmiş ve bir T-175 balona transfer edilmesi gerekecektir.
3 İn Vitro Lenfosit Göç Testi
- 1 gün önce göç tahlil, mont, 4, 20 mg / ml Protein PBS içinde A veya G gecede bir cam alt 0.17 mm çanak ° C
- PBS ile yoğun bulaşık yıkayın.
- Insan ICAM-1/Fc (10 mg / ml) ve insan çanak PBS çözüm bu reaktifler ekleyerek ve 4 saat oda sıcaklığında inkübe SDF-1 (2 mcg / ml). Hareketsiz
- T lenfositleri, ilk T-175 şişesi hemasitometre kullanarak kültür hücre yoğunluğu tespit ederek hazırlayın. Yaklaşık 2-5 x 10 5 hücreleri göç analizi için uygun bir hücre yoğunluğu elde etmek için çanak için kullanılmalıdır.
- T lenfositlerin iki kez PBS ile yıkayın ve sonra, 1 mg / mL D-glukoz içeren 1 ml L-15 medya tekrar süspansiyon haline getirin.
- Yoğun PBS ile ICAM-1/Fc ve SDF-1 ile kaplı çanak yıkayın.
- 1 ml medya çanak T lenfositleri aktarın ve 37 ° onları korumak ° C
4. NIS Elements Yazılım Kullanarak Bir Resim Sırası yakalama
- NIS Elements yazılımı açın.
- Kamera ayarları menüsünde, hem de canlı görüntüleme ve görüntü yakalama modu olarak "2x2 binning" seçin.
- Uygulamalar menüsüne gidin ve Çalıştır / tanımlayın Deney seçin.
- Görüntü ve görüntü yakalama sırası toplam uzunluğu arasındaki zaman uzunluğu seçin.
- Görüntü elde başlamak için "Çalıştır" düğmesine basın.
- Hücreler takip edilebilir ve göç parametreleri (hız, yol uzunluğu, yer değiştirme, vb.) ImageJ, AutoQUANT veya Volocity (Şekil 1) de dahil olmak üzere çeşitli yazılım paketleri, birini kullanarak nicel.
- Oluşturmak için "örümcek web arsa, her hücre ve timepoint toplanır (Şekil 2) ve kökeni her hücre için ortak bir başlangıç noktası (Şekil 3) ile bir grafik yansıtılıyor." Xy koordinatları.
5. Temsilcisi Sonuçlar
IL-2 veya IL-15, T lenfositleri ya varlığı kültür, 6 günyanı sıra olumlu CD4 ve / veya CD8 boyama pozitif CD3 boyama tarafından belirlenir hücrelerinin>% 98 kadar olun. IL-2 için, biz% 83 CD4 + hücreler,% 15 CD8 + ve <% 1 CD4 + CD8 + hücreler bulundu. IL-15 için,% 88 CD4 + hücreler, CD8 +% 11 ve <% 1 CD4 + CD8 + hücreler bulundu. ICAM-1/SDF-1 yüzeylerde T lenfosit göç sırasında, hücreler, yaklaşık 1 saatlik zaman dilimi içinde sürekli 15 mm / dak bir hız sergiledi. ICAM-1/SDF-1 T lenfosit göç, LFA-1-aracılı adezyon bağımlı olarak bir anti-LFA-1 ligand engelleme antikor göç ciddi engeller.
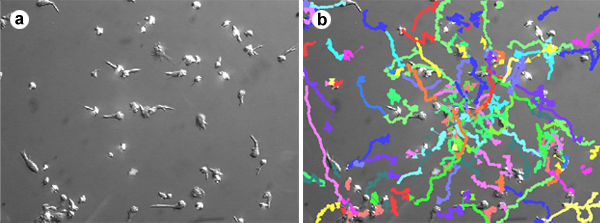
Şekil 1. T lenfositleri göç Hücre izleme, tam kan izole edilen ve 6 gün boyunca IL-2 veya IL-15 varlığında kültür T lenfositleri 10 mcg / mL ICAM-1 ve kaplamalı cam tabanlı yemekler yapışmaz ve geçiş için izin verildi 2 mcg / ml SDF-1. Görüntüler 30 dakika boyunca her 10 saniyede elde edildi. Hücreler her görüntünün Volocity yazılım kullanarak zaman içinde tespit ve takip edilmiştir. Bu film ~ 15 mm / dak hızda T lenfositlerin rastgele göç gösterir.
Videoyu görmek için buraya tıklayın.
T lenfositleri göç Film 1. Hücre izleme. T lenfositlerin, tam kan varlığında izole ve kültür IL-2, 6 gün süreyle veya IL-15, 10 mikrogram / ml ICAM-1 ve 2 mcg / ml SDF-1 ile kaplı cam dipli yemekleri üzerine yapışır ve göç etmeye izin verildi . Görüntüler 30 dakika boyunca her 10 saniyede elde edildi. Hücreler her görüntünün Volocity yazılım kullanarak zaman içinde tespit ve takip edilmiştir. Bu film ~ 15 mm / dak hızda T lenfositlerin rastgele göç gösterir.
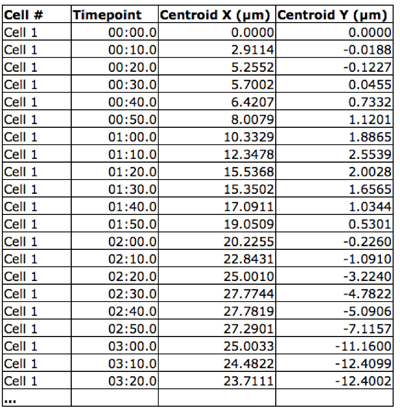
Şekil 2 Spatiotemporal hücre konumu. Her bir hücrenin XY koordinatlarını Volocity yazılımı kullanarak her zaman noktası için elde edilmiştir.

Şekil 3 "Örümcek web arsa." XYt kullanarak, her bir hücre, 15 hücre rastgele seçilmiştir ve kökeni ortak bir başlangıç noktası ile çizilen koordine eder. Örümcek web grafikleri karşılaştırarak, farklı deneysel koşullar arasında göç farklılıkları hızlı bir görsel tasviri verir. T lenfosit göçü kontrol koşulları altında (sol panel) ve anti-LFA-1 ligand engelleme antikor (sağ panel) varlığı Arsalar.
Tartışmalar
Bu deneyde, birincil insan T lenfosit motilite analiz etmek için basit bir sistem hakkında ayrıntılı bilgi sağlar. In vitro göç deneyleri, çeşitli hücre tipleri hareketine katılan birçok moleküller ve sinyal yolları rolleri incelemek kullanılmıştır . Bizim protokol kendi deney tasarımı akılda tutulması gereken bazı kritik kontrolleri şunlardır: 1), sığır serum albumini (BSA) veya poli-L lisin (PLL) gibi yapışkanlı olmayan veya non-integrin yapışkan substrat kaplamalar, sırasıyla, 2 ) integrin özel SDF-1 protokolünde açıklandığı gibi uyarıcı sinyal olmadan integrin özgüllük ve 3) işbirliği kaplama belirlemek için antikor tedavisi engelliyor.
Açıklamalar
Teşekkürler
Bu proje, Ulusal Sağlık Grants HL087088 (MK) Enstitüleri ve HL18208 (MK) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| RPMI 1640 | GIBCO, by Life Technologies | 11875 | |
| FBS | Thermo Fisher Scientific, Inc. | SH300070.03 | |
| Penicillin-Streptomycin | GIBCO, by Life Technologies | 15140 | |
| 1-Step Polymorphs | Accurate Chemical & Scientific Corporation | AN221725 | |
| PHA | Remel, Thermo Fisher Scientific | R30852801 | |
| Rec. human IL-2 | R&D Systems | 202-IL | |
| Rec. human IL-15 | R&D Systems | 247-IL | |
| Protein G | Sigma-Aldrich | 19459 | |
| Rec. human ICAM-1/Fc | R&D Systems | 720-IC | |
| Rec. human SDF-1 | R&D Systems | 350-NS |
Referanslar
- Hyun, Y. M., Chung, H. L., McGrath, J. L., Waugh, R. E., Kim, M. Activated integrin VLA-4 localizes to the lamellipodia and mediates t cell migration on VCAM-1. J Immunol. 183, 359-369 (2009).
- Morin, N. A., Oakes, P. W., Hyun, Y. M., Lee, D., Chin, Y. E., King, M. R., Springer, T. A., Shimaoka, M., Tang, J. X., Reichner, J. S., Kim, M. Nonmuscle myosin heavy chain IIA mediates integrin LFA-1 de-adhesion during T lymphocyte migration. The Journal of experimental medicine. 205, 195-205 (2008).
- Hyun, Y. M., Lefort, C. T., Kim, M. Leukocyte integrins and their ligand interactions. Immunologic research. , (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır