Method Article
האדם בידוד T לימפוציטים, התרבות ניתוח של הגירה במבחנה
In This Article
Summary
T לימפוציטים הגירה מתרחשת במהלך הביות הלימפה לאיברים, יציאה vasculature, וכניסה לתוך רקמות הפריפריה. כאן אנו מתארים פרוטוקול כי ניתן להשתמש כדי לנתח את ההגירה T לימפוציטים במבחנה.
Abstract
ההגירה של לימפוציטים מסוג T מערבת את האינטראקציה של דבק integrins פני התא עם ligands הביע על תאים אחרים או עם חלבונים תאי מטריקס. הפעלת spatiotemporal המדויק של integrins ממצב נמוך זיקה למדינה זיקה גבוהה בקצה התא מוביל חשוב T לימפוציטים הגירה
Protocol
1. בידוד של האדם לימפוציטים-T
- השג דם אדם מתורם בריא. לאפשר לדם להתקרר לטמפרטורת החדר (~ 30 דקות) לפני שתמשיך לשלב הבא.
- בעדינות פיפטה 3 מ"ל של בטמפרטורת החדר צפיפות התקשורת Polymorph הדרגתי לתוך צינור עגול 8 התחתונה מ"ל קלקר. בעדינות להוסיף 3 מ"ל של דם מלא על גבי מדיה Polymorph. חשוב כדי למנוע ערבוב של שני חומרים כימיים.
- צנטריפוגה הצינורות בבית XG 500 במשך 45 דקות בטמפרטורת החדר.
- בעקבות צנטריפוגה, את כדוריות הדם ההיקפיים mononuclear (PBMC) נפרדו עכשיו לתוך שכבת התאים העליונה של מרכיבי דם אחרים. שכבת PBMC מופיע, מלמעלה למטה, כמו הלהקה מעונן הראשון.
- מוציאים בזהירות את השלב ברור בצבע צהוב העליון של הדם, מעל שכבת PBMC, ולאחר מכן להשתמש micropipette P1000 להעביר את השכבה PBMC כדי 15 מ"ל או 50 מ"ל צינור חרוטי.
- שטפו את PBMC פעמיים עם PBS, centrifuging תאים ב XG 500 במשך 5 דקות בכל פעם. Supernatant יהיה מעונן קצת אחרי כל שטיפה.
2. התרבות של האדם לימפוציטים-T
- בעזרת פיפטה, העברת PBMC כדי בבקבוק T-75 תרבות 20 מ"ל RPMI 1640 מדיה המכילה 10% FBS, 1% פניצילין / סטרפטומיצין, ו 1 מיקרוגרם / מ"ל phytohemagglutinin (PHA).
- לדגור על 37 ° C ו 5% CO 2 לפחות 1 שעה, עד 24 שעות. שלב זה מאפשר מונוציטים, אשר יהיה חסיד אל פני השטח את הבקבוק, להיות מופרדים מן לימפוציטים כי לרחף. אם הדגירה קצר (1 שעה) משמש בשלב זה, מקובל להשתמש RPMI 1640 מדיה המכילה 10% FBS ו -1% פניצילין / סטרפטומיצין בלי להשלים עם PHA כפי שצוין בשלב 2.1.
- בזהירות להסיר את כל התקשורת מהבקבוק, להוסיף אותו צינור חרוטי 50 מ"ל, ו צנטריפוגות ב XG 500 במשך 5 דקות.
- Resuspend התא גלולה, אשר כעת כוללת בעיקר לימפוציטים, ולהעביר את התאים בבקבוק T-75 חדש המכיל 25 מ"ל RPMI 1640 מדיה המכילה 10% FBS, 1% פניצילין / סטרפטומיצין, ו 1 מיקרוגרם / מ"ל PHA.
- לדגור על 37 מעלות צלזיוס במשך 3 ימים (2 ימים אם הדגירה הראשונית של PBMC היה לילה). לאחר 24 שעות של צמיחה, ייתכן שיהיה צורך להוסיף 15-20 מ"ל של התקשורת טריים להעביר T-175 גדול יותר בקבוק.
- לאחר 3 ימים, להשתמש פיפטה להסיר את המדיה לימפוציטים מושעה מהבקבוק ומעבירים צינור חרוטי 50 מ"ל. צנטריפוגה ב XG 500 במשך 5 דקות.
- Resuspend התא גלולה ותאי להעביר בקבוק T-75 או T-175 חדש המכיל 25 מ"ל (T-75) או 50 מ"ל (T-175) RPMI 1640 עם 10% FBS, 1% פניצילין / סטרפטומיצין, ו 20 ng / mL האדם IL-2 או IL-15.
- לגדל לימפוציטים ימים 4-7. אם מתחילים עם בקבוק T-75, התרבות יהיה צורך להרחיב והועברו בקבוק T-175 לאחר 1-2 ימים.
3. Assay הגירה לימפוציטים חוץ גופית
- 1 יום לפני assay ההגירה, מעיל זכוכית התחתונה 0.17 מ"מ עם צלחת חלבון מיקרוגרם / מ"ל או 20 G ב PBS לילה בשעה 4 ° C.
- לשטוף את המנה נרחב עם PBS.
- לשתק ICAM-1/Fc האנושי (10 מיקרוגרם / מ"ל) אדם SDF-1 (2 מיקרוגרם / מ"ל) על ידי הוספת חומרים כימיים אלו בתמיסה PBS לצלחת ואת דוגרים 4 שעות בטמפרטורת החדר.
- הכן לימפוציטים מסוג T על ידי הראשון בקביעת צפיפות התאים בתרבית בתוך בקבוק T-175 באמצעות hemacytometer. כ 2-5 x 10 5 תאים יש להשתמש לכל מנה להשיג צפיפות התאים המתאימים לניתוח הגירה.
- לשטוף לימפוציטים מסוג T פעמיים עם PBS ו resuspend אז 1 מ"ל L-15 מדיה המכילה 1 מ"ג / מ"ל D-גלוקוז.
- לשטוף את צלחת מצופה ICAM-1/Fc ו - SDF-1 נרחב עם PBS.
- העברת לימפוציטים מסוג T ב 1 מ"ל התקשורת על צלחת ולשמור אותם על 37 ° C.
4. לכידת תמונה ברצף באמצעות תוכנות ש"ח Elements
- פתח תוכנה ש"ח אלמנטים.
- בתפריט הגדרות המצלמה, בחר "binning 2x2" כמצב הדמיה שניהם חיים לכידת תמונה.
- עבור אל התפריט Applications ובחר הגדר / הפעלה ניסוי.
- בחר את משך הזמן בין התמונות את האורך הכולל של רצף לכידת תמונה.
- לחץ על כפתור "הפעל" כדי להתחיל רכישת התמונה.
- תאים ניתן לעקוב ופרמטרים הגירה (מהירות, אורך הדרך, עקירה, וכו ') לכמת באמצעות אחד כמה חבילות תוכנה, כולל ImageJ, AutoQuant או Volocity (איור 1).
- כדי ליצור "מגרש קורי העכביש", xy את הקואורדינטות של כל תא timepoint נאספים (איור 2) ו מוקרנת על גרף עם נקודת מוצא משותפת עבור כל תא על המקור (איור 3).
5. נציג תוצאות
ביום 6 של התרבות בנוכחות או IL-2 או IL-15, לימפוציטים מסוג T.לפצות> 98% של תאים, כפי שנקבע על ידי מכתים CD3 חיובי כמו גם CD4 חיובי ו / או CD8 מכתים. עבור IL-2, מצאנו 83 תאים מסוג CD4 +%, 15% ו - CD8 + <1% CD4 + CD8 + תאים. עבור IL-15, מצאנו 88 תאים מסוג CD4 +%, 11% ו - CD8 + <1% CD4 + CD8 + תאים. במהלך הנדידה T לימפוציטים על ICAM-1/SDF-1 מצעים, תאים הציג מהירות של כ 15 מיקרומטר / min שיכולים להתקיים לאורך תקופת זמן 1 שעה. הגירה T לימפוציטים על ICAM-1/SDF-1 תלויה הידבקות LFA-1-בתיווך, כמו אנטי LFA-1 ליגנד חוסמות הנוגדן מעכב הגירה קשות.
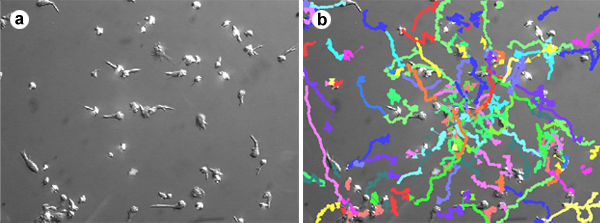
באיור 1. מעקב סלולרי של העברת לימפוציטים מסוג T. לימפוציטים מסוג T מבודדים מהדם כולו בתרבית בנוכחות של IL-2 או IL-15 עבור 6 ימים הורשו לדבוק ולהעביר על קרקעית הזכוכית מאכלים מצופה 10 מיקרוגרם / מ"ל ICAM-1 ו 2 מיקרוגרם / מ"ל SDF-1. תמונות נרכשו כל 10 שניות במשך 30 דקות. תאים זוהו כל תמונה מסומנים לאורך זמן באמצעות תוכנת Volocity. סרט זה מציג את ההגירה אקראי של לימפוציטים מסוג T במהירות של ~ 15 מיקרומטר / min.
לחץ כאן כדי לראות את הוידאו.
1. סרט Cell מעקב של העברת לימפוציטים מסוג T. לימפוציטים מסוג T מבודדים מהדם כולו בתרבית בנוכחות של IL-2 או IL-15 עבור 6 ימים הורשו לדבוק ולהעביר על תחתית צלחות זכוכית מצופה 10 מיקרוגרם / מ"ל ICAM-1 ו 2 מיקרוגרם / מ"ל SDF-1 . תמונות נרכשו כל 10 שניות במשך 30 דקות. תאים זוהו כל תמונה מסומנים לאורך זמן באמצעות תוכנת Volocity. סרט זה מציג את ההגירה אקראי של לימפוציטים מסוג T במהירות של ~ 15 מיקרומטר / min.
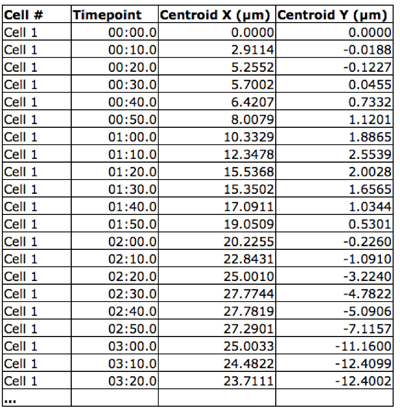
איור 2. בעמדה תא Spatiotemporal. קואורדינטות XY של כל תא התקבלו עבור כל נקודת זמן באמצעות תוכנת Volocity.

איור 3. "מזימה קורי עכביש". שימוש XYt קואורדינטות עבור כל תא, 15 תאים נבחרו באקראי זממו עם נקודת מוצא משותפת על המקור. השוואת באינטרנט חלקות עכביש נותן תיאור חזותי מהירה של ההבדלים הגירה בין תנאי הניסוי השונים. מגרשים הגירה T לימפוציטים בתנאים שליטה (פאנל משמאל) בנוכחות נוגדן ליגנד לחסימת אנטי LFA-1 (פאנל מימין).
Discussion
בניסוי זה, אנו מספקים פרטים על מערכת פשוטה לנתח את תנועתיות העיקרי של לימפוציטים מסוג T אנושיים. ב מבחני חוץ גופית הגירה שימשו לנתח את התפקידים של מולקולות רבות במעברי האותות המעורבים תנועה של תאים מסוגים שונים. חלק שולטת קריטי לזכור בעת תכנון הניסוי שלכם מתוך פרוטוקול שלנו כוללים: 1) ללא דבק או לא integrin ציפויים המצע דבק, כגון אלבומין בסרום שור (BSA) או פולי-L ליזין (PLL), בהתאמה, 2 ) integrin ספציפיים חסימת טיפול נוגדן כדי לקבוע סגוליות integrin, ו 3) שיתוף ציפוי ללא אות גירוי, כגון SDF-1 המתואר בפרוטוקול שלנו.
Disclosures
Acknowledgements
פרויקט זה מומן על ידי המכונים הלאומיים לבריאות מענקים HL087088 (ח"כ) ו HL18208 (ח"כ).
Materials
| Name | Company | Catalog Number | Comments |
| RPMI 1640 | GIBCO, by Life Technologies | 11875 | |
| FBS | Thermo Fisher Scientific, Inc. | SH300070.03 | |
| Penicillin-Streptomycin | GIBCO, by Life Technologies | 15140 | |
| 1-Step Polymorphs | Accurate Chemical & Scientific Corporation | AN221725 | |
| PHA | Remel, Thermo Fisher Scientific | R30852801 | |
| Rec. human IL-2 | R&D Systems | 202-IL | |
| Rec. human IL-15 | R&D Systems | 247-IL | |
| Protein G | Sigma-Aldrich | 19459 | |
| Rec. human ICAM-1/Fc | R&D Systems | 720-IC | |
| Rec. human SDF-1 | R&D Systems | 350-NS |
References
- Hyun, Y. M., Chung, H. L., McGrath, J. L., Waugh, R. E., Kim, M. Activated integrin VLA-4 localizes to the lamellipodia and mediates t cell migration on VCAM-1. J Immunol. 183, 359-369 (2009).
- Morin, N. A., Oakes, P. W., Hyun, Y. M., Lee, D., Chin, Y. E., King, M. R., Springer, T. A., Shimaoka, M., Tang, J. X., Reichner, J. S., Kim, M. Nonmuscle myosin heavy chain IIA mediates integrin LFA-1 de-adhesion during T lymphocyte migration. The Journal of experimental medicine. 205, 195-205 (2008).
- Hyun, Y. M., Lefort, C. T., Kim, M. Leukocyte integrins and their ligand interactions. Immunologic research. , (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved