Method Article
Human T isolement des lymphocytes, de la Culture et de l'analyse des migrations In Vitro
Dans cet article
Résumé
La migration des lymphocytes T se produit pendant homing vers les organes lymphoïdes, la sortie de la vascularisation, et entrer dans les tissus périphériques. Ici, nous décrivons un protocole qui peut être utilisé pour analyser la migration lymphocytaire T In vitro.
Résumé
La migration des lymphocytes T implique l'interaction adhésive des intégrines de surface des cellules avec des ligands exprimés sur d'autres cellules ou avec des protéines de la matrice extracellulaire. L'activation des intégrines spatiotemporelle précise d'un état de faible affinité à un état de haute affinité au bord leader de cellules est important pour la migration des lymphocytes T
Protocole
1. Isolement des lymphocytes T humains
- Obtenir le sang humain à partir d'un donneur sain. Laisser le sang se refroidir à température ambiante (~ 30 minutes) avant de passer à l'étape suivante.
- Délicatement la pipette 3 ml de Métamorphose Salle des médias de température à gradient de densité dans un tube 8 ml en polystyrène à fond rond. Ajouter délicatement 3 mL de sang total sur le dessus du support Métamorphose. Il est important d'éviter le mélange des deux réactifs.
- Centrifuger les tubes à 500 g pendant 45 minutes à température ambiante.
- Après la centrifugation, les cellules mononucléées du sang périphérique (PBMC) ont maintenant séparé de d'autres composants sanguins dans la couche cellulaire supérieure. La couche de PBMC apparaît, de haut en bas, comme le premier groupe nuageux.
- Retirer délicatement le clair de couleur jaune phase supérieure du sang, au-dessus de la couche PBMC, puis utiliser une micropipette P1000 à transférer la couche PBMC à un ml 15 ou 50 ml tube conique.
- Laver les PBMC à deux reprises avec du PBS, les cellules de centrifugation à 500 xg pendant 5 minutes chaque fois. Le surnageant sera un peu nuageux après chaque lavage.
2. Culture de lymphocytes T humains
- Avec une pipette, transférer les PBMC d'un flacon T-75 de la culture dans 20 ml du milieu RPMI 1640 contenant 10% de FBS, 1% de pénicilline / streptomycine et 1 pg / mL phytohémagglutinine (PHA).
- Incuber à 37 ° C et 5% de CO 2 d'au moins 1 heure, et jusqu'à 24 heures. Cette étape permet de monocytes, qui sera adhérente à la surface de ballon, d'être séparé de l'lymphocytes qui restent en suspension. Si une incubation courte (1 heure) est utilisé à cette étape, il est acceptable d'utiliser du milieu RPMI 1640 contenant 10% de FBS et 1% de pénicilline / streptomycine, sans complétant avec PHA comme spécifié à l'étape 2.1.
- Retirez soigneusement l'ensemble des médias de la fiole, ajoutez-le à un tube conique de 50 ml, et centrifuger à 500 xg pendant 5 minutes.
- Reprendre le culot cellulaire, qui contient principalement des lymphocytes aujourd'hui, et le transfert des cellules d'un nouveau T-75 flacon contenant 25 ml du milieu RPMI 1640 contenant 10% de FBS, 1% de pénicilline / streptomycine et 1 ug / ml de PHA.
- Incuber à 37 ° C pendant 3 jours (2 jours si l'incubation initiale des PBMC a été toute la nuit). Après 24 heures de croissance, il peut être nécessaire d'ajouter 15-20 ml de milieux frais et le transfert à un plus grand T-175 flacon.
- Après 3 jours, utiliser une pipette pour enlever les médias et les lymphocytes en suspension dans le ballon et le transfert d'un tube conique de 50 ml. Centrifuger à 500 xg pendant 5 minutes.
- Reprendre le culot cellulaire et des cellules de transfert à un nouveau flacon T-75 ou T-175 contenant 25 ml (T-75) ou 50 ml (T-175) RPMI 1640 avec 10% de FBS, 1% de pénicilline / streptomycine et 20 ng / ml IL-2 humaine ou l'IL-15.
- Cultivez les lymphocytes pendant 4-7 jours. Si en commençant par un flacon T-75, la culture devra être élargi et transféré dans un flacon T-175 après 1-2 jours.
3. Dosage in vitro la migration lymphocytaire
- 1 jour avant le test de migration, un manteau à fond de verre plat de 0,17 mm avec 20 pg / ml de protéine A ou G en PBS pendant une nuit à 4 ° C.
- Laver abondamment le plat avec du PBS.
- Immobiliser humaine ICAM-1/Fc (10 pg / ml) et humaines du SDF-1 (2 pg / ml) en ajoutant ces réactifs en solution PBS pour le plat et l'incubation de 4 heures à température ambiante.
- Préparer les lymphocytes T en déterminant d'abord la densité des cellules en culture en flacon T-175 en utilisant un hématimètre. Environ 2-5 x 10 5 cellules doit être utilisé par plat pour atteindre une densité cellulaire appropriée pour l'analyse de la migration.
- Lavez les lymphocytes T à deux reprises avec du PBS, puis remettre en suspension dans 1 ml L-15 supports contenant 1 mg / ml de D-glucose.
- Laver la vaisselle et les enduits de ICAM-1/Fc SDF-1 abondamment avec du PBS.
- Transfert lymphocytes T dans les médias 1 mL de la vaisselle et les maintenir à 37 ° C.
4. Capture d'une séquence d'images en utilisant NIS éléments logiciels
- Ouvrez NIS Elements.
- Dans la caméra du menu Paramètres, choisissez «binning 2x2" que le mode à la fois pour l'imagerie en direct et la capture d'image.
- Allez dans le menu Applications et choisissez Définir / Run Experiment.
- Choisissez la durée de temps entre les images et la longueur totale de la séquence de capture d'image.
- Appuyez sur le bouton "Exécuter" pour commencer l'acquisition des images.
- Les cellules peuvent être suivis et la migration des paramètres (vitesse, longueur du trajet, les déplacements, etc) ont quantifié en utilisant une des plusieurs logiciels, dont ImageJ, AutoQuant ou Volocity (figure 1).
- Pour générer un «complot toile d'araignée", les coordonnées XY pour chaque cellule et timepoint sont collectées (figure 2) et projetée sur un graphique avec un point de départ commun pour chacune des cellules à l'origine (figure 3).
5. Les résultats représentatifs
Au jour 6 de la culture dans la présence de lymphocytes T soit IL-2 ou l'IL-15,MAQUILLAGE> 98% des cellules, tel que déterminé par coloration CD3 positifs ainsi que des CD4 positifs et / ou CD8 coloration. Pour l'IL-2, nous avons trouvé 83% des CD4 +, les cellules CD8 + 15% et <1% des CD4 + CD8 +. Pour l'IL-15, nous avons trouvé 88% des CD4 +, les cellules CD8 + 11% et <1% des CD4 + CD8 +. Pendant la migration lymphocytaire T sur ICAM-1/SDF-1 substrats, les cellules présentaient une vitesse d'environ 15 um / min qui peut être maintenu sur une période de 1 heure. T sur la migration lymphocytaire ICAM-1/SDF-1 dépend de LFA-1 médiée par l'adhésion, comme un anti-LFA-1 ligand bloquant anticorps inhibe fortement la migration.
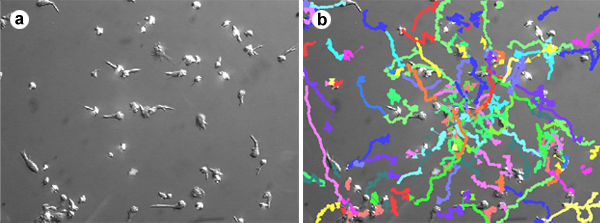
Figure 1. Cellule de suivi de la migration des lymphocytes T. Lymphocytes T isolés du sang total et cultivées en présence d'IL-2 ou l'IL-15 pendant 6 jours ont été autorisés à adhérer et migrer sur fond de verre plats revêtus d'10 pg / mL ICAM-1 et 2 pg / mL SDF-1. Les images ont été acquises toutes les 10 secondes pendant 30 minutes. Les cellules ont été identifiés dans chaque image et suivis dans le temps en utilisant le logiciel Volocity. Ce film montre la migration aléatoire des lymphocytes T à une vitesse de ~ 15 um / min.
Cliquez ici pour voir la vidéo.
Cellule de suivi Movie 1. Migration des lymphocytes T. Lymphocytes T isolés du sang total et cultivées en présence d'IL-2 ou l'IL-15 pendant 6 jours ont été autorisés à adhérer et migrer sur fond de verre plats revêtus d'10 ug / ml d'ICAM-1 et 2 pg / mL SDF-1 . Les images ont été acquises toutes les 10 secondes pendant 30 minutes. Les cellules ont été identifiés dans chaque image et suivis dans le temps en utilisant le logiciel Volocity. Ce film montre la migration aléatoire des lymphocytes T à une vitesse de ~ 15 um / min.
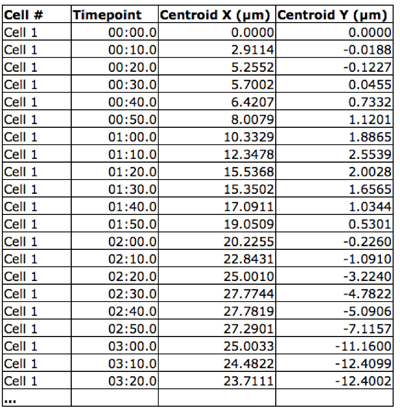
Figure 2. Position de la cellule spatio-temporelle. Les coordonnées XY de chaque cellule ont été obtenues pour chaque point de temps en utilisant le logiciel Volocity.

Figure 3. "Spider Web intrigue." Utilisation de la XYT coordonnées de chaque cellule, 15 cellules ont été choisis au hasard et tracées avec un point de départ commun à l'origine. En comparant des parcelles toile d'araignée donne une représentation visuelle rapide des différences de migration entre les différentes conditions expérimentales. Parcelles à la migration lymphocytaire T dans des conditions de contrôle (à gauche) et en présence d'un anti-LFA-1 ligand-anticorps bloquant (à droite).
Discussion
Dans cette expérience, nous fournissons des détails sur un système simple pour analyser la motilité des lymphocytes T primaires humains. Dans les essais de migration in vitro ont été utilisés pour disséquer les rôles de nombreuses molécules et voies de signalisation impliquées dans la locomotion des différents types cellulaires. Certains contrôles essentiels à garder à l'esprit lorsque vous concevez votre propre expérience de notre protocole comprennent: 1) Non-adhésif ou non intégrine revêtements substrat adhésif, tel que l'albumine sérique bovine (BSA) ou de poly-L lysine (PLL), respectivement, 2 ) intégrines spécifiques bloquant traitement par anticorps pour déterminer la spécificité de l'intégrine, et 3) la co-stimulatrices revêtement sans signaux, tels que le SDF-1 décrit dans notre protocole.
Déclarations de divulgation
Remerciements
Ce projet a été soutenu par des subventions des National Institutes Health HL087088 (MK) et HL18208 (MK).
matériels
| Name | Company | Catalog Number | Comments |
| RPMI 1640 | GIBCO, by Life Technologies | 11875 | |
| FBS | Thermo Fisher Scientific, Inc. | SH300070.03 | |
| Penicillin-Streptomycin | GIBCO, by Life Technologies | 15140 | |
| 1-Step Polymorphs | Accurate Chemical & Scientific Corporation | AN221725 | |
| PHA | Remel, Thermo Fisher Scientific | R30852801 | |
| Rec. human IL-2 | R&D Systems | 202-IL | |
| Rec. human IL-15 | R&D Systems | 247-IL | |
| Protein G | Sigma-Aldrich | 19459 | |
| Rec. human ICAM-1/Fc | R&D Systems | 720-IC | |
| Rec. human SDF-1 | R&D Systems | 350-NS |
Références
- Hyun, Y. M., Chung, H. L., McGrath, J. L., Waugh, R. E., Kim, M. Activated integrin VLA-4 localizes to the lamellipodia and mediates t cell migration on VCAM-1. J Immunol. 183, 359-369 (2009).
- Morin, N. A., Oakes, P. W., Hyun, Y. M., Lee, D., Chin, Y. E., King, M. R., Springer, T. A., Shimaoka, M., Tang, J. X., Reichner, J. S., Kim, M. Nonmuscle myosin heavy chain IIA mediates integrin LFA-1 de-adhesion during T lymphocyte migration. The Journal of experimental medicine. 205, 195-205 (2008).
- Hyun, Y. M., Lefort, C. T., Kim, M. Leukocyte integrins and their ligand interactions. Immunologic research. , (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon