Method Article
Автоматизированное и высокопроизводительное микробное моноклональное культивирование и сбор с использованием системы омиксной культуры микролитровых капель для одноклеточных микролитров
В этой статье
Резюме
В этом протоколе описывается, как использовать систему омикса культуры микролитровых капель (MISS cell) для выделения, культивирования и сбора микробных моноклональных клеток. Ячейка MISS обеспечивает интегрированный рабочий процесс на основе капельной микрофлюидной технологии, которая обеспечивает превосходную монодисперсность капель, высокую параллельность культивирования и высокую производительность обнаружения биомассы.
Аннотация
Чистые бактериальные культуры необходимы для изучения микробной культуромики. Традиционные методы, основанные на твердотельных планшетах, луночных планшетах и микрореакторах, затрудняются громоздкими процедурами и низкой пропускной способностью, что препятствует быстрому прогрессу исследований микробной культуры. Для решения этих проблем мы успешно разработали систему Single-cell Microliter-droplet Culture Omics System (MISS cell) — автоматизированную высокопроизводительную платформу, которая использует микрофлюидную технологию капель для выделения, культивирования и скрининга микробных моноклональных культур. Эта система может генерировать большое количество капель одиночных клеток и культивировать, экранировать и собирать моноклональные колонии за короткое время, облегчая интегрированный процесс от микробной изоляции до сбора. В этом протоколе мы продемонстрировали его применение на примере выделения и культивирования микробиоты кишечника человека и сравнили эффективность микробной изоляции, эффективность моноклонального культивирования и производительность скрининга с использованием метода сплошной культуры. Экспериментальный процесс был простым, а расход реагентов очень низким. По сравнению с методами культивирования на твердых планшетах, клетка MISS может культивировать большее разнообразие видов кишечной микробиоты, предлагая значительный потенциал и ценность для исследований микробной культуромики.
Введение
Микробная культуромика имеет широкое применение в исследовании полезных микробов в пищевой промышленности, разнообразия микробов окружающей среды, скрининге новых антимикробных соединений и микробиома человека в связи с болезнями 1,2,3,4. Традиционные методы, в первую очередь основанные на твердых планшетах, луночных планшетах или микрореакторах для получения и отбора моноклональных колоний, просты в эксплуатации, но имеют низкую пропускную способность из-за их многоступенчатости. Это ограничение препятствует таким приложениям, как скрининг микробного мутагенеза, исследования микробной культуромики и селекция высокопродуктивных колоний, которые требуют обширного моноклонального скрининга.
В последнее время были разработаны различные устройства для обнаружения и диспенсирования одиночных клеток, которые значительно повышают скорость обработки микробных образцов при одновременном снижении трудозатрат и минимизации ошибок при ручной обработке5. Тем не менее, эти инструменты обычно предназначены только для определенных этапов в рамках традиционных методов, часто требующих обширной интеграции оборудования, занимающих значительное пространство и несущих высокие затраты. В связи с этим возникла острая необходимость в разработке недорогой, универсально применимой платформы для микробного культивирования и скрининга, чтобы компенсировать упомянутые выше недостатки.
В нашей предыдущей работе мы успешно разработали автоматизированную высокопроизводительную платформу скрининга, известную как Single-cell Microliter-droplet-Culture Culture Omics System (MISS cell, далее именуемая «Omics-система»)6. Эта платформа использует капельную микрофлюидную технологию, которая обещает достичь автоматизации и интеграции в микробной изоляции, культивировании исборе 7,8,9,10. Система Omics состоит из нескольких ключевых модулей, включая модуль отбора проб, микрофлюидный чип, систему обнаружения и сбора капель, что позволяет эффективно выделять одиночные клетки, культивировать, моноклональный скрининг и собирать в микробиологических исследованиях. Мы уже использовали систему Omics для достижения высокопроизводительного скрининга мутагенеза Corynebacterium glutamicum6.
Благодаря автоматизации и высокопроизводительным возможностям скрининга системы Omics, ожидается, что ее применение в микробной культуромике позволит быстро получить большой объем микробиологических данных. В этом протоколе мы представили подробную операционную процедуру MISS-клетки на примере выделения и культивирования кишечной микробиоты человека, чтобы продемонстрировать процесс выделения, культивирования, моноклонального обнаружения и скрининга микробных одиночных клеток. Работа с системой Omics проста, и исследователям нужно только следовать указаниям программного обеспечения для последовательной установки микротрубок и микрофлюидного чипа для генерации капель, настройки параметров и подготовки образцов.
В интерфейсе работы программного обеспечения система Omics разделена на три основные функции: изоляция, выращивание и скрининг. Исследователи могут выбирать разные этапы в соответствии с экспериментом. Кроме того, на этапе скрининга капель исследователи могут выбрать один из двух режимов обнаружения: флуоресцентный сигнал или оптическая плотность. Программное обеспечение обеспечивает визуализацию процесса просеивания капель в режиме реального времени. Наконец, исследователи имеют возможность конфигурировать такие параметры, как условия культивирования, обнаруженная длина волны и количество сборных лунок в зависимости от их конкретных экспериментальных требований, и они могут приостановить работу прибора в любое время для выполнения других операций. MISS cell — это безопасная для микробов высокопроизводительная моноклональная скрининговая платформа, простая в эксплуатации и с минимальным расходом реагентов.
протокол
Все процедуры исследования соответствуют всем применимым этическим нормам. Процедуры были одобрены Комитетом по этике науки и техники Университета Цинхуа. Для изучения микробиоты кишечника человека были взяты образцы кала у здорового взрослого человека без серьезных заболеваний, который дал письменное информированное согласие.
1. Установка прибора
- Поместите прибор системы Omics в чистую или стерильную среду (например, в стерильную комнату или анаэробный стол). Прибор является прецизионным устройством, и при его размещении на объекте учитывайте следующее:
- Поддерживайте в приборе нормальное давление и температуру.
- Держите прибор вдали от сильных электрических полей, магнитных полей и источников теплового излучения.
- Убедитесь, что площадь размещения прибора превышает размеры 2 500 мм (Г) x 1 500 мм (Ш) x 2 000 мм (В).
- Поддерживайте влажность прибора в окружающей среде ниже 60%.
2. Подготовка
- Последовательно включайте питание системы Omics, компьютера и операционного программного обеспечения системы Omics.
- Установка микрофлюидных чипов MISS cell и микрофлюидных чипов для генерации капель:
- Откройте дверцу камеры генерации и культивирования капель (рис. 1A) и вертикально снимите защитную крышку микротрубки и микрофлюидного чипа для генерации капель. С помощью одноразового шприца добавьте 10 мл стерильной дистиллированной воды в увлажнитель внутри камеры для выращивания капель (рис. 1C) и установите на место защитную крышку микротрубки и микрофлюидного чипа для генерации капель.
- Откройте стерильную упаковку микротрубки и микрофлюидного чипа, генерирующего капли, и вертикально поместите его прямо над камерой культивирования (рис. 1C).
- В интерфейсе программного обеспечения нажмите « Установка » (рисунок 2A). В этот момент появляется всплывающее окно с запросом: Подтвердите замену микротрубки и микрофлюидный чип для генерации капель? Нажмите кнопку Да , чтобы начать установку.
- Выньте средство для удаления пузырьков воздуха и закрепите его вверх ногами на месте удаления пузырьков воздуха в камере генерации и культивирования капель. Будьте осторожны, чтобы не надавить на входную и выходную трубки капли устройства для удаления пузырьков воздуха (Рисунок 1E).
- Подсоедините трубку для выхода капель устройства для удаления пузырьков воздуха к расположенному под ним зажимному клапану и пропустите его через отверстие, которое направлено в камеру обнаружения и сбора капель (рис. 1B).
- Откройте дверцу камеры обнаружения и сбора капель, вертикально вставьте трубку обнаружения, уже подключенную к отводящей трубке, в гнездо обнаружения и убедитесь, что трубка обнаружения полностью вставлена (Рисунок 1D).
ПРИМЕЧАНИЕ: При установке контрольной трубки вставьте ее вертикально без каких-либо изгибов на трубке. - Затяните винт, которым фиксируется контрольная трубка по часовой стрелке. Убедившись, что трубка обнаружения полностью вставлена и закреплена, закройте дверцу камеры обнаружения и сбора капель.
- Микротрубка и микрофлюидный чип для генерации капель состоят из 10 силиконовых трубок, каждая из которых помечена номером (L01-L10). Подсоедините каждую промаркированную трубку к соответствующему пронумерованному зажимному клапану (01-10) (Рисунок 1C).
- Подключите быстроразъемный соединитель микротрубки и микрофлюидного чипа для генерации капель к соответствующему порту в системе Omics: C1 к O1, C2 к O2, C4 к O4 и CF к OF.
ПРИМЕЧАНИЕ: Установка микротрубки и микрофлюидного чипа для генерации капель завершена. C3 не нужно подключать к O3. - После того, как установка микротрубок и микрофлюидной стружки для генерации капель завершена, появляется всплывающее окно с предложением открыть зажимной клапан для капельной трубки. Нажмите OK, когда установка микрофлюидного чипа с микротрубками и генерацией капель будет завершена. Убедившись, что все силиконовые трубки из микротрубки и микрофлюидного чипа для генерации капель прикреплены к соответствующему зажимному клапану, нажмите OK.
- Инициализация инструмента
- Перед выполнением инициализации нажмите на интерфейс Setting (рисунок 2B) для настройки соответствующих параметров: режим обнаружения (обнаружение на основе OD или на основе флуоресценции; Наружный диаметр), температуру инкубации (37 °C) и время (30 дней = 720 ч), скорость мешалки (20 об/мин), длину волны обнаружения наружного диаметра (600 нм), а также длину волны возбуждения и излучения флуоресцентного детектирования.
ПРИМЕЧАНИЕ: Параметры, используемые для выделения и культивирования кишечной микробиоты человека в данном протоколе, приведены в скобках. При настройке параметров температура выращивания должна быть в пределах от 5 °C до 50 °C. При выборе режима обнаружения оптическое волокно необходимо заменить, если волокно на модуле обнаружения капель отличается (см. шаг 2.3.2). При настройке параметров опорное значение масляной фазы (базовое спектральное) автоматически определяется программным обеспечением, что устраняет необходимость в ручной регулировке. - Замена обнаруженного оптического волокна
- Извлеките обнаруженное волокно из держателя волокна (открутите против часовой стрелки) и ослабьте крепежный винт волокна на модуле капель (рис. 1D).
- Если оптическое волокно не будет использоваться, извлеките его из модуля, вставьте в держатель волокна и затяните. Вставьте обнаруженное волокно в порт обнаружения и затяните крепежный винт волокна на модуле. Замена оптического волокна завершена.
- Перейдите в главный интерфейс и нажмите «Инициализировать», чтобы система Omics выполнила самопроверку своих компонентов, включая насос впрыска, настройки температуры, тестирование сброса отработанной жидкости, модуль скрининга и модуль обнаружения капель.
- Во время инициализации проведите испытание сброса отработанной жидкости из модуля обнаружения капель, впрыскав 1 мл 75% спирта в порт для отработанной жидкости и наблюдая, нормально ли вытекает жидкость.
- Для тестирования скринингового модуля поместите 96-луночный планшет на место расположения планшета и посмотрите, нормально ли движение планшета.
- Перед выполнением инициализации нажмите на интерфейс Setting (рисунок 2B) для настройки соответствующих параметров: режим обнаружения (обнаружение на основе OD или на основе флуоресценции; Наружный диаметр), температуру инкубации (37 °C) и время (30 дней = 720 ч), скорость мешалки (20 об/мин), длину волны обнаружения наружного диаметра (600 нм), а также длину волны возбуждения и излучения флуоресцентного детектирования.
3. Генерация капель
- Сбор и обработка образцов микробиоты кишечника человека
- Подготовьте ночной горшок и контейнеры для стула, вымойте руки и наденьте перчатки, чтобы собрать свежие образцы стула.
ПРИМЕЧАНИЕ: При сборе образцов кала по возможности избегайте загрязнения мочи. Лучше заранее помочиться, а стул поместить в чистую сухую емкость. - Асептически соберите необходимое количество стула среднего сегмента и запечатайте его в стерилизованные криовиалы (примерно 3-5 г на флакон). Немедленно поместите флаконы на лед для последующей аликвотации и маркировки.
ПРИМЕЧАНИЕ: Если образец кала большой или не может быть собран сразу, его следует собрать в течение максимум 2 часов. - На анаэробной скамье используйте стерильный тампон или инструмент для забора кала для сбора образца среднего сегмента.
ПРИМЕЧАНИЕ: Поверхностный слой стула содержит отторгнутые клетки слизистой оболочки кишечника и подвержен внешнему загрязнению; после контакта с воздухом некоторые микробные ДНК начинают разрушаться. - Собранные образцы кала переложите в стерильные микроцентрифужные пробирки объемом 2 мл или стерильные криовиалы, каждая пробирка должна содержать 0,5-2,0 г стула. Подготовьте две аликвоты для заморозки на каждый образец.
- Повторно суспендируйте свежий образец кала в стерильном физиологическом растворе, при этом каждые 100 мг стула разводят в 1 мл раствора. Тщательно перемешайте стул до тех пор, пока не будут видны крупные частицы.
- После естественного осаждения в течение 10 минут последовательно отфильтруйте надосадочную жидкость через стерильные сетчатые фильтры с размерами пор 200 меш (0,075 мм), 400 меш (0,038 мм) и 800 меш (0,018 мм) для удаления непереваренной пищи и более мелких твердых частиц. Наконец, соберите фильтрат в стерильные центрифужные пробирки.
- Возьмите 10 μл отфильтрованной фекальной суспензии и определите микробную концентрацию с помощью гемоцитометра и инвертированного флуоресцентного микроскопа.
ПРИМЕЧАНИЕ: После фильтрации надосадочной жидкости образца кала через ячейки разного размера остаются некоторые более мелкие частицы кала. Поэтому при определении концентрации микробов активные частицы, наблюдаемые под микроскопом, рассматриваются как микроорганизмы, что позволяет лишь приблизительно рассчитать концентрацию микроорганизмов. - Перенесите фекальную суспензию в стерильную центрифужную пробирку объемом 1,5 мл и пометьте ее датой, концентрацией микроорганизмов и названием образца. Оставьте часть для последующих экспериментов, а остальное храните при температуре 4 °C в будущем.
ПРИМЕЧАНИЕ: Своевременно записывайте информацию об образце (название образца, время сбора), чтобы обеспечить одновременный сбор образцов (с учетом изменений временного ритма кишечных микроорганизмов млекопитающих). Весь сбор и обработка проб должны осуществляться в анаэробной среде.
- Подготовьте ночной горшок и контейнеры для стула, вымойте руки и наденьте перчатки, чтобы собрать свежие образцы стула.
- Подготовка к начальной суспензии кала
- Приготовьте среду Brain Heart Broth (BHI) в соответствии с протоколом производителя и простерилизуйте ее путем автоклавирования при 121 °C в течение 15 минут.
- Возьмите фекальную суспензию из шага 3.1.8 и выполните последовательное разведение средой BHI до достижения концентрации ~50 клеток/мл.
ПРИМЕЧАНИЕ: Чтобы наполнить флакон с образцом, приготовьте не менее 40 мл фекальной суспензии. - Убедившись, что на дне находится небольшая магнитная мешалка, вылейте разбавленную фекальную суспензию в бутылку с образцом до места добавления образца. Закрутите колпачок и закрутите его. Затем вставьте быстроразъем A в быстроразъем B, чтобы завершить процесс загрузки образца (рис. 3A).
- Поместите флакон с образцом в указанное положение и отделите быстроразъемные соединения A и B от флакона с образцом. Подсоедините быстроразъем A флакона с образцом к порту O3 в системе Omics, а разъем C3 на микротрубке и микрофлюидном чипе для генерации капель подключите к быстроразъемному разъему B. Закройте дверцу камеры генерации капель и культивирования (рис. 3B).
- Генерация капель
- Выберите желаемое количество капельных трубок, которые будут сгенерированы в домашнем интерфейсе программного обеспечения (рис. 2A).
ПРИМЕЧАНИЕ: Каждый прогон может производить до 10 капельных трубок, при этом каждая трубка генерирует около 5 000 капель. - Нажмите «Создать» в домашнем интерфейсе программного обеспечения, чтобы начать генерацию капель одиночных клеток.
ПРИМЕЧАНИЕ: Убедитесь, работает ли насос для сброса отработанной жидкости или нет. Во время генерации капель каждая капля имеет объем 2,0 мкл. Смотрите раздел обсуждения для описания генерации капель. - Подождите, пока звуковой сигнал не укажет на то, что генерация капель завершена. Закройте зажим на разъеме C3 (рис. 1E) и извлеките флакон с образцом.
- Выберите желаемое количество капельных трубок, которые будут сгенерированы в домашнем интерфейсе программного обеспечения (рис. 2A).
4. Выращивание капель
- Выберите тот же номер капельной трубки, что и во время генерации капель, в домашнем интерфейсе программного обеспечения, нажмите «Культура», подтвердите время и температуру выращивания и начните процесс. Следите за индикатором выполнения в домашнем интерфейсе, который показывает прогресс обработки и оставшееся время.
- Подождите, пока звуковой сигнал не укажет на то, что выращивание капель завершено. Если время обработки необходимо продлить, отрегулируйте время непосредственно в интерфейсе настроек .
5. Просеивание капель
- Нажмите кнопку UV на системе Omics, чтобы включить ультрафиолетовое (УФ) излучение (рис. 1A), облучайте камеру обнаружения и сбора капель в течение 30 минут, а затем выключите ультрафиолетовое излучение.
ПРИМЕЧАНИЕ: Перед включением ультрафиолетового излучения убедитесь, что дверца камеры обнаружения и сбора капель закрыта. - В сверхчистом скамейке откройте все 96-луночные планшеты, используемые для сбора капель, и сложите их друг на друга без крышек, последовательно пронумеровав их снизу вверх. Следите за тем, чтобы верхняя пластина колодца была закрыта крышкой.
ПРИМЕЧАНИЕ: В каждом прогоне может быть до десяти 96-луночных планшетов, а количество планшетов зависит от общего количества капель. - Откройте дверцу камеры обнаружения и сбора капель, установите луночные пластины в обозначенные места (рис. 1D), снимите крышку с верхней луночной пластины и закройте дверцу камеры.
- Включите ультрафиолетовый свет на системе Omics на 30 минут, чтобы выполнить вторичную стерилизацию.
- Установка устройства для удаления пузырьков воздуха
- Снимите средство для удаления пузырьков воздуха с места установки, открутите крышку и снимите винт в форме бабочки с крышки (рисунок 3C).
- Налейте 200 мл масла для удаления пузырьков воздуха в средство для удаления пузырьков воздуха, плотно закрутите флакон с крышкой средства для удаления пузырьков воздуха на системе Omics, а затем зафиксируйте средство для удаления пузырьков воздуха вверх ногами на месте удаления пузырьков воздуха. Установка средства для удаления пузырьков воздуха завершена.
ПРИМЕЧАНИЕ: При фиксации средства для удаления пузырьков воздуха на месте убедитесь, что масло не вытекает. Если произошла утечка, закрутите крышку.
- Выберите капельную трубку для сортировки в домашнем интерфейсе, нажмите кнопку Сортировка, введите количество луночных пластин, которые необходимо собрать, а затем начните процесс. После начала скрининга капель наблюдайте за областью отображения процесса, на которой в режиме реального времени отображаются измерения оптической плотности (OD) капель или значений флуоресценции.
- Проанализируйте примерно 20-30 капель, чтобы проверить значение OD. Например, если обнаружено, что большинство из них имеют значение OD ~0,2, что соответствует значению OD пустых капель, основанное на распределении Пуассона, установите нижний порог OD равным 0,5, а верхний порог OD равным 4,0. Капли в этом диапазоне будут автоматически собираться в 96-луночные планшеты (Рисунок 4A).
ПРИМЕЧАНИЕ: Согласно закону Беера-Ламберта, значение OD пустых капель определяется составом питательной среды внутри капель. Как правило, нижний порог OD устанавливается на 0,2-0,3 единицы выше, чем значение OD пустых капель, чтобы обеспечить четкое различие между пустыми каплями и каплями, содержащими микроорганизмы. - Подождите, пока звуковой сигнал не укажет на то, что фильтрация и сбор капель завершены. Откройте дверцу камеры обнаружения и сбора капель, наденьте крышку луночной пластины на верхнюю луночную пластину, а затем выньте все луночные планшеты из камеры вместе, чтобы провести последующее секвенирование и резервное копирование.
6. Экспорт данных и отображение тепловых карт
- Нажмите кнопку Экспорт данных, чтобы сохранить собранные данные о сигнале капель (рис. 4A, B).
- Нажмите Тепловая карта, выберите файл данных сбора капель и наблюдайте за значениями наружного диаметра капель, собранных на микропланшете, отображаемом программным обеспечением. Визуализируйте эти значения ОП в виде тепловой карты, где интенсивность цвета соответствует распределению ОП по лункам, обеспечивая четкое и интуитивно понятное представление собранных значений ОП моноклональных ОП (рис. 4A, C).
7. Чистка ячейки MISS
- После завершения эксперимента выберите капельную трубку, которую необходимо очистить, и нажмите кнопку Очистить , чтобы начать очистку прибора.
8. Микробное моноклональное резервное копирование и секвенирование образцов
- Секвенирование пробоподготовки
- На анаэробном стенде добавьте по 100 мкл среды BHI в каждую лунку собранной капельной пластины, хорошо перемешайте с помощью пипетирования, а затем возьмите по 10 мкл из каждой лунки и переложите все это в одну стерильную пробирку объемом 15 мл. Vortex для получения смешанной микробной суспензии.
- Добавьте 5 мл фосфатно-солевого буфера в смешанную микробную суспензию, центрифугируйте при 1000 × г в течение 10 минут, удалите надосадочную жидкость и поместите микробную гранулу в жидкий азот для быстрого замораживания. Подготовка образца для секвенирования завершена.
- Используйте методы ампликон-секвенирования 16S рДНК, нацеленные на домены V3 и V4 16S рДНК. Конкретные используемые праймеры для секвенирования: 341F: ACTCCTACGGGAGGCAGCA и 806R: GGACTACHVGGGTWTCTAAT.
- Криоконсервация микробного моноклонального образца:
- После сбора 10 мкл образца из каждой лунки в капельные пластины (с шага 8.1.1) добавьте 30 мкл глицерина в каждую лунку. Поместите планшеты при температуру ниже -80 °C для сохранения микробного штамма.
Результаты
По оценкам, микробиота кишечника человека, составляющая преобладающее микробное сообщество, содержит в кишечнике примерно 4 ×10 13 микроорганизмов, что свидетельствует о ее огромном количестве и сложном составе11. В этом исследовании мы стремились изолировать и культивировать микробиоту кишечника и использовали метод твердой пластины в качестве контроля, чтобы продемонстрировать высокую пропускную способность клетки MISS.
Во-первых, мы использовали одну и ту же фекальную суспензию для сравнения пропускной способности выделения одиночных клеток при обоих методах. В клетке MISS мы использовали низкие микробные концентрации, где вероятность распространения микроорганизмов в каплях можно рассчитать на основе распределения Пуассона: P(λ,x) = λx e-λ/x!, где λ — среднее количество клеток над каплями, которое можно рассчитать путем умножения микробной концентрации и объема капель; x — количество клеток, инкапсулированных в капли. Здесь мы использовали исходную концентрацию микробной суспензии = 0,1 (исходная микробная концентрация составляет 50 клеток/мл, а объем капель составляет 2,0 мкл), что указывает на вероятность появления пустых капель, одноклеточных капель и многоклеточных капель 90,5% (x = 0), 9,1% (x = 1) и 0,4% (x ≥ 2) соответственно.
В системе Omics мы сгенерировали около 30 000 капель со скоростью 5 000 капель в час и культивировали их в шести пробирках с политетрафторэтиленом (внешний диаметр 1,67 мм, внутренний диаметр 1,07 мм) в течение 30 дней. В конечном счете, мы проверили капли через модуль детектирования, используя режим обнаружения OD, для сбора содержащих бактерии капель в 96-луночных планшетах и получили 1057 целевых моноклональных штаммов. Напротив, при использовании метода культивирования твердыми пластинами концентрация твердого агарового планшета составляла 3,0 × 103 клеток /мл при использовании в общей сложности десяти 100 мм чашек Петри (каждая пластина содержала 100 мкл исходной микробной суспензии). После 30 дней выращивания из тарелок было собрано 536 колоний. Система Omics дала в 1,97 раза больше моноклональных клонов, чем метод твердых пластин. Это указывает на то, что моноклональное культивирование одиночных клеток в микрофлюидных каплях может эффективно изолировать микроорганизмы, устраняя при этом конкурентное ингибирование между колониями.
Затем мы провели анализ 16S секвенирования по всем моноклональным штаммам и сравнили видовое разнообразие, полученное с помощью двух вышеупомянутых методов. С точки зрения видового разнообразия на уровне семейств, те же 34 семейства могут быть обогащены с помощью обоих методов. В частности, система Omics дополнительно обогатила четыре семейства: Bacteroidales unclassified, Bacillales Thermoactinomycetaceae, Burkholderiales Comamonadaceae и Enterobacterales unclassified (Рисунок 5B) и легко обогатила более низкое содержание Clostridiales Family_XI, Clostridiales Acidaminococcaceae, Desulfovibrionales Desulfovibrionaceae и Enterobacterales Enterobacteriaceae в исходной микробной суспензии (Рисунок 5D).
На уровне рода 74 рода могут быть обогащены обоими методами, в то время как клеточный метод MISS дополнительно обогатил 13 родов микробов: Bacillaceae Bacillus, Bacillaceae Oceanobacillus, Bacillaceae Pseudogracilibacillus, Thermoactinomycetaceae Kroppenstedtia, Peptoniphilaceae Phocea, Clostridiaceae Anaerosalibacter, Peptoniphilaceae Ezakiella, Peptoniphilaceae W5053, XI неклассифицированные, Clostridiaceae Clostridioides, Comamonadaceae Pelomonas и два неклассифицированных вида микробов (Рисунок 5C). Среди них роды Enterococcaceae Enterococcus и Acidaminococcaceae Phascolarctobacterium, которые были в меньшей численности в исходной микробной суспензии, были легко обогащены с помощью системы Omics (рис. 5E). Как и ожидалось, эти два рода принадлежали к семейству Enterococcaceae и Acidaminococcaceae соответственно, где мы наблюдали одинаковые результаты анализа семейства. В целом, на уровне семейства и рода видовое обогащение методом MISS cell culture увеличилось на 30,6% и 37,9% соответственно по сравнению с методом культивирования в твердой тарелке. Эти результаты показали, что метод культивирования клеток MISS обеспечивал лучшие условия роста для тех штаммов, которые присутствовали в низких пропорциях или имели плохие показатели роста в исходной микробной суспензии.

Рисунок 1: Структура и основные компоненты ячейки MISS. (A) Внешний вид ячейки MISS. 1. Камера генерации и культивации капель, 2. Камера обнаружения и сбора капель, 3. Подсветка и УФ-кнопки камеры сбора капель. (B) Внутреннее пространство камеры генерации капель и культивации. В этой камере осуществляется генерация капель, инкубация капель и удаление пузырьков воздуха для просеивания капель. 4. Камера для выращивания капель, 5. Зажимные клапаны для зажима силиконовых трубок из микротрубок и микрофлюидного чипа для генерации капель; Зажимные клапаны пронумерованы последовательно от 1 до 10, слева направо, 6. Размещение средства для удаления пузырьков воздуха, 7. Порты для генерации капель и просеивания (O1-O4): масло, проба и газовая фаза подключаются к ячейке MISS через эти порты. 8. Порт для отходов (OF), 9. Прижимной клапан для зажима капельной отводящей трубки устройства для удаления пузырьков воздуха, 10. Отверстие, ведущее в камеру обнаружения и сбора капель, 11. Размещение бутылок с образцами; Под помещением находится магнитная мешалка, которую можно использовать для управления скоростью перемешивания образца.(C) Вид сверху на камеру для выращивания капель. Внутри камеры находится отверстие для впуска воды для увлажнителя воздуха. Шприц используется для добавления 10 мл стерильной дистиллированной воды, устанавливается защитная крышка и микрофлюидный чип микротрубки и генерации капель, а силиконовые трубки из микротрубки зажимаются к соответствующим зажимным клапанам, как показано на рисунке справа. 12. Входное отверстие для воды для увлажнителя воздуха в камере обработки капель, 13. Микротрубки и микрофлюидный чип для генерации капель. (D) Внутренняя часть камеры обнаружения и сбора капель. На рисунке слева показаны три установки луночных планшетов и манипулятор-манипулятор, перемещающий луночный планшет между установками. На изображении справа показан увеличенный вид модуля обнаружения и сбора капель (красный прямоугольник на изображении слева). Установка 96 колодезных пластин 14. раньше, 15. во время и 16. после сбора капель. 17. 96 Роботизированная рука для обработки скважинных плит. Во время обнаружения и сбора капель роботизированный манипулятор перемещает один 96-луночный планшет к луночному планшету, расположенному рядом с модулем обнаружения капель. После завершения сбора капель луночный планшет перемещается в другое место, и та же операция продолжается до завершения процесса. 18. Модуль обнаружения и сбора капель. 19. Держатель волокна для волокна обнаружения. Существует два детектирующих волокна (на основе OD и на основе флуоресценции). Когда используется одно волокно обнаружения, другое вставляется в держатель волокна. 20. Детекторная трубка. Эта трубка уже подсоединена к выпускной трубке устройства для удаления пузырьков воздуха. 21. Детектирующее волокно на основе OD и флуоресценции; Волокна обнаружения помечены соответствующими названиями. 22. Оптическое волокно источника света. 23. Гнездо обнаружения, в которое вставляется трубка обнаружения. 24. Винт для фиксации волокна для фиксации волокна обнаружения. 25. Винт, которым крепится трубка обнаружения. Затяните винт после того, как трубка обнаружения будет правильно вставлена в отверстие для обнаружения. 26. Порт для отработанных жидкостей. 27. Сливная трубка для отвода капель вне сигнала сбора. (E) Установка микротрубки, микрофлюидного чипа для генерации капель и средства для удаления пузырьков воздуха в соответствующее место. Четыре трубки (C1, C2, C4 и CF) соответственно подключены к соответствующим портам ячейки MISS. (O1, O2, O4 и OF). 28. Защитная крышка для микротрубки и микрофлюидного чипа для генерации капель. 29. Средство для удаления пузырьков воздуха. 30. Капельная входная трубка в средство для удаления пузырьков воздуха. 31. Капельная отводящая трубка от устройства для удаления пузырьков воздуха. 32. Зажимной клапан на разъеме С3. Сокращения: MISS = система омикса одноклеточных микролитровых капель; OD = оптическая плотность. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
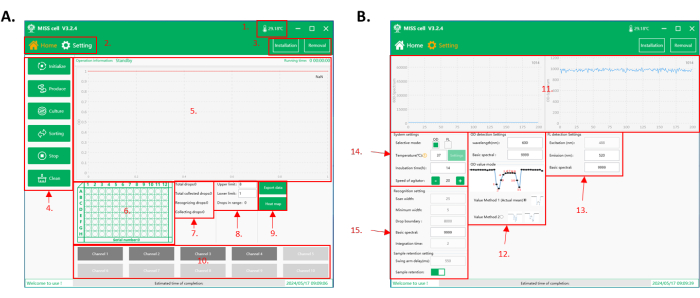
Рисунок 2: Интерфейс программного обеспечения для управления ячейкой MISS. (A) Домашний интерфейс программного обеспечения. 1. Температура в рабочей камере. 2. Функциональный интерфейс. Есть два интерфейса для работы: домашний интерфейс и интерфейс настройки параметров. 3. Микротрубки и капли, микрофлюидные кнопки установки и удаления чипов. 4. Выбор функции: на выбор предлагается шесть функций: «Инициализация», «Производство», «Культура», «Сортировка», «Остановка» и «Очистка». 5. Область отображения процесса: в этой области отображается информация о работе, время работы и собранные данные капель. 6. Область отображения 96-луночных планшетов: отображение в режиме реального времени текущего номера сборной пластины и положения лунки для сбора капель. 7. Область отображения данных обнаружения и сбора капель. 8. Сортировка верхнего и нижнего предела, настройка и отображение области отображения количества капель. Диапазон собираемой капли устанавливается в соответствии с сигналом капли (OD/интенсивность флуоресценции). Клеточная система MISS подсчитывает общее количество собранных капель. 9. Кнопки для экспорта данных сбора и отображения тепловых карт пластин. 10. Зона капельной трубки. Выберите количество трубок, которые будут использоваться для генерации капель, культивирования капель, просеивания капель и очистки. (B) Интерфейс настройки параметров программного обеспечения. 11. Отображение в режиме реального времени спектральных значений, обнаруженных при сортировке капель (OD/интенсивность флуоресценции). 12. Параметры настройки обнаружения наружного диаметра, включая длину волны обнаружения, базовое спектральное значение и режим внешнего диаметра. Существует два режима наружного диаметра: эффективное среднее значение (метод значений 1), который вычисляет среднее значение спектрального значения капли; и минимальное значение (метод значений 2), которое принимает минимальное значение спектрального значения капли в качестве сигнала. 13. Параметры настройки флуоресцентного детектирования, включая возбуждение (конфигурация прибора), длину волны излучения (350-800 нм) и базовое спектральное значение. 14. Параметры настройки системы, включая выбор режима детектирования (OD/интенсивность флуоресценции), температуры инкубации, времени инкубации и скорости перемешивания образца во флаконе с реагентом. 15. Параметры для идентификации капель и настройки сбора образцов. Сокращения: MISS = система омикса одноклеточных микролитровых капель; OD = оптическая плотность. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Иллюстрация 3: Установка флакона с образцом и средства для удаления пузырьков воздуха. (A) Флакон с образцом MISS cell. Микробная суспензия добавляется во флакон с образцом в место добавления образца. Крышка немедленно закручивается и подключаются быстроразъемные соединения A и B. Наконец, бутылка с образцом помещается в место для бутылки с образцом на ячейке MISS. (B) Установка бутылки с образцом. Быстроразъемные соединения A и B подключены к порту O3 на ячейке MISS и разъему C3 от микрофлюидного чипа микротрубки и микрофлюидного чипа для генерации капель соответственно. (C) Установка устройства для удаления пузырьков воздуха. При установке средства для удаления пузырьков воздуха винт в форме бабочки сначала снимается с крышки перед установкой бутылки, содержащей масло для удаления пузырьков воздуха. Сокращение: MISS = Single-cell Microliter-droplet Culture Omics System Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
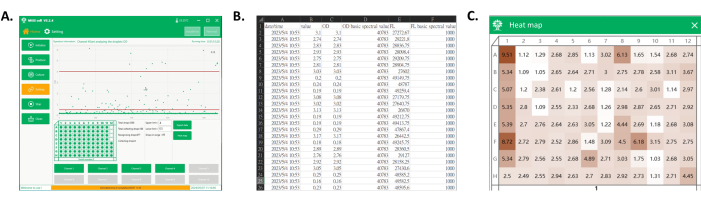
Рисунок 4: Экспорт данных и тепловая карта собранной луночной пластины. (A) Основной интерфейс программного обеспечения при обнаружении и сборе капель. В области отображения процесса отображается сигнал каждой капли, а капли в нужном диапазоне собираются на планшет лунки. (B) Скриншот части экспортируемых данных. Экспортируемые данные включают в себя спектральный сигнал собранных капель (столбцы C и E) и время их обнаружения (столбец A). (C) Скриншот тепловой карты номерного знака. На основе сигналов от собранных капель значения нормализуются для получения тепловой карты планшета, которая может быть использована позже для дифференциации культуральных характеристик моноклональных штаммов каждого клона по цвету. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
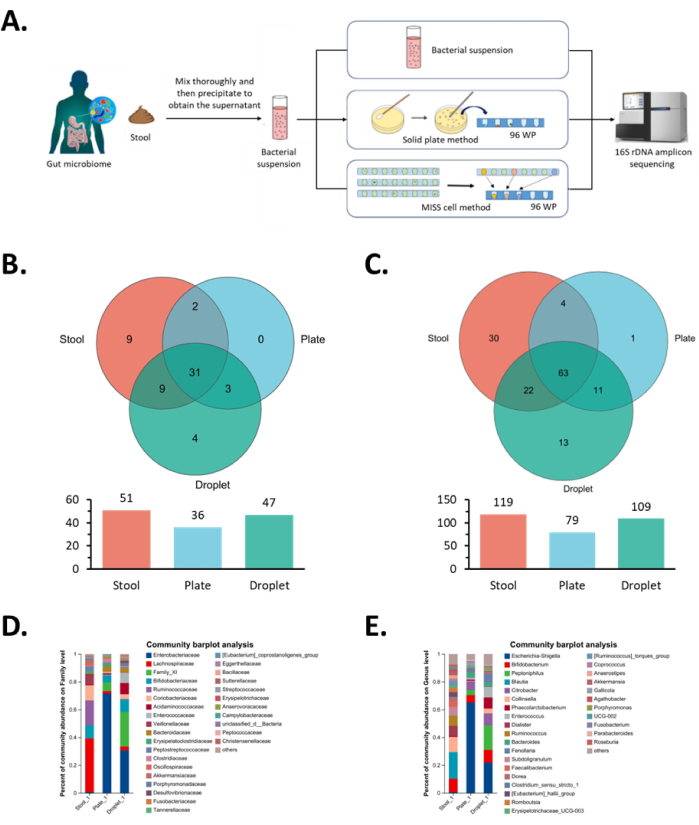
Рисунок 5: Результаты моноклонального выделения и культивирования кишечных микроорганизмов в клетке MISS. (A) Схема рабочего процесса для выделения, культивирования и идентификации кишечной микробиоты. Исходная микробная суспензия, метод твердой пластины и клеточный метод MISS используются для выделения и культивирования одной и той же кишечной микробиоты с последующим анализом секвенирования. (Б,Г) Анализ моноклональных колоний на семейном уровне, полученный в результате выделения и культивирования кишечной микробиоты, где B показывает анализ диаграммы Венна, а D — анализ состава сообщества. (С,Е) Анализ моноклональных колоний на уровне рода, полученных в результате выделения и культивирования кишечной микробиоты, где C показывает анализ диаграммы Венна, а E — анализ состава сообщества. Сокращение: MISS = Single-cell Microliter-droplet Culture Omics System. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В этом протоколе описывается работа клетки MISS для автоматизированной и высокопроизводительной микробной моноклональной изоляции, культивирования, обнаружения и сбора. По сравнению с традиционными методами, с помощью которых можно было выделить и культивировать только ~20%-30% микробиоты кишечника 2,12, количество моноклональных клонов, полученных с помощью системы Omics, было в 1,97 раза выше, чем полученных из твердых планшетов. Это сравнение показывает, что клетка MISS имеет преимущества в выделении одиночных клеток, моноклональном культивировании и скрининге.
Для выделения одиночных клеток в системе Omics были получены капли одиночных клеток в соответствии с распределением Пуассона, что обеспечило хорошую моноклональность. Кроме того, система Omics генерирует капли со скоростью до 5 000 капель в час, что обеспечивает высокопроизводительную изоляцию одиночных клеток при значительном снижении расхода реагентов благодаря малому размеру капель. При генерации капель был использован канал фокусировки потока на микротрубке. Система Omics использует инжекторный насос для проталкивания масляной фазы, раствора образца и газа в канал фокусировки потока и образования капель. Пользователи могут наблюдать, успешно ли капли генерируются через канал или глядя непосредственно на капельную трубку. Силиконовые трубки из микротрубки и микрофлюидного чипа для генерации капель соединены с концами 10 капельных трубок. Когда в одной капельной трубке образуется достаточное количество капель (~5 000 капель), зажимной клапан автоматически зажимает силиконовые трубки трубки и продолжает генерировать каплю в следующую трубку.
При культивировании моноклонального штамма микроорганизмы в каплях получили преимущества от превосходных показателей газообмена, высокого параллельного культивирования и эффективного массообмена, что обеспечивает оптимальные условия роста для сортов с низкой численностью или с трудностью выращивания. Для скрининга моноклональных штаммов система Omics поддерживала флуоресценцию и обнаружение биомассы на основе OD, благодаря чему обнаружение могло быть основано на показателях роста микроорганизмов и уровне экспрессии конкретного гена или белка, представляющего интерес13. Кроме того, в системе Omics использовалось гравитационно-индуцированное осаждение капель в пластины скважин. Сочетая этот метод пассивного скрининга с поворотным рычагом, он обеспечил стабильное и высокоточное скрининг капель, что делает его экологически чистой платформой для скрининга. Кроме того, система Omics позволила добиться полной автоматизации процесса от выделения одного микроорганизма до финального клонального скрининга, что позволило сократить трудовые и временные затраты.
Учитывая производительность системы Omics, она может быть использована для микробной культуромики и скрининга микробного мутагенеза, а также для других приложений, таких как отбор высокопродуктивныхштаммов и поиск ключевых функциональных генов. Чтобы получить точные экспериментальные результаты, исследователи могут оптимизировать условия эксперимента в зависимости от видов, подлежащих выделению, культивированию и скринингу. Во-первых, генерация одноклеточных капель в системе Omics происходит в соответствии с распределением Пуассона, где низкое значение λ гарантирует, что генерируемые капли являются преимущественно пустыми или одноклеточными каплями. В нашей предыдущей работе мы подтвердили, что оптимальный диапазон концентраций микроорганизмов для генерации капель одиночных клеток в системе Omics составляет 16,8-69,7 клеток/мл (λ = 0,035-0,145)6. При приготовлении суспензий образцов крайне важно разбавлять их в этом диапазоне концентраций для повышения точности моноклональности. Во-вторых, перед использованием системы Omics необходимо оптимизировать условия роста микроорганизмов. Исходя из потребности микроорганизма в кислороде, исследователи могут выбрать либо азот, либо кислород в качестве газовой фазы для генерации капель. В-третьих, при обнаружении капель поглощение или флуоресценция определяется интенсивностью света, полученного после освещения капель. Следовательно, числовые значения, полученные из одного и того же образца, могут различаться между обнаружением капель и измерением спектрофотометром из-за различий в толщине образца, как это наблюдалось в нашей предыдущей работе14. Поэтому перед проведением экспериментов рекомендуется установить калибровочную кривую для экспериментальных образцов.
Кроме того, мы также улучшаем производительность системы Omics для применения в других видах, таких как клетки млекопитающих, включая биосовместимость масляной фазы с клетками (например, фторированное масло имеет более высокую растворимость в газах и больше подходит для культуры клеток млекопитающих15,16), влияние двухфазной скорости потока на клеточную силу сдвига17, 18,19, и оптимизация размера капель13,20. Эти усовершенствования могут значительно облегчить использование системы Omics в биомедицинских исследованиях, таких как разработка клеточных линий, скрининг антител к одиночным В-клеткам и открытие гибридомных антител. Основываясь на трех основных операционных модулях системы Omics — генерации, культивировании и скрининге капель, исследователи могут выбрать подходящие модули в соответствии с требованиями эксперимента. Кроме того, модуль впрыска капель и расщепления капель может быть добавлен в описанную здесь систему для выполнения добавления реагентов или создания библиотек деформаций.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Это исследование было поддержано проектами исследований и разработок в ключевых районах провинции Гуандун (2024B1111130002), проектами исследований и разработок провинции Хэбэй (22375503D) и проектом открытия Аньхойской инженерной лаборатории по промышленной микробиологии молекулярной селекции (грант ELMB-07).
Материалы
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Merck KGaA, Darmstadt, Germany | P5731-500EA | For solid plate preparation |
| 30 mL Stool Containers | Boen Healthcare Co., Ltd | 611101 | For collecting the stool samples |
| 37 °C constant temperature incubator | Shanghai Yiheng Technology Co., Ltd. | LRH-150 | Cultivate the solid plate in the incubator |
| 96-well Clear Flat Bottom Polystyrene TC-treated Microplates | Corning | 3599 | For well plate movement detection and droplet collection |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| Air bubble removal oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S-oil | The oil in the air bubble remover during droplet screening |
| Air bubble remover | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S | Exclude the gas phase between droplets before performing droplet detection and collection |
| Anaerobic bench | Argon and Nitrogen Space Equipment Business Department, Haiyu Town, Changshu City | VGB-4CM | For aseptic operation and UV sterilization under anaerobic condition |
| Autoclave | Puhexi Health and Medical Equipment Co., Ltd. | MLS-830L | For autoclaving BHI medium, EP tube, and so on. |
| Brain Heart Infusion (BHI) Broth | Qingdao High-tech Industrial Park Haibo Biotechnology Co., Ltd | HB8297-1 | Components of the BHI medium The ingredient list: 38.5 g/L BHI Broth in distilled water |
| Cell Spreader | Merck KGaA, Darmstadt, Germany | HS8151 | Inoculate the microbial solution onto the solid plate |
| Centrifuge tube, 15 mL | Beijing Xinhengyan Technology Co., Ltd | HB53397 | For microbial solution preparation |
| Computer | Lenovo | E450 | Software installation and MISS cell control |
| Cryovial | Thermo Fisher | 2.0 mL | For stool preservation |
| Distilled water | Beijing Mreda Technology Co., Ltd. | M306444-100ml | Add into humidifier to keep the humidity in droplet cultivation chamber |
| EP tube | Thermo Fisher | 2.0 mL | For collecting the stool samples |
| Fluorescent inverted microscope | Olympus Life Science (LS) | CKX53 | Check and calculate the microbial concentration |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| Hemocytometer | Acmec | AYA0810-1ea | Calculate the microbial concentration |
| KCl | Ambeed | A442876 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| KH2PO4 | MACKLIN | P815661 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| Mesh filter | Anping Jiufeng Wire Mesh Manufacturing Co., Ltd | 200 mesh (0.075 mm), 400 mesh (0.038 mm), 800 mesh (0.018 mm) | Remove undigested food and smaller particulate matter from the stool samples |
| Micro-tubing and droplet generation microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISC-B2 | For droplet generation and droplet incubation |
| MISS cell oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-BOS-B | The oil phase for droplet microfluidics |
| MISS cell software | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell V3.2.4 | Perform experimental operations on the MISS cell instrument |
| Na2HPO4 | Solarbio | D7292 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| NaCl | GENERAL-REAGENT | G81793J | Components of the physiological saline solution The ingredient list: 9 g/L NaCl in distilled water |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Polytetrafluoroethylene tube | Shenzhen WOER Heat-shrinkable Material Co., Ltd. | 3401000141 | For droplet incubation. This material was already included in micro-tubing and droplet generation microfluidic chip |
| Sample bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-bottle | Sampling of microbial solution |
| Single Cell Microliter-droplet Culture Omics System (MISS cell) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-G3f | Performing the microbial monoclonal isolation, cultivation, detection and collection |
| Superspeed Centrifuge | Thermo Fisher | Sorvall Lynx 4000 | Prepare the microbial solution for sequencing |
| Syringe | Jiangsu Zhiyu Medical Instructment Co., Ltd | 10 mL | Draw the distilled water and inject it into the humidifier in droplet cultivation chamber |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
Ссылки
- Hahn, M. W., Koll, U., Schmidt, J., Hurst, C. J. Isolation and cultivation of bacteria. The structure and function of aquatic microbial communities. , 313-351 (2019).
- Xu, M. Q., Pan, F., Peng, L. H., Yang, Y. S. Advances in the isolation, cultivation, and identification of gut microbes. Mil Med Res. 11 (1), 34 (2024).
- Lattermann, C., Büchs, J. Microscale and miniscale fermentation and screening. Curr Opin Biotechnol. 35, 1-6 (2015).
- Huang, Y., et al. High-throughput microbial culturomics using automation and machine learning. Nat Biotechnol. 41 (10), 1424-1433 (2023).
- Brehm-Stecher Byron, F., Johnson Eric, A. Single-cell microbiology: Tools, technologies, and applications. Microbiol Mol Biol Rev. 68 (3), 538-559 (2004).
- Jian, X., et al. Single-cell microliter-droplet screening system (miss cell): An integrated platform for automated high-throughput microbial monoclonal cultivation and picking. Biotechnol Bioeng. 120 (3), 778-792 (2023).
- Hu, B., et al. One cell at a time: Droplet-based microbial cultivation, screening and sequencing. Mar Life Sci Technol. 3 (2), 169-188 (2021).
- Leygeber, M., et al. Analyzing microbial population heterogeneity-expanding the toolbox of microfluidic single-cell cultivations. J Mol Biol. 431 (23), 4569-4588 (2019).
- He, Z., Wu, H., Yan, X., Liu, W. Recent advances in droplet microfluidics for microbiology. Chinese Chemical Letters. 33 (4), 1729-1742 (2022).
- Kaminski, T. S., Garstecki, P. Controlled droplet microfluidic systems for multistep chemical and biological assays. Chem Soc Rev. 46 (20), 6210-6226 (2017).
- Sender, R., Fuchs, S., Milo, R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell. 164 (3), 337-340 (2016).
- Simrén, M., et al. Intestinal microbiota in functional bowel disorders: A rome foundation report. Gut. 62 (1), 159-176 (2013).
- Periyannan Rajeswari, P. K., Joensson, H. N., Andersson-Svahn, H. Droplet size influences division of mammalian cell factories in droplet microfluidic cultivation. Electrophoresis. 38 (2), 305-310 (2017).
- Jian, X., et al. Microbial microdroplet culture system (mmc): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnol Bioeng. 117 (6), 1724-1737 (2020).
- Baret, J. -. C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Kubie, L. S. The solubility of O2, CO2, and N2 in mineral oil and the transfer of carbon dioxide from oil to air. J Biol Chem. 72 (2), 545-548 (1927).
- Poon, C. Measuring the density and viscosity of culture media for optimized computational fluid dynamics analysis of in vitro devices. J Mech Behav Biomed Mater. 126, 105024 (2022).
- Yao, J., Lin, F., Kim, H. S., Park, J. The effect of oil viscosity on droplet generation rate and droplet size in a t-junction microfluidic droplet generator. Micromachines. 10 (12), 808 (2019).
- Venkateshwarlu, A., Bharti, R. P. Effects of capillary number and flow rates on the hydrodynamics of droplet generation in two-phase cross-flow microfluidic systems. Journal of the Taiwan Institute of Chemical Engineers. 129, 64-79 (2021).
- Nekouei, M., Vanapalli, S. A. Volume-of-fluid simulations in microfluidic t-junction devices: Influence of viscosity ratio on droplet size. Physics of Fluids. 29, 032007 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены