Method Article
Coltivazione e prelievo monoclonale microbico automatizzato e ad alto rendimento con il sistema omico di coltura a microlitri di goccioline a cellula singola
In questo articolo
Riepilogo
Questo protocollo descrive come utilizzare il sistema omico di coltura a singola cellula microlitri-goccioline (cellula MISS) per eseguire l'isolamento, la coltivazione e il prelievo monoclonale microbico. La cella MISS raggiunge un flusso di lavoro integrato basato sulla tecnologia microfluidica delle gocce, che offre un'eccellente monodispersione delle gocce, un'elevata coltivazione parallela e un rilevamento della biomassa ad alto rendimento.
Abstract
Le colture batteriche pure sono essenziali per lo studio della cultura microbica. I metodi tradizionali basati su piastre solide, piastre a pozzetti e microreattori sono ostacolati da procedure macchinose e bassa produttività, che impediscono il rapido progresso della ricerca sulla culturromica microbica. Per affrontare queste sfide, abbiamo sviluppato con successo il sistema omico di coltura a microlitro di gocce di singola cellula (MISS cell), una piattaforma automatizzata ad alto rendimento che utilizza la tecnologia microfluidica delle goccioline per l'isolamento, la coltivazione e lo screening monoclonale microbico. Questo sistema è in grado di generare un gran numero di goccioline di singola cellula e di coltivare, vagliare e raccogliere colonie monoclonali in breve tempo, facilitando un processo integrato dall'isolamento microbico al prelievo. In questo protocollo, ne abbiamo dimostrato l'applicazione utilizzando come esempio l'isolamento e la coltivazione del microbiota intestinale umano e abbiamo confrontato l'efficienza dell'isolamento microbico, le prestazioni della coltura monoclonale e la produttività dello screening utilizzando il metodo di coltura su piastra solida. Il flusso di lavoro sperimentale era semplice e il consumo di reagenti era molto basso. Rispetto ai metodi di coltura su piastra solida, la cellula MISS potrebbe coltivare una maggiore diversità di specie di microbiota intestinale, offrendo un potenziale e un valore significativi per la ricerca culturomica microbica.
Introduzione
La culturromica microbica ha ampie applicazioni nella ricerca di microbi benefici nell'industria alimentare, nella diversità dei microbi ambientali, nello screening di nuovi composti antimicrobici e nel microbioma umano in relazione alla malattia 1,2,3,4. I metodi tradizionali, basati principalmente su piastre solide, piastre a pozzetti o microreattori per ottenere e prelevare colonie monoclonali, sono facili da utilizzare ma soffrono di una bassa produttività a causa delle loro molteplici fasi. Questa limitazione ostacola applicazioni come lo screening della mutagenesi microbica, gli studi di cultoromica microbica e la selezione di colonie ad alta produzione, che richiedono un ampio screening monoclonale.
Recentemente, sono stati progettati vari dispositivi di rilevamento e dispensazione a singola cellula per migliorare significativamente la velocità di elaborazione dei campioni microbici, riducendo al contempo la manodopera e minimizzando gli errori dovuti alla manipolazione manuale5. Tuttavia, questi strumenti in genere affrontano solo passaggi specifici all'interno dei metodi tradizionali, spesso richiedendo un'ampia integrazione delle apparecchiature, occupando uno spazio significativo e incorrendo in costi elevati. Pertanto, c'era l'urgente necessità di sviluppare una piattaforma di coltura e screening microbico a basso costo e universalmente applicabile per compensare le carenze sopra menzionate.
Nel nostro lavoro precedente, abbiamo sviluppato con successo una piattaforma di screening automatizzata ad alto rendimento, nota come Single-cell Microliter-droplet Culture Omics System (MISS cell, di seguito denominata "sistema omico")6. Questa piattaforma utilizza la tecnologia microfluidica a goccioline, che promette di ottenere l'automazione e l'integrazione nell'isolamento, nella coltivazione e nel prelievo microbico 7,8,9,10. Il sistema Omics comprende diversi moduli chiave, tra cui un modulo di campionamento, un chip microfluidico, un sistema di rilevamento e raccolta delle gocce, che consente un efficiente isolamento, coltivazione, screening monoclonale e raccolta di singole cellule nella ricerca microbiologica. Abbiamo già utilizzato il sistema Omics per ottenere uno screening di mutagenesi ad alto rendimento di Corynebacterium glutamicum6.
Grazie all'automazione e alle capacità di screening ad alto rendimento del sistema Omics, si prevede che l'applicazione alla culturologia microbica consenta di ottenere rapidamente una grande quantità di dati microbici. In questo protocollo, abbiamo introdotto la procedura operativa dettagliata della cellula MISS, con l'isolamento e la coltivazione del microbiota intestinale umano come esempio per dimostrare il processo di isolamento, coltivazione, rilevamento monoclonale e screening microbico di singole cellule. Il funzionamento del sistema Omics è semplice e i ricercatori devono solo seguire le indicazioni del software per l'installazione sequenziale di microtubi e chip microfluidici per la generazione di goccioline, le impostazioni dei parametri e la preparazione del campione.
Nell'interfaccia operativa del software, il sistema Omics è suddiviso in tre funzioni principali: isolamento, coltivazione e screening. I ricercatori possono selezionare diverse fasi in base all'esperimento. Inoltre, durante la fase di screening delle goccioline, i ricercatori possono scegliere tra due modalità di rilevamento: segnale fluorescente o densità ottica. Il software fornisce una visualizzazione in tempo reale del processo di screening delle goccioline. Infine, i ricercatori hanno la flessibilità di configurare parametri come le condizioni di coltura, la lunghezza d'onda rilevata e il numero di pozzetti di raccolta in base alle loro specifiche esigenze sperimentali, e possono mettere in pausa lo strumento in qualsiasi momento per eseguire altre operazioni. La cella MISS è una piattaforma di screening monoclonale ad alto rendimento e rispettosa dei microbi, con un funzionamento semplice e un consumo minimo di reagenti.
Protocollo
Tutte le procedure di studio sono conformi a tutte le norme etiche pertinenti. Le procedure sono state approvate dal Comitato Etico per la Scienza e la Tecnologia dell'Università Tsinghua. Per lo studio del microbiota intestinale umano, sono stati raccolti campioni di feci da un adulto sano senza condizioni mediche significative, che ha dato il consenso informato scritto.
1. Installazione dello strumento
- Collocare lo strumento del sistema Omics in un ambiente pulito o sterile (come una camera sterile o un banco anaerobico). Lo strumento è un dispositivo di precisione e, quando lo si posiziona nella struttura, considerare quanto segue:
- Mantenere lo strumento a pressione e temperatura normali.
- Tenere lo strumento lontano da forti campi elettrici, campi magnetici e fonti di radiazioni termiche.
- Assicurarsi che l'area di posizionamento dello strumento superi le dimensioni di 2.500 mm (P) x 1.500 mm (L) x 2.000 mm (A).
- Mantenere l'umidità ambientale dello strumento al di sotto del 60%.
2. Preparativi
- Accendere in sequenza il sistema Omics, il computer e il software operativo del sistema Omics.
- Installazione di microtubi per celle MISS e chip microfluidici per la generazione di goccioline:
- Aprire lo sportello della camera di generazione e coltivazione delle goccioline (Figura 1A) e rimuovere verticalmente il coperchio protettivo per il microtubo e il chip microfluidico per la generazione di goccioline. Utilizzare una siringa monouso per aggiungere 10 ml di acqua distillata sterile all'umidificatore all'interno della camera di coltivazione delle goccioline (Figura 1C) e reinstallare il coperchio protettivo per il microtubo e il chip microfluidico per la generazione di goccioline.
- Aprire la confezione sterile del microtubo e del chip microfluidico per la generazione di goccioline e posizionarlo verticalmente direttamente sopra la camera di coltivazione (Figura 1C).
- Nell'interfaccia del software, fare clic su Installazione (Figura 2A). A questo punto, viene visualizzata una finestra pop-up con il prompt Confermare la sostituzione del micro-tubo e del chip microfluidico per la generazione di goccioline? Fare clic su Sì per avviare l'installazione.
- Estrarre il dispositivo di rimozione delle bolle d'aria e fissarlo a testa in giù sul posizionamento del dispositivo di rimozione delle bolle d'aria nella camera di generazione e coltivazione delle goccioline. Fare attenzione a non premere i tubi di ingresso e uscita delle gocce del dispositivo di rimozione delle bolle d'aria (Figura 1E).
- Collegare il tubo di uscita delle goccioline del dispositivo di rimozione delle bolle d'aria al clampvalvola sottostante e lasciarlo passare attraverso il foro, che è diretto alla camera di rilevamento e raccolta delle gocce (Figura 1B).
- Aprire lo sportello della camera di rilevamento e raccolta delle gocce, inserire verticalmente il tubo di rilevamento, già collegato al tubo di uscita delle gocce, nella presa di rilevamento e assicurarsi che il tubo di rilevamento sia completamente inserito (Figura 1D).
NOTA: Quando si inserisce il tubo di rilevamento, inserirlo verticalmente senza alcuna piegatura sul tubo. - Serrare la vite che fissa il tubo di rilevamento in senso orario. Dopo aver verificato che la provetta di rilevamento sia completamente inserita e fissata, chiudere lo sportello della camera di rilevamento e raccolta delle goccioline.
- Dal micro-tubo e dal chip microfluidico per la generazione di goccioline, ci sono 10 tubi in silicone, ciascuno etichettato con un numero (L01-L10). Collegare ciascun tubo etichettato al corrispondente numerato clamp valvola (01-10) (Figura 1C).
- Collegare il connettore rapido dal micro-tubo e dal chip microfluidico per la generazione di goccioline alla porta corrispondente sul sistema Omics: da C1 a O1, da C2 a O2, da C4 a O4 e da CF a OF.
NOTA: L'installazione del chip microfluidico per la generazione di microtubi e goccioline è completa. Non è necessario collegare C3 a O3. - Dopo aver completato l'installazione del chip microfluidico per la generazione di microtubi e goccioline, viene visualizzata una finestra pop-up che richiede l'apertura della valvola di bloccaggio del tubo a gocce. Fare clic su OK quando l'installazione del chip microfluidico per la generazione di microtubi e goccioline è completata. Dopo essersi assicurati che tutti i tubi in silicone del microtubo e il chip microfluidico per la generazione di goccioline siano collegati alla valvola a morsetto corrispondente, fare clic su OK.
- Inizializzazione dello strumento
- Prima di eseguire l'inizializzazione, fare clic sull'interfaccia Impostazioni (Figura 2B) per configurare i parametri pertinenti: modalità di rilevamento (rilevamento basato su OD o fluorescenza; OD qui), temperatura di incubazione (37 °C) e tempo (30 giorni = 720 h), velocità dell'agitatore (20 giri/min), lunghezza d'onda di rivelazione OD (600 nm) e lunghezza d'onda di eccitazione ed emissione della rivelazione di fluorescenza.
NOTA: I parametri utilizzati per l'isolamento e la coltivazione del microbiota intestinale umano in questo protocollo sono riportati tra parentesi. Quando si impostano i parametri, la temperatura di coltivazione deve essere compresa tra 5 °C e 50 °C. Quando si seleziona la modalità di rilevamento, la fibra ottica deve essere sostituita se la fibra sul modulo di rilevamento delle gocce non è la stessa (vedere il passaggio 2.3.2). Durante la configurazione dei parametri, il valore di riferimento della fase dell'olio (spettrale di base) viene identificato automaticamente dal software, eliminando la necessità di regolazioni manuali. - La sostituzione della fibra ottica rilevata
- Rimuovere la fibra rilevata dal supporto della fibra (svitare in senso antiorario) e allentare la vite di fissaggio della fibra sul modulo droplet (Figura 1D).
- Se la fibra ottica non verrà utilizzata, rimuoverla dal modulo, inserirla nel supporto della fibra e serrarla. Inserire la fibra rilevata nella porta di rilevamento e serrare la vite di fissaggio della fibra sul modulo. La sostituzione della fibra ottica è terminata.
- Passare all'interfaccia Home e fare clic su Inizializza per consentire al sistema Omics di eseguire un autocontrollo dei suoi componenti, tra cui la pompa di iniezione, le impostazioni di temperatura, il test di scarico del liquido di scarto, il modulo di screening e il modulo di rilevamento delle goccioline.
- Durante l'inizializzazione, eseguire il test di scarico del liquido di scarto dal modulo di rilevamento delle goccioline iniettando 1 ml di alcol al 75% nella porta del liquido di scarto e osservando se il liquido fuoriesce normalmente.
- Per il test del modulo di screening, posizionare una piastra a 96 pozzetti sul posizionamento della piastra e osservare se il movimento della piastra è normale.
- Prima di eseguire l'inizializzazione, fare clic sull'interfaccia Impostazioni (Figura 2B) per configurare i parametri pertinenti: modalità di rilevamento (rilevamento basato su OD o fluorescenza; OD qui), temperatura di incubazione (37 °C) e tempo (30 giorni = 720 h), velocità dell'agitatore (20 giri/min), lunghezza d'onda di rivelazione OD (600 nm) e lunghezza d'onda di eccitazione ed emissione della rivelazione di fluorescenza.
3. Generazione di goccioline
- Raccolta ed elaborazione di campioni di microbiota intestinale umano
- Prepara un vaso da notte e contenitori per le feci, lavati le mani e indossa i guanti per raccogliere campioni di feci fresche.
NOTA: Quando si raccolgono campioni di feci, evitare il più possibile la contaminazione delle urine. È meglio urinare in anticipo e mettere le feci in un contenitore pulito e asciutto. - Raccogliere asetticamente la quantità appropriata di feci del segmento medio e sigillarla in crioviali sterilizzati (circa 3-5 g per fiala). Mettere immediatamente le fiale sul ghiaccio per la successiva aliquotazione ed etichettatura.
NOTA: Se il campione di feci è grande o non può essere raccolto immediatamente, deve essere raccolto entro 2 ore al massimo. - Nel banco anaerobico, utilizzare un tampone sterile o uno strumento di campionamento delle feci per raccogliere un campione del segmento intermedio.
NOTA: Lo strato superficiale delle feci contiene cellule della mucosa intestinale perse ed è soggetto a contaminazione esterna; dopo l'esposizione all'aria, parte del DNA microbico inizia a degradarsi. - Trasferire i campioni di feci raccolti in provette sterili da microcentrifuga da 2 ml o crioviali sterili, ciascuna contenente 0,5-2,0 g di feci. Preparare due aliquote per il congelamento per campione.
- Risospendere il campione di feci fresche in soluzione fisiologica sterile, con ogni 100 mg di feci diluite in 1 mL di soluzione. Mescola accuratamente le feci fino a quando non sono visibili particelle di grandi dimensioni.
- Dopo la sedimentazione naturale per 10 minuti, filtrare in sequenza il surnatante attraverso filtri a rete sterili con pori di 200 mesh (0,075 mm), 400 mesh (0,038 mm) e 800 mesh (0,018 mm) per rimuovere il cibo non digerito e il particolato più piccolo. Infine, raccogliere il filtrato in provette da centrifuga sterili.
- Prelevare 10 μl della sospensione fecale filtrata e determinare la concentrazione microbica utilizzando un emocitometro e un microscopio a fluorescenza invertita.
NOTA: Dopo aver filtrato il surnatante del campione fecale attraverso maglie di diverse dimensioni, rimangono alcune particelle fecali più piccole. Pertanto, quando si determina la concentrazione microbica, le particelle attive osservate al microscopio sono considerate microrganismi, il che consente solo un calcolo approssimativo della concentrazione microbica. - Trasferire la sospensione fecale in una provetta da centrifuga sterile da 1,5 ml ed etichettarla con la data, la concentrazione microbica e il nome del campione. Riservarne un po' per esperimenti successivi e conservare il resto a 4 °C come uso futuro.
NOTA: Registrare tempestivamente le informazioni sul campione (nome del campione, tempo di raccolta) per garantire che i campioni vengano raccolti contemporaneamente (considerando i cambiamenti del ritmo temporale microbico intestinale dei mammiferi). L'intera raccolta e l'elaborazione del campione devono essere effettuate in un ambiente anaerobico.
- Prepara un vaso da notte e contenitori per le feci, lavati le mani e indossa i guanti per raccogliere campioni di feci fresche.
- Preparazione per la sospensione fecale iniziale
- Preparare il terreno Brain Heart Broth (BHI) secondo il protocollo del produttore e sterilizzarlo in autoclave a 121 °C per 15 min.
- Prelevare la sospensione fecale dal passaggio 3.1.8 ed eseguire diluizioni seriali con terreno BHI per ottenere una concentrazione di ~50 cellule/mL.
NOTA: Per riempire il flacone del campione, preparare almeno 40 ml di sospensione fecale. - Assicurandosi che una piccola barra di agitazione magnetica si trovi sul fondo, versare la sospensione fecale diluita nel flacone del campione fino alla posizione di aggiunta del campione. Avvitare il tappo e serrarlo. Quindi, inserire il connettore rapido A nel connettore rapido B per completare il processo di caricamento del campione (Figura 3A).
- Posizionare il flacone del campione nella posizione designata e separare i connettori rapidi A e B dal flacone del campione. Collegare il connettore rapido A del flacone del campione alla porta O3 del sistema Omics e il connettore C3 del microtubo e del chip microfluidico per la generazione di goccioline al connettore rapido B. Chiudere lo sportello della camera di generazione e coltivazione delle goccioline (Figura 3B).
- Generazione di goccioline
- Selezionare il numero desiderato di tubi per gocce da generare sull'interfaccia principale del software (Figura 2A).
NOTA: Ogni ciclo può produrre fino a 10 tubi per goccioline, con ogni tubo che genera circa 5.000 goccioline. - Fare clic su Produci nell'interfaccia principale del software per avviare la generazione di goccioline a cella singola.
NOTA: Verificare se lo scarico della pompa del liquido di scarico funziona o meno. Durante la generazione di goccioline, ogni gocciolina ha un volume di 2,0 μl. Vedere la sezione di discussione per una descrizione della generazione di goccioline. - Attendere che il segnale acustico indichi che la generazione delle goccioline è terminata. Chiudere il morsetto sul connettore C3 (Figura 1E) e rimuovere il flacone del campione.
- Selezionare il numero desiderato di tubi per gocce da generare sull'interfaccia principale del software (Figura 2A).
4. Coltivazione di goccioline
- Seleziona lo stesso numero di tubo per goccioline come durante la generazione di goccioline nell'interfaccia principale del software, fai clic su Cultura, conferma il tempo e la temperatura di coltivazione e inizia il processo. Monitora la barra di avanzamento sull'interfaccia principale che mostra l'avanzamento della coltivazione e il tempo rimanente.
- Attendere che il segnale acustico indichi che la coltivazione delle goccioline è terminata. Se il tempo di coltivazione deve essere prolungato, regolare il tempo direttamente sull'interfaccia di impostazione .
5. Screening delle goccioline
- Premere il pulsante UV sul sistema Omics per accendere la luce ultravioletta (UV) (Figura 1A), irradiare la camera di rilevamento e raccolta delle goccioline per 30 minuti, quindi spegnere la luce UV.
NOTA: Prima di accendere la luce UV, assicurarsi che lo sportello della camera di rilevamento e raccolta delle goccioline sia chiuso. - In un banco super pulito, aprire tutte le piastre da 96 pozzetti utilizzate per raccogliere le goccioline e impilarle l'una sull'altra senza coperchi, numerandole in sequenza dal basso verso l'alto. Assicurarsi che la piastra del pozzetto superiore sia coperta con un coperchio.
NOTA: Ogni ciclo può ospitare fino a dieci piastre da 96 pozzetti e il numero di piastre dipende dal numero totale di goccioline. - Aprire lo sportello della camera di rilevamento e raccolta delle gocce, posizionare le piastre dei pozzetti nelle posizioni designate (Figura 1D), estrarre il coperchio dalla piastra del pozzetto superiore e chiudere lo sportello della camera.
- Accendere la luce UV sul sistema Omics per 30 minuti per eseguire la sterilizzazione secondaria.
- Installazione del dispositivo di rimozione delle bolle d'aria
- Rimuovere il dispositivo di rimozione delle bolle d'aria dalla sua posizione di posizionamento, svitare il tappo e rimuovere la vite a forma di farfalla dal tappo (Figura 3C).
- Versare 200 ml di olio per la rimozione delle bolle d'aria nel dispositivo di rimozione delle bolle d'aria, avvitare saldamente il flacone con il tappo del dispositivo di rimozione delle bolle d'aria sul sistema Omics, quindi fissare il dispositivo di rimozione capovolto sulla posizione del dispositivo di rimozione delle bolle d'aria. L'installazione del dispositivo di rimozione delle bolle d'aria è completa.
NOTA: Quando si fissa il dispositivo di rimozione delle bolle d'aria sulla posizione, assicurarsi che non fuoriesca olio. In caso di perdite, serrare il coperchio.
- Selezionare il tubo delle gocce per l'ordinamento nell'interfaccia principale , fare clic su Ordinamento, inserire il numero di piastre a pozzetti da raccogliere, quindi avviare il processo. Dopo l'inizio dello screening delle goccioline, osservare l'area di visualizzazione del processo, che mostra le misurazioni in tempo reale della densità ottica delle goccioline (OD) o dei valori di fluorescenza.
- Analizzare circa 20-30 goccioline per controllare il valore OD. Ad esempio, se la maggior parte di essi ha un valore OD di ~0,2, che corrisponde al valore OD delle goccioline vuote, in base alla distribuzione di Poisson, impostare la soglia OD inferiore su 0,5 e la soglia OD superiore su 4,0. Le goccioline all'interno di questo intervallo verranno raccolte automaticamente in piastre a 96 pozzetti (Figura 4A).
NOTA: Secondo la legge di Beer-Lambert, il valore OD delle goccioline vuote è determinato dalla composizione del terreno di coltura all'interno delle goccioline. In genere, la soglia OD inferiore è impostata 0,2-0,3 unità in più rispetto al valore OD delle goccioline vuote per garantire una chiara distinzione tra goccioline vuote e goccioline contenenti microrganismi. - Attendere che il segnale acustico indichi che lo screening e la raccolta delle goccioline sono terminati. Aprire lo sportello della camera di rilevamento e raccolta delle goccioline, posizionare il coperchio della piastra del pozzetto sulla piastra del pozzetto superiore, quindi estrarre tutte le piastre del pozzetto dalla camera insieme per eseguire il successivo sequenziamento e backup.
6. Esportazione dei dati e visualizzazione delle mappe di calore
- Fare clic su Esporta dati per salvare i dati del segnale delle goccioline raccolti (Figura 4A, B).
- Fare clic su Mappa termica, selezionare il file di dati di raccolta delle goccioline e osservare i valori OD delle goccioline raccolte nella micropiastra visualizzate dal software. Visualizzare questi valori di OD come una mappa di calore, in cui l'intensità del colore corrisponde alla distribuzione OD tra i pozzetti, fornendo una rappresentazione chiara e intuitiva dei valori di OD monoclonali raccolti (Figura 4A, C).
7. Pulizia della cella MISS
- Dopo aver completato l'esperimento, selezionare il tubo delle gocce da pulire e fare clic su Pulisci per avviare la pulizia dello strumento.
8. Backup monoclonale microbico e preparazione del campione di sequenziamento
- Preparazione del campione di sequenziamento
- Nel banco anaerobico, aggiungere 100 μl di terreno BHI a ciascun pozzetto della piastra di goccioline raccolta, mescolare bene mediante pipettaggio, quindi prelevare 10 μl da ciascun pozzetto e trasferire il tutto in una provetta sterile da 15 mL. Vortex per ottenere una sospensione microbica mista.
- Aggiungere 5 mL di soluzione salina tamponata con fosfato alla sospensione microbica mista, centrifugare a 1.000 × g per 10 minuti, rimuovere il surnatante e immergere il pellet microbico in azoto liquido per un rapido congelamento. La preparazione del campione di sequenziamento è completa.
- Utilizzare metodi di sequenziamento dell'amplicone dell'rDNA 16S mirati al dominio V3 e V4 dell'rDNA 16S. I primer di sequenziamento specifici utilizzati sono i seguenti: 341F: ACTCCTACGGGAGGCAGCA e 806R: GGACTACHVGGGTWTCTAAT.
- Crioconservazione del campione monoclonale microbico:
- Dopo aver raccolto 10 μl di campione da ciascun pozzetto nelle piastre di goccioline (dal passaggio 8.1.1), aggiungere 30 μl di glicerolo a ciascun pozzetto. Posizionare le piastre a una temperatura inferiore a -80 °C per la conservazione del ceppo microbico.
Risultati
Si stima che il microbiota intestinale umano, che costituisce la comunità microbica predominante, ospiti circa 4 × 1013 microrganismi nell'intestino, mostrando il suo vasto numero e la sua complessa composizione11. In questo studio, abbiamo mirato a isolare e coltivare il microbiota intestinale e abbiamo utilizzato il metodo della piastra solida come controllo per dimostrare le prestazioni ad alto rendimento della cellula MISS.
In primo luogo, abbiamo utilizzato la stessa sospensione fecale per confrontare il rendimento di isolamento di singole cellule di entrambi i metodi. Nella cella MISS, abbiamo utilizzato basse concentrazioni microbiche, dove la probabilità di distribuzione dei microrganismi nelle goccioline poteva essere calcolata in base alla distribuzione di Poisson: P(λ,x) = λx e-λ/x!, dove λ è il numero medio di cellule sulle goccioline, che può essere calcolato moltiplicando la concentrazione microbica e il volume delle goccioline; x è il numero di cellule incapsulate nelle goccioline. Qui, abbiamo utilizzato una concentrazione microbica iniziale di = 0,1 (la concentrazione microbica iniziale è di 50 cellule/mL e il volume delle goccioline è di 2,0 μL), indicando che la probabilità che si verifichino goccioline vuote, goccioline di singole cellule e goccioline multicellulari è rispettivamente del 90,5% (x = 0), 9,1% (x = 1) e 0,4% (x ≥ 2).
Nel sistema Omics, abbiamo generato circa 30.000 goccioline a una velocità di 5.000 goccioline/h e le abbiamo coltivate in sei provette di politetrafluoroetilene (O.D. 1,67 mm, I.D. 1,07 mm) per 30 giorni. Infine, abbiamo esaminato le goccioline attraverso il modulo di rilevamento utilizzando la modalità di rilevamento OD per raccogliere goccioline contenenti batteri in piastre a 96 pozzetti e abbiamo ottenuto 1.057 ceppi monoclonali target. Al contrario, attraverso il metodo di coltura su piastra solida, la concentrazione della piastra di agar solido era di 3,0 ×10 3 cellule/mL con un totale di dieci piastre di Petri da 100 mm (ciascuna piastra con 100 μL della sospensione microbica iniziale). Dopo 30 giorni di coltivazione, sono state raccolte 536 colonie dai piatti. Il sistema Omics ha prodotto 1,97 volte più cloni monoclonali rispetto al metodo su piastra solida. Ciò ha indicato che la coltivazione monoclonale a singola cellula in goccioline microfluidiche può isolare efficacemente i microrganismi eliminando l'inibizione competitiva tra le colonie.
Successivamente, abbiamo eseguito l'analisi del sequenziamento 16S su tutti i ceppi monoclonali e confrontato la diversità di specie ottenuta dai due metodi sopra menzionati. In termini di diversità delle specie a livello familiare, le stesse 34 famiglie potrebbero essere arricchite attraverso entrambi i metodi. In particolare, il sistema Omics ha ulteriormente arricchito quattro famiglie: Bacteroidales non classificate, Bacillales Thermoactinomycetaceae, Burkholderiales Comamonadaceae ed Enterobacterales non classificate (Figura 5B) e ha facilmente arricchito la minore abbondanza di Clostridiales Family_XI, Clostridiales Acidaminococcaceae, Desulfovibrionales Desulfovibrionaceae e Enterobacterales Enterobacteriaceae nella sospensione microbica originale (Figura 5D).
A livello di genere, 74 generi microbici potrebbero essere arricchiti con entrambi i metodi, mentre il metodo delle cellule MISS ha arricchito ulteriormente 13 generi microbici: Bacillaceae Bacillus, Bacillaceae Oceanobacillus, Bacillaceae Pseudogracilibacillus, Thermoactinomycetaceae Kroppenstedtia, Peptoniphilaceae Phocea, Clostridiaceae Anaerosalibacter, Peptoniphilaceae Ezakiella, Peptoniphilaceae W5053, XI non classificato, Clostridiaceae Clostridioides, Comamonadaceae Pelomonas e due specie microbiche non classificate (Figura 5C). Tra questi, i generi Enterococcaceae Enterococcus e Acidaminococcaceae Phascolarctobacterium, che erano in minore abbondanza nella sospensione microbica originale, sono stati facilmente arricchiti utilizzando il sistema Omics (Figura 5E). Come previsto, questi due generi appartenevano rispettivamente alla famiglia delle Enterococcaceae e delle Acidaminococcaceae , dove abbiamo osservato gli stessi risultati dall'analisi della famiglia. Nel complesso, a livello di famiglia e di genere, l'arricchimento di specie del metodo di coltura cellulare MISS è aumentato rispettivamente del 30,6% e del 37,9% rispetto al metodo di coltura su piastra solida. Questi risultati hanno mostrato che il metodo di coltura cellulare MISS ha fornito migliori condizioni di crescita per quei ceppi che erano presenti in basse proporzioni o avevano scarse prestazioni di crescita nella sospensione microbica originale.

Figura 1: Struttura e componenti essenziali della cellula MISS. (Un) Esterno della cella MISS. 1. Camera di generazione e coltivazione delle goccioline, 2. Camera di rilevamento e raccolta goccioline, 3. Pulsanti di illuminazione e UV della camera di raccolta delle gocce. (B) Interno della camera di generazione e coltivazione delle goccioline. In questa camera vengono effettuate la generazione delle goccioline, l'incubazione delle goccioline e la rimozione delle bolle d'aria per lo screening delle goccioline. 4. Camera di coltivazione delle goccioline, 5. Valvole di serraggio per il serraggio di tubi in silicone dal chip microfluidico per la generazione di microtubi e goccioline; Le valvole di serraggio sono numerate in sequenza da 1 a 10, da sinistra a destra, 6. Posizionamento del dispositivo di rimozione delle bolle d'aria, 7. Porte per la generazione e la vagliatura delle goccioline (O1-O4): la fase olio, campione e gas sono collegate alla cella MISS attraverso queste porte. 8. Porta di scarico (OF), 9. Valvola di bloccaggio per il bloccaggio del tubo di uscita delle gocce del dispositivo di rimozione delle bolle d'aria, 10. L'apertura che conduce alla camera di rilevamento e raccolta delle goccioline, 11. Posizionamento della bottiglia del campione; C'è un agitatore magnetico sotto il posizionamento, che può essere utilizzato per controllare la velocità di agitazione del campione.(C) Vista dall'alto della camera di coltivazione delle goccioline. All'interno della camera è presente una porta di ingresso dell'acqua per un umidificatore. Una siringa viene utilizzata per aggiungere 10 ml di acqua distillata sterile, il coperchio protettivo e il microtubo e il chip microfluidico per la generazione di goccioline sono installati e i tubi in silicone del microtubo sono fissati alle corrispondenti valvole a morsetto, come mostrato nella figura a destra. 12. Una porta di ingresso dell'acqua per l'umidificatore nella camera di coltivazione delle goccioline, 13. Il chip microfluidico per la generazione di microtubi e goccioline. (D) Interno della camera di rilevamento e raccolta delle goccioline. L'immagine a sinistra mostra tre posizionamenti della piastra del pozzetto e il braccio robotico di movimentazione che sposta la piastra del pozzetto tra i posizionamenti. L'immagine a destra mostra la vista ingrandita del modulo di rilevamento e raccolta delle gocce (rettangolo rosso nell'immagine a sinistra). Posizionamento di 96 piastre a pozzetti 14. prima, 15. durante, e 16. dopo la raccolta delle goccioline. 17. 96 Braccio robotico per la movimentazione di piastre a pozzetti. Durante il rilevamento e la raccolta delle goccioline, il braccio robotico sposta una piastra da 96 pozzetti verso la posizione della piastra a pozzetti vicino al modulo di rilevamento delle gocce. Al termine della raccolta delle gocce, la piastra a pozzetti viene spostata in un'altra posizione e la stessa operazione viene continuata fino al completamento del processo. 18. Modulo di rilevamento e raccolta delle goccioline. 19. Il supporto della fibra per la fibra di rilevamento. Esistono due fibre di rilevamento (rilevamento basato su OD e rilevamento basato sulla fluorescenza). Quando viene utilizzata una fibra di rilevamento, l'altra viene inserita nel supporto della fibra. 20. Il tubo di rilevamento. Questo tubo è già collegato al tubo di uscita delle goccioline del dispositivo di rimozione delle bolle d'aria. 21. La fibra di rivelazione basata sul OD e la fibra di rilevamento basata sulla fluorescenza; Le fibre di rilevamento sono etichettate con i rispettivi nomi. 22. La fibra ottica della sorgente luminosa. 23. La presa di rilevamento in cui è inserito il tubo di rilevamento. 24. La vite di fissaggio della fibra per fissare la fibra di rilevamento. 25. La vite che fissa il tubo di rilevamento. Serrare correttamente la vite dopo aver inserito correttamente il tubo di rilevamento nel foro di rilevamento. 26. La porta del liquido di scarto. 27. Tubo di scarico per lo scarico delle goccioline al di fuori del segnale di raccolta. (E) Installazione del microtubo, del chip microfluidico per la generazione di goccioline e del dispositivo di rimozione delle bolle d'aria nella posizione corrispondente. I quattro tubi (C1, C2, C4 e CF) sono collegati rispettivamente alle porte corrispondenti della cella MISS. (O1, O2, O4 e OF). 28. La copertura protettiva per il micro-tubo e il chip microfluidico per la generazione di goccioline. 29. Il dispositivo di rimozione delle bolle d'aria. 30. Il tubo di ingresso delle goccioline al dispositivo di rimozione delle bolle d'aria. 31. Il tubo di uscita delle gocce dal dispositivo di rimozione delle bolle d'aria. 32. Valvola di serraggio sul connettore C3. Abbreviazioni: MISS = Sistema Omico di Coltura a Singola Cellula Microlitro-Goccioline; OD = densità ottica. Clicca qui per visualizzare una versione più grande di questa figura.
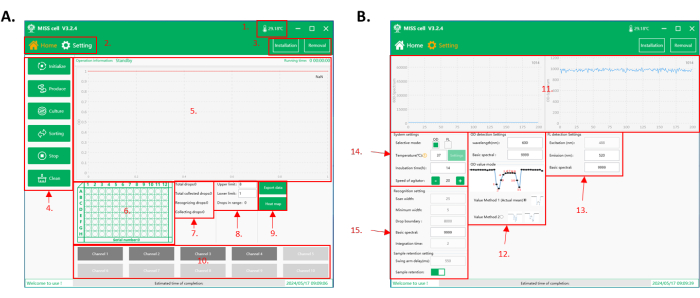
Figura 2: Interfaccia del software operativo della cella MISS. (A) L'interfaccia principale del software. 1. Temperatura nella camera di funzionamento. 2. Interfaccia delle funzioni. Ci sono due interfacce per funzionare: l'interfaccia domestica e l'interfaccia di impostazione dei parametri. 3. Pulsanti di installazione e rimozione di chip microfluidici per la generazione di microtubi e goccioline. 4. Selezione delle funzioni: ci sono sei funzioni tra cui scegliere: Inizializza, Produci, Cultura, Smistamento, Arresto e Pulizia. 5. Area di visualizzazione del processo: in quest'area vengono visualizzate le informazioni sull'operazione, il tempo di funzionamento e i dati delle goccioline raccolte. 6. Area di visualizzazione della piastra a 96 pozzetti: visualizzazione in tempo reale del numero corrente della piastra di raccolta e della posizione del pozzetto di raccolta delle goccioline. 7. Area di visualizzazione dei dati di rilevamento e raccolta delle goccioline. 8. Smistamento, impostazione del limite superiore e inferiore e area di visualizzazione del conteggio delle gocce. L'intervallo della gocciolina raccolta viene impostato in base al segnale della gocciolina (OD/intensità fluorescente). Il sistema di celle MISS conta il numero totale di goccioline raccolte. 9. Pulsanti per l'esportazione dei dati di raccolta e la visualizzazione delle mappe di calore delle lastre. 10. Area del tubo delle goccioline. Selezionare il numero di tubi da utilizzare per la generazione di goccioline, la coltivazione delle goccioline, la vagliatura delle goccioline e la pulizia. (B) L'interfaccia di impostazione dei parametri del software. 11. Visualizzazione in tempo reale dei valori spettrali rilevati durante lo smistamento delle gocce (OD/intensità fluorescente). 12. Parametri di configurazione del rilevamento OD, inclusa la lunghezza d'onda di rilevamento, il valore spettrale di base e la modalità OD. Esistono due modalità OD: valore medio efficace (metodo del valore 1), che calcola il valore medio del valore spettrale della gocciolina; e il valore minimo (metodo del valore 2), che prende come segnale il valore minimo del valore spettrale della gocciolina. 13. Parametri di configurazione del rilevamento della fluorescenza, tra cui eccitazione (configurazione del dispositivo), lunghezza d'onda di emissione (350-800 nm) e valore spettrale di base. 14. Parametri di configurazione del sistema, inclusa la selezione della modalità di rilevamento (OD/intensità fluorescente), la temperatura di incubazione, il tempo di incubazione e la velocità di agitazione del campione nel flacone del reagente. 15. Parametri per l'identificazione delle goccioline e le impostazioni di raccolta del campione. Abbreviazioni: MISS = Sistema Omico di Coltura a Singola Cellula Microlitro-Goccioline; OD = densità ottica. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Installazione del flacone del campione e del dispositivo di rimozione delle bolle d'aria. (A) Il flacone del campione della cella MISS. La sospensione microbica viene aggiunta al flacone del campione fino alla posizione di aggiunta del campione. Il coperchio viene serrato immediatamente e i connettori rapidi A e B collegati. Infine, il flacone del campione viene posizionato nel posizionamento del flacone del campione sulla cella MISS. (B) L'installazione del flacone del campione. I connettori rapidi A e B sono collegati alla porta O3 sulla cella MISS e al connettore C3 rispettivamente dal micro-tubo e dal chip microfluidico per la generazione di gocce. (C) L'installazione del dispositivo di rimozione delle bolle d'aria. Quando si installa il dispositivo di rimozione delle bolle d'aria, la vite a forma di farfalla viene rimossa dal coperchio prima di installare il flacone contenente l'olio per la rimozione delle bolle d'aria. Abbreviazione: MISS = Sistema Omico di Coltura a Singola Cellula Microliter-droplet Fare clic qui per visualizzare una versione più grande di questa figura.
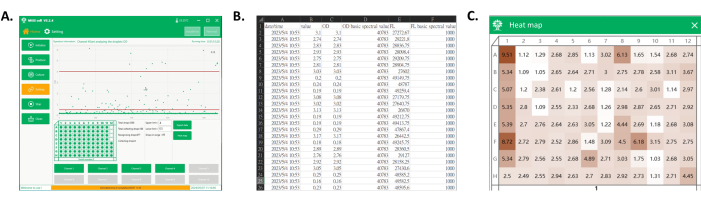
Figura 4: Esportazione dei dati e mappa di calore della piastra a pozzetti raccolta. (A) L'interfaccia principale del software durante il rilevamento e la raccolta delle goccioline. Nell'area di visualizzazione del processo, viene visualizzato ogni segnale di gocciolina e le goccioline nell'intervallo desiderato vengono raccolte nella piastra a pozzetti. (B) Screenshot di parte dei dati esportati. I dati esportati includono il segnale spettrale delle goccioline raccolte (colonne C ed E) e i loro tempi di rilevamento (colonna A). (C) Screenshot della mappa di calore della piastra. Sulla base dei segnali provenienti dalle goccioline raccolte, i valori vengono normalizzati per ottenere una heatmap della piastra, che potrebbe essere utilizzata in seguito per differenziare le prestazioni di coltura dei ceppi monoclonali di ciascun clone in base al colore. Clicca qui per visualizzare una versione più grande di questa figura.
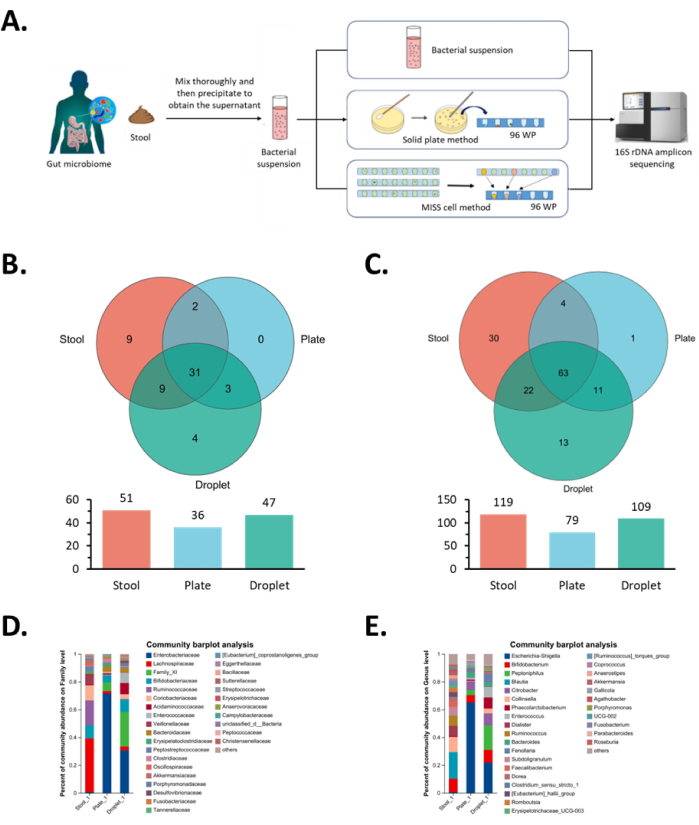
Figura 5: Risultati dell'isolamento monoclonale e della coltivazione di microrganismi intestinali nella cellula MISS. (A) Diagramma del flusso di lavoro per l'isolamento, la coltivazione e l'identificazione del microbiota intestinale. La sospensione microbica iniziale, il metodo della piastra solida e il metodo delle cellule MISS vengono utilizzati per isolare e coltivare lo stesso microbiota intestinale seguito dall'analisi di sequenziamento. (B,D) Analisi a livello familiare di colonie monoclonali ottenute dall'isolamento e dalla coltivazione di microbiota intestinale, dove B mostra l'analisi del diagramma di Venn e D mostra l'analisi della composizione della comunità. (C,E) Analisi a livello di genere di colonie monoclonali ottenute dall'isolamento e dalla coltivazione di microbiota intestinale, dove C mostra l'analisi del diagramma di Venn ed E mostra l'analisi della composizione della comunità. Abbreviazione: MISS = Sistema Omico di Coltura a Singola Cellula Microlitro-Goccioline. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo delinea il funzionamento della cellula MISS per l'isolamento, la coltivazione, il rilevamento e la raccolta monoclonale microbico automatizzati e ad alto rendimento. Rispetto ai metodi tradizionali con i quali solo il ~20%-30% del microbiota intestinale poteva essere isolato e coltivato 2,12, il numero di cloni monoclonali ottenuti utilizzando il sistema Omics era 1,97 volte superiore a quelli ottenuti da piastre solide. Questo confronto rivela che la cellula MISS presenta vantaggi nell'isolamento di singole cellule, nella coltura monoclonale e nello screening.
Per l'isolamento di singole cellule, il sistema Omics ha ottenuto goccioline di singole cellule secondo la distribuzione di Poisson, che ha garantito una buona monoclonalità. Inoltre, il sistema Omics ha generato goccioline a una velocità fino a 5.000 goccioline/h, consentendo l'isolamento di singole cellule ad alta produttività e riducendo significativamente il consumo di reagenti grazie alle dimensioni ridotte delle goccioline. Durante la generazione delle goccioline, è stato utilizzato un canale di focalizzazione del flusso sul microtubo. Il sistema Omics utilizza la pompa di iniezione per spingere la fase oleosa, la soluzione campione e il gas nel canale di focalizzazione del flusso e formare goccioline. Gli utenti possono osservare se le goccioline vengono generate correttamente attraverso il canale o guardando direttamente il tubo delle goccioline. I tubi in silicone del micro-tubo e il chip microfluidico per la generazione di goccioline sono collegati all'estremità dei 10 tubi a goccioline. Quando viene generato un numero sufficiente di goccioline in un tubo a goccia (~5.000 goccioline), la valvola di bloccaggio blocca automaticamente i tubi in silicone del tubo e continua a generare la gocciolina nel tubo successivo.
Per la coltivazione del ceppo monoclonale, i microrganismi nelle goccioline hanno beneficiato di eccellenti prestazioni di scambio gassoso, di un'elevata coltivazione parallela e di un efficiente trasferimento di massa, fornendo condizioni di crescita ottimali per ceppi a bassa abbondanza o difficili da coltivare. Per lo screening dei ceppi monoclonali, il sistema Omics ha supportato la fluorescenza e la rilevazione della biomassa basata sull'OD, grazie alla quale il rilevamento potrebbe essere basato sulle prestazioni di crescita microbica e sul livello di espressione di un gene o di una proteina specifica di interesse13. Inoltre, il sistema Omics ha impiegato la deposizione di goccioline indotta dalla gravità nelle piastre dei pozzetti. Combinando questo metodo di screening passivo con un braccio oscillante, ha ottenuto uno screening delle goccioline stabile e altamente accurato, rendendola una piattaforma di screening bio-friendly. Inoltre, il sistema Omics ha ottenuto un processo completamente automatizzato dall'isolamento di un singolo microrganismo allo screening clonale finale, riducendo i costi di manodopera e tempo.
Date le prestazioni del sistema Omics, potrebbe essere utilizzato per la culturromica microbica e lo screening della mutagenesi microbica, nonché per altre applicazioni come la selezione di ceppi ad alta produzione e l'estrazione di geni funzionali chiave6. Per ottenere risultati sperimentali accurati, i ricercatori possono ottimizzare le condizioni sperimentali in base alle specie da isolare, coltivare e sottoporre a screening. In primo luogo, la generazione di goccioline a singola cellula nel sistema Omics segue la distribuzione di Poisson, dove un basso valore λ assicura che le goccioline generate siano prevalentemente vuote o goccioline a singola cellula. Nel nostro lavoro precedente, abbiamo convalidato l'intervallo di concentrazione microbica ottimale per la generazione di goccioline di singole cellule nel sistema Omics in 16,8-69,7 cellule/mL (λ = 0,035-0,145)6. Quando si preparano le sospensioni dei campioni, è fondamentale diluire all'interno di questo intervallo di concentrazione per migliorare l'accuratezza della monoclonalità. In secondo luogo, prima di utilizzare il sistema Omics, è necessario ottimizzare le condizioni di crescita microbica. In base al fabbisogno di ossigeno del microrganismo, i ricercatori possono scegliere l'azoto o l'ossigeno come fase gassosa per la generazione di goccioline. In terzo luogo, durante il rilevamento delle goccioline, l'assorbanza o la fluorescenza è determinata dall'intensità della luce ricevuta dopo aver illuminato le goccioline. Di conseguenza, i valori numerici ottenuti dallo stesso campione potrebbero differire tra la rilevazione delle goccioline e la misurazione dello spettrofotometro a causa delle differenze nello spessore del campione, come osservato nel nostro precedente lavoro14. Pertanto, si consiglia di stabilire una curva di calibrazione per i campioni sperimentali prima di condurre gli esperimenti.
Inoltre, stiamo anche migliorando le prestazioni del sistema Omics per l'applicazione di altre specie come le cellule di mammifero, compresa la biocompatibilità della fase oleosa con le cellule (ad esempio, l'olio fluorurato ha una maggiore solubilità in gas ed è più adatto per la coltura cellulare di mammiferi15,16), l'effetto della velocità di flusso bifase sulla forza di taglio cellulare17, 18,19 e l'ottimizzazione della dimensione delle gocce13,20. Questi miglioramenti possono facilitare in modo significativo l'uso del sistema Omics nella ricerca biomedica, come lo sviluppo di linee cellulari, lo screening di anticorpi a cellule B singole e la scoperta di anticorpi per ibridomi. Sulla base dei tre moduli operativi principali del sistema Omics: generazione, coltivazione e screening delle gocce, i ricercatori possono scegliere i moduli adatti in base alle esigenze dell'esperimento. Inoltre, il modulo di iniezione e divisione delle gocce può essere aggiunto al sistema qui descritto per eseguire l'aggiunta di reagenti o creare librerie di deformazione.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Questo studio è stato supportato dai progetti di ricerca e sviluppo in aree chiave della provincia del Guangdong (2024B1111130002), dai progetti di ricerca e sviluppo della provincia di Hebei (22375503D) e dal progetto di apertura del laboratorio di ingegneria di Anhui per l'allevamento molecolare di microbiologia industriale (sovvenzione ELMB-07).
Materiali
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Merck KGaA, Darmstadt, Germany | P5731-500EA | For solid plate preparation |
| 30 mL Stool Containers | Boen Healthcare Co., Ltd | 611101 | For collecting the stool samples |
| 37 °C constant temperature incubator | Shanghai Yiheng Technology Co., Ltd. | LRH-150 | Cultivate the solid plate in the incubator |
| 96-well Clear Flat Bottom Polystyrene TC-treated Microplates | Corning | 3599 | For well plate movement detection and droplet collection |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| Air bubble removal oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S-oil | The oil in the air bubble remover during droplet screening |
| Air bubble remover | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S | Exclude the gas phase between droplets before performing droplet detection and collection |
| Anaerobic bench | Argon and Nitrogen Space Equipment Business Department, Haiyu Town, Changshu City | VGB-4CM | For aseptic operation and UV sterilization under anaerobic condition |
| Autoclave | Puhexi Health and Medical Equipment Co., Ltd. | MLS-830L | For autoclaving BHI medium, EP tube, and so on. |
| Brain Heart Infusion (BHI) Broth | Qingdao High-tech Industrial Park Haibo Biotechnology Co., Ltd | HB8297-1 | Components of the BHI medium The ingredient list: 38.5 g/L BHI Broth in distilled water |
| Cell Spreader | Merck KGaA, Darmstadt, Germany | HS8151 | Inoculate the microbial solution onto the solid plate |
| Centrifuge tube, 15 mL | Beijing Xinhengyan Technology Co., Ltd | HB53397 | For microbial solution preparation |
| Computer | Lenovo | E450 | Software installation and MISS cell control |
| Cryovial | Thermo Fisher | 2.0 mL | For stool preservation |
| Distilled water | Beijing Mreda Technology Co., Ltd. | M306444-100ml | Add into humidifier to keep the humidity in droplet cultivation chamber |
| EP tube | Thermo Fisher | 2.0 mL | For collecting the stool samples |
| Fluorescent inverted microscope | Olympus Life Science (LS) | CKX53 | Check and calculate the microbial concentration |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| Hemocytometer | Acmec | AYA0810-1ea | Calculate the microbial concentration |
| KCl | Ambeed | A442876 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| KH2PO4 | MACKLIN | P815661 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| Mesh filter | Anping Jiufeng Wire Mesh Manufacturing Co., Ltd | 200 mesh (0.075 mm), 400 mesh (0.038 mm), 800 mesh (0.018 mm) | Remove undigested food and smaller particulate matter from the stool samples |
| Micro-tubing and droplet generation microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISC-B2 | For droplet generation and droplet incubation |
| MISS cell oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-BOS-B | The oil phase for droplet microfluidics |
| MISS cell software | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell V3.2.4 | Perform experimental operations on the MISS cell instrument |
| Na2HPO4 | Solarbio | D7292 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| NaCl | GENERAL-REAGENT | G81793J | Components of the physiological saline solution The ingredient list: 9 g/L NaCl in distilled water |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Polytetrafluoroethylene tube | Shenzhen WOER Heat-shrinkable Material Co., Ltd. | 3401000141 | For droplet incubation. This material was already included in micro-tubing and droplet generation microfluidic chip |
| Sample bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-bottle | Sampling of microbial solution |
| Single Cell Microliter-droplet Culture Omics System (MISS cell) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-G3f | Performing the microbial monoclonal isolation, cultivation, detection and collection |
| Superspeed Centrifuge | Thermo Fisher | Sorvall Lynx 4000 | Prepare the microbial solution for sequencing |
| Syringe | Jiangsu Zhiyu Medical Instructment Co., Ltd | 10 mL | Draw the distilled water and inject it into the humidifier in droplet cultivation chamber |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
Riferimenti
- Hahn, M. W., Koll, U., Schmidt, J., Hurst, C. J. Isolation and cultivation of bacteria. The structure and function of aquatic microbial communities. , 313-351 (2019).
- Xu, M. Q., Pan, F., Peng, L. H., Yang, Y. S. Advances in the isolation, cultivation, and identification of gut microbes. Mil Med Res. 11 (1), 34 (2024).
- Lattermann, C., Büchs, J. Microscale and miniscale fermentation and screening. Curr Opin Biotechnol. 35, 1-6 (2015).
- Huang, Y., et al. High-throughput microbial culturomics using automation and machine learning. Nat Biotechnol. 41 (10), 1424-1433 (2023).
- Brehm-Stecher Byron, F., Johnson Eric, A. Single-cell microbiology: Tools, technologies, and applications. Microbiol Mol Biol Rev. 68 (3), 538-559 (2004).
- Jian, X., et al. Single-cell microliter-droplet screening system (miss cell): An integrated platform for automated high-throughput microbial monoclonal cultivation and picking. Biotechnol Bioeng. 120 (3), 778-792 (2023).
- Hu, B., et al. One cell at a time: Droplet-based microbial cultivation, screening and sequencing. Mar Life Sci Technol. 3 (2), 169-188 (2021).
- Leygeber, M., et al. Analyzing microbial population heterogeneity-expanding the toolbox of microfluidic single-cell cultivations. J Mol Biol. 431 (23), 4569-4588 (2019).
- He, Z., Wu, H., Yan, X., Liu, W. Recent advances in droplet microfluidics for microbiology. Chinese Chemical Letters. 33 (4), 1729-1742 (2022).
- Kaminski, T. S., Garstecki, P. Controlled droplet microfluidic systems for multistep chemical and biological assays. Chem Soc Rev. 46 (20), 6210-6226 (2017).
- Sender, R., Fuchs, S., Milo, R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell. 164 (3), 337-340 (2016).
- Simrén, M., et al. Intestinal microbiota in functional bowel disorders: A rome foundation report. Gut. 62 (1), 159-176 (2013).
- Periyannan Rajeswari, P. K., Joensson, H. N., Andersson-Svahn, H. Droplet size influences division of mammalian cell factories in droplet microfluidic cultivation. Electrophoresis. 38 (2), 305-310 (2017).
- Jian, X., et al. Microbial microdroplet culture system (mmc): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnol Bioeng. 117 (6), 1724-1737 (2020).
- Baret, J. -. C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Kubie, L. S. The solubility of O2, CO2, and N2 in mineral oil and the transfer of carbon dioxide from oil to air. J Biol Chem. 72 (2), 545-548 (1927).
- Poon, C. Measuring the density and viscosity of culture media for optimized computational fluid dynamics analysis of in vitro devices. J Mech Behav Biomed Mater. 126, 105024 (2022).
- Yao, J., Lin, F., Kim, H. S., Park, J. The effect of oil viscosity on droplet generation rate and droplet size in a t-junction microfluidic droplet generator. Micromachines. 10 (12), 808 (2019).
- Venkateshwarlu, A., Bharti, R. P. Effects of capillary number and flow rates on the hydrodynamics of droplet generation in two-phase cross-flow microfluidic systems. Journal of the Taiwan Institute of Chemical Engineers. 129, 64-79 (2021).
- Nekouei, M., Vanapalli, S. A. Volume-of-fluid simulations in microfluidic t-junction devices: Influence of viscosity ratio on droplet size. Physics of Fluids. 29, 032007 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Tutti i diritti riservati
Utilizziamo i cookies per migliorare la tua esperienza sul nostro sito web.
Continuando a utilizzare il nostro sito web o cliccando “Continua”, accetti l'utilizzo dei cookies.