Method Article
Cultivo y selección monoclonales microbianos automatizados y de alto rendimiento mediante el sistema ómico de cultivo de gotas de microlitros de una sola célula
En este artículo
Resumen
Este protocolo describe cómo utilizar el sistema ómico de cultivo de gotas de microlitros de una sola célula (célula MISS) para realizar el aislamiento, el cultivo y la recolección monoclonales microbianos. La célula MISS logra un flujo de trabajo integrado basado en la tecnología microfluídica de gotas, que ofrece una excelente monodispersidad de gotas, un cultivo paralelo alto y una detección de biomasa de alto rendimiento.
Resumen
Los cultivos bacterianos puros son esenciales para el estudio de la culturomica microbiana. Los métodos tradicionales basados en placas sólidas, placas de pocillos y microrreactores se ven obstaculizados por procedimientos engorrosos y bajo rendimiento, lo que impide el rápido progreso de la investigación en culturomica microbiana. Para abordar estos desafíos, habíamos desarrollado con éxito el sistema ómico de cultivo de gotas de microlitros de una sola célula (MISS cell), una plataforma automatizada de alto rendimiento que utiliza la tecnología microfluídica de gotas para el aislamiento, el cultivo y el cribado monoclonales microbianos. Este sistema puede generar una gran cantidad de gotas unicelulares y cultivar, seleccionar y recolectar colonias monoclonales en poco tiempo, lo que facilita un proceso integrado desde el aislamiento microbiano hasta la recolección. En este protocolo, demostramos su aplicación utilizando como ejemplo el aislamiento y el cultivo de microbiota intestinal humana y comparamos la eficiencia del aislamiento microbiano, el rendimiento del cultivo monoclonal y el rendimiento del cribado mediante el método de cultivo en placa sólida. El flujo de trabajo experimental fue sencillo y el consumo de reactivos fue muy bajo. En comparación con los métodos de cultivo en placa sólida, la célula MISS podría cultivar una mayor diversidad de especies de microbiota intestinal, lo que ofrece un gran potencial y valor para la investigación en cultivo microbiano.
Introducción
La culturomica microbiana tiene amplias aplicaciones en la investigación de microbios beneficiosos en la industria alimentaria, la diversidad de microbios ambientales, la detección de nuevos compuestos antimicrobianos y el microbioma humano en relación con enfermedades 1,2,3,4. Los métodos tradicionales, basados principalmente en placas sólidas, placas de pocillos o microrreactores para obtener y seleccionar colonias monoclonales, son fáciles de operar, pero sufren de un bajo rendimiento debido a sus múltiples pasos. Esta limitación dificulta aplicaciones como el cribado de mutagénesis microbiana, los estudios de culturomica microbiana y la selección de colonias de alta producción, todo lo cual requiere un cribado monoclonal extenso.
Recientemente, se han diseñado varios dispositivos de detección y dispensación de una sola célula para mejorar significativamente la velocidad de procesamiento de muestras microbianas, al tiempo que se reduce la mano de obra y se minimizan los errores de manipulación manual5. Sin embargo, estos instrumentos generalmente abordan solo pasos específicos dentro de los métodos tradicionales, a menudo requieren una amplia integración de equipos, ocupan un espacio significativo e incurren en altos costos. Por lo tanto, existía una necesidad apremiante de desarrollar una plataforma de cribado y cultivo microbiano de bajo costo y aplicación universal para compensar las deficiencias mencionadas anteriormente.
En nuestro trabajo anterior, desarrollamos con éxito una plataforma de cribado automatizada y de alto rendimiento, conocida como Single-cell Microliter-droplet Culture Omics System (MISS cell, en lo sucesivo denominado "el sistema Omics")6. Esta plataforma utiliza la tecnología microfluídica de gotas, que promete lograr la automatización y la integración en el aislamiento, el cultivo y la recolección microbiana 7,8,9,10. El sistema Omics consta de varios módulos clave, incluido un módulo de muestreo, un chip microfluídico, un sistema de detección y recolección de gotas, lo que permite el aislamiento, el cultivo, el cribado monoclonal y la recolección eficientes en la investigación microbiológica. Ya hemos utilizado el sistema Omics para lograr el cribado de mutagénesis de alto rendimiento de Corynebacterium glutamicum6.
Debido a la automatización y las capacidades de cribado de alto rendimiento del sistema Ómicas, se espera que su aplicación a la culturomica microbiana obtenga rápidamente una gran cantidad de datos microbianos. En este protocolo, presentamos el procedimiento operativo detallado de la célula MISS, con el aislamiento y cultivo de la microbiota intestinal humana como ejemplo para demostrar el proceso de aislamiento, cultivo, detección monoclonal y cribado microbiano de una sola célula. El funcionamiento del sistema Omics es sencillo, y los investigadores sólo tienen que seguir las instrucciones del software para la instalación secuencial de los microtubos y el chip microfluídico de generación de gotas, la configuración de los parámetros y la preparación de las muestras.
En la interfaz de operación del software, el sistema Omics se divide en tres funciones principales: aislamiento, cultivo y cribado. Los investigadores pueden seleccionar diferentes etapas de acuerdo con el experimento. Además, durante la etapa de detección de gotas, los investigadores pueden elegir entre dos modos de detección: señal fluorescente o densidad óptica. El software proporciona visualización en tiempo real del proceso de cribado de gotas. Por último, los investigadores tienen la flexibilidad de configurar parámetros como las condiciones de cultivo, la longitud de onda detectada y el número de pozos de recolección en función de sus demandas experimentales específicas, y pueden pausar el instrumento en cualquier momento para realizar otras operaciones. La célula MISS es una plataforma de cribado monoclonal de alto rendimiento y respetuosa con los microbios, con un funcionamiento sencillo y un consumo mínimo de reactivos.
Protocolo
Todos los procedimientos del estudio cumplen con todas las normas éticas pertinentes. Los procedimientos fueron aprobados por el Comité de Ética Científica y Tecnológica de la Universidad de Tsinghua. Para el estudio de la microbiota intestinal humana, se recogieron muestras de heces de un adulto sano sin afecciones médicas significativas, que dio su consentimiento informado por escrito.
1. Instalación del instrumento
- Coloque el instrumento del sistema Omics en un entorno limpio o estéril (como una sala estéril o un banco anaeróbico). El instrumento es un dispositivo de precisión, y al colocarlo en la instalación, tenga en cuenta lo siguiente:
- Mantenga el instrumento bajo presión y temperatura normales.
- Mantenga el instrumento alejado de campos eléctricos fuertes, campos magnéticos y fuentes de radiación de calor.
- Asegúrese de que el área de colocación del instrumento supere las dimensiones de 2.500 mm (D) x 1.500 mm (W) x 2.000 mm (H).
- Mantenga la humedad ambiental del instrumento por debajo del 60%.
2. Preparativos
- Encienda secuencialmente el sistema Ómica, el equipo y el software operativo del sistema Ómica.
- Instalación de microtubos de microtubos y generación de gotas de celdas MISS:
- Abra la puerta de la cámara de generación y cultivo de gotas (Figura 1A) y retire verticalmente la cubierta protectora del microtubo y el chip microfluídico de generación de gotas. Utilice una jeringa desechable para agregar 10 ml de agua destilada estéril al humidificador dentro de la cámara de cultivo de gotas (Figura 1C) y vuelva a instalar la cubierta protectora para el microtubo y el chip microfluídico de generación de gotas.
- Abra el embalaje estéril del microtubo y el chip microfluídico de generación de gotas y colóquelo verticalmente directamente sobre la cámara de cultivo (Figura 1C).
- En la interfaz del software, haga clic en Instalación (Figura 2A). En este punto, aparece una ventana emergente con el mensaje, ¿Confirmar el reemplazo del microtubo y el chip microfluídico de generación de gotas? Haga clic en Sí para iniciar la instalación.
- Saque el removedor de burbujas de aire y fíjelo boca abajo en la colocación del removedor de burbujas de aire en la cámara de generación y cultivo de gotas. Tenga cuidado de no presionar los tubos de entrada y salida de gotas del removedor de burbujas de aire (Figura 1E).
- Conecte el tubo de salida de gotas del removedor de burbujas de aire a la válvula de sujeción debajo de él y déjelo pasar a través del orificio, que se dirige a la cámara de detección y recolección de gotas (Figura 1B).
- Abra la puerta de la cámara de detección y recolección de gotas, inserte verticalmente el tubo de detección, ya conectado al tubo de salida de gotas, en el zócalo de detección y asegúrese de que el tubo de detección esté completamente insertado (Figura 1D).
NOTA: Al insertar el tubo de detección, insértelo verticalmente sin curvas en el tubo. - Apriete el tornillo que sujeta el tubo de detección en el sentido de las agujas del reloj. Después de confirmar que el tubo de detección está completamente insertado y asegurado, cierre la puerta de la cámara de detección y recolección de gotas.
- Del chip microfluídico de microtubos y generación de gotas, hay 10 tubos de silicona, cada uno etiquetado con un número (L01-L10). Conecte cada tubo etiquetado a la válvula de abrazadera numerada correspondiente (01-10) (Figura 1C).
- Conecte el conector rápido del chip microfluídico de microtubos y generación de gotas al puerto correspondiente del sistema Ómicas: C1 a O1, C2 a O2, C4 a O4 y CF a OF.
NOTA: La instalación del microtubo y el chip microfluídico de generación de gotas está completa. No es necesario conectar C3 a O3. - Una vez completada la instalación del chip microfluídico de generación de microtubos y microtubos, aparece una ventana emergente que indica que se abre la válvula de sujeción de tubos de gotas. Haga clic en Aceptar cuando se complete la instalación del chip microfluídico de generación de microtubos y gotas. Después de asegurarse de que todos los tubos de silicona del microtubo y el chip microfluídico de generación de gotas estén conectados a la válvula de abrazadera correspondiente, haga clic en Aceptar.
- Inicialización del instrumento
- Antes de realizar la inicialización, haga clic en la interfaz de configuración (Figura 2B) para configurar los parámetros relevantes: modo de detección (detección basada en OD o fluorescencia; OD aquí), temperatura de incubación (37 °C) y tiempo (30 días = 720 h), velocidad del agitador (20 rpm), la longitud de onda de la detección de OD (600 nm) y la longitud de onda de excitación y emisión de la detección de fluorescencia.
NOTA: Los parámetros utilizados para el aislamiento y el cultivo de la microbiota intestinal humana en este protocolo figuran entre paréntesis. Al configurar los parámetros, la temperatura de cultivo debe estar entre 5 °C y 50 °C. Al seleccionar el modo de detección, se debe reemplazar la fibra óptica si la fibra en el módulo de detección de gotas no es la misma (consulte el paso 2.3.2). Al configurar los parámetros, el software identifica automáticamente el valor de referencia de la fase oleosa (espectral básico), lo que elimina la necesidad de ajustes manuales. - La sustitución de la fibra óptica detectada
- Retire la fibra detectada del soporte de fibra (desenrosque en sentido contrario a las agujas del reloj) y afloje el tornillo de fijación de fibra en el módulo de gotas (Figura 1D).
- Si no se va a utilizar la fibra óptica, retírela del módulo, insértela en el soporte de fibra y apriételo. Inserte la fibra detectada en el puerto de detección y apriete el tornillo de fijación de fibra en el módulo. Se ha finalizado el reemplazo de la fibra óptica.
- Diríjase a la interfaz de inicio y haga clic en Inicializar para permitir que el sistema Omics realice una autocomprobación de sus componentes, incluida la bomba de inyección, los ajustes de temperatura, las pruebas de descarga de líquidos residuales, el módulo de cribado y el módulo de detección de gotas.
- Durante la inicialización, realice una prueba de descarga de líquido residual desde el módulo de detección de gotas inyectando 1 ml de alcohol al 75% en el puerto de líquido residual y observando si el líquido fluye normalmente.
- Para la prueba del módulo de detección, coloque una placa de 96 pocillos en la colocación de la placa y observe si el movimiento de la placa es normal.
- Antes de realizar la inicialización, haga clic en la interfaz de configuración (Figura 2B) para configurar los parámetros relevantes: modo de detección (detección basada en OD o fluorescencia; OD aquí), temperatura de incubación (37 °C) y tiempo (30 días = 720 h), velocidad del agitador (20 rpm), la longitud de onda de la detección de OD (600 nm) y la longitud de onda de excitación y emisión de la detección de fluorescencia.
3. Generación de gotas
- Recogida y tratamiento de muestras de microbiota intestinal humana
- Prepare una olla de cámara y recipientes para heces, lávese las manos y use guantes para recolectar muestras de heces frescas.
NOTA: Al recolectar muestras de heces, evite la contaminación de la orina tanto como sea posible. Es mejor orinar antes y colocar las heces en un recipiente limpio y seco. - Recoja asépticamente la cantidad adecuada de heces del segmento medio y séllela en crioviales esterilizados (aproximadamente 3-5 g por vial). Coloque los viales en hielo inmediatamente para su posterior alícuota y etiquetado.
NOTA: Si la muestra de heces es grande o no se puede recoger inmediatamente, debe recogerse en un plazo máximo de 2 horas. - En el banco anaeróbico, use un hisopo estéril o una herramienta de muestreo de heces para recolectar una muestra de segmento medio.
NOTA: La capa superficial de las heces contiene células de la mucosa intestinal desprendidas y es propensa a la contaminación externa; después de la exposición al aire, parte del ADN microbiano comienza a degradarse. - Transfiera las muestras de heces recolectadas a tubos de microcentrífuga estériles de 2 ml o crioviales estériles, con cada tubo conteniendo 0,5-2,0 g de heces. Prepare dos alícuotas para congelar por muestra.
- Vuelva a suspender la muestra de heces frescas en una solución salina fisiológica estéril, con cada 100 mg de heces diluidas en 1 ml de solución. Mezcle bien las heces hasta que no se vean partículas grandes.
- Después de la sedimentación natural durante 10 minutos, filtre secuencialmente el sobrenadante a través de filtros de malla estériles con tamaños de poro de malla 200 (0,075 mm), malla 400 (0,038 mm) y malla 800 (0,018 mm) para eliminar los alimentos no digeridos y las partículas más pequeñas. Finalmente, recoja el filtrado en tubos de centrífuga estériles.
- Tome 10 μL de la suspensión fecal filtrada y determine la concentración microbiana utilizando un hemocitómetro y un microscopio de fluorescencia invertida.
NOTA: Después de filtrar el sobrenadante de la muestra fecal a través de diferentes tamaños de malla, quedan algunas partículas fecales más pequeñas. Por lo tanto, a la hora de determinar la concentración microbiana, las partículas activas observadas bajo el microscopio se consideran microorganismos, lo que solo permite un cálculo aproximado de la concentración microbiana. - Transfiera la suspensión fecal a un tubo de centrífuga estéril de 1,5 ml y etiquételo con la fecha, la concentración microbiana y el nombre de la muestra. Reserve algunos para experimentos posteriores y almacene el resto a 4 °C para uso futuro.
NOTA: Registre de inmediato la información de la muestra (nombre de la muestra, hora de recolección) para garantizar que las muestras se recolecten al mismo tiempo (teniendo en cuenta los cambios en el ritmo temporal microbiano intestinal de los mamíferos). Toda la recolección y el procesamiento de la muestra deben llevarse a cabo en un entorno anaeróbico.
- Prepare una olla de cámara y recipientes para heces, lávese las manos y use guantes para recolectar muestras de heces frescas.
- Preparación para la suspensión fecal inicial
- Prepare el medio Brain Heart Calth (BHI) según el protocolo del fabricante y esterilícelo esterilizándolo en autoclave a 121 °C durante 15 min.
- Tome la suspensión fecal del paso 3.1.8 y realice diluciones en serie con medio BHI para lograr una concentración de ~50 células/mL.
NOTA: Para llenar el frasco de muestra, prepare al menos 40 mL de suspensión fecal. - Asegurándose de que haya una pequeña barra de agitación magnética en la parte inferior, vierta la suspensión fecal diluida en el frasco de muestra hasta la posición de adición de la muestra. Enrosca la tapa y apriétala. A continuación, inserte el conector rápido A en el conector rápido B para completar el proceso de carga de muestras (Figura 3A).
- Coloque el frasco de muestra en la posición designada y separe los conectores rápidos A y B del frasco de muestra. Conecte el conector rápido A de la botella de muestra al puerto O3 del sistema Omics, y el conector C3 del microtubo y el chip microfluídico de generación de gotas se conecte al conector rápido B. Cierre la puerta de la cámara de generación y cultivo de gotas (Figura 3B).
- Generación de gotas
- Seleccione el número deseado de tubos de gotas que se generarán en la interfaz de inicio del software (Figura 2A).
NOTA: Cada tramo puede producir hasta 10 tubos de gotas, y cada tubo genera aproximadamente 5.000 gotas. - Haga clic en Producir en la interfaz de inicio del software para iniciar la generación de gotas de una sola celda.
NOTA: Confirme si la bomba de descarga de líquido residual está funcionando o no. Durante la generación de gotas, cada gota tiene un volumen de 2,0 μL. Consulte la sección de discusión para obtener una descripción de la generación de gotas. - Espere a que la alarma sonora indique que la generación de gotas ha finalizado. Cierre la abrazadera del conector C3 (Figura 1E) y retire el frasco de muestra.
- Seleccione el número deseado de tubos de gotas que se generarán en la interfaz de inicio del software (Figura 2A).
4. Cultivo de gotas
- Seleccione el mismo número de tubo de gota que durante la generación de gotas en la interfaz de inicio del software, haga clic en Cultivo, confirme el tiempo y la temperatura de cultivo y comience el proceso. Monitoree la barra de progreso en la interfaz de inicio que muestra el progreso del cultivo y el tiempo restante.
- Espere a que la alarma sonora indique que el cultivo de gotas ha terminado. Si es necesario ampliar el tiempo de cultivo, ajuste el tiempo directamente en la interfaz de configuración .
5. Cribado de gotitas
- Presione el botón UV en el sistema Omics para encender la luz ultravioleta (UV) (Figura 1A), irradiar la cámara de detección y recolección de gotas durante 30 minutos y luego apague la luz UV.
NOTA: Antes de encender la luz ultravioleta, asegúrese de que la puerta de la cámara de detección y recolección de gotas esté cerrada. - En un banco súper limpio, abra todas las placas de 96 pocillos que se usan para recolectar gotas y apílelas una encima de la otra sin tapas, numerándolas secuencialmente de abajo hacia arriba. Asegúrese de que la placa del pocillo superior esté cubierta con una tapa.
NOTA: Cada tramo puede acomodar hasta diez placas de 96 pocillos, y el número de placas depende del número total de gotas. - Abra la puerta de la cámara de detección y recolección de gotas, coloque las placas de pocillos en las posiciones designadas (Figura 1D), saque la tapa de la placa de pocillo superior y cierre la puerta de la cámara.
- Encienda la luz ultravioleta del sistema Omics durante 30 minutos para realizar una esterilización secundaria.
- Instalación del removedor de burbujas de aire
- Retire el removedor de burbujas de aire de su posición de colocación, desenrosque la tapa y retire el tornillo en forma de mariposa de la tapa (Figura 3C).
- Vierta 200 ml de aceite para eliminar burbujas de aire en el removedor de burbujas de aire, enrosque bien la botella con la tapa del removedor de burbujas de aire en el sistema Omics y luego fije el removedor boca abajo en la ubicación del removedor de burbujas de aire. La instalación del removedor de burbujas de aire está completa.
NOTA: Al fijar el removedor de burbujas de aire en la colocación, asegúrese de que no haya fugas de aceite. Si se produce alguna fuga, apriete la tapa.
- Seleccione el tubo de gotas para clasificar en la interfaz de inicio , haga clic en Clasificación, ingrese el número de placas de pocillos que se recolectarán y luego inicie el proceso. Después de que comience el cribado de gotas, observe el área de visualización del proceso, que muestra mediciones en tiempo real de la densidad óptica (OD) de gotas o los valores de fluorescencia.
- Analice aproximadamente 20-30 gotas para verificar el valor de OD. Por ejemplo, si se encuentra que la mayoría tiene un valor OD de ~0,2, que corresponde al valor OD de las gotas vacías, según la distribución de Poisson, establezca el umbral OD inferior en 0,5 y el umbral OD superior en 4,0. Las gotas dentro de este rango se recogerán automáticamente en placas de 96 pocillos (Figura 4A).
NOTA: De acuerdo con la Ley de Beer-Lambert, el valor OD de las gotas vacías está determinado por la composición del medio de cultivo dentro de las gotas. Por lo general, el umbral de DO inferior se establece entre 0,2 y 0,3 unidades más alto que el valor de DO de las gotas vacías para garantizar una distinción clara entre las gotas vacías y las gotas que contienen microorganismos. - Espere a que suene la alarma para indicar que el cribado y la recolección de gotas han finalizado. Abra la puerta de la cámara de detección y recolección de gotas, coloque la tapa de la placa de pocillos en la placa de pocillo superior y, a continuación, saque todas las placas de pocillos de la cámara juntas para realizar la secuenciación y la copia de seguridad posteriores.
6. Exportación de datos y visualización de mapas de calor
- Haga clic en Exportar datos para guardar los datos de señal de gota recopilados (Figura 4A,B).
- Haga clic en Mapa de calor, seleccione el archivo de datos de recolección de gotas y observe los valores de OD de las gotas recolectadas en la microplaca que muestra el software. Visualice estos valores de DO como un mapa de calor, donde la intensidad del color corresponde a la distribución de DO en los pocillos, proporcionando una representación clara e intuitiva de los valores de DO monoclonales recopilados (Figura 4A,C).
7. Limpieza de la célula MISS
- Después de completar el experimento, seleccione el tubo de gotas que requiere limpieza y haga clic en Limpiar para iniciar la limpieza del instrumento.
8. Copia de seguridad monoclonal microbiana y preparación de muestras de secuenciación
- Secuenciación de la preparación de muestras
- En el banco anaeróbico, agregue 100 μL de medio BHI a cada pocillo de la placa de gotas recolectada, mezcle bien mediante pipeteo y luego tome 10 μL de cada pocillo y transfiéralo todo a un tubo estéril de 15 mL. Vórtice para obtener una suspensión microbiana mixta.
- Agregue 5 mL de solución salina tamponada con fosfato a la suspensión microbiana mezclada, centrifugue a 1.000 × g durante 10 minutos, retire el sobrenadante y coloque la pastilla microbiana en nitrógeno líquido para una congelación rápida. La preparación de la muestra de secuenciación está completa.
- Utilice métodos de secuenciación de amplicones de ADNr 16S dirigidos al dominio V3 y V4 del ADNr 16S. Los cebadores de secuenciación específicos utilizados son los siguientes: 341F: ACTCCTACGGGAGGCAGCA y 806R: GGACTACHVGGGTWTCTAAT.
- Criopreservación de muestras monoclonales microbianas:
- Después de recoger 10 μL de la muestra de cada pocillo en las placas de gotas (del paso 8.1.1), añada 30 μL de glicerol a cada pocillo. Coloque las placas a menos de -80 °C para la conservación de la deformación microbiana.
Resultados
Se estima que la microbiota intestinal humana, que constituye la comunidad microbiana predominante, alberga aproximadamente 4 × 1013 microorganismos en el intestino, lo que demuestra su gran número y su compleja composición11. En este estudio, nos propusimos aislar y cultivar la microbiota intestinal y utilizamos el método de la placa sólida como control para demostrar el rendimiento de alto rendimiento de la célula MISS.
En primer lugar, utilizamos la misma suspensión fecal para comparar el rendimiento de aislamiento de una sola célula de ambos métodos. En la célula MISS, se utilizaron concentraciones microbianas bajas, donde la probabilidad de distribución de microorganismos en las gotas se pudo calcular en función de la distribución de Poisson: P(λ,x) = λx e-λ/x!, donde λ es el número promedio de células sobre las gotas, que se puede calcular multiplicando la concentración microbiana y el volumen de las gotas; x es el número de células encapsuladas en las gotas. Aquí, utilizamos una concentración inicial de suspensión microbiana de = 0,1 (la concentración microbiana inicial es de 50 células/mL y el volumen de gotas es de 2,0 μL), lo que indica que la probabilidad de que ocurran gotas vacías, gotas unicelulares y gotas multicelulares es del 90,5% (x = 0), 9,1% (x = 1) y 0,4% (x ≥ 2), respectivamente.
En el sistema Ómica, generamos aproximadamente 30.000 gotas a una velocidad de 5.000 gotas/h y las cultivamos en seis tubos de politetrafluoroetileno (D.O. 1,67 mm, D.I. 1,07 mm) durante 30 días. En última instancia, filtramos las gotas a través del módulo de detección utilizando el modo de detección OD para recolectar gotas que contenían bacterias en placas de 96 pocillos y obtuvimos 1.057 cepas monoclonales objetivo. Por el contrario, a través del método de cultivo en placa sólida, la concentración de la placa de agar sólida fue de 3,0 × 103 células/mL con un total de diez placas de Petri de 100 mm (cada placa con 100 μL de la suspensión microbiana inicial). Después de 30 días de cultivo, se recogieron 536 colonias de las placas. El sistema Omics produjo 1,97 veces más clones monoclonales que el método de placa sólida. Esto indicó que el cultivo monoclonal unicelular en gotas microfluídicas puede aislar eficazmente los microorganismos al tiempo que elimina la inhibición competitiva entre colonias.
A continuación, realizamos un análisis de secuenciación 16S en todas las cepas monoclonales y comparamos la diversidad de especies obtenida con los dos métodos mencionados. En cuanto a la diversidad de especies a nivel de familia, las mismas 34 familias podrían enriquecerse a través de ambos métodos. Específicamente, el sistema Ómicos enriqueció aún más cuatro familias: Bacteroidales sin clasificar, Bacillales Thermoactinomycetaceae, Burkholderiales Comamonadaceae y Enterobacterales sin clasificar (Figura 5B) y enriqueció fácilmente la menor abundancia de Clostridiales Family_XI, Clostridiales Acidaminococcaceae, Desulfovibrionales Desulfovibrionaceae y Enterobacterales Enterobacteriaceae en la suspensión microbiana original (Figura 5D).
A nivel de género, 74 géneros microbianos pudieron enriquecerse con ambos métodos, mientras que el método de células MISS enriqueció adicionalmente 13 géneros microbianos: Bacillaceae, Bacillus, Bacillaceae, Oceanobacillus, Bacillaceae, Pseudogracilibacillus, Thermoactinomycetaceae, Kroppenstedtia, Peptoniphilaceae, Phocea, Clostridiaceae, Anaerosalibacter, Peptoniphilaceae, Ezakiella, Peptoniphilaceae, W5053, XI sin clasificar, Clostridiaceae, Clostridioides, Comamonadaceae, Pelomonas, y dos especies microbianas no clasificadas (Figura 5C). Entre ellos, los géneros Enterococcaceae Enterococcus y Acidaminococcaceae Phascolarctobacterium, que se encontraban en menor abundancia en la suspensión microbiana original, se enriquecieron fácilmente utilizando el sistema Omics (Figura 5E). Como era de esperar, estos dos géneros pertenecían a la familia Enterococcaceae y Acidaminococcaceae, respectivamente, donde observamos los mismos resultados del análisis familiar. En general, a nivel de familia y género, el enriquecimiento de especies del método de cultivo celular MISS aumentó en un 30,6% y un 37,9%, respectivamente, en comparación con el método de cultivo en placa sólida. Estos resultados mostraron que el método de cultivo celular MISS proporcionó mejores condiciones de crecimiento para aquellas cepas que estaban presentes en bajas proporciones o tenían un rendimiento de crecimiento deficiente en la suspensión microbiana original.

Figura 1: Estructura y componentes esenciales de la célula MISS. (Un) Exterior de la celda MISS. 1. Cámara de generación y cultivo de gotas, 2. Cámara de detección y recolección de gotas, 3. Iluminación y botones UV de la cámara de recogida de gotas. (B) Interior de la cámara de generación y cultivo de gotas. La generación de gotas, la incubación de gotas y la eliminación de burbujas de aire para el cribado de gotas se llevan a cabo en esta cámara. 4. Cámara de cultivo de gotas, 5. Válvulas de sujeción para la sujeción de tubos de silicona del chip microfluídico de generación de microtubos y gotas; Las válvulas de apriete están numeradas secuencialmente del 1 al 10, de izquierda a derecha, 6. Colocación del removedor de burbujas de aire, 7. Puertos para la generación y el cribado de gotas (O1-O4): la fase de aceite, muestra y gas se conectan a la celda MISS a través de estos puertos. 8. Puerto de residuos (OF), 9. Válvula de apriete para sujetar el tubo de salida de gotas del removedor de burbujas de aire, 10. La abertura que conduce a la cámara de detección y recolección de gotas, 11. Colocación de la botella de muestra; Hay un agitador magnético debajo de la colocación, que se puede usar para controlar la velocidad de agitación de la muestra.(C) Vista aérea de la cámara de cultivo de gotas. Dentro de la cámara, hay un puerto de entrada de agua para un humidificador. Se utiliza una jeringa para añadir 10 mL de agua destilada estéril, se instala la cubierta protectora y el microtubo y el chip microfluídico de generación de gotas, y los tubos de silicona del microtubo se sujetan a las válvulas de pinza correspondientes, como se muestra en la figura de la derecha. 12. Un puerto de entrada de agua para el humidificador en la cámara de cultivo de gotas, 13. El chip microfluídico de microtubos y generación de gotas. (D) Interior de la cámara de detección y recogida de gotas. La imagen de la izquierda muestra tres ubicaciones de placas de pocillos y el brazo robótico de manipulación moviendo la placa de pocillos entre las ubicaciones. La imagen de la derecha muestra la vista ampliada del módulo de detección y recogida de gotas (rectángulo rojo en la imagen de la izquierda). Colocación de 96 placas de pocillos 14. antes, 15. durante, y 16. después de la recolección de gotas. 17. Brazo robótico de manejo de placa de pozo 96. Durante la detección y recolección de gotas, el brazo robótico mueve una placa de 96 pocillos a la ubicación de la placa de pocillos cerca del módulo de detección de gotas. Una vez completada la recolección de gotas, la placa de pocillo se mueve a otra ubicación y se continúa la misma operación hasta que se completa el proceso. 18. Módulo de detección y recolección de gotas. 19. El soporte de fibra para la fibra de detección. Hay dos fibras de detección (detección basada en OD y detección basada en fluorescencia). Cuando se utiliza una fibra de detección, la otra se inserta en el soporte de fibra. 20. El tubo de detección. Este tubo ya está conectado al tubo de salida de gotas del removedor de burbujas de aire. 21. La fibra de detección basada en OD y la fibra de detección basada en fluorescencia; Las fibras de detección están etiquetadas con sus respectivos nombres. 22. La fibra óptica de la fuente de luz. 23. El zócalo de detección donde se inserta el tubo de detección. 24. El tornillo de fijación de fibra para asegurar la fibra de detección. 25. El tornillo que asegura el tubo de detección. Apriete el tornillo después de insertar correctamente el tubo de detección en el orificio de detección. 26. El puerto de líquidos residuales. 27. Tubo de desagüe para la descarga de gotitas fuera de la señal de recolección. (E) Instalación del microtubo, el chip microfluídico de generación de gotas y el removedor de burbujas de aire en la ubicación correspondiente. Los cuatro tubos (C1, C2, C4 y CF) están conectados respectivamente a los puertos correspondientes de la celda MISS. (O1, O2, O4 y OF). 28. La cubierta protectora para el microtubo y el chip microfluídico de generación de gotas. 29. El removedor de burbujas de aire. 30. El tubo de entrada de gotas al removedor de burbujas de aire. 31. El tubo de salida de gotas del removedor de burbujas de aire. 32. Válvula de apriete en el conector C3. Abreviaturas: MISS = Sistema Ómico de Cultivo de Microlitros de Microlitros de una sola célula; OD = densidad óptica. Haga clic aquí para ver una versión más grande de esta figura.
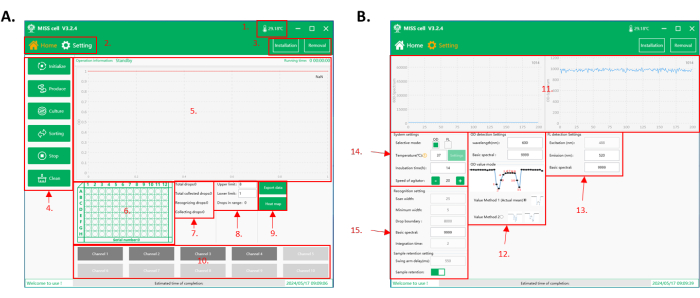
Figura 2: Interfaz del software de operación de la celda MISS. (A) La interfaz de inicio del software. 1. Temperatura en la cámara de operación. 2. Interfaz de función. Hay dos interfaces para operar: la interfaz de inicio y la interfaz de configuración de parámetros. 3. Botones de instalación y extracción de chips microfluídicos de generación de microtubos y gotas. 4. Selección de funciones: hay seis funciones para elegir: Inicializar, Producir, Cultivar, Clasificar, Detener y Limpiar. 5. Área de visualización del proceso: en esta área se muestra la información de operación, el tiempo de funcionamiento y los datos de gotas recolectados. 6. Área de visualización de la placa de 96 pocillos: visualización en tiempo real del número de placa de recolección actual y la posición del pozo de recolección de gotas. 7. Área de visualización de datos de detección y recolección de gotas. 8. Clasificación de la configuración del límite superior e inferior y del área de visualización del recuento de gotas. El rango de la gota recolectada se establece de acuerdo con la señal de la gota (OD / intensidad fluorescente). El sistema de células MISS cuenta el número total de gotas recolectadas. 9. Botones para exportar los datos de la colección y mostrar los mapas de calor de las placas. 10. Área de tubos de gotas. Seleccione el número de tubos que se utilizarán para la generación de gotas, el cultivo de gotas, el cribado de gotas y la limpieza. (B) La interfaz de configuración de parámetros del software. 11. Visualización en tiempo real de los valores espectrales detectados durante la clasificación de gotas (OD/intensidad fluorescente). 12. Parámetros de configuración de detección de OD, incluida la longitud de onda de detección, el valor espectral básico y el modo OD. Hay dos modos de OD: valor medio efectivo (método de valor 1), que calcula el valor medio del valor espectral de la gota; y el valor mínimo (método de valor 2), que toma el valor mínimo del valor espectral de la gota como señal. 13. Parámetros de configuración de detección de fluorescencia, incluida la excitación (configuración del dispositivo), la longitud de onda de emisión (350-800 nm) y el valor espectral base. 14. Parámetros de configuración del sistema, incluida la selección del modo de detección (OD / intensidad fluorescente), temperatura de incubación, tiempo de incubación y velocidad de agitación de la muestra en la botella de reactivo. 15. Parámetros para la identificación de gotas y la configuración de la recolección de muestras. Abreviaturas: MISS = Sistema Ómico de Cultivo de Microlitros de Microlitros de una sola célula; OD = densidad óptica. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Instalación del frasco de muestra y el removedor de burbujas de aire. (A) El frasco de muestra de células MISS. La suspensión microbiana se agrega al frasco de muestra a la posición de adición de muestra. La tapa se aprieta inmediatamente y se conectan los conectores rápidos A y B. Finalmente, el frasco de muestra se coloca en la ubicación del frasco de muestra en la celda MISS. (B) La instalación de la botella de muestra. Los conectores rápidos A y B se conectan al puerto O3 de la célula MISS y al conector C3 del microtubo y del chip microfluídico de generación de gotas, respectivamente. (C) La instalación del removedor de burbujas de aire. Al instalar el removedor de burbujas de aire, primero se retira el tornillo en forma de mariposa de la tapa antes de instalar la botella que contiene el aceite para eliminar burbujas de aire. Abreviatura: MISS = Sistema ómico de cultivo de microlitros de una sola célula Haga clic aquí para ver una versión más grande de esta figura.
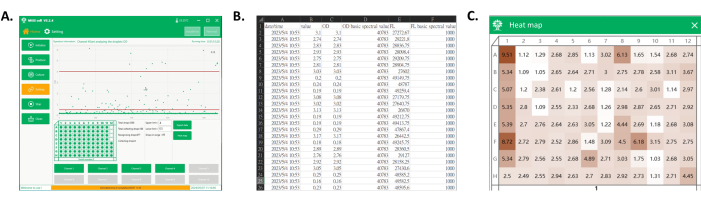
Figura 4: Exportación de datos y mapa de calor de la placa de pocillo recolectada. (A) La interfaz principal del software durante la detección y recolección de gotas. En el área de visualización del proceso, se muestra cada señal de gota y las gotas en el rango deseado se recogen en la placa del pocillo. (B) Captura de pantalla de parte de los datos exportados. Los datos exportados incluyen la señal espectral de las gotas recogidas (columnas C y E) y sus tiempos de detección (columna A). (C) Captura de pantalla del mapa de calor de la placa. A partir de las señales de las gotas recogidas, los valores se normalizan para obtener un mapa de calor de la placa, que podría utilizarse posteriormente para diferenciar el rendimiento del cultivo de las cepas monoclonales de cada clon en función del color. Haga clic aquí para ver una versión más grande de esta figura.
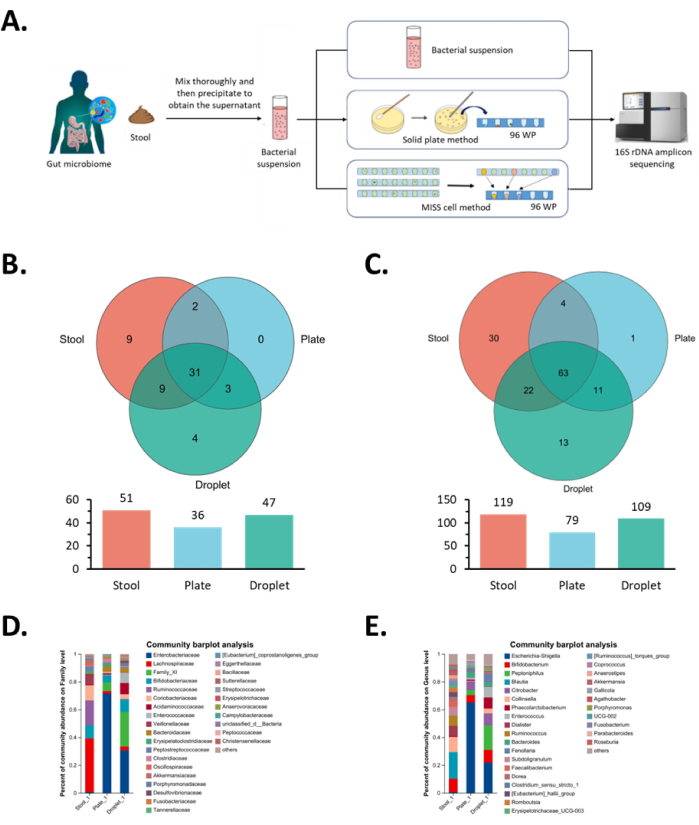
Figura 5: Resultados del aislamiento monoclonal y cultivo de microorganismos intestinales en la célula MISS. (A) Diagrama de flujo de trabajo para el aislamiento, cultivo e identificación de la microbiota intestinal. La suspensión microbiana inicial, el método de la placa sólida y el método de las células MISS se utilizan para aislar y cultivar la misma microbiota intestinal, seguidas de un análisis de secuenciación. (B,D) Análisis a nivel familiar de colonias monoclonales obtenidas a partir del aislamiento y cultivo de microbiota intestinal, donde B muestra el análisis del diagrama de Venn y D el análisis de la composición de la comunidad. (C,E) Análisis a nivel de género de colonias monoclonales obtenidas a partir del aislamiento y cultivo de microbiota intestinal, donde C muestra el análisis del diagrama de Venn y E muestra el análisis de la composición de la comunidad. Abreviatura: MISS = Sistema Ómico de Cultivo de Microlitros de Microlitros de una sola célula. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe el funcionamiento de la célula MISS para el aislamiento, el cultivo, la detección y la recolección monoclonales microbianos automatizados y de alto rendimiento. En comparación con los métodos tradicionales, en los que solo se podía aislar y cultivar ~20%-30% de la microbiota intestinal 2,12, el número de clones monoclonales obtenidos mediante el sistema Omics fue 1,97 veces superior al de los obtenidos a partir de placas sólidas. Esta comparación revela que la célula MISS tiene ventajas en el aislamiento de una sola célula, el cultivo monoclonal y el cribado.
Para el aislamiento de una sola célula, el sistema Omics obtuvo gotas de una sola célula de acuerdo con la distribución de Poisson, lo que garantizó una buena monoclonalidad. Además, el sistema Omics generó gotas a una velocidad de hasta 5.000 gotas/h, lo que permitió un aislamiento de una sola célula de alto rendimiento al tiempo que redujo significativamente el consumo de reactivos debido al pequeño tamaño de las gotas. Durante la generación de gotas, se utilizó un canal de enfoque de flujo en el microtubo. El sistema Omics utiliza la bomba de inyección para empujar la fase de aceite, la solución de muestra y el gas hacia el canal de enfoque de flujo y formar gotas. Los usuarios pueden observar si las gotas se generan con éxito a través del canal o mirando directamente el tubo de gotas. Los tubos de silicona del microtubo y el chip microfluídico de generación de gotas están conectados al extremo de los 10 tubos de gotas. Cuando se generan suficientes gotas en un tubo de gotas (~ 5,000 gotas), la válvula de sujeción sujetará automáticamente los tubos de silicona del tubo y continuará generando la gota en el siguiente tubo.
Para el cultivo de cepas monoclonales, los microorganismos de las gotas se beneficiaron de un excelente rendimiento de intercambio de gases, un alto cultivo paralelo y una transferencia de masa eficiente, lo que proporciona condiciones de crecimiento óptimas para cepas de baja abundancia o difíciles de cultivar. Para el cribado de cepas monoclonales, el sistema Omics apoyó la detección de biomasa basada en fluorescencia y OD, por lo que la detección pudo basarse en el rendimiento del crecimiento microbiano y el nivel de expresión de un gen o proteína específica de interés13. Además, el sistema Omics empleó la deposición de gotas inducida por la gravedad en placas de pocillos. Al combinar este método de cribado pasivo con un brazo oscilante, logró un cribado de gotas estable y muy preciso, lo que la convierte en una plataforma de cribado respetuosa con el medio ambiente. Además, el sistema Omics logró un proceso totalmente automatizado desde el aislamiento de un solo microorganismo hasta el cribado clonal final, lo que redujo los costos de mano de obra y tiempo.
Dado el rendimiento del sistema Ómicas, podría utilizarse para la culturiómica microbiana y el cribado de mutagénesis microbiana, así como para otras aplicaciones, como la selección de cepas de alta producción y la extracción de genes funcionales clave6. Para obtener resultados experimentales precisos, los investigadores pueden optimizar las condiciones experimentales en función de las especies que se van a aislar, cultivar y examinar. En primer lugar, la generación de gotas de una sola célula en el sistema Omics sigue la distribución de Poisson, donde un valor λ bajo garantiza que las gotas generadas sean predominantemente gotas vacías o de una sola célula. En nuestro trabajo anterior, validamos que el rango óptimo de concentración microbiana para generar gotas unicelulares en el sistema Omics es de 16,8-69,7 células/mL (λ = 0,035-0,145)6. Al preparar suspensiones de muestras, es crucial diluir dentro de este rango de concentración para mejorar la precisión de la monoclonalidad. En segundo lugar, antes de utilizar el sistema Ómicas, es necesario optimizar las condiciones de crecimiento microbiano. En función de las necesidades de oxígeno del microorganismo, los investigadores pueden elegir entre el nitrógeno o el oxígeno como fase gaseosa para la generación de gotas. En tercer lugar, durante la detección de gotas, la absorbancia o fluorescencia está determinada por la intensidad de la luz recibida después de iluminar las gotas. En consecuencia, los valores numéricos obtenidos de una misma muestra pueden diferir entre la detección de gotas y la medición con espectrofotómetro debido a las diferencias en el espesor de la muestra, como se observó en nuestro trabajo previo14. Por lo tanto, se recomienda establecer una curva de calibración para las muestras experimentales antes de realizar los experimentos.
Además, también estamos mejorando el rendimiento del sistema Omics para la aplicación de otras especies como las células de mamíferos, incluida la biocompatibilidad de la fase oleosa con las células (por ejemplo, el aceite fluorado tiene una mayor solubilidad en gases y es más adecuado para el cultivo de células de mamíferos15,16), el efecto del caudal bifásico en la fuerza de cizallamiento celular17, 18,19, y la optimización del tamaño de las gotas13,20. Estas mejoras pueden facilitar significativamente el uso del sistema Omics en la investigación biomédica, como en el desarrollo de líneas celulares, el cribado de anticuerpos de células B individuales y el descubrimiento de anticuerpos contra hibridomas. Sobre la base de los tres módulos operativos básicos del sistema Omics: generación, cultivo y cribado de gotas, los investigadores pueden elegir los módulos adecuados de acuerdo con las demandas del experimento. Además, el módulo de inyección y división de gotas se puede agregar al sistema descrito en este documento para realizar la adición de reactivos o establecer bibliotecas de cepas.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este estudio fue apoyado por los proyectos de Investigación y Desarrollo en áreas clave de la provincia de Guangdong (2024B1111130002), los proyectos de Investigación y Desarrollo de la provincia de Hebei (22375503D) y el Proyecto de Apertura del Laboratorio de Ingeniería de Anhui para el Mejoramiento Molecular de Microbiología Industrial (Subvención ELMB-07).
Materiales
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Merck KGaA, Darmstadt, Germany | P5731-500EA | For solid plate preparation |
| 30 mL Stool Containers | Boen Healthcare Co., Ltd | 611101 | For collecting the stool samples |
| 37 °C constant temperature incubator | Shanghai Yiheng Technology Co., Ltd. | LRH-150 | Cultivate the solid plate in the incubator |
| 96-well Clear Flat Bottom Polystyrene TC-treated Microplates | Corning | 3599 | For well plate movement detection and droplet collection |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| Air bubble removal oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S-oil | The oil in the air bubble remover during droplet screening |
| Air bubble remover | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S | Exclude the gas phase between droplets before performing droplet detection and collection |
| Anaerobic bench | Argon and Nitrogen Space Equipment Business Department, Haiyu Town, Changshu City | VGB-4CM | For aseptic operation and UV sterilization under anaerobic condition |
| Autoclave | Puhexi Health and Medical Equipment Co., Ltd. | MLS-830L | For autoclaving BHI medium, EP tube, and so on. |
| Brain Heart Infusion (BHI) Broth | Qingdao High-tech Industrial Park Haibo Biotechnology Co., Ltd | HB8297-1 | Components of the BHI medium The ingredient list: 38.5 g/L BHI Broth in distilled water |
| Cell Spreader | Merck KGaA, Darmstadt, Germany | HS8151 | Inoculate the microbial solution onto the solid plate |
| Centrifuge tube, 15 mL | Beijing Xinhengyan Technology Co., Ltd | HB53397 | For microbial solution preparation |
| Computer | Lenovo | E450 | Software installation and MISS cell control |
| Cryovial | Thermo Fisher | 2.0 mL | For stool preservation |
| Distilled water | Beijing Mreda Technology Co., Ltd. | M306444-100ml | Add into humidifier to keep the humidity in droplet cultivation chamber |
| EP tube | Thermo Fisher | 2.0 mL | For collecting the stool samples |
| Fluorescent inverted microscope | Olympus Life Science (LS) | CKX53 | Check and calculate the microbial concentration |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| Hemocytometer | Acmec | AYA0810-1ea | Calculate the microbial concentration |
| KCl | Ambeed | A442876 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| KH2PO4 | MACKLIN | P815661 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| Mesh filter | Anping Jiufeng Wire Mesh Manufacturing Co., Ltd | 200 mesh (0.075 mm), 400 mesh (0.038 mm), 800 mesh (0.018 mm) | Remove undigested food and smaller particulate matter from the stool samples |
| Micro-tubing and droplet generation microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISC-B2 | For droplet generation and droplet incubation |
| MISS cell oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-BOS-B | The oil phase for droplet microfluidics |
| MISS cell software | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell V3.2.4 | Perform experimental operations on the MISS cell instrument |
| Na2HPO4 | Solarbio | D7292 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| NaCl | GENERAL-REAGENT | G81793J | Components of the physiological saline solution The ingredient list: 9 g/L NaCl in distilled water |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Polytetrafluoroethylene tube | Shenzhen WOER Heat-shrinkable Material Co., Ltd. | 3401000141 | For droplet incubation. This material was already included in micro-tubing and droplet generation microfluidic chip |
| Sample bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-bottle | Sampling of microbial solution |
| Single Cell Microliter-droplet Culture Omics System (MISS cell) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-G3f | Performing the microbial monoclonal isolation, cultivation, detection and collection |
| Superspeed Centrifuge | Thermo Fisher | Sorvall Lynx 4000 | Prepare the microbial solution for sequencing |
| Syringe | Jiangsu Zhiyu Medical Instructment Co., Ltd | 10 mL | Draw the distilled water and inject it into the humidifier in droplet cultivation chamber |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
Referencias
- Hahn, M. W., Koll, U., Schmidt, J., Hurst, C. J. Isolation and cultivation of bacteria. The structure and function of aquatic microbial communities. , 313-351 (2019).
- Xu, M. Q., Pan, F., Peng, L. H., Yang, Y. S. Advances in the isolation, cultivation, and identification of gut microbes. Mil Med Res. 11 (1), 34 (2024).
- Lattermann, C., Büchs, J. Microscale and miniscale fermentation and screening. Curr Opin Biotechnol. 35, 1-6 (2015).
- Huang, Y., et al. High-throughput microbial culturomics using automation and machine learning. Nat Biotechnol. 41 (10), 1424-1433 (2023).
- Brehm-Stecher Byron, F., Johnson Eric, A. Single-cell microbiology: Tools, technologies, and applications. Microbiol Mol Biol Rev. 68 (3), 538-559 (2004).
- Jian, X., et al. Single-cell microliter-droplet screening system (miss cell): An integrated platform for automated high-throughput microbial monoclonal cultivation and picking. Biotechnol Bioeng. 120 (3), 778-792 (2023).
- Hu, B., et al. One cell at a time: Droplet-based microbial cultivation, screening and sequencing. Mar Life Sci Technol. 3 (2), 169-188 (2021).
- Leygeber, M., et al. Analyzing microbial population heterogeneity-expanding the toolbox of microfluidic single-cell cultivations. J Mol Biol. 431 (23), 4569-4588 (2019).
- He, Z., Wu, H., Yan, X., Liu, W. Recent advances in droplet microfluidics for microbiology. Chinese Chemical Letters. 33 (4), 1729-1742 (2022).
- Kaminski, T. S., Garstecki, P. Controlled droplet microfluidic systems for multistep chemical and biological assays. Chem Soc Rev. 46 (20), 6210-6226 (2017).
- Sender, R., Fuchs, S., Milo, R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell. 164 (3), 337-340 (2016).
- Simrén, M., et al. Intestinal microbiota in functional bowel disorders: A rome foundation report. Gut. 62 (1), 159-176 (2013).
- Periyannan Rajeswari, P. K., Joensson, H. N., Andersson-Svahn, H. Droplet size influences division of mammalian cell factories in droplet microfluidic cultivation. Electrophoresis. 38 (2), 305-310 (2017).
- Jian, X., et al. Microbial microdroplet culture system (mmc): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnol Bioeng. 117 (6), 1724-1737 (2020).
- Baret, J. -. C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Kubie, L. S. The solubility of O2, CO2, and N2 in mineral oil and the transfer of carbon dioxide from oil to air. J Biol Chem. 72 (2), 545-548 (1927).
- Poon, C. Measuring the density and viscosity of culture media for optimized computational fluid dynamics analysis of in vitro devices. J Mech Behav Biomed Mater. 126, 105024 (2022).
- Yao, J., Lin, F., Kim, H. S., Park, J. The effect of oil viscosity on droplet generation rate and droplet size in a t-junction microfluidic droplet generator. Micromachines. 10 (12), 808 (2019).
- Venkateshwarlu, A., Bharti, R. P. Effects of capillary number and flow rates on the hydrodynamics of droplet generation in two-phase cross-flow microfluidic systems. Journal of the Taiwan Institute of Chemical Engineers. 129, 64-79 (2021).
- Nekouei, M., Vanapalli, S. A. Volume-of-fluid simulations in microfluidic t-junction devices: Influence of viscosity ratio on droplet size. Physics of Fluids. 29, 032007 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados