Method Article
Automatisierte mikrobielle monoklonale Kultivierung und Ernte mit hohem Durchsatz mit dem Einzelzell-Mikroliter-Tröpfchen-Kultur-Omics-System
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt, wie das Einzelzell-Mikroliter-Tröpfchen-Kultur-Omics-System (MISS-Zelle) verwendet wird, um die mikrobielle monoklonale Isolierung, Kultivierung und Entnahme durchzuführen. Die MISS-Zelle erreicht einen integrierten Arbeitsablauf auf der Grundlage der Tröpfchen-Mikrofluidik-Technologie, die eine hervorragende Tröpfchen-Monodispersität, eine hohe parallele Kultivierung und einen Hochdurchsatz-Biomassenachweis bietet.
Zusammenfassung
Reine Bakterienkulturen sind für die Erforschung der mikrobiellen Kultur unerlässlich. Traditionelle Methoden, die auf Festplatten, Well-Platten und Mikroreaktoren basieren, werden durch umständliche Verfahren und geringen Durchsatz behindert, was den raschen Fortschritt der mikrobiellen Kulturforschung behindert. Um diesen Herausforderungen zu begegnen, haben wir erfolgreich das Einzelzell-Mikroliter-Tröpfchen-Kultur-Omics-System (MISS-Zelle) entwickelt, eine automatisierte Hochdurchsatz-Plattform, die die Tröpfchen-Mikrofluidik-Technologie für die mikrobielle monoklonale Isolierung, Kultivierung und das Screening nutzt. Dieses System ist in der Lage, eine große Anzahl einzelliger Tröpfchen zu erzeugen und monoklonale Kolonien in kurzer Zeit zu kultivieren, zu screenen und zu sammeln, was einen integrierten Prozess von der mikrobiellen Isolierung bis zur Ernte ermöglicht. In diesem Protokoll haben wir die Anwendung am Beispiel der Isolierung und Kultivierung menschlicher Darmmikrobiota demonstriert und die mikrobielle Isolationseffizienz, die Leistung monoklonaler Kulturen und den Screening-Durchsatz mit der Festplattenkulturmethode verglichen. Der experimentelle Arbeitsablauf war einfach und der Reagenzienverbrauch war sehr gering. Im Vergleich zu Festplattenkulturmethoden könnte die MISS-Zelle eine größere Vielfalt an Darmmikrobiota-Arten kultivieren, was ein erhebliches Potenzial und einen erheblichen Wert für die mikrobielle Kulturforschung bietet.
Einleitung
Die mikrobielle Culturomik hat breite Anwendungen bei der Erforschung nützlicher Mikroben in der Lebensmittelindustrie, der Vielfalt von Umweltmikroben, dem Screening auf neue antimikrobielle Verbindungen und dem menschlichen Mikrobiom in Bezug auf Krankheiten 1,2,3,4. Traditionelle Methoden, die hauptsächlich auf Festplatten, Well-Platten oder Mikroreaktoren basieren, um monoklonale Kolonien zu gewinnen und zu entnehmen, sind einfach zu bedienen, leiden aber aufgrund ihrer mehreren Schritte unter einem geringen Durchsatz. Diese Einschränkung behindert Anwendungen wie das mikrobielle Mutagenese-Screening, mikrobielle Kulturstudien und die Selektion hochproduktiver Kolonien, die alle ein umfangreiches monoklonales Screening erfordern.
In jüngster Zeit wurden verschiedene Einzelzell-Detektions- und Dosiergeräte entwickelt, um die Verarbeitungsgeschwindigkeit von mikrobiellen Proben erheblich zu verbessern und gleichzeitig den Arbeitsaufwand zu reduzieren und Fehler durch manuelle Handhabung zu minimieren5. Diese Instrumente decken jedoch in der Regel nur bestimmte Schritte innerhalb herkömmlicher Methoden ab, erfordern oft eine umfangreiche Geräteintegration, beanspruchen viel Platz und verursachen hohe Kosten. Daher bestand ein dringender Bedarf, eine kostengünstige, universell einsetzbare mikrobielle Kultur- und Screening-Plattform zu entwickeln, um die oben genannten Mängel auszugleichen.
In unserer früheren Arbeit haben wir erfolgreich eine automatisierte Hochdurchsatz-Screening-Plattform entwickelt, die als Single-cell Microliter-droplet Culture Omics System (MISS-Zelle, im Folgenden als "Omics-System" bezeichnet)6 bekannt ist. Diese Plattform nutzt die mikrofluidische Tröpfchentechnologie, die vielversprechend ist, um die Automatisierung und Integration bei der mikrobiellen Isolierung, Kultivierung und Erntezu erreichen 7,8,9,10. Das Omics-System besteht aus mehreren Schlüsselmodulen, darunter ein Probenahmemodul, ein mikrofluidischer Chip, ein Tröpfchenerkennungs- und -sammelsystem, das eine effiziente Einzelzellisolierung, Kultivierung, monoklonales Screening und Entnahme in der mikrobiologischen Forschung ermöglicht. Wir haben das Omics-System bereits eingesetzt, um ein Hochdurchsatz-Mutagenese-Screening von Corynebacterium glutamicum6 zu erreichen.
Aufgrund der Automatisierung und der Hochdurchsatz-Screening-Fähigkeiten des Omics-Systems wird erwartet, dass seine Anwendung in der mikrobiellen Kultur schnell eine große Menge an mikrobiellen Daten liefert. In diesem Protokoll haben wir das detaillierte Betriebsverfahren der MISS-Zelle vorgestellt, am Beispiel der Isolierung und Kultivierung der menschlichen Darmmikrobiota, um den Prozess der mikrobiellen Einzelzellisolierung, Kultivierung, monoklonalen Detektion und des Screenings zu demonstrieren. Die Bedienung des Omics-Systems ist einfach, und die Forscher müssen nur den Softwareanweisungen für die sequentielle Installation von Mikroschläuchen und den Mikrofluidik-Chip zur Tröpfchenerzeugung, den Parametereinstellungen und der Probenvorbereitung folgen.
In der Software-Bedienoberfläche ist das Omics-System in drei Hauptfunktionen unterteilt: Isolierung, Kultivierung und Screening. Je nach Experiment können die Forscher verschiedene Stadien auswählen. Darüber hinaus können die Forscher während der Tröpfchen-Screening-Phase zwischen zwei Detektionsmodi wählen: Fluoreszenzsignal oder optische Dichte. Die Software bietet eine Echtzeit-Visualisierung des Tröpfchensiebprozesses. Schließlich haben die Forscher die Flexibilität, Parameter wie Kulturbedingungen, detektierte Wellenlänge und die Anzahl der Sammelwellen basierend auf ihren spezifischen experimentellen Anforderungen zu konfigurieren, und sie können das Instrument jederzeit anhalten, um andere Vorgänge durchzuführen. Die MISS-Zelle ist eine mikrobenfreundliche monoklonale Screening-Plattform mit hohem Durchsatz und einfacher Bedienung und minimalem Reagenzienverbrauch.
Protokoll
Alle Studienverfahren stehen unter Einhaltung aller relevanten ethischen Vorschriften. Die Verfahren wurden von der Ethikkommission für Wissenschaft und Technologie der Tsinghua-Universität genehmigt. Zur Untersuchung der menschlichen Darmmikrobiota wurden Stuhlproben von einem gesunden Erwachsenen ohne signifikante Erkrankungen entnommen, der eine schriftliche Einverständniserklärung gab.
1. Installation des Instruments
- Platzieren Sie das Instrument des Omics-Systems in einer sauberen oder sterilen Umgebung (z. B. in einem sterilen Raum oder auf einer anaeroben Bank). Das Instrument ist ein Präzisionsgerät, und wenn Sie es in der Einrichtung aufstellen, beachten Sie Folgendes:
- Halten Sie das Gerät unter normalem Druck und normaler Temperatur.
- Halten Sie das Gerät von starken elektrischen Feldern, Magnetfeldern und Wärmestrahlungsquellen fern.
- Stellen Sie sicher, dass der Instrumentenplatzierungsbereich die Abmessungen von 2.500 mm (T) x 1.500 mm (B) x 2.000 mm (H) überschreitet.
- Halten Sie die Umgebungsfeuchtigkeit des Instruments unter 60 %.
2. Vorbereitungen
- Schalten Sie das Omics-System, den Computer und die Betriebssoftware des Omics-Systems nacheinander ein.
- Installation von Mikro-Chips für MISS-Zellen und Mikrofluidik-Chips zur Tröpfchenerzeugung:
- Öffnen Sie die Tür der Tröpfchenerzeugungs- und Kultivierungskammer (Abbildung 1A) und entfernen Sie vertikal die Schutzabdeckung für den Mikroschlauch und den Mikrofluidik-Chip zur Tröpfchenerzeugung. Geben Sie mit einer Einwegspritze 10 ml steriles destilliertes Wasser in den Befeuchter in der Tröpfchenkultivierungskammer (Abbildung 1C) und bringen Sie die Schutzabdeckung für den Mikroschlauch und den Mikrofluidik-Chip zur Tröpfchenerzeugung wieder an.
- Öffnen Sie die sterile Verpackung des Mikroschlauchs und des Mikrofluidik-Chips zur Tröpfchenerzeugung und platzieren Sie ihn vertikal direkt über der Kultivierungskammer (Abbildung 1C).
- Klicken Sie auf der Softwareoberfläche auf Installation (Abbildung 2A). An dieser Stelle erscheint ein Popup-Fenster mit der Eingabeaufforderung Bestätigen Sie den Austausch des Mikroschlauchs und des Mikrofluidik-Chips für die Tröpfchenerzeugung? Klicken Sie auf Ja , um die Installation zu starten.
- Nehmen Sie den Luftblasenentferner heraus und befestigen Sie ihn kopfüber auf dem Luftblasenentferner, der in der Tröpfchenerzeugungs- und Kultivierungskammer platziert ist. Achten Sie darauf, nicht auf die Tröpfcheneinlass- und -auslassrohre des Luftblasenentferners zu drücken (Abbildung 1E).
- Befestigen Sie das Tropfenauslassrohr des Luftblasenentferners an dem darunter liegenden Klemmventil und lassen Sie es durch das Loch passieren, das zur Tropfenerkennungs- und Auffangkammer führt (Abbildung 1B).
- Öffnen Sie die Tür der Tröpfchendetektions- und -sammelkammer, führen Sie das Detektionsröhrchen, das bereits mit dem Tröpfchenauslassrohr verbunden ist, senkrecht in die Detektionsbuchse ein, und stellen Sie sicher, dass das Detektionsröhrchen vollständig eingeführt ist (Abbildung 1D).
HINWEIS: Wenn Sie das Detektionsrohr einführen, führen Sie es vertikal ein, ohne dass es zu Biegungen am Rohr kommt. - Ziehen Sie die Schraube, mit der das Detektionsrohr befestigt ist, im Uhrzeigersinn fest. Nachdem Sie sich vergewissert haben, dass das Detektionsröhrchen vollständig eingeführt und gesichert ist, schließen Sie die Tür der Tröpfchendetektions- und Auffangkammer.
- Aus dem Mikroschlauch- und Tröpfchenerzeugungs-Mikrofluidik-Chip bestehen 10 Silikonschläuche, die jeweils mit einer Nummer (L01-L10) gekennzeichnet sind. Verbinden Sie jedes beschriftete Rohr mit dem entsprechenden nummerierten Klemmventil (01-10) (Abbildung 1C).
- Verbinden Sie den Schnellanschluss vom Mikroschlauch- und Tröpfchenerzeugungs-Mikrofluidik-Chip mit dem entsprechenden Anschluss am Omics-System: C1 auf O1, C2 auf O2, C4 auf O4 und CF auf OF.
HINWEIS: Die Installation des Mikroschlauchs und des Mikrofluidik-Chips zur Tröpfchenerzeugung ist abgeschlossen. C3 muss nicht an O3 angeschlossen werden. - Nachdem die Installation der Mikroschläuche und der Mikrofluidik-Chips zur Erzeugung von Tröpfchen abgeschlossen ist, wird ein Popup-Fenster angezeigt, in dem Sie aufgefordert werden, das Klemmventil für Tröpfchenschläuche zu öffnen. Klicken Sie auf OK , wenn die Installation des Mikroschlauchs und der Tröpfchenerzeugung des Mikrofluidik-Chips abgeschlossen ist. Nachdem Sie sichergestellt haben, dass alle Silikonschläuche aus dem Mikroschlauch- und Tröpfchenerzeugungs-Mikrofluidik-Chip an das entsprechende Klemmventil angeschlossen sind, klicken Sie auf OK.
- Initialisierung des Instruments
- Bevor Sie die Initialisierung durchführen, klicken Sie auf die Einstellungsschnittstelle (Abbildung 2B), um die relevanten Parameter zu konfigurieren: Detektionsmodus (OD-basierte oder fluoreszenzbasierte Detektion; Inkubationstemperatur (37 °C) und -zeit (30 Tage = 720 h), die Geschwindigkeit des Rührwerks (20 U/min), die Wellenlänge der OD-Detektion (600 nm) und die Anregungs- und Emissionswellenlänge der Fluoreszenzdetektion.
HINWEIS: Die Parameter, die in diesem Protokoll für die Isolierung und Kultivierung der menschlichen Darmmikrobiota verwendet werden, sind in Klammern angegeben. Bei der Einstellung der Parameter sollte die Kultivierungstemperatur zwischen 5 °C und 50 °C liegen. Bei der Auswahl des Detektionsmodus muss die optische Faser ausgetauscht werden, wenn die Faser am Tröpfchendetektionsmodul nicht identisch ist (siehe Schritt 2.3.2). Bei der Konfiguration der Parameter wird der Referenzwert der Ölphase (spektral) automatisch von der Software identifiziert, so dass keine manuellen Anpassungen erforderlich sind. - Der Austausch der erkannten optischen Faser
- Entfernen Sie die erkannte Faser aus dem Faserhalter (schrauben Sie sie gegen den Uhrzeigersinn ab) und lösen Sie die Faserbefestigungsschraube am Tröpfchenmodul (Abbildung 1D).
- Wenn die optische Faser nicht verwendet wird, entfernen Sie sie aus dem Modul, stecken Sie sie in den Faserhalter und ziehen Sie sie fest. Führen Sie die erkannte Faser in den Erkennungsanschluss ein, und ziehen Sie die Faserbefestigungsschraube am Modul fest. Der Austausch der optischen Faser ist abgeschlossen.
- Wechseln Sie zur Home-Benutzeroberfläche und klicken Sie auf Initialisieren , damit das Omics-System eine Selbstprüfung seiner Komponenten durchführen kann, einschließlich der Einspritzpumpe, der Temperatureinstellungen, der Prüfung des Abflusses von Abfallflüssigkeiten, des Screening-Moduls und des Tröpfchenerkennungsmoduls.
- Führen Sie während der Initialisierung einen Test zur Abgabe von Abfallflüssigkeiten aus dem Tröpfchenerkennungsmodul durch, indem Sie 1 ml 75 % Alkohol in den Anschluss der Abfallflüssigkeit injizieren und beobachten, ob die Flüssigkeit normal abfließt.
- Setzen Sie für den Test des Screening-Moduls eine 96-Well-Platte auf die Plattenplatzierung und beobachten Sie, ob die Plattenbewegung normal ist.
- Bevor Sie die Initialisierung durchführen, klicken Sie auf die Einstellungsschnittstelle (Abbildung 2B), um die relevanten Parameter zu konfigurieren: Detektionsmodus (OD-basierte oder fluoreszenzbasierte Detektion; Inkubationstemperatur (37 °C) und -zeit (30 Tage = 720 h), die Geschwindigkeit des Rührwerks (20 U/min), die Wellenlänge der OD-Detektion (600 nm) und die Anregungs- und Emissionswellenlänge der Fluoreszenzdetektion.
3. Tröpfchen-Erzeugung
- Entnahme und Verarbeitung von Proben der menschlichen Darmmikrobiota
- Bereiten Sie einen Nachttopf und Stuhlbehälter vor, waschen Sie sich die Hände und tragen Sie Handschuhe, um frische Stuhlproben zu sammeln.
HINWEIS: Bei der Entnahme von Stuhlproben ist eine Urinkontamination so weit wie möglich zu vermeiden. Es ist besser, vorher zu urinieren und den Stuhl in einen sauberen, trockenen Behälter zu geben. - Sammeln Sie aseptisch die entsprechende Menge des Stuhls im mittleren Segment und verschließen Sie ihn in sterilisierten Kryoröhrchen (ca. 3-5 g pro Fläschchen). Stellen Sie die Fläschchen sofort auf Eis, um sie anschließend zu aliquotieren und zu markieren.
HINWEIS: Wenn die Stuhlprobe groß ist oder nicht sofort entnommen werden kann, sollte sie innerhalb von maximal 2 h entnommen werden. - Verwenden Sie in der anaeroben Bank einen sterilen Tupfer oder ein Stuhlprobenahmewerkzeug, um eine Probe des mittleren Segments zu entnehmen.
HINWEIS: Die Oberflächenschicht des Stuhls enthält abgestoßene Darmschleimhautzellen und ist anfällig für äußere Verunreinigungen; Nach der Exposition gegenüber der Luft beginnt sich ein Teil der mikrobiellen DNA abzubauen. - Übertragen Sie die gesammelten Stuhlproben in sterile 2-ml-Mikrozentrifugenröhrchen oder sterile Kryoröhrchen, wobei jedes Röhrchen 0,5-2,0 g Stuhl enthält. Pro Probe werden zwei Aliquots für das Einfrieren vorbereitet.
- Resuspendieren Sie die frische Stuhlprobe in steriler physiologischer Kochsalzlösung, wobei jeweils 100 mg des Stuhls in 1 ml Lösung verdünnt werden. Mischen Sie den Stuhl gründlich, bis keine großen Partikel mehr zu sehen sind.
- Nach einer natürlichen Sedimentation von 10 Minuten wird der Überstand nacheinander durch sterile Maschenfilter mit Porengrößen von 200 Mesh (0,075 mm), 400 Mesh (0,038 mm) und 800 Mesh (0,018 mm) filtriert, um unverdaute Nahrung und kleinere Partikel zu entfernen. Zum Schluss sammeln Sie das Filtrat in sterilen Zentrifugenröhrchen.
- Nehmen Sie 10 μl der gefilterten Stuhlsuspension und bestimmen Sie die mikrobielle Konzentration mit einem Hämozytometer und einem inversen Fluoreszenzmikroskop.
HINWEIS: Nach dem Filtern des Überstands der Stuhlprobe durch verschiedene Maschenweiten bleiben einige kleinere Stuhlpartikel zurück. Daher werden bei der Bestimmung der mikrobiellen Konzentration aktive Partikel, die unter dem Mikroskop beobachtet werden, als Mikroorganismen betrachtet, was nur eine ungefähre Berechnung der mikrobiellen Konzentration ermöglicht. - Übertragen Sie die Stuhlsuspension in ein steriles 1,5-ml-Zentrifugenröhrchen und beschriften Sie es mit dem Datum, der mikrobiellen Konzentration und dem Namen der Probe. Bewahren Sie einen Teil für spätere Experimente auf und lagern Sie den Rest bei 4 °C für die zukünftige Verwendung.
HINWEIS: Notieren Sie umgehend die Probeninformationen (Probenname, Entnahmezeit), um sicherzustellen, dass die Proben gleichzeitig entnommen werden (unter Berücksichtigung der Veränderungen des zeitlichen Rhythmus des mikrobiellen Darms von Säugetieren). Die gesamte Probenentnahme und -verarbeitung sollte in einer anaeroben Umgebung durchgeführt werden.
- Bereiten Sie einen Nachttopf und Stuhlbehälter vor, waschen Sie sich die Hände und tragen Sie Handschuhe, um frische Stuhlproben zu sammeln.
- Vorbereitung für die erste Stuhlsuspension
- Bereiten Sie das Medium Brain Heart Broth (BHI) gemäß dem Protokoll des Herstellers vor und sterilisieren Sie es durch Autoklavieren bei 121 °C für 15 Minuten.
- Nehmen Sie die Stuhlsuspension aus Schritt 3.1.8 und führen Sie serielle Verdünnungen mit BHI-Medium durch, um eine Konzentration von ~50 Zellen/ml zu erreichen.
HINWEIS: Bereiten Sie zum Befüllen der Probenflasche mindestens 40 ml Stuhlsuspension vor. - Stellen Sie sicher, dass sich ein kleiner magnetischer Rührstab am Boden befindet, und gießen Sie die verdünnte Stuhlsuspension bis zur Position der Probenzugabe in die Probenflasche. Schrauben Sie die Kappe auf und ziehen Sie sie fest. Setzen Sie anschließend den Schnellanschluss A in den Schnellanschluss B ein, um den Ladevorgang der Probe abzuschließen (Abbildung 3A).
- Stellen Sie die Probenflasche in die vorgesehene Position und trennen Sie die Schnellanschlüsse A und B von der Probenflasche. Verbinden Sie den Schnellanschluss A der Probenflasche mit dem O3-Anschluss des Omics-Systems, und der C3-Anschluss am Mikroschlauch- und Tröpfchenerzeugungs-Mikrofluidik-Chip wird mit dem Schnellanschluss B verbunden. Schließen Sie die Tür der Tröpfchenerzeugungs- und Kultivierungskammer (Abbildung 3B).
- Tröpfchen-Erzeugung
- Wählen Sie die gewünschte Anzahl von Tröpfchenschläuchen, die auf der Startoberfläche der Software erzeugt werden sollen (Abbildung 2A).
HINWEIS: Jeder Lauf kann bis zu 10 Tröpfchenschläuche produzieren, wobei jeder Schlauch ca. 5.000 Tröpfchen erzeugt. - Klicken Sie in der Startoberfläche der Software auf Produzieren, um die Tröpfchenerzeugung mit einer einzelnen Zelle zu starten.
HINWEIS: Vergewissern Sie sich, ob die Pumpe für den Auslass der Restflüssigkeit funktioniert oder nicht. Bei der Tröpfchenerzeugung hat jedes Tröpfchen ein Volumen von 2,0 μL. Eine Beschreibung der Tröpfchengenerierung finden Sie im Diskussionsabschnitt. - Warten Sie, bis der Piepseralarm anzeigt, dass die Tröpfchengenerierung abgeschlossen ist. Schließen Sie die Klemme am C3-Anschluss (Abbildung 1E), und entfernen Sie die Probenflasche.
- Wählen Sie die gewünschte Anzahl von Tröpfchenschläuchen, die auf der Startoberfläche der Software erzeugt werden sollen (Abbildung 2A).
4. Tröpfchen-Kultivierung
- Wählen Sie auf der Startoberfläche der Software die gleiche Nummer des Tröpfchenschlauchs wie bei der Tröpfchengenerierung aus, klicken Sie auf Kultur, bestätigen Sie die Kultivierungszeit und -temperatur und starten Sie den Vorgang. Beobachte den Fortschrittsbalken auf der Home-Oberfläche , der den Fortschritt der Kultivierung und die verbleibende Zeit anzeigt.
- Warten Sie, bis der Piepser-Alarm anzeigt, dass die Tröpfchenkultivierung abgeschlossen ist. Wenn die Kultivierungszeit verlängert werden muss, stellen Sie die Zeit direkt auf der Einstellungsoberfläche ein.
5. Tröpfchen-Screening
- Drücken Sie die UV-Taste am Omics-System, um ultraviolettes (UV) Licht einzuschalten (Abbildung 1A), die Tröpfchenerkennungs- und Sammelkammer 30 Minuten lang zu bestrahlen und dann das UV-Licht auszuschalten.
HINWEIS: Stellen Sie vor dem Einschalten des UV-Lichts sicher, dass die Tür der Tröpfchenerkennungs- und Sammelkammer geschlossen ist. - Öffnen Sie in einer supersauberen Bank alle 96-Well-Platten, die zum Sammeln von Tröpfchen verwendet werden, und stapeln Sie sie ohne Deckel übereinander, wobei Sie sie fortlaufend von unten nach oben nummerieren. Stellen Sie sicher, dass die obere Vertiefungsplatte mit einem Deckel abgedeckt ist.
HINWEIS: Jeder Lauf kann bis zu zehn 96-Well-Platten aufnehmen, und die Anzahl der Platten hängt von der Gesamtzahl der Tröpfchen ab. - Öffnen Sie die Tür der Tröpfchenerkennungs- und -sammelkammer, setzen Sie die Well-Platten in die dafür vorgesehenen Positionen (Abbildung 1D), nehmen Sie den Deckel von der oberen Well-Platte heraus und schließen Sie die Tür der Kammer.
- Schalten Sie das UV-Licht am Omics-System für 30 Minuten ein, um eine Sekundärsterilisation durchzuführen.
- Installation des Luftblasenentferners
- Entfernen Sie den Luftblasenentferner aus seiner Position, schrauben Sie die Kappe ab und entfernen Sie die schmetterlingsförmige Schraube von der Kappe (Abbildung 3C).
- Gießen Sie 200 ml des Luftblasenentfernungsöls in den Luftblasenentferner, schrauben Sie die Flasche fest mit der Kappe des Luftblasenentferners auf dem Omics-System und befestigen Sie den Entferner dann kopfüber auf der Platzierung des Luftblasenentferners. Die Installation des Luftblasenentferners ist abgeschlossen.
HINWEIS: Achten Sie beim Befestigen des Luftblasenentferners an der Stelle darauf, dass kein Öl austritt. Wenn ein Leck auftritt, ziehen Sie den Deckel fest.
- Wählen Sie den Tröpfchenschlauch für die Sortierung auf der Home-Oberfläche aus, klicken Sie auf Sortierung, geben Sie die Anzahl der zu sammelnden Well-Platten ein, und starten Sie dann den Vorgang. Beobachten Sie nach Beginn des Tröpfchenscreenings den Prozessanzeigebereich, in dem Echtzeitmessungen der optischen Tröpfchendichte (OD) oder der Fluoreszenzwerte angezeigt werden.
- Analysieren Sie ca. 20-30 Tröpfchen, um den OD-Wert zu überprüfen. Wenn z. B. festgestellt wird, dass die Mehrheit einen OD-Wert von ~0,2 aufweist, der dem OD-Wert leerer Tröpfchen entspricht, basierend auf der Poisson-Verteilung, legen Sie den unteren OD-Schwellenwert auf 0,5 und den oberen OD-Schwellenwert auf 4,0 fest. Die Tröpfchen innerhalb dieses Bereichs werden automatisch in 96-Well-Platten gesammelt (Abbildung 4A).
HINWEIS: Gemäß dem Beer-Lambert-Gesetz wird der OD-Wert leerer Tröpfchen durch die Zusammensetzung des Nährmediums in den Tröpfchen bestimmt. In der Regel wird der untere OD-Schwellenwert 0,2 bis 0,3 Einheiten höher angesetzt als der OD-Wert leerer Tröpfchen, um eine klare Unterscheidung zwischen leeren Tröpfchen und Tröpfchen, die Mikroorganismen enthalten, zu gewährleisten. - Warten Sie, bis der Piepseralarm anzeigt, dass die Tröpfchensiebung und -sammlung abgeschlossen ist. Öffnen Sie die Tür der Tröpfchendetektions- und -sammelkammer, setzen Sie den Deckel der Well-Platte auf die obere Well-Platte und nehmen Sie dann alle Well-Platten zusammen aus der Kammer, um die anschließende Sequenzierung und Sicherung durchzuführen.
6. Datenexport und Anzeige von Heatmaps
- Klicken Sie auf Daten exportieren, um die gesammelten Tröpfchensignaldaten zu speichern (Abbildung 4A,B).
- Klicken Sie auf Heatmap, wählen Sie die Datendatei für die Tröpfchensammlung aus und beobachten Sie die OD-Werte der in der von der Software angezeigten Mikroplatte gesammelten Tröpfchen. Visualisieren Sie diese OD-Werte als Heatmap, wobei die Farbintensität der OD-Verteilung über die Wells entspricht, um eine klare und intuitive Darstellung der gesammelten monoklonalen OD-Werte zu erhalten (Abbildung 4A,C).
7. Reinigung der MISS-Zelle
- Wählen Sie nach Abschluss des Experiments den Tröpfchenschlauch aus, der gereinigt werden muss, und klicken Sie auf Reinigen , um die Reinigung des Instruments zu starten.
8. Mikrobielle monoklonale Sicherung und Probenvorbereitung zur Sequenzierung
- Probenvorbereitung für die Sequenzierung
- Geben Sie in der anaeroben Bank 100 μl BHI-Medium in jede Vertiefung der gesammelten Tröpfchenplatte, mischen Sie die Vertiefung durch Pipettieren und entnehmen Sie dann 10 μl aus jeder Vertiefung und übertragen Sie alles in ein steriles 15-ml-Röhrchen. Vortex, um eine gemischte mikrobielle Suspension zu erhalten.
- Geben Sie 5 ml phosphatgepufferte Kochsalzlösung in die gemischte mikrobielle Suspension, zentrifugieren Sie 10 Minuten lang bei 1.000 × g , entfernen Sie den Überstand und legen Sie das mikrobielle Pellet zum schnellen Einfrieren in flüssigen Stickstoff. Die Probenvorbereitung für die Sequenzierung ist abgeschlossen.
- Verwenden Sie 16S rDNA-Amplikon-Sequenzierungsmethoden, die auf die V3- und V4-Domäne der 16S rDNA abzielen. Die spezifischen Sequenzierungsprimer, die verwendet werden, sind wie folgt: 341F: ACTCCTACGGGAGGCAGCA und 806R: GGACTACHVGGGTWTCTAAT.
- Kryokonservierung mikrobieller monoklonaler Proben:
- Nachdem Sie 10 μl der Probe aus jeder Vertiefung in den Tröpfchenplatten (aus Schritt 8.1.1) entnommen haben, geben Sie 30 μl Glycerin in jede Vertiefung. Stellen Sie die Platten unter -80 °C auf, um den mikrobiellen Stamm zu erhalten.
Ergebnisse
Die menschliche Darmmikrobiota, die die vorherrschende mikrobielle Gemeinschaft bildet, beherbergt schätzungsweise etwa 4 ×10 13 Mikroorganismen im Darm, was ihre große Anzahl und komplexe Zusammensetzung zeigt11. In dieser Studie zielten wir darauf ab, die Darmmikrobiota zu isolieren und zu kultivieren, und verwendeten die Festplattenmethode als Kontrolle, um die Hochdurchsatzleistung der MISS-Zelle zu demonstrieren.
Zunächst verwendeten wir die gleiche Stuhlsuspension, um den Einzelzellisolationsdurchsatz beider Methoden zu vergleichen. In der MISS-Zelle haben wir niedrige mikrobielle Konzentrationen verwendet, wobei die Verteilungswahrscheinlichkeit von Mikroorganismen in den Tröpfchen auf der Grundlage der Poisson-Verteilung berechnet werden konnte: P(λ,x) = λx e-λ/x!, wobei λ die durchschnittliche Anzahl der Zellen über den Tröpfchen ist, die durch Multiplikation der mikrobiellen Konzentration und des Tröpfchenvolumens berechnet werden kann; x ist die Anzahl der Zellen, die in den Tröpfchen eingekapselt sind. Hier haben wir eine anfängliche mikrobielle Suspensionskonzentration von = 0,1 verwendet (die anfängliche mikrobielle Konzentration beträgt 50 Zellen/ml und das Tröpfchenvolumen 2,0 μl), was bedeutet, dass die Wahrscheinlichkeit des Auftretens von leeren Tröpfchen, einzelligen Tröpfchen und mehrzelligen Tröpfchen 90,5 % (x = 0), 9,1 % (x = 1) bzw. 0,4 % (x ≥ 2) beträgt.
Im Omics-System erzeugten wir ca. 30.000 Tröpfchen mit einer Geschwindigkeit von 5.000 Tröpfchen/h und kultivierten sie in sechs Polytetrafluorethylen-Röhrchen (AD 1,67 mm, I.D. 1,07 mm) für 30 Tage. Letztendlich haben wir die Tröpfchen durch das Detektionsmodul gescreent, indem wir den OD-Detektionsmodus verwendet haben, um bakterienhaltige Tröpfchen in 96-Well-Platten zu sammeln und 1.057 monoklonale Zielstämme zu erhalten. Im Gegensatz dazu betrug die Konzentration der festen Agarplatte bei der Festplattenkulturmethode 3,0 × 103 Zellen/ml mit insgesamt zehn 100 mm Petrischalen (jede Platte mit 100 μl der ursprünglichen mikrobiellen Suspension). Nach 30 Tagen Kultivierung wurden 536 Völker von den Platten gepflückt. Das Omics-System lieferte 1,97-mal mehr monoklonale Klone als die Festplattenmethode. Dies deutet darauf hin, dass die monoklonale Einzelzellkultivierung in mikrofluidischen Tröpfchen Mikroorganismen effektiv isolieren und gleichzeitig die kompetitive Hemmung zwischen den Kolonien eliminieren kann.
Als nächstes führten wir eine 16S-Sequenzierungsanalyse an allen monoklonalen Stämmen durch und verglichen die Artenvielfalt, die mit den beiden oben genannten Methoden erhalten wurde. In Bezug auf die Artenvielfalt auf Familienebene könnten dieselben 34 Familien mit beiden Methoden angereichert werden. Konkret bereicherte das Omics-System vier Familien weiter: Bacteroidales nicht klassifiziert, Bacillales Thermoactinomycetaceae, Burkholderiales Comamonadaceae und Enterobacterales nicht klassifiziert (Abbildung 5B) und bereicherte leicht die geringere Häufigkeit von Clostridiales Family_XI, Clostridiales Acidaminococcaceae, Desulfovibrionales Desulfovibrionaceae und Enterobacterales Enterobacteriaceae in der ursprünglichen mikrobiellen Suspension (Abbildung 5D).
Auf Gattungsebene konnten mit beiden Methoden 74 mikrobielle Gattungen angereichert werden, während die MISS-Zellmethode zusätzlich 13 mikrobielle Gattungen anreicherte: Bacillaceae Bacillus, Bacillaceae Oceanobacillus, Bacillaceae Pseudogracilibacillus, Thermoactinomycetaceae Kroppenstedtia, Peptoniphilaceae Phocea, Clostridiaceae Anaerosalibacter, Peptoniphilaceae Ezakiella, Peptoniphilaceae W5053, XI nicht klassifiziert, Clostridiaceae Clostridioides, Comamonadaceae Pelomonas und zwei nicht klassifizierte mikrobielle Arten (Abbildung 5C). Unter ihnen konnten die Gattungen Enterococcaceae, Enterococcus und Acidaminococcaceae Phascolarctobacterium, die in der ursprünglichen mikrobiellen Suspension eine geringere Häufigkeit aufwiesen, mit dem Omics-System leicht angereichert werden (Abbildung 5E). Erwartungsgemäß gehörten diese beiden Gattungen zur Familie der Enterococcaceae bzw. Acidaminococcaceae , wobei wir die gleichen Ergebnisse aus der Familienanalyse beobachteten. Insgesamt stieg die Speziesanreicherung der MISS-Zellkulturmethode auf Familien- und Gattungsebene im Vergleich zur Festplattenkulturmethode um 30,6 % bzw. 37,9 %. Diese Ergebnisse zeigten, dass die MISS-Zellkulturmethode bessere Wachstumsbedingungen für diejenigen Stämme bot, die in der ursprünglichen mikrobiellen Suspension in geringen Anteilen vorhanden waren oder eine schlechte Wachstumsleistung aufwiesen.

Abbildung 1: Struktur und wesentliche Bestandteile der MISS-Zelle. (Ein) Außenseite der MISS-Zelle. 1. Kammer für Tröpfchenerzeugung und -kultivierung, 2. Tröpfchendetektions- und -sammelkammer, 3. Beleuchtung und UV-Tasten der Tröpfchensammelkammer. (B) Innenraum der Tröpfchenerzeugungs- und Kultivierungskammer. In dieser Kammer werden die Tröpfchenerzeugung, die Tröpfcheninkubation und die Entfernung von Luftblasen für das Tröpfchensieb durchgeführt. 4. Tröpfchen-Kultivierungskammer, 5. Klemmventile zum Klemmen von Silikonschläuchen aus dem Mikroschlauch- und Tröpfchenerzeugungs-Mikrofluidik-Chip; Die Spannventile sind fortlaufend nummeriert von 1 bis 10, von links nach rechts, 6. Platzierung des Luftblasenentferners, 7. Anschlüsse für die Tröpfchenerzeugung und -siebung (O1-O4): Über diese Anschlüsse werden die Öl-, Proben- und Gasphase mit der MISS-Zelle verbunden. 8. Abfallhafen (OF), 9. Klemmventil zum Einklemmen des Tropfenaustrittsrohrs des Luftblasenentferners, 10. Die Öffnung, die zur Tröpfchendetektions- und -sammelkammer führt, 11. Platzierung der Probenflasche; Unter der Platzierung befindet sich ein Magnetrührer, mit dem die Rührgeschwindigkeit der Probe gesteuert werden kann.(C) Draufsicht auf die Tröpfchenkultivierungskammer. Im Inneren der Kammer befindet sich eine Wassereinlassöffnung für einen Luftbefeuchter. Eine Spritze wird verwendet, um 10 mL steriles destilliertes Wasser hinzuzufügen, die Schutzhülle und der Mikroschlauch- und Tröpfchenerzeugungs-Mikrofluidik-Chip werden installiert, und die Silikonschläuche aus dem Mikroschlauch werden an die entsprechenden Klemmventile geklemmt, wie in der Abbildung rechts gezeigt. 12. Eine Wassereinlassöffnung für den Befeuchter in der Tröpfchenkultivierungskammer, 13. Der Mikroschlauch- und Tröpfchenerzeugungs-Mikrofluidik-Chip. (D) Innenraum der Tröpfchendetektions- und -sammelkammer. Das Bild links zeigt drei Well-Platten-Platzierungen und den Handhabungsroboterarm, der die Well-Platte zwischen den Platzierungen bewegt. Das Bild rechts zeigt die vergrößerte Ansicht des Moduls zur Tröpfchenerkennung und -sammlung (rotes Rechteck im Bild links). Platzierung von 96 Well-Platten 14. vorher, 15. währenddessen und 16. Nach der Tröpfchensammlung. 17. 96 Well-Plattenhandhabungs-Roboterarm. Während der Tröpfchenerkennung und -sammlung bewegt der Roboterarm eine 96-Well-Platte zur Platzierung der Well-Platte in der Nähe des Tröpfchendetektionsmoduls. Nachdem die Tröpfchensammlung abgeschlossen ist, wird die Well-Platte an eine andere Stelle verschoben und derselbe Vorgang fortgesetzt, bis der Vorgang abgeschlossen ist. 18. Modul zur Erkennung und Sammlung von Tröpfchen. 19. Der Faserhalter für die Detektionsfaser. Es gibt zwei Detektionsfasern (OD-basierte und fluoreszenzbasierte Detektion). Wenn eine Detektionsfaser verwendet wird, wird die andere in den Faserhalter eingeführt. 20. Das Detektionsrohr. Dieses Rohr ist bereits mit dem Tropfenauslassrohr des Luftblasenentferners verbunden. 21. Die OD-basierte und die fluoreszenzbasierte Detektionsfaser; Die Detektionsfasern sind mit ihren jeweiligen Namen gekennzeichnet. 22. Die optische Faser der Lichtquelle. 23. Die Detektionsbuchse, in die das Detektionsrohr eingeführt ist. 24. Die Faserbefestigungsschraube zur Befestigung der Detektionsfaser. 25. Die Schraube, mit der das Detektionsrohr befestigt ist. Ziehen Sie die Schraube fest, nachdem Sie das Detektionsrohr richtig in die Detektionsöffnung eingeführt haben. 26. Der Anschluss für die Abfallflüssigkeit. 27. Abfallrohr zum Ablassen von Tröpfchen außerhalb des Sammelsignals. (E) Installation des Mikroschlauchs, des Mikrofluidik-Chips zur Tröpfchenerzeugung und des Luftblasenentferners an der entsprechenden Stelle. Die vier Schläuche (C1, C2, C4 und CF) werden jeweils mit den entsprechenden Anschlüssen der MISS-Zelle verbunden. (O1, O2, O4 und OF). 28. Die Schutzabdeckung für den Mikroschlauch- und Tröpfchenerzeugungs-Mikrofluidik-Chip. 29. Der Luftblasenentferner. 30. Das Tröpfcheneinlassrohr zum Luftblasenentferner. 31. Das Tröpfchenauslassrohr aus dem Luftblasenentferner. 32. Klemmventil am C3-Stecker. Abkürzungen: MISS = Single-cell Microliter-droplet Culture Omics System; OD = optische Dichte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
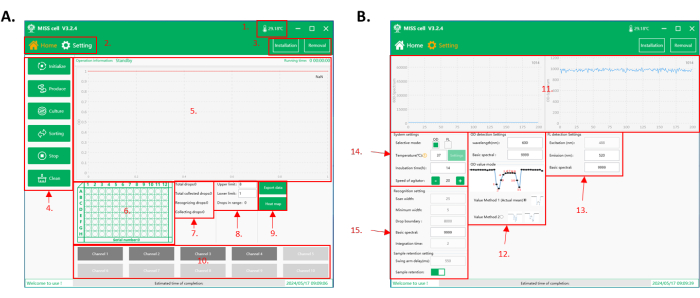
Abbildung 2: Bedienungssoftware-Schnittstelle der MISS-Zelle. (A) Die Home-Schnittstelle der Software. 1. Temperatur in der Operationskammer. 2. Funktionsschnittstelle. Es gibt zwei Schnittstellen für die Bedienung: Home-Schnittstelle und Parametereinstellungsschnittstelle. 3. Mikroschläuche und Tropfenerzeugung Mikrofluidik-Chip-Installations- und -Entfernungsknöpfe. 4. Funktionsauswahl: Es stehen sechs Funktionen zur Auswahl: Initialisieren, Produzieren, Kultur, Sortieren, Stopp und Reinigen. 5. Prozessanzeigebereich: In diesem Bereich werden Betriebsinformationen, Laufzeit und gesammelte Tröpfchendaten angezeigt. 6. Anzeigebereich für 96-Well-Platten: Echtzeitanzeige der aktuellen Sammelplattennummer und der Position der Tropfensammelwanne. 7. Anzeigebereich der Tröpfchenerkennungs- und -sammeldaten. 8. Einstellung der oberen und unteren Grenze für die Sortierung und Anzeigebereich für die Tröpfchenanzahl. Die Reichweite des gesammelten Tröpfchens wird entsprechend dem Tröpfchensignal (OD/ Fluoreszenzintensität) eingestellt. Das MISS-Zellensystem zählt die Gesamtzahl der gesammelten Tröpfchen. 9. Schaltflächen zum Exportieren von Sammlungsdaten und Anzeigen von Heatmaps von Platten. 10. Bereich der Tröpfchenschläuche. Wählen Sie die Anzahl der Schläuche aus, die für die Tröpfchenerzeugung, die Tröpfchenkultivierung, die Tröpfchensiebung und die Reinigung betrieben werden sollen. (B) Die Parametereinstellungsschnittstelle der Software. 11. Echtzeitanzeige der bei der Tröpfchensortierung erfassten Spektralwerte (OD/Fluoreszenzintensität). 12. Parameter für die Einrichtung der OD-Detektion, einschließlich der Detektionswellenlänge, des grundlegenden Spektralwerts und des OD-Modus. Es gibt zwei OD-Modi: effektiven Mittelwert (Wertmethode 1), der den Mittelwert des Spektralwerts des Tröpfchens berechnet; und der Minimalwert (Wertmethode 2), der den Minimalwert des Tröpfchenspektralwerts als Signal annimmt. 13. Setup-Parameter für die Fluoreszenzdetektion, einschließlich Anregung (Gerätekonfiguration), Emissionswellenlänge (350-800 nm) und Spektralwert der Basis. 14. Parameter für die Systemeinrichtung, einschließlich Auswahl des Detektionsmodus (OD/Fluoreszenzintensität), Inkubationstemperatur, Inkubationszeit und Rührgeschwindigkeit der Probe in der Reagenzflasche. 15. Parameter für die Tröpfchenidentifikation und die Probenentnahme. Abkürzungen: MISS = Single-cell Microliter-droplet Culture Omics System; OD = optische Dichte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Installation der Probenflasche und des Luftblasenentferners. (A) Die MISS-Zellen-Probenflasche. Die mikrobielle Suspension wird in die Probenflasche in die Position der Probenzugabe gegeben. Der Deckel wird sofort festgezogen und die Schnellkupplungen A und B angeschlossen. Schließlich wird die Probenflasche in die Probenflasche auf der MISS-Zelle gestellt. (B) Die Installation der Probenflasche. Die Schnellanschlüsse A und B werden mit dem O3-Anschluss der MISS-Zelle bzw. dem C3-Anschluss des Mikroschlauch- bzw. Tröpfchenerzeugungs-Mikrofluidik-Chips verbunden. (C) Die Installation des Luftblasenentferners. Bei der Installation des Luftblasenentferners wird zuerst die schmetterlingsförmige Schraube vom Deckel entfernt, bevor die Flasche mit dem Luftblasenentferneröl installiert wird. Abkürzung: MISS = Single-cell Microliter-droplet Culture Omics System Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
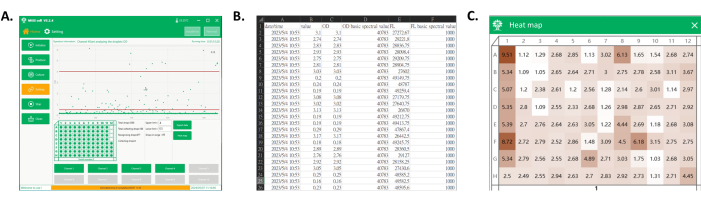
Abbildung 4: Datenexport und die Heatmap der gesammelten Well-Platte. (A) Die Hauptschnittstelle der Software bei der Tröpfchenerkennung und -sammlung. Im Prozessanzeigebereich wird jedes Tröpfchensignal angezeigt, und die Tröpfchen im gewünschten Bereich werden auf der Well-Platte gesammelt. (B) Screenshot eines Teils der exportierten Daten. Zu den exportierten Daten gehören das spektrale Signal der gesammelten Tröpfchen (Spalten C und E) und deren Detektionszeiten (Spalte A). (C) Screenshot der Heatmap der Platte. Basierend auf den Signalen der gesammelten Tröpfchen werden die Werte normalisiert, um eine Heatmap der Platte zu erhalten, die später verwendet werden könnte, um die Kulturleistung der monoklonalen Stämme jedes Klons anhand der Farbe zu unterscheiden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
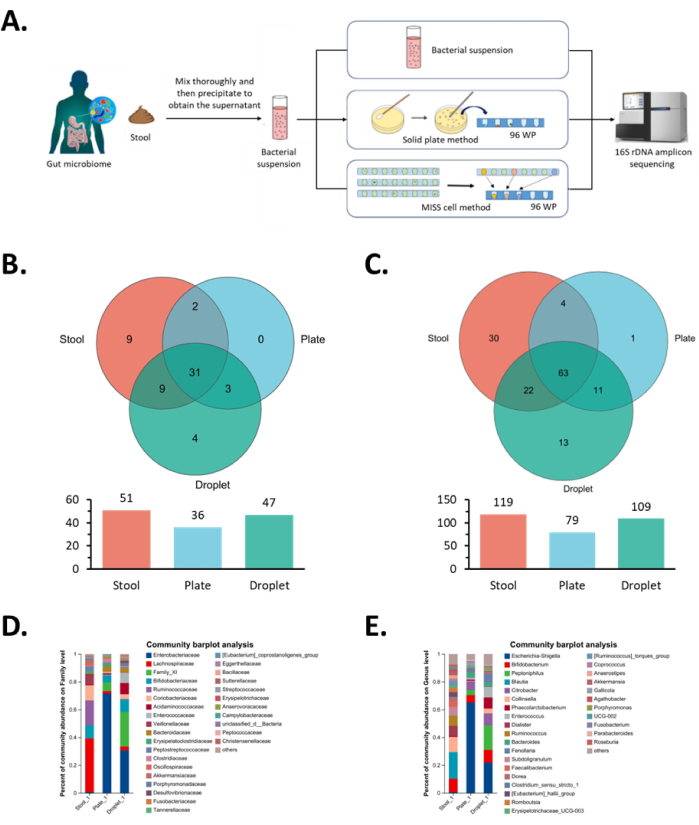
Abbildung 5: Ergebnisse der monoklonalen Isolierung und Kultivierung von intestinalen Mikroorganismen in der MISS-Zelle. (A) Workflow-Diagramm für die Isolierung, Kultivierung und Identifizierung von Darmmikrobiota. Die anfängliche mikrobielle Suspension, die Festplattenmethode und die MISS-Zellmethode werden verwendet, um dieselbe Darmmikrobiota zu isolieren und zu kultivieren, gefolgt von einer Sequenzierungsanalyse. (B,D) Analyse monoklonaler Kolonien auf Familienebene, die aus der Isolierung und Kultivierung von Darmmikrobiota gewonnen wurden, wobei B die Venn-Diagramm-Analyse und D die Analyse der Gemeinschaftszusammensetzung zeigt. (C,E) Analyse auf Gattungsebene von monoklonalen Kolonien, die aus der Isolierung und Kultivierung von Darmmikrobiota gewonnen wurden, wobei C die Venn-Diagramm-Analyse und E die Analyse der Gemeinschaftszusammensetzung zeigt. Abkürzung: MISS = Single-cell Microliter-droplet Culture Omics System. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieses Protokoll beschreibt den Betrieb der MISS-Zelle für die automatisierte und hochwirksame mikrobielle monoklonale Isolierung, Kultivierung, Detektion und Sammlung. Im Vergleich zu herkömmlichen Methoden, mit denen nur ~20%-30% der Darmmikrobiota isoliert und kultiviert werden konnten 2,12, war die Anzahl der monoklonalen Klone, die mit dem Omics-System erhalten wurden, 1,97-mal höher als die aus festen Platten. Dieser Vergleich zeigt, dass die MISS-Zelle Vorteile bei der Einzelzellisolierung, der monoklonalen Kultivierung und dem Screening hat.
Für die Einzelzellisolierung erhielt das Omics-System einzellige Tröpfchen gemäß der Poisson-Verteilung, die eine gute Monoklonalität gewährleisteten. Darüber hinaus erzeugte das Omics-System Tröpfchen mit einer Rate von bis zu 5.000 Tröpfchen/h, was eine Einzelzellisolierung mit hohem Durchsatz ermöglichte und gleichzeitig den Reagenzienverbrauch aufgrund der geringen Tröpfchengröße erheblich reduzierte. Bei der Tröpfchenerzeugung wurde ein strömungsfokussierender Kanal auf dem Mikroschlauch verwendet. Das Omics-System verwendet die Einspritzpumpe, um die Ölphase, die Probenlösung und das Gas in den strömungsfokussierenden Kanal zu drücken und Tröpfchen zu bilden. Der Benutzer kann beobachten, ob die Tröpfchen erfolgreich durch den Kanal erzeugt werden, oder indem er direkt auf den Tröpfchenschlauch schaut. Die Silikonschläuche aus dem Mikroschlauch- und Tröpfchenerzeugungs-Mikrofluidik-Chip werden mit dem Ende der 10 Tröpfchenschläuche verbunden. Wenn genügend Tröpfchen in einem Tröpfchenschlauch (~5.000 Tröpfchen) erzeugt werden, klemmt das Klemmventil automatisch die Silikonschläuche des Schlauchs ein und erzeugt den Tropfen weiter in den nächsten Schlauch.
Bei der Kultivierung mit monoklonalen Stämmen profitierten die Mikroorganismen in den Tröpfchen von einer hervorragenden Gasaustauschleistung, einer hohen Parallelkultivierung und einem effizienten Stofftransfer, wodurch optimale Wachstumsbedingungen für Stämme mit geringer Abundanz oder schwer zu züchten geschaffen wurden. Für das monoklonale Stammscreening unterstützte das Omics-System den Nachweis von Fluoreszenz und OD-basierter Biomasse, wodurch der Nachweis auf der mikrobiellen Wachstumsleistung und dem Expressionsniveau eines bestimmten Gens oder Proteins von Interesse basierenkonnte 13. Darüber hinaus nutzte das Omics-System die schwerkraftinduzierte Tröpfchenabscheidung in Well-Platten. Durch die Kombination dieses passiven Screening-Verfahrens mit einem Schwenkarm wurde ein stabiles und hochpräzises Tröpfchensieb erreicht, was es zu einer biofreundlichen Screening-Plattform macht. Darüber hinaus erreichte das Omics-System einen vollautomatischen Prozess von der Isolierung eines einzelnen Mikroorganismus bis zum abschließenden klonalen Screening, was die Arbeits- und Zeitkosten reduzierte.
Angesichts der Leistungsfähigkeit des Omics-Systems könnte es für die mikrobielle Kultivierung und das mikrobielle Mutagenese-Screening sowie für andere Anwendungen wie die Auswahl hochproduktiver Stämme und den Abbau wichtiger funktioneller Gene verwendet werden6. Um genaue experimentelle Ergebnisse zu erhalten, können Forscher die Versuchsbedingungen basierend auf den zu isolierenden, zu kultivierenden und zu screenenden Spezies optimieren. Zunächst folgt die Erzeugung von einzelligen Tröpfchen im Omics-System der Poisson-Verteilung, wobei ein niedriger λ-Wert dafür sorgt, dass es sich bei den erzeugten Tröpfchen überwiegend um leere oder einzellige Tröpfchen handelt. In unserer früheren Arbeit haben wir den optimalen mikrobiellen Konzentrationsbereich für die Erzeugung von Einzelzelltröpfchen im Omics-System auf 16,8-69,7 Zellen/ml (λ = 0,035-0,145)6 validiert. Bei der Herstellung von Probensuspensionen ist es entscheidend, innerhalb dieses Konzentrationsbereichs zu verdünnen, um die Genauigkeit der Monoklonalität zu verbessern. Zweitens ist es vor dem Einsatz des Omics-Systems notwendig, die mikrobiellen Wachstumsbedingungen zu optimieren. Basierend auf dem Sauerstoffbedarf des Mikroorganismus können die Forscher entweder Stickstoff oder Sauerstoff als Gasphase für die Tröpfchenerzeugung wählen. Drittens wird bei der Tröpfchendetektion die Absorption oder Fluoreszenz durch die Intensität des Lichts bestimmt, das nach dem Beleuchten der Tröpfchen empfangen wird. Folglich können sich die numerischen Werte, die aus derselben Probe erhalten wurden, zwischen der Tröpfchendetektion und der Spektralphotometermessung aufgrund von Unterschieden in der Probendicke unterscheiden, wie in unserer früheren Arbeit14 beobachtet. Daher wird empfohlen, vor der Durchführung der Versuche eine Kalibrierkurve für experimentelle Proben zu erstellen.
Darüber hinaus verbessern wir auch die Leistung des Omics-Systems für die Anwendung anderer Spezies wie Säugetierzellen, einschließlich der Biokompatibilität der Ölphase zu Zellen (z. B. hat fluoriertes Öl eine höhere Gaslöslichkeit und ist besser für Säugetierzellkulturen geeignet15,16), die Wirkung der Zweiphasen-Flussrate auf die zelluläre Scherkraft17, 18,19 und die Optimierung der Tröpfchengröße13,20. Diese Verbesserungen können den Einsatz des Omics-Systems in der biomedizinischen Forschung erheblich erleichtern, z. B. bei der Entwicklung von Zelllinien, dem Screening von Einzel-B-Zell-Antikörpern und der Entdeckung von Hybridom-Antikörpern. Basierend auf den drei operativen Kernmodulen des Omics-Systems – Tröpfchenerzeugung, -kultivierung und -screening – können die Forscher die geeigneten Module entsprechend den Anforderungen des Experiments auswählen. Zusätzlich kann das Tröpfcheninjektions- und Tröpfchenteilungsmodul zu dem hierin beschriebenen System hinzugefügt werden, um eine Reagenzienzugabe durchzuführen oder Stammbibliotheken zu erstellen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Studie wurde durch die Forschungs- und Entwicklungsprojekte in Schlüsselbereichen der Provinz Guangdong (2024B1111130002), Forschungs- und Entwicklungsprojekte der Provinz Hebei (22375503D) und das Eröffnungsprojekt des Anhui Engineering Laboratory for Industrial Microbiology Molecular Breeding (Grant ELMB-07) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Merck KGaA, Darmstadt, Germany | P5731-500EA | For solid plate preparation |
| 30 mL Stool Containers | Boen Healthcare Co., Ltd | 611101 | For collecting the stool samples |
| 37 °C constant temperature incubator | Shanghai Yiheng Technology Co., Ltd. | LRH-150 | Cultivate the solid plate in the incubator |
| 96-well Clear Flat Bottom Polystyrene TC-treated Microplates | Corning | 3599 | For well plate movement detection and droplet collection |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| Air bubble removal oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S-oil | The oil in the air bubble remover during droplet screening |
| Air bubble remover | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S | Exclude the gas phase between droplets before performing droplet detection and collection |
| Anaerobic bench | Argon and Nitrogen Space Equipment Business Department, Haiyu Town, Changshu City | VGB-4CM | For aseptic operation and UV sterilization under anaerobic condition |
| Autoclave | Puhexi Health and Medical Equipment Co., Ltd. | MLS-830L | For autoclaving BHI medium, EP tube, and so on. |
| Brain Heart Infusion (BHI) Broth | Qingdao High-tech Industrial Park Haibo Biotechnology Co., Ltd | HB8297-1 | Components of the BHI medium The ingredient list: 38.5 g/L BHI Broth in distilled water |
| Cell Spreader | Merck KGaA, Darmstadt, Germany | HS8151 | Inoculate the microbial solution onto the solid plate |
| Centrifuge tube, 15 mL | Beijing Xinhengyan Technology Co., Ltd | HB53397 | For microbial solution preparation |
| Computer | Lenovo | E450 | Software installation and MISS cell control |
| Cryovial | Thermo Fisher | 2.0 mL | For stool preservation |
| Distilled water | Beijing Mreda Technology Co., Ltd. | M306444-100ml | Add into humidifier to keep the humidity in droplet cultivation chamber |
| EP tube | Thermo Fisher | 2.0 mL | For collecting the stool samples |
| Fluorescent inverted microscope | Olympus Life Science (LS) | CKX53 | Check and calculate the microbial concentration |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| Hemocytometer | Acmec | AYA0810-1ea | Calculate the microbial concentration |
| KCl | Ambeed | A442876 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| KH2PO4 | MACKLIN | P815661 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| Mesh filter | Anping Jiufeng Wire Mesh Manufacturing Co., Ltd | 200 mesh (0.075 mm), 400 mesh (0.038 mm), 800 mesh (0.018 mm) | Remove undigested food and smaller particulate matter from the stool samples |
| Micro-tubing and droplet generation microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISC-B2 | For droplet generation and droplet incubation |
| MISS cell oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-BOS-B | The oil phase for droplet microfluidics |
| MISS cell software | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell V3.2.4 | Perform experimental operations on the MISS cell instrument |
| Na2HPO4 | Solarbio | D7292 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| NaCl | GENERAL-REAGENT | G81793J | Components of the physiological saline solution The ingredient list: 9 g/L NaCl in distilled water |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Polytetrafluoroethylene tube | Shenzhen WOER Heat-shrinkable Material Co., Ltd. | 3401000141 | For droplet incubation. This material was already included in micro-tubing and droplet generation microfluidic chip |
| Sample bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-bottle | Sampling of microbial solution |
| Single Cell Microliter-droplet Culture Omics System (MISS cell) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-G3f | Performing the microbial monoclonal isolation, cultivation, detection and collection |
| Superspeed Centrifuge | Thermo Fisher | Sorvall Lynx 4000 | Prepare the microbial solution for sequencing |
| Syringe | Jiangsu Zhiyu Medical Instructment Co., Ltd | 10 mL | Draw the distilled water and inject it into the humidifier in droplet cultivation chamber |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
Referenzen
- Hahn, M. W., Koll, U., Schmidt, J., Hurst, C. J. Isolation and cultivation of bacteria. The structure and function of aquatic microbial communities. , 313-351 (2019).
- Xu, M. Q., Pan, F., Peng, L. H., Yang, Y. S. Advances in the isolation, cultivation, and identification of gut microbes. Mil Med Res. 11 (1), 34 (2024).
- Lattermann, C., Büchs, J. Microscale and miniscale fermentation and screening. Curr Opin Biotechnol. 35, 1-6 (2015).
- Huang, Y., et al. High-throughput microbial culturomics using automation and machine learning. Nat Biotechnol. 41 (10), 1424-1433 (2023).
- Brehm-Stecher Byron, F., Johnson Eric, A. Single-cell microbiology: Tools, technologies, and applications. Microbiol Mol Biol Rev. 68 (3), 538-559 (2004).
- Jian, X., et al. Single-cell microliter-droplet screening system (miss cell): An integrated platform for automated high-throughput microbial monoclonal cultivation and picking. Biotechnol Bioeng. 120 (3), 778-792 (2023).
- Hu, B., et al. One cell at a time: Droplet-based microbial cultivation, screening and sequencing. Mar Life Sci Technol. 3 (2), 169-188 (2021).
- Leygeber, M., et al. Analyzing microbial population heterogeneity-expanding the toolbox of microfluidic single-cell cultivations. J Mol Biol. 431 (23), 4569-4588 (2019).
- He, Z., Wu, H., Yan, X., Liu, W. Recent advances in droplet microfluidics for microbiology. Chinese Chemical Letters. 33 (4), 1729-1742 (2022).
- Kaminski, T. S., Garstecki, P. Controlled droplet microfluidic systems for multistep chemical and biological assays. Chem Soc Rev. 46 (20), 6210-6226 (2017).
- Sender, R., Fuchs, S., Milo, R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell. 164 (3), 337-340 (2016).
- Simrén, M., et al. Intestinal microbiota in functional bowel disorders: A rome foundation report. Gut. 62 (1), 159-176 (2013).
- Periyannan Rajeswari, P. K., Joensson, H. N., Andersson-Svahn, H. Droplet size influences division of mammalian cell factories in droplet microfluidic cultivation. Electrophoresis. 38 (2), 305-310 (2017).
- Jian, X., et al. Microbial microdroplet culture system (mmc): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnol Bioeng. 117 (6), 1724-1737 (2020).
- Baret, J. -. C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Kubie, L. S. The solubility of O2, CO2, and N2 in mineral oil and the transfer of carbon dioxide from oil to air. J Biol Chem. 72 (2), 545-548 (1927).
- Poon, C. Measuring the density and viscosity of culture media for optimized computational fluid dynamics analysis of in vitro devices. J Mech Behav Biomed Mater. 126, 105024 (2022).
- Yao, J., Lin, F., Kim, H. S., Park, J. The effect of oil viscosity on droplet generation rate and droplet size in a t-junction microfluidic droplet generator. Micromachines. 10 (12), 808 (2019).
- Venkateshwarlu, A., Bharti, R. P. Effects of capillary number and flow rates on the hydrodynamics of droplet generation in two-phase cross-flow microfluidic systems. Journal of the Taiwan Institute of Chemical Engineers. 129, 64-79 (2021).
- Nekouei, M., Vanapalli, S. A. Volume-of-fluid simulations in microfluidic t-junction devices: Influence of viscosity ratio on droplet size. Physics of Fluids. 29, 032007 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten