Method Article
使用单细胞微升液滴培养组学系统的自动化和高通量微生物单克隆培养和挑取
摘要
该协议描述了如何使用单细胞微升液滴培养组学系统 (MISS 细胞) 进行微生物单克隆分离、培养和挑选。MISS Cell 实现了基于液滴微流控技术的集成工作流程,可提供出色的液滴单分散性、高平行培养和高通量生物量检测。
摘要
纯细菌培养物对于微生物培养组学研究至关重要。基于固体板、孔板和微反应器的传统方法受到繁琐程序和低通量的阻碍,阻碍了微生物培养组学研究的快速进展。为了应对这些挑战,我们成功开发了单细胞微升液滴培养组学系统 (MISS cell),这是一个自动化的高通量平台,利用液滴微流控技术进行微生物单克隆分离、培养和筛选。该系统可产生大量单细胞液滴,并在短时间内培养、筛选和收集单克隆菌落,有利于实现从微生物分离到挑取的一体化过程。在该协议中,我们以人肠道微生物群的分离和培养为例展示了其应用,并使用固体板培养方法比较了微生物分离效率、单克隆培养性能和筛选通量。实验工作流程简单,试剂消耗量非常低。与固体板培养方法相比,MISS 细胞可以培养更多样化的肠道微生物群物种,为微生物培养组学研究提供巨大的潜力和价值。
引言
微生物培养组学在研究食品工业中的有益微生物、环境微生物的多样性、筛选新的抗菌化合物以及与疾病相关的人类微生物组方面具有广泛的应用1,2,3,4。传统方法主要基于固体板、孔板或微反应器来获取和挑选单克隆,易于作,但由于步骤多,通量低。这一限制阻碍了微生物诱变筛选、微生物培养组学研究和高产菌落选择等应用,所有这些都需要广泛的单克隆筛选。
最近,各种单细胞检测和分液设备被设计出来,以显著提高微生物样品的处理速度,同时减少劳动力并最大限度地减少手动处理的错误5。然而,这些仪器通常仅处理传统方法中的特定步骤,通常需要广泛的设备集成,占用大量空间,并产生高成本。因此,迫切需要开发一种低成本、普遍适用的微生物培养和筛选平台来弥补上述缺点。
在我们之前的工作中,我们成功开发了一种自动化、高通量筛选平台,称为单细胞微升液滴培养组学系统(MISS 细胞,以下简称“组学系统”)6。该平台利用液滴微流控技术,有望实现微生物分离、培养和采摘的自动化和集成 7,8,9,10。组学系统由几个关键模块组成,包括采样模块、微流控芯片、液滴检测和收集系统,可在微生物学研究中实现高效的单细胞分离、培养、单克隆筛选和收集。我们已经利用 Omics 系统实现了谷氨酸棒状杆菌6 的高通量诱变筛选。
由于 Omics 系统的自动化和高通量筛选能力,将其应用于微生物培养组学有望快速获得大量微生物数据。在该方案中,我们介绍了 MISS 细胞的详细作程序,以人肠道微生物群的分离和培养为例,展示了微生物单细胞分离、培养、单克隆检测和筛选的过程。组学系统作简单,研究人员只需按照软件方向进行微管和液滴生成微流控芯片的顺序安装、参数设置和样品制备。
在软件作界面中,组学系统分为三个主要功能——分离、培养和筛选。研究人员可以根据实验选择不同的阶段。此外,在液滴筛选阶段,研究人员可以从两种检测模式中进行选择:荧光信号或光密度。该软件提供液滴筛选过程的实时可视化。最后,研究人员可以根据其特定的实验需求灵活地配置培养条件、检测到的波长和收集孔的数量等参数,并且他们可以随时暂停仪器以进行其他作。MISS Cell 是一种对微生物友好、高通量的单克隆筛选平台,作简单,试剂消耗量最小。
研究方案
所有研究程序均符合所有相关的道德规定。程序由清华大学科技伦理委员会批准。为了研究人类肠道微生物群,从没有明显疾病的健康成年人那里收集粪便样本,该成年人提供了书面知情同意书。
1. 仪器安装
- 将 Omics 系统仪器放置在清洁或无菌环境中(例如无菌室或厌氧工作台)。该仪器是一种精密设备,将其放置在设施中时,请考虑以下事项:
- 将仪器保持在常压常温下。
- 使仪器远离强电场、磁场和热辐射源。
- 确保仪器放置区域超过 2,500 mm (D) x 1,500 mm (W) x 2,000 mm (H) 的尺寸。
- 将仪器的环境湿度保持在 60% 以下。
2. 准备工作
- 依次打开组学系统、计算机和组学系统作软件的电源。
- MISS Cell 微管及液滴发生微流控芯片安装:
- 打开液滴发生和培养室的门(图 1A),垂直取下微管和液滴发生微流控芯片的保护盖。使用一次性注射器将 10 mL 无菌蒸馏水添加到液滴培养室内的加湿器中(图 1C),并重新安装微管和液滴生成微流体芯片的保护盖。
- 打开微管和液滴生成微流控芯片的无菌包装,并将其垂直放置在培养室的正上方(图 1C)。
- 在软件界面上,单击 安装 (图 2A)。此时,会出现一个弹出窗口,提示 Confirm the replacement of micro-tubing and droplet generation microfluidic chip? 单击 Yes 开始安装。
- 取出气泡去除器,将其倒置固定在液滴发生和培养室中的气泡去除器上。小心不要按压气泡去除器的液滴入口和出口管(图 1E)。
- 将气泡去除器的液滴出口管连接到其下方的夹紧阀上,并让它穿过孔,该孔被引导到液滴检测和收集室(图 1B)。
- 打开液滴检测和收集室的门,将已经连接到液滴出口管的检测管垂直插入检测插座,并确保检测管完全插入(图 1D)。
注意: 插入检测管时,请将其垂直插入,不要在管上弯曲。 - 顺时针方向拧紧固定检测管的螺钉。确认检测管已完全插入并固定后,关闭液滴检测和收集室的门。
- 从微管和液滴生成微流控芯片中,有 10 个硅胶管,每个硅胶管都标有一个数字 (L01-L10)。将每根标记的管子连接到相应的编号夹紧阀 (01-10)(图 1C)。
- 将微管和液滴生成微流控芯片的快速连接器连接到组学系统上的相应端口:C1 到 O1、C2 到 O2、C4 到 O4 和 CF 到 OF。
注意:微管和液滴生成微流控芯片的安装已完成。C3 不需要连接到 O3。 - 微管和液滴生成微流控芯片安装完成后,出现弹窗提示 液滴管夹紧阀打开。单击 “确定 ”,当微管和液滴生成微流控芯片安装完成后。确保来自微管和液滴生成微流体芯片的所有硅胶管都连接到相应的夹紧阀后,单击 OK(确定)。
- 仪器初始化
- 在执行初始化之前,点击 设置 界面(图 2B)配置相关参数:检测模式(基于 OD 或基于荧光的检测;此处为 OD)、孵育温度 (37 °C) 和时间 (30 天 = 720 小时)、搅拌器速度 (20 rpm)、OD 检测波长 (600 nm) 以及荧光检测的激发和发射波长。
注意:本方案中用于分离和培养人类肠道微生物群的参数在括号中给出。设置参数时,培养温度应在 5 °C 至 50 °C 之间。 选择检测模式时,如果液滴检测模块上的光纤不相同,则必须更换光纤(参见步骤 2.3.2)。配置参数时,软件会自动识别油相参考值(基本光谱),无需手动调整。 - 更换检测到的光纤
- 从光纤支架中取出检测到的光纤(逆时针拧下),然后松开液滴模块上的光纤固定螺钉(图 1D)。
- 如果不使用光纤,请将其从模块中取出,插入光纤支架,然后拧紧。将检测到的光纤插入检测端口,并拧紧模块上的光纤固定螺钉。光纤的更换完成。
- 转到 Home 界面,然后单击 Initialize 让 Omics 系统对其组件进行自检,包括注射泵、温度设置、废液排放测试、筛选模块和液滴检测模块。
- 初始化时,将 1 mL 75% 酒精注入废液端口,观察液体是否正常流出,从液滴检测模块进行废液排放测试。
- 对于筛选模块测试,将 96 孔板放在板的位置上,观察板移动是否正常。
- 在执行初始化之前,点击 设置 界面(图 2B)配置相关参数:检测模式(基于 OD 或基于荧光的检测;此处为 OD)、孵育温度 (37 °C) 和时间 (30 天 = 720 小时)、搅拌器速度 (20 rpm)、OD 检测波长 (600 nm) 以及荧光检测的激发和发射波长。
3. 液滴生成
- 人类肠道微生物群样本的采集和处理
- 准备一个腔室罐和粪便容器,洗手,并戴上手套以收集新鲜的粪便样本。
注意:采集粪便样本时,请尽可能避免尿液污染。最好事先排尿,并将粪便放入干净、干燥的容器中。 - 在无菌条件下收集适量的中段粪便并将其密封在灭菌的冻存管中(每瓶约 3-5 g)。立即将样品瓶放在冰上,以便随后分装和标记。
注意:如果粪便样本大或不能立即收集,最多应在 2 小时内收集。 - 在厌氧工作台中,使用无菌拭子或粪便采样工具收集中段样本。
注意:粪便表层含有脱落的肠粘膜细胞,容易受到外部污染;暴露在空气中后,一些微生物 DNA 开始降解。 - 将收集的粪便样品转移到 2 mL 无菌微量离心管或无菌冷冻管中,每管含有 0.5-2.0 g 粪便。每个样品准备两份等分试样进行冷冻。
- 将新鲜粪便样品重悬于无菌生理盐水溶液中,每 100 mg 粪便用 1 mL 溶液稀释。彻底混合粪便,直到看不到大颗粒。
- 自然沉淀 10 分钟后,通过孔径为 200 目 (0.075 mm)、400 目 (0.038 mm) 和 800 目 (0.018 mm) 的无菌网状过滤器依次过滤上清液,以去除未消化的食物和较小的颗粒物。最后,将滤液收集在无菌离心管中。
- 取 10 μL 过滤后的粪便悬浮液,使用血细胞计数器和倒置荧光显微镜测定微生物浓度。
注:通过不同网孔大小过滤粪便样品上清液后,仍会残留一些较小的粪便颗粒。因此,在确定微生物浓度时,在显微镜下观察到的活性颗粒被视为微生物,这只能近似计算微生物浓度。 - 将粪便悬液转移至 1.5 mL 无菌离心管中,并标明日期、微生物浓度和样品名称。保留一些用于后续实验,其余的储存在 4 °C 以备将来使用。
注意:及时记录样本信息(样本名称、采集时间),以确保同时采集样本(考虑到哺乳动物肠道微生物时间节律的变化)。整个样品采集和处理应在厌氧环境中进行。
- 准备一个腔室罐和粪便容器,洗手,并戴上手套以收集新鲜的粪便样本。
- 初始粪便悬浮液的准备
- 根据制造商的方案制备脑心肉汤 (BHI) 培养基,并通过在 121 °C 下高压灭菌 15 分钟对其进行消毒。
- 取步骤 3.1.8 中的粪便悬液,用 BHI 培养基进行连续稀释,以达到 ~50 个细胞/mL 的浓度。
注:要填充样品瓶,请准备至少 40 mL 的粪便悬浮液。 - 确保底部有一个小的磁力搅拌棒,将稀释的粪便悬浮液倒入样品瓶中,直至样品添加位置。拧上盖子并拧紧。接下来,将快速接头 A 插入快速接头 B 以完成样品装载过程(图 3A)。
- 将样品瓶放入指定位置,并将快速接头 A 和 B 与样品瓶分开。将样品瓶的快速连接器 A 连接到 Omics 系统上的 O 3 端口,微管和液滴发生微流控芯片上的 C3 连接器连接到快速连接器 B。关闭液滴发生和培养室的门(图 3B)。
- 液滴生成
- 选择要在软件 主 界面上生成的所需数量的液滴管(图 2A)。
注:每次运行最多可产生 10 个液滴管,每管可产生大约 5,000 个液滴。 - 单击软件主界面中的 Produce 开始生成单细胞液滴。
注意: 确认废液泵的排放是否正常工作。在液滴生成过程中,每个液滴的体积为 2.0 μL。有关液滴生成的描述,请参阅讨论部分。 - 等待蜂鸣器警报指示液滴生成已完成。关闭 C3 连接器上的夹子(图 1E)并取出样品瓶。
- 选择要在软件 主 界面上生成的所需数量的液滴管(图 2A)。
4. 液滴培养
- 在软件 的主 界面上选择与液滴生成过程中相同的液滴管编号,单击 Culture,确认培养时间和温度,然后开始该过程。监控 主 界面上的进度条,显示修炼进度和剩余时间。
- 等待蜂鸣器警报指示液滴培养已完成。如果必须延长修炼时间,直接在 设置 界面 调整时间。
5. 飞沫筛选
- 按下 Omics 系统上的 UV 按钮打开紫外线 (UV) 光(图 1A),照射液滴检测和收集室 30 分钟,然后关闭紫外线灯。
注意: 在打开紫外线灯之前,请确保液滴检测和收集室的门已关闭。 - 在超净工作台中,打开所有用于收集液滴的 96 孔板,并将它们堆叠在一起,无需盖子,从下到上依次编号。确保顶孔板盖上盖子。
注:每次运行最多可容纳 10 个 96 孔板,板的数量取决于液滴的总数。 - 打开液滴检测和收集室的门,将孔板放在指定位置(图 1D),从顶部孔板中取出盖子,然后关闭腔室门。
- 打开 Omics 系统上的紫外线灯 30 分钟以进行二次灭菌。
- 安装气泡去除器
- 从放置位置取下气泡去除器,拧下盖子,然后从盖子上取下蝴蝶形螺钉(图 3C)。
- 将 200 mL 气泡去除油倒入气泡去除剂中,用 Omics 系统上的气泡去除剂瓶盖拧紧,然后将去除剂倒置在气泡去除剂的位置上。气泡去除器安装完成。
注意: 将气泡去除器固定在放置位置上时,请确保没有油泄漏。如果发生任何泄漏,请拧紧盖子。
- 在 主 界面选择需要排序的液滴管,点击 排序,输入需要采集的孔板数量,然后开始该过程。液滴筛选开始后,观察过程显示区域,该区域显示液滴光密度 (OD) 或荧光值的实时测量值。
- 分析大约 20-30 个液滴以检查 OD 值。例如,如果发现大多数液滴的 OD 值为 ~0.2,对应于空液滴的 OD 值,则根据泊松分布,将 OD 阈值下限 设置为 0.5,将 OD 阈值上限 设置为 4.0。此范围内的液滴将自动收集到 96 孔板中(图 4A)。
注:根据 Beer-Lambert 定律,空液滴的 OD 值由液滴内的培养基成分决定。通常,较低的 OD 阈值设置为比空液滴的 OD 值高 0.2-0.3 个单位,以确保明确区分空液滴和含有微生物的液滴。 - 等待蜂鸣器警报指示液滴筛查和收集已完成。打开液滴检测收集室的门,将孔板盖放在顶部孔板上,然后将所有孔板一起从腔室中取出,进行后续的测序和备份。
6. 热图的数据导出和展示
- 单击 导出数据 以保存收集的液滴信号数据(图 4A、B)。
- 单击 热图,选择液滴采集数据文件,观察软件显示的微孔板中采集的液滴的 OD 值。将这些 OD 值可视化为热图,其中颜色强度对应于孔中的 OD 分布,从而清晰直观地表示收集的单克隆 OD 值(图 4A、C)。
7. MISS 单元的清洁
- 实验完成后,选择需要清洁的液滴管,然后单击 Clean(清洁 )开始仪器清洁。
8. 微生物单克隆备份和测序样品制备
- 测序样品制备
- 在厌氧工作台中,向收集的液滴板的每个孔中加入 100 μL BHI 培养基,通过移液充分混合,然后从每个孔中取出 10 μL,将其全部转移到一个 15 mL 无菌管中。涡旋以获得混合微生物悬浮液。
- 向混合微生物悬浮液中加入 5 mL 磷酸盐缓冲盐水,以 1,000 × g 离心 10 分钟,去除上清液,将微生物沉淀置于液氮中快速冷冻。测序样品制备完成。
- 使用靶向 16S rDNA 的 V3 和 V4 结构域的 16S rDNA 扩增子测序方法。使用的具体测序引物如下:341F:ACTCCTACGGGAGGCAGCA 和 806R:GGACTACHVGGGTWTCTAAT。
- 微生物单克隆样品冻存:
- 从液滴板中的每个孔中收集 10 μL 样品后(来自步骤 8.1.1),向每个孔中加入 30 μL 甘油。将板置于 -80 °C 以下以保存微生物菌株。
结果
人类肠道微生物群构成了主要的微生物群落,据估计,肠道中大约有 4 ×10 13 种微生物,展示了其庞大的数量和复杂的组成11。在这项研究中,我们旨在分离和培养肠道微生物群,并使用实心板法作为对照来证明 MISS 细胞的高通量性能。
首先,我们使用相同的粪便悬液来比较两种方法的单细胞分离通量。在 MISS 细胞中,我们使用了低微生物浓度,其中微生物在液滴中的分布概率可以根据泊松分布计算: P(λ,x) = λx e-λ/x!,其中 λ 是液滴上细胞的平均数量,可以通过乘以微生物浓度和液滴体积来计算;x 是封装在液滴中的细胞数。在这里,我们使用 = 0.1 的初始微生物悬浮浓度(初始微生物浓度为 50 个细胞/mL,液滴体积为 2.0 μL),表明空液滴、单细胞液滴和多细胞液滴发生的概率分别为 90.5% (x = 0)、9.1% (x = 1) 和 0.4% (x ≥ 2)。
在组学系统中,我们以 5,000 滴/小时的速度生成大约 30,000 个液滴,并在 6 个聚四氟乙烯管(外径 1.67 毫米,内径 1.07 毫米)中培养 30 天。最终,我们使用 OD 检测模式通过 96 孔板中收集含菌的液滴,通过检测模块筛选液滴,获得 1,057 株目标单克隆菌株。相比之下,通过固体平板培养法,固体琼脂平板的浓度为 3.0 × 103 个细胞/mL,总共 10 个 100 mm 培养皿(每个培养皿含有 100 μL 初始微生物悬浮液)。培养 30 天后,从平板中挑选 536 个菌落。Omics 系统产生的单克隆克隆比实心板法多 1.97 倍。这表明微流控液滴中的单细胞单克隆培养可以有效分离微生物,同时消除菌落之间的竞争抑制。
接下来,我们对所有单克隆菌株进行了 16S 测序分析,并比较了从上述两种方法获得的物种多样性。就科水平的物种多样性而言,相同的 34 个科可以通过两种方法丰富。具体来说,组学系统进一步丰富了四个科: 未分类的拟杆菌科、热放线菌科、伯克霍尔德菌科 Comamonadaceae 和 未分类的肠杆菌科(图 5B),并轻松富集了原始微生物悬浮液中 Family_XI 梭菌、酸性氨基球菌科梭菌、 脱硫核菌科和 肠杆菌科肠杆菌科 的较低丰度(图 5D)。
在属水平上,两种方法都可以富集 74 个微生物属,而 MISS 细胞方法还富集了 13 个微生物属:芽孢杆菌科、海洋芽孢杆菌科、假芽孢杆菌科、热 放线菌科 Kroppenstedtia、嗜钙菌科 Phocea、梭状芽胞杆菌科厌氧菌属、嗜钙菌科 Ezakiella、嗜钙菌科 W5053、XI 未分类、梭状芽孢杆菌科、Comamonadaceae Pelomonas 和两个未分类的微生物物种 (图 5C)。其中,肠 球菌科肠球菌 属和 酸氨基球菌科 Phascolarctobacterium 在原始微生物悬浮液中的丰度较低,使用组学系统很容易富集(图 5E)。正如预期的那样,这两个属分别属于 肠球菌科 和 酸氨基球菌科 ,我们从科分析中观察到相同的结果。总体而言,在科和属水平上,与固体板培养法相比,MISS 细胞培养法的物种富集度分别增加了 30.6% 和 37.9%。这些结果表明,MISS 细胞培养方法为原始微生物悬浮液中低比例存在或生长性能差的菌株提供了更好的生长条件。

图 1: MISS 细胞的结构和基本成分。 (一个) MISS 单元的外部。1. 液滴生成和培养室,2.液滴检测和收集室,3.液滴收集室的照明和 UV 按钮。(B) 液滴生成和培养室的内部。液滴生成、液滴孵育和用于液滴筛选的气泡去除均在该腔室中进行。4. 液滴培养室,5.夹紧阀,用于从微管和液滴产生微流控芯片上夹紧硅胶管;夹紧阀从 1 到 10 依次编号,从左到右,6。气泡去除器放置,7.用于液滴生成和筛选的端口 (O1-O4):油相、样品相和气相通过这些端口连接到 MISS 池。8. 废物端口 (OF),9.用于夹紧气泡去除器液滴出口管的夹紧阀,10.通向液滴检测和收集室的开口,11.样品瓶放置;放置下方有一个磁力搅拌器,可用于控制样品的搅拌速度。(C) 液滴培养室的俯视图。腔室内有一个用于加湿器的进水口。用注射器加入 10 mL 无菌蒸馏水,安装保护罩和微管和液滴产生微流控芯片,将来自微管的硅胶管夹在相应的卡箍阀上,如右图所示。12. 液滴培养室中加湿器的进水口,13.微管和液滴生成微流体芯片。(D) 液滴检测和收集室内部。左图显示了三个孔板放置和处理机械臂在放置之间移动孔板。右图显示了液滴检测和收集模块的放大视图(左图中的红色矩形)。放置 96 个孔板 14.之前,15.期间和 16.液滴收集后。17. 96 孔板搬运机械臂。在液滴检测和收集过程中,机械臂将一个 96 孔板移动到液滴检测模块附近的孔板位置。液滴收集完成后,将孔板移至另一个位置,并继续相同的作,直到该过程完成。18. 液滴检测和收集模块。19. 用于检测光纤的光纤支架。有两种检测纤维(基于 OD 的检测和基于荧光的检测)。当使用一根检测光纤时,另一根光纤插入光纤支架中。20. 检测管。该管已经连接到气泡去除器的液滴出口管。21. OD型和荧光型检测光纤;检测纤维标有各自的名称。22. 光源的光纤。23. 插入检测管的检测插座。24. 用于固定检测光纤的光纤固定螺钉。25. 固定检测管的螺钉。将检测管正确插入检测孔后拧紧螺丝。26. 废液口。27. 用于在收集信号之外排放液滴的废液管。(E) 将微管、液滴产生微流控芯片和气泡去除器安装到相应的位置。四根管路(C1、C2、C4 和 CF)分别连接到 MISS 单元的相应端口。(O1、O2、O4 和 OF)。28. 微管和液滴产生的保护罩微流控芯片。29. 气泡去除器。30. 将液滴入口管连接到气泡去除器。31. 气泡去除器的液滴出口管。32. C3 连接器上的夹紧阀。缩写:MISS = 单细胞微升液滴培养组学系统;OD = 光密度。 请单击此处查看此图的较大版本。
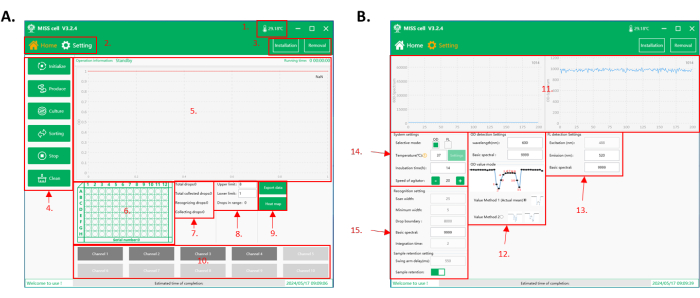
图 2:MISS 单元的作软件界面。 (A) 软件的 home 界面。1.作室内的温度。2. 功能接口。有两个作界面: home 界面和 parameter setting interface。3. 微管和液滴产生微流控芯片安装和拆卸按钮。4. 功能选择:有六个功能可供选择:Initialize、Produce、Culture、Sorting、Stop 和 Clean。5. 过程展示区域:作信息、运行时间和采集的液滴数据都显示在该区域。6. 96 孔板显示区:实时显示当前收集板号和液滴收集孔位置。7. 液滴检测和采集数据展示区。8. 分选上下限设置和液滴计数显示区域。收集的液滴范围根据液滴信号(OD/荧光强度)进行设置。MISS 单元系统对收集的液滴总数进行计数。9. 用于导出采集数据和显示板热图的按钮。10. 液滴管区域。选择要作用于液滴生成、液滴培养、液滴筛选和清洁的管路数量。(B) 软件的参数 设置 界面。11. 实时显示液滴分选过程中检测到的光谱值(OD/荧光强度)。12. OD 检测设置参数,包括检测波长、基本光谱值和 OD 模式。OD 模式有两种:有效平均值(值方法 1),计算液滴光谱值的平均值;以及最小值(值方法 2),它将液滴光谱值的最小值作为信号。13. 荧光检测设置参数,包括激发(设备配置)、发射波长 (350-800 nm) 和基本光谱值。14. 系统设置参数,包括检测模式的选择(OD/荧光强度)、孵育温度、孵育时间和试剂瓶中样品的搅拌速度。15. 液滴识别和样品采集设置的参数。缩写:MISS = 单细胞微升液滴培养组学系统;OD = 光密度。 请单击此处查看此图的较大版本。

图 3:样品瓶和气泡去除器的安装。 (A) MISS 细胞样品瓶。将微生物悬浮液添加到样品瓶中至样品添加位置。立即拧紧盖子并连接快速接头 A 和 B。最后,将样品瓶放置在 MISS 池上的样品瓶中。(B) 样品瓶的安装。快速接头 A 和 B 分别连接到 MISS 单元上的 O3 端口和微管和液滴发生微流控芯片的 C3 接头。(C) 安装气泡去除器。安装气泡去除器时,先从盖子上取下蝴蝶形螺丝,然后再安装装有气泡去除油的瓶子。缩写: MISS = Single-cell Microliter-droplet Culture Omics System 请点击此处查看此图的较大版本。
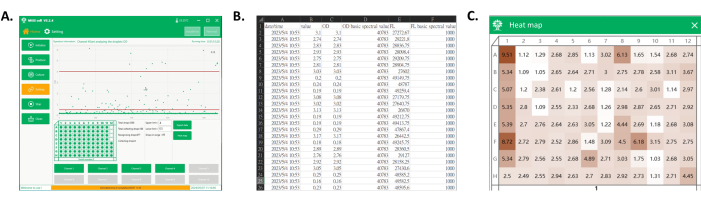
图 4:收集的数据导出和收集的孔板的热图。 (A) 液滴检测和采集过程中软件的主界面。在过程显示区域中,显示每个液滴信号,并将所需范围内的液滴收集到孔板中。(B) 部分导出数据的屏幕截图。导出的数据包括收集的液滴的光谱信号(C 列和 E)及其检测时间(A 列)。(C) 板块热图的屏幕截图。根据来自收集的液滴的信号,对值进行归一化以获得板的热图,稍后可用于根据颜色区分每个克隆的单克隆菌株的培养性能。 请单击此处查看此图的较大版本。
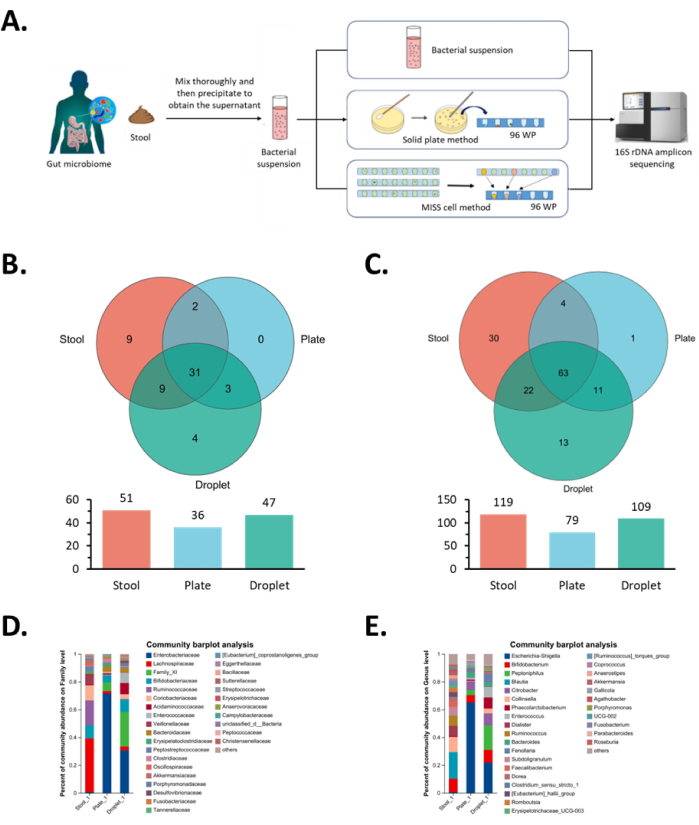
图 5:MISS 细胞中肠道微生物的单克隆分离和培养结果。 (A) 肠道微生物群分离、培养和鉴定的工作流程图。初始微生物悬浮液、实心板法和 MISS 细胞法用于分离和培养相同的肠道微生物群,然后进行测序分析。(B,D)从肠道微生物群的分离和培养中获得的单克隆菌落的家族水平分析,其中 B 显示维恩图分析, D 显示群落组成分析。(C,E)从肠道微生物群的分离和培养中获得的单克隆菌落的属水平分析,其中 C 表示维恩图分析, E 表示群落组成分析。简称:MISS = Single-cell Microliter-droplet Culture Omics System。 请单击此处查看此图的较大版本。
讨论
该方案概述了 MISS 细胞用于自动化和高通量微生物单克隆分离、培养、检测和收集的作。与只能分离和培养 ~20%-30% 的肠道微生物群的传统方法相比 2,12,使用组学系统获得的单克隆克隆数量比从实心板获得的克隆高 1.97 倍。这种比较表明,MISS 细胞在单细胞分离、单克隆培养和筛选方面具有优势。
对于单细胞分离,组学系统根据泊松分布获得单细胞液滴,确保了良好的单克隆性。此外,Omics 系统以高达 5,000 个液滴/小时的速率生成液滴,可实现高通量单细胞分离,同时由于液滴尺寸小,可显著减少试剂消耗。在液滴生成过程中,在微管上使用了流聚焦通道。Omics 系统使用注入泵将油相、样品溶液和气体推入流聚焦通道并形成液滴。用户可以观察液滴是否通过通道成功生成,也可以通过直接查看液滴管来观察。来自微管和液滴生成微流控芯片的硅胶管连接到 10 个液滴管的末端。当一根液滴管中产生足够的液滴(~5,000 个液滴)时,夹紧阀将自动夹紧管的硅胶管,并继续将液滴产生到下一根管中。
对于单克隆菌株培养,液滴中的微生物受益于优异的气体交换性能、高平行培养和高效的传质,为低丰度或难以生长的菌株提供了最佳的生长条件。对于单克隆菌株筛选,组学系统支持基于荧光和 OD 的生物量检测,因此检测可以基于微生物生长性能和目标特定基因或蛋白质的表达水平13。此外,Omics 系统采用重力诱导液滴沉积到孔板中。通过将这种被动筛查方法与摇臂相结合,实现了稳定且高精度的液滴筛查,使其成为一个生物友好型筛查平台。此外,Omics 系统实现了从单个微生物分离到最终克隆筛选的全自动过程,从而减少了人工和时间成本。
鉴于 Omics 系统的性能,它可用于微生物培养组学和微生物诱变筛选,以及其他应用,例如高产菌株选择和关键功能基因的挖掘6。为了获得准确的实验结果,研究人员可以根据要分离、培养和筛选的物种来优化实验条件。首先,在组学系统中单细胞液滴的产生遵循泊松分布,其中低 λ 值确保生成的液滴主要是空的或单细胞的液滴。在我们之前的工作中,我们验证了在组学系统中产生单细胞液滴的最佳微生物浓度范围为 16.8-69.7 个细胞/mL (λ = 0.035-0.145)6。制备样品悬浮液时,在此浓度范围内稀释以提高单克隆性准确性至关重要。其次,在使用组学系统之前,有必要优化微生物生长条件。根据微生物的氧气需求,研究人员可以选择氮气或氧气作为液滴生成的气相。第三,在液滴检测过程中,吸光度或荧光由照射液滴后接收到的光强度决定。因此,由于样品厚度不同,从同一样品中获得的数值在液滴检测和分光光度计测量之间可能会有所不同,正如我们之前的工作14 所观察到的那样。因此,建议在进行实验之前为实验样品建立校准曲线。
此外,我们还在提高组学系统的性能,使其应用于其他物种,如哺乳动物细胞,包括油相与细胞的生物相容性(例如,氟化油具有更高的气体溶解度,更适合哺乳动物细胞培养15,16),两相流速对细胞剪切力的影响17,18,19 和液滴大小的优化13,20。这些改进可以显著促进组学系统在生物医学研究中的应用,例如细胞系开发、单 B 细胞抗体筛选和杂交瘤抗体发现。基于组学系统的三个核心作模块——液滴生成、培养和筛选,研究人员可以根据实验需求选择合适的模块。此外,可以将液滴注射和液滴分离模块添加到本文描述的系统中,以执行试剂添加或建立菌株库。
披露声明
作者没有需要披露的利益冲突。
致谢
本研究得到了广东省重点领域研发项目 (2024B1111130002)、河北省研发项目 (22375503D) 和安徽省工业微生物分子育种工程实验室开放项目 (Grant ELMB-07) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 100 mm Petri dish | Merck KGaA, Darmstadt, Germany | P5731-500EA | For solid plate preparation |
| 30 mL Stool Containers | Boen Healthcare Co., Ltd | 611101 | For collecting the stool samples |
| 37 °C constant temperature incubator | Shanghai Yiheng Technology Co., Ltd. | LRH-150 | Cultivate the solid plate in the incubator |
| 96-well Clear Flat Bottom Polystyrene TC-treated Microplates | Corning | 3599 | For well plate movement detection and droplet collection |
| Agar | Becton, Dickinson and Company | 214010 | For solid plate preparation |
| Air bubble removal oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S-oil | The oil in the air bubble remover during droplet screening |
| Air bubble remover | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-S | Exclude the gas phase between droplets before performing droplet detection and collection |
| Anaerobic bench | Argon and Nitrogen Space Equipment Business Department, Haiyu Town, Changshu City | VGB-4CM | For aseptic operation and UV sterilization under anaerobic condition |
| Autoclave | Puhexi Health and Medical Equipment Co., Ltd. | MLS-830L | For autoclaving BHI medium, EP tube, and so on. |
| Brain Heart Infusion (BHI) Broth | Qingdao High-tech Industrial Park Haibo Biotechnology Co., Ltd | HB8297-1 | Components of the BHI medium The ingredient list: 38.5 g/L BHI Broth in distilled water |
| Cell Spreader | Merck KGaA, Darmstadt, Germany | HS8151 | Inoculate the microbial solution onto the solid plate |
| Centrifuge tube, 15 mL | Beijing Xinhengyan Technology Co., Ltd | HB53397 | For microbial solution preparation |
| Computer | Lenovo | E450 | Software installation and MISS cell control |
| Cryovial | Thermo Fisher | 2.0 mL | For stool preservation |
| Distilled water | Beijing Mreda Technology Co., Ltd. | M306444-100ml | Add into humidifier to keep the humidity in droplet cultivation chamber |
| EP tube | Thermo Fisher | 2.0 mL | For collecting the stool samples |
| Fluorescent inverted microscope | Olympus Life Science (LS) | CKX53 | Check and calculate the microbial concentration |
| Glycerol | GENERAL-REAGENT | G66258A | For strain preservation |
| Hemocytometer | Acmec | AYA0810-1ea | Calculate the microbial concentration |
| KCl | Ambeed | A442876 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| KH2PO4 | MACKLIN | P815661 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| Mesh filter | Anping Jiufeng Wire Mesh Manufacturing Co., Ltd | 200 mesh (0.075 mm), 400 mesh (0.038 mm), 800 mesh (0.018 mm) | Remove undigested food and smaller particulate matter from the stool samples |
| Micro-tubing and droplet generation microfluidic chip | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISC-B2 | For droplet generation and droplet incubation |
| MISS cell oil | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-BOS-B | The oil phase for droplet microfluidics |
| MISS cell software | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell V3.2.4 | Perform experimental operations on the MISS cell instrument |
| Na2HPO4 | Solarbio | D7292 | Components of phosphate buffered saline (PBS solution)The ingredient list: 8 g/L NaCl, 0.2 g KCl, 1.44 g Na2HPO4, 0.24 g KH2PO4 in distilled water |
| NaCl | GENERAL-REAGENT | G81793J | Components of the physiological saline solution The ingredient list: 9 g/L NaCl in distilled water |
| Pipette | eppendorf | 2.5 μL, 10 μL, 100μL, 1000μL | For liquid handling |
| Polytetrafluoroethylene tube | Shenzhen WOER Heat-shrinkable Material Co., Ltd. | 3401000141 | For droplet incubation. This material was already included in micro-tubing and droplet generation microfluidic chip |
| Sample bottle | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-bottle | Sampling of microbial solution |
| Single Cell Microliter-droplet Culture Omics System (MISS cell) | Luoyang TMAXTREE Biotechnology Co., Ltd. | MISS cell-G3f | Performing the microbial monoclonal isolation, cultivation, detection and collection |
| Superspeed Centrifuge | Thermo Fisher | Sorvall Lynx 4000 | Prepare the microbial solution for sequencing |
| Syringe | Jiangsu Zhiyu Medical Instructment Co., Ltd | 10 mL | Draw the distilled water and inject it into the humidifier in droplet cultivation chamber |
| Ultra low temperature refrigerator | SANYO Ultra-low | MDF-U4086S | For strain preservation (-80 °C) |
参考文献
- Hurst, C. J. Isolation and cultivation of bacteria. The structure and function of aquatic microbial communities. , Springer International Publishing. Cham. 313-351 (2019).
- Xu, M. Q., Pan, F., Peng, L. H., Yang, Y. S. Advances in the isolation, cultivation, and identification of gut microbes. Mil Med Res. 11 (1), 34(2024).
- Lattermann, C., Büchs, J. Microscale and miniscale fermentation and screening. Curr Opin Biotechnol. 35, 1-6 (2015).
- Huang, Y., et al. High-throughput microbial culturomics using automation and machine learning. Nat Biotechnol. 41 (10), 1424-1433 (2023).
- Brehm-Stecher Byron, F., Johnson Eric, A. Single-cell microbiology: Tools, technologies, and applications. Microbiol Mol Biol Rev. 68 (3), 538-559 (2004).
- Jian, X., et al. Single-cell microliter-droplet screening system (miss cell): An integrated platform for automated high-throughput microbial monoclonal cultivation and picking. Biotechnol Bioeng. 120 (3), 778-792 (2023).
- Hu, B., et al. One cell at a time: Droplet-based microbial cultivation, screening and sequencing. Mar Life Sci Technol. 3 (2), 169-188 (2021).
- Leygeber, M., et al. Analyzing microbial population heterogeneity-expanding the toolbox of microfluidic single-cell cultivations. J Mol Biol. 431 (23), 4569-4588 (2019).
- He, Z., Wu, H., Yan, X., Liu, W. Recent advances in droplet microfluidics for microbiology. Chinese Chemical Letters. 33 (4), 1729-1742 (2022).
- Kaminski, T. S., Garstecki, P. Controlled droplet microfluidic systems for multistep chemical and biological assays. Chem Soc Rev. 46 (20), 6210-6226 (2017).
- Sender, R., Fuchs, S., Milo, R. Are we really vastly outnumbered? Revisiting the ratio of bacterial to host cells in humans. Cell. 164 (3), 337-340 (2016).
- Simrén, M., et al. Intestinal microbiota in functional bowel disorders: A rome foundation report. Gut. 62 (1), 159-176 (2013).
- Periyannan Rajeswari, P. K., Joensson, H. N., Andersson-Svahn, H. Droplet size influences division of mammalian cell factories in droplet microfluidic cultivation. Electrophoresis. 38 (2), 305-310 (2017).
- Jian, X., et al. Microbial microdroplet culture system (mmc): An integrated platform for automated, high-throughput microbial cultivation and adaptive evolution. Biotechnol Bioeng. 117 (6), 1724-1737 (2020).
- Baret, J. -C. Surfactants in droplet-based microfluidics. Lab on a Chip. 12 (3), 422-433 (2012).
- Kubie, L. S. The solubility of O2, CO2, and N2 in mineral oil and the transfer of carbon dioxide from oil to air. J Biol Chem. 72 (2), 545-548 (1927).
- Poon, C. Measuring the density and viscosity of culture media for optimized computational fluid dynamics analysis of in vitro devices. J Mech Behav Biomed Mater. 126, 105024(2022).
- Yao, J., Lin, F., Kim, H. S., Park, J. The effect of oil viscosity on droplet generation rate and droplet size in a t-junction microfluidic droplet generator. Micromachines. 10 (12), 808(2019).
- Venkateshwarlu, A., Bharti, R. P. Effects of capillary number and flow rates on the hydrodynamics of droplet generation in two-phase cross-flow microfluidic systems. Journal of the Taiwan Institute of Chemical Engineers. 129, 64-79 (2021).
- Nekouei, M., Vanapalli, S. A. Volume-of-fluid simulations in microfluidic t-junction devices: Influence of viscosity ratio on droplet size. Physics of Fluids. 29, 032007(2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。