Method Article
Хирургическая техника введения поясничного спинномозгового катетера у свиней, обеспечивающая непрерывный доступ к текальному мешку в терминальной установке
В этой статье
Резюме
Мы представляем методику введения поясничного спинномозгового катетера на уровне L4-L5 у 3-месячной свиньи датской породы Ландрас в рамках протокола терминального исследования, что позволяет проводить непрерывную инфузию или забор образцов спинномозговой жидкости из текального мешка.
Аннотация
Свиньи все чаще используются в качестве крупной животной модели для фармакологических исследований ЦНС из-за анатомического и физиологического сходства между центральной нервной системой (ЦНС) свиньи и человека. Тем не менее, доступ к спинномозговой жидкости (СМЖ) у крупных пород свиней с помощью обычных методов люмбальной пункции может быть затруднен из-за косой ориентации спинномозговых остистых отростков и ограниченного межслойного пространства. Соответственно, в данной работе подробно описана открытая хирургическая процедура введения поясничного спинального катетера для непрерывного забора СМЖ на уровне L4/L5 у свиней. После позиционирования свиньи и определения анатомических ориентиров делается дорсальный хирургический разрез по средней линии, чтобы обнажить остистые отростки. Продвигая иглу проводника, спинномозговой катетер вводится внутрь текального мешка позвоночного канала, оставляя костные структуры позвоночника нетронутыми. Этот метод обеспечивает непрерывную инфузию или отбор проб из текального мешка свиньи с минимальным кровотечением или утечкой ликвора. Процедура проста, эффективна по времени и воспроизводима в различных экспериментальных установках, предлагая значительный потенциал для различных доклинических исследований, включая фармакокинетические исследования, хирургическое обучение и модели травм спинного мозга.
Введение
Животные модели необходимы, когда этические или практические ограничения не позволяют использовать людей для исследования заболеваний или тестирования хирургических методов. В то время как грызуны широко используются из-за их низкой стоимости, их трансляционная значимость ограничена значительными отличиями от человека1. Свиньи, однако, имеют ряд преимуществ по сравнению с грызунами, включая анатомическое и физиологическое сходство с человеком, особенно в контексте исследований ЦНС. Собачьи модели исторически служили экспериментальными моделями для исследований ЦНС, но этические соображения ограничивали использование собак впоследние годы. Кроме того, сопоставимые размеры органов свиньи с человеческими увеличивают их использование в хирургических исследованиях и процедурном обучении4. ЦНС и позвоночник свиньи очень похожи на человеческие, с сходством в архитектуре и функциональности головного и спинного мозга 1,5,6. Важно отметить, что размеры позвоночного столба и спинномозгового канала у свиней делают их пригодными для проведения различных доклинических исследований 7,8, включая хирургическую процедурную подготовку 9,10, проникновение лекарственных препаратов 11,12,13 и травмы спинного мозга14.
Доступ к спинномозговой жидкости в моделях свиней имеет решающее значение во многих экспериментальных установках. В то время как люмбальная пункция обеспечивает метод однократного отбора образцов спинномозговой жидкости или интратекального введения лекарств, повторные люмбальные пункции непрактичны. Они представляют потенциальный риск внутриспинальных гематом, повреждения нервов и загрязнения ликвора кровью. У пациентов микрокатетеры позвоночника обычно используются для непрерывного дренирования поясничной спинномозговой жидкости при аневризматических субарахноидальных кровоизлияниях и, из-за сходства размеров, должны быть одинаково пригодны для непрерывного отбора проб спинномозговой жидкости у свиней. Тем не менее, видоспецифичные анатомические различия у свиней создают уникальные проблемы для доступа к спинномозговой жидкости. Например, наличие перекрывающихся пластинок, окостенелых связок и обильного эпидурального жирового тканя делает традиционные методы чрескожной люмбальной пункциименее надежными. У гёттингенских минипигов был использован минимально инвазивный чрескожный метод, который позволяет осуществлять серийный отбор проб спинномозговой жидкости16. Этот метод основан на ручной идентификации поясничных межпозвоночных пространств, а сама катетеризация выполняется без визуализации проводника. Однако этот метод менее подходит для более крупных свиней, так как анатомические вариации размера позвонков, остистых отростков и количества эпидуральной жировой ткани затрудняют чрескожную катетеризацию. Таким образом, в более крупных моделях свиней могут потребоваться более инвазивные методы, включающие обнажение позвоночника, чтобы обеспечить надежную установку катетера.
Целью данной рукописи является описание хирургической процедуры введения спинномозгового катетера в текальный мешок свиньи на уровне L4/L5. Процедура включает в себя позиционирование субъекта, планирование хирургического разреза на основе анатомических ориентиров и доступ к задним костным структурам позвоночника перед катетеризацией.
протокол
Субъекты были размещены в соответствии с местными нормами с разрешения Датской инспекции по экспериментам на животных (лицензия No 2020-15-0201-00401). Информация о предмете: Домашняя свинья, самка, весом около 40 кг, возраст 3 месяца.
1. Предмет размещения и предоперационного голодания
- Размещение субъектов в группах по 12 часов светлых/темных циклов в утвержденных загонах для содержания в течение не менее 14 дней до процедуры для обеспечения надлежащей акклиматизации и снижения стресса17.
- Убедитесь, что субъекты находились на режиме отмены пищи в течение 12 часов до запланированной анестезии, чтобы снизить риск срыгивания. Если рацион испытуемых включает люцерну или другие виды сена, это должно быть исключено из рациона за 2-3 дня до процедуры, так как это может задержать время опорожнения желудка ещена 18 дней.
2. Анестезия и мониторинг
- Обезболивайте пациента с помощью внутримышечной инъекции 2 мл/10 кг массы тела смеси кетамина 6,25 мг/мл, золазепама 6,25 мг/мл, тилетамина 6,25 мг/мл, буторфанола 1,25 мг/мл и ксилазина 6,25 мг/мл (Золетил).
- Поместите объект в лежачем положении на спине поверх одеяла с подогревом для поддержания терморегуляции.
- Интубируйте пациента с помощью трубки19 размера 6,5 и проветрите его механическим способом с помощью неувлажненного воздуха, дыхательный объем 8-10 мл/кг и частота дыхания 16-22 вдоха/мин в соответствии с концентрациейСО2 в конце выдоха < 6,0 кПа.
ПРИМЕЧАНИЕ: Показания CO2 подтверждают правильное внутритрахеальное расположение трубки. - Поддерживайте анестезию путем ингаляции 3%-4% испаренного севофлурана18.
- Наносите офтальмологические мази осторожно с обеих сторон, чтобы избежать сухости во время анестезии.
- Обеспечьте достаточную степень анестезии, проверяя расслабление мышц и отсутствие движения глаз каждые10-ю минуту18.
- Введите катетер мочевого пузыря с термометром в мочевой пузырь субъекта через мочеиспускательный канал19 для контроля температуры и сбора мочи в подходящий мешок для катетера.
- Введите периферический венозный катетер в подходящую поверхностную вену уха путем чрескожной пункции и используйте его для непрерывной инфузии физиологического раствора (NaCl, 0,9%), инфузии лекарств и эвтаназии в конце исследования.
- Вставьте катетер бедренной артерии (лист 6 Fr) в правую бедренную артерию через чрескожный прокол. Используйте этот доступ для непрерывного инвазивного мониторинга артериального давления.
- Контролируйте жизненные показатели субъекта каждые 5 минут на протяжении всей процедуры.
ПРИМЕЧАНИЕ: Жизненно важные показатели включают пульс, непрерывное инвазивное артериальное давление, внутрипузырную температуру и концентрациюCO2 в конце выдоха.
3. Позиционирование животного
- Поместите пациента в положение лежа по центру операционного стола. Убедитесь, что позвоночник объекта прямой, чтобы избежать сколиоза.
- Поместите мешок с песком под поясничную часть позвоночника, чтобы увеличить угол между пластинками.
- Сбрейте волосы в месте операции с помощью триммера.
- Нанесите раствор йода на операционное поле центробежными схемами. Повторяйте этот процесс до тех пор, пока не будет покрыто все операционное место.
- Слегка наклоните объект в вертикальное положение.
4. Подготовка хирургического оборудования
- Подготовьте хирургическое оборудование, указанное в Таблице материалов.
5. Определение ключевых анатомических ориентиров
- Определите подвздошный гребень с каждой стороны поясничного отдела позвоночника пациента и следуйте контурам медиально до тех пор, пока не будет определен крестец (Рисунок 1).
- Определите межпозвоночное пространство по средней линии между краниальной стороной крестца и остистым отростком L6.
- Определите остистые отростки L6, L5 и L4 (рис. 1, рис. 2).
6. Обнажение остистых отростков
- Сделайте разрез по средней линии вдоль остистых отростков L4-L6 с помощью скальпеля No 24, разрезая кожу и подкожную клетчатку.
- Используйте монополяр для прижигания небольших кровотечений из поверхностных вен и артериол.
- Вытрите кровь хирургическим болотом и проверьте наличие активного кровотечения; Используйте монополярность соответственно.
ПРИМЕЧАНИЕ: Важно остановить даже незначительные кровотечения, чтобы избежать гематом. - Вставьте хирургический ретрактор и расширьте отверстие.
- Определите надостную связку дорсально по отношению к остистым отросткам.
- Постепенно расширяйте разрез монополярным вдоль латеральной поверхности остистых отростков до тех пор, пока не станет виден примерно 1 см остистых отростков (рис. 3).
ПРИМЕЧАНИЕ: Если человек, выполняющий процедуру, является правшой, следует рассмотреть возможность наблюдения за правой боковой стороной остистого отростка субъекта, чтобы облегчить введение интродьюсера позже. - Определите межостистую связку между L4/L5 (Рисунок 3).
- Проверьте наличие активного кровотечения и приложите монополяр для прижигания соответственно.
7. Доступ к текальному мешку
- Определите межпозвонковое пространство L4/L5 между пластинками остистых отростков путем ручной пальпации.
- Поместите интродьюсер так, чтобы его скос и просвет были ориентированы в краниальном направлении под углом к интраламинарному пространству L4/L5 (рис. 2, рис. 4, рис. 5).
- Убедитесь, что интродьюсер находится под углом 30° по горизонтали и 45° наклона черепа (Рисунок 5).
ПРИМЕЧАНИЕ: Стремитесь к интраламинарному пространству между L4/L5. - Постепенно продвигайте интродьюсер до тех пор, пока не почувствуете легкое сопротивление; Это представляет собой желтую связку.
ПРИМЕЧАНИЕ: Ощущение тупого сопротивления указывает на то, что интродьюсер остановлен остистым отростком. Если это произошло, втяните интродьюсер на 1 см и снова продвигайтесь под несколько другим наклоном. - Надавите сильно, но очень осторожно и продвигайте интродьюсер миллиметр за миллилитром через желтовато-литровую связку до тех пор, пока не почувствуете внезапную потерю сопротивления.
ПРИМЕЧАНИЕ: Если у субъекта проявляются двигательные рефлексы в поясничной мускулатуре или задних конечностях, это происходит из-за прямого контакта с нервными корешками, а не из-за недостаточной анестезии. - Следите за каждым продвижением интродьюсера, снимая троакар, чтобы проверить видимый поток спинномозговой жидкости.
- Подтвердите правильность размещения интродьюсера в спинномозговом канале путем визуального подтверждения потока ликвора из интродьюсера после того, как он проник в желтую связку и, впоследствии, в твердую мозговую оболочку.
ПРИМЕЧАНИЕ: Спонтанное течение спинномозговой жидкости может быть медленным. Подтверждение можно ускорить, заполнив интродьюсер стерильным физиологическим раствором и наблюдая за пульсацией. - Снова вставьте троакар в проводник, чтобы избежать чрезмерной потери спинномозговой жидкости при подготовке катетера.
8. Введение катетера в текальный мешок
- Вставьте проводник в катетер.
- Снимите троакар с интродьюсера.
- Вставьте катетер, содержащий проводник, в проводник до тех пор, пока не почувствуется легкое сопротивление.
- Отмерьте расстояние в 5 см от проводника и установите отметку хирургическим маркером.
- Мягко, но сильно надавливайте по мере того, как катетер продвигается в текальный мешок, пока ранее измеренная отметка не достигнет проводника.
ПРИМЕЧАНИЕ: Из-за медуллярных рефлексов субъект может дергаться/двигаться, несмотря на достаточную анестезию. - Осторожно втяните проводник, удерживая катетер на месте.
ПРИМЕЧАНИЕ: Крепко захватите катетер, как только он станет виден над кожей, чтобы избежать смещения при удалении проводника. - Снимите проводник, крепко удерживая катетер на уровне кожи (рисунок 6).
- Прикрепите к катетеру одноразовый пластиковый шприц объемом 2 мл.
- Подтвердите расположение в спинномозговом канале с помощью аспирации спинномозговой жидкости из катетера.
- В случае отсутствия ликвора в шприце аккуратно втяните катетер на несколько миллиметров для восстановления проходимости.
- Закрепите спинальный катетер на хирургическом ретракторе и коже с помощью ленты, чтобы избежать смещения.
9. Введение липополисахарида
- Введите 400 мкг липополисахарида (ЛПС) E . coli (OH:143) в центральный венозный слой.
- Запустите таймер.
10. Отбор проб спинномозговой жидкости
- Получайте образцы спинномозговой жидкости ежечасно в течение следующих 24 часов для измерения общего количества лейкоцитов, ликвора-альбумина и IgG ликвора. Наберите максимум 0,5 мл спинномозговой жидкости в каждом образце.
11. Эвтаназия
- Введение болюса пентобарбитала (50 мг/кг) через периферический венозный катетер.
- Наблюдайте за пульсом, артериальным давлением и кривыми концентрацииCO2 в конце выдоха на респираторе в качестве подтверждения остановки сердца.
Результаты
Положение свиньи в положении лежа на животе оптимизирует хирургический доступ к поясничным позвонкам. Использование поддерживающих мешков с песком увеличивает угол между соседними поясничными остистыми отростками, тем самым улучшая доступ к позвоночному каналу.
Целью настоящего исследования было изучение воспалительной реакции в зоне ликвора после внутрижелудочковой инокуляции липополисахаридом E. coli . В общей сложности 10 свиней прошли эту процедуру, и последующие анализы ликвора показали увеличение среднего общего лейкоцита ликвора с 30 x 106/л (диапазон 17-39) через 0 ч до 19 720 x 106/л (11 353-30 546) через 12 ч и увеличение альбумина ликвора 0,05 г/л (0,03-0,07) через 0 ч до 0,15 г/л (0,14-0,17) через 12 ч, тем самым подтвердив воспаление головного мозга и то, что все спинномозговые катетеры были установлены правильно с использованием представленную методику (рисунок 7). В настоящем исследовании ключевые анатомические ориентиры, в частности, гребни подвздошной кости, крестец и остистые отростки L4, L5 и L6, были использованы для точного определения средней линии позвонка до разреза (Рисунок 1). После разреза через кожу и подкожные ткани были обнажены надостная связка и остистые отростки L4, L5 и L6, что подтвердило анатомическую среднюю линию (рис. 2). Продолжительное рассечение и обнажение пластинок остистых отростков позволило выявить межпозвонковые пространства между L4/L5, L5/L6 и L6/S1 путем ручной пальпации. Эти пространства были особенно подходящими в качестве анатомических ориентиров из-за их близости к нижележащему позвоночному каналу (Рисунок 3).
Постепенное введение интродьюсера под углом 30° по горизонтали и 45° по наклону черепа привело к успешному вхождению в текальный мешок, что подтверждается видимым спонтанным потоком ликвора. Обеспечение скоса интродьюсера краниально позволило обеспечить плавное введение катетера после катетеризации. После удаления проводника правильное размещение катетера было подтверждено аспирацией спинномозговой жидкости. Общий успех процедуры определялся следующими критериями: (а) во время разреза не произошло большого кровотечения, (б) интродьюсер оставался свободным от крови при входе в спинномозговой канал, (в) отсутствовала утечка ликвора в операционном поле, и (г) спинномозговая жидкость могла многократно аспирироваться из катетера.
На начальных этапах разреза следует ожидать незначительных кровоизлияний из-за хорошо васкуляризированного характера ткани. Часто встречались более мелкие артерии, что подчеркивает необходимость прижигания. Хирургический ретрактор также использовался для оказания давления и достижения гемостаза. Во время более глубоких разрезов иногда встречались небольшие межпозвоночные вены, которые было трудно контролировать из-за их расположения. Поскольку в этой области трудно оказывать давление или прижигать, тщательная хирургическая техника имеет решающее значение, чтобы избежать такого венозного кровотечения. Поскольку катетер предназначался для длительной установки, было важно предотвратить кровотечение, чтобы избежать образования гематомы. В случае возникновения такого венозного кровотечения гемостаз может быть достигнут с помощью котоноидов, наносимых с локализованным прямым давлением.
Целостность эпидурального пространства спинномозгового канала оценивали путем осмотра тканей, окружающих катетер, на предмет утечки ликвора. Любая утечка будет проявляться в виде скопления жидкости, похожей на воду, в ткани. В этом случае было подтверждено, что твердая мозговая оболочка, окружающая катетер, не повреждена, так как во время или после процедуры не наблюдалось утечки спинномозговой оболочки (Рисунок 6). Наконец, последовательная аспирация спинномозговой жидкости через катетер дополнительно подтвердила правильное размещение в поясничном бачке текального мешка.
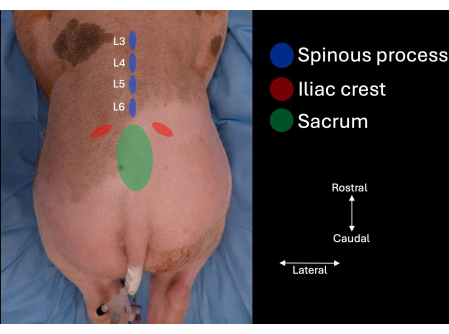
Рисунок 1: Изображение поясничного отдела позвоночника свиньи с анатомическими ориентирами, выявленными при ручной пальпации. Крестец, подвздошные гребни и остистые отростки L4, L5 и L6. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
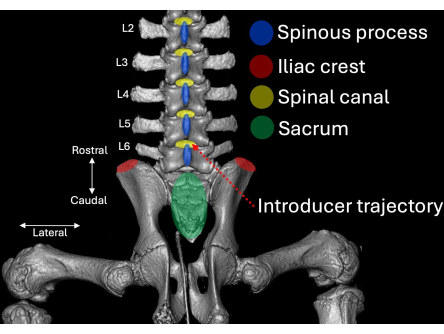
Рисунок 2: Трехмерная компьютерная томография поясничного отдела позвоночника свиньи, визуализированная с задней точки зрения. Анатомические ориентиры выделены синим цветом (остистые отростки), красным (гребни подвздошной кости) и зеленым (крестец) с их соответствующим отношением к позвоночному каналу (желтый). Путь введения интродьюсера выделен пунктирным красным цветом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
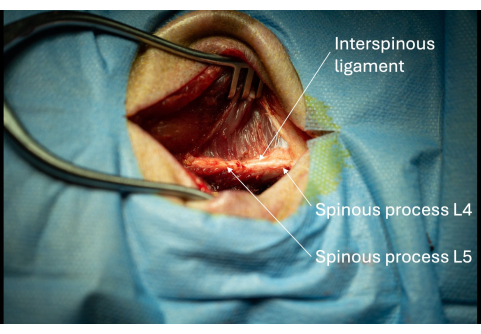
Рисунок 3: Изображение обнаженных остистых отростков L5 и L6 с прилегающей межостистой связкой, видимых с боковой перспективы. Наличие этих остистых отростков подтверждает правильное анатомическое расположение операционного отверстия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
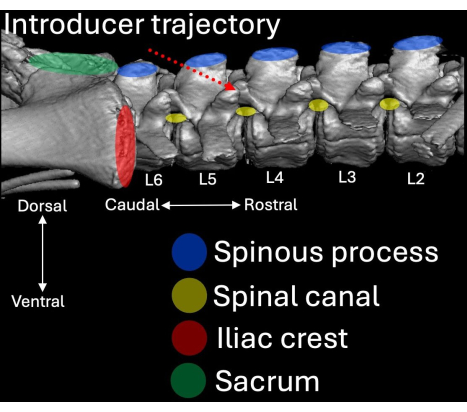
Рисунок 4: Трехмерная компьютерная томография поясничного отдела позвоночника свиньи, визуализированная с боковой точки зрения. Анатомические ориентиры выделены синим цветом (остистые отростки), красным (гребни подвздошной кости) и зеленым (крестец) с их соответствующим отношением к позвоночному каналу (желтый). Путь введения интродьюсера выделен пунктирным красным цветом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
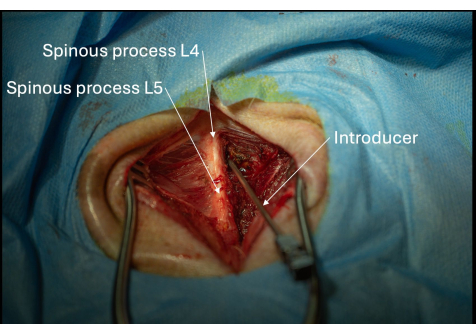
Рисунок 5: Изображение правильного расположения интродьюсера под углом к межслойному пространству L4/L5, наблюдаемое с заднебоковой перспективы. Интродьюсер должен постепенно продвигаться миллиметр за миллиметром до тех пор, пока не будет проникнуть в желтую связку. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
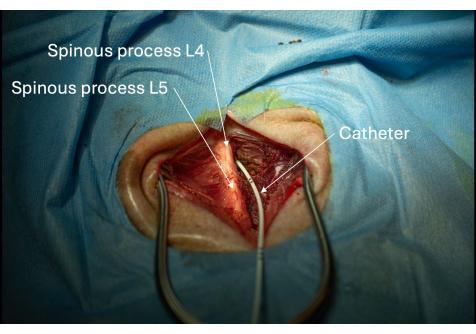
Рисунок 6: Изображение катетера, введенного в спинномозговой канал через межпластинчатое пространство L4/L5. Размещение катетера в спинномозговом канале подтверждается, если спинномозговая жидкость может быть аспирирована повторно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 7: Графики временной концентрации общего количества лейкоцитов в спинномозговой жидкости (оранжевый) и альбумина в спинномозговой жидкости (синий) после внутрижелудочковой инокуляции ЛПС, измеренные через 0 ч, 12 ч и 24 ч. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Продемонстрированная процедура введения поясничного катетера для непрерывного отбора проб спинномозговой жидкости у свиней включает в себя несколько важных этапов. Во-первых, необходимо обнажить правильный уровень позвонков, чтобы обеспечить оптимальные условия для успешной катетеризации. Спинной мозг свиньи простирается дальше каудально по сравнению с человеком, достигая уровня S2-S315, в отличие от мозгового мозга человека, который заканчивается на уровне L1-L220. Следовательно, доступ к поясничному резервуару для отбора проб спинномозговой жидкости у свиней затруднен, особенно на более высоких уровнях поясничного отдела, где спинной мозг занимает большую часть интратекального пространства. По нашему опыту, уровни L4/L5 или L5/L6 являются подходящими участками для катетеризации, поскольку спинной мозг занимает несколько меньшую часть спинномозгового канала в этих сегментах21.
Представленный здесь хирургический подход контрастирует с менее инвазивными методами, такими как минимально инвазивная модель сбора ликвора, разработанная Bergadano et al., в которой использовалась чрескожная люмбальная пункция у геттингенских минипигов16. В их методике межпозвоночные пространства поясничного отдела позвоночника определяются с помощью ручной пальпации и нацелены на введение интродьюсера под углом 45° по горизонтали. Подтверждение правильности размещения интродьюсера в эпидуральном пространстве основано на восприятии потери сопротивления во время катетеризации. В то время как минимально инвазивные методы имеют преимущество в виде уменьшения повреждения тканей и более быстрого восстановления, они также имеют потенциальные ограничения для более крупных пород свиней, таких как датский ландрас. Например, Pleticha et al. выявили несколько анатомических особенностей, таких как перекрывающиеся пластинки, окостенелые связки и обилие эпидурального жира у крупных свиней, которые делают люмбальную пункцию более ненадежнойбез визуализационного контроля. Следовательно, могут потребоваться многократные попытки пункции, что увеличивает риск кровотечения, утечки ликвора и загрязнения образцов ликвора в крови.
Для сравнения, Pleticha et al. успешно применили технику латеральной люмбальной пункции под контролем КТ для преодоления этих анатомических проблем, достигнув точного интратекального доступа у крупных свиней15. Аргумент в пользу использования визуализации заключается в том, что ручная пальпация не может идентифицировать анатомические ориентиры с необходимой воспроизводимостью. Следовательно, для точной анатомической идентификации действительно необходимы визуальный контроль (например, ультразвуковое исследование или рентгеноскопия)15,22. Несмотря на то, что этот латеральный метод, представленный Pleticha et al., предлагает значительные преимущества в учреждениях, оснащенных возможностями визуализации, он может быть невозможен во всех лабораторных условиях из-за потребности в оборудовании для компьютерной томографии. Описанный здесь хирургический метод, хотя и является более инвазивным, представляет собой практическую альтернативу, которая может быть легко реализована в лабораториях без доступа к компьютерной томографии. Обнажая остистые отростки и межпозвоночные пространства, такой подход позволяет получить прямое визуальное подтверждение вхождения катетеров в поясничный отдел, снижая потребность в повторных попытках и сводя к минимуму осложнения.
Еще одним важным фактором является повреждение тканей и послеоперационные осложнения, связанные с любым открытым хирургическим доступом. В то время как описанный здесь метод обеспечивает превосходную визуализацию позвоночника и надежную установку катетера, он также вызывает большее разрушение тканей по сравнению с минимально инвазивными методами. Это может ограничить его применение в исследованиях выживаемости, где сохранение целостности мышц и снижение риска инфекции имеют решающее значение. Однако при тщательной хирургической технике и использовании монополярного прижигания для контроля кровотечения риск послеоперационных осложнений может быть сведен к минимуму. Несмотря на то, что представленный метод был использован в исследовании невыживаемости воспаления головного мозга после внутрижелудочковой инокуляции липополисахарида E. coli у 10 свиней, мы считаем, что метод может быть адаптирован для исследований выживаемости, поскольку фасция и кожа могут быть сшиты вокруг установленного катетера. В потенциальном исследовании выживаемости крайне важно наблюдать за субъектом на предмет признаков неврологического дефицита или инфекций в послеоперационной фазе.
В целом, представленный здесь хирургический метод имеет ряд преимуществ по сравнению с менее инвазивными методами. Обнажая большую часть позвоночника, этот подход позволяет точно разместить интродьюсер и катетер с первой попытки, тем самым снижая риск загрязнения спинномозговой жидкости кровью и обеспечивая последовательный забор образцов спинномозговой жидкости. По нашему опыту, этот метод позволяет надежно собирать ликвор со скоростью около 0,5 мл/ч в течение 24 часов. Если поток ликвора уменьшается, незначительное втягивание катетера на несколько миллиметров часто восстанавливает проходимость. Кроме того, прямое наблюдение за операционным полем позволяет обнаружить потенциальные осложнения, такие как утечка ликвора. Этот метод также обеспечивает гибкость для будущих исследований, которые могут потребовать имплантации нескольких катетеров или дополнительных инструментов.
В заключение следует отметить, что представленный метод является простым и воспроизводимым, с существенным применением в различных будущих моделях свиней, имеющих отношение к спинному мозгу свиней, особенно в моделях, требующих обширной выборки спинномозговой жидкости или инструментализации спинномозгового канала свиней.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Авторы хотели бы выразить искреннюю благодарность за опыт, которым поделились сотрудники биомедицинской лаборатории Университетской больницы Ольборга, Дания.
Материалы
| Name | Company | Catalog Number | Comments |
| Adjustable operating table | N/A | N/A | |
| Bair Hugger heater | 3M | B5005241003 | |
| Bair Hugger heating blanket | 3M | B5005241003 | |
| Endotracheal tube size 6.5 | DVMed | DVM-107860 | Cuffed endotracheal tube |
| Euthasol Vet | Dechra Veterinary Products A/S | 380019 | phentobarbital for euthanazia, 400mg/mL |
| Foley Catheter 12F | Becton, Dickinson and Company | D175812E | Catheter with in-built thermosensor |
| Intravenous peripheral catheter | Avantor | BDAM381344 | Size G18 |
| Intravenous sheath | Coris Avanti | Avanti Cordis Femoral Sheath 6F | |
| Monopolar, ForceTriad System | Medtronic | ||
| Plastic Syringe, 2 mL | Becton, Dickinson and Company | 300928 | |
| Primus respirator | Dräger | Respirator with in-built vaporiser for supplementary Sevofluran anesthisa | |
| Self-retaining retractor | World Precission Instruments | 501722 | Weitlander retractor, self-retaining, 14 cm blunt |
| Silicone Lumbar Catheter incl. Introducer | Integra | NL8508330 | |
| Sterile Saline | Fresnius Kabi | 805541 | 1000 mL |
| Sterile surgical swaps | |||
| Surgical scalpel no 24 | Swann Morton | 5.03396E+12 | Swann Morton Sterile Disposable Scalpel No. 24 |
| Zoletil Vet | Virbac | Medical mixture for induction of anesthesia |
Ссылки
- Meurens, F., Summerfield, A., Nauwynck, H., Saif, L., Gerdts, V. The pig: A model for human infectious diseases. Trends Microbiol. 20 (1), 50-57 (2012).
- Bassols, A., et al. The pig as an animal model for human pathologies: A proteomics perspective. Proteomics Clin Appl. 8 (9-10), 715-731 (2014).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Lunney, J. K., et al. Importance of the pig as a human biomedical model. Sci Transl Med. 13 (621), eabd5758 (2021).
- Lind, N. M., et al. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31 (5), 728-751 (2007).
- Hoffe, B., Holahan, M. R. The use of pigs as a translational model for studying neurodegenerative diseases. Front Physiol. 10, 838 (2019).
- Toossi, A., et al. Comparative neuroanatomy of the lumbosacral spinal cord of the rat, cat, pig, monkey, and human. Sci Rep. 11 (1), 1955 (1955).
- Busscher, I., Ploegmakers, J. J. W., Verkerke, G. J., Veldhuizen, A. G. Comparative anatomical dimensions of the complete human and porcine spine. Eur Spine J. 19 (7), 1104-1114 (2010).
- Säteri, T., et al. Ex vivo porcine models are valid for testing and training microsurgical lumbar decompression techniques. World Neurosurg. 155, e64-e74 (2021).
- Yamanouchi, K., et al. Validation of a surgical drill with a haptic interface in spine surgery. Sci Rep. 13 (1), 598 (2023).
- Hanberg, P., Bue, M., Birke Sørensen, H., Søballe, K., Tøttrup, M. Pharmacokinetics of single-dose cefuroxime in porcine intervertebral disc and vertebral cancellous bone determined by microdialysis. Spine J. 16 (3), 432-438 (2016).
- Hvistendahl, M. A., et al. Cefuroxime concentrations in the anterior and posterior column of the lumbar spine - an experimental porcine study. Spine J. 22 (9), 1434-1441 (2022).
- Mariager, T., et al. Continuous evaluation of single-dose moxifloxacin concentrations in brain extracellular fluid, cerebrospinal fluid, and plasma: a novel porcine model. J Antimicrob Chemother. 79 (6), 1313-1319 (2024).
- Thygesen, M. M., et al. A 72-h sedated porcine model of traumatic spinal cord injury. Brain Spine. 4, 102813 (2024).
- Pleticha, J., et al. Pig lumbar spine anatomy and imaging-guided lateral lumbar puncture: A new large animal model for intrathecal drug delivery. J Neurosci Methods. 216 (1), 10-15 (2013).
- Bergadano, A., et al. A minimally-invasive serial cerebrospinal fluid sampling model in conscious Göttingen minipigs. J Biol Methods. 6 (1), e107 (2019).
- Maxwell, A. R., Castell, N. J., Brockhurst, J. K., Hutchinson, E. K., Izzi, J. M. Determination of an acclimation period for swine in biomedical research. J Am Assoc Lab Anim Sci. 63 (6), 651-654 (2024).
- Costea, R., Ene, I., Pavel, R. Pig Sedation and anesthesia for medical research. Animals. 13 (24), 3807 (2023).
- Ettrup, K. S., et al. Basic surgical techniques in the göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. J Vis Exp. 52, e2652 (2011).
- Grogan, J. P., Daniels, D. L., Williams, A. L., Rauschning, W., Haughton, V. M. The normal conus medullaris: CT criteria for recognition. Radiology. 151 (3), 661-664 (1984).
- Bessen, M. A., et al. Characterising spinal cerebrospinal fluid flow in the pig with phase-contrast magnetic resonance imaging. Fluids Barriers CNS. 20 (1), 5 (2023).
- Weber-Levine, C., et al. Porcine model of spinal cord injury: A systematic review. Neurotrauma Rep. 3 (1), 352-368 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены