Method Article
Operationstechnik für das Einführen eines lumbalen Spinalkatheters bei Schweinen, die einen kontinuierlichen Zugang zum thekalen Sack in einem terminalen Setup ermöglichen
In diesem Artikel
Zusammenfassung
Wir stellen eine Technik zum Einführen eines lumbalen Wirbelsäulenkatheters auf Höhe L4-L5 bei einem 3 Monate alten dänischen Landrasseschwein als Teil eines terminalen Forschungsprotokolls vor, das eine kontinuierliche Infusions- oder Liquorentnahme aus dem Thekalsack ermöglicht.
Zusammenfassung
Schweine werden aufgrund der anatomischen und physiologischen Ähnlichkeiten zwischen dem zentralen Nervensystem (ZNS) des Schweins und des Menschen zunehmend als Großtiermodell für die pharmakologische ZNS-Forschung verwendet. Der Zugang zum Liquor cerebrospinalis (CSF) bei größeren Schweinerassen durch konventionelle Lumbalpunktionstechniken kann jedoch aufgrund einer schrägen Ausrichtung der spinalen Dornfortsätze und eines begrenzten interlaminaren Raums eine Herausforderung darstellen. Dementsprechend wird in dieser Arbeit ein offenes chirurgisches Verfahren zum Einführen eines lumbalen Spinalkatheters zur kontinuierlichen Liquorentnahme auf L4/L5-Ebene bei Schweinen ausführlich beschrieben. Nach der Positionierung des Schweins und der Identifizierung der anatomischen Orientierungspunkte wird ein chirurgischer Schnitt in der dorsalen Mittellinie vorgenommen, um die Dornfortsätze freizulegen. Durch das Vorschieben der Einführnadel wird der Wirbelsäulenkatheter in den Thekalsack des Wirbelkanals eingeführt, wobei die Knochenstrukturen der Wirbelsäule intakt bleiben. Diese Methode ermöglicht eine kontinuierliche Infusion in den Thekalsack des Schweins oder eine Probenahme aus dem Schweinesack mit minimaler Blutung oder Liquorleckage. Das Verfahren ist einfach, zeiteffizient und über verschiedene Versuchsaufbauten hinweg reproduzierbar und bietet ein erhebliches Potenzial für verschiedene präklinische Studien, einschließlich pharmakokinetischer Forschung, chirurgischer Ausbildung und Modellen für Rückenmarksverletzungen.
Einleitung
Tiermodelle sind unerlässlich, wenn ethische oder praktische Einschränkungen den Einsatz von Menschen zur Erforschung von Krankheiten oder zur Erprobung chirurgischer Methoden verhindern. Während Nagetiere aufgrund ihrer geringen Kosten häufig verwendet werden, ist ihre translationale Relevanz durch signifikante Unterschiede zum Menschen begrenzt1. Schweine bieten jedoch einige Vorteile im Vergleich zu Nagetieren, darunter anatomische und physiologische Ähnlichkeiten mit dem Menschen - insbesondere im Rahmen der ZNS-Forschung 1,2. Hundemodelle dienten in der Vergangenheit als experimentelle Modelle für die ZNS-Forschung, aber ethische Überlegungen haben den Einsatz von Hunden in den letzten Jahren eingeschränkt3. Darüber hinaus verbessert die vergleichbare Größe von Schweineorganen mit denen des Menschen deren Einsatz in der chirurgischen Forschung und in der verfahrenstechnischen Ausbildung4. Das ZNS und die Wirbelsäule des Schweins ähneln weitgehend denen des Menschen, mit Ähnlichkeiten in der Architektur und Funktionalität des Gehirns und des Rückenmarks 1,5,6. Wichtig ist, dass die Abmessungen der Wirbelsäule und des Spinalkanals bei Schweinen sie für verschiedene präklinische Studien geeignet machen 7,8, einschließlich chirurgischer Verfahrensschulungen 9,10, Medikamentenpenetration 11,12,13 und Rückenmarksverletzungen14.
Der Zugang zum Liquor in Schweinemodellen ist in vielen Versuchsaufbauten von entscheidender Bedeutung. Während die Lumbalpunktion eine Methode für die singuläre Liquorprobenahme oder die intrathekale Verabreichung von Arzneimitteln darstellt, sind wiederholte Lumbalpunktionen unpraktisch. Sie stellen ein potenzielles Risiko für intraspinale Hämatome, Nervenschäden und Liquorkontamination mit Blut dar. Bei menschlichen Patienten werden spinale Mikrokatheter häufig für die kontinuierliche lumbale Liquordrainage bei aneurismalen Subarachnoidalblutungen verwendet und sollten aufgrund von Größenähnlichkeiten ebenso für die kontinuierliche Liquorprobenahme bei Schweinen geeignet sein. Speziesspezifische anatomische Unterschiede bei Schweinen stellen jedoch einzigartige Herausforderungen für den Zugang zum Liquor dar. Zum Beispiel macht das Vorhandensein von überlappenden Laminae, verknöcherten Bändern und reichlich vorhandenem epiduralem Fettgewebe herkömmliche perkutane Lumbalpunktionstechniken weniger zuverlässig15. Bei Göttinger Minischweinen wurde eine minimalinvasive perkutane Methode eingesetzt, die eine serielle Liquorprobenahme ermöglicht16. Diese Methode beruht auf der manuellen Identifizierung der lumbalen Zwischenwirbelräume, und die Katheterisierung selbst wird ohne Visualisierung des Einführgeräts durchgeführt. Für größere Schweine ist diese Technik jedoch weniger geeignet, da anatomische Unterschiede in der Wirbelgröße, den Dornfortsätzen und der Menge an epiduralem Fettgewebe die perkutane Katheterisierung erschweren15. Daher können bei größeren Schweinemodellen invasivere Methoden, bei denen die Wirbelsäule freigelegt wird, erforderlich sein, um eine zuverlässige Katheterplatzierung zu gewährleisten.
Der Zweck dieses Manuskripts ist es, das chirurgische Verfahren zum Einführen eines Spinalkatheters in den Thekalsack des Schweins auf Höhe L4/L5 zu beschreiben. Das Verfahren umfasst die Positionierung des Probanden, die Planung des chirurgischen Schnitts auf der Grundlage anatomischer Orientierungspunkte und den Zugang zu den hinteren Knochenstrukturen der Wirbelsäule vor der Katheterisierung.
Protokoll
Die Probanden wurden in Übereinstimmung mit den örtlichen Vorschriften und mit Genehmigung der dänischen Tierversuchsinspektion (Lizenznummer 2020-15-0201-00401) untergebracht. Angaben zum Thema: Hausschwein, weiblich, ca. 40 kg, 3 Monate alt.
1. Subjekt-Housing und präoperatives Fasten
- Untertanen in Gruppen bei 12 h Hell-Dunkel-Zyklen in zugelassenen Gehegen für mindestens 14 Tage vor dem Eingriff, um eine angemessene Akklimatisation zu gewährleisten und Stress abzubauen17.
- Stellen Sie sicher, dass die Probanden 12 Stunden vor der geplanten Anästhesie eine Nahrungsentzugskur erhalten haben, um das Risiko eines Aufstoßens zu verringern. Wenn die Ernährung der Probanden Luzerne oder andere Arten von Heu enthält, muss dies 2-3 Tage vor dem Eingriff von der Ernährung ausgeschlossen werden, da dies die Magenentleerungszeit weiter verzögern kann18.
2. Anästhesie und Überwachung
- Betäuben Sie den Probanden mit einer intramuskulären Injektion von 2 ml/10 kg Körpergewicht einer Mischung aus Ketamin 6,25 mg/ml, Zolazepam 6,25 mg/ml, Tiletamin 6,25 mg/ml, Butorphanol 1,25 mg/ml und Xylazin 6,25 mg/ml (Zoletil).
- Legen Sie das Motiv in Rückenlage auf eine Heizdecke, um die Wärmeregulierung zu unterstützen.
- Intubieren Sie den Probanden mit einem Schlauch der Größe6,5 19 und beatmen Sie ihn mechanisch mit nicht befeuchteter Luft, einem Atemzugvolumen von 8-10 ml/kg und einer Atemfrequenz von 16-22 Atemzügen/min entsprechend den exspiratorischen endtidalen CO2 -Konzentrationen < 6,0 kPa.
HINWEIS: Die CO2 -Messwerte bestätigen die korrekte intratracheale Position des Schlauchs. - Halten Sie die Anästhesie durch Inhalation von 3%-4% verdampftem Sevofluran18 aufrecht.
- Tragen Sie Augensalben vorsichtig beidseitig auf, um Trockenheit während der Anästhesie zu vermeiden.
- Stellen Sie einen ausreichenden Grad der Anästhesie sicher, indem Sie alle 10Minuten 18 auf Muskelentspannung und Abwesenheit von Lidbewegungen überprüfen.
- Führen Sie einen Blasenkatheter mit einem Thermometer durch die Harnröhre19 in die Blase des Probanden ein, um die Temperatur zu überwachen und den Urin in einem geeigneten Katheterbeutel aufzufangen.
- Legen Sie einen peripheren Venenkatheter durch perkutane Punktion in eine geeignete oberflächliche Ohrvene an und verwenden Sie ihn für die kontinuierliche Kochsalzinfusion (NaCl, 0,9 %), die Arzneimittelinfusion und die Euthanasie am Ende der Studie.
- Legen Sie einen Katheter der Oberschenkelarterie (6 Fr Blatt) durch eine perkutane Punktion in die rechte Oberschenkelarterie ein. Nutzen Sie diesen Zugang für eine kontinuierliche invasive Blutdrucküberwachung.
- Überwachen Sie die Vitalparameter des Probanden während des gesamten Eingriffs alle 5 Minuten.
HINWEIS: Zu den Vitalparametern gehören Puls, kontinuierlicher invasiver arterieller Blutdruck, intravesikale Temperatur und endtidale CO2 -Konzentration.
3. Positionierung der Tiere
- Legen Sie das Subjekt in Bauchlage mittig auf den Operationstisch. Stellen Sie sicher, dass die Wirbelsäule des Probanden gerade ist, um Skoliose zu vermeiden.
- Lege einen Sandsack unter die Lendenwirbelsäule, um die Winkelung zwischen den Laminae zu erhöhen.
- Rasieren Sie die Haare an der Operationsstelle mit einem Trimmer.
- Tragen Sie Jodlösung in Zentrifugalmustern auf die Operationsstelle auf. Wiederholen Sie diesen Vorgang, bis das gesamte Operationsfeld bedeckt ist.
- Neigen Sie das Motiv leicht in eine aufrechte Position.
4. Vorbereitung der chirurgischen Ausrüstung
- Bereiten Sie die in der Materialtabelle aufgeführten chirurgischen Geräte vor.
5. Identifizierung der wichtigsten anatomischen Orientierungspunkte
- Identifizieren Sie den Beckenkamm auf jeder Seite der Lendenwirbelsäule des Probanden und folgen Sie den Konturen medial, bis das Kreuzbein identifiziert ist (Abbildung 1).
- Identifizieren Sie den Zwischenwirbelraum in der Mittellinie zwischen dem kranialen Aspekt des Kreuzbeins und dem Dornfortsatz von L6.
- Identifizieren Sie die Dornfortsätze von L6, L5 und L4 (Abbildung 1, Abbildung 2).
6. Freilegung der Dornfortsätze
- Mit dem Skalpell Nr. 24 einen Mittellinienschnitt entlang der Dornfortsätze L4-L6 vornehmen und dabei die Haut und die Unterhaut durchschneiden.
- Verwenden Sie ein Monopolar, um kleine Blutungen aus oberflächlichen Venen und Arteriolen zu kauterisieren.
- Wischen Sie das Blut mit einem chirurgischen Sumpf ab und prüfen Sie, ob es aktive Blutungen gibt. Verwenden Sie den Monopolar entsprechend.
HINWEIS: Es ist wichtig, auch kleinere Blutungen zu stoppen, um Hämatome zu vermeiden. - Setzen Sie den chirurgischen Retraktor ein und erweitern Sie die Öffnung.
- Identifizieren Sie das supraspinöse Band dorsal zu den Dornfortsätzen.
- Erweitern Sie die Inzision allmählich mit dem Monopolar entlang der lateralen Seite der Dornfortsätze, bis etwa 1 cm der Dornfortsätze sichtbar ist (Abbildung 3).
HINWEIS: Wenn die Person, die den Eingriff durchführt, Rechtshänder ist, sollte in Betracht gezogen werden, dem rechten lateralen Aspekt des Dornfortsatzes des Probanden zu folgen, um das spätere Einführen des Einführgeräts zu erleichtern. - Identifizieren Sie das interspinöse Band zwischen L4/L5 (Abbildung 3).
- Prüfen Sie, ob aktive Blutungen vorliegen, und wenden Sie das Monopolar zum Kauterisieren entsprechend an.
7. Zugang zum Thekalsack
- Identifizieren Sie den L4/L5-Zwischenwirbelraum zwischen den Lamina der Dornfortsätze durch manuelles Abtasten.
- Platzieren Sie den Introducer mit Abschrägung und Lumen, die in kranialer Richtung zum intralaminaren Raum L4/L5 ausgerichtet sind (Abbildung 2, Abbildung 4, Abbildung 5).
- Stellen Sie sicher, dass der Einführkopf in einer horizontalen Neigung von 30° und einer Schädelneigung von 45° gehalten wird (Abbildung 5).
HINWEIS: Zielen Sie auf den intralaminaren Raum zwischen L4/L5. - Schieben Sie den Einführhebel allmählich vor, bis ein sanfter Widerstand zu spüren ist. Dies stellt das Ligamentum flavum dar.
HINWEIS: Das Gefühl eines stumpfen Widerstands deutet darauf hin, dass der Einführer durch den Dornfortsatz gestoppt wird. Ziehen Sie in diesem Fall den Einführhebel 1 cm ein und schieben Sie ihn wieder in einer etwas anderen Neigung vor. - Üben Sie einen festen, aber sehr vorsichtigen Druck aus und schieben Sie den Einführkopf Millimeter für Milliliter durch das Flavumband, bis ein plötzlicher Widerstandsverlust zu spüren ist.
HINWEIS: Wenn der Proband motorische Reflexe in der Lendenwirbelmuskulatur oder den Hinterbeinen zeigt, ist dies auf den direkten Kontakt mit den Nervenwurzeln und nicht auf eine unzureichende Anästhesie zurückzuführen. - Verfolgen Sie jeden Vorschub des Einführgeräts, indem Sie den Trokar entfernen, um zu prüfen, ob der Liquorfluss sichtbar ist.
- Bestätigen Sie die korrekte Platzierung des Einführers im Spinalkanal durch visuelle Bestätigung des Liquorflusses aus dem Einführzahn, nachdem er in das Ligamentum flavum und anschließend in die Dura mater eingedrungen ist.
HINWEIS: Der spontane Fluss des Liquors kann langsam sein. Die Bestätigung kann beschleunigt werden, indem der Einführkopf mit steriler Kochsalzlösung gefüllt und auf Pulsation beobachtet wird. - Setzen Sie den Trokar wieder in den Einführer ein, um einen übermäßigen Liquorverlust bei der Vorbereitung des Katheters zu vermeiden.
8. Einführen des Katheters in den Thekalsack
- Führen Sie den Führungsdraht in den Katheter ein.
- Entfernen Sie den Trokar aus der Einführdose.
- Führen Sie den Katheter mit dem Führungsdraht in die Einführhilfe ein, bis ein sanfter Widerstand zu spüren ist.
- Messen Sie 5 cm distal von der Einführhilfe und setzen Sie eine Markierung mit dem chirurgischen Marker.
- Üben Sie sanften, aber festen Druck aus, während der Katheter in den Thekalsack vorgeschoben wird, bis die zuvor gemessene Markierung den Einführkopf erreicht.
HINWEIS: Aufgrund von medullären Reflexen kann es vorkommen, dass das Subjekt trotz ausreichender Betäubung zuckt/sich bewegt. - Ziehen Sie die Einführhilfe vorsichtig zurück, während Sie den Katheter in seiner Position halten.
HINWEIS: Greifen Sie den Katheter fest, sobald er über der Haut sichtbar ist, um eine Fehlplatzierung beim Entfernen des Einführknopfes zu vermeiden. - Entfernen Sie den Führungsdraht, während Sie den Katheter auf Hauthöhe fest halten (Abbildung 6).
- Befestigen Sie eine 2-ml-Einwegspritze aus Kunststoff am Katheter.
- Bestätigen Sie die Position im Spinalkanal durch Aspiration des Liquors aus dem Katheter.
- Bei fehlendem Liquor in der Spritze ziehen Sie den Katheter vorsichtig einige Millimeter zurück, um die Durchgängigkeit wiederherzustellen.
- Befestigen Sie den Wirbelsäulenkatheter mit Klebeband am chirurgischen Retraktor und an der Haut, um eine Fehlplatzierung zu vermeiden.
9. Verabreichung von Lipopolysaccharid
- Verabreichen Sie 400 μg E. coli-Lipopolysaccharid (LPS) (OH:143) in das zentrale Venenblatt.
- Starten Sie einen Timer.
10. Liquor-Probenahme
- Entnehmen Sie in den folgenden 24 Stunden stündlich Liquorproben, um die Gesamtleukozytenzahl, das Liquoralbumin und das Liquor-IgG zu messen. Entnehmen Sie maximal 0,5 ml Liquor in jede Probe.
11. Euthanasie
- Verabreichen Sie einen Bolus Pentobarbital (50 mg/kg) durch den peripheren Venenkatheter.
- Beobachten Sie die Kurven des Pulses, des Blutdrucks und der endtidalen CO2 -Konzentration am Beatmungsgerät für Flatline als Bestätigung des Herzstillstands.
Ergebnisse
Die Bauchlage des Molches optimiert den chirurgischen Zugang zu den Lendenwirbeln. Die Verwendung von stützenden Sandsäcken erhöht die Winkelung zwischen den benachbarten lumbalen Dornfortsätzen und verbessert dadurch den Zugang zum Wirbelkanal.
Ziel der vorliegenden Studie war es, die Entzündungsreaktion innerhalb des Liquorkompartiments nach intraventrikulärer Inokulation mit E. coli Lipopolysaccharid zu untersuchen. Insgesamt wurden 10 Schweine dem Verfahren unterzogen, und nachfolgende Liquoranalysen zeigten einen Anstieg der mittleren Liquor-Leukozyten von 30 x 106/L (Bereich 17-39) nach 0 h auf 19.720 x 106/L (11.353-30.546) nach 12 h und einen Anstieg des Liquoralbumins 0,05 g/L (0,03-0,07) nach 0 h auf 0,15 g/L (0,14-0,17) nach 12 h - dies bestätigt eine zerebrale Entzündung und dass alle Wirbelsäulenkatheter korrekt platziert wurden die vorgestellte Technik (Abbildung 7). In der vorliegenden Studie wurden wichtige anatomische Orientierungspunkte - insbesondere die Beckenkämme, das Kreuzbein und die Dornfortsätze von L4, L5 und L6 - verwendet, um die Wirbelmittellinie vor dem Schnitt genau zu lokalisieren (Abbildung 1). Nach der Inzision durch die Haut und das Unterhautgewebe wurden das supraspinöse Band und die Dornfortsätze von L4, L5 und L6 freigelegt, was die anatomische Mittellinie bestätigte (Abbildung 2). Die fortgesetzte Dissektion und Freilegung der Laminen der Dornfortsätze ermöglichte die Identifizierung der Zwischenwirbelräume zwischen L4/L5, L5/L6 und L6/S1 durch manuelle Palpation. Diese Räume eigneten sich aufgrund ihrer Nähe zum darunterliegenden Spinalkanal besonders gut als anatomische Landmarken (Abbildung 3).
Das allmähliche Einführen des Einführers bei 30° horizontaler und 45° kranialer Neigung führte zum erfolgreichen Eintritt in die Thekalblase, was durch den sichtbaren spontanen Liquorfluss bestätigt wurde. Die Sicherstellung, dass die Abschrägung des Einführzahns kranial ausgerichtet ist, ermöglichte ein reibungsloses Einführen des Katheters nach der Katheterisierung. Nachdem der Führungsdraht entfernt worden war, wurde die korrekte Platzierung des Katheters durch die Aspiration des Liquors bestätigt. Der Gesamterfolg des Eingriffs wurde durch folgende Kriterien bestimmt: (a) Während der Inzision traten keine größeren Blutungen auf, (b) der Einführkopf blieb beim Eintritt in den Spinalkanal blutfrei, (c) es gab keinen Liquoraustritt im Operationsfeld und (d) Liquor konnte wiederholt aus dem Katheter aspiriert werden.
Kleinere Blutungen sollten in den Anfangsstadien der Inzision aufgrund der gut vaskularisierten Beschaffenheit des Gewebes erwartet werden. Kleinere Arterien waren häufig anzutreffen, was die Notwendigkeit einer Kauterisation unterstreicht. Der chirurgische Retraktor wurde auch verwendet, um Druck auszuüben und eine Blutstillung zu erreichen. Bei tieferen Schnitten stieß man gelegentlich auf kleine Zwischenwirbelvenen, die aufgrund ihrer Lage schwer zu kontrollieren sein konnten. Da es in diesem Bereich schwierig ist, Druck auszuüben oder zu kauterisieren, ist eine sorgfältige Operationstechnik entscheidend, um solche venösen Blutungen zu vermeiden. Da der Katheter für die langfristige Platzierung vorgesehen war, war es wichtig, Blutungen zu verhindern, um die Bildung von Hämatomen zu vermeiden. Im Falle einer solchen venösen Blutung kann die Blutstillung durch Cottonoide erreicht werden, die mit lokalisiertem direktem Druck angewendet werden.
Die Integrität des Epiduralraums des Spinalkanals wurde beurteilt, indem das den Katheter umgebende Gewebe auf Liquorleckagen untersucht wurde. Jede Leckage würde sich als wasserartige Flüssigkeitsansammlung im Gewebe äußern. In diesem Fall wurde bestätigt, dass die Dura mater, die den Katheter umgibt, intakt ist, da weder während noch nach dem Eingriff ein Liquorleck beobachtet wurde (Abbildung 6). Schließlich bestätigte die konsequente Liquoraspiration durch den Katheter die korrekte Platzierung in der Lendenwirbelspüle des Thekalsacks.
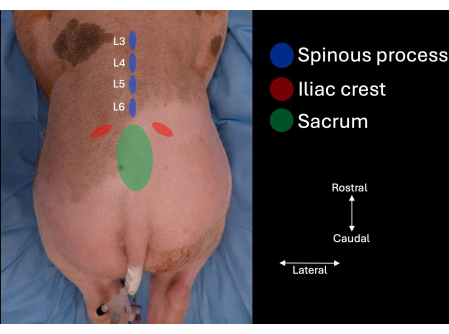
Abbildung 1: Bild der Lendenwirbelsäule des Schweins mit anatomischen Orientierungspunkten, die durch manuelle Palpation identifiziert wurden. Das Kreuzbein, die Beckenkämme und die Dornfortsätze von L4, L5 und L6. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
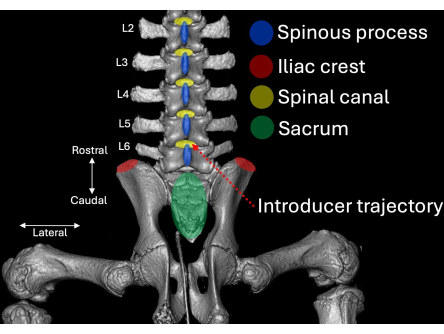
Abbildung 2: Dreidimensionale Computertomographie des lumbalen Aspekts der Schweinewirbelsäule aus der hinteren Perspektive. Anatomische Orientierungspunkte sind in Blau (Dornfortsätze), Rot (Beckenkämme) und Grün (Kreuzbein) mit ihrem jeweiligen Bezug zum Spinalkanal (gelb) hervorgehoben. Der Einführweg des Einführgeräts ist rot gestrichelt hervorgehoben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
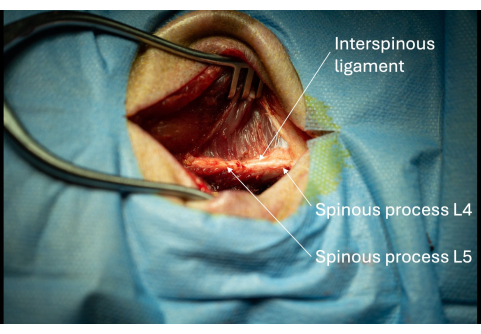
Abbildung 3: Bild der exponierten Dornfortsätze von L5 und L6 mit angrenzendem interspinösen Band aus lateraler Perspektive. Das Vorhandensein dieser Dornfortsätze bestätigt die korrekte anatomische Lage der Operationsöffnung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
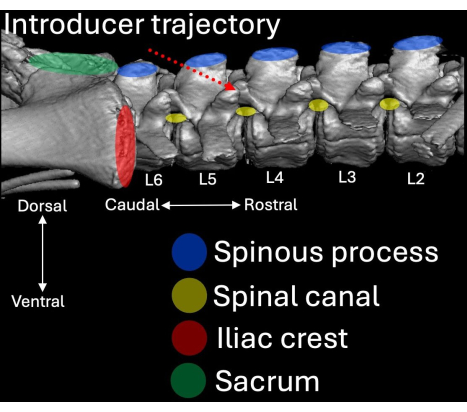
Abbildung 4: Dreidimensionale Computertomographie der Lendenwirbelsäule des Schweins aus lateraler Perspektive. Anatomische Orientierungspunkte sind in Blau (Dornfortsätze), Rot (Beckenkämme) und Grün (Kreuzbein) mit ihrem jeweiligen Bezug zum Spinalkanal (gelb) hervorgehoben. Der Einführweg des Einführgeräts ist rot gestrichelt hervorgehoben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
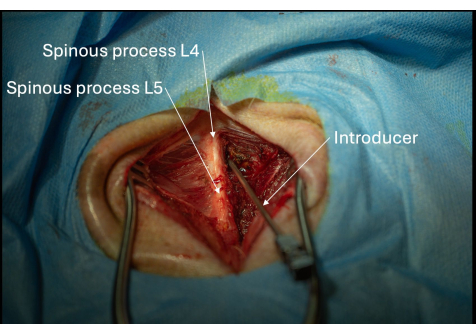
Abbildung 5: Bild der korrekten Positionierung des Introducers in Richtung des interlaminaren Raums L4/L5 aus posterolateraler Perspektive. Der Einführapparat muss schrittweise Millimeter für Millimeter vorgeschoben werden, bis das Ligamentum flavum durchdrungen ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
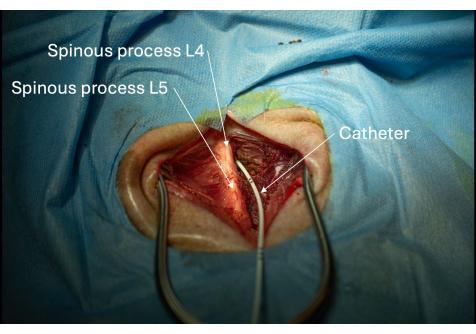
Abbildung 6: Bild des Katheters, der durch den interlaminaren Raum L4/L5 in den Spinalkanal eingeführt wird. Die Platzierung des Katheters im Spinalkanal ist bestätigt, wenn der Liquor wiederholt aspiriert werden kann. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Zeit-Konzentrationsdiagramme der Gesamt-Liquor-Leukozytenzahl (orange) und des Liquoralbumins (blau) nach intraventrikulärer LPS-Inokulation, gemessen bei 0 h, 12 h und 24 h. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Das demonstrierte Verfahren zur Einführung eines Lumbalkatheters für die kontinuierliche Liquorprobenahme bei Schweinen umfasst mehrere entscheidende Schritte. Zunächst muss die richtige Wirbelhöhe freigelegt werden, um optimale Bedingungen für eine erfolgreiche Katheterisierung zu gewährleisten. Das Rückenmark des Schweins erstreckt sich im Vergleich zum Menschen weiter kaudal und erreicht die S2-S3-Ebene15, im Gegensatz zum menschlichen Conus medullaris, der auf der L1-L2-Ebene20 endet. Folglich ist der Zugang zur lumbalen Zisterne für die Liquorprobenahme bei Schweinen schwieriger, insbesondere in höheren lumbalen Bereichen, wo das Rückenmark einen größeren Teil des intrathekalen Raums einnimmt. Nach unserer Erfahrung sind die Ebenen L4/L5 oder L5/L6 geeignete Abschnitte für die Katheterisierung, da das Rückenmark an diesen Segmenten einen etwas kleineren Teil des Spinalkanals einnimmt21.
Der hier vorgestellte Operationsansatz steht im Gegensatz zu weniger invasiven Methoden, wie z.B. dem von Bergadano et al. entwickelten minimal-invasiven Liquorentnahmemodell, bei dem die perkutane Lumbalpunktion bei Göttinger Minischweinen zum Einsatz kam16. Bei ihrer Technik werden die Zwischenwirbelräume der Lendenwirbelsäule durch manuelles Abtasten identifiziert und gezielt für das Einführsystem mit einer horizontalen Neigung von 45° eingesetzt. Die Bestätigung der korrekten Platzierung des Einführers im Epiduralraum hängt von der Wahrnehmung des Widerstandsverlustes während der Katheterisierung ab. Minimalinvasive Techniken bieten zwar den Vorteil einer geringeren Gewebeschädigung und schnellerer Genesungszeiten, bieten aber auch bei größeren Schweinerassen wie der dänischen Landrasse potenzielle Einschränkungen. Zum Beispiel identifizierten Pleticha et al. mehrere anatomische Merkmale, wie z. B. überlappende Laminae, verknöcherte Bänder und das Vorkommen von epiduralem Fett bei großen Schweinen, die eine Lumbalpunktion ohne bildgebende Anleitung unzuverlässiger machen15. Folglich können mehrere Punktionsversuche notwendig sein, was das Risiko von Blutungen, Liquorleckagen und Blutkontaminationen der Liquorproben erhöht.
Im Vergleich dazu setzten Pleticha et al. erfolgreich eine CT-gesteuerte laterale Lumbalpunktionstechnik ein, um diese anatomischen Herausforderungen zu überwinden und einen präzisen intrathekalen Zugang bei größeren Schweinen zu erreichen15. Das Argument für die Verwendung einer bildgebenden Anleitung ist, dass die manuelle Palpation anatomische Orientierungspunkte nicht mit der erforderlichen Reproduzierbarkeit identifizieren kann. Folglich ist für eine exakte anatomische Identifizierung in der Tat eine Bildführung (wie Ultraschall oder Fluoroskopie) erforderlich15,22. Während diese von Pleticha et al. vorgestellte laterale Methode in Einrichtungen, die mit bildgebenden Funktionen ausgestattet sind, erhebliche Vorteile bietet, ist sie aufgrund des Bedarfs an CT-Geräten möglicherweise nicht in allen Laborumgebungen durchführbar. Die hier beschriebene Operationsmethode ist zwar invasiver, bietet aber eine praktische Alternative, die in Laboren ohne Zugang zu CT-Bildgebung problemlos umgesetzt werden kann. Durch die Freilegung der Dornfortsätze und der Zwischenwirbelräume ermöglicht dieser Ansatz eine direkte visuelle Bestätigung des Eintritts des Katheters in den Lendenkasten, wodurch die Notwendigkeit wiederholter Versuche reduziert und Komplikationen minimiert werden.
Ein weiterer wichtiger Aspekt sind die Gewebeschäden und postoperativen Komplikationen, die mit einem offenen chirurgischen Zugang verbunden sind. Die hier beschriebene Methode bietet zwar eine hervorragende Visualisierung der Wirbelsäule und eine zuverlässige Katheterplatzierung, verursacht aber im Vergleich zu minimal-invasiven Techniken auch mehr Gewebeaufschluss. Dies könnte die Anwendung in Überlebensstudien einschränken, bei denen die Erhaltung der Muskelintegrität und die Verringerung des Infektionsrisikos von entscheidender Bedeutung sind. Mit einer sorgfältigen Operationstechnik und der Verwendung von monopolarem Kauter zur Kontrolle von Blutungen kann das Risiko postoperativer Komplikationen jedoch minimiert werden. Obwohl die vorgestellte Methode in einer Non-Survival-Studie zur zerebralen Entzündung nach intraventrikulärer Inokulation mit E. coli Lipopolysaccharid bei 10 Schweinen verwendet wurde, glauben wir, dass die Methode an Überlebensstudien angepasst werden kann, da die Faszie und die Haut um den gelegten Katheter herum genäht werden können. In einer potenziellen Überlebensstudie ist es entscheidend, den Probanden in der postoperativen Phase auf Anzeichen von neurologischen Ausfällen oder Infektionen zu überwachen.
Insgesamt bietet die hier vorgestellte Operationsmethode mehrere Vorteile gegenüber weniger invasiven Techniken. Durch die Freilegung eines größeren Teils der Wirbelsäule ermöglicht dieser Ansatz eine präzise Platzierung des Einführapparats und des Katheters beim ersten Versuch, wodurch das Risiko einer Liquorkontamination mit Blut verringert und eine konsistente Liquorprobenahme gewährleistet wird. Nach unserer Erfahrung ermöglicht diese Methode eine zuverlässige Entnahme von Liquor mit einer Rate von ca. 0,5 mL/h über einen Zeitraum von 24 Stunden. Wenn der Liquorfluss nachlässt, stellt oft ein leichtes Zurückziehen des Katheters um einige Millimeter die Durchgängigkeit wieder her. Darüber hinaus ermöglicht die direkte Beobachtung des Operationsfeldes die Erkennung potenzieller Komplikationen, wie z. B. Liquorleckagen. Diese Methode bietet auch Flexibilität für zukünftige Studien, die die Implantation mehrerer Katheter oder zusätzlicher Instrumente erfordern können.
Zusammenfassend halten wir die vorgestellte Methode für einfach und reproduzierbar, mit signifikanten Anwendungen in verschiedenen zukünftigen Schweinemodellen, die für das Schweinerückenmark relevant sind, insbesondere in Modellen, die eine umfangreiche Liquorprobenahme oder eine Instrumentalisierung des Schweinespinalkanals erfordern.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Die Autoren möchten sich herzlich für die Erfahrungen bedanken, die das Personal des Biomedizinischen Labors des Universitätskrankenhauses Aalborg, Dänemark, geteilt hat.
Materialien
| Name | Company | Catalog Number | Comments |
| Adjustable operating table | N/A | N/A | |
| Bair Hugger heater | 3M | B5005241003 | |
| Bair Hugger heating blanket | 3M | B5005241003 | |
| Endotracheal tube size 6.5 | DVMed | DVM-107860 | Cuffed endotracheal tube |
| Euthasol Vet | Dechra Veterinary Products A/S | 380019 | phentobarbital for euthanazia, 400mg/mL |
| Foley Catheter 12F | Becton, Dickinson and Company | D175812E | Catheter with in-built thermosensor |
| Intravenous peripheral catheter | Avantor | BDAM381344 | Size G18 |
| Intravenous sheath | Coris Avanti | Avanti Cordis Femoral Sheath 6F | |
| Monopolar, ForceTriad System | Medtronic | ||
| Plastic Syringe, 2 mL | Becton, Dickinson and Company | 300928 | |
| Primus respirator | Dräger | Respirator with in-built vaporiser for supplementary Sevofluran anesthisa | |
| Self-retaining retractor | World Precission Instruments | 501722 | Weitlander retractor, self-retaining, 14 cm blunt |
| Silicone Lumbar Catheter incl. Introducer | Integra | NL8508330 | |
| Sterile Saline | Fresnius Kabi | 805541 | 1000 mL |
| Sterile surgical swaps | |||
| Surgical scalpel no 24 | Swann Morton | 5.03396E+12 | Swann Morton Sterile Disposable Scalpel No. 24 |
| Zoletil Vet | Virbac | Medical mixture for induction of anesthesia |
Referenzen
- Meurens, F., Summerfield, A., Nauwynck, H., Saif, L., Gerdts, V. The pig: A model for human infectious diseases. Trends Microbiol. 20 (1), 50-57 (2012).
- Bassols, A., et al. The pig as an animal model for human pathologies: A proteomics perspective. Proteomics Clin Appl. 8 (9-10), 715-731 (2014).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Lunney, J. K., et al. Importance of the pig as a human biomedical model. Sci Transl Med. 13 (621), eabd5758 (2021).
- Lind, N. M., et al. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31 (5), 728-751 (2007).
- Hoffe, B., Holahan, M. R. The use of pigs as a translational model for studying neurodegenerative diseases. Front Physiol. 10, 838 (2019).
- Toossi, A., et al. Comparative neuroanatomy of the lumbosacral spinal cord of the rat, cat, pig, monkey, and human. Sci Rep. 11 (1), 1955 (1955).
- Busscher, I., Ploegmakers, J. J. W., Verkerke, G. J., Veldhuizen, A. G. Comparative anatomical dimensions of the complete human and porcine spine. Eur Spine J. 19 (7), 1104-1114 (2010).
- Säteri, T., et al. Ex vivo porcine models are valid for testing and training microsurgical lumbar decompression techniques. World Neurosurg. 155, e64-e74 (2021).
- Yamanouchi, K., et al. Validation of a surgical drill with a haptic interface in spine surgery. Sci Rep. 13 (1), 598 (2023).
- Hanberg, P., Bue, M., Birke Sørensen, H., Søballe, K., Tøttrup, M. Pharmacokinetics of single-dose cefuroxime in porcine intervertebral disc and vertebral cancellous bone determined by microdialysis. Spine J. 16 (3), 432-438 (2016).
- Hvistendahl, M. A., et al. Cefuroxime concentrations in the anterior and posterior column of the lumbar spine - an experimental porcine study. Spine J. 22 (9), 1434-1441 (2022).
- Mariager, T., et al. Continuous evaluation of single-dose moxifloxacin concentrations in brain extracellular fluid, cerebrospinal fluid, and plasma: a novel porcine model. J Antimicrob Chemother. 79 (6), 1313-1319 (2024).
- Thygesen, M. M., et al. A 72-h sedated porcine model of traumatic spinal cord injury. Brain Spine. 4, 102813 (2024).
- Pleticha, J., et al. Pig lumbar spine anatomy and imaging-guided lateral lumbar puncture: A new large animal model for intrathecal drug delivery. J Neurosci Methods. 216 (1), 10-15 (2013).
- Bergadano, A., et al. A minimally-invasive serial cerebrospinal fluid sampling model in conscious Göttingen minipigs. J Biol Methods. 6 (1), e107 (2019).
- Maxwell, A. R., Castell, N. J., Brockhurst, J. K., Hutchinson, E. K., Izzi, J. M. Determination of an acclimation period for swine in biomedical research. J Am Assoc Lab Anim Sci. 63 (6), 651-654 (2024).
- Costea, R., Ene, I., Pavel, R. Pig Sedation and anesthesia for medical research. Animals. 13 (24), 3807 (2023).
- Ettrup, K. S., et al. Basic surgical techniques in the göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. J Vis Exp. 52, e2652 (2011).
- Grogan, J. P., Daniels, D. L., Williams, A. L., Rauschning, W., Haughton, V. M. The normal conus medullaris: CT criteria for recognition. Radiology. 151 (3), 661-664 (1984).
- Bessen, M. A., et al. Characterising spinal cerebrospinal fluid flow in the pig with phase-contrast magnetic resonance imaging. Fluids Barriers CNS. 20 (1), 5 (2023).
- Weber-Levine, C., et al. Porcine model of spinal cord injury: A systematic review. Neurotrauma Rep. 3 (1), 352-368 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten