Method Article
טכניקה כירורגית להחדרת קטטר עמוד השדרה המותני בחזירים המאפשרת גישה רציפה לשק ה-thecal במערך מסוף
In This Article
Summary
אנו מציגים טכניקה להחדרת קטטר עמוד שדרה מותני ברמת L4-L5 בחזיר דני בן 3 חודשים כחלק מפרוטוקול מחקר טרמינלי, המאפשר עירוי רציף או דגימת CSF מהשק.
Abstract
חזירים משמשים יותר ויותר כמודל של בעלי חיים גדולים למחקר פרמקולוגי של מערכת העצבים המרכזית בשל הדמיון האנטומי והפיזיולוגי בין מערכת העצבים המרכזית של החזיר למערכת העצבים המרכזית האנושית (CNS). עם זאת, גישה לנוזל המוח השדרתי (CSF) בגזעי חזירים גדולים יותר על ידי טכניקות ניקוב מותני קונבנציונליות יכולה להיות מאתגרת בשל אוריינטציה אלכסונית של התהליכים הקוצניים בעמוד השדרה ומרחב בין-שכבתי מוגבל. בהתאם לכך, הליך כירורגי פתוח להחדרת קטטר עמוד שדרה מותני לדגימת CSF רציפה ברמת L4/L5 בחזירים מתואר ביסודיות בעבודה זו. לאחר מיקום החזיר וזיהוי ציוני הדרך האנטומיים, נעשה חתך כירורגי בקו האמצע הגבי כדי לחשוף את התהליכים הקוצניים. על ידי קידום מחט ההיכרות, קטטר עמוד השדרה מוחדר לתוך השק של תעלת עמוד השדרה תוך השארת מבני העצם של עמוד השדרה שלמים. שיטה זו מאפשרת עירוי רציף או דגימה מהשק החזירי עם מינימום דימום או דליפת CSF. ההליך פשוט, חסכוני בזמן וניתן לשחזור על פני מערכי ניסוי שונים, ומציע פוטנציאל משמעותי למחקרים פרה-קליניים שונים, כולל מחקר פרמקוקינטי, הכשרה כירורגית ומודלים של פגיעות בחוט השדרה.
Introduction
מודלים של בעלי חיים חיוניים כאשר מגבלות אתיות או מעשיות מונעות את השימוש בנבדקים אנושיים לחקירת מחלות או לבדיקת שיטות כירורגיות. בעוד שמכרסמים נמצאים בשימוש נפוץ בשל עלותם הנמוכה, הרלוונטיות התרגומית שלהם מוגבלת על ידי הבדלים משמעותיים מבני אדם1. חזירים, לעומת זאת, מציעים מספר יתרונות בהשוואה למכרסמים, כולל דמיון אנטומי ופיזיולוגי לבני אדם - במיוחד בהקשר של מחקר מערכת העצבים המרכזית 1,2. מודלים של כלבים שימשו לאורך ההיסטוריה כמודלים ניסיוניים למחקר במערכת העצבים המרכזית, אך שיקולים אתיים הגבילו את השימוש בכלביםבשנים האחרונות. יתר על כן, הגודל הדומה של איברי חזיר לבני אדם משפר את השימוש בהם במחקר כירורגי ובהכשרה פרוצדורלית4. מערכת העצבים המרכזית ועמוד השדרה החזיריים משקפים באופן הדוק את אלה של בני אדם, עם קווי דמיון בארכיטקטורה ובתפקוד של המוח וחוט השדרה 1,5,6. חשוב לציין, הממדים של עמוד השדרה ותעלת עמוד השדרה בחזירים הופכים אותם למתאימים למחקרים פרה-קליניים שונים 7,8, כולל אימון פרוצדורלי כירורגי 9,10, חדירת תרופות 11,12,13 ופגיעות בחוט השדרה 14.
גישה ל-CSF במודלים של חזירים היא קריטית במערכי ניסוי רבים. בעוד שניקור מותני מספק שיטה לדגימת CSF בודדת או מתן תרופות תוך-תקליות, ניקור מותני חוזר ונשנה אינו מעשי. הם מהווים סיכון פוטנציאלי להמטומה תוך שדרתית, נזק עצבי וזיהום CSF בדם. בחולים אנושיים, מיקרו-צנתרים בעמוד השדרה משמשים בדרך כלל לניקוז CSF מותני רציף בדימומים תת-עכבישיים מפרצתיים וצריכים, בשל דמיון בגודל, להתאים באותה מידה לדגימת CSF רציפה בחזירים. עם זאת, הבדלים אנטומיים ספציפיים למין בחזירים מהווים אתגרים ייחודיים לגישה ל-CSF. לדוגמה, נוכחותן של למינות חופפות, רצועות מאובנות ורקמת שומן אפידורלית בשפע הופכת את טכניקות הניקוב המותני המלעוריות לפחות אמינות15. במיני-חזירים בגטינגן, נעשה שימוש בשיטה מלעורית זעיר פולשנית, המאפשרת דגימת CSF סדרתית16. שיטה זו מסתמכת על זיהוי ידני של החללים הבין חולייתיים המותניים, והצנתור עצמו מבוצע ללא הדמיה של המציג. עם זאת, טכניקה זו פחות מתאימה לחזירים גדולים יותר, שכן שינויים אנטומיים בגודל החוליות, תהליכים קוצניים וכמות רקמת השומן האפידורלית מקשים על צנתור מלעורי15. לכן, ייתכן שיידרשו שיטות פולשניות יותר הכרוכות בחשיפת עמוד השדרה במודלים חזיריים גדולים יותר כדי להבטיח מיקום קטטר אמין.
מטרת כתב היד הזה היא לתאר את ההליך הכירורגי להחדרת קטטר עמוד השדרה לשק החזירי ברמת L4/L5. ההליך כולל מיקום הנבדק, תכנון החתך הניתוחי על סמך ציוני דרך אנטומיים, וגישה למבני העצם האחוריים של עמוד השדרה לפני הצנתור.
Protocol
הנבדקים שוכנו בהתאם לתקנות המקומיות באישור הפיקוח הדני על ניסויים בבעלי חיים (רישיון מס' 2020-15-0201-00401). מידע על הנושא: חזירי בית, נקבה, כ-40 ק"ג, גיל 3 חודשים.
1. נושא דיור וצום טרום ניתוחי
- נבדקים בקבוצות במחזורי אור/חושך של 12 שעות במכלאות דיור מאושרות לפחות 14 יום לפני ההליך כדי להבטיח התאקלמות נכונה ולהפחתת מתח17.
- ודא שהנבדקים היו במשטר גמילה ממזון במשך 12 שעות לפני ההרדמה המתוכננת כדי להפחית את הסיכון לרגורגיטציה. אם התזונה של הנבדקים כוללת אספסת או סוגים אחרים של חציר, יש להוציא זאת מהתזונה 2-3 ימים לפני ההליך, מכיוון שהדבר יכול לעכב את זמן ריקון הקיבה עוד18.
2. הרדמה וניטור
- יש להרדים את הנבדק באמצעות הזרקה תוך שרירית של 2 מ"ל/10 ק"ג משקל גוף של תערובת של קטמין 6.25 מ"ג/מ"ל, זולאזפם 6.25 מ"ג/מ"ל, טילטמין 6.25 מ"ג/מ"ל, בוטאורפנול 1.25 מ"ג/מ"ל וקסילזין 6.25 מ"ג/מ"ל (זולטיל).
- הנח את הנבדק במצב שכיבה על גבי שמיכת חימום כדי לתמוך בוויסות חום.
- יש להחדיר את הנבדק עם צינור19 בגודל 6.5, ולאוורר אותו מכנית עם אוויר לא לח, נפח גאות של 8-10 מ"ל/ק"ג, וקצב נשימה של 16-22 נשימות לדקה בהתאםלריכוזי CO 2 בסוף הגאות < 6.0 kPa.
הערה: קריאות CO2 מאשרות את המיקום התוך-קנה הנכון של הצינור. - שמור על הרדמה על ידי שאיפה של 3%-4% סבופלורן מאודה18.
- מרחו משחות עיניים בזהירות דו צדדית כדי למנוע יובש במהלך ההרדמה.
- ודא מידה מספקת של הרדמה על ידי בדיקת הרפיית שרירים והיעדר תנועת פלפברל כל10 דקות 18.
- הכנס קטטר שלפוחית השתן עם מדחום לשלפוחית השתן של הנבדק דרך השופכה19 כדי לנטר את הטמפרטורה ולאסוף שתן בשקית קטטר מתאימה.
- הכנס קטטר ורידי היקפי לווריד אוזן שטחי מתאים על ידי ניקוב מלעורי והשתמש בו לעירוי מי מלח רציף (NaCl, 0.9%), עירוי תרופות והמתת חסד בסוף המחקר.
- הכנס קטטר עורק הירך (גיליון 6 Fr) לעורק הירך הימני דרך ניקוב מלעור. השתמש בגישה זו לניטור לחץ דם פולשני מתמשך.
- עקוב אחר הסימנים החיוניים של הנבדק כל 5 דקות לאורך כל ההליך.
הערה: סימנים חיוניים כוללים דופק, לחץ דם עורקי פולשני מתמשך, טמפרטורה תוך שלפוחית וריכוזCO2 בסוף הגאות.
3. מיקום בעלי חיים
- הנח את הנבדק במצב נוטה במרכז שולחן הניתוחים. ודא שעמוד השדרה של הנבדק ישר כדי למנוע עקמת.
- הניחו שק חול מתחת להיבט המותני של עמוד השדרה כדי להגביר את הזווית בין הלמינות.
- לגלח את השיער מאתר הניתוח בעזרת גוזם.
- מרחו תמיסת יוד על אתר הניתוח בדפוסים צנטריפוגליים. חזור על תהליך זה עד שכל אתר הניתוח מכוסה.
- הטה מעט את הנושא למצב זקוף.
4. הכנת ציוד כירורגי
- הכן את הציוד הכירורגי המפורט בטבלת החומרים.
5. זיהוי ציוני דרך אנטומיים מרכזיים
- זהה את פסגת הכסל בכל צד של עמוד השדרה המותני של הנבדק ועקוב אחר קווי המתאר באופן מדיאלי עד לזיהוי העצה (איור 1).
- זהה את החלל הבין חולייתי בקו האמצע בין ההיבט הגולגולתי של העצה לתהליך הקוצני של L6.
- זהה את התהליכים הקוצניים של L6, L5 ו-L4 (איור 1, איור 2).
6. חשיפת התהליכים הקוצניים
- בצע חתך בקו האמצע לאורך התהליכים הקוצניים L4-L6 באמצעות אזמל מס' 24, חותך את העור ואת תת העור.
- השתמש בחד-קוטבי כדי לצרוב דימום קטן מוורידים ועורקים שטחיים.
- נגב את הדם עם ביצה כירורגית ובדוק אם יש דימום פעיל; השתמש בחד-קוטבי בהתאם.
הערה: חשוב להפסיק אפילו דימום קל כדי למנוע המטומות. - הכנס את המפסק הכירורגי והרחיב את הפתח.
- זהה את הרצועה העל-ספינית הגבית לתהליכים הקוצניים.
- הרחב את החתך בהדרגה עם החד-קוטבי לאורך ההיבט הצדדי של התהליכים הקוצניים עד שנראה כ-1 ס"מ מהתהליכים הקוצניים (איור 3).
הערה: אם האדם שמבצע את ההליך הוא ימני, יש לשקול לעקוב אחר ההיבט הצדדי הימני של הנבדק בתהליך הקוצני כדי להקל על הכנסת המציג מאוחר יותר. - זהה את הרצועה הבין-קוצנית בין L4/L5 (איור 3).
- בדוק אם יש דימום פעיל והחל את החד-קוטבי לצריבה בהתאם.
7. גישה לשק ה-thecal
- זהה את החלל הבין חולייתי L4/L5 בין הלמינה של התהליכים הקוצניים על ידי מישוש ידני.
- הנח את המבוא עם השיפוע והלומן שלו מכוונים לכיוון הגולגולת בזווית לכיוון החלל התוך-למינרי L4/L5 (איור 2, איור 4, איור 5).
- ודא שהמבוא נשמר בנטייה אופקית של 30° ו-45° (איור 5).
הערה: כוון לעבר החלל התוך-למינרי בין L4/L5. - קדם בהדרגה את המציג עד שתורגש התנגדות עדינה; זה מייצג את הרצועה flavum.
הערה: התחושה של התנגדות קהה מצביעה על כך שהמציג נעצר על ידי התהליך הקוצני. אם זה קורה, החזר את המציג 1 ס"מ והתקדם שוב בנטייה מעט שונה. - הפעל לחץ יציב אך זהיר מאוד וקדם את המכניס מילימטר אחר מיליליטר דרך רצועת הפלבום עד שמורגש אובדן התנגדות פתאומי.
הערה: אם הנבדק מפגין רפלקסים מוטוריים בשרירי המותניים או ברגליים האחוריות, הדבר נובע ממגע ישיר עם שורשי העצבים ולא הרדמה לא מספקת. - עקוב אחר כל התקדמות של המציג על ידי הסרת הטרוקר כדי לבדוק אם יש זרימת CSF גלויה.
- אשר את המיקום הנכון של המביא בתוך תעלת עמוד השדרה על ידי אישור חזותי של זרימת CSF מהמכניס לאחר שחדר ל-ligamentum flavum ובהמשך לדורה מאטר.
הערה: זרימה ספונטנית של CSF עשויה להיות איטית. ניתן לזרז את האישור על ידי מילוי המכניס במי מלח סטריליים והתבוננות בפעימות. - הכנס מחדש את הטרוקר לתוך המכניס כדי למנוע אובדן מוגזם של CSF בזמן הכנת הקטטר.
8. החדרת קטטר לשק ה-thecal
- הכנס את חוט ההנחיה לתוך הצנתר.
- הסר את הטרוקר מהמציג.
- הכנס את הקטטר, המכיל את חוט המנחה, לתוך המכניס עד שתורגש התנגדות עדינה.
- מדוד 5 ס"מ רחוק מהמבוא וקבע סימן עם הסמן הכירורגי.
- הפעל לחץ עדין אך יציב כאשר הצנתר מתקדם לתוך השק עד שהסימן שנמדד קודם לכן מגיע למכניס.
הערה: עקב רפלקסים מדולריים, הנבדק עלול להתעוות/לזוז למרות שהוא מורדם מספיק. - החזר את המכניס בזהירות תוך שמירה על הצנתר במקומו.
הערה: יש לאחוז בחוזקה בצנתר ברגע שהוא נראה מעל העור כדי למנוע מיקום שגוי בעת הסרת המציג. - הסר את חוט ההנחיה תוך שמירה על אחיזה איתנה בצנתר בגובה העור (איור 6).
- חבר מזרק פלסטיק חד פעמי בנפח 2 מ"ל לצנתר.
- אשר מיקום בתוך תעלת עמוד השדרה על ידי CSF שאיפה מהצנתר.
- במקרה של חוסר CSF במזרק, החזר בעדינות את הקטטר כמה מילימטרים כדי להחזיר את הסבלנות.
- אבטח את קטטר עמוד השדרה למחזיר הניתוח ואת העור באמצעות סרט כדי למנוע מיקום שגוי.
9. מתן ליפופוליסכריד
- יש לתת 400 מיקרוגרם של E. coli lipopolysaccharide (LPS) (OH:143) לתוך היריעה הוורידית המרכזית.
- הפעל טיימר.
10. דגימת CSF
- השג דגימות CSF מדי שעה במשך 24 השעות הבאות כדי למדוד את ספירת הלויקוציטים הכוללת, CSF-אלבומין ו-CSF IgG. צייר מקסימום 0.5 מ"ל CSF בכל דגימה.
11. המתת חסד
- יש לתת בולוס של פנטוברביטל (50 מ"ג/ק"ג) דרך הצנתר הוורידי ההיקפי.
- התבונן בעקומות הדופק, לחץ הדם וריכוזה-CO2 בסוף הגאות במכונת ההנשמה לקו שטוח כאישור לדום הלב.
תוצאות
מיקום הנטייה של החזיר מייעל את הגישה הכירורגית לחוליות המותניות. השימוש בשקי חול תומכים מגביר את הזווית בין תהליכים קוצניים מותניים סמוכים, ובכך משפר את הגישה לתעלת עמוד השדרה.
המחקר הנוכחי נועד לחקור את התגובה הדלקתית בתוך תא ה-CSF לאחר חיסון תוך חדרי עם E. coli lipopolysaccharide. בסך הכל עברו 10 חזירים את ההליך, וניתוחי CSF שלאחר מכן חשפו עלייה בממוצע הכולל של לויקוציטים CSF מ-30 x 106/L (טווח 17-39) ב-0 שעות ל-19,720 x 106/L (11,353-30,546) ב-12 שעות ועלייה באלבומין CSF 0.05 גרם/ליטר (0.03-0.07) ב-0 שעות ל-0.15 גרם/ליטר (0.14-0.17) ב-12 שעות - ובכך אישרו דלקת מוחית וכי כל הצנתרים בעמוד השדרה הונחו כהלכה באמצעות הטכניקה המוצגת (איור 7). במחקר הנוכחי, ציוני דרך אנטומיים מרכזיים - במיוחד פסגות הכסל, עצם העצה והתהליכים הקוצניים של L4, L5 ו-L6 - שימשו לאיתור מדויק של קו האמצע החולייתי לפני החתך (איור 1). לאחר החתך דרך העור והרקמות התת-עוריות, נחשפו הרצועה העל-ספינית והתהליכים הקוצניים של L4, L5 ו-L6, המאשרים את קו האמצע האנטומי (איור 2). המשך חיתוך וחשיפה של הלמינה של התהליכים הקוצניים אפשרו לזהות את החללים הבין חולייתיים בין L4/L5, L5/L6 ו-L6/S1 במישוש ידני. חללים אלה התאימו במיוחד כציוני דרך אנטומיים בשל קרבתם לתעלת עמוד השדרה שמתחתיה (איור 3).
ההחדרה ההדרגתית של המכניס בנטייה האופקית של 30° ו-45° הובילה לכניסה המוצלחת לשק ה-thecal, שאושרה על ידי הזרימה הספונטנית הנראית לעין של CSF. הקפדה על שיפוע המכניס פונה לגולגולת אפשרה החדרת קטטר חלקה לאחר הצנתור. לאחר הסרת חוט ההנחיה, מיקום נכון של הצנתר אושר על ידי שאיפת CSF. ההצלחה הכוללת של ההליך נקבעה על פי הקריטריונים הבאים: (א) לא התרחש דימום משמעותי במהלך החתך, (ב) המכניס נשאר נקי מדם עם הכניסה לתעלת עמוד השדרה, (ג) לא הייתה דליפת CSF בשדה הניתוח, ו-(ד) ניתן היה לשאוב CSF שוב ושוב מהקטטר.
יש לצפות לשטפי דם קלים בשלבים הראשונים של החתך בשל האופי הוסקולרי היטב של הרקמה. לעתים קרובות נתקלו בעורקים קטנים יותר, מה שמדגיש את הצורך בצריבה. המחזיר הכירורגי שימש גם להפעלת לחץ ולהשגת המוסטזיס. במהלך חתכים עמוקים יותר, נתקלו מדי פעם בוורידים בין-חולייתיים קטנים, שעלולים להיות קשים לשליטה בשל מיקומם. מכיוון שקשה להפעיל לחץ או צריבה באזור זה, טכניקה כירורגית זהירה היא חיונית כדי למנוע דימום ורידי כזה. מכיוון שהקטטר נועד להשמה ארוכת טווח, היה חיוני למנוע דימום כדי למנוע היווצרות המטומה. במקרה של דימום ורידי כזה, ניתן להשיג המוסטזיס באמצעות כותנה המופעלת בלחץ ישיר מקומי.
תקינות החלל האפידורלי של תעלת עמוד השדרה הוערכה על ידי בדיקת הרקמה המקיפה את הצנתר לאיתור דליפת CSF. כל דליפה תופיע כהצטברות נוזלים דמויי מים ברקמה. במקרה זה, הדורה מאטר המקיף את הצנתר אושר כשלם, מכיוון שלא נצפתה דליפת CSF במהלך ההליך או לאחריו (איור 6). לבסוף, שאיבת CSF עקבית דרך הצנתר אישרה עוד יותר את המיקום הנכון בתוך הבור המותני של שק ה-thecal.
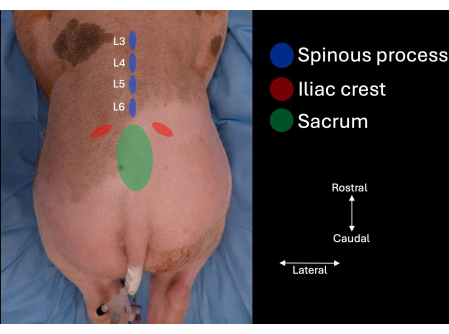
איור 1: תמונה של עמוד השדרה המותני של החזיר עם סימני דרך אנטומיים שזוהו על ידי מישוש ידני. עצם העצה, פסגות הכסל והתהליכים הקוצניים של L4, L5 ו-L6. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
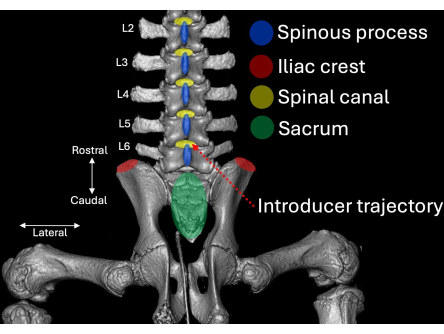
איור 2: סריקת טומוגרפיה ממוחשבת תלת מימדית של ההיבט המותני של עמוד השדרה החזירי מנקודת מבט אחורית. ציוני דרך אנטומיים מודגשים בכחול (תהליכים קוצניים), אדום (פסגות איליאק) וירוק (עצם העצה) עם הקשר שלהם לתעלת עמוד השדרה (צהוב). מסלול ההכנסה של המבוא מודגש באדום מנוקד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
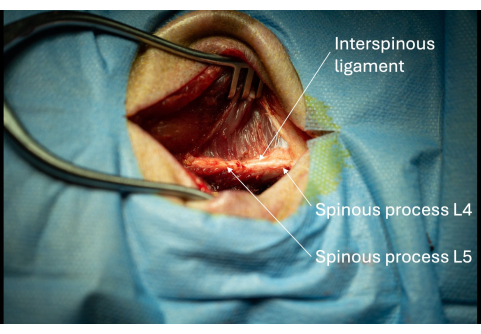
איור 3: תמונה של התהליכים הקוצניים החשופים של L5 ו-L6 עם רצועה בין-קוצנית סמוכה הנראית מנקודת מבט רוחבית. נוכחותם של תהליכים קוצניים אלה מאשרת את המיקום האנטומי הנכון של פתח הניתוח. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
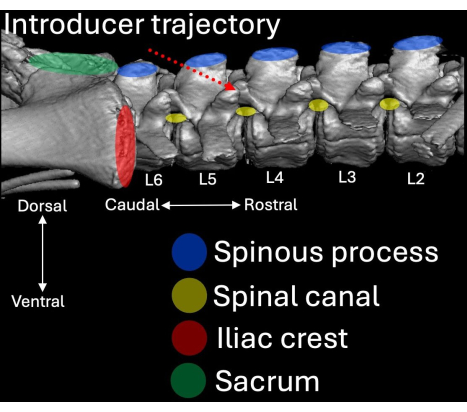
איור 4: סריקת טומוגרפיה ממוחשבת תלת מימדית של ההיבט המותני של עמוד השדרה החזירי מנקודת מבט רוחבית. ציוני דרך אנטומיים מודגשים בכחול (תהליכים קוצניים), אדום (פסגות איליאק) וירוק (עצם העצה) עם הקשר שלהם לתעלת עמוד השדרה (צהוב). מסלול ההכנסה של המבוא מודגש באדום מנוקד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
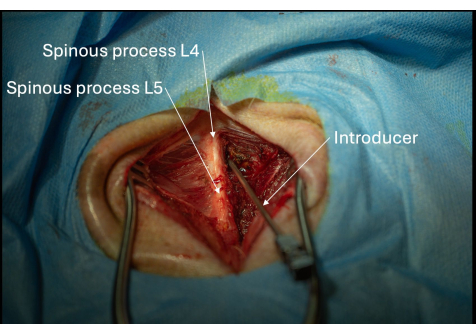
איור 5: תמונה של המיקום הנכון של המציג בזווית לכיוון המרחב הבין-שכבתי L4/L5 הנראה מנקודת מבט אחורית-צדדית. יש לקדם את המציג בהדרגה מילימטר אחר מילימטר עד לחדירת הרצועה פלבום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
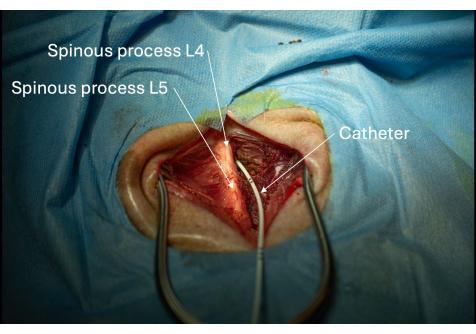
איור 6: תמונה של הצנתר המוחדר לתעלת עמוד השדרה דרך החלל הבין-למינרי L4/L5. מיקום הקטטר בתוך תעלת עמוד השדרה מאושר אם ניתן לשאוב CSF שוב ושוב. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 7: גרפים של ריכוז זמן של ספירת לויקוציטים CSF (כתום) ואלבומין CSF (כחול) לאחר חיסון LPS תוך-חדרי שנמדד ב-0 שעות, 12 שעות ו-24 שעות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
ההליך המודגם להחדרת קטטר מותני לדגימת CSF רציפה בחזירים כולל מספר שלבים מכריעים. ראשית, יש לחשוף את רמת החוליות הנכונה כדי להבטיח תנאים אופטימליים לצנתור מוצלח. חוט השדרה החזירי משתרע עוד יותר בזנב בהשוואה לבני אדם, ומגיע לרמה S2-S315, בניגוד לקונוס מדולריס האנושי, שמסתיים ברמה L1-L220. כתוצאה מכך, הגישה לבור המותני לדגימת CSF מאתגרת יותר אצל חזירים, במיוחד ברמות מותניות גבוהות יותר בהן חוט השדרה תופס יותר מהחלל התוך-תקלי. מניסיוננו, רמות L4/L5 או L5/L6 הן קטעים מתאימים לצנתור מכיוון שחוט השדרה תופס חלק מעט קטן יותר מתעלת עמוד השדרה במקטעים אלה21.
הגישה הכירורגית המוצגת כאן מנוגדת לשיטות פחות פולשניות, כגון מודל איסוף CSF זעיר פולשני שפותח על ידי Bergadano et al., שהשתמש בניקור מותני מלעורי במיני-חזירים בגטינגן16. בטכניקה שלהם, החללים הבין חולייתיים של עמוד השדרה המותני מזוהים באמצעות מישוש ידני ומיועדים להחדרת מכניס בנטייה אופקית של 45°. אישור מיקום נכון של מכניס בתוך החלל האפידורלי מסתמך על תפיסת אובדן ההתנגדות במהלך הצנתור. בעוד שטכניקות זעיר פולשניות מציעות את היתרון של נזק מופחת לרקמות וזמני החלמה מהירים יותר, הן מציגות גם מגבלות פוטנציאליות בגזעי חזירים גדולים יותר כמו הזן הדני. לדוגמה, Pleticha et al. זיהו מספר מאפיינים אנטומיים, כגון למינות חופפות, רצועות מאובנות ושפע השומן האפידורלי בחזירים גדולים, מה שהופך את הניקור המותני לבלתי אמין יותר ללא הנחיית הדמיה15. כתוצאה מכך, ייתכן שיהיה צורך בניסיונות ניקוב מרובים, מה שמגביר את הסיכון לדימום, דליפת CSF וזיהום דם של דגימות CSF.
לשם השוואה, Pleticha et al. השתמשו בהצלחה בטכניקת ניקור מותני רוחבי מונחה CT כדי להתגבר על האתגרים האנטומיים הללו, והשיגו גישה תוך-תקלית מדויקת בחזירים גדולים יותר15. הטיעון בעד שימוש בהנחיית הדמיה הוא שמישוש ידני אינו יכול לזהות ציוני דרך אנטומיים עם יכולת השחזור הדרושה. כתוצאה מכך, הנחיית תמונה (כגון אולטרסאונד או פלואורוסקופיה) אכן נחוצה לזיהוי אנטומי מדויק15,22. בעוד ששיטה רוחבית זו שהוצגה על ידי Pleticha et al. מציעה יתרונות משמעותיים במתקנים המצוידים ביכולות הדמיה, ייתכן שהיא לא תהיה ישימה בכל מסגרות המעבדה בשל הצורך בציוד CT. השיטה הניתוחית המתוארת כאן, למרות שהיא פולשנית יותר, מספקת אלטרנטיבה מעשית הניתנת ליישום בקלות במעבדות ללא גישה להדמיית CT. על ידי חשיפת התהליכים הקוצניים והחללים הבין חולייתיים, גישה זו מאפשרת אישור חזותי ישיר של כניסת הצנתרים לבור המותני, מפחיתה את הצורך בניסיונות חוזרים וממזערת סיבוכים.
שיקול חשוב נוסף הוא הנזק לרקמות והסיבוכים שלאחר הניתוח הקשורים לכל גישה כירורגית פתוחה. בעוד שהשיטה המתוארת כאן מספקת הדמיה מצוינת של עמוד השדרה ומיקום קטטר אמין, היא גם גורמת להפרעה רבה יותר לרקמות בהשוואה לטכניקות זעיר פולשניות. זה עשוי להגביל את יישומו במחקרי הישרדות, שבהם שמירה על שלמות השרירים והפחתת הסיכון לזיהום היא קריטית. עם זאת, עם טכניקה כירורגית זהירה ושימוש בצריבה חד קוטבית לשליטה בדימום, ניתן למזער את הסיכון לסיבוכים לאחר הניתוח. למרות שהשיטה המוצגת שימשה במחקר אי-הישרדות של דלקת מוחית לאחר חיסון תוך חדרי עם E. coli lipopolysaccharide ב-10 חזירים, אנו מאמינים שניתן להתאים את השיטה למחקרי הישרדות, שכן ניתן לתפור את הפאשיה והעור סביב הצנתר המונח. במחקר הישרדות פוטנציאלי, חיוני לעקוב אחר הנבדק לאיתור סימנים של ליקויים נוירולוגיים או זיהומים בשלב שלאחר הניתוח.
בסך הכל, השיטה הניתוחית המוצגת כאן מציעה מספר יתרונות על פני טכניקות פחות פולשניות. על ידי חשיפת חלק גדול יותר מעמוד השדרה, גישה זו מאפשרת מיקום מדויק של המכניס והצנתר בניסיון הראשון, ובכך מפחיתה את הסיכון לזיהום CSF בדם ומבטיחה דגימת CSF עקבית. מניסיוננו, שיטה זו מאפשרת איסוף אמין של CSF בקצב של כ-0.5 מ"ל לשעה במשך תקופה של 24 שעות. אם זרימת CSF פוחתת, נסיגה קלה של הצנתר בכמה מילימטרים מחזירה לעתים קרובות את הסבלנות. בנוסף, תצפית ישירה על השדה הניתוחי מאפשרת זיהוי סיבוכים פוטנציאליים, כגון דליפת CSF. שיטה זו מספקת גם גמישות למחקרים עתידיים שעשויים לדרוש השתלה של מספר צנתרים או מכשירים נוספים.
לסיכום, אנו רואים את השיטה המוצגת כפשוטה וניתנת לשחזור, עם יישומים משמעותיים במודלים חזיריים עתידיים שונים הרלוונטיים לחוט השדרה החזירי, במיוחד במודלים הדורשים דגימת CSF נרחבת או אינסטרומנטליזציה של תעלת עמוד השדרה החזירית.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
המחברים מבקשים להביע את תודתנו הכנה על הניסיון המשותף לצוות המעבדה הביו-רפואית, בית החולים האוניברסיטאי אלבורג, דנמרק.
Materials
| Name | Company | Catalog Number | Comments |
| Adjustable operating table | N/A | N/A | |
| Bair Hugger heater | 3M | B5005241003 | |
| Bair Hugger heating blanket | 3M | B5005241003 | |
| Endotracheal tube size 6.5 | DVMed | DVM-107860 | Cuffed endotracheal tube |
| Euthasol Vet | Dechra Veterinary Products A/S | 380019 | phentobarbital for euthanazia, 400mg/mL |
| Foley Catheter 12F | Becton, Dickinson and Company | D175812E | Catheter with in-built thermosensor |
| Intravenous peripheral catheter | Avantor | BDAM381344 | Size G18 |
| Intravenous sheath | Coris Avanti | Avanti Cordis Femoral Sheath 6F | |
| Monopolar, ForceTriad System | Medtronic | ||
| Plastic Syringe, 2 mL | Becton, Dickinson and Company | 300928 | |
| Primus respirator | Dräger | Respirator with in-built vaporiser for supplementary Sevofluran anesthisa | |
| Self-retaining retractor | World Precission Instruments | 501722 | Weitlander retractor, self-retaining, 14 cm blunt |
| Silicone Lumbar Catheter incl. Introducer | Integra | NL8508330 | |
| Sterile Saline | Fresnius Kabi | 805541 | 1000 mL |
| Sterile surgical swaps | |||
| Surgical scalpel no 24 | Swann Morton | 5.03396E+12 | Swann Morton Sterile Disposable Scalpel No. 24 |
| Zoletil Vet | Virbac | Medical mixture for induction of anesthesia |
References
- Meurens, F., Summerfield, A., Nauwynck, H., Saif, L., Gerdts, V. The pig: A model for human infectious diseases. Trends Microbiol. 20 (1), 50-57 (2012).
- Bassols, A., et al. The pig as an animal model for human pathologies: A proteomics perspective. Proteomics Clin Appl. 8 (9-10), 715-731 (2014).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Lunney, J. K., et al. Importance of the pig as a human biomedical model. Sci Transl Med. 13 (621), eabd5758 (2021).
- Lind, N. M., et al. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31 (5), 728-751 (2007).
- Hoffe, B., Holahan, M. R. The use of pigs as a translational model for studying neurodegenerative diseases. Front Physiol. 10, 838 (2019).
- Toossi, A., et al. Comparative neuroanatomy of the lumbosacral spinal cord of the rat, cat, pig, monkey, and human. Sci Rep. 11 (1), 1955 (1955).
- Busscher, I., Ploegmakers, J. J. W., Verkerke, G. J., Veldhuizen, A. G. Comparative anatomical dimensions of the complete human and porcine spine. Eur Spine J. 19 (7), 1104-1114 (2010).
- Säteri, T., et al. Ex vivo porcine models are valid for testing and training microsurgical lumbar decompression techniques. World Neurosurg. 155, e64-e74 (2021).
- Yamanouchi, K., et al. Validation of a surgical drill with a haptic interface in spine surgery. Sci Rep. 13 (1), 598 (2023).
- Hanberg, P., Bue, M., Birke Sørensen, H., Søballe, K., Tøttrup, M. Pharmacokinetics of single-dose cefuroxime in porcine intervertebral disc and vertebral cancellous bone determined by microdialysis. Spine J. 16 (3), 432-438 (2016).
- Hvistendahl, M. A., et al. Cefuroxime concentrations in the anterior and posterior column of the lumbar spine - an experimental porcine study. Spine J. 22 (9), 1434-1441 (2022).
- Mariager, T., et al. Continuous evaluation of single-dose moxifloxacin concentrations in brain extracellular fluid, cerebrospinal fluid, and plasma: a novel porcine model. J Antimicrob Chemother. 79 (6), 1313-1319 (2024).
- Thygesen, M. M., et al. A 72-h sedated porcine model of traumatic spinal cord injury. Brain Spine. 4, 102813 (2024).
- Pleticha, J., et al. Pig lumbar spine anatomy and imaging-guided lateral lumbar puncture: A new large animal model for intrathecal drug delivery. J Neurosci Methods. 216 (1), 10-15 (2013).
- Bergadano, A., et al. A minimally-invasive serial cerebrospinal fluid sampling model in conscious Göttingen minipigs. J Biol Methods. 6 (1), e107 (2019).
- Maxwell, A. R., Castell, N. J., Brockhurst, J. K., Hutchinson, E. K., Izzi, J. M. Determination of an acclimation period for swine in biomedical research. J Am Assoc Lab Anim Sci. 63 (6), 651-654 (2024).
- Costea, R., Ene, I., Pavel, R. Pig Sedation and anesthesia for medical research. Animals. 13 (24), 3807 (2023).
- Ettrup, K. S., et al. Basic surgical techniques in the göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. J Vis Exp. 52, e2652 (2011).
- Grogan, J. P., Daniels, D. L., Williams, A. L., Rauschning, W., Haughton, V. M. The normal conus medullaris: CT criteria for recognition. Radiology. 151 (3), 661-664 (1984).
- Bessen, M. A., et al. Characterising spinal cerebrospinal fluid flow in the pig with phase-contrast magnetic resonance imaging. Fluids Barriers CNS. 20 (1), 5 (2023).
- Weber-Levine, C., et al. Porcine model of spinal cord injury: A systematic review. Neurotrauma Rep. 3 (1), 352-368 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved