Method Article
猪腰椎导管插入手术技术,可在终端设置中连续进入鞘囊
摘要
我们提出了一种在 3 个月大的丹麦长白猪的 L4-L5 水平插入腰椎导管的技术,作为最终研究方案的一部分,能够从鞘囊连续输注或脑脊液采样。
摘要
由于猪和人类中枢神经系统 (CNS) 之间的解剖学和生理学相似性,猪越来越多地被用作药理学 CNS 研究的大型动物模型。然而,由于脊髓棘突的倾斜方向和有限的椎板间隙,通过传统的腰椎穿刺技术获取大型猪品种的脑脊液 (CSF) 可能具有挑战性。因此,本研究详细描述了一种插入腰椎导管在猪 L4/L5 水平连续 CSF 采样的开放外科手术。在定位猪并确定解剖标志后,制作背侧中线手术切口以暴露棘突。通过推进导引针,脊髓导管插入椎管的鞘囊内,同时保持脊柱的骨骼结构完好无损。这种方法允许连续输注到猪鞘膜囊中或从中取样,出血或脑脊液泄漏最少。该程序简单、省时且可在不同的实验设置中重现,为各种临床前研究提供了巨大的潜力,包括药代动力学研究、手术培训和脊髓损伤模型。
引言
当道德或实际限制阻止使用人类受试者来研究疾病或测试手术方法时,动物模型是必不可少的。虽然啮齿动物因其低成本而被广泛使用,但它们的转化相关性受到与人类的显著差异的限制1。然而,与啮齿动物相比,猪具有多项优势,包括与人类的解剖学和生理学相似性——尤其是在 CNS 研究的背景下 1,2。犬类模型历来是 CNS 研究的实验模型,但近年来道德考虑限制了狗的使用3。此外,猪器官的大小与人类相当,增强了它们在外科研究和程序培训中的用途4。猪的 CNS 和脊柱与人类的 CNS 和脊柱非常相似,在大脑和脊髓的结构和功能上具有相似之处 1,5,6。重要的是,猪的脊柱和椎管的尺寸使其适用于各种临床前研究 7,8,包括手术程序训练 9,10、药物穿透 11,12,13 和脊髓损伤 14。
在许多实验设置中,获取猪模型中的 CSF 至关重要。虽然腰椎穿刺提供了一种单一 CSF 取样或鞘内给药的方法,但反复腰椎穿刺是不切实际的。它们存在椎管内血肿、神经损伤和脑脊液血液污染的潜在风险。在人类患者中,脊髓微导管通常用于动脉瘤性蛛网膜下腔出血的连续腰椎 CSF 引流,并且由于大小相似,应该同样适用于猪的连续 CSF 采样。然而,猪的物种特异性解剖学差异对 CSF 通路提出了独特的挑战。例如,重叠的椎板、骨化韧带和丰富的硬膜外脂肪组织的存在使传统的经皮腰椎穿刺技术不太可靠15。在哥廷根小型猪中,采用了一种微创经皮方法,可以进行连续 CSF 采样16。这种方法依赖于手动识别腰椎间隙,并且导管插入术本身是在没有看到导引器的情况下进行的。然而,这种技术不太适合体型较大的猪,因为椎体大小、棘突和硬膜外脂肪组织数量的解剖变化使经皮导管插入术更加困难15。因此,在较大的猪模型中,可能需要涉及脊柱暴露的更具侵入性的方法,以确保可靠的导管放置。
本手稿的目的是描述将脊髓导管插入 L4/L5 水平猪鞘膜囊的外科手术。该程序包括定位受试者、根据解剖标志规划手术切口以及在导管插入术前进入脊柱的后骨结构。
研究方案
根据丹麦动物实验检查局(许可证号 2020-15-0201-00401)的批准,受试者按照当地法规被安置。对象信息:家猪,母猪,约 40 公斤,3 个月大。
1. 受试者住房和术前禁食
- 在手术前至少 14 天,将受试者分组在 12 小时的光照/黑暗循环中放入经批准的住房围栏中,以确保适当适应并减轻压力17。
- 确保受试者在计划麻醉前已进行食物戒断 12 小时,以降低反流的风险。如果受试者的饮食包括苜蓿或其他类型的干草,则必须在手术前 2-3 天将其从饮食中排除,因为这会进一步延迟胃排空时间18.
2. 麻醉和监测
- 通过肌肉注射 2 mL/10 kg 体重的氯胺酮 6.25 mg/mL、唑拉西泮 6.25 mg/mL、噻拉胺 6.25 mg/mL、布托啡诺 1.25 mg/mL 和甲苯噻嗪 6.25 mg/mL (Zoletil) 的混合物麻醉受试者。
- 将受试者仰卧在加热毯上以支持体温调节。
- 用 6.5 号管19 对受试者进行插管,并根据呼气呼气末 CO2 浓度 6.0 kPa,用非加湿空气进行机械通气,潮气量为 8-10 mL/kg,呼吸频率为 16-22 呼吸/分钟< 6.0 kPa。
注意:CO2 读数可确认插管的正确气管内位置。 - 通过吸入 3%-4% 汽化七氟烷维持麻醉18。
- 小心地双侧涂抹眼药膏,以避免麻醉时干燥。
- 每 10分钟检查 一次肌肉松弛和无睑部运动,确保足够的麻醉程度18。
- 将带有温度计的膀胱导管通过尿道19 插入受试者的膀胱,以监测温度并将尿液收集在合适的导尿袋中。
- 通过经皮穿刺将外周静脉导管插入合适的浅表耳静脉,并在研究结束时将其用于连续盐水(NaCl,0.9%)输注、药物输注和安乐死。
- 通过经皮穿刺将股动脉导管(6 Fr 片)插入右股动脉。使用此通路进行连续有创血压监测。
- 在整个手术过程中每 5 分钟监测一次受试者的生命体征。
注:生命体征包括脉搏、持续侵入性动脉血压、膀胱内温度和呼气末 CO2 浓度。
3. 动物定位
- 将受试者置于手术台中央的俯卧位。确保受试者的脊柱笔直,以避免任何脊柱侧弯。
- 在脊柱的腰部下方放置一个沙袋,以增加椎板之间的角度。
- 用修剪器剃掉手术部位的毛发。
- 以离心方式将碘溶液涂抹在手术部位。重复此过程,直到覆盖整个手术部位。
- 将被摄体稍微倾斜至直立位置。
4. 手术器材的准备
- 准备 材料表中列出的手术设备。
5. 确定关键的解剖标志
- 确定受试者腰椎两侧的髂嵴,并沿着内侧的轮廓移动,直到确定骶骨(图1)。
- 确定骶骨颅侧和 L6 棘突之间中线的椎间空间。
- 识别 L6、L5 和 L4 的棘突(图 1、 图 2)。
6. 揭露棘突
- 使用 24 号手术刀沿棘突 L4-L6 做一个中线切口,切开皮肤和皮下。
- 使用单极烧灼浅静脉和小动脉的小出血。
- 用手术沼泽擦去血液,检查是否有活动性出血;相应地使用 monopolar。
注意:即使是轻微的出血也要停止,以避免血肿。 - 插入手术牵开器并扩大开口。
- 确定棘突背侧的棘上韧带。
- 沿着棘突的外侧用单极逐渐扩大切口,直到可以看到大约 1 cm 的棘突(图3)。
注意:如果执行该程序的人是右撇子,则应考虑跟随受试者的棘突右侧,以便以后插入导引人。 - 识别 L4/L5 之间的棘突间韧带(图3)。
- 检查是否有活动性出血,并相应地应用单极进行烧灼。
7. 进入鞘囊
- 通过手动触诊确定棘突板之间的 L4/L5 椎间隙。
- 放置导引器,其斜面和管腔朝向颅方向,与 L4/L5 椎板内空间成一定角度(图 2、 图 4、 图 5)。
- 确保导引器保持在 30° 水平和 45° 颅倾角(图 5)。
注意:瞄准 L4/L5 之间的椎板内空间。 - 逐渐推进导引器,直到感觉到轻微的阻力;这代表黄韧带。
注意:钝性阻力的感觉表明导引器被棘突停止。如果发生这种情况,请将导引器缩回 1 cm,然后以略微不同的倾斜度再次前进。 - 施加一个坚定但非常小心的压力,并将导引器逐毫升推进黄韧带,直到感觉到突然失去阻力。
注意:如果受试者在腰部肌肉组织或后腿表现出运动反射,那是由于与神经根的直接接触而不是麻醉不足。 - 通过移除套管针来跟踪导引器的每一次进步,以检查可见的 CSF 流量。
- 通过目视确认导引器在穿透黄韧带和随后的硬脑膜后从导引器流出的 CSF 来确认导引器在椎管内的正确位置。
注意:CSF 的自发流动可能很慢。可以通过向导引器中注入无菌盐水并观察脉动来加快确认。 - 将套管针重新插入导引器,以避免在准备导管时脑脊液过度损失。
8. 将导管插入鞘囊
- 将导丝插入导管。
- 从导引器上取下套管针。
- 将包含导丝的导管插入导引器,直到感觉到轻微的阻力。
- 从导引器远端测量 5 厘米,并用手术标记做标记。
- 当导管推进到鞘囊中时,施加轻柔而坚定的压力,直到先前测量的标记到达导引器。
注意:由于延髓反射,尽管被充分麻醉,对象仍可能会抽搐/移动。 - 小心地缩回导引器,同时保持导管在其位置。
注意:一旦导管在皮肤上方可见,请立即牢牢抓住导管,以避免在移除导引器时错位。 - 取下导丝,同时在皮肤水平牢牢抓住导管(图 6)。
- 将 2 mL 一次性塑料注射器连接到导管上。
- 通过从导管抽吸 CSF 确认椎管内的位置。
- 如果注射器中缺少 CSF,请轻轻缩回导管几毫米以恢复通畅。
- 用胶带将脊髓导管固定在手术牵开器和皮肤上,以避免错位。
9. 脂多糖的给药
- 将 400 μg 大肠杆菌 脂多糖 (LPS) (OH:143) 注入中心静脉片中。
- 启动计时器。
10. CSF 采样
- 在接下来的 24 小时内每小时获取 CSF 样本,以测量总白细胞计数、CSF-白蛋白和 CSF IgG。每个样品中最多抽取 0.5 mL 的 CSF。
11. 安乐死
- 通过外周静脉导管推注戊巴比妥 (50 mg/kg)。
- 观察呼吸器处的脉搏、血压和呼气末 CO2 浓度曲线是否平坦,以确认心脏骤停。
结果
猪的俯卧位优化了对腰椎的手术通路。使用支撑沙袋会增加相邻腰椎棘突之间的成角,从而改善椎管通路。
本研究旨在调查脑室内接种 大肠 杆菌脂多糖后脑脊液隔室内的炎症反应。共有 10 头猪接受了该程序,随后的 CSF 分析显示,平均总 CSF 白细胞从 0 小时的 30 x 106/L(范围 17-39)增加到 12 小时的 19,720 x 106/L (11,353-30,546),CSF 白蛋白增加 0.05 g/L (0.03-0.07) 到 12 h 时的 0.15 g/L (0.14-0.17) - 从而证实了脑炎症,并且所有脊髓导管均已正确放置提出的技术(图 7)。在本研究中,关键的解剖标志——特别是髂嵴、骶骨以及 L4、L5 和 L6 的棘突——用于在切口前准确定位椎体中线(图 1)。通过皮肤和皮下组织切开后,暴露出棘上韧带和 L4、L5 和 L6 的棘突,确认了解剖中线(图2)。棘突椎板的持续解剖和暴露允许通过手动触诊识别 L4/L5、L5/L6 和 L6/S1 之间的椎间隙。这些空间特别适合作为解剖标志,因为它们靠近下面的椎管(图 3)。
导引子以 30° 水平和 45° 颅倾角逐渐插入导致成功进入鞘囊,CSF 的可见自发流证实了这一点。确保导引器的斜面朝向颅骨,以便在导管插入后顺利插入导管。移除导丝后,通过 CSF 抽吸验证导管的正确放置。手术的总体成功由以下标准确定:(a) 切口期间未发生大出血,(b) 导引器在进入椎管时保持无血,(c) 手术区域没有 CSF 渗漏,以及 (d) CSF 可以从导管中反复抽吸。
由于组织的血管化性质,在切口的初始阶段应预料到轻微出血。经常遇到较小的动脉,突出了烧灼的必要性。手术牵开器也用于施加压力和实现止血。在较深的切口中,偶尔会遇到小的椎间静脉,由于它们的位置,这可能难以控制。由于很难在该区域施加压力或烧灼,因此谨慎的手术技术对于避免此类静脉出血至关重要。由于导管用于长期放置,因此必须防止出血以避免血肿形成。在这种静脉出血的情况下,可以通过局部直接加压的 cottonoid 来实现止血。
通过检查导管周围的组织是否有 CSF 渗漏来评估椎管硬膜外腔的完整性。任何渗漏都会表现为组织中类似水的液体积聚。在这种情况下,导管周围的硬脑膜被确认为完整,因为在手术期间或手术后没有观察到 CSF 渗漏(图6)。最后,通过导管的一致 CSF 抽吸进一步验证了在鞘囊腰池内的正确放置。
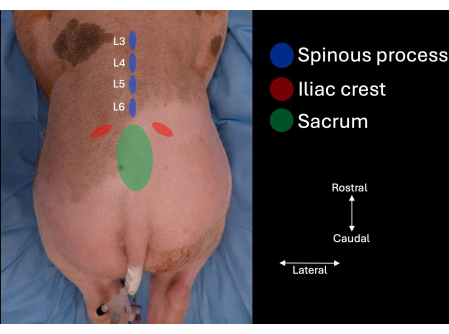
图 1:猪腰椎图片,通过手动触诊确定解剖标志。 骶骨、髂嵴以及 L4、L5 和 L6 的棘突。 请单击此处查看此图的较大版本。
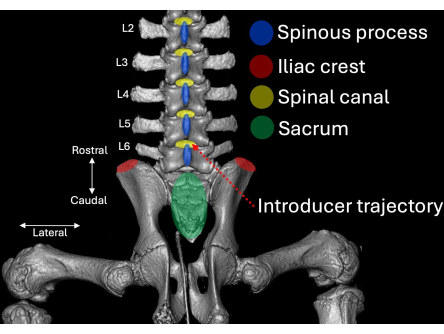
图 2:从后视角可视化的猪脊柱腰部的三维计算机断层扫描。 解剖标志以蓝色(棘突)、红色(髂嵴)和绿色(骶骨)突出显示,以及它们各自与椎管(黄色)的关系。引言的插入路径以红色虚线突出显示。 请单击此处查看此图的较大版本。
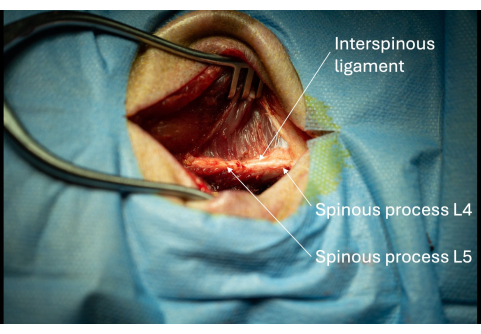
图 3:从侧面观察 L5 和 L6 暴露的棘突与相邻棘间韧带的图片。 这些棘突的存在证实了手术口的正确解剖位置。 请单击此处查看此图的较大版本。
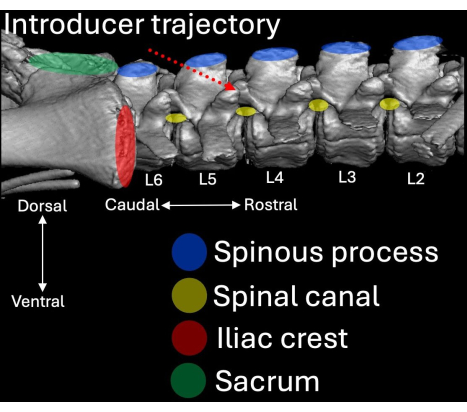
图 4:从侧面观察猪脊柱腰椎的三维计算机断层扫描。 解剖标志以蓝色(棘突)、红色(髂嵴)和绿色(骶骨)突出显示,以及它们各自与椎管(黄色)的关系。引言的插入路径以红色虚线突出显示。 请单击此处查看此图的较大版本。
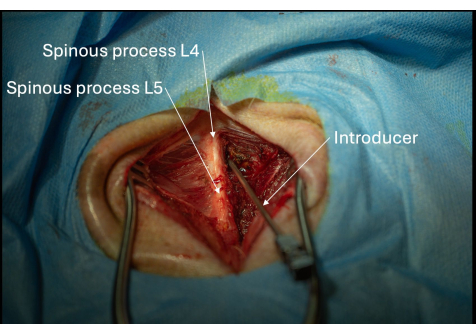
图 5:从后外侧视角看到的导引器向 L4/L5 椎板间隙倾斜的正确定位图片。 导引子必须逐毫米逐渐推进,直到穿透黄韧带。 请单击此处查看此图的较大版本。
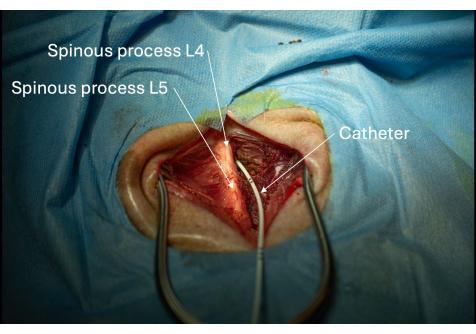
图 6:导管通过 L4/L5 椎板间隙插入椎管的图片。 如果可以反复抽吸 CSF,则确认导管在椎管内的位置。 请单击此处查看此图的较大版本。

图 7:在 0 小时、12 小时和 24 小时测量的脑室内 LPS 接种后 CSF 白细胞总数(橙色)和 CSF 白蛋白(蓝色)的时间浓度图。请单击此处查看此图的较大版本。
讨论
用于猪连续 CSF 采样的腰椎导管插入演示程序涉及几个关键步骤。首先,必须暴露正确的椎体水平,以确保成功插管的最佳条件。与人类相比,猪脊髓进一步向尾部延伸,达到 S2-S315 级,而人类髓圆锥终止于 L1-L220 级。因此,在猪中进入腰腔池进行 CSF 采样更具挑战性,尤其是在脊髓占据更多鞘内空间的较高腰椎水平时。根据我们的经验,L4/L5 或 L5/L6 水平是适合导管插入术的切片,因为脊髓在这些节段21 中占据椎管的比例略小。
这里介绍的手术方法与微创方法形成鲜明对比,例如 Bergadano 等人开发的微创 CSF 收集模型,该模型利用哥廷根小型猪的经皮腰椎穿刺16。在他们的技术中,通过手动触诊识别腰椎的椎间空间,并以 45° 水平倾斜的目标插入导引器。确认硬膜外腔内正确的导引器放置取决于导管插入过程中阻力丧失的感知。虽然微创技术具有减少组织损伤和更快恢复时间的优势,但它们在丹麦长白等大型猪品种中也存在潜在的局限性。例如,Pleticha 等人确定了几个解剖特征,例如重叠的椎板、骨化的韧带和大型猪硬膜外脂肪的丰富,这使得在没有影像学指导的情况下腰椎穿刺更加不可靠15。因此,可能需要多次穿刺尝试,这会增加出血、CSF 渗漏和 CSF 样本血液污染的风险。
相比之下,Pleticha 等人成功地采用了 CT 引导下腰椎外侧穿刺技术来克服这些解剖学挑战,在较大的猪中实现了精确的鞘内通路15。使用影像学引导的论点是,手动触诊无法识别具有必要可重复性的解剖标志物。因此,精确解剖识别确实需要图像引导(例如超声或透视)15,22。虽然 Pleticha 等人提出的这种横向方法在配备成像功能的设施中具有显着优势,但由于需要 CT 设备,它可能并非在所有实验室环境中都可行。这里描述的手术方法虽然更具侵入性,但提供了一种实用的替代方案,可以在无法进行 CT 成像的实验室中轻松实施。通过暴露棘突和椎间隙,这种方法可以直接目视确认导管进入腰椎池,从而减少重复尝试的需要并最大限度地减少并发症。
另一个重要的考虑因素是与任何开放手术方法相关的组织损伤和术后并发症。虽然这里描述的方法提供了出色的脊柱可视化和可靠的导管放置,但与微创技术相比,它也会导致更多的组织破坏。这可能会限制其在生存研究中的应用,因为在生存研究中,保持肌肉完整性和降低感染风险至关重要。然而,通过谨慎的手术技术和使用单极烧灼来控制出血,可以将术后并发症的风险降至最低。尽管所提出的方法用于 10 头猪脑室内接种大 肠 杆菌脂多糖后脑炎症的非生存研究,但我们相信该方法可以适用于生存研究,因为筋膜和皮肤可以在放置的导管周围缝合。在潜在的生存研究中,在术后阶段监测受试者是否有神经功能缺损或感染的迹象至关重要。
总体而言,与微创技术相比,这里介绍的手术方法具有几个优势。通过暴露脊柱的更大部分,这种方法允许在第一次尝试时精确放置导引器和导管,从而降低血液中 CSF 污染的风险并确保 CSF 采样的一致性。根据我们的经验,这种方法可以在 24 小时内以大约 0.5 mL/h 的速率可靠地收集 CSF。如果脑脊液流量减少,导管略微缩回几毫米通常可以恢复通畅。此外,直接观察手术区域可以检测潜在的并发症,例如脑脊液渗漏。这种方法还为未来可能需要植入多根导管或其他器械的研究提供了灵活性。
总之,我们认为所提出的方法简单且可重复,在与猪脊髓相关的各种未来猪模型中具有重要应用,特别是在需要大量 CSF 采样或猪椎管器械化的模型中。
披露声明
作者没有需要声明的利益冲突。
致谢
作者对丹麦奥尔堡大学医院生物医学实验室工作人员分享的经验表示衷心的感谢。
材料
| Name | Company | Catalog Number | Comments |
| Adjustable operating table | N/A | N/A | |
| Bair Hugger heater | 3M | B5005241003 | |
| Bair Hugger heating blanket | 3M | B5005241003 | |
| Endotracheal tube size 6.5 | DVMed | DVM-107860 | Cuffed endotracheal tube |
| Euthasol Vet | Dechra Veterinary Products A/S | 380019 | phentobarbital for euthanazia, 400mg/mL |
| Foley Catheter 12F | Becton, Dickinson and Company | D175812E | Catheter with in-built thermosensor |
| Intravenous peripheral catheter | Avantor | BDAM381344 | Size G18 |
| Intravenous sheath | Coris Avanti | Avanti Cordis Femoral Sheath 6F | |
| Monopolar, ForceTriad System | Medtronic | ||
| Plastic Syringe, 2 mL | Becton, Dickinson and Company | 300928 | |
| Primus respirator | Dräger | Respirator with in-built vaporiser for supplementary Sevofluran anesthisa | |
| Self-retaining retractor | World Precission Instruments | 501722 | Weitlander retractor, self-retaining, 14 cm blunt |
| Silicone Lumbar Catheter incl. Introducer | Integra | NL8508330 | |
| Sterile Saline | Fresnius Kabi | 805541 | 1000 mL |
| Sterile surgical swaps | |||
| Surgical scalpel no 24 | Swann Morton | 5.03396E+12 | Swann Morton Sterile Disposable Scalpel No. 24 |
| Zoletil Vet | Virbac | Medical mixture for induction of anesthesia |
参考文献
- Meurens, F., Summerfield, A., Nauwynck, H., Saif, L., Gerdts, V. The pig: A model for human infectious diseases. Trends Microbiol. 20 (1), 50-57 (2012).
- Bassols, A., et al. The pig as an animal model for human pathologies: A proteomics perspective. Proteomics Clin Appl. 8 (9-10), 715-731 (2014).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Lunney, J. K., et al. Importance of the pig as a human biomedical model. Sci Transl Med. 13 (621), eabd5758 (2021).
- Lind, N. M., et al. The use of pigs in neuroscience: Modeling brain disorders. Neurosci Biobehav Rev. 31 (5), 728-751 (2007).
- Hoffe, B., Holahan, M. R. The use of pigs as a translational model for studying neurodegenerative diseases. Front Physiol. 10, 838 (2019).
- Toossi, A., et al. Comparative neuroanatomy of the lumbosacral spinal cord of the rat, cat, pig, monkey, and human. Sci Rep. 11 (1), 1955 (1955).
- Busscher, I., Ploegmakers, J. J. W., Verkerke, G. J., Veldhuizen, A. G. Comparative anatomical dimensions of the complete human and porcine spine. Eur Spine J. 19 (7), 1104-1114 (2010).
- Säteri, T., et al. Ex vivo porcine models are valid for testing and training microsurgical lumbar decompression techniques. World Neurosurg. 155, e64-e74 (2021).
- Yamanouchi, K., et al. Validation of a surgical drill with a haptic interface in spine surgery. Sci Rep. 13 (1), 598 (2023).
- Hanberg, P., Bue, M., Birke Sørensen, H., Søballe, K., Tøttrup, M. Pharmacokinetics of single-dose cefuroxime in porcine intervertebral disc and vertebral cancellous bone determined by microdialysis. Spine J. 16 (3), 432-438 (2016).
- Hvistendahl, M. A., et al. Cefuroxime concentrations in the anterior and posterior column of the lumbar spine - an experimental porcine study. Spine J. 22 (9), 1434-1441 (2022).
- Mariager, T., et al. Continuous evaluation of single-dose moxifloxacin concentrations in brain extracellular fluid, cerebrospinal fluid, and plasma: a novel porcine model. J Antimicrob Chemother. 79 (6), 1313-1319 (2024).
- Thygesen, M. M., et al. A 72-h sedated porcine model of traumatic spinal cord injury. Brain Spine. 4, 102813 (2024).
- Pleticha, J., et al. Pig lumbar spine anatomy and imaging-guided lateral lumbar puncture: A new large animal model for intrathecal drug delivery. J Neurosci Methods. 216 (1), 10-15 (2013).
- Bergadano, A., et al. A minimally-invasive serial cerebrospinal fluid sampling model in conscious Göttingen minipigs. J Biol Methods. 6 (1), e107 (2019).
- Maxwell, A. R., Castell, N. J., Brockhurst, J. K., Hutchinson, E. K., Izzi, J. M. Determination of an acclimation period for swine in biomedical research. J Am Assoc Lab Anim Sci. 63 (6), 651-654 (2024).
- Costea, R., Ene, I., Pavel, R. Pig Sedation and anesthesia for medical research. Animals. 13 (24), 3807 (2023).
- Ettrup, K. S., et al. Basic surgical techniques in the göttingen minipig: Intubation, bladder catheterization, femoral vessel catheterization, and transcardial perfusion. J Vis Exp. 52, e2652 (2011).
- Grogan, J. P., Daniels, D. L., Williams, A. L., Rauschning, W., Haughton, V. M. The normal conus medullaris: CT criteria for recognition. Radiology. 151 (3), 661-664 (1984).
- Bessen, M. A., et al. Characterising spinal cerebrospinal fluid flow in the pig with phase-contrast magnetic resonance imaging. Fluids Barriers CNS. 20 (1), 5 (2023).
- Weber-Levine, C., et al. Porcine model of spinal cord injury: A systematic review. Neurotrauma Rep. 3 (1), 352-368 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。