Method Article
Анализ экспрессии онкогенов с изменениями pH в линии протоковых клеток поджелудочной железы
В этой статье
Резюме
В этом исследовании описан протокол изучения влияния измененного pH на экспрессию онкогена с помощью анализа РНК-секвенирования линии протоковых клеток поджелудочной железы.
Аннотация
Четвертая по значимости причина смертности, связанной с раком, протоковая аденокарцинома поджелудочной железы (PDAC), имеет 12% пятилетнюю выживаемость. Это заболевание имеет плохой прогноз и характеризуется жестким стромальным микроокружением, что представляет собой ощутимую проблему в его лечении. Пациенты с хроническим панкреатитом имеют в 10 раз больший риск развития PDAC; У этих пациентов рН протоков снижается с рН 8,0 до рН 6,0 из-за недостаточности бикарбоната и воспалительной среды. Наша цель состояла в том, чтобы понять роль кислой среды, наблюдаемой при хроническом панкреатите, на экспрессию онкогенов в линии протоковых клеток поджелудочной железы.
Таким образом, 80% сливающихся эпителиальных клеток протоков поджелудочной железы человека инкубировали при pH от 6,0 до pH 7,2 в течение 6 ч. Общая РНК из клеток была обработана для обогащения общей мРНК в образцах. Экспрессия генов оценивалась с помощью секвенирования нового поколения (NGS) биологических репликатов. С помощью онлайн-инструмента был проведен анализ РНК-секвенирования и идентифицированы дифференциально экспрессируемые гены (ФК < ± 2.0); было 90, 148 и 109 повышенных генов и 20, 14 и 23 пониженных гена при pH 6,0, 6,5 и 7,0 соответственно. Четыре онкогена были повышены при pH 6,0, семь — при pH 6,5 и семь — при pH 7,0. Общими генами, которые были повышены при pH 6,0, pH 6,5 и pH 7,0, были специфичный для клеток лимфоцитов белоктирозинкиназа (LCK) [pH 6,0, FC: 2,93; pH 6,5, FC: 2,93; pH 7,0, FC: 3,32], протоонкоген FGR, тирозинкиназа семейства Src (FGR) [pH 6,0, FC: 4,17; pH 6,5, FC: 5,25; pH 7,0, FC: 5,09], и ArfGAP с доменом SH3, анкириновый повтор и домен PH 3 (ASAP3) [pH 6,0, FC: 2,37; pH 6,5, FC: 3,84; pH 7,0, FC: 2,51]. Кислая среда вызывает активацию протоонкогенов, что может спровоцировать начало образования опухоли при хроническом панкреатите.
Введение
Протоковая аденокарцинома поджелудочной железы (PDAC) является одним из основных видов рака и занимает четвертое место среди онкологических заболеваний по количеству связанных смертей1. Более высокий уровень смертности очевиден среди пациентов с PDAC, и, согласно последним исследованиям, пятилетняя выживаемость составляет всего 12%. Пациенты с документально подтвержденным хроническим панкреатитом, заболеванием, приводящим к воспалению поджелудочной железы2, более склонны (примерно в 15-16 раз) к развитию PDAC3. Существуют различные типы ЦП с разной этиологией, такие как алкогольный, наследственный и идиопатический ЦП4. Известно, что состояния, которые существуют во время ДЦП, приводят к образованию кальцинированных камней, развитию раковых клеток и даже диабету. Распространенность PDAC высока у пациентов с наследственным хроническим панкреатитом5.
Некоторые физиологические состояния поджелудочной железы у пациентов с ДЦП могут быть полезны для возникновения других заболеваний; к ним относятся воспалительная среда, активные пищеварительные ферменты и кислый pH панкреатического сока6. В области воспаления проводится широкий спектр исследований, так как воспаление создает хаос в нормальном функционировании органа 7,8,9. Тем не менее, дисбаланс в регуляции pH является еще одним явлением, которое может вызвать начало неконтролируемогороста клеток. Сок поджелудочной железы здоровых людей является щелочным, что помогает нейтрализовать кислый химус, вырабатываемый желудком. Напротив, сок поджелудочной железы остается кислым у пациентов с ДЦП из-за недостаточной секреции бикарбоната. Низкий уровень бикарбоната не может полностью нейтрализовать сок, что приводит к образованию слабокислой среды внутри протока11.
Более ранние исследования показывают, что раковые клетки адаптируются к кислой среде и процветают в ней12. В таких случаях условия, существующие в процессе хронического панкреатита, предполагают благоприятную среду для пролиферации и метастазирования этих клеток13. Таким образом, наше исследование было направлено на оценку морфологических изменений в протоковых клетках поджелудочной железы человека и оценку экспрессии онкогенов в слабокислых условиях.
протокол
1. Возрождение клеточной линии
- Получить нормальную линию протоковых клеток поджелудочной железы человека (HPDEC/H6C7) и оживить клетки в свежей среде.
- Разморозьте ячейки при 37 °C на водяной бане.
- Свежеприготовленную готовую среду и процедите ее с помощью шприцевого фильтра.
ПРИМЕЧАНИЕ: Готовая среда содержит модифицированную среду Dulbecco Eagle's Medium (DMEM) с добавлением 10% фетальной бычьей сыворотки (FBS). - Добавьте 6 мл готовой среды в свежую коническую пробирку объемом 15 мл, добавьте размороженную клеточную суспензию и тщательно перемешайте.
- Центрифугируйте суспензию при 1 800 × г в течение 6 мин. Выбросьте надосадочную жидкость, добавьте в гранулу 1 мл питательной среды и аккуратно перемешайте.
ПРИМЕЧАНИЕ: Питательная среда содержит DMEM с 10% фетальной бычьей сывороткой (FBS) и 1% пен/стрептококковыми антибиотиками. - Добавьте клетки по каплям в колбу Т-25, содержащую 4 мл питательной среды, и инкубируйте при 37 °С, 5%СО2.
2. Изменение рН питательной среды
- Приготовьте 100 мл 0,5 М буферных растворов фосфата натрия со значениями pH 6,0, 6,5 и 7,0, как указано в таблице 1.
- Проверьте pH с помощью pH-метра и отрегулируйте его с помощью 1 N HCl/1 M NaOH.
- Фильтруйте и стерилизуйте буферы в ламинарном колпаке с помощью шприцевого фильтра 0,45 мкм.
ПРИМЕЧАНИЕ: Буфер можно хранить при температуре 4 °C до дальнейшего использования. - Питательные среды готовят со значениями рН 6,0, 6,5 и 7,0 путем добавления 20 мл стерильного 0,5 М буфера фосфата натрия с соответствующим рН к 80 мл питательной среды.
- Добавьте среду с измененным pH к 85-90% сливающихся протоковых клеток поджелудочной железы человека и проверьте морфологические изменения под светлопольным микроскопом с интервалом в 1 ч в течение 6 ч.
3. Выделение РНК
ПРИМЕЧАНИЕ: Для выделения РНК из клеток необходимо использовать стерильные перчатки, а поверхность должна быть обеззаражена с использованием 100% этанола.
- Удалите питательную среду и промойте клетки фосфатно-солевым буфером (PBS).
- Поставьте тарелку на лед, добавьте в лунку PBS, а затем соскребите ячейки скребком для клеток.
ПРИМЕЧАНИЕ: Количество добавленного PBS должно быть достаточным для покрытия ячеек для скребка. Нет необходимости добавлять большой объем PBS. - Соберите суспензию в свежую пробирку и центрифугируйте ее при давлении 8 000 ×г в течение 10 минут. Выбросьте надосадочную жидкость.
- Добавьте в гранулу буфер для лизиса, содержащий β-меркаптоэтанол, и пипеткой вверх и вниз в течение 5-10 минут на льду.
- Добавьте в лизат равный объем 70% этанола и тщательно перемешайте. Не делайте вихрей.
- Добавьте раствор в колонну с кремнеземной мембраной, центрифугируйте при >8 000 ×g в течение 30 с и сбросьте поток.
- Добавьте промывочный буфер в образец и центрифугируйте при >8 000 ×г в течение 30 с. Центрифугируйте пустую пробирку в течение 1 минуты при >8 000 ×г.
- Добавьте в колонку 30-50 μл воды, не содержащей нуклеаз, и оставьте на 5 минут при комнатной температуре. Центрифугируйте колонку при >8 000 ×g в течение 5 минут.
ПРИМЕЧАНИЕ: Образцы РНК можно хранить при температуре -20 °C до дальнейшего использования.
4. РНК-секвенирование/транскриптом
- Оценка целостности РНК
- Проверьте целостность РНК в биоанализаторе, взяв 1 мкл (25-500 нг) и смешав его с 5 мкл буфера для красителя.
- Перемешайте раствор при давлении 500 ×g в течение 1 минуты и кратковременно вращайте.
- Запустите одноэтапную полимеразную цепную реакцию (ПЦР) для каждого образца при температуре 72 °C в течение 3 минут, а затем возьмите пробирки и инкубируйте их на льду в течение 2 минут перед анализом с помощью биоанализатора.
- Обедненная рРНК
- Добавьте 5 г общей РНК, 50 мл буфера для гибридизации и 1-3 л смеси зондов в свежую пробирку для ПЦР.
- Выполните следующие этапы: первый этап, денатурация при 70 °C в течение 10 минут; второй этап, гибридизация при 37 °C в течение 20 мин; и инкубация при 37 °C до использования.
- В свежую пробирку добавьте 500 мкл магнитных шариков и образец; Поместите смесь на магнитную подставку на 1 минуту, пока раствор не станет прозрачным.
- Аккуратно выбросьте надосадочную жидкость. Извлеките тюбик, промойте шарики, добавив 500 μл воды, не содержащей нуклеаз, и поместите смесь обратно на магнитную подставку на 1 минуту. Удалите надосадочную жидкость, как только раствор станет прозрачным.
- Повторите процесс 5-7 раз. Добавьте 200 μL буфера для гибридизации и тщательно перемешайте. Держите пробирки при температуре 37 °C в течение 5 минут.
- Добавьте к вышеуказанной смеси 100 μL РНК-зонда, аккуратно перемешайте и инкубируйте смесь при 37 °C в течение 15 минут.
- Кратковременно покрутите трубку, прежде чем поместить ее на магнитную подставку на 1 минуту.
- Соберите прозрачную надосадочную жидкость, содержащую обедненную рРНК РНК, в свежую пробирку.
- Фрагментация РНК
- В свежую пробирку для ПЦР добавьте 8-10 мкл обедненной рРНК общей РНК (500 нг/г), 1 мкл 10-кратного буфера и 1 мкл РНКазы III.
- Перемешайте раствор, постукивая и быстро вращая.
- Поместите пробирки в термоамплификатор на 10 минут при температуре 37 °C.
- В свежую пробирку добавьте 5 μL гранул, связывающих нуклеиновые кислоты, а затем добавьте 90 μL концентрата связующего раствора.
- Добавьте в указанную смесь 30 мкл фрагментов РНК и 150 мкл 100% этанола. Перемешайте образец с помощью пипетирования 10 раз и инкубируйте его в течение 5 минут при комнатной температуре.
- Поместите пробирки на магнитную подставку до тех пор, пока раствор не станет прозрачным. Удалите и выбросьте надосадочную жидкость.
- Промойте шарики 150 μл этанола, пока трубки находятся на магнитной подставке; Дайте смеси постоять 30 секунд, а затем удалите надосадочную жидкость.
- Оставьте пробирки на магнитной подставке на 1-2 минуты, чтобы оставшийся этанол испарился.
- Добавьте в гранулы 12 мкл предварительно подогретой воды, не содержащей нуклеаз, и перемешайте образец пипетированием 10 раз.
- Инкубируйте образец в течение 1 минуты при комнатной температуре. Поместите трубки на магнитную подставку и соберите надосадочную жидкость, как только она станет прозрачной.
- Подготовка библиотеки и кДНК
- Добавьте 3 мкл фрагментированного образца РНК в ПЦР-пробирку, а затем добавьте 5 мкл гибридизационной смеси. Перемешайте образец с помощью пипетирования несколько раз, а затем кратковременно открутите образец.
- Держите пробирки в термоамплификаторе в течение 10 минут при температуре 65 °C, а затем 5 минут при 30 °C.
- Добавьте в указанный раствор 10 μл буфера для лигирования и 2 μл смеси ферментов лигирования. Инкубируйте реакцию в термоамплификаторе в течение 1 ч при 30 °C.
- Добавьте мастер-смесь обратной транскриптазы в смесь для лигирования и инкубируйте при 70 °C в течение 10 мин с последующей инкубацией на льду.
- Амплификация кДНК
- Добавьте 6 мкл кДНК (500 нг) в свежую ПЦР-пробирку, а затем добавьте 46 мкл смеси для ПЦР со штрих-кодом из пробирки, содержащей 46 мкл высокоточного фермента полимеразы и 1 мкл 3'-праймеров со штрих-кодом.
- Установите следующие условия ПЦР: первый этап, держать при температуре 94 °C в течение 2 минут; вторая ступень - циклы при 94°С в течение 30 с и 50°С в течение 30 с; третья ступень, 16 циклов при 94 °C в течение 30 с, 62 °C в течение 30 с и 68 °C в течение 30 с. Держите реакцию при температуре 68 °C в течение 5 минут.
- Очистите амплифицированную кДНК путем повторения этапов с 4.3.5 по 4.3.10 и замените фрагментированный образец РНК продуктом ПЦР, полученным на предыдущем этапе.
- Проанализируйте очищенный образец РНК на секвенсоре (NGS) для генерации данных в виде файлов FASTq.
5. Биоинформатика
- Откройте доступный в Интернете инструмент «Галактика», скопировав и вставив ссылку: https://usegalaxy.org во вкладку поиска браузера.
- При первом посещении этого сайта зарегистрируйтесь для получения профиля, нажав на кнопку входа или опцию регистрации в правом верхнем углу.
- После создания учетной записи войдите в учетную запись, заполнив публичное имя/логин и пароль.
- Загрузите файлы FASTq, полученные после анализа РНК-секвенирования, нажав на опцию загрузки на левой боковой панели.
- Выберите инструмент cutadapt в разделе инструментов на левой боковой панели. Этот инструмент будет обрезать некачественные последовательности.
ПРИМЕЧАНИЕ: Теперь этот файл можно использовать для сопоставления. - Нажмите на кнопку инструмента на левой боковой панели и найдите инструмент «Звезда РНК». Заполните детали следующим образом: Используйте выходной файл cutadapt, выберите референсный геном как референсный геном человека (hg38) и измените длину геномной последовательности вокруг аннотированных соединений на 36. Выберите выходные данные в виде количества генов и нажмите на опцию «Запустить инструмент» в правом верхнем углу.
ПРИМЕЧАНИЕ: Этот инструмент сгенерирует файл BAM. - Выберите инструмент featurecounts из опций инструмента и загрузите файлы BAM, полученные после анализа РНК-звезд. Установите минимальное качество сопоставления на чтение в параметрах фильтрации чтения на 10 и нажмите на опцию запустить инструмент в правом верхнем углу.
- Откройте выходной файл featurecount на правой панели и скопируйте данные в электронную таблицу. Вычислите изменение свертки относительно элемента управления, разделив количество полученных в тесте счетчиков прочтений на количество прочитанных счетчиков, полученных в контроле с помощью команды =log (изменение свертки, 2).
ПРИМЕЧАНИЕ: Изменение складки <-2.0 считается указанием на понижение регуляции, а изменение складки > 2.0 считается повышающей регуляцией.
Результаты
Морфологические изменения
Инкубация протоковых клеток поджелудочной железы человека в кислой среде изменяла морфологию клеток. Слияние и плотно упакованный клеточный паттерн приводил к дисперсию клеток в кислых условиях, и клеточная гибель со временем становится заметной. По сравнению с нормальными клетками, содержащими среду, протоковые клетки уменьшались и уменьшались в размерах. Резкое изменение смертности наблюдалось после 6 ч инкубации. Через 24 ч количество клеток уменьшилось, и клетки, казалось, находились в напряженном состоянии (рис. 1, рис. 2 и рис. 3). Таким образом, инкубационный период продлевали до 6 ч в кислой среде перед дальнейшим анализом.
Анализ РНК-секвенирования
Исходные файлы транскриптома доступны на сайте Mendeley Data (https://data.mendeley.com/datasets/kd994sftcs/1) с DOI: 10.17632/kd994sftcs.1. Данные NGS выявили в общей сложности 1389 генов при pH 6,0, 1346 генов при pH 6,5 и 1427 генов при pH 7,0 (дополнительная таблица S1). Когда учитывалось изменение кратности для нерегулируемых генов, количество повышенных генов составляло 90, 148 и 109 при pH 6,0, 6,5 и 7,0 соответственно. Кроме того, 20, 14 и 23 гена были подавлены при pH 6,0, 6,5 и 7,0 соответственно (рис. 4). Онкогены и гены-супрессоры опухолей, которые были повышены при различных уровнях pH, показаны в Таблице 2 и Таблице 3. Три онкогена, которые были повышены на всех трех уровнях pH (рис. 5), — это специфичный для клеток лимфоцитов белок-тирозинкиназа (LCK), протоонкоген FGR, тирозинкиназа семейства Src (FGR) и ArfGAP с доменом SH3, анкириновым повтором и доменом PH 3 (ASAP3). Известно, что LCK участвует в регуляции миграции опухолевых клеток и участвует в самообновлении раковых стволовых клеток14. Активация киназы семейства Src участвует в развитии и прогрессировании рака15. Было обнаружено, что сверхэкспрессия FGR связана с быстрым прогрессированием опухоли, что приводит к низким показателям выживаемости пациентов с такими видами рака, как лейкемия16, лимфома17 и мультиформная глиобластома18. Документально подтверждено, что ASAP3 играет роль в клеточной пролиферации гепатоцеллюлярной карциномы19 , а также в миграции и инвазииклеток20.
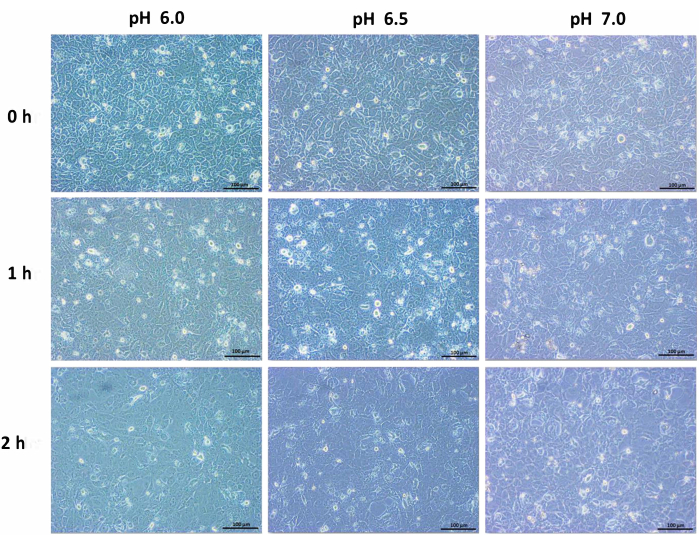
Рисунок 1: Изображения с 10-кратным увеличением линии протоковых клеток поджелудочной железы человека, инкубированных при pH 6,0, pH 6,5 и pH 7,0 с инкубацией в измененной среде в течение 0 ч, 1 ч и 2 ч. Масштабная линейка = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
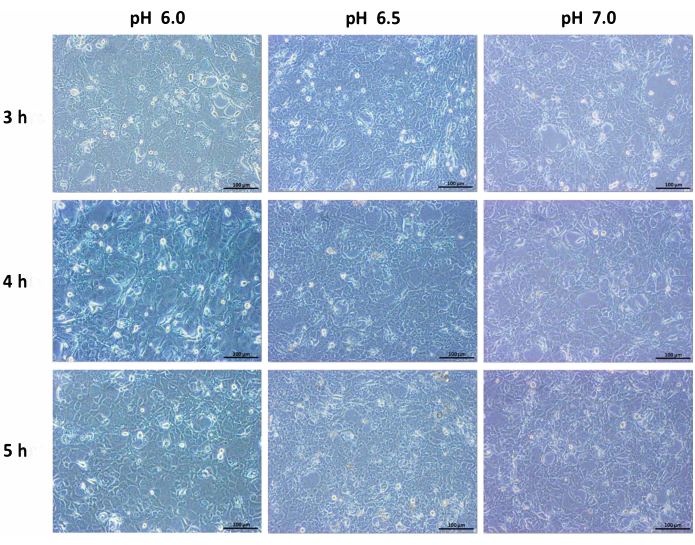
Рисунок 2: Изображения с 10-кратным увеличением линии протоковых клеток поджелудочной железы человека, инкубированных при pH 6,0, pH 6,5 и pH 7,0 с инкубацией в измененной среде в течение 3 ч, 4 ч и 5 ч. Масштабная линейка = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Изображения с 10-кратным увеличением линии протоковых клеток поджелудочной железы человека, инкубированные при pH 6,0, pH 6,5 и pH 7,0 с инкубацией в измененной среде в течение 6 ч и 22 ч. Масштабная линейка = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Гистограмма общего количества нерегулируемых генов при pH 6,0, pH 6,5 и pH 7,0, отображающая общее количество повышенных и подавленных генов при соответствующих значениях pH. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
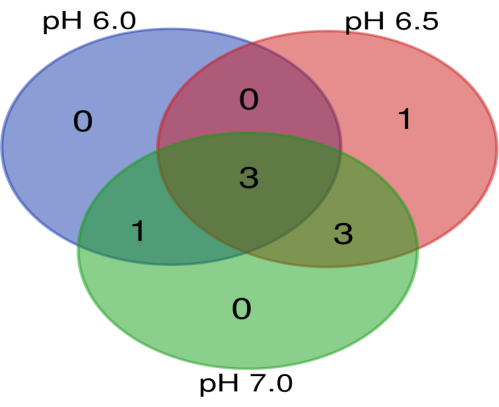
Диаграмма Венна, представляющая общий онкоген, определенный при pH 6,0, 6,5 и 7,0. Было обнаружено, что онкогены, которые обычно активируются при всех значениях pH, были LCK, FGR и ASAP3. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Sr. No. | Итоговый pH | Химический | Количество |
| 1 | рН 6,0 | Na2HPO4 Диабазис | 1,835 г |
| 2PO4 Однобазовый | 5.955 г | ||
| 2 | рН 6,5 | Na2HPO4 Диабазис | 4.789 г |
| 2PO4 Однобазовый | 4.434 г | ||
| 3 | рН 7,0 | Na2HPO4 Диабазис | 7,743 г |
| 2PO4 Однобазовый | 2,913 г |
Таблица 1: Буферный состав фосфата натрия.
| Онкогены | |||
| Гены | pH 6,0 FC | pH 6,5 FC | pH 7,0 FC |
| ЛКК | 2.93 | 2.93 | 3.32 |
| TNFRSF14 | 3.91 | 1 | 2.58 |
| ФГР | 4.17 | 5.25 | 5.09 |
| КАК СЕЙЧАС3 | 2.37 | 3.84 | 2.51 |
| МКЛ | 1 | 2.94 | 2.69 |
| ТАЛ1 | 1 | 3.05 | 2.36 |
| ВТКН1 | 1 | 2.25 | 1 |
| ЭПХА10 | 1 | 2.58 | 2.09 |
Таблица 2: Список онкогенов, активизированных при различных значениях pH и кратном изменении гена.
| Гены-супрессоры опухолей | |||
| Гены | pH 6,0 FC | pH 6,5 FC | pH 7,0 FC |
| ПТЧ2 | 5.52 | 6.73 | 6.41 |
| ДИРАС3 | 1 | 2.22 | 1 |
| ВТКН1 | 1 | 2.25 | 1 |
Таблица 3: Список генов-супрессоров опухолей, активизированных при различных значениях pH и кратном изменении гена.
Дополнительная таблица S1: Повышающая и понижающая регуляция генов при pH 6 против 7,2, pH 6,5 против 7,2 и pH 7 против pH 7,2. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Этот метод был разработан для определения влияния кислотных условий на доброкачественные эпителиальные клетки протоков поджелудочной железы человека в биологических повторах. Изменение рН среды приводило к тому, что клетки находились в стрессовом состоянии, и наблюдалось изменение морфологии. Клетки культивировали при pH 6,0, 6,5 или 7,0 в течение 24 ч и контролировали каждый час для оптимизации инкубационного периода для дальнейших экспериментов. Мы наблюдали изменение морфологии через 4 ч инкубации, а уровень смертности клеток увеличивался после 6 ч инкубации при кислом pH. Поэтому мы инкубировали клетки в течение 6 часов, прежде чем приступить к анализу экспрессии генов.
Дифференциально экспрессируемые гены (DEGs) с log2-кратным изменением продемонстрировали влияние кислого pH на экспрессию генов протоковых клеток. Повышенная экспрессия онкогенов LCK, FGR и ASAP3 продемонстрировала влияние кислого pH на экспрессию генов эпителиальных клеток протоков. Нарушение регуляции экспрессии онкогена и генов-супрессоров опухолей в условиях кислого pH указывает на то, что pH может играть роль в инициации опухоли в условиях воспаления 7,8.
Критическим этапом в этом методе является время инкубации протоковых клеток при кислом рН, поскольку, в отличие от раковых клеток, нераковые клетки восприимчивы к изменениям условий культивирования, что становится ограничивающим фактором для проведения экспериментов с длительными инкубационнымипериодами. Ограничением данного исследования является то, что мы использовали линию протоковых клеток поджелудочной железы человека. Несмотря на это ограничение, мы оценили изменения в экспрессии генов в условиях кислого pH, чтобы имитировать хронический панкреатит.
Основным недостатком в лечении рака является микроокружение и строма, которые развиваются в процессе рака. Противоопухолевые препараты обладают способностью убивать раковые клетки, но не вторгаются в микроокружение, что приводит к низкой эффективности лекарств. Одним из факторов микроокружения при любом раке является кислотное состояние, которое индуцируется во время метаболизма и прогрессированиярака. С помощью этого метода можно оценить изменения в поведении клеток и эффективность лекарств против определенного типа рака. Экспрессия генов может быть оценена с помощью секвенирования нового поколения, а также могут быть определены потенциальные мишени для лекарств.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Ренука Гаудшелвар благодарна DBT за предоставленную ей стипендию. Ренука Гаудшелвар выражает признательность за помощь, полученную от факультета биохимии Университета Османии (Хайдарабад) и доктору В. В. Равиканту за его руководство при анализе данных NGS. Д-р М. Сасикала выражает признательность за финансовую помощь, полученную от ICMR, Министерства здравоохранения, правительства Индии (грант No-94/2020/5582/Proteomics-Adhoc/BMS).
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL graduated centrifuge tubes (Falcon) | Tarsons | 500031 | used for sample preparation |
| 50 mL graduated centrifuge tubes (Falcon) | Tarsons | 500041 | used for sample preparation |
| Agilent 2100 Bioanalyzer instrument | Agilent | Agilent G2938A | Instrment for RNA quality assessment |
| Antibiotic Antimycotic Solution 100x liquid | Himedia | A002-100 mL | Used to prevent contamination |
| Cell Scraper with rotatable blade | Himedia | TCP223 | Scraping and collecting the cells |
| CO2 incubator | New Brunswick | Galaxy 170 S | Used for incubating the culture |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose | Himedia | AL007S-500 mL | Medium used for culturing the cells |
| Dulbecco's Phosphate Buffered saline 1x | Himedia | TL1006-500mL | cell washing |
| Galaxy | (https://usegalaxy.org) | Online tool for processing NSG Data | |
| HI FBS (origin: Australia) | Gibco | 10100-147 | Used for the growth of cells |
| Human Pancreatic Ductal Epithelial Cell Line (HPDEC/ H6C7) | Addex Bio | T0018001 | Pancreatic ductal cell line |
| Ion Total RNA-Seq Kit v2 | Thermo fisher scientific | 4475936 | RNA sample preparation kit |
| Laminar Air Flow | |||
| Na2HPO4 Diabasic | Sigma Aldrich | S3264-250G | Sodium phosphate buffer preparation |
| NaH2PO4 Monobasic | Sigma Aldrich | S3139-250G | Sodium phosphate buffer preparation |
| NovaSeq 6000 | Illumina | 3376672 | Sequencer |
| Nunclon Delta Surface (6-well plate) | Thermo Scientific | 140675 | Culturing the cells |
| Refrigerated benchtop Centrifuge | Thermo Scientific | Sorvall ST 8R | Used for centrifugation |
| RiboMinus Eukaryote System v2 | Thermo fisher scientific | A15026 | rRNA depletion kit |
| Rneasy Mini kit | Qiagen | 74104 | Kit for isolating Total RNA from cells |
| Thermal cycler | Eppendorf | E950040025 | PCR reaction |
| Water Bath | Equitron | #8406M | Thawing of sample |
Ссылки
- Franck, C., et al. Advanced pancreatic ductal adenocarcinoma: Moving forward. Cancers (Basel). 12 (7), 1955 (2020).
- Kong, X., Sun, T., Kong, F., Du, Y., Li, Z. Chronic pancreatitis and pancreatic cancer. Gastrointest Tumors. 1 (3), 123-134 (2014).
- Jura, N., Archer, H., Bar-Sagi, D. Chronic pancreatitis, pancreatic adenocarcinoma and the black box in-between. Cell Res. 15 (1), 72-77 (2005).
- Kloppel, G. Chronic pancreatitis, pseudotumors and other tumor-like lesions. Mod Pathol. 20 (Suppl 1), S113-S131 (2007).
- Schneider, A., Whitcomb, D. C. Hereditary pancreatitis: a model for inflammatory diseases of the pancreas. Best Pract Res Clin Gastroenterol. 16 (3), 347-363 (2002).
- Boedtkjer, E., Pedersen, S. F. The acidic tumor microenvironment as a driver of cancer. Annu Rev Physiol. 82, 103-126 (2020).
- Coussens, L. M., Werb, Z. Inflammation and cancer. Nature. 420 (6917), 860-867 (2002).
- Balkwill, F., Mantovani, A. Inflammation and cancer: back to Virchow. Lancet. 357 (9255), 539-345 (2001).
- Clevers, H. At the crossroads of inflammation and cancer. Cell. 118 (6), 671-674 (2004).
- Kato, , et al. Acidic extracellular microenvironment and cancer. Cancer Cell Int. 13 (1), 89 (2013).
- Hegyi, P., Maléth, J., Venglovecz, V., Rakonczay, Z. Pancreatic ductal bicarbonate secretion: challenge of the acinar acid load. Front Physiol. 2, 36 (2011).
- Ibrahim-Hashim, A., Estrella, V. Acidosis and cancer: from mechanism to neutralization. Cancer Metastasis Rev. 38 (1-2), 149-155 (2019).
- Vakkila, J., Lotze, M. T. Inflammation and necrosis promote tumour growth. Nat Rev Immunol. 4 (8), 641-648 (2004).
- Zepecki, J. P., et al. Regulation of human glioma cell migration, tumor growth, and stemness gene expression using a Lck targeted inhibitor. Oncogene. 38 (10), 1734-1750 (2019).
- Kim, R. K., et al. Role of lymphocyte-specific protein tyrosine kinase (LCK) in the expansion of glioma-initiating cells by fractionated radiation. Biochem Biophys Res Commun. 402 (4), 631-636 (2010).
- Hu, Y., et al. Requirement of Src kinases Lyn, Hck and Fgr for BCR-ABL1-induced B-lymphoblastic leukemia but not chronic myeloid leukemia. Nat Genet. 36 (5), 453-461 (2004).
- Sharp, N. A., Luscombe, M. J., Clemens, M. J. Regulation of c-fgr proto-oncogene expression in Burkitt's lymphoma cells: effect of interferon treatment and relationship to EBV status and c-myc mRNA levels. Oncogene. 4 (8), 1043-1046 (1989).
- Hui, A. B., Lo, K. W., Yin, X. L., Poon, W. S., Ng, H. K. Detection of multiple gene amplifications in glioblastoma multiforme using array-based comparative genomic hybridization. Lab Invest. 81 (5), 717-723 (2001).
- Fang, Z. Y., et al. Proteomic identification and functional characterization of a novel ARF6 GTPase-activating protein, ACAP4. Mol Cell Proteomics. 5 (8), 1437-1449 (2006).
- Okabe, H., et al. Isolation of development and differentiation enhancing factor-like 1 (DDEFL1) as a drug target for hepatocellular carcinomas. Int J Oncol. 24 (1), 43-48 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены