Method Article
Análise da Expressão de Oncogenes com Alterações no pH em uma Linhagem Celular Ductal Pancreática
Neste Artigo
Resumo
Este estudo descreve um protocolo para explorar os efeitos do pH alterado na expressão de oncogenes por meio da análise de RNA-seq de uma linhagem de células ductais pancreáticas.
Resumo
A quarta principal causa de morte relacionada ao câncer, o adenocarcinoma ductal pancreático (PDAC), tem uma taxa de sobrevida de 12% em cinco anos. Esta doença tem um prognóstico ruim e é caracterizada por um microambiente estromal rígido, o que representa um desafio tangível em seu tratamento. Pacientes com pancreatite crônica têm um risco 10 vezes maior de desenvolver PDAC; nesses pacientes, o pH ductal diminui de pH 8,0 para pH 6,0 devido à insuficiência de bicarbonato e ao meio inflamatório. Nosso objetivo foi entender o papel do ambiente ácido observado na pancreatite crônica na expressão de oncogenes em uma linhagem de células ductais pancreáticas.
Portanto, 80% de células epiteliais ductais pancreáticas humanas confluentes foram incubadas em pH 6,0 a pH 7,2 por 6 h. O RNA total das células foi processado para enriquecer o mRNA total nas amostras. A expressão gênica foi avaliada por meio de sequenciamento de nova geração (NGS) de réplicas biológicas. A análise de RNA-seq foi realizada com o auxílio de uma ferramenta online, e os genes diferencialmente expressos (FCs < ± 2.0) foram identificados; havia 90, 148 e 109 genes regulados positivamente e 20, 14 e 23 genes regulados negativamente em pH 6,0, 6,5 e 7,0, respectivamente. Quatro oncogenes foram regulados positivamente em pH 6,0, sete foram regulados positivamente em pH 6,5 e sete foram regulados positivamente em pH 7,0. Os genes comuns que foram regulados positivamente em pH 6,0, pH 6,5 e pH 7,0 foram proteína tirosina quinase (LCK) específica para células de linfócitos [pH 6,0, FC: 2,93; pH 6,5, FC: 2,93; pH 7,0, FC: 3,32], proto-oncogene FGR, tirosina quinase da família Src (FGR) [pH 6,0, FC: 4,17; pH 6,5, FC: 5,25; pH 7,0, FC: 5,09] e ArfGAP com domínio SH3, repetição de anquirina e domínio PH 3 (ASAP3) [pH 6,0, FC: 2,37; pH 6,5, FC: 3,84; pH 7,0, FC: 2,51]. O ambiente ácido desencadeia a ativação de proto-oncogenes, que podem desencadear a iniciação do tumor na pancreatite crônica.
Introdução
O adenocarcinoma ductal pancreático (PDAC) é um dos primecancros e ocupa o quarto lugar entre os cânceres em termos de número de mortes relacionadas1. Uma taxa de mortalidade mais alta é evidente entre os pacientes com PDAC e, de acordo com estudos recentes, a taxa de sobrevida em cinco anos é de apenas 12%. Pacientes com pancreatite crônica documentada, uma doença que resulta em inflamação do pâncreas2, têm maior probabilidade (aproximadamente 15-16 vezes) de desenvolver PDAC3. Existem vários tipos de PC com diferentes etiologias, como a PC relacionada ao álcool, hereditária e idiopática4. Sabe-se que as condições que existem durante a PC levam à formação de cálculos calcificados, ao desenvolvimento de células cancerígenas e até mesmo ao diabetes. A prevalência de PDAC é alta em pacientes com pancreatite crônica hereditária5.
Algumas condições fisiológicas no pâncreas de pacientes com PC podem ser benéficas para o início de outras doenças; estes incluem o meio inflamatório, enzimas digestivas ativas e o pH ácido do suco pancreático6. Uma ampla gama de estudos está sendo realizada na área da inflamação, pois a inflamação cria caos no funcionamento normal do órgão 7,8,9. No entanto, um desequilíbrio na regulação do pH é outro fenômeno que pode desencadear o início do crescimento descontrolado das células10. O suco pancreático de indivíduos saudáveis é alcalino, o que ajuda a neutralizar o quimo ácido produzido pelo estômago. Em contraste, o suco pancreático permanece ácido em pacientes com PC devido à secreção insuficiente de bicarbonato. Baixos níveis de bicarbonato não podem neutralizar completamente o suco, o que resulta em um ambiente levemente ácido dentro do ducto11.
Estudos anteriores indicam que as células cancerígenas se adaptam e prosperam em ambientes ácidos12. Nesses casos, as condições existentes durante o processo de pancreatite crônica sugerem um ambiente favorável para a proliferação e metástase dessas células13. Assim, nosso estudo teve como objetivo avaliar as alterações morfológicas nas células ductais pancreáticas humanas e avaliar a expressão de oncogenes em condições levemente ácidas.
Protocolo
1. Renascimento da linha celular
- Adquira a linha de células ductais pancreáticas normais humanas (HPDEC / H6C7) e reviva as células em meio fresco.
- Descongelar as células a 37 °C em banho-maria.
- Prepare o meio completo e filtre-o usando um filtro de seringa.
NOTA: O meio completo contém meio de Eagle modificado de Dulbecco (DMEM) suplementado com 10% de soro fetal bovino (FBS). - Adicione 6 mL do meio completo a um tubo cônico novo de 15 mL, adicione a suspensão de células descongeladas e misture bem.
- Centrifugue a suspensão a 1.800 × g por 6 min. Descarte o sobrenadante, adicione 1 mL de meio de cultura ao pellet e misture delicadamente.
NOTA: O meio de cultura contém DMEM com 10% de soro fetal bovino (FBS) e 1% de antibióticos caneta/estreptococos. - Adicionar as células gota a gota a um balão T-25 contendo 4 ml de meio de cultura e incubar a 37 °C, 5% de CO2.
2. Alterando o pH do meio de cultura
- Prepare 100 mL de soluções de estoque tampão de fosfato de sódio 0,5 M com valores de pH de 6,0, 6,5 e 7,0, conforme mencionado na Tabela 1.
- Verifique o pH com um medidor de pH e ajuste-o usando 1 N HCl/1 M NaOH.
- Filtre e esterilize os tampões em uma capela de fluxo de ar laminar com um filtro de seringa de 0,45 μm.
NOTA: O tampão pode ser armazenado a 4 °C até nova utilização. - Prepare meios de cultura com valores de pH de 6,0, 6,5 e 7,0 adicionando 20 mL de tampão fosfato de sódio estéril 0,5 M com o respectivo pH a 80 mL de meio de cultura.
- Adicione o meio com o pH alterado a 85-90% de células ductais pancreáticas humanas confluentes e verifique as alterações morfológicas em um microscópio de campo claro em intervalos de 1 h por 6 h.
3. Isolamento de RNA
NOTA: Luvas estéreis devem ser usadas para isolamento de RNA das células e a superfície deve ser descontaminada com etanol 100%.
- Remova o meio de cultura e enxágue as células com solução salina tamponada com fosfato (PBS).
- Coloque a placa no gelo, adicione PBS ao poço e, em seguida, raspe as células com um raspador de células.
NOTA: A quantidade de PBS adicionada deve ser suficiente para cobrir as células para raspagem. Não há necessidade de adicionar um grande volume de PBS. - Recolha a suspensão num tubo novo e centrifugue a 8.000 ×g durante 10 min. Descarte o sobrenadante.
- Adicione tampão de lise contendo β-mercaptoetanol ao pellet e pipete-o para cima e para baixo por 5-10 min no gelo.
- Adicione um volume igual de etanol a 70% ao lisado e misture bem. Não vórtice.
- Adicionar a solução à coluna de membrana de sílica, centrifugar a >8 000 × g durante 30 s e rejeitar o fluxo.
- Adicione tampão de lavagem à amostra e centrifugue a >8.000 ×g por 30 s. Centrifugue o tubo vazio por 1 min a >8.000 ×g.
- Adicione 30-50 μL de água livre de nuclease à coluna e deixe por 5 min em temperatura ambiente. Centrifugue a coluna a >8.000 ×g por 5 min.
NOTA: As amostras de RNA podem ser armazenadas a -20 °C até uso posterior.
4. RNA-seq/transcriptoma
- Avaliação da integridade do RNA
- Verifique a integridade do RNA em um bioanalisador tomando 1 μL (25-500 ng) e misturando-o com 5 μL de tampão de corante.
- Vortex a solução a 500 ×g por 1 min e gire brevemente.
- Execute uma reação em cadeia da polimerase (PCR) de uma etapa para cada amostra a 72 ° C por 3 min e, em seguida, pegue os tubos e incube-os no gelo por 2 min antes da análise com um bioanalisador.
- RNA total depletado de rRNA
- Adicione 5 μg de RNA total, 50 μL de tampão de hibridização e 1-3 μL de mistura de sonda a um novo tubo de PCR.
- Execute as seguintes etapas: primeiro passo, desnaturação a 70 °C por 10 min; segunda etapa, hibridização a 37 °C por 20 min; e incubação a 37 °C até o uso.
- Em um tubo novo, adicione 500 μL de esferas magnéticas e a amostra; Coloque a mistura em um suporte magnético por 1 min até que a solução fique límpida.
- Descarte cuidadosamente o sobrenadante. Remova o tubo, lave as esferas adicionando 500 μL de água livre de nuclease e coloque a mistura de volta no suporte magnético por 1 min. Remover o sobrenadante assim que a solução estiver límpida.
- Repita o processo 5-7x. Adicione 200 μL de tampão de hibridização e misture corretamente. Mantenha os tubos a 37 °C durante 5 min.
- Adicione 100 μL de sonda de RNA à mistura acima, misture suavemente e incube a mistura a 37 °C por 15 min.
- Gire brevemente o tubo antes de colocá-lo no suporte magnético por 1 min.
- Colete o sobrenadante claro contendo o RNA empobrecido de rRNA em um tubo novo.
- Fragmentação de RNA
- Em um tubo de PCR novo, adicione 8-10 μL de RNA total empobrecido de rRNA (500 ng/g), 1 μL de tampão 10x e 1 μL de RNase III.
- Misture a solução batendo e girando brevemente.
- Coloque os tubos em um termociclador por 10 min a 37 °C.
- Em um tubo novo, adicione 5 μL de grânulos de ligação de ácidos nucleicos e, em seguida, adicione 90 μL de concentrado de solução de ligação.
- Adicione 30 μL dos fragmentos de RNA e 150 μL de etanol 100% à mistura acima. Misture a amostra pipetando 10x e incube-a por 5 min em temperatura ambiente.
- Coloque os tubos no suporte magnético até que a solução fique límpida. Remova e descarte o sobrenadante.
- Lave as esferas com 150 μL de etanol enquanto os tubos estão em um suporte magnético; Deixe a mistura repousar por 30 segundos e depois remova o sobrenadante.
- Deixe os tubos em um suporte magnético por 1-2 min para permitir que o etanol restante evapore.
- Adicione 12 μL de água livre de nuclease pré-aquecida às esferas e misture a amostra pipetando 10 vezes.
- Incubar a amostra por 1 min em temperatura ambiente. Coloque os tubos em um suporte magnético e colete o sobrenadante assim que estiver claro.
- Preparação da biblioteca e preparação do cDNA
- Adicione 3 μL da amostra de RNA fragmentada a um tubo de PCR e, em seguida, adicione 5 μL de mistura de hibridização. Misture a amostra pipetando algumas vezes e, em seguida, gire brevemente a amostra.
- Mantenha os tubos em um termociclador por 10 min a 65 °C, seguido de 5 min a 30 °C.
- Adicione 10 μL de tampão de ligação e 2 μL de mistura de enzimas de ligação à solução acima. Incubar a reação em um termociclador por 1 h a 30 °C.
- Adicionar a mistura principal da transcriptase reversa à mistura de ligação e incubar a 70 °C durante 10 min, seguida de incubação em gelo.
- Amplificação do cDNA
- Adicione 6 μL de cDNA (500 ng) a um novo tubo de PCR e, em seguida, adicione 46 μL de mistura de PCR com código de barras de um tubo contendo 46 μL de enzima polimerase de alta fidelidade e 1 μL de primers de código de barras 3'.
- Defina as condições de PCR da seguinte forma: primeiro estágio, manter a 94 °C por 2 min; segundo estágio, ciclos a 94 °C por 30 s e 50 °C por 30 s; terceiro estágio, 16 ciclos a 94 ° C por 30 s, 62 ° C por 30 s e 68 ° C por 30 s. Mantenha a reação a 68 °C por 5 min.
- Purificar o ADN amplificado repetindo os passos 4.3.5 a 4.3.10 e substituir a amostra de ARN fragmentada pelo produto da PCR obtido no passo anterior.
- Analise a amostra de RNA purificada em um sequenciador (NGS) para gerar dados na forma de arquivos FASTq.
5. Bioinformática
- Abra a ferramenta galaxy disponível online copiando e colando o link: https://usegalaxy.org na guia de pesquisa do navegador.
- Na primeira visita a este site, registre-se para um perfil clicando no login ou na opção de registro no canto superior direito.
- Depois de criar uma conta, faça login na conta preenchendo o nome/nome de usuário público e senha.
- Carregue os arquivos FASTq obtidos após a análise de RNA-seq clicando na opção de upload no painel do lado esquerdo.
- Selecione a ferramenta cutadapt na seção de ferramentas no painel do lado esquerdo. Esta ferramenta cortará sequências de baixa qualidade.
NOTA: Este arquivo agora pode ser usado para mapeamento. - Clique no botão da ferramenta no painel do lado esquerdo e procure a ferramenta RNA star. Preencha os detalhes da seguinte forma: Use o arquivo de saída do cutadapt, selecione o genoma de referência como genoma de referência humano (hg38) e altere o comprimento da sequência genômica em torno das junções anotadas para 36. Selecione a saída como contagem de genes e clique na opção de ferramenta de execução no canto superior direito.
NOTA: Esta ferramenta irá gerar um arquivo BAM. - Selecione a ferramenta featurecounts nas opções da ferramenta e carregue os arquivos BAM obtidos após a análise de estrelas de RNA. Defina a qualidade mínima de mapeamento por opção de leitura nas opções de filtragem de leitura como 10 e clique na opção de ferramenta de execução no canto superior direito.
- Abra o arquivo de saída de contagem de recursos no painel direito e copie os dados em uma planilha. Calcule a mudança de dobra em relação ao controle dividindo o número de contagens de leitura obtidas no teste pelo número de contagens de leitura obtidas no controle com o comando =log (mudança de dobra, 2).
NOTA: Uma mudança de dobra <-2.0 é considerada como indicando regulação negativa e uma alteração de dobra > 2.0 é considerada regulação positiva.
Resultados
Alterações morfológicas
A incubação de células ductais pancreáticas humanas em meio ácido alterou a morfologia das células. Um padrão celular confluente e compactado resultou em células dispersas sob condições ácidas, e a morte celular torna-se proeminente com o tempo. Em comparação com as células normais contendo meio, as células ductais encolheram e diminuíram de tamanho. Uma mudança drástica na taxa de mortalidade foi observada após 6 h de incubação. Após 24 h, o número de células diminuiu e as células pareciam estar em um estado de estresse (Figura 1, Figura 2 e Figura 3). Assim, o período de incubação foi prolongado para 6 h em meio ácido antes de uma análise mais aprofundada.
Análise de RNA-seq
Os arquivos brutos do transcriptoma estão disponíveis no Mendeley Data (https://data.mendeley.com/datasets/kd994sftcs/1) com DOI: 10.17632/kd994sftcs.1. Os dados do NGS revelaram um total de 1.389 genes em pH 6,0, 1.346 genes em pH 6,5 e 1.427 genes em pH 7,0 (Tabela Suplementar S1). Quando a mudança de dobra foi considerada para genes desregulados, o número de genes regulados positivamente foi 90, 148 e 109 em pH 6,0, 6,5 e 7,0, respectivamente. Além disso, 20, 14 e 23 genes foram regulados negativamente em pH 6,0, 6,5 e 7,0, respectivamente (Figura 4). Oncogenes e genes supressores de tumor que foram regulados positivamente em vários níveis de pH são mostrados na Tabela 2 e na Tabela 3. Os três oncogenes que foram regulados positivamente em todos os três níveis de pH (Figura 5) são proteína tirosina quinase específica de células linfocitárias (LCK), proto-oncogene FGR, tirosina quinase da família Src (FGR) e ArfGAP com domínio SH3, repetição de anquirina e domínio PH 3 (ASAP3). Sabe-se que a LCK está envolvida na regulação da migração de células tumorais e na auto-renovação das células-tronco cancerígenas14. A ativação da quinase da família Src está envolvida no desenvolvimento e progressão do câncer15. A superexpressão de FGR foi encontrada em associação com a rápida progressão tumoral, resultando em baixas taxas de sobrevida de pacientes com cânceres como leucemia16, linfoma17 e glioblastoma multiforme18. Está documentado que o ASAP3 tem um papel na proliferação celular do carcinoma hepatocelular19 , juntamente com a migração e invasão celular20.
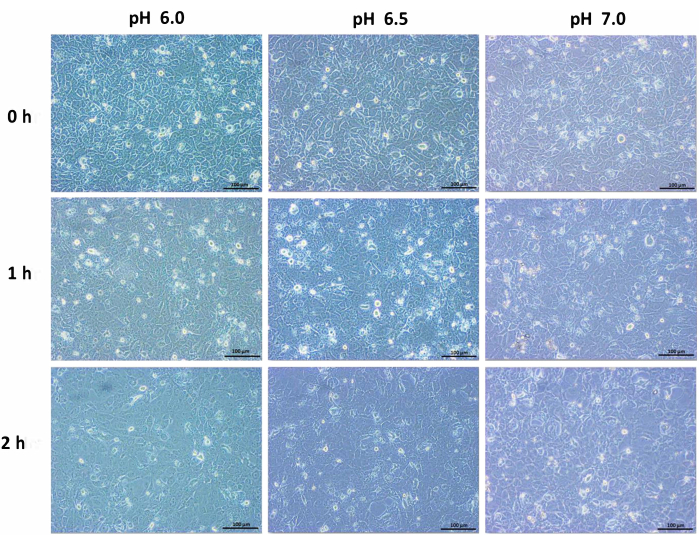
Figura 1: Imagens de ampliação de 10x da linhagem de células ductais pancreáticas humanas incubadas em pH 6,0, pH 6,5 e pH 7,0 com incubação em meio alterado por 0 h, 1 h e 2 h. Barra de escala = 100 μm. Clique aqui para ver uma versão ampliada desta figura.
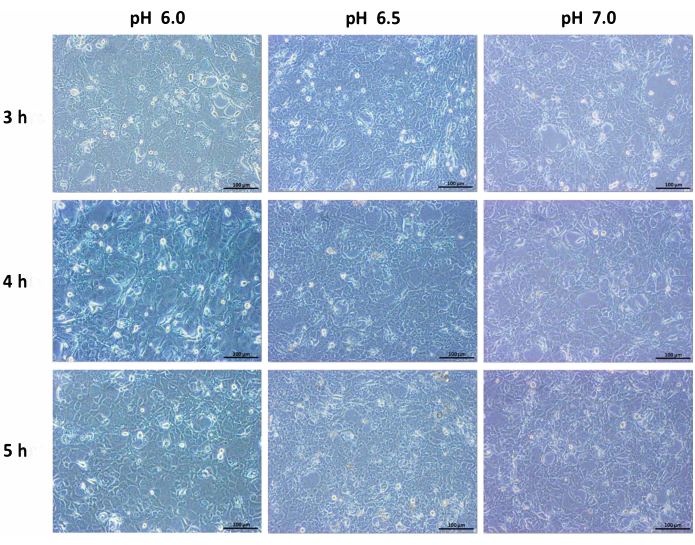
Figura 2: Imagens de ampliação de 10x da linha de células ductais pancreáticas humanas incubadas em pH 6,0, pH 6,5 e pH 7,0 com incubação em meio alterado por 3 h, 4 h e 5 h. Barra de escala = 100 μm. Clique aqui para ver uma versão ampliada desta figura.

Figura 3: Imagens de ampliação de 10x da linha de células ductais pancreáticas humanas incubadas em pH 6,0, pH 6,5 e pH 7,0 com incubação em meio alterado por 6 h e 22 h. Barra de escala = 100 μm. Clique aqui para ver uma versão ampliada desta figura.

Figura 4: Gráfico de barras do total de genes desregulados em pH 6,0, pH 6,5 e pH 7,0 representando o número total de genes regulados positivamente e negativamente nos respectivos valores de pH. Clique aqui para ver uma versão maior desta figura.
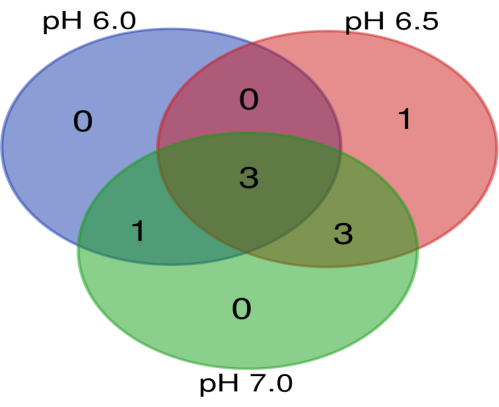
Figura 5: Diagrama de Venn representando o oncogene comum determinado em pH 6,0, 6,5 e 7,0. Os oncogenes que foram comumente regulados positivamente em todos os valores de pH foram LCK, FGR e ASAP3. Clique aqui para ver uma versão maior desta figura.
| Sr. Não. | pH final | Químico | Quantidade |
| 1 | pH 6,0 | Na2HPO4 Diabasic | 1.835 gramas |
| NaH2PO4 Monobásico | 5.955 gramas | ||
| 2 | pH 6,5 | Na2HPO4 Diabasic | 4.789 gramas |
| NaH2PO4 Monobásico | 4.434 gramas | ||
| 3 | pH 7,0 | Na2HPO4 Diabasic | 7.743 gramas |
| NaH2PO4 Monobásico | 2.913 gramas |
Quadro 1: Composição do depósito regulador de fosfato de sódio.
| Oncogenes | |||
| Genes | pH 6,0 FC | pH 6,5 FC | pH 7,0 FC |
| LCK | 2.93 | 2.93 | 3.32 |
| TNFRSF14 | 3.91 | 1 | 2.58 |
| FGR | 4.17 | 5.25 | 5.09 |
| o mais rápido possível3 | 2.37 | 3.84 | 2.51 |
| MYCL | 1 | 2.94 | 2.69 |
| TAL1 | 1 | 3.05 | 2.36 |
| VTCN1 | 1 | 2.25 | 1 |
| EPHA10 | 1 | 2.58 | 2.09 |
Tabela 2: Lista de oncogenes regulados positivamente em diferentes valores de pH e mudança de dobra do gene.
| Genes supressores de tumor | |||
| Genes | pH 6,0 FC | pH 6,5 FC | pH 7,0 FC |
| PTCH2 | 5.52 | 6.73 | 6.41 |
| DIRAS3 | 1 | 2.22 | 1 |
| VTCN1 | 1 | 2.25 | 1 |
Tabela 3: Lista dos genes supressores de tumor regulados positivamente em diferentes valores de pH e mudança de dobra do gene.
Tabela Suplementar S1: Genes regulados para cima e para baixo em pH 6 versus 7,2, pH 6,5 versus 7,2 e pH 7 versus pH 7,2. Clique aqui para baixar este arquivo.
Discussão
Este método foi desenvolvido para determinar os efeitos de condições ácidas em células epiteliais ductais pancreáticas humanas não cancerosas em repetições biológicas. Uma mudança no pH do meio fez com que as células ficassem em um estado de estresse e uma mudança na morfologia foi observada. As células foram cultivadas em pH 6,0, 6,5 ou 7,0 por 24 h e monitoradas a cada hora para otimizar o período de incubação para novos experimentos. Observamos uma mudança na morfologia após 4 h de incubação, e a taxa de mortalidade celular aumentou após 6 h de incubação em pH ácido. Portanto, incubamos as células por 6 h antes de prosseguir com a análise da expressão gênica.
Genes diferencialmente expressos (DEGs) com alteração de log2 vezes demonstraram os efeitos do pH ácido na expressão gênica das células ductais. O aumento da expressão dos oncogenes LCK, FGR e ASAP3 demonstrou a influência do pH ácido na expressão gênica das células epiteliais ductais. A desregulação da expressão do gene oncogênico e supressor de tumor em condições de pH ácido indica que o pH pode desempenhar um papel na iniciação do tumor em condições inflamatórias 7,8.
A etapa crítica desse método é o tempo de incubação das células ductais em pH ácido, pois, ao contrário das células cancerígenas, as células não cancerígenas são suscetíveis a mudanças nas condições de cultivo, o que se torna um fator limitante para a realização de experimentos com longos períodos de incubação12. Uma limitação deste estudo é que usamos uma linha de células ductais pancreáticas humanas. Apesar dessa limitação, avaliamos alterações na expressão gênica em condições de pH ácido para mimetizar a pancreatite crônica.
A principal desvantagem no tratamento do câncer é o microambiente e o estroma que se desenvolvem durante o curso do câncer. Os medicamentos anticancerígenos têm a capacidade de matar as células cancerígenas, mas não conseguem invadir o microambiente, resultando em baixa eficácia do medicamento. Um dos fatores microambientais em qualquer câncer é a condição ácida que é induzida durante o metabolismo e progressão do câncer20. As alterações no comportamento celular e a eficácia do medicamento contra um determinado tipo de câncer podem ser avaliadas por meio desse método. A expressão gênica pode ser avaliada por sequenciamento de próxima geração e potenciais alvos de medicamentos podem ser identificados.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Renuka Goudshelwar é grata ao DBT por lhe fornecer a bolsa. Renuka Goudshelwar agradece a ajuda recebida do Departamento de Bioquímica da Universidade de Osmania (Hyderabad) e do Dr. V. V. Ravikanth por sua orientação durante a análise dos dados do NGS. O Dr. M. Sasikala agradece a assistência financeira recebida do ICMR, Ministério da Saúde, Governo da Índia (Concessão nº 94/2020/5582/Proteomics-Adhoc/BMS).
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL graduated centrifuge tubes (Falcon) | Tarsons | 500031 | used for sample preparation |
| 50 mL graduated centrifuge tubes (Falcon) | Tarsons | 500041 | used for sample preparation |
| Agilent 2100 Bioanalyzer instrument | Agilent | Agilent G2938A | Instrment for RNA quality assessment |
| Antibiotic Antimycotic Solution 100x liquid | Himedia | A002-100 mL | Used to prevent contamination |
| Cell Scraper with rotatable blade | Himedia | TCP223 | Scraping and collecting the cells |
| CO2 incubator | New Brunswick | Galaxy 170 S | Used for incubating the culture |
| Dulbecco's Modified Eagle Medium (DMEM), high glucose | Himedia | AL007S-500 mL | Medium used for culturing the cells |
| Dulbecco's Phosphate Buffered saline 1x | Himedia | TL1006-500mL | cell washing |
| Galaxy | (https://usegalaxy.org) | Online tool for processing NSG Data | |
| HI FBS (origin: Australia) | Gibco | 10100-147 | Used for the growth of cells |
| Human Pancreatic Ductal Epithelial Cell Line (HPDEC/ H6C7) | Addex Bio | T0018001 | Pancreatic ductal cell line |
| Ion Total RNA-Seq Kit v2 | Thermo fisher scientific | 4475936 | RNA sample preparation kit |
| Laminar Air Flow | |||
| Na2HPO4 Diabasic | Sigma Aldrich | S3264-250G | Sodium phosphate buffer preparation |
| NaH2PO4 Monobasic | Sigma Aldrich | S3139-250G | Sodium phosphate buffer preparation |
| NovaSeq 6000 | Illumina | 3376672 | Sequencer |
| Nunclon Delta Surface (6-well plate) | Thermo Scientific | 140675 | Culturing the cells |
| Refrigerated benchtop Centrifuge | Thermo Scientific | Sorvall ST 8R | Used for centrifugation |
| RiboMinus Eukaryote System v2 | Thermo fisher scientific | A15026 | rRNA depletion kit |
| Rneasy Mini kit | Qiagen | 74104 | Kit for isolating Total RNA from cells |
| Thermal cycler | Eppendorf | E950040025 | PCR reaction |
| Water Bath | Equitron | #8406M | Thawing of sample |
Referências
- Franck, C., et al. Advanced pancreatic ductal adenocarcinoma: Moving forward. Cancers (Basel). 12 (7), 1955 (2020).
- Kong, X., Sun, T., Kong, F., Du, Y., Li, Z. Chronic pancreatitis and pancreatic cancer. Gastrointest Tumors. 1 (3), 123-134 (2014).
- Jura, N., Archer, H., Bar-Sagi, D. Chronic pancreatitis, pancreatic adenocarcinoma and the black box in-between. Cell Res. 15 (1), 72-77 (2005).
- Kloppel, G. Chronic pancreatitis, pseudotumors and other tumor-like lesions. Mod Pathol. 20 (Suppl 1), S113-S131 (2007).
- Schneider, A., Whitcomb, D. C. Hereditary pancreatitis: a model for inflammatory diseases of the pancreas. Best Pract Res Clin Gastroenterol. 16 (3), 347-363 (2002).
- Boedtkjer, E., Pedersen, S. F. The acidic tumor microenvironment as a driver of cancer. Annu Rev Physiol. 82, 103-126 (2020).
- Coussens, L. M., Werb, Z. Inflammation and cancer. Nature. 420 (6917), 860-867 (2002).
- Balkwill, F., Mantovani, A. Inflammation and cancer: back to Virchow. Lancet. 357 (9255), 539-345 (2001).
- Clevers, H. At the crossroads of inflammation and cancer. Cell. 118 (6), 671-674 (2004).
- Kato, , et al. Acidic extracellular microenvironment and cancer. Cancer Cell Int. 13 (1), 89 (2013).
- Hegyi, P., Maléth, J., Venglovecz, V., Rakonczay, Z. Pancreatic ductal bicarbonate secretion: challenge of the acinar acid load. Front Physiol. 2, 36 (2011).
- Ibrahim-Hashim, A., Estrella, V. Acidosis and cancer: from mechanism to neutralization. Cancer Metastasis Rev. 38 (1-2), 149-155 (2019).
- Vakkila, J., Lotze, M. T. Inflammation and necrosis promote tumour growth. Nat Rev Immunol. 4 (8), 641-648 (2004).
- Zepecki, J. P., et al. Regulation of human glioma cell migration, tumor growth, and stemness gene expression using a Lck targeted inhibitor. Oncogene. 38 (10), 1734-1750 (2019).
- Kim, R. K., et al. Role of lymphocyte-specific protein tyrosine kinase (LCK) in the expansion of glioma-initiating cells by fractionated radiation. Biochem Biophys Res Commun. 402 (4), 631-636 (2010).
- Hu, Y., et al. Requirement of Src kinases Lyn, Hck and Fgr for BCR-ABL1-induced B-lymphoblastic leukemia but not chronic myeloid leukemia. Nat Genet. 36 (5), 453-461 (2004).
- Sharp, N. A., Luscombe, M. J., Clemens, M. J. Regulation of c-fgr proto-oncogene expression in Burkitt's lymphoma cells: effect of interferon treatment and relationship to EBV status and c-myc mRNA levels. Oncogene. 4 (8), 1043-1046 (1989).
- Hui, A. B., Lo, K. W., Yin, X. L., Poon, W. S., Ng, H. K. Detection of multiple gene amplifications in glioblastoma multiforme using array-based comparative genomic hybridization. Lab Invest. 81 (5), 717-723 (2001).
- Fang, Z. Y., et al. Proteomic identification and functional characterization of a novel ARF6 GTPase-activating protein, ACAP4. Mol Cell Proteomics. 5 (8), 1437-1449 (2006).
- Okabe, H., et al. Isolation of development and differentiation enhancing factor-like 1 (DDEFL1) as a drug target for hepatocellular carcinomas. Int J Oncol. 24 (1), 43-48 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados