Method Article
Прямая криосекция голов дрозофил для усиленного флуоресцентного окрашивания мозга и иммуноокрашивания
В этой статье
Резюме
В этом исследовании представлен упрощенный протокол обработки тканей, включающий обезглавливание, фиксацию, криосекцию, флуоресцентное окрашивание, иммуноокрашивание и визуализацию, который может быть расширен до конфокальной и многофотонной визуализации. Метод сохраняет эффективность, сравнимую со сложными вскрытиями, минуя необходимость в продвинутых моторных навыках. Количественный анализ изображений обеспечивает широкие исследовательские возможности.
Аннотация
Иммуноокрашивание мозга Drosophila melanogaster имеет важное значение для изучения механизмов, лежащих в основе сложного поведения, нейронных цепей и паттернов экспрессии белков. Традиционные методы часто сопряжены с такими проблемами, как выполнение сложной диссекции, поддержание целостности тканей и визуализация конкретных паттернов экспрессии во время визуализации с высоким разрешением. Мы представляем оптимизированный протокол, который сочетает в себе криосекцию с флуоресцентным окрашиванием и иммуноокрашиванием. Этот метод улучшает сохранность тканей и четкость сигнала, а также снижает потребность в трудоемком вскрытии для визуализации мозга дрозофилы. Метод включает в себя быструю диссекцию, оптимальную фиксацию, криопротекцию и криосекцию с последующим флуоресцентным окрашиванием и иммуноокрашиванием. Протокол значительно снижает повреждение тканей, усиливает проникновение антител и позволяет получать четкие, четко определенные изображения. Мы демонстрируем эффективность этого подхода, визуализируя конкретные нейронные популяции и синаптические белки с высокой точностью. Этот универсальный метод позволяет анализировать различные белковые маркеры в мозге взрослого человека в нескольких z-плоскостях и может быть адаптирован для других тканей и модельных организмов. Протокол предоставляет надежный и эффективный инструмент для исследователей, проводящих высококачественную иммуногистохимию в нейробиологических исследованиях дрозофилы. Детальная визуализация этого метода способствует всестороннему анализу нейроанатомии, патологии и локализации белков, что делает его особенно ценным для исследований в области нейробиологии.
Введение
Сложное поведение, начиная от социальных взаимодействий1, сенсорного восприятия и обработкиинформации2, обучения 3 и заканчивая движением4, управляется мозгом. Неврологические расстройства также становятся все более распространенными и, по прогнозам, со временем будут увеличиваться 5,6. Крайне важно изучить, как мозг работает как в здоровом, так и в болезнетворном состоянии. Центральная догма молекулярной биологии предполагает, что одной из наиболее важных функций биологических единиц являютсябелки-7, и как их количество, так и место их экспрессии имеет решающее значение для понимания того, как работает мозг.
Drosophila melanogaster, широко известная как плодовая муха, является очень ценной моделью для изучения функции мозга в условиях старения и патофизиологических состояний8. Наличие передовых генетических инструментов у дрозофил позволяет исследователям изучать функцию практически любого белка9, с обширными генетическими библиотеками почти для каждого гена, которыелегко доступны. В сочетании с короткой продолжительностью жизни и высокой скоростью размножения эти особенности делают дрозофилу исключительной модельюдля исследования мозга. Это привело к значительным достижениям, в том числе к разработке полной карты мозга мухи12, и даже способствовало присуждению Нобелевской премии за выяснение нейронных механизмов циркадных ритмов и молекулярных часов 13,14,15. В результате, дрозофила остается мощной и универсальной системой, способствующей нашему пониманию функций мозга и обеспечивающей беспрецедентное понимание неврологических процессов.
Иммуногистохимия и иммунофлуоресценция являются основополагающими инструментами для изучения экспрессии белков in situ. В отличие от таких методов, как вестерн-блоттинг, который позволяет проводить только полуколичественный анализ и обычно проводится на объемных тканях16, или сложных и дорогостоящих методов, таких как масс-спектрометрия для измерения уровня белка17, иммуногистохимия относительно проста и позволяет как количественно оценить экспрессию белка, так и измерить локализацию белка в ткани или клетке. Важно отметить, что флуоресцентная иммуногистохимия также может быть мультиплексирована для измерения нескольких белков для идентификации конкретных типов клеток и тканей или ответа на несколько вопросов в одной и той же ткани. Кроме того, тканевая фиксация может позволить сравнивать различные экспериментальные условия, генотипы, возраст и циркадные временные точки. Тем не менее, флуоресцентная иммуногистохимия может быть сложной задачей, и многие факторы могут влиять на качество изображения. Этот оптимизированный протокол криосекции и иммуноокрашивания мозга дрозофил направлен на улучшение визуализации с высоким разрешением за счет улучшения сохранности тканей, проникновения антител и визуализации нейронных популяций и белковых маркеров. Разработан для решения проблем при использовании традиционных методов, таких как сложная диссекция, повреждение тканей и ограниченное разрешение визуализации, связанное с монтированием всего мозга18. Этот протокол сочетает в себе криосекцию с флуоресцентным окрашиванием для обеспечения структурной целостности и четкого изображения в нескольких z-плоскостях. По сравнению с цельными препаратами, этот метод сводит к минимуму искажения, способствует более глубокой диффузии антител и обеспечивает четкий нейроанатомический анализ и анализ локализации белков18. Его универсальность позволяет адаптироваться к другим тканям и модельным организмам, предлагая надежный и эффективный инструмент для исследований в области нейробиологии19,20. Он может быть адаптирован для изучения практически любого белка и применен для изучения любого состояния, болезни или модели.
протокол
1. Подготовка оборудования
- Убедитесь, что криостат включен и установлен на -20 °C. Включите подогреватель слайдов или небольшой инкубатор, установив его на 37 °C.
ПРИМЕЧАНИЕ: На этом этапе промаркированные предметные стекла можно поместить на обогреватель или инкубатор и оставить на неопределенный срок до разделения.
2. Приготовление растворов
- Приготовьте 50 мл 1x фосфатно-солевого буфера (PBS), pH 7,4, из 10x запаса PBS. Приготовьте раствор 4% Параформальдегида в PBS с конечным объемом 10 мл.
- Приготовьте чистящий раствор 70% этанола в воде в пульверизаторе. Приготовьте блокирующий раствор (3% бычий сывороточный альбумин (БСА) в трис-буферном физрастворе из 20-кратного запаса). Приготовьте первичный раствор антитела (разведение зависит от эксперимента). Здесь используется разведение мышиного антитела ApoE в соотношении 1:250 в 3% BSA при TBS.
- Приготовьте вторичный раствор антитела (разведение зависит от эксперимента). Здесь используется разведение 1:500 Alexa Flour 750 A21037 Goat Anti-Mouse Secondary в 3% BSA в TBS.
- Приготовьте раствор флуоресцентного морилки (разведение зависит от эксперимента). Здесь готовится раствор нильского красного в концентрации 5 мкг/мл в PBS.
ПРИМЕЧАНИЕ: Все растворы, особенно флуоресцентные, следует хранить в холодильнике и хранить в темном охлажденном контейнере. Их также следует довести до комнатной температуры непосредственно перед использованием.
3. Забор ткани
- После получения мушек во флаконах для старения откройте клапан на коврике CO2 и быстро сбросьте мух на коврик, чтобы избежать побега. Подождите, пока мухи потеряют сознание и перестанут двигаться. Положение перемещается под микроскопом SZ61 путем перемещения коврика под линзой объектива. Отрегулируйте увеличение и сфокусируйтесь так, чтобы мухи были хорошо видны и их было удобно обезглавливать.
ПРИМЕЧАНИЕ: В этом примере используются мухи ELAV/+ и ELAV>ApoE4 - Вставьте пружинные ножницы между грудной клеткой и головой, плотно сожмите и обезглавьте от 5 до 10 головок мух в каждой экспериментальной группе. Верните неиспользованных мух в их стареющий флакон.
ПРИМЕЧАНИЕ: Если существуют опасения по поводу проникновения фиксатора, можно сделать небольшой разрез на задней части головки, чтобы обеспечить более высокую проникаемость фиксирующего агента на шаге 4.1. - С помощью щетки аккуратно поместите головки в пробирки объемом 1,5 мл на лед до тех пор, пока не будут собраны группы ELAV/+ и ELAV>ApoE4.
4. Фиксация всей ткани
- Извлеките пробирки изо льда и нанесите пипеткой 100 мкл 4% параформальдегида в растворе PBS в каждую пробирку, следя за тем, чтобы все головки были погружены в раствор. Если головки прилипают к стенкам трубки и избегают контакта с раствором, используйте щетку, чтобы аккуратно надавить на них вниз, или слегка постучите по горизонтальной поверхности, чтобы обеспечить надлежащий контакт.
- Поместите на орбитальный шейкер со средним режимом на 15 минут. Через 15 минут выбросьте раствор параформальдегида и замените его 1x PBS на 10 минут, убедившись, что все головки погружены в раствор.
- Каждый раз отбрасывая предыдущий раствор, промойте салфетку PBS 2x по 10 минут каждая, всего 3 стирки.
- После окончательной промывки переложите головки в 10% сахарозу в растворе PBS, убедившись, что головки погружены в трубку. Оставьте их на ночь для оптимального насыщения.
ПРИМЕЧАНИЕ: Если требуется визуализация в тот же день, инфузию сахарозы можно уменьшить; Тем не менее, эффекты криопротектора также будут пропорционально снижены.
5. Подготовка формы
- Заполните этикетированную форму примерно на 50% составом для оптимальной температуры резки (OCT), чтобы он распределился по всем 4 углам формы.
- С помощью щетки осторожно поместите головки на поверхность ОКТ внутри формы. При помещении нескольких экспериментальных групп в одну и ту же форму убедитесь, что эти группы разделены внутри формы, чтобы избежать путаницы.
ПРИМЕЧАНИЕ: Важно предотвратить разведение соединения ОКТ из-за загрязнения предыдущим раствором сахарозы через щетку. Кроме того, при глубоком введении в ОКТ с помощью щетки может образоваться множество пузырьков вокруг головок. Избегайте этих ошибок, чтобы предотвратить проблемы с разделами в будущем. - С помощью кончика щипцов медленно прижмите каждую головку ко дну формы глазами, обращенными ко дну. Эта ориентация выбирается для разреза в корональной плоскости.
- Избегайте прокола или раздавливания головок о дно формы во время этого процесса. Выровняйте все заголовки в измерениях X, Y и Z так, чтобы в каждой секции одновременно находились все объекты. Обеспечьте медленное погружение, чтобы уменьшить образование пузырьков воздуха.
- После того, как все головки будут правильно выровнены, осторожно поместите формы непосредственно в температуру -20 °C для замораживания.
ПРИМЕЧАНИЕ: Если во время секционирования наблюдается значительное смещение соосных частей, рассмотрите возможность использования сухого льда или жидкого азота для первоначального мгновенного замораживания формы. - После того, как форма в основном застынет, заполните оставшуюся часть OCT и дайте ей застыть перед хранением в течение длительного времени при температуре -80 °C.
6. Криосекция форм
ПРИМЕЧАНИЕ: Как правило, рекомендуется подготовить и вырезать заготовку формы перед резкой экспериментальных групповых форм. Это позволяет обеспечить надлежащую функциональность колеса, лезвия и стекла с защитой от скручивания непосредственно перед разделкой ткани.
- Прикрепите биту патрона к форме, нанеся на форму большое количество OCT и поместив биту сверху, прижав ее плашмя. Дайте ему полностью застыть в криостате, обычно в течение 5 минут.
- Извлеките биту и блок OCT из формы и поместите его в патрон, убедившись, что форма остается правильно ориентированной сверху вниз. Затяните ключ патрона до упора.
- Совместите блок с лезвием с помощью ручек регулировки и регуляторов глубины патрона.
- Установите ширину сечения равной 20 мкм. Разрежьте каждый ломтик медленным, но последовательным движением, позволяя стеклу с защитой от перекатов захватить каждый кусочек. Снимайте секции с помощью подогретых слайдов, прикоснувшись слайдом к ближайшему краю секции и позволив секции подняться на слайд. На затворе стандартного размера (25 мм x 75 мм x 1 мм) можно разместить до восьми секций при правильном расстоянии.
ПРИМЕЧАНИЕ: При выборе разделов для сбора необходимо сделать выбор. В результате ориентации встраивания более ранние срезы будут находиться с передней, а более поздние срезы будут с задних частей головы. Таким образом, если интерес к одной конкретной области лежит больше, чем к другой, выбор раздела может быть скорректирован соответствующим образом. В качестве альтернативы, все срезы можно собрать на нескольких предметных стеклах, пока не останется ткани. - Дайте предметным стеклам высохнуть при комнатной температуре не менее 30 минут, но не более 1 часа.
7. Окрашивание и ИГХ
ПРИМЕЧАНИЕ: Для этого протокола метод будет детализировать ИГХ с использованием неконъюгированного первичного антитела. Флюорохромные конъюгированные антитела или другие флуоресцентные красители, которые могут быть выполнены в одну стадию, следует использовать вместе со вторичным антителом, если оба они должны использоваться вместе.
- Сразу после высыхания удалите ОКТ с краев предметного стекла с помощью бритвенного лезвия, оставив место для гидрофобной границы. Нарисуйте гидрофобную границу на каждом слайде с помощью маркера. Дайте ему высохнуть в течение 5 минут.
- Промойте все предметные стекла 3 раза в течение 5 минут каждый с помощью PBS, аккуратно нанося пипетирование на верхнюю часть предметного стекла, по возможности избегая пипетирования непосредственно поверх ткани.
ПРИМЕЧАНИЕ: Здесь наиболее полезна пипетка объемом 1000 μл. Предметное стекло стандартного размера с салфеткой должно быть полностью покрыто 750μл любого раствора. Также можно использовать выдвижные решетки и ведра. - После того, как предметные стекла будут промыты, нанесите пипетку 3% BSA в блокирующем растворе TBS на предметные стекла. Дайте поинкубироваться в течение 30 минут.
- Выбросьте блокирующий раствор и нанесите первичный раствор антитела на предметные стекла. В этом случае разведение SC-13521 ApoE в соотношении 1:250 в 3% BSA при TBS. Дайте антителу инкубироваться в течение ночи при 4 °C или в течение 1 часа при комнатной температуре. Используйте влажные салфетки или бумажные полотенца, чтобы раствор не высох за ночь.
- Выбросьте первичное антитело и с помощью пипетки промойте 3 раза по 5 минут каждый PBS.
- Добавьте вторичный раствор антитела. В этом случае разведение AF 750 Goat Anti-Mouse в соотношении 1:500 в дополнение к концентрации 5 мкг/мл Nile Red, все в 3% BSA в TBS. Дайте ему инкубироваться в течение 1 часа при комнатной температуре.
ПРИМЕЧАНИЕ: Мы одновременно инкубируем флуоресцентный краситель и вторичное антитело в одном буфере, 3% BSA в TBS. Это предпочтительно до тех пор, пока нет известных конфликтов между двумя реагентами. Если конфликты существуют, инкубируйте отдельно и выполняйте дополнительно 3 промывки между инкубациями. - Промойте слайды 3 раза PBS по 5 мин каждая. После окончательной промывки оставьте небольшое количество PBS на предметном стекле.
8. Монтаж и подготовка к визуализации
- С помощью пипетки объемом 1000 мкл добавьте 3-5 капель затвердевающего монтажного материала, содержащего DAPI (0,9 мкг/мл), равномерно по предметному стеклу, избегая прямого попадания капель на ткань.
- Поместите покровное стекло на предметное стекло, не допуская образования пузырьков воздуха.
ПРИМЕЧАНИЕ: Использование щипцов может помочь в этом, позволяя покровному стеколу скользить близко к поверхности предметного стекла, прежде чем окончательно освободиться. - Осторожно обращайтесь со свежеустановленными горками и храните их в горизонтальном положении до полного высыхания. Заклейте горки лаком для ногтей, если предполагается длительное хранение.
- Делайте снимки как можно скорее, чтобы избежать флуоресцентного распада.
9. Получение изображения
ПРИМЕЧАНИЕ: Для получения изображений будет подробно описано использование программного обеспечения Olympus Cell Sense Dimensions.
- Перед визуализацией осмотрите предметные стекла и протрите их, используя 70% этанол в водном растворе. Если слайды отображаются сразу после монтажа, будьте особенно осторожны при очистке, чтобы не повредить покровное стекло. Дайте поверхностям предметного стекла и защитного стекла высохнуть в течение 5 минут перед нанесением изображения.
- Выберите каждый нужный канал для захвата, в данном случае каналы для DAPI, Nile Red и AF 750.
- Выберите желаемое увеличение, как описано ниже. Выбор увеличения зависит от эксперимента; Здесь используйте 10-кратное увеличение.
ПРИМЕЧАНИЕ: Можно использовать все увеличения, включая масляные линзы. При желании нанесите на поверхность предмета горки иммерсионное масло. - Для каждого канала откалибруйте правильное время экспозиции на основе самых ярких флуоресцентных объектов в эксперименте. Избегайте передержки при создании как можно более яркого изображения.
ПРИМЕЧАНИЕ: В целом, двумя основными факторами, определяющими некачественный захват процесса, являются переэкспонирование, приводящее к потере четкости, и слишком большой фоновый сигнал, который трудно отделить от истинного сигнала. Кроме того, экспозиция должна быть установлена независимо для каждого используемого уникального увеличения. - Выберите папку для сохранения и присвойте имя объединенным изображениям в меню. После захвата все изображения будут находиться в этой папке и носить имя, указанное здесь.
- Делайте снимки, сначала сфокусировавшись на объекте в канале, который позволяет получить наилучшую точку фокусировки, а затем начните съемку. Поддерживайте процедуру концентрации внимания на каждом объекте в одном и том же канале для обеспечения согласованности на протяжении всего эксперимента.
- Захватите все экспериментальные группы, используемые для последующих сравнений, в тот же день, чтобы избежать распада флуоресценции между сравниваемыми группами.
- Выберите желаемое увеличение, как описано ниже. Выбор увеличения зависит от эксперимента; Здесь используйте 10-кратное увеличение.
10. Количественная оценка
ПРИМЕЧАНИЕ: Количественная оценка может быть выполнена с использованием различных программ. В этой статье рассматривается использование Olympus CellSense Dimensions.
- После сбора просмотрите изображения. Удалите разделы, которые имеют дефекты или артефакты сечения, из папки количественного анализа. Выберите изображения, которые отражают цель количественной оценки. Примерами дефектов являются пузыри, разорванные участки, перекрывающиеся ткани, пыль или мусор.
- Чтобы выбрать подходящие изображения, убедитесь, что все изображения с изображением тканей мозга используются для количественной оценки, чтобы отразить общую экспрессию во всем мозге. В качестве альтернативы используйте изображения, отражающие только переднюю, среднюю или заднюю часть мозга, чтобы дать представление о различиях в экспрессии в этих областях.
- В меню подсчета и измерения определите интересующие параметры и их границы для количественной оценки изображений.
- Для количественной оценки выражения ApoE путем сравнения средних значений интенсивности выберите пороговые значения таким образом, чтобы учитывались все пиксели для этого канала (0-бесконечность). Кроме того, очерчивайте области интереса с помощью доступных инструментов рисования.
- Выполните подсчет и измерьте либо пакетно для всех файлов, либо по отдельности для каждого изображения.
- Для пакетной обработки запишите настройки и выполнение количественного анализа, а затем выберите папку для выполнения количественного анализа. Обработка в пакете доступна через вкладку «Менеджер макросов» и значительно ускоряет рабочий процесс.
- Экспортируйте таблицу данных в таблицу для построения графика. Для этого используйте меню результатов подсчета и измерения при автоматическом открытии или экспорте в таблицу при выполнении в пакете. Эти таблицы данных будут содержать все выбранные параметры, выбранные на шаге 10.2.
- Для статистического анализа и построения графиков отображайте данные с помощью электронной таблицы напрямую или с помощью другого программного обеспечения. Знакомство с выбранным программным обеспечением является ключом к созданию точного представления результатов эксперимента. Здесь абсолютные значения интенсивности экспрессии ApoE в мозге мутанта были нормализованы до контрольной группы, а затем построены с помощью GraphPad Prism.
Результаты
Описанный выше метод позволяет проводить флуоресцентную визуализацию мозга взрослых мух надежно и без утомительного вскрытия. Как показано на рисунке 1, этот метод прост и может быть выполнен быстро, если все образцы, оборудование и материалы легко доступны. В качестве альтернативы, при хранении при температуре -80 °C на стадии OCT-формы, образцы могут быть сохранены для использования в течение многих недель. Исследователям не нужно долго обучаться, чтобы изучить простые методы препарирования и встраивания, что делает этот метод вполне доступным.
Примеры флуоресцентной микроскопии, выполненной с использованием этого метода, можно увидеть на рисунке 2A-D. Экспрессия как метки антител (ApoE), так и флуоресцентного красителя (Nile Red) хорошо определена. Кроме того, можно заметить высокую целостность мозговой ткани. Изображения могут быть дополнительно уточнены с помощью общих функций программного обеспечения для обработки изображений, таких как деконволюция, которая также показана на рисунке 2A'-D'. Деконволюция полезна для улучшения резкости и контрастности, а также для снижения шума.
Что касается количественной оценки изображений, все изображения могут быть количественно оценены по стандартным параметрам, таким как количество объектов, средняя площадь объекта, интенсивность и доля площади. Ограничения количественной оценки действительно зависят от выбранного программного обеспечения, но в целом перечисленные выше параметры позволяют провести адекватное исследование и доступны в большинстве приложений. На рисунке 3 показана гистограмма, созданная на основе средних значений интенсивности в областях мозга на нескольких изображениях. Это служит для визуализации средней интенсивности мозга данного генотипа. В данном случае ELAV/+ и ELAV>ApoE4.
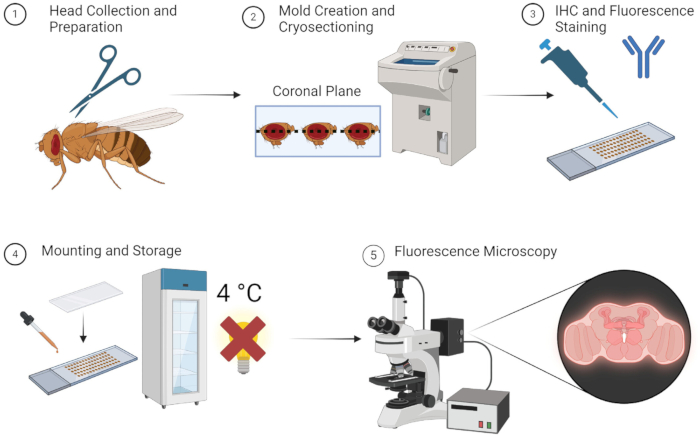
Рисунок 1: Рабочий процесс для среза мозга дрозофилы и визуализации. 1. Головы дрозофил собирают путем обезглавливания с помощью тонких ножниц. 2. После фиксации собранные головки с помощью ОКТ встраивают в форму и криосекцию для получения тонких срезов мозга. 3. Отделы головного мозга подвергают иммуногистохимическому окрашиванию (ИГХ) первичными антителами или флуоресцентному окрашиванию. 4. После окрашивания секции монтируются с помощью защитного стекла и хранятся при температуре 4 °C в темноте для сохранения целостности флуоресценции. 5. Срезы мозга визуализируются с помощью флуоресцентной микроскопии для изучения целевых белков или клеточных структур. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Иммуногистохимия и флуоресцентное окрашивание криосекционных голов. (А-Г) Репрезентативные изображения голов 7-недельных самок мух, окрашенных на экспрессию ApoE, липиды (Nile Red) и DAPI. Эти изображения демонстрируют экспрессию ApoE4 у человека (Elav>ApoE4), в то время как у контрольных мух Elav/+ эта экспрессия ApoE отсутствует. Окрашивание липидов нильским красным (Elav>ApoE4 и Elav/+). Целостность тканей мозга с помощью этого метода также подтверждается. (А'-Д') Они представляют собой A, B, C и D после деконволюции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Относительная количественная оценка ApoE. Показаны результаты количественной оценки экспрессии белка ApoE в мозге 7-недельной дрозофилы . Абсолютные значения интенсивности были собраны для мутантных субъектов Elav/+ и Elav>ApoE4, а затем нормализованы до Elav/+. Статистическая значимость между Elav>ApoE4 и Elav/+ очевидна. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
В этой статье мы представляем протокол для точной флуоресцентной визуализации криосекционированных голов дрозофил. Это простой подход, который имеет несколько важных положительных моментов. А именно, методы достаточно просты, чтобы их мог пройти любой, кто прошел базовую подготовку по технике безопасности в лаборатории, они могут быть адаптированы для измерения экспрессии любого белка, для которого существуют высококачественные антитела, и они позволяют точно измерить как то, сколько белка экспрессируется и где эта экспрессия происходит в голове. Если качество тканей и изображений достаточно высокое, это потенциально может позволить 3D-картирование экспрессии по всей голове дрозофилы .
В отличие от технически сложных подходов к выделению мозга для визуализации в сочетании с конфокальной микроскопией, этот протокол позволяет проводить визуализацию всей головы дрозофилы, а не только мозга. Это особенно важно, учитывая, что зрительная система мухи является важной моделью функции нейронов21, но некоторые из этих структур могут быть утрачены во время изоляции мозга. Он также обеспечивает контроль тканей в срезе, например, мышц хоботка, для определения того, является ли экспрессия представляющего интерес белка специфичной для определенных типов клеток или типов тканей22. Это позволяет проводить прямое сравнение между тканями, а не использовать отдельные срезы, на которые могут повлиять небольшие различия в условиях. Еще одним преимуществом этого протокола и использования дрозофилы в качестве модельной системы является то, что головы мух очень маленькие(19,20), поэтому можно проводить относительно высокую флуоресцентную визуализацию. Нам удалось разместить более 50 головок в одном блоке. С 8 секциями, которые могут быть размещены на горке стандартного размера, 1 слайд может содержать 8 уникальных секций на муху, что в общей сложности составляет 400 уникальных секций. Важно отметить, что все секции подвергаются воздействию одних и тех же экспериментальных условий и временных точек для достижения максимальной достоверности при сравнении между группами. Кроме того, этот протокол требует использования только стандартного флуоресцентного микроскопа, а не конфокального микроскопа, что может быть непомерно дорого для лабораторий или учреждений, которые не имеют высокой финансовой поддержки и обеспечивают более широкий доступ к этой визуализации.
Одним из ключевых ограничений этого протокола, которое присуще иммуноокрашиванию, является важность использования высококачественных антител и соответствующего контроля при оптимизации антител. Крайне важно убедиться в том, что антитела являются селективными и чувствительными к интересующему белку, так как часто происходит окрашивание не по назначению, что может привести к проблемам с определением реальности флуоресцентного сигнала. Для этого проверьте как первичные, так и вторичные антитела. К счастью, это легко сделать благодаря легкодоступным генетическим инструментам дрозофилы. Чтобы проверить качество первичного антитела, мы рекомендуем дополнить протокол с мухами дикого типа и подопытными мухами, а также с положительными контрольными мухами, которые сверхэкспрессируют интересующий белок, и отрицательными контрольными мухами, у которых ген нокаутирован или сбит с ног. Эти контрольные группы установят диапазон уровней экспрессии и ожидаемой флуоресценции, что послужит ориентиром для оценки того, где экспериментальные мухи находятся в этом спектре. Крайне важно тестировать многократные разведения первичного антитела, так как слишком малое количество приведет к некачественному окрашиванию, которое не приведет к флуоресценции выше фона там, где присутствует белок, в то время как слишком большое количество антител приведет к нецелевому окрашиванию там, где белок отсутствует. Этот подход с множественным разведением должен включать группу без первичного антитела, которая будет проверять качество вторичного антитела, поскольку флуоресценция в этой группе будет иметь место только при наличии фоновой флуоресценции и обеспечивает дополнительную отрицательную контрольную группу, которая показывает пределы обнаружения флуоресценции вторичным антителом. При необходимости используйте другие условия инкубации, т. е. время или температуру, чтобы максимизировать соотношение сигнал/шум на конечных изображениях. Мы повторяем, что высококачественные антитела, наряду с высококачественными тканями, имеют решающее значение для высококачественной иммунофлуоресцентной визуализации.
В целом, иммунофлуоресцентная визуализация является мощным инструментом для изучения биологии в более широком смысле и нейробиологии в частности. Это, в сочетании с мощными генетическими инструментами, доступными у дрозофилы, может раскрыть важные знания о том, как белки влияют на здоровье и болезни. Мозг мухи был явно важен для выяснения того, как функционирует человеческий мозг, и будет продолжать это делать. Из-за адаптивности протокола, о котором мы здесь говорим, роль практически любого белка (или липида) в голове может быть изучена в контексте любого заболевания или состояния, ограниченного только качеством антител. Таким образом, иммунофлуоресцентная визуализация, вероятно, будет иметь решающее значение для будущих исследований того, как работает мозг, и окажет значительное влияние на здоровье человека и развитие терапии.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарим сотрудников лаборатории Melkani за их помощь и ценные отзывы при разработке протокола. Запасы мух, Elav-Gal4 (BL#458) и UAS-ApoE4 (BL#76607) были получены из Bloomington Drosophila Stock Center (Блумингтон, штат Индиана, США). Эта работа была поддержана грантами Национальных институтов здравоохранения (NIH) AG065992 и RF1NS133378 для G.C.M. Эту работу также поддерживают фонды UAB Startup 3123226 и 3123227 G.C.M.
Материалы
| Name | Company | Catalog Number | Comments |
| 1000 uL Pipette | Eppendorf | 3123000063 | |
| 1000 uL Pipette Tips | Olympus Plastics | 23-165R | |
| 10X Phosphate Buffered Saline (PBS) | Fisher | J62036.K7 | ph=7.4 |
| 200 Proof Ethanol | Decon Laboratories | 64-17-5 | |
| 20X Tris Buffered Saline | Thermo Scientific | J60877.K2 | pH=7.4 |
| AF750 Goat Anti-Mouse Secondary Antibody | Alexa Fluor | A21037 | |
| Anti-Roll Glass | IMEB | AR-14047742497 | |
| ApoE Mouse Primary Antibody | Santa Cruz | SC13521 | |
| Bovine Serum Albumin | Fisher | 9048-46-8 | |
| Centrifuge Tubes 1.5 mL | Fisher | 05-408-129 | |
| Charged Slides | Globe Scientific | 1415-15 | |
| Cryosectioning Molds | Fisher | 2363553 | |
| Cryostat | Leica | CM 3050 S | |
| Cryostat Blades | C.L. Sturkey | DT554N50 | |
| Distilled Water | |||
| Dry Ice | ??? | ??? | |
| Fine Forceps | Fine Science Tools | 11254-20 | |
| Fly Pad | Tritech Research | MINJ-DROS-FP | |
| Hardening mounting Media with Dapi | Vectashield | H-1800 | |
| Kimwipes | Kimtech | 34120 | |
| Microscope | Olympus | SZ61 | |
| Nile Red | Sigma | N3013 | |
| Optimal Cutting Temperature Compound | Fisher | 4585 | |
| Orbital Shaker | OHAUS | SHLD0415DG | |
| Paraformaldehyde 20% | Electron Microscopy Sciences | 15713 | |
| Razor Blades | Gravey | #40475 | |
| Spring Scissors | Fine Science Tools | 15000-10 | |
| Sucrose | Fisher | S5-500 |
Ссылки
- Fabbri-Destro, M., Rizzolatti, G. Mirror neurons and mirror systems in monkeys and humans. Physiology. 23, 171-179 (2008).
- Faust, T. E., Gunner, G., Schafer, D. P. Mechanisms governing activity-dependent synaptic pruning in the developing mammalian CNS. Nat Rev Neurosci. 22, 657-673 (2021).
- Roozendaal, B., McEwen, B. S., Chattarji, S. Stress, memory and the amygdala. Nat Rev Neurosci. 10, 423-433 (2009).
- Arber, S., Costa, R. M. Networking brainstem and basal ganglia circuits for movement. Nat Rev Neurosci. 23, 342-360 (2022).
- GBD 2019 Dementia Forecasting Collaborators. Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050: an analysis for the Global Burden of Disease Study 2019. Lancet Public Health. 7, e105-e125 (2022).
- Huang, Y., Li, Y., Pan, H., Han, L. Global, regional, and national burden of neurological disorders in 204 countries and territories worldwide. J Glob Health. 13, 04160 (2023).
- Crick, F. Central dogma of molecular biology. Nature. 227, 561-563 (1970).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9, 235-244 (2016).
- Hales, K. G., Korey, C. A., Larracuente, A. M., Roberts, D. M. Genetics on the Fly: A primer on the Drosophila model system. Genetics. 201, 815-842 (2015).
- Larkin, A., et al. FlyBase: updates to the Drosophila melanogaster knowledge base. Nucleic Acids Res. 49, D899-D907 (2021).
- Jeibmann, A., Paulus, W. Drosophila melanogaster as a model organism of brain diseases. Int J Mol Sci. 10, 407-440 (2009).
- Winding, M., et al. The connectome of an insect brain. Science. 379, eadd9330 (2023).
- Bargiello, T. A., Jackson, F. R., Young, M. W. Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature. 312, 752-754 (1984).
- Zehring, W. A., et al. P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell. 39, 369-376 (1984).
- Huang, R. C. The discoveries of molecular mechanisms for the circadian rhythm: The 2017 Nobel Prize in Physiology or Medicine. Biomed J. 41, 5-8 (2018).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. N Am J Med Sci. 4, 429-434 (2012).
- Ong, S. E., Foster, L. J., Mann, M. Mass spectrometric-based approaches in quantitative proteomics. Methods. 29, 124-130 (2003).
- Behnke, J. A., Ye, C., Moberg, K. H., Zheng, J. Q. A protocol to detect neurodegeneration in Drosophila melanogaster whole-brain mounts using advanced microscopy. STAR Protoc. 2, 100689 (2021).
- Moraes, R. C. M., et al. Apolipoprotein E induces lipid accumulation through Dgat2 that is prevented with time-restricted feeding in Drosophila. Genes. 15 (11), 1376 (2024).
- Roth, J. R., et al. Rapamycin reduces neuronal mutant huntingtin aggregation and ameliorates locomotor performance in Drosophila. Front Aging Neurosci. 15, 1223911 (2023).
- Currier, T. A., Pang, M. M., Clandinin, T. R. Visual processing in the fly, from photoreceptors to behavior. Genetics. 224, (2023).
- McKellar, C. E., Siwanowicz, I., Dickson, B. J., Simpson, J. H. Controlling motor neurons of every muscle for fly proboscis reaching. Elife. 9, (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены