Method Article
التقطيع بالتبريد المباشر لرؤوس ذبابة الفاكهة لتعزيز تلطيخ مضان الدماغ والتلوين المناعي
In This Article
Summary
تقدم هذه الدراسة بروتوكولا مبسطا لمعالجة الأنسجة يتضمن قطع الرأس ، والتثبيت ، والقطع بالتبريد ، وتلوين التألق ، والتلوين المناعي ، والتصوير ، والذي يمكن تمديده إلى التصوير متحد البؤر والتصوير متعدد الفوتونات. تحافظ الطريقة على فعالية مماثلة للتشريح المعقد ، متجاوزة الحاجة إلى المهارات الحركية المتقدمة. يوفر التحليل الكمي للصور إمكانات استقصائية واسعة النطاق.
Abstract
يعد التلوين المناعي ذبابة الفاكهة السوداء أدمغة ضرورية لاستكشاف الآليات الكامنة وراء السلوكيات المعقدة والدوائر العصبية وأنماط التعبير عن البروتين. غالبا ما تنطوي الطرق التقليدية على تحديات مثل إجراء تشريح معقد ، والحفاظ على سلامة الأنسجة ، وتصور أنماط تعبير محددة أثناء التصوير عالي الدقة. نقدم بروتوكولا محسنا يجمع بين التقطيع بالتبريد والتلوين الفلوري والتلوين المناعي. تعمل هذه الطريقة على تحسين الحفاظ على الأنسجة ووضوح الإشارة وتقلل من الحاجة إلى تشريح شاق لتصوير ذبابة الفاكهة الدماغ. تستلزم الطريقة التشريح السريع ، والتثبيت الأمثل ، والحماية بالتبريد ، والاستئصال بالتبريد ، يليه تلطيخ الفلورسنت والتلوين المناعي. يقلل البروتوكول بشكل كبير من تلف الأنسجة ، ويعزز اختراق الأجسام المضادة ، وينتج صورا حادة ومحددة جيدا. نظهر فعالية هذا النهج من خلال تصور مجموعات عصبية محددة وبروتينات متشابكة بدقة عالية. تسمح هذه الطريقة متعددة الاستخدامات بتحليل علامات البروتين المختلفة في الدماغ البالغ عبر طائرات z متعددة ويمكن تكييفها مع الأنسجة والكائنات الحية النموذجية الأخرى. يوفر البروتوكول أداة موثوقة وفعالة للباحثين الذين يجرون الكيمياء المناعية عالية الجودة في دراسات ذبابة الفاكهة العصبية. يسهل التصور التفصيلي لهذه الطريقة التحليل الشامل للتشريح العصبي وعلم الأمراض وتوطين البروتين ، مما يجعلها ذات قيمة خاصة لأبحاث علم الأعصاب.
Introduction
السلوكيات المعقدة التي تتراوح من التفاعلات الاجتماعية1 ، والإدراك الحسي والمعالجة2 ، والتعلم3 ، إلى الحركة4 مدفوعة بالدماغ. الاضطرابات العصبية شائعة بشكل متزايد ومن المتوقع أن تزداد بمرور الوقت5،6. من الأهمية بمكان دراسة كيفية عمل الدماغ في كل من الصحة والمرض. تشير العقيدة المركزية للبيولوجيا الجزيئية إلى أن واحدة من أهم وظائف الوحدات البيولوجية هي البروتينات7 ، ومقدار ومكان التعبير عنها أمران حاسمان لفهم كيفية عمل الدماغ.
ذبابة الفاكهة السوداء ، المعروفة باسم ذبابة الفاكهة ، هي نموذج ذو قيمة عالية لدراسة وظائف المخ في ظل الشيخوخة والظروف الفيزيولوجيةالمرضية 8. يتيح توفر الأدوات الجينية المتقدمة في ذبابة الفاكهة للباحثين استكشاف وظيفة أي بروتين9 تقريبا ، مع مكتبات وراثية شاملة لكل جين تقريبا يمكن الوصول إليه بسهولة10. إلى جانب عمرها القصير ومعدل التكاثر المرتفع ، فإن هذه الميزات تجعل ذبابة الفاكهة نموذجا استثنائيا لأبحاث الدماغ11. وقد أدى ذلك إلى إنجازات كبيرة ، بما في ذلك تطوير خريطة دماغية كاملة للذبابة12 ، بل وساهم في جائزة نوبل لتوضيح الآليات العصبية لإيقاعات الساعة البيولوجية والساعات الجزيئية13،14،15. نتيجة لذلك ، تظل ذبابة الفاكهة نظاما قويا ومتعدد الاستخدامات ، مما يدفع فهمنا لوظائف المخ إلى الأمام ويوفر رؤى غير مسبوقة في العمليات العصبية.
تعتبر الكيمياء المناعية والتألق المناعي من الأدوات الأساسية لدراسة تعبير البروتين في الموقع. على عكس تقنيات مثل Western Blot ، التي تسمح فقط بالتحليل شبه الكمي ويتم إجراؤها عادة في الأنسجةالسائبة 16 ، أو التقنيات المعقدة والمكلفة مثل قياس الطيف الكتلي لقياس مستوى البروتين17 ، فإن الكيمياء المناعية واضحة نسبيا وتسمح بالقياس الكمي للتعبير عن البروتين وقياس توطين البروتين داخل الأنسجة أو الخلية. الأهم من ذلك ، يمكن أيضا تعدد الكيمياء المناعية الفلورية لقياس بروتينات متعددة لتحديد أنواع وأنسجة معينة من الخلايا أو الإجابة على أسئلة متعددة في نفس الأنسجة. بالإضافة إلى ذلك ، يمكن أن يسمح تثبيت الأنسجة بإجراء مقارنات عبر الظروف التجريبية المختلفة والأنماط الجينية والأعمار والنقاط الزمنية اليومية. ومع ذلك ، يمكن أن تكون الكيمياء النسيجية المناعية الفلورية صعبة ، ويمكن أن تؤثر العديد من العوامل على جودة الصورة. يهدف بروتوكول التقطيع بالتبريد والتلوين المناعي المحسن لأدمغة ذبابة الفاكهة إلى تعزيز التصوير عالي الدقة من خلال تحسين الحفاظ على الأنسجة واختراق الأجسام المضادة وتصور التجمعات العصبية وعلامات البروتين. تم تطويره لمواجهة التحديات في الطرق التقليدية ، مثل التشريح المعقد ، وتلف الأنسجة ، ودقة التصوير المحدودة المرتبطة بحوامل الدماغبالكامل 18. يجمع هذا البروتوكول بين التقطيع بالتبريد والتلوين الفلوري لضمان السلامة الهيكلية والتصوير الحاد عبر مستويات Z متعددة. بالمقارنة مع المستحضرات الكاملة ، تقلل هذه الطريقة من التشويه ، وتسهل انتشار الأجسام المضادة بشكل أعمق ، وتوفر تحليلات توضيحية للتوطين العصبي والبروتين18. يسمح تعدد استخداماته بالتكيف مع الأنسجة والكائنات الحية النموذجية الأخرى ، مما يوفر أداة موثوقة وفعالة لأبحاث علم الأعصاب19،20. يمكن تكييفه للنظر في أي بروتين تقريبا وتطبيقه لدراسة أي حالة أو مرض أو نموذج.
Protocol
1. إعداد المعدات
- تأكد من تشغيل ناظم التبريد وضبطه على -20 درجة مئوية. قم بتشغيل جهاز تسخين الشرائح أو الحاضنة الصغيرة ، مما يضمن ضبطه على 37 درجة مئوية.
ملاحظة: في هذه المرحلة ، يمكن وضع الشرائح المصنفة على المدفأة أو الحاضنة وتركها إلى أجل غير مسمى حتى التقسيم.
2. إعداد الحلول
- تحضير 50 مل من محلول ملحي مخزن 1x فوسفات (PBS) ، درجة الحموضة 7.4 ، من مخزون 10x PBS. تحضير محلول 4٪ بارافورمالدهيد في PBS بحجم نهائي 10 مل.
- تحضير محلول تنظيف 70٪ من الإيثانول في الماء في زجاجة رذاذ. تحضير محلول مانع (3٪ ألبومين مصل بقري (BSA) في محلول ملحي مخزن في تريس من مخزون 20 ضعفا). تحضير محلول الأجسام المضادة الأولية (التخفيف يعتمد على التجربة). هنا ، يتم استخدام تخفيف 1: 250 من الجسم المضاد للفأر ApoE في 3٪ BSA في TBS.
- تحضير محلول الأجسام المضادة الثانوية (التخفيف يعتمد على التجربة). هنا ، يتم استخدام تخفيف 1: 500 من Alexa Flour 750 A21037 Goat Anti-Mouse Secondary في 3٪ BSA في TBS.
- تحضير محلول صبغة الفلورسنت (التخفيف يعتمد على التجربة). هنا ، يتم تحضير محلول 5 ميكروغرام / مل من النيل الأحمر في PBS.
ملاحظة: يجب تبريد جميع المحاليل ، وخاصة الفلورسنت ، وتخزينها في حاوية مبردة مظلمة. يجب أيضا إحضارها إلى درجة حرارة الغرفة قبل الاستخدام مباشرة.
3. جمع الأنسجة
- بعد الحصول على الذباب في قوارير الشيخوخة ، افتح الصمام الموجود على حصيرة ثاني أكسيد الكربون2 وقم بتفريغ الذباب على السجادة بسرعة لتجنب الهروب. انتظر حتى يصبح الذباب فاقدا للوعي في الغالب ، مما يتوقف عن معظم الحركة. يطير الموضع تحت مجهر SZ61 عن طريق تحريك السجادة أسفل العدسة الشيئية. اضبط التكبير والتركيز بحيث يكون الذباب مرئيا بوضوح ومريحا لقطع الرأس.
ملاحظة: الذباب المستخدم في هذا المثال هو ELAV/+ وELAV>ApoE4 - أدخل مقصا زنبركيا بين الصدر والرأس ، واضغط بقوة ، واقطع رأس 5 إلى 10 رؤوس ذبابة لكل مجموعة تجريبية. أعد الذباب غير المستخدم إلى قارورة الشيخوخة.
ملاحظة: في حالة وجود قلق بشأن اختراق المثبت ، يمكن إجراء شق صغير على الجزء الخلفي من الرأس للسماح بزيادة اختراق عامل التثبيت في الخطوة 4.1. - باستخدام فرشاة ، ضع الرؤوس برفق في أنابيب 1.5 مل على الجليد حتى يتم جمع مجموعات ELAV / + و ELAV>ApoE4.
4. تثبيت الأنسجة الكاملة
- قم بإزالة الأنابيب من الثلج والماصة 100 ميكرولتر من 4٪ بارافورمالدهايد في محلول PBS في كل أنبوب ، مما يضمن غمر جميع الرؤوس في المحلول. إذا كانت الرؤوس تلتصق بجدران الأنبوب وتتجنب ملامسة المحلول ، فاستخدم فرشاة لدفعها برفق لأسفل أو اضغط برفق على سطح أفقي لضمان الاتصال المناسب.
- ضعه على شاكر مداري باستخدام إعداد متوسط لمدة 15 دقيقة. بعد 15 دقيقة ، تخلص من محلول Paraformaldehyde واستبدله ب 1x PBS لمدة 10 دقائق ، مع التأكد من غمر جميع الرؤوس في المحلول.
- تخلص من المحلول السابق في كل مرة ، اغسل المنديل باستخدام PBS 2x لمدة 10 دقائق لكل منهما ، ليصبح المجموع 3 غسلات.
- بعد الغسيل النهائي ، انقل الرؤوس إلى 10٪ سكروز في محلول PBS ، مع ضمان غمر الرؤوس داخل الأنبوب. اتركها طوال الليل للحصول على التشبع الأمثل.
ملاحظة: إذا كان التصوير في نفس اليوم مطلوبا ، فيمكن تقليل ضخ السكروز. ومع ذلك ، سيتم أيضا تقليل تأثيرات الحمالات البردية بشكل متناسب.
5. تحضير القالب
- املأ القالب الملصق بنسبة 50٪ تقريبا بمركب درجة حرارة القطع المثلى (OCT) ، مما يسمح له بالانتشار إلى جميع زوايا القالب الأربعة
- باستخدام فرشاة ، ضع الرؤوس بعناية على سطح OCT داخل القالب. عند وضع مجموعات تجريبية متعددة في نفس القالب ، تأكد من فصل هذه المجموعات داخل القالب لمنع الالتباس.
ملاحظة: من المهم منع تخفيف مركب OCT من خلال التلوث بمحلول السكروز السابق عبر الفرشاة. بالإضافة إلى ذلك ، يمكن أن يؤدي التنسيب العميق في OCT باستخدام الفرشاة إلى إنشاء العديد من الفقاعات حول الرؤوس. تجنب هذه الأخطاء لمنع مشكلات التقسيم لاحقا. - باستخدام طرف الملقط ، ادفع كل رأس ببطء إلى أسفل القالب مع توجيه العينين إلى الأسفل. يتم تحديد هذا الاتجاه لقطع المستوى الإكليلي.
- تجنب ثقب أو سحق الرؤوس في قاع القالب أثناء هذه العملية. قم بمحاذاة جميع الرؤوس في أبعاد X و Y و Z بحيث يحتوي كل قسم على جميع الموضوعات في وقت واحد. تأكد من الغمر البطيء لتقليل تكوين فقاعة الهواء.
- بمجرد محاذاة جميع الرؤوس بشكل صحيح ، ضع القوالب بعناية مباشرة في -20 درجة مئوية للتجميد.
ملاحظة: إذا لوحظ أن محاذاة الرؤوس متوقفة بشكل كبير أثناء التقسيم ، ففكر في استخدام الثلج الجاف أو النيتروجين السائل للتجميد الأولي للقالب. - بمجرد تجميد القالب في الغالب ، املأ الباقي ب OCT واتركه يتجمد قبل تخزينه على المدى الطويل عند - 80 درجة مئوية.
6. التقطيع بالتبريد للقوالب
ملاحظة: ينصح عموما بإعداد قالب فارغ وقطعه قبل قطع قوالب المجموعة التجريبية. هذا يسمح بضمان الوظيفة المناسبة للعجلة والشفرة والزجاج المضاد للانزلاق مباشرة قبل تقسيم الأنسجة.
- قم بتوصيل لقمة الظرف بالقالب عن طريق وضع كمية وفيرة من OCT على القالب ووضع القطعة في الأعلى ، والضغط عليها بشكل مسطح. اترك هذا يتجمد تماما في ناظم البرد ، عادة في غضون 5 دقائق.
- حرر البتة وكتلة OCT من القالب وضعها في ظرف الظرف ، مع ضمان بقاء القالب موجها بشكل صحيح من أعلى إلى أسفل. شد مفتاح الظرف حتى يتم تأمين البت.
- قم بمحاذاة الكتلة مع الشفرة باستخدام مقابض الضبط وأدوات التحكم في عمق الظرف.
- اضبط عرض القسم على 20 ميكرومتر. قص كل شريحة باستخدام حركة بطيئة ولكن متسقة ، مما يسمح للزجاج المضاد للدحرجة بالتقاط كل شريحة. التقط الأقسام باستخدام الشرائح الدافئة عن طريق لمس الشريحة إلى الحافة الأقرب للقسم والسماح للقسم بالارتفاع إلى الشريحة. يمكن وضع ما يصل إلى ثمانية أقسام على شريحة بحجم قياسي (25 مم × 75 مم × 1 مم) عند التباعد بشكل مناسب.
ملاحظة: هناك مسألة اختيار يجب اتخاذها عند اختيار الأقسام التي يجب جمعها. نتيجة لاتجاه التضمين ، ستكون الأقسام السابقة من الأمام ، وستكون الأقسام اللاحقة من الأجزاء الخلفية من الرأس. على هذا النحو ، إذا كان الاهتمام يكمن في مجال معين أكثر من الآخر ، فيمكن تعديل اختيار القسم وفقا لذلك. بدلا من ذلك ، يمكن جمع جميع الأقسام على شرائح متعددة حتى لا يتبقى أي نسيج. - اترك الشرائح تجف في درجة حرارة الغرفة لمدة 30 دقيقة على الأقل ولكن ليس أكثر من 1 ساعة.
7. تلطيخ و IHC
ملاحظة: بالنسبة لهذا البروتوكول ، ستقوم الطريقة بتفصيل IHC باستخدام جسم مضاد أولي غير مترافق. يجب استخدام الأجسام المضادة المترافقة بالفلوروكروم ، أو بقع التألق الأخرى التي يمكن إجراؤها في مرحلة واحدة ، مع الجسم المضاد الثانوي إذا كان سيتم استخدام كلاهما معا.
- مباشرة بعد فترة التجفيف ، قم بإزالة OCT على حواف الشريحة باستخدام شفرة حلاقة ، مما يترك مساحة لحدود كارهة للماء. ارسم حدا كارها للماء على كل شريحة باستخدام العلامة. اترك هذا يجف لمدة 5 دقائق.
- اغسل جميع الشرائح 3 مرات لمدة 5 دقائق لكل منها باستخدام PBS عن طريق سحب العينة برفق أعلى الشريحة، وتجنب سحب العينة مباشرة فوق الأنسجة عندما يكون ذلك ممكنا.
ملاحظة: الماصة سعة 1000 ميكرولتر مفيدة للغاية هنا. يجب تغطية الشريحة ذات الحجم القياسي مع الأنسجة بالكامل ب 750 ميكرولتر من أي محلول. يمكن أيضا استخدام رفوف الشرائح والجراء. - بعد غسل الشرائح، قم بتعبئة الماصة 3٪ BSA في محلول منع TBS على الشرائح. اتركيه للاحتضانة لمدة 30 دقيقة.
- تخلص من محلول الانسداد وقم بسحب محلول الجسم المضاد الأساسي على الشرائح. في هذه الحالة ، تخفيف 1: 250 من SC-13521 ApoE في 3٪ BSA في TBS. اسمح للجسم المضاد بالحضانة طوال الليل عند 4 درجات مئوية أو لمدة ساعة واحدة في درجة حرارة الغرفة. استخدم مناديل مبللة أو مناشف ورقية لمنع المحلول من الجفاف طوال الليل.
- تخلص من الجسم المضاد الأساسي واستخدم الماصة ، واغسلها 3 مرات لمدة 5 دقائق مع كل منها باستخدام PBS.
- أضف محلول الجسم المضاد الثانوي. في هذه الحالة ، تخفيف 1: 500 من AF 750 Goat Anti-Mouse بالإضافة إلى تركيز 5 ميكروغرام / مل من Nile Red ، كل ذلك في 3٪ BSA في TBS. دع هذا يحتضن لمدة ساعة واحدة في درجة حرارة الغرفة.
ملاحظة: نقوم في نفس الوقت باحتضان صبغة فلورية وجسم مضاد ثانوي في نفس المخزن المؤقت ، 3٪ BSA في TBS. يفضل هذا طالما لا توجد تعارضات معروفة بين الكاشفين. في حالة وجود تعارضات ، احتضن بشكل منفصل وقم بإجراء 3 غسلات إضافية بين الحضانات. - اغسل الشرائح 3 مرات باستخدام PBS لمدة 5 دقائق لكل منها. بعد الغسيل النهائي ، اترك كمية صغيرة من PBS على الشريحة.
8. التركيب والتحضير للتصوير
- باستخدام ماصة سعة 1000 ميكرولتر، أضف 3-5 قطرات من وسائط التثبيت الصلبة التي تحتوي على DAPI (0.9 ميكروغرام/مل)، بالتساوي عبر الشريحة لتجنب السقوط المباشر على الأنسجة.
- ضع الغطاء على الشريحة ، وتجنب أي تكوين فقاعة هواء.
ملاحظة: يمكن أن يساعد استخدام الملقط في ذلك عن طريق السماح للغطاء بالانزلاق بالقرب من سطح الشريحة قبل إطلاقه في النهاية. - تعامل مع الشرائح المثبتة حديثا بعناية واحفظها بشكل مسطح حتى تجف تماما. قم بإغلاق الشرائح باستخدام طلاء الأظافر إذا كان التخزين طويل الأمد متوقعا.
- التقط الصور في أسرع وقت ممكن لتجنب تسوس الفلورسنت.
9. الحصول على الصور
ملاحظة: لالتقاط الصور ، سيتم تفصيل استخدام برنامج Olympus Cell Sense Dimensions.
- قبل التصوير ، افحص الشرائح وامسحها باستخدام 70٪ من الإيثانول في محلول مائي. إذا تم تصوير الشرائح مباشرة بعد التركيب، فاحرص على توخي الحذر الشديد عند التنظيف لتجنب إزعاج الغطاء. اترك أسطح الشريحة والغطاء تجف لمدة 5 دقائق قبل التصوير.
- حدد كل قناة مطلوبة للالتقاط، في هذه الحالة، قنوات DAPI وNile Red وAF 750.
- حدد التكبير المطلوب كما هو موضح أدناه. اختيار التكبير يعتمد على التجربة. هنا ، استخدم التكبير 10x.
ملاحظة: جميع التكبيرات قابلة للاستخدام، بما في ذلك العدسات الزيتية. إذا رغبت في ذلك ، ضع زيت الغمر على سطح الشريحة. - لكل قناة، قم بمعايرة أوقات التعريض الضوئي المناسبة بناء على ألمع موضوعات التألق في التجربة. تجنب التعرض المفرط أثناء إنشاء صورة ساطعة قدر الإمكان.
ملاحظة: بشكل عام ، فإن المحددين الرئيسيين لالتقاط العملية السيئة هما التعرض المفرط ، مما يؤدي إلى فقدان التعريف ، والكثير من إشارات الخلفية ، والتي يصعب فصلها عن الإشارة الحقيقية. بالإضافة إلى ذلك، يجب ضبط التعريضات الضوئية بشكل مستقل لكل تكبير فريد مستخدم. - حدد المجلد المراد حفظه وقم بتسمية الصور المدمجة داخل القائمة. بعد الالتقاط ، ستكون جميع الصور موجودة في هذا المجلد وتحمل الاسم المحدد هنا.
- التقط الصور من خلال التركيز أولا على هدف في القناة يسمح بأفضل نقطة محورية ثم ابدأ في الجمع. حافظ على إجراء التركيز على كل موضوع في نفس القناة لتحقيق الاتساق عبر التجربة.
- التقط جميع المجموعات التجريبية المستخدمة للمقارنات اللاحقة في نفس اليوم لتجنب اضمحلال الفلورسنت بين المجموعات المقارنة.
- حدد التكبير المطلوب كما هو موضح أدناه. اختيار التكبير يعتمد على التجربة. هنا ، استخدم التكبير 10x.
10. القياس الكمي
ملاحظة: يمكن إجراء القياس الكمي باستخدام مجموعة متنوعة من البرامج. هنا ، تمت الإشارة إلى استخدام أبعاد Olympus CellSense.
- بعد المجموعة ، راجع الصور. قم بإزالة الأقسام التي تحتوي على عيوب أو أقسام البيانات الاصطناعية من مجلد القياس الكمي. حدد الصور التي تعكس هدف القياس الكمي. ومن أمثلة العيوب الفقاعات والأقسام الممزقة والأنسجة المتداخلة والغبار أو الحطام.
- لتحديد الصور المناسبة ، تأكد من استخدام جميع الصور التي تظهر أنسجة المخ للقياس الكمي لتعكس التعبير الكلي في جميع أنحاء الدماغ. بدلا من ذلك ، استخدم الصور التي تعكس فقط الدماغ الأمامي أو الأوسط أو الخلفي لإعطاء نظرة ثاقبة للاختلافات في التعبير في هذه المناطق.
- ضمن قوائم العد والقياس ، حدد معلمات الاهتمام وحدودها للقياس الكمي للصور.
- للقياس الكمي لتعبير ApoE من خلال مقارنة قيمة متوسط الشدة ، حدد قيم العتبة بحيث يتم اعتبار جميع وحدات البكسل لتلك القناة (0-ما لا نهاية). بالإضافة إلى ذلك ، حدد مناطق الاهتمام باستخدام أدوات الرسم المتاحة.
- قم بتشغيل العد والقياس إما دفعة واحدة لجميع الملفات أو بشكل فردي على كل صورة.
- لمعالجة الدفعات ، قم بتسجيل الإعدادات وتنفيذ القياس الكمي ثم حدد المجلد لإجراء القياس الكمي. يمكن الوصول إلى المعالجة دفعة واحدة من خلال علامة التبويب مدير الماكرو وتسريع سير العمل بشكل كبير.
- تصدير جدول البيانات إلى جدول بيانات لتخطيطه. للقيام بذلك، استخدم قائمة الجرد وقياس النتائج أثناء فتح جدول أو تصديره تلقائيا عند الأداء دفعة واحدة. وستحتوي جداول البيانات هذه على جميع المعلمات المحددة المختارة في الخطوة 2.10.
- للتحليل الإحصائي والتخطيط ، قم برسم البيانات باستخدام جدول بيانات مباشرة ، أو من خلال برامج أخرى. يعد الإلمام بالبرنامج المختار أمرا أساسيا لإنشاء تمثيل دقيق للنتائج التجريبية. هنا ، تم تطبيع قيم الشدة المطلقة لتعبير ApoE في دماغ الطفرة إلى وحدة التحكم ثم رسمها باستخدام GraphPad Prism.
النتائج
تسمح الطريقة الموضحة أعلاه بالتصوير الفلوري لأدمغة الذباب البالغة بشكل موثوق وبدون تشريح ممل. موضحة ببساطة في الشكل 1 ، الطريقة واضحة ومباشرة ويمكن إجراؤها بسرعة إذا كانت جميع العينات والمعدات والمواد متاحة بسهولة. بدلا من ذلك ، باستخدام تخزين -80 درجة مئوية خلال مرحلة قالب OCT ، يمكن الاحتفاظ بالعينات للاستخدام بعد عدة أسابيع. لا يحتاج الباحثون إلى التدريب لفترة طويلة لتعلم تقنيات التشريح والتضمين البسيطة ، مما يجعل هذه الطريقة في متناول الجميع.
يمكن رؤية أمثلة على الفحص المجهري الفلوري الذي يتم إجراؤه باستخدام هذه الطريقة في الشكل 2A-D. إن التعبير عن كل من علامة الجسم المضاد (ApoE) وصبغة الفلورسنت (النيل الأحمر) محدد جيدا. بالإضافة إلى ذلك ، يمكن أيضا رؤية السلامة العالية لأنسجة المخ. يمكن توضيح الصور بشكل أكبر باستخدام ميزات برامج معالجة الصور الشائعة مثل deconvoltion ، والتي تظهر أيضا في اللوحة الشكل 2A'-D'. يعد إزالة الالتواء مفيدا لتحسين الحدة والتباين وتقليل الضوضاء.
فيما يتعلق بالقياس الكمي للصور ، يمكن قياس جميع الصور للمعلمات القياسية مثل عدد الكائنات ومتوسط مساحة الكائن والشدة وكسر المساحة. تعتمد قيود القياس الكمي حقا على البرنامج المختار ، ولكن بشكل عام ، تسمح المعلمات المذكورة أعلاه بالتحقيق الكافي وهي متاحة في معظم التطبيقات. يوضح الشكل 3 الرسم البياني الذي تم إنشاؤه من متوسط قيم الشدة داخل مناطق الدماغ لصور متعددة. يعمل هذا على تصور متوسط كثافة الدماغ لنمط وراثي معين. في هذه الحالة ELAV / + و ELAV>ApoE4.
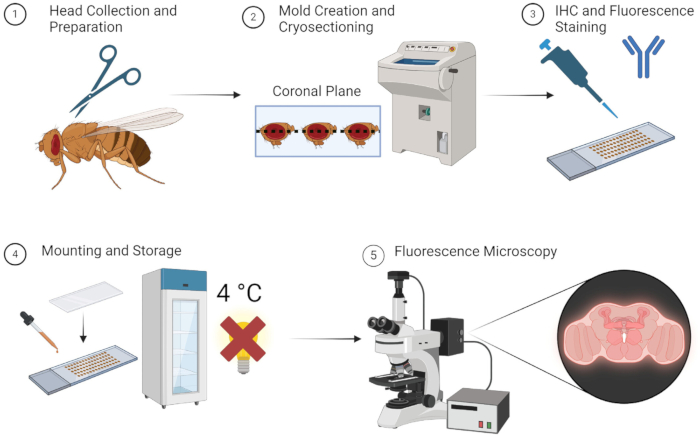
الشكل 1: سير عمل ذبابة الفاكهة قسم الدماغ والتصوير. 1. يتم جمع رؤوس ذبابة الفاكهة عن طريق قطع الرأس باستخدام مقص ناعم. 2. بعد التثبيت ، يتم تضمين الرؤوس المجمعة مع OCT في قالب ويتم تقطيعها بالتبريد للحصول على أقسام رقيقة في الدماغ. 3. تخضع أقسام الدماغ لتلطيخ الكيمياء المناعية (IHC) بالأجسام المضادة الأولية أو تلطيخ الفلورسنت. 4. بعد التلوين ، يتم تثبيت الأقسام مع زلة غطاء وتخزينها عند 4 درجات مئوية في الظلام للحفاظ على سلامة الفلورة. 5. يتم تصور أقسام الدماغ باستخدام المجهر الفلوري لدراسة البروتينات أو الهياكل الخلوية المستهدفة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: الكيمياء المناعية والتلوين الفلوري للرؤوس المقطوعة بالتبريد. (أ-د) صور تمثيلية لرؤوس ذبابة أنثى تبلغ من العمر 7 أسابيع ملطخة بتعبير ApoE والدهون (النيل الأحمر) و DAPI. توضح هذه الصور التعبير عن ApoE4 البشري (Elav>ApoE4) ، بينما يفتقر ذباب التحكم Elav / + إلى تعبير ApoE هذا. تلطيخ الدهون باللون الأحمر النيلي (Elav>ApoE4 و Elav/+). يتضح هنا أيضا سلامة أنسجة المخ باستخدام هذه الطريقة. (أ - د') هذه تمثل A و B و C و D بعد التفكيك. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التقدير الكمي النسبي ل ApoE. أظهرت نتائج القياس الكمي لتعبير بروتين ApoE في أدمغة ذبابة الفاكهة البالغة من العمر 7 أسابيع. تم جمع القيم المطلقة للشدة لكل من Elav / + و Elav >ApoE4 المتحولين ثم تم تطبيعها إلى Elav / +. الدلالة الإحصائية بين Elav>ApoE4 و Elav /+ واضحة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا ، نقدم بروتوكولا للتصوير الفلوري الدقيق لرؤوس ذبابة الفاكهة المقطوعة بالتبريد. هذا نهج مباشر له العديد من الإيجابيات المهمة. وبالتحديد ، فإن الطرق بسيطة بما يكفي يمكن لأي شخص لديه تدريب أساسي على السلامة المختبرية إكمالها ، فهي قابلة للتكيف لقياس التعبير عن أي بروتين توجد له أجسام مضادة عالية الجودة ، وتسمح بقياس دقيق لكل من مقدار البروتين ذي الأهمية الذي يتم التعبير عنه ومكان حدوث هذا التعبير في جميع أنحاء الرأس. إذا كانت جودة الأنسجة والصورة عالية بما فيه الكفاية ، فمن المحتمل أن يسمح ذلك برسم خرائط ثلاثية الأبعاد للتعبير في جميع أنحاء رأس ذبابة الفاكهة بأكمله.
على عكس الأساليب الصعبة تقنيا لعزل الدماغ للتصوير جنبا إلى جنب مع الفحص المجهري متحد البؤر ، يسمح هذا البروتوكول بالتصوير في جميع أنحاء رأس ذبابة الفاكهة بأكمله ، وليس فقط الدماغ. هذا مهم بشكل خاص بالنظر إلى أن النظام البصري للذبابة هو نموذج مهم لوظيفة الخلايا العصبية21 ، ولكن يمكن أن تضيع بعض هذه الهياكل أثناء عزل الدماغ. كما يوفر أنسجة تحكم في القسم ، على سبيل المثال ، عضلات خرطوم ، لتحديد ما إذا كان التعبير عن البروتين محل الاهتمام خاصا بأنواع معينة من الخلايا أو أنواع الأنسجة22. يسمح ذلك بالمقارنة المباشرة بين الأنسجة ، بدلا من استخدام أقسام منفصلة يمكن أن تتأثر باختلافات طفيفة في الظروف. من نقاط القوة الأخرى لهذا البروتوكول واستخدام ذبابة الفاكهة كنظام نموذجي أن رؤوس الذباب صغيرة جدا19،20 ، لذلك يمكن إجراء تصوير الفلورسنت عالي المحتوى نسبيا. لقد تمكنا من وضع أكثر من 50 رأسا في كتلة واحدة. مع 8 أقسام يمكن وضعها على شريحة بحجم قياسي في الصناعة ، يمكن أن تحتوي شريحة واحدة على 8 أقسام فريدة لكل ذبابة ليصبح المجموع 400 قسم فريد. الأهم من ذلك ، أن جميع الأقسام تخضع لنفس الظروف التجريبية والنقاط الزمنية لتحقيق نزاهة كبيرة عند المقارنة بين المجموعات. بالإضافة إلى ذلك ، لا يتطلب هذا البروتوكول سوى استخدام مجهر فلوري قياسي بدلا من مجهر متحد البؤر ، والذي قد يكون باهظ التكلفة للمختبرات أو المؤسسات التي تفتقر إلى الدعم المالي العالي وتسمح بالوصول إلى هذا التصوير على نطاق أوسع.
أحد القيود الرئيسية لهذا البروتوكول ، المتأصل في التلوين المناعي ، هو أهمية استخدام الأجسام المضادة عالية الجودة والضوابط المناسبة عند تحسين الأجسام المضادة. من الأهمية بمكان التحقق من أن الأجسام المضادة انتقائية وحساسة للبروتين محل الاهتمام ، حيث غالبا ما يكون هناك تلطيخ خارج الهدف يمكن أن يؤدي إلى تحديات في تحديد ما إذا كانت إشارة الفلورسنت حقيقية. للقيام بذلك ، اختبر كل من الأجسام المضادة الأولية والثانوية. لحسن الحظ ، من السهل القيام بذلك بسبب الأدوات الجينية المتاحة بسهولة في ذبابة الفاكهة. للتحقق من جودة الجسم المضاد الأساسي ، نوصي بإكمال البروتوكول مع الذباب البري والذباب التجريبي جنبا إلى جنب مع ذباب التحكم الإيجابي الذي يفرط في التعبير عن البروتين محل الاهتمام وذباب التحكم السلبي الذي تم إخراج الجين منه أو إسقاطه. ستحدد مجموعات التحكم هذه نطاق مستويات التعبير والتألق المتوقع ، وتعمل كنقاط مرجعية لتقييم مكان وقوع الذباب التجريبي ضمن هذا الطيف. من الأهمية بمكان اختبار تخفيفات متعددة للجسم المضاد الأساسي ، لأن القليل جدا سيؤدي إلى تلطيخ رديء الجودة لا يؤدي إلى تألق فوق الخلفية حيث يوجد البروتين ، في حين أن الكثير من الأجسام المضادة سيؤدي إلى تلطيخ خارج الهدف حيث يكون البروتين غائبا. يجب أن يشمل نهج التخفيف المتعدد هذا مجموعة بدون جسم مضاد أولي ، والتي ستتحقق من جودة الجسم المضاد الثانوي ، حيث لن يكون هناك مضان في هذه المجموعة إلا إذا كان هناك مضان في الخلفية ويوفر مجموعة تحكم سلبية إضافية تظهر حدود الكشف عن الفلورسنت بواسطة الجسم المضاد الثانوي. إذا لزم الأمر ، استخدم ظروف حضانة مختلفة ، مثل الوقت أو درجة الحرارة ، لزيادة الإشارة إلى الضوضاء في صورك النهائية. نؤكد مجددا أن الأجسام المضادة عالية الجودة ، جنبا إلى جنب مع الأنسجة عالية الجودة ، ضرورية للتصوير المناعي عالي الجودة.
إجمالا ، يعد التصوير المناعي الفلوري أداة قوية لدراسة علم الأحياء على نطاق أوسع وعلم الأعصاب بشكل أكثر تحديدا. هذا ، جنبا إلى جنب مع الأدوات الجينية القوية المتوفرة في ذبابة الفاكهة ، لديه القدرة على الكشف عن معرفة مهمة حول كيفية تأثير البروتينات على الصحة والمرض. كان دماغ الذبابة مهما بشكل واضح لاكتشاف كيفية عمل الدماغ البشري وسيستمر في القيام بذلك. نظرا لقدرة البروتوكول على التكيف ، كما نصف هنا ، يمكن دراسة دور أي بروتين (أو دهون) تقريبا في الرأس في سياق أي مرض أو حالة ، محدودة فقط بجودة الأجسام المضادة. وبالتالي ، من المحتمل أن يكون التصوير المناعي الفلوري أمرا بالغ الأهمية للبحث المستقبلي حول كيفية عمل الدماغ وسيكون له تأثير كبير على صحة الإنسان وتطوره العلاجي.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
نشكر أعضاء مختبر ملكاني على مساعدتهم في تقديم ملاحظات قيمة لتطوير البروتوكول. تم الحصول على مخزون الذبابة ، Elav-Gal4 (BL # 458) و UAS-ApoE4 (BL # 76607) من مركز بلومنجتون ذبابة الفاكهة (بلومنجتون ، إنديانا ، الولايات المتحدة الأمريكية). تم دعم هذا العمل من خلال منح المعاهد الوطنية للصحة (NIH) AG065992 و RF1NS133378 إلى G.C.M. يتم دعم هذا العمل أيضا من قبل صناديق UAB Startup 3123226 و 3123227 إلى G.C.M.
Materials
| Name | Company | Catalog Number | Comments |
| 1000 uL Pipette | Eppendorf | 3123000063 | |
| 1000 uL Pipette Tips | Olympus Plastics | 23-165R | |
| 10X Phosphate Buffered Saline (PBS) | Fisher | J62036.K7 | ph=7.4 |
| 200 Proof Ethanol | Decon Laboratories | 64-17-5 | |
| 20X Tris Buffered Saline | Thermo Scientific | J60877.K2 | pH=7.4 |
| AF750 Goat Anti-Mouse Secondary Antibody | Alexa Fluor | A21037 | |
| Anti-Roll Glass | IMEB | AR-14047742497 | |
| ApoE Mouse Primary Antibody | Santa Cruz | SC13521 | |
| Bovine Serum Albumin | Fisher | 9048-46-8 | |
| Centrifuge Tubes 1.5 mL | Fisher | 05-408-129 | |
| Charged Slides | Globe Scientific | 1415-15 | |
| Cryosectioning Molds | Fisher | 2363553 | |
| Cryostat | Leica | CM 3050 S | |
| Cryostat Blades | C.L. Sturkey | DT554N50 | |
| Distilled Water | |||
| Dry Ice | ??? | ??? | |
| Fine Forceps | Fine Science Tools | 11254-20 | |
| Fly Pad | Tritech Research | MINJ-DROS-FP | |
| Hardening mounting Media with Dapi | Vectashield | H-1800 | |
| Kimwipes | Kimtech | 34120 | |
| Microscope | Olympus | SZ61 | |
| Nile Red | Sigma | N3013 | |
| Optimal Cutting Temperature Compound | Fisher | 4585 | |
| Orbital Shaker | OHAUS | SHLD0415DG | |
| Paraformaldehyde 20% | Electron Microscopy Sciences | 15713 | |
| Razor Blades | Gravey | #40475 | |
| Spring Scissors | Fine Science Tools | 15000-10 | |
| Sucrose | Fisher | S5-500 |
References
- Fabbri-Destro, M., Rizzolatti, G. Mirror neurons and mirror systems in monkeys and humans. Physiology. 23, 171-179 (2008).
- Faust, T. E., Gunner, G., Schafer, D. P. Mechanisms governing activity-dependent synaptic pruning in the developing mammalian CNS. Nat Rev Neurosci. 22, 657-673 (2021).
- Roozendaal, B., McEwen, B. S., Chattarji, S. Stress, memory and the amygdala. Nat Rev Neurosci. 10, 423-433 (2009).
- Arber, S., Costa, R. M. Networking brainstem and basal ganglia circuits for movement. Nat Rev Neurosci. 23, 342-360 (2022).
- GBD 2019 Dementia Forecasting Collaborators. Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050: an analysis for the Global Burden of Disease Study 2019. Lancet Public Health. 7, e105-e125 (2022).
- Huang, Y., Li, Y., Pan, H., Han, L. Global, regional, and national burden of neurological disorders in 204 countries and territories worldwide. J Glob Health. 13, 04160 (2023).
- Crick, F. Central dogma of molecular biology. Nature. 227, 561-563 (1970).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9, 235-244 (2016).
- Hales, K. G., Korey, C. A., Larracuente, A. M., Roberts, D. M. Genetics on the Fly: A primer on the Drosophila model system. Genetics. 201, 815-842 (2015).
- Larkin, A., et al. FlyBase: updates to the Drosophila melanogaster knowledge base. Nucleic Acids Res. 49, D899-D907 (2021).
- Jeibmann, A., Paulus, W. Drosophila melanogaster as a model organism of brain diseases. Int J Mol Sci. 10, 407-440 (2009).
- Winding, M., et al. The connectome of an insect brain. Science. 379, eadd9330 (2023).
- Bargiello, T. A., Jackson, F. R., Young, M. W. Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature. 312, 752-754 (1984).
- Zehring, W. A., et al. P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell. 39, 369-376 (1984).
- Huang, R. C. The discoveries of molecular mechanisms for the circadian rhythm: The 2017 Nobel Prize in Physiology or Medicine. Biomed J. 41, 5-8 (2018).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. N Am J Med Sci. 4, 429-434 (2012).
- Ong, S. E., Foster, L. J., Mann, M. Mass spectrometric-based approaches in quantitative proteomics. Methods. 29, 124-130 (2003).
- Behnke, J. A., Ye, C., Moberg, K. H., Zheng, J. Q. A protocol to detect neurodegeneration in Drosophila melanogaster whole-brain mounts using advanced microscopy. STAR Protoc. 2, 100689 (2021).
- Moraes, R. C. M., et al. Apolipoprotein E induces lipid accumulation through Dgat2 that is prevented with time-restricted feeding in Drosophila. Genes. 15 (11), 1376 (2024).
- Roth, J. R., et al. Rapamycin reduces neuronal mutant huntingtin aggregation and ameliorates locomotor performance in Drosophila. Front Aging Neurosci. 15, 1223911 (2023).
- Currier, T. A., Pang, M. M., Clandinin, T. R. Visual processing in the fly, from photoreceptors to behavior. Genetics. 224, (2023).
- McKellar, C. E., Siwanowicz, I., Dickson, B. J., Simpson, J. H. Controlling motor neurons of every muscle for fly proboscis reaching. Elife. 9, (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved