Method Article
Criosección directa de cabezas de Drosophila para mejorar la tinción de fluorescencia cerebral y la inmunotinción
En este artículo
Resumen
Este estudio presenta un protocolo simplificado para el procesamiento de tejidos que involucra decapitación, fijación, criosección, tinción de fluorescencia, inmunotinción e imágenes, que puede extenderse a imágenes confocales y multifotónicas. El método mantiene una eficacia comparable a las disecciones complejas, evitando la necesidad de habilidades motoras avanzadas. El análisis cuantitativo de imágenes ofrece un amplio potencial de investigación.
Resumen
La inmunotinción de cerebros de Drosophila melanogaster es esencial para explorar los mecanismos detrás de comportamientos complejos, circuitos neuronales y patrones de expresión de proteínas. Los métodos tradicionales a menudo implican desafíos como realizar disecciones complejas, mantener la integridad del tejido y visualizar patrones de expresión específicos durante imágenes de alta resolución. Presentamos un protocolo optimizado que combina la criosección con la tinción de fluorescencia y la inmunotinción. Este método mejora la preservación del tejido y la claridad de la señal, y reduce la necesidad de una disección laboriosa para las imágenes cerebrales de Drosophila. El método implica una disección rápida, fijación óptima, crioprotección y criosección, seguidas de tinción fluorescente e inmunotinción. El protocolo reduce significativamente el daño tisular, mejora la penetración de los anticuerpos y produce imágenes nítidas y bien definidas. Demostramos la efectividad de este enfoque mediante la visualización de poblaciones neuronales específicas y proteínas sinápticas con alta fidelidad. Este método versátil permite el análisis de varios marcadores de proteínas en el cerebro adulto a través de múltiples planos z y se puede adaptar a otros tejidos y organismos modelo. El protocolo proporciona una herramienta fiable y eficiente para los investigadores que realizan estudios de inmunohistoquímica de alta calidad en neurobiología de Drosophila. La visualización detallada de este método facilita el análisis exhaustivo de la neuroanatomía, la patología y la localización de proteínas, lo que lo hace especialmente valioso para la investigación en neurociencia.
Introducción
Los comportamientos complejos que van desde las interacciones sociales1, la percepción y el procesamiento sensorial2, el aprendizaje3 hasta el movimiento4 son impulsados por el cerebro. Los trastornos neurológicos también son cada vez más comunes y se prevé que aumenten con el tiempo 5,6. Es fundamental estudiar cómo funciona el cerebro tanto en la salud como en la enfermedad. El dogma central de la biología molecular sugiere que una de las funciones más importantes de las unidades biológicas son las proteínas7, y tanto la cantidad como el lugar donde se expresan son fundamentales para comprender cómo funciona el cerebro.
Drosophila melanogaster, comúnmente conocida como mosca de la fruta, es un modelo muy valioso para el estudio de la función cerebral en condiciones de envejecimiento y fisiopatologías8. La disponibilidad de herramientas genéticas avanzadas en Drosophila permite a los investigadores explorar la función de casi cualquier proteína9, con bibliotecas genéticas completas para casi todos los genes fácilmente accesibles10. Junto con su corta vida útil y su alta tasa reproductiva, estas características hacen de Drosophila un modelo excepcional para la investigación del cerebro11. Esto ha llevado a logros significativos, incluyendo el desarrollo de un mapa cerebral completo de la mosca12, e incluso contribuyó a la obtención de un Premio Nobel por dilucidar los mecanismos neuronales de los ritmos circadianos y los relojes moleculares 13,14,15. Como resultado, Drosophila sigue siendo un sistema potente y versátil, que impulsa nuestra comprensión de la función cerebral y proporciona información sin precedentes sobre los procesos neurológicos.
La inmunohistoquímica y la inmunofluorescencia son herramientas fundamentales para estudiar la expresión de proteínas in situ. A diferencia de técnicas como Western Blot, que solo permite el análisis semicuantitativo y generalmente se realiza en tejido a granel16, o técnicas complicadas y costosas como la espectrometría de masas para medir el nivel de proteína17, la inmunohistoquímica es relativamente sencilla y permite tanto la cuantificación de la expresión de proteínas como la medición de la localización de una proteína dentro de un tejido o célula. Es importante destacar que la inmunohistoquímica fluorescente también se puede multiplexar para medir múltiples proteínas para identificar tipos de células y tejidos específicos o responder a múltiples preguntas en el mismo tejido. Además, la fijación de tejidos puede permitir comparaciones entre diferentes condiciones experimentales, genotipos, edades y puntos temporales circadianos. Sin embargo, la inmunohistoquímica fluorescente puede ser un desafío y muchos factores pueden influir en la calidad de la imagen. Este protocolo optimizado de criosección e inmunotinción para cerebros de Drosophila tiene como objetivo mejorar las imágenes de alta resolución al mejorar la preservación de tejidos, la penetración de anticuerpos y la visualización de poblaciones neuronales y marcadores de proteínas. Desarrollado para abordar los desafíos de los métodos tradicionales, como la disección compleja, el daño tisular y la resolución limitada de las imágenes asociadas con las monturas de todo el cerebro18. Este protocolo combina la criosección con la tinción de fluorescencia para garantizar la integridad estructural y la obtención de imágenes nítidas en múltiples planos z. En comparación con las preparaciones de montaje completo, este método minimiza la distorsión, facilita una difusión más profunda de los anticuerpos y proporciona análisis neuroanatómicos y de localización de proteínasclaros 18. Su versatilidad permite la adaptación a otros tejidos y organismos modelo, ofreciendo una herramienta confiable y eficiente para la investigación en neurociencia19,20. Se puede adaptar para observar casi cualquier proteína y aplicarse para estudiar cualquier condición, enfermedad o modelo.
Protocolo
1. Preparación del equipo
- Asegúrese de que el criostato esté encendido y ajustado a -20 °C. Encienda el calentador de portaobjetos o una incubadora pequeña, asegurándose de que esté ajustado a 37 °C.
NOTA: En esta etapa, los portaobjetos etiquetados se pueden colocar en el calentador o la incubadora y dejarlos indefinidamente hasta que se seccionen.
2. Preparación de soluciones
- Prepare 50 mL de 1x solución salina tamponada con fosfato (PBS), pH 7,4, a partir de 10x caldo de PBS. Prepare una solución de paraformaldehído al 4% en PBS con un volumen final de 10 mL.
- Prepare una solución de limpieza de etanol al 70% en agua en una botella rociadora. Prepare una solución de bloqueo (3% de albúmina sérica bovina (BSA) en solución salina tamponada con Tris de 20x stock). Prepare una solución de anticuerpos primarios (la dilución depende del experimento). En este caso, se utiliza una dilución 1:250 del anticuerpo de ratón ApoE en BSA al 3% en TBS.
- Prepare una solución de anticuerpos secundarios (la dilución depende del experimento). Aquí, se utiliza una dilución 1:500 de Alexa Flour 750 A21037 Goat Anti-Mouse Secondary en 3% BSA en TBS.
- Prepare la solución de tinción fluorescente (la dilución depende del experimento). Aquí, se prepara una solución de 5 μg/mL de rojo del Nilo en PBS.
NOTA: Todas las soluciones, particularmente las fluorescentes, deben refrigerarse y almacenarse en un recipiente refrigerado oscuro. También deben llevarse a temperatura ambiente justo antes de su uso.
3. Recolección de tejido
- Después de obtener moscas en viales envejecidos, abra la válvula de la estera de CO2 y vierta las moscas en la alfombrilla rápidamente para evitar que se escapen. Espera a que las moscas queden casi inconscientes, cesando la mayor parte del movimiento. Coloque moscas debajo del microscopio SZ61 moviendo la alfombrilla por debajo de la lente del objetivo. Ajuste la ampliación y el enfoque de modo que las moscas sean claramente visibles y cómodas de decapitar.
NOTA: Las moscas utilizadas para este ejemplo son ELAV/+ y ELAV>ApoE4 - Inserte unas tijeras de resorte entre el tórax y la cabeza, apriete firmemente y decapita de 5 a 10 cabezas de mosca por grupo experimental. Regrese las moscas sin usar a su frasco envejecido.
NOTA: Si existe preocupación con respecto a la penetración del fijador, se puede realizar una pequeña incisión en la parte posterior de la cabeza para permitir una mayor penetración del agente fijador en el paso 4.1. - Con un cepillo, coloque suavemente las cabezas en tubos de 1,5 ml marcados con hielo hasta que se hayan recogido los grupos ELAV/+ y ELAV>ApoE4.
4. Fijación de tejido entero
- Retire los tubos del hielo y pipetee 100 μL de paraformaldehído al 4% en solución de PBS en cada tubo, asegurándose de que todas las cabezas estén sumergidas en la solución. Si las cabezas se adhieren a las paredes del tubo y evitan el contacto con la solución, use un cepillo para empujarlas suavemente hacia abajo o golpee ligeramente contra una superficie horizontal para asegurar un contacto adecuado.
- Coloque en un agitador orbital usando una configuración media durante 15 min. Después de 15 minutos, deseche la solución de paraformaldehído y reemplácela con 1x PBS durante 10 minutos, asegurándose de que todas las cabezas estén sumergidas en la solución.
- Desechando la solución anterior cada vez, lave el pañuelo con PBS 2x durante 10 minutos cada uno, para un total de 3 lavados.
- Después del lavado final, transfiera las cabezas a una solución de sacarosa al 10% en PBS, asegurándose de que las cabezas estén sumergidas dentro del tubo. Déjalos toda la noche para una saturación óptima.
NOTA: Si se desean imágenes el mismo día, se puede reducir la infusión de sacarosa; Sin embargo, los efectos de los crioprotectores también se reducirán proporcionalmente.
5. Preparación del molde
- Llene un molde etiquetado aproximadamente el 50% con compuesto de temperatura óptima de corte (OCT), permitiendo que se extienda a las 4 esquinas del molde.
- Con un cepillo, coloque con cuidado las cabezas en la superficie del OCT dentro del molde. Al colocar varios grupos experimentales en el mismo molde, asegúrese de que estos grupos estén separados dentro del molde para evitar confusiones.
NOTA: Es importante evitar la dilución del compuesto OCT a través de la contaminación con la solución de sacarosa anterior a través del cepillo. Además, la colocación profunda en la OCT con el pincel puede crear muchas burbujas alrededor de las cabezas. Evite estos errores para evitar problemas de seccionamiento más adelante. - Con la punta de las pinzas, empuje lentamente cada cabeza hasta el fondo del molde con los ojos mirando hacia el fondo. Esta orientación se selecciona para un corte a través del plano coronal.
- Evite perforar o aplastar las cabezas contra el fondo del molde durante este proceso. Alinee todas las cabezas en las dimensiones X, Y y Z para que cada sección contenga todos los sujetos simultáneamente. Asegure una inmersión lenta para reducir la formación de burbujas de aire.
- Una vez que todos los cabezales estén alineados correctamente, coloque con cuidado los moldes directamente a -20 °C para congelar.
NOTA: Si se observa que la alineación de las cabezas está significativamente desviada durante el corte, considere el uso de hielo seco o nitrógeno líquido para la congelación instantánea inicial del molde. - Una vez que el molde se haya congelado en su mayor parte, llene el resto con OCT y deje que se congele antes de almacenarlo a largo plazo a -80 °C.
6. Crioseccionamiento de moldes
NOTA: Por lo general, es aconsejable preparar y cortar un molde en blanco antes de cortar los moldes de grupo experimental. Esto permite garantizar el correcto funcionamiento de la rueda, la cuchilla y el vidrio estabilizador inmediatamente antes de seccionar el tejido.
- Fije la broca al molde aplicando una cantidad generosa de OCT al molde y colocando la broca encima, presionándola para que quede plana. Deje que esto se congele completamente en el criostato, generalmente dentro de los 5 minutos.
- Suelte la broca y el bloque OCT del molde y colóquelo en el mandril, asegurándose de que el molde permanezca correctamente orientado de arriba a abajo. Apriete la llave del mandril hasta que la broca esté segura.
- Alinee el bloque con la hoja usando las perillas de ajuste y los controles de profundidad del mandril.
- Ajuste el ancho de la sección a 20 μm. Corte cada rebanada con un movimiento lento pero constante, permitiendo que el vidrio estabilizador capture cada rebanada. Capture secciones con las diapositivas calentadas tocando la diapositiva con el borde más cercano de la sección y permitiendo que la sección se eleve sobre la diapositiva. Se pueden colocar hasta ocho secciones en una guía de tamaño estándar (25 mm x 75 mm x 1 mm) cuando se espacian adecuadamente.
NOTA: Hay que hacer una cuestión de elección a la hora de elegir qué secciones recoger. Como resultado de la orientación de la incrustación, las secciones anteriores serán de la parte anterior y las secciones posteriores serán de las partes posteriores de la cabeza. Como tal, si el interés radica en un área en particular más que en otra, la selección de secciones se puede ajustar en consecuencia. Alternativamente, todas las secciones se pueden recolectar en varios portaobjetos hasta que no quede tejido. - Deje que los portaobjetos se sequen a temperatura ambiente durante al menos 30 minutos, pero no más de 1 hora.
7. Tinción e IHQ
NOTA: Para este protocolo, el método detallará la IHQ utilizando un anticuerpo primario no conjugado. Los anticuerpos conjugados con fluorocromo, u otras tinciones de fluorescencia que se pueden realizar en una sola etapa, deben usarse junto con el anticuerpo secundario si ambos se van a usar juntos.
- Inmediatamente después del período de secado, retire la OCT en los bordes del portaobjetos con una cuchilla de afeitar, dejando espacio para un borde hidrofóbico. Dibuja un borde hidrofóbico en cada diapositiva con el marcador. Deja que se seque durante 5 min.
- Lave todos los portaobjetos 3 veces durante 5 minutos cada uno con PBS pipeteando suavemente sobre el portaobjetos, evitando pipetear directamente sobre el pañuelo cuando sea posible.
NOTA: La pipeta de 1000 μL es la más útil en este caso. Un portaobjetos de tamaño estándar con pañuelo debe cubrirse completamente con 750 μL de cualquier solución. También se pueden utilizar rejillas deslizantes y cubos. - Después de lavar los portaobjetos, pipetee el 3% de BSA en la solución de bloqueo TBS en los portaobjetos. Deje incubar durante 30 minutos.
- Deseche la solución de bloqueo y pipetee la solución de anticuerpo primario en los portaobjetos. En este caso, una dilución 1:250 de SC-13521 ApoE en BSA al 3% en TBS. Dejar que el anticuerpo incube durante la noche a 4 °C o durante 1 h a temperatura ambiente. Use toallitas húmedas o toallas de papel para evitar que la solución se seque durante la noche.
- Deseche el anticuerpo primario y, con la pipeta, lávese 3 veces durante 5 minutos cada una con PBS.
- Agregue la solución de anticuerpos secundarios. En este caso, una dilución 1:500 de AF 750 Goat Anti-Mouse además de una concentración de 5 μg/mL de Nilo Red, todo ello en un 3% de BSA en TBS. Deje incubar durante 1 hora a temperatura ambiente.
NOTA: Incubamos simultáneamente una tinción fluorescente y un anticuerpo secundario en el mismo tampón, 3% BSA en TBS. Esto es preferible siempre y cuando no haya conflictos conocidos entre los dos reactivos. Si existen conflictos, incubar por separado y realizar 3 lavados adicionales entre incubaciones. - Lave los portaobjetos 3 veces con PBS durante 5 minutos cada uno. Después del lavado final, deje una pequeña cantidad de PBS en el portaobjetos.
8. Montaje y preparación para la obtención de imágenes
- Con una pipeta de 1000 μl, añada de 3 a 5 gotas de medio de montaje endurecedor que contenga DAPI (0,9 μg/ml), de manera uniforme por el portaobjetos evitando que caiga directamente sobre el tejido.
- Coloque el cubreobjetos en el portaobjetos, evitando la formación de burbujas de aire.
NOTA: El uso de pinzas puede ayudar en esto al permitir que el cubreobjetos se deslice cerca de la superficie del portaobjetos antes de soltarse finalmente. - Manipule las guías recién montadas con cuidado y guárdelas planas hasta que estén completamente secas. Selle los portaobjetos con esmalte de uñas si se prevé un almacenamiento a largo plazo.
- Capture imágenes lo antes posible para evitar la desintegración fluorescente.
9. Adquisición de imágenes
NOTA: Para la captura de imágenes, se detallará el uso del software Olympus Cell Sense Dimensions.
- Antes de tomar imágenes, inspeccione los portaobjetos y límpielos con una solución de etanol al 70% en agua. Si se obtienen imágenes de las guías inmediatamente después del montaje, tenga especial cuidado al limpiarlas para evitar alterar el cubreobjetos. Deje que las superficies del portaobjetos y el cubreobjetos se sequen durante 5 minutos antes de tomar imágenes.
- Seleccione cada canal deseado para capturar, en este caso, los canales para DAPI, Nile Red y AF 750.
- Seleccione el aumento deseado como se describe a continuación. La elección del aumento depende del experimento; Aquí, use un aumento de 10x.
NOTA: Se pueden utilizar todos los aumentos, incluidas las lentes a base de aceite. Si lo desea, aplique aceite de inmersión a la superficie del portaobjetos. - Para cada canal, calibre los tiempos de exposición adecuados en función de los sujetos fluorescentes más brillantes de un experimento. Evite la sobreexposición mientras genera una imagen lo más brillante posible.
NOTA: En general, los dos principales determinantes de una mala captura del proceso son la sobreexposición, que resulta en la pérdida de definición, y demasiada señal de fondo, que es difícil de separar de la señal verdadera. Además, las exposiciones deben ajustarse de forma independiente para cada aumento único utilizado. - Seleccione la carpeta para guardar y asigne un nombre a las imágenes combinadas dentro del menú. Después de la captura, todas las imágenes se ubicarán en esta carpeta y llevarán el nombre definido aquí.
- Capture imágenes enfocándose primero en un sujeto en el canal que permita el mejor punto focal y luego comience la recopilación. Mantenga el procedimiento de enfocarse en cada sujeto en el mismo canal para mantener la coherencia en todo el experimento.
- Capture todos los grupos experimentales utilizados para comparaciones posteriores el mismo día para evitar la desintegración fluorescente entre los grupos comparados.
- Seleccione el aumento deseado como se describe a continuación. La elección del aumento depende del experimento; Aquí, use un aumento de 10x.
10. Cuantificación
NOTA: La cuantificación se puede realizar utilizando una variedad de softwares. Aquí, se hace referencia al uso de Olympus CellSense Dimensions.
- Después de la recopilación, revisa las imágenes. Elimine las secciones que posean imperfecciones o artefactos de sección de la carpeta de cuantificación. Seleccione imágenes que reflejen el objetivo de la cuantificación. Ejemplos de imperfecciones son las burbujas, las secciones rasgadas, el tejido superpuesto y el polvo o los residuos.
- Para seleccionar las imágenes adecuadas, asegúrese de que todas las imágenes que presenten tejido cerebral se utilicen para la cuantificación a fin de reflejar la expresión general en todo el cerebro. Alternativamente, use imágenes que solo reflejen el cerebro anterior, medio o posterior para dar una idea de las diferencias en la expresión en estas áreas.
- Dentro de los menús de recuento y medición, determine los parámetros de interés y sus límites para la cuantificación de imágenes.
- Para la cuantificación de la expresión de ApoE mediante la comparación de valores de intensidad media, seleccione valores de umbral de modo que se consideren todos los píxeles de ese canal (0-infinito). Además, delinee las regiones de interés con las herramientas de dibujo disponibles.
- Ejecute el recuento y la medición en un lote para todos los archivos o individualmente en cada imagen.
- Para el procesamiento por lotes, registre la configuración y la ejecución de la cuantificación y, a continuación, seleccione la carpeta para realizar la cuantificación. Se puede acceder al procesamiento en un lote a través de la pestaña del administrador de macros y acelera en gran medida el flujo de trabajo.
- Exporte la tabla de datos a una hoja de cálculo para trazarla. Para ello, utilice el menú de resultados de recuento y medición mientras abre o exporta a una tabla automáticamente cuando se realiza en un lote. Estas tablas de datos contendrán todos los parámetros seleccionados en el paso 10.2.
- Para el análisis estadístico y la elaboración de gráficos, trace los datos utilizando una hoja de cálculo directamente o mediante otro software. La familiaridad con el software elegido es clave para generar una representación precisa de los resultados experimentales. Aquí, los valores de intensidad absoluta de la expresión de ApoE en el cerebro del mutante se normalizaron al control y luego se trazaron utilizando GraphPad Prism.
Resultados
El método descrito anteriormente permite obtener imágenes de fluorescencia de cerebros de moscas adultas de manera confiable y sin disecciones tediosas. Ilustrado simplemente en la Figura 1, el método es sencillo y se puede realizar rápidamente si todos los especímenes, equipos y materiales están fácilmente disponibles. Alternativamente, utilizando el almacenamiento a -80 °C durante la etapa de molde OCTA, las muestras se pueden conservar para su uso muchas semanas después. Los investigadores no necesitan mucho tiempo de formación para aprender las técnicas sencillas de disección e incrustación, lo que hace que este método sea bastante accesible.
En la Figura 2A-D se pueden ver ejemplos de microscopía de fluorescencia realizada con este método. La expresión tanto de la marca de anticuerpos (ApoE) como de la tinción fluorescente (rojo del Nilo) está bien definida. Además, también se puede ver la alta integridad del tejido cerebral. Las imágenes se pueden clarificar aún más utilizando las características comunes del software de procesamiento de imágenes, como la deconvolución, que también se muestra en el panel Figura 2A'-D'. La deconvolución es útil para mejorar la nitidez y el contraste y reducir el ruido.
Con respecto a la cuantificación de imágenes, todas las imágenes se pueden cuantificar para parámetros estándar como el recuento de objetos, el área media del objeto, la intensidad y la fracción de área. Las limitaciones de la cuantificación dependen realmente del software elegido, pero en general, los parámetros enumerados anteriormente permiten una investigación adecuada y están disponibles en la mayoría de las aplicaciones. La Figura 3 muestra un histograma generado a partir de los valores de intensidad media dentro de las regiones cerebrales de múltiples imágenes. Esto sirve para visualizar la intensidad cerebral media de un genotipo dado. En este caso ELAV/+ y ELAV>ApoE4.
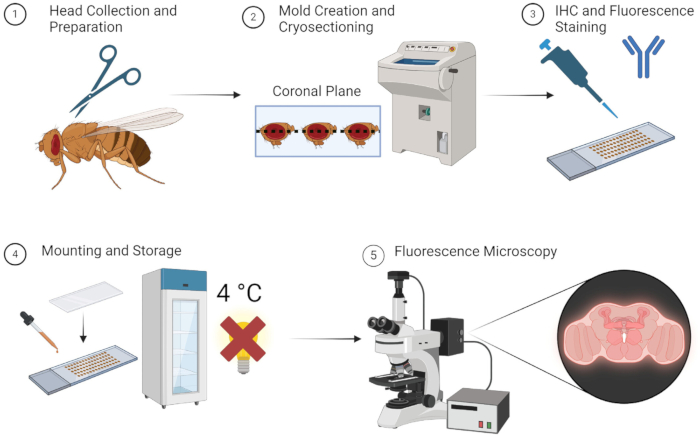
Figura 1: Flujo de trabajo para la sección y obtención de imágenes del cerebro de Drosophila. 1. Las cabezas de Drosophila se recogen por decapitación con tijeras finas. 2. Después de la fijación, las cabezas recolectadas se incrustan con OCT en un molde y se crioseccionan para obtener secciones delgadas del cerebro. 3. Las secciones del cerebro se someten a tinción inmunohistoquímica (IHQ) con anticuerpos primarios o tinción fluorescente. 4. Después de la tinción, las secciones se montan con un cubreobjetos y se almacenan a 4 °C en la oscuridad para mantener la integridad de la fluorescencia. 5. Las secciones del cerebro se visualizan mediante microscopía de fluorescencia para estudiar las proteínas o estructuras celulares objetivo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Inmunohistoquímica y tinción de fluorescencia de cabezas crioseccionadas. (A-D) Imágenes representativas de cabezas de moscas hembras de 7 semanas de edad teñidas para la expresión de ApoE, lípidos (rojo del Nilo) y DAPI. Estas imágenes demuestran la expresión de ApoE4 humano (Elav>ApoE4), mientras que las moscas de control Elav/+ carecen de esta expresión de ApoE. Tinción lipídica con rojo del Nilo (Elav>ApoE4 y Elav/+). La integridad del tejido cerebral utilizando este método también se evidencia aquí. (A'-D') Estos representan el A, B, C y D después de la deconvolución. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Cuantificación relativa de ApoE. Se muestran los resultados de la cuantificación de la expresión de la proteína ApoE en cerebros de Drosophila de 7 semanas de edad. Los valores absolutos de intensidad se recogieron para los sujetos mutantes Elav/+ y Elav>ApoE4 y luego se normalizaron a Elav/+. La significación estadística entre Elav>ApoE4 y Elav/+ es evidente. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí, presentamos un protocolo para imágenes fluorescentes precisas de cabezas de Drosophila crioseccionadas. Este es un enfoque sencillo que tiene varios aspectos positivos importantes. Es decir, los métodos son lo suficientemente simples como para que cualquier persona con capacitación básica en seguridad de laboratorio pueda completar, son adaptables para medir la expresión de cualquier proteína para la que existen anticuerpos de alta calidad y permiten una medición precisa tanto de cuánto se expresa una proteína de interés como de dónde se produce esa expresión en toda la cabeza. Si la calidad del tejido y la imagen es lo suficientemente alta, podría permitir el mapeo en 3D de la expresión en toda la cabeza de Drosophila .
A diferencia de los enfoques técnicamente desafiantes para aislar el cerebro para obtener imágenes combinadas con microscopía confocal, este protocolo permite obtener imágenes de toda la cabeza de Drosophila, no solo del cerebro. Esto es especialmente importante dado que el sistema visual de la mosca es un modelo importante de la función neuronal21, pero algunas de estas estructuras podrían perderse durante el aislamiento del cerebro. También proporciona tejidos de control en sección, por ejemplo, los músculos de la probóscide, para determinar si la expresión de la proteína de interés es específica de ciertos tipos de células o tipos de tejidos22. Esto permite la comparación directa entre tejidos, en lugar de usar secciones separadas que podrían verse afectadas por ligeras diferencias en las condiciones. Otro punto fuerte de este protocolo y de utilizar Drosophila como sistema modelo es que las cabezas de las moscas son muy pequeñas19,20, por lo que se pueden realizar imágenes fluorescentes de contenido relativamente alto. Hemos sido capaces de poner más de 50 cabezas en un solo bloque. Con 8 secciones que se pueden colocar en un portaobjetos de tamaño estándar de la industria, 1 portaobjetos podría contener 8 secciones únicas por mosca para un total de 400 secciones únicas. Es importante destacar que todas las secciones se someten a las mismas condiciones experimentales y puntos de tiempo para lograr una gran integridad en la comparación entre grupos. Además, este protocolo solo requiere el uso de un microscopio fluorescente estándar en lugar de un microscopio confocal, lo que puede ser prohibitivo para los laboratorios o instituciones que carecen de un alto apoyo financiero y permiten el acceso a estas imágenes de manera más amplia.
Una limitación clave de este protocolo, que es inherente a la inmunotinción, es la importancia de utilizar anticuerpos de alta calidad y controles adecuados a la hora de optimizar los anticuerpos. Es fundamental verificar que los anticuerpos sean selectivos y sensibles a la proteína de interés, ya que a menudo hay tinciones fuera del objetivo que pueden dificultar la determinación de si la señal fluorescente es real. Para ello, pruebe tanto los anticuerpos primarios como los secundarios. Afortunadamente, es sencillo hacer esto debido a las herramientas genéticas fácilmente disponibles en Drosophila. Para verificar la calidad del anticuerpo primario, recomendaríamos completar el protocolo con moscas de tipo salvaje y moscas experimentales junto con moscas de control positivo que sobreexpresan la proteína de interés y moscas de control negativo que tienen el gen noqueado o derribado. Estos grupos de control establecerán el rango de niveles de expresión y fluorescencia esperada, sirviendo como puntos de referencia para evaluar dónde se encuentran las moscas experimentales dentro de ese espectro. Es fundamental probar múltiples diluciones del anticuerpo primario, ya que muy poco conducirá a una tinción de mala calidad que no conduce a la fluorescencia por encima del fondo donde la proteína está presente, mientras que demasiado anticuerpo conducirá a una tinción fuera del objetivo donde la proteína está ausente. Este enfoque de dilución múltiple debe incluir un grupo sin anticuerpo primario, que verificará la calidad del anticuerpo secundario, ya que solo habrá fluorescencia en este grupo si hay fluorescencia de fondo y proporciona un grupo de control negativo adicional que muestra los límites de detección fluorescente por el anticuerpo secundario. Si es necesario, utilice diferentes condiciones de incubación, es decir, tiempo o temperatura, para maximizar la relación señal-ruido en sus imágenes finales. Reiteramos que los anticuerpos de alta calidad, junto con el tejido de alta calidad, son fundamentales para la obtención de imágenes inmunofluorescentes de alta calidad.
En conjunto, las imágenes inmunofluorescentes son una herramienta poderosa para estudiar la biología en general y la neurociencia en particular. Esto, combinado con las poderosas herramientas genéticas disponibles en Drosophila, tiene el potencial de descubrir conocimientos importantes sobre cómo las proteínas afectan la salud y la enfermedad. Se ha demostrado que el cerebro de la mosca es importante para descubrir cómo funciona el cerebro humano y seguirá haciéndolo. Debido a la adaptabilidad del protocolo que describimos aquí, el papel de casi cualquier proteína (o lípido) en la cabeza se puede estudiar en el contexto de cualquier enfermedad o afección, solo limitada por la calidad de los anticuerpos. Por lo tanto, es probable que las imágenes inmunofluorescentes sean fundamentales para futuras investigaciones sobre cómo funciona el cerebro y tengan un impacto significativo en la salud humana y el desarrollo terapéutico.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a los miembros del laboratorio Melkani por su ayuda con valiosos comentarios para desarrollar el protocolo. Las cepas de mosca, Elav-Gal4 (BL#458) y UAS-ApoE4 (BL#76607) se obtuvieron del Bloomington Drosophila Stock Center (Bloomington, IN, EE. UU.). Este trabajo fue apoyado por las subvenciones de los Institutos Nacionales de Salud (NIH, por sus siglas en inglés) AG065992 y RF1NS133378 a G.C.M. Este trabajo también cuenta con el apoyo de los fondos UAB Startup 3123226 y 3123227 a G.C.M.
Materiales
| Name | Company | Catalog Number | Comments |
| 1000 uL Pipette | Eppendorf | 3123000063 | |
| 1000 uL Pipette Tips | Olympus Plastics | 23-165R | |
| 10X Phosphate Buffered Saline (PBS) | Fisher | J62036.K7 | ph=7.4 |
| 200 Proof Ethanol | Decon Laboratories | 64-17-5 | |
| 20X Tris Buffered Saline | Thermo Scientific | J60877.K2 | pH=7.4 |
| AF750 Goat Anti-Mouse Secondary Antibody | Alexa Fluor | A21037 | |
| Anti-Roll Glass | IMEB | AR-14047742497 | |
| ApoE Mouse Primary Antibody | Santa Cruz | SC13521 | |
| Bovine Serum Albumin | Fisher | 9048-46-8 | |
| Centrifuge Tubes 1.5 mL | Fisher | 05-408-129 | |
| Charged Slides | Globe Scientific | 1415-15 | |
| Cryosectioning Molds | Fisher | 2363553 | |
| Cryostat | Leica | CM 3050 S | |
| Cryostat Blades | C.L. Sturkey | DT554N50 | |
| Distilled Water | |||
| Dry Ice | ??? | ??? | |
| Fine Forceps | Fine Science Tools | 11254-20 | |
| Fly Pad | Tritech Research | MINJ-DROS-FP | |
| Hardening mounting Media with Dapi | Vectashield | H-1800 | |
| Kimwipes | Kimtech | 34120 | |
| Microscope | Olympus | SZ61 | |
| Nile Red | Sigma | N3013 | |
| Optimal Cutting Temperature Compound | Fisher | 4585 | |
| Orbital Shaker | OHAUS | SHLD0415DG | |
| Paraformaldehyde 20% | Electron Microscopy Sciences | 15713 | |
| Razor Blades | Gravey | #40475 | |
| Spring Scissors | Fine Science Tools | 15000-10 | |
| Sucrose | Fisher | S5-500 |
Referencias
- Fabbri-Destro, M., Rizzolatti, G. Mirror neurons and mirror systems in monkeys and humans. Physiology. 23, 171-179 (2008).
- Faust, T. E., Gunner, G., Schafer, D. P. Mechanisms governing activity-dependent synaptic pruning in the developing mammalian CNS. Nat Rev Neurosci. 22, 657-673 (2021).
- Roozendaal, B., McEwen, B. S., Chattarji, S. Stress, memory and the amygdala. Nat Rev Neurosci. 10, 423-433 (2009).
- Arber, S., Costa, R. M. Networking brainstem and basal ganglia circuits for movement. Nat Rev Neurosci. 23, 342-360 (2022).
- GBD 2019 Dementia Forecasting Collaborators. Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050: an analysis for the Global Burden of Disease Study 2019. Lancet Public Health. 7, e105-e125 (2022).
- Huang, Y., Li, Y., Pan, H., Han, L. Global, regional, and national burden of neurological disorders in 204 countries and territories worldwide. J Glob Health. 13, 04160 (2023).
- Crick, F. Central dogma of molecular biology. Nature. 227, 561-563 (1970).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9, 235-244 (2016).
- Hales, K. G., Korey, C. A., Larracuente, A. M., Roberts, D. M. Genetics on the Fly: A primer on the Drosophila model system. Genetics. 201, 815-842 (2015).
- Larkin, A., et al. FlyBase: updates to the Drosophila melanogaster knowledge base. Nucleic Acids Res. 49, D899-D907 (2021).
- Jeibmann, A., Paulus, W. Drosophila melanogaster as a model organism of brain diseases. Int J Mol Sci. 10, 407-440 (2009).
- Winding, M., et al. The connectome of an insect brain. Science. 379, eadd9330 (2023).
- Bargiello, T. A., Jackson, F. R., Young, M. W. Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature. 312, 752-754 (1984).
- Zehring, W. A., et al. P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell. 39, 369-376 (1984).
- Huang, R. C. The discoveries of molecular mechanisms for the circadian rhythm: The 2017 Nobel Prize in Physiology or Medicine. Biomed J. 41, 5-8 (2018).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. N Am J Med Sci. 4, 429-434 (2012).
- Ong, S. E., Foster, L. J., Mann, M. Mass spectrometric-based approaches in quantitative proteomics. Methods. 29, 124-130 (2003).
- Behnke, J. A., Ye, C., Moberg, K. H., Zheng, J. Q. A protocol to detect neurodegeneration in Drosophila melanogaster whole-brain mounts using advanced microscopy. STAR Protoc. 2, 100689 (2021).
- Moraes, R. C. M., et al. Apolipoprotein E induces lipid accumulation through Dgat2 that is prevented with time-restricted feeding in Drosophila. Genes. 15 (11), 1376 (2024).
- Roth, J. R., et al. Rapamycin reduces neuronal mutant huntingtin aggregation and ameliorates locomotor performance in Drosophila. Front Aging Neurosci. 15, 1223911 (2023).
- Currier, T. A., Pang, M. M., Clandinin, T. R. Visual processing in the fly, from photoreceptors to behavior. Genetics. 224, (2023).
- McKellar, C. E., Siwanowicz, I., Dickson, B. J., Simpson, J. H. Controlling motor neurons of every muscle for fly proboscis reaching. Elife. 9, (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados