Method Article
脳蛍光染色および免疫染色を強化するための ショウジョウバエ 頭部の直接凍結切片
要約
この研究では、斬首、固定、凍結切片、蛍光染色、免疫染色、およびイメージングを含む組織処理の簡略化されたプロトコルを提示します。これらは共焦点および多光子イメージングに拡張できます。この方法は、複雑な解剖に匹敵する有効性を維持し、高度な運動能力の必要性を回避します。定量的な画像分析は、広範な調査の可能性を提供します。
要約
ショウジョウバエのメラノガスター脳の免疫染色は、複雑な行動、神経回路、およびタンパク質発現パターンの背後にあるメカニズムを探求するために不可欠です。従来の方法では、複雑な解剖の実施、組織の完全性の維持、高解像度イメージング中の特定の発現パターンの視覚化などの課題がよく伴います。クライオ切片と蛍光染色および免疫染色を組み合わせた最適化されたプロトコールを紹介します。この方法により、組織の保存とシグナルの明瞭さが向上し、ショウジョウバエの脳イメージングのための面倒な解剖の必要性が軽減されます。この方法では、迅速な解剖、最適な固定、凍結保護、凍結切片、続いて蛍光染色と免疫染色が行われます。このプロトコールは、組織の損傷を大幅に低減し、抗体の浸透性を高め、鮮明で鮮明な画像を提供します。このアプローチの有効性を、特定の神経集団とシナプスタンパク質を高い忠実度で視覚化することにより実証します。この汎用性の高い方法により、成体脳のさまざまなタンパク質マーカーを複数のz面にわたって分析でき、他の組織やモデル生物にも適応できます。このプロトコルは、ショウジョウバエの神経生物学研究において高品質の免疫組織化学を行う研究者に、信頼性と効率性に優れたツールを提供します。この手法の詳細な可視化により、神経解剖学、病理学、タンパク質の局在化の包括的な解析が容易になり、神経科学研究に特に価値があります。
概要
社会的相互作用1、感覚的知覚と処理2、学習3、運動4に至るまでの複雑な行動は、脳によって駆動されます。神経障害もますます一般的になっており、時間とともに増加すると予測されています5,6。脳が健康と病気の両方でどのように機能するかを研究することは非常に重要です。分子生物学のセントラルドグマは、生物学的ユニットの最も重要な機能の1つはタンパク質7であり、それらがどれだけ、どこで発現するかの両方が、脳がどのように機能するかを理解するために重要であることを示唆しています。
ショウジョウバエ(Drosophila melanogaster)は、一般にショウジョウバエとして知られており、老化および病態生理学的条件下での脳機能を研究するための非常に貴重なモデルである8。ショウジョウバエの高度な遺伝ツールの利用可能性により、研究者はほぼすべてのタンパク質の機能を探索することができ9、ほぼすべての遺伝子の包括的な遺伝ライブラリに容易にアクセスできます10。これらの特徴と、その短い寿命と高い繁殖率により、ショウジョウバエは脳研究の優れたモデルとなっています11。これは、ハエの完全な脳地図の開発を含む重要な成果につながり12、さらには概日リズムと分子時計のニューロンメカニズムを解明するためのノーベル賞に貢献しました13,14,15。その結果、ショウジョウバエは依然として強力で汎用性の高いシステムであり、脳機能の理解を前進させ、神経学的プロセスに対する前例のない洞察を提供しています。
免疫組織化学と免疫蛍光は、in situでのタンパク質発現を研究するための基本的なツールです。ウェスタンブロットのような手法は、半定量的な分析しかできず、通常はバルク組織16で実施され、質量分析のような複雑で高価な手法でタンパク質レベル17を測定するのとは対照的に、免疫組織化学は比較的簡単で、タンパク質発現の定量化と、組織または細胞内のタンパク質の局在測定の両方が可能です。重要なことは、蛍光免疫組織化学をマルチプレックス化して複数のタンパク質を測定し、特定の細胞タイプや組織を特定したり、同じ組織内の複数の質問に答えたりすることもできることです。さらに、組織固定により、さまざまな実験条件、遺伝子型、年齢、概日時間軸での比較が可能になります。しかし、蛍光免疫組織化学は困難な場合があり、多くの要因が画質に影響を与える可能性があります。このショウジョウバエの脳に対する最適化された凍結切片および免疫染色プロトコルは、組織の保存、抗体の浸透、神経集団とタンパク質マーカーの可視化を改善することにより、高解像度イメージングを強化することを目的としています。複雑な解剖、組織の損傷、全脳マウント18に関連する限られた画像解像度など、従来の方法の課題に対処するために開発されました。このプロトコルは、クライオセクショニングと蛍光染色を組み合わせて、複数のz面にわたる構造的完全性とシャープなイメージングを保証します。ホールマウント調製と比較して、この方法は歪みを最小限に抑え、抗体のより深い拡散を促進し、明確な神経解剖学的およびタンパク質の局在分析を提供します18。その汎用性により、他の組織やモデル生物への適応が可能になり、神経科学研究のための信頼性と効率的なツールを提供します19,20。ほぼすべてのタンパク質を見るように適応でき、あらゆる状態、疾患、またはモデルの研究に適用できます。
プロトコル
1. 機器の準備
- クライオスタットの電源がオンになっていて、-20°Cに設定されていることを確認します。 スライドウォーマーまたは小型インキュベーターの電源を入れ、37°Cに設定されていることを確認します。
注:この段階では、ラベル付けされたスライドをウォーマーまたはインキュベーターに置き、切片化まで無期限に放置することができます。
2. 溶液の調製
- 10x PBSストックから50 mLの1x Phosphate buffered saline(PBS)(pH 7.4)を調製します。PBS中の4%パラホルムアルデヒド溶液を最終容量10mLで調製します。
- スプレーボトルに70%エタノールを水に溶かした洗浄液を調製します。ブロッキング溶液(20倍ストックのトリス緩衝生理食塩水中の3%ウシ血清アルブミン(BSA))を調製します。一次抗体溶液を調製します(希釈は実験に依存します)。ここでは、TBS中の3% BSAに1:250に希釈したApoEマウス抗体を使用します。
- 二次抗体溶液を調製します(希釈は実験によって異なります)。ここでは、Alexa Flour 750 A21037 Goat Anti-Mouse Secondary を TBS 中の 3% BSA で 1:500 に希釈して使用しています。
- 蛍光染色液を調製します(希釈は実験に依存します)。ここでは、PBS中のナイルレッドの5μg/mL溶液を調製します。
注意: すべての溶液、特に蛍光灯は冷蔵し、暗い冷蔵容器に保管する必要があります。また、使用直前に室温に戻す必要があります。
3. ティッシュの収集
- 老朽化したバイアルでハエを入手した後、CO2 マットのバルブを開き、ハエをマットに素早く捨てて逃げないようにします。ハエがほとんど意識を失い、ほとんどの動きが止まるのを待ちます。SZ61顕微鏡の下をマットを対物レンズの下に移動させることにより、位置は顕微鏡の下を移動します。ハエがはっきりと見え、首を切るのに快適になるように倍率と焦点を調整します。
注:この例で使用されているフライは、ELAV/+およびELAV>ApoE4です - 胸部と頭の間にスプリングハサミを挿入し、しっかりと握り、実験グループごとに5〜10個のフライヘッドを斬首します。未使用のハエを老朽化したバイアルに戻します。
注:固定剤の浸透に関する懸念がある場合は、ステップ4.1で固定剤の浸透を増加させるために、頭部の後部に小さな切開を行うことができます。 - ブラシを使用して、ELAV/+およびELAV>ApoE4グループが収集されるまで、氷上の標識された1.5 mLチューブにヘッドをそっと入れます。
4. 全組織の固定
- チューブを氷から取り出し、PBS溶液中の4%パラホルムアルデヒド100μLを各チューブにピペットで移し、すべてのヘッドが溶液に沈んでいることを確認します。ヘッドがチューブの壁に付着し、溶液との接触を避けている場合は、ブラシを使用してヘッドをそっと下に押すか、水平面を軽くたたいて適切な接触を確保します。
- 中程度の設定でオービタルシェーカーに15分間置きます。15分後、パラホルムアルデヒド溶液を廃棄し、1x PBSと10分間交換して、すべてのヘッドが溶液に沈むようにします。
- 毎回前の溶液を捨てて、ティッシュをPBSで2回、それぞれ10分間、合計3回洗浄します。
- 最終洗浄後、ヘッドをPBS溶液中の10%ショ糖に移し、ヘッドがチューブ内に沈んでいることを確認します。これらを一晩放置して、最適な飽和状態にします。
注:同日イメージングが必要な場合は、ショ糖注入を減らすことができます。ただし、凍結保護剤の効果も比例して減少します。
5.金型の準備
- ラベル付き金型に約50%の最適切削温度(OCT)コンパウンドを充填し、金型の四隅すべてに広がるようにします。
- ブラシを使用して、ヘッドを金型内のOCTの表面に慎重に置きます。複数の実験グループを同じ金型に配置する場合は、混乱を防ぐために、これらのグループが金型内で分離されていることを確認してください。
注:ブラシを介して以前のショ糖溶液と汚染することにより、OCT化合物の希釈を防ぐことが重要です。さらに、ブラシを使用してOCTの奥深くに配置すると、頭の周りに多くの泡が作成される可能性があります。これらの間違いを避けて、後でセクショニングの問題を防ぎます。 - 鉗子の先端を使用して、目が底を向いた状態で、各ヘッドをゆっくりと型の底に押し込みます。この方向は、冠状平面を貫通するカットに対して選択されます。
- このプロセスでは、ヘッドを金型の底に穴を開けたり押しつぶしたりしないでください。すべての頭部をX、Y、Z次元に位置合わせして、各セクションにすべての被写体が同時に含まれるようにします。気泡の形成を減らすために、ゆっくりとした沈没を確保してください。
- すべてのヘッドが適切に位置合わせされたら、金型を慎重に-20°Cに直接置き、凍結します。
注意: セクショニング中にヘッドの位置合わせが大幅にずれていることがわかった場合は、金型の初期スナップ凍結にドライアイスまたは液体窒素の使用を検討してください。 - 金型がほぼ凍結したら、残りをOCTで満たし、凍結させてから-80°Cで長期間保存します。
6. 金型のクライオセクショニング
注:一般的に、実験グループの型を切断する前に、ブランク型の準備をして切断することをお勧めします。これにより、組織切片化の直前に、ホイール、ブレード、およびアンチロールガラスの適切な機能を確保することができます。
- チャックビットを金型にたっぷりとOCTを塗布し、ビットを上に置き、平らに押し付けて、チャックビットを金型に取り付けます。これをクライオスタットで完全に凍結させます(通常は5分以内)。
- ビットとOCTブロックを金型から外してチャックに入れ、金型が上から下に適切な向きに保たれるようにします。ビットが固定されるまでチャックキーを締めます。
- 調整ノブとチャック深さコントロールを使用して、ブロックをブレードに合わせます。
- 切片幅を20μmに設定します。ゆっくりとした一貫した動きで各スライスをカットし、アンチロールガラスが各スライスをキャプチャできるようにします。温められたスライドを使用してセクションをキャプチャします。スライドをセクションに近い端に触れ、セクションがスライド上に浮き上がるようにします。標準サイズのスライド(25 mm x 75 mm x 1 mm)に適切な間隔を空けて、最大8つのセクションを収めることができます。
注:収集するセクションを選択する際には、選択の問題があります。埋め込み方向の結果として、前のセクションは前部から、後のセクションは頭部の後部からになります。そのため、特定の領域に関心がある場合、それに応じてセクション選択を調整できます。あるいは、組織が残らなくなるまで、すべての切片を複数のスライドに集めることもできます。 - スライドを室温で少なくとも30分間、1時間以内で乾燥させます。
7. 染色とIHC
注:このプロトコルでは、非標識一次抗体を使用してIHCを詳述します。蛍光色素標識抗体、または1つのステージで実施できるその他の蛍光染色剤は、二次抗体を併用する場合は、二次抗体と併用する必要があります。
- 乾燥期間の直後に、かみそりの刃を使用してスライドの端にあるOCTを取り除き、疎水性の境界線の余地を残します。マーカーを使用して、各スライドに疎水性の境界線を描きます。これを5分間乾燥させます。
- スライドの上部で優しくピペッティングし、可能であればティッシュの上に直接ピペッティングしないようにして、すべてのスライドをPBSでそれぞれ5分間3回洗浄します。
注:ここでは、1000 μLピペットが最も役立ちます。ティッシュが入った標準サイズのスライドは、750μLの溶液で完全に覆う必要があります。スライドラックやバケツも使用できます。 - スライドを洗浄した後、TBSブロッキング溶液中の3%BSAをスライドにピペットで移します。30分間インキュベートします。
- ブロッキング溶液を廃棄し、一次抗体溶液をスライドにピペットで移します。この場合、SC-13521 ApoEをTBS中の3% BSAで1:250に希釈し、抗体を4°Cで一晩または室温で1時間インキュベートします。ウェットティッシュペーパーやペーパータオルを使用して、溶液が一晩で乾かないようにします。
- 一次抗体を廃棄し、ピペットを使用してPBSで各5分間3回洗浄します。
- 二次抗体溶液を添加します。この場合、1:500 希釈の AF 750 Goat Anti-Mouse と 5 μg/mL 濃度の Nile Red を TBS 中の 3% BSA に添加します。これを室温で 1 時間インキュベートします。
注:蛍光染色剤と二次抗体を同じバッファー(TBS中3% BSA)で同時にインキュベートします。これは、2つの試薬間に既知の競合がない限り、推奨されます。競合が存在する場合は、別々にインキュベートし、インキュベーションの間にさらに3回の洗浄を行います。 - スライドをPBSで3回、それぞれ5分間洗浄します。最終洗浄後、スライドに少量のPBSを残します。
8. イメージングのマウントと準備
- 1000 μLのピペットを使用して、DAPI(0.9μg/ml)を含む硬化封入剤を3〜5滴、組織に直接落下しないようにスライド全体に均等に加えます。
- カバースリップをスライドに置き、気泡が発生しないようにします。
注:鉗子を使用すると、カバーガラスがスライドの表面近くにスライドしてから最終的に解放されるため、これを助けることができます。 - 取り付けたばかりのスライドは取り扱いに注意し、完全に乾くまで平らに保管してください。長期保存が予想される場合は、マニキュアを使用してスライドを密封します。
- 蛍光による劣化を避けるために、できるだけ早く画像を撮影してください。
9. 画像取得
注意:画像キャプチャの場合、Olympus Cell Sense Dimensionsソフトウェアの使用について詳しく説明します。
- イメージングする前に、スライドを検査し、水溶液中の70%エタノールを使用してスライドを拭いてください。取り付け直後にスライドが写っている場合は、カバースリップを邪魔しないよう清掃に十分注意してください。スライドとカバースリップの表面を5分間乾かしてから、イメージングします。
- キャプチャする各チャンネル(この場合は、DAPI、Nile Red、AF 750のチャンネル)を選択します。
- 以下で説明するように、目的の倍率を選択します。倍率の選択は実験に依存します。ここでは、10倍の倍率を使用します。
注:油性レンズを含むすべての倍率を使用できます。必要に応じて、スライド面に液浸油を塗布します。 - 各チャンネルについて、実験で最も明るい蛍光を発する被験者に基づいて、適切な露光時間を較正します。露出オーバーを避けながら、できるだけ明るい画像を生成します。
注:一般に、プロセスキャプチャが不十分である主な要因は、露出過多による定義の損失と、バックグラウンドシグナルが多すぎて真のシグナルから分離するのが難しいことです。さらに、露出は、使用する固有の倍率ごとに個別に設定する必要があります。 - 保存するフォルダを選択し、メニュー内で結合された画像に名前を付けます。キャプチャ後、すべての画像はこのフォルダに配置され、ここで定義された名前が付けられます。
- 最初に、最適な焦点を可能にするチャネル内の被写体に焦点を合わせて画像をキャプチャし、次に収集を開始します。実験全体で一貫性を保つために、同じチャネルで各被験者に焦点を当てる手順を維持します。
- 比較したグループ間の蛍光減衰を避けるために、同じ日に後の比較に使用したすべての実験グループをキャプチャします。
- 以下で説明するように、目的の倍率を選択します。倍率の選択は実験に依存します。ここでは、10倍の倍率を使用します。
10. 定量化
注:定量化は、さまざまなソフトウェアを使用して実行できます。ここでは、オリンパスのCellSense Dimensionsの使用について言及しています。
- コレクションに続いて、画像を確認します。不完全性または切片化アーティファクトがある切片を定量化フォルダから削除します。定量化の目標を反映した画像を選択します。欠陥の例としては、気泡、破れた部分、組織の重なり、ほこりや破片などがあります。
- 適切な画像を選択するには、脳組織を特徴とするすべての画像が、脳全体の全体的な発現を反映するための定量化に使用されていることを確認してください。あるいは、前脳、中脳、後脳のみを反映した画像を使用して、これらの領域の表現の違いについての洞察を得ることができます。
- カウントメニューとメジャーメニュー内で、画像の定量化のための関心のあるパラメータとその境界を決定します。
- 平均強度値の比較による ApoE 発現の定量化を行うには、そのチャネルのすべてのピクセルが考慮される (0-無限大) ような閾値を選択します。さらに、使用可能な描画ツールを使用して、関心領域のアウトラインを作成します。
- カウントを実行し、すべてのファイルに対してバッチで測定するか、各画像で個別に測定します。
- バッチ処理の場合は、定量化の設定と実行を記録した上で、定量化を行うフォルダを選択します。バッチでの処理は、マクロマネージャータブからアクセスでき、ワークフローを大幅に高速化します。
- データテーブルをスプレッドシートにエクスポートしてプロットします。これを行うには、カウントと測定の結果メニューを使用して、バッチで実行するときにテーブルを自動的に開いたり、テーブルにエクスポートしたりします。これらのデータテーブルには、ステップ10.2で選択したすべてのパラメータが含まれます。
- 統計解析とプロットの場合は、スプレッドシートを直接使用して、または他のソフトウェアを使用してデータをプロットします。選択したソフトウェアに精通していることは、実験結果を正確に表現するための鍵となります。ここでは、変異体の脳におけるApoE発現の絶対強度値をコントロールに正規化し、GraphPad Prismを使用してプロットしました。
結果
上述の方法により、成虫のハエの脳の蛍光イメージングを、面倒な解剖なしに確実に行うことができます。 図1に簡単に示すように、この方法は簡単で、すべての試料、機器、材料がすぐに入手できる場合は迅速に実行できます。あるいは、OCT金型段階で-80°Cの保管を使用することで、試料を何週間も後で使用するために保管することができます。研究者は、簡単な解剖および埋め込み技術を学ぶために長いトレーニングを受ける必要がないため、この方法は非常に利用しやすくなっています。
この方法を用いて実施された蛍光顕微鏡法の例を図2A-Dに示すことができます。抗体タグ(ApoE)と蛍光染色(ナイルレッド)の両方の発現は明確に定義されています。さらに、脳組織の高い完全性も見ることができます。画像は、デコンボリューションなどの一般的な画像処理ソフトウェア機能を使用してさらに鮮明にすることができます。これは、パネル図2A'-D'にも示されています。デコンボリューションは、シャープネスとコントラストを改善し、ノイズを減らすのに役立ちます。
画像の定量化に関しては、オブジェクト数、平均オブジェクト面積、強度、面積分率などの標準パラメータについて、すべての画像を定量化できます。定量の限界は、選択するソフトウェアによって大きく異なりますが、一般的には、上記のパラメータにより適切な調査が可能になり、ほとんどのアプリケーションで利用できます。 図3 は、複数の画像の脳領域内の平均強度値から生成されたヒストグラムを示しています。これは、特定の遺伝子型の平均脳強度を視覚化するのに役立ちます。この場合は、ELAV/+ と ELAV>ApoE4 です。
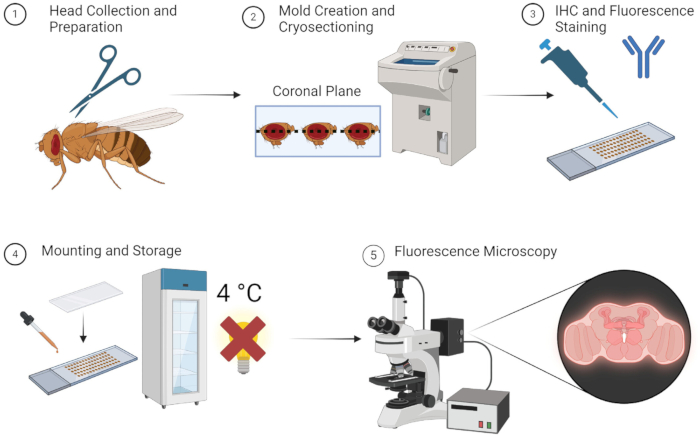
図1:ショウジョウバエの脳切片化とイメージングのワークフロー。 1.ショウジョウバエの頭は、細いハサミを使用して斬首することによって収集されます。2.固定後、採取した頭部をOCTとともに型に埋め込み、凍結切片で脳の薄い切片を得る。3.脳切片は、一次抗体による免疫組織化学染色(IHC)または蛍光染色にかけられます。4. 染色後、切片をカバースリップでマウントし、暗所で4°Cで保存することで、蛍光の完全性を維持します。5.脳切片を蛍光顕微鏡で可視化し、標的タンパク質や細胞構造を研究します。 この図の拡大版を表示するには、ここをクリックしてください。

図2:凍結切片頭部の免疫組織化学および蛍光染色。(A-D)ApoE発現のために染色された生後7週齢の雌のハエの頭部、脂質(ナイルレッド)、DAPIの代表的な画像。これらの画像は、ヒトのApoE4(Elav>ApoE4)の発現を示していますが、コントロールフライのElav/+にはこのApoEの発現がありません。ナイルレッド(Elav>ApoE4、およびElav/+)による脂質染色。この方法を使用した脳組織の完全性は、ここでも証明されています。(A'-D')これらは、デコンボリューション後のA、B、C、およびDを表します。この図の拡大版を表示するには、ここをクリックしてください。

図3:ApoEの相対定量。 7週齢の ショウジョウバエ の脳におけるApoEタンパク質発現の定量結果が示されました。強度の絶対値は、Elav/+およびElav>ApoE4変異体の両方の被験者について収集され、次いでElav/+に正規化された。Elav>ApoE4とElav/+の間には統計的有意性が認められています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここでは、凍結切片化された ショウジョウバエ の頭部の正確な蛍光イメージングのためのプロトコールを紹介します。これは、いくつかの重要な利点を持つ単純なアプローチです。つまり、これらの方法は、基本的な実験室の安全トレーニングを受けた人なら誰でも完了できるほど単純であり、高品質の抗体が存在する任意のタンパク質の発現を測定することに適応でき、目的のタンパク質がどれだけ発現しているか、そしてその発現が頭のどこで発生するかを正確に測定することができます。組織と画像の品質が十分に高ければ、 ショウジョウバエ の頭部全体にわたる発現の3Dマッピングが可能になる可能性があります。
共焦点顕微鏡と組み合わせたイメージングのために脳を分離する技術的に困難なアプローチとは対照的に、このプロトコルでは、脳だけでなく、ショウジョウバエの頭部全体にわたるイメージングが可能です。これは、ハエの視覚系がニューロン機能の重要なモデルであることを考えると特に重要です21が、これらの構造の一部は脳の分離中に失われる可能性があります。それはまた、目的のタンパク質の発現が特定の細胞型または組織型22に特異的であるかどうかを決定するために、例えば、テングの筋肉を切片内対照組織に提供する。これにより、わずかな条件の違いによって影響を受ける可能性のある別々の切片を使用するのではなく、組織間の直接比較が可能になります。このプロトコルのもう一つの強みであり、モデルシステムとしてショウジョウバエを使用することは、フライヘッドが非常に小さい19,20であるため、比較的ハイコンテントの蛍光イメージングを行うことができることです。1つのブロックに50個以上のヘッドを入れることができました。業界標準サイズのスライドに8つのセクションを配置できるため、1つのスライドにはフライごとに8つのユニークなセクションが含まれ、合計400のユニークなセクションが含まれます。重要なことは、すべてのセクションが同じ実験条件と時点にさらされ、グループ間で比較する際に優れた完全性を達成することです。さらに、このプロトコルでは、共焦点顕微鏡ではなく標準的な蛍光顕微鏡を使用するだけで済みます。これは、高い財政的支援がなく、このイメージングへのアクセスをより広く許可している研究室や機関にとっては法外な費用になる可能性があります。
このプロトコルの主な制限の1つは、免疫染色に固有のものですが、抗体を最適化する際に高品質の抗体と適切なコントロールを使用することの重要性です。抗体が選択的で目的のタンパク質に対して感受性があることを確認することは非常に重要ですが、多くの場合、オフターゲット染色が行われ、蛍光シグナルが本物であるかどうかを判断するのが難しくなる可能性があります。そのためには、一次抗体と二次抗体の両方を試験します。幸いなことに、 ショウジョウバエには簡単に利用できる遺伝ツールがあるため、これを行うのは簡単です。一次抗体の品質を検証するために、野生型ハエと実験ハエ、目的のタンパク質を過剰発現するポジティブコントロールハエ、および遺伝子がノックアウトまたはノックダウンされたネガティブコントロールハエでプロトコールを完了することをお勧めします。これらの対照群は、発現レベルと予想される蛍光の範囲を確立し、実験用のハエがそのスペクトル内のどこに該当するかを評価するための基準点として機能します。一次抗体の希釈倍率を複数回試験することは、少なすぎると質の低下につながり、タンパク質が存在するバックグラウンドより上での蛍光につながらない一方、抗体が多すぎると、タンパク質が存在しない場所でオフターゲット染色につながるため、試験することが重要です。この複数回希釈法には、一次抗体を含まないグループを含めるべきであり、これにより二次抗体の品質が検証されます。これは、バックグラウンド蛍光が存在する場合にのみ蛍光が存在し、二次抗体による蛍光検出の限界を示す追加のネガティブコントロールグループを提供するためです。必要に応じて、時間や温度など、さまざまなインキュベーション条件を使用して、最終画像のS/N比を最大化します。私たちは、高品質の免疫蛍光イメージングには、高品質の抗体と高品質の組織が重要であることを繰り返し述べます。
全体として、免疫蛍光イメージングは、生物学をより広く、神経科学をより具体的に研究するための強力なツールです。これは、 ショウジョウバエ で利用可能な強力な遺伝ツールと組み合わせることで、タンパク質が健康や病気にどのように影響するかについての重要な知識を明らかにする可能性があります。ハエの脳は、人間の脳がどのように機能するかを発見するために明らかに重要であり、今後もそうであり続けるでしょう。ここで説明するプロトコルの適応性により、頭部内のほぼすべてのタンパク質(または脂質)の役割は、抗体の品質によってのみ制限されるあらゆる疾患や状態の状況で研究できます。したがって、免疫蛍光イメージングは、脳の働きに関する将来の研究にとって重要であり、人間の健康と治療法の開発に大きな影響を与える可能性があります。
開示事項
著者は何も開示していません。
謝辞
私たちは、プロトコルの開発に貴重なフィードバックを提供してくださったMelkani研究室のメンバーに感謝します。フライストックのElav-Gal4(BL#458)およびUAS-ApoE4(BL#76607)は、Bloomington Drosophila Stock Center(米国インディアナ州ブルーミントン)から入手しました。この研究は、国立衛生研究所(NIH)の助成金AG065992およびG.C.M.へのRF1NS133378によって支援されました。この作業は、UAB Startup Fundsによっても支援されており、G.C.M.に3123226および3123227しています。
資料
| Name | Company | Catalog Number | Comments |
| 1000 uL Pipette | Eppendorf | 3123000063 | |
| 1000 uL Pipette Tips | Olympus Plastics | 23-165R | |
| 10X Phosphate Buffered Saline (PBS) | Fisher | J62036.K7 | ph=7.4 |
| 200 Proof Ethanol | Decon Laboratories | 64-17-5 | |
| 20X Tris Buffered Saline | Thermo Scientific | J60877.K2 | pH=7.4 |
| AF750 Goat Anti-Mouse Secondary Antibody | Alexa Fluor | A21037 | |
| Anti-Roll Glass | IMEB | AR-14047742497 | |
| ApoE Mouse Primary Antibody | Santa Cruz | SC13521 | |
| Bovine Serum Albumin | Fisher | 9048-46-8 | |
| Centrifuge Tubes 1.5 mL | Fisher | 05-408-129 | |
| Charged Slides | Globe Scientific | 1415-15 | |
| Cryosectioning Molds | Fisher | 2363553 | |
| Cryostat | Leica | CM 3050 S | |
| Cryostat Blades | C.L. Sturkey | DT554N50 | |
| Distilled Water | |||
| Dry Ice | ??? | ??? | |
| Fine Forceps | Fine Science Tools | 11254-20 | |
| Fly Pad | Tritech Research | MINJ-DROS-FP | |
| Hardening mounting Media with Dapi | Vectashield | H-1800 | |
| Kimwipes | Kimtech | 34120 | |
| Microscope | Olympus | SZ61 | |
| Nile Red | Sigma | N3013 | |
| Optimal Cutting Temperature Compound | Fisher | 4585 | |
| Orbital Shaker | OHAUS | SHLD0415DG | |
| Paraformaldehyde 20% | Electron Microscopy Sciences | 15713 | |
| Razor Blades | Gravey | #40475 | |
| Spring Scissors | Fine Science Tools | 15000-10 | |
| Sucrose | Fisher | S5-500 |
参考文献
- Fabbri-Destro, M., Rizzolatti, G. Mirror neurons and mirror systems in monkeys and humans. Physiology. 23, 171-179 (2008).
- Faust, T. E., Gunner, G., Schafer, D. P. Mechanisms governing activity-dependent synaptic pruning in the developing mammalian CNS. Nat Rev Neurosci. 22, 657-673 (2021).
- Roozendaal, B., McEwen, B. S., Chattarji, S. Stress, memory and the amygdala. Nat Rev Neurosci. 10, 423-433 (2009).
- Arber, S., Costa, R. M. Networking brainstem and basal ganglia circuits for movement. Nat Rev Neurosci. 23, 342-360 (2022).
- GBD 2019 Dementia Forecasting Collaborators. Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050: an analysis for the Global Burden of Disease Study 2019. Lancet Public Health. 7, e105-e125 (2022).
- Huang, Y., Li, Y., Pan, H., Han, L. Global, regional, and national burden of neurological disorders in 204 countries and territories worldwide. J Glob Health. 13, 04160 (2023).
- Crick, F. Central dogma of molecular biology. Nature. 227, 561-563 (1970).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9, 235-244 (2016).
- Hales, K. G., Korey, C. A., Larracuente, A. M., Roberts, D. M. Genetics on the Fly: A primer on the Drosophila model system. Genetics. 201, 815-842 (2015).
- Larkin, A., et al. FlyBase: updates to the Drosophila melanogaster knowledge base. Nucleic Acids Res. 49, D899-D907 (2021).
- Jeibmann, A., Paulus, W. Drosophila melanogaster as a model organism of brain diseases. Int J Mol Sci. 10, 407-440 (2009).
- Winding, M., et al. The connectome of an insect brain. Science. 379, eadd9330 (2023).
- Bargiello, T. A., Jackson, F. R., Young, M. W. Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature. 312, 752-754 (1984).
- Zehring, W. A., et al. P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell. 39, 369-376 (1984).
- Huang, R. C. The discoveries of molecular mechanisms for the circadian rhythm: The 2017 Nobel Prize in Physiology or Medicine. Biomed J. 41, 5-8 (2018).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. N Am J Med Sci. 4, 429-434 (2012).
- Ong, S. E., Foster, L. J., Mann, M. Mass spectrometric-based approaches in quantitative proteomics. Methods. 29, 124-130 (2003).
- Behnke, J. A., Ye, C., Moberg, K. H., Zheng, J. Q. A protocol to detect neurodegeneration in Drosophila melanogaster whole-brain mounts using advanced microscopy. STAR Protoc. 2, 100689 (2021).
- Moraes, R. C. M., et al. Apolipoprotein E induces lipid accumulation through Dgat2 that is prevented with time-restricted feeding in Drosophila. Genes. 15 (11), 1376 (2024).
- Roth, J. R., et al. Rapamycin reduces neuronal mutant huntingtin aggregation and ameliorates locomotor performance in Drosophila. Front Aging Neurosci. 15, 1223911 (2023).
- Currier, T. A., Pang, M. M., Clandinin, T. R. Visual processing in the fly, from photoreceptors to behavior. Genetics. 224, (2023).
- McKellar, C. E., Siwanowicz, I., Dickson, B. J., Simpson, J. H. Controlling motor neurons of every muscle for fly proboscis reaching. Elife. 9, (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved