Method Article
Direkte Kryosektion von Drosophila-Köpfen zur verbesserten Fluoreszenzfärbung und Immunfärbung des Gehirns
In diesem Artikel
Zusammenfassung
Diese Studie stellt ein vereinfachtes Protokoll für die Gewebeaufbereitung vor, das Enthauptung, Fixierung, Kryosektion, Fluoreszenzfärbung, Immunfärbung und Bildgebung umfasst und auf konfokale und Multiphotonen-Bildgebung erweitert werden kann. Die Methode behält eine Wirksamkeit bei, die mit komplexen Dissektionen vergleichbar ist, ohne dass fortgeschrittene motorische Fähigkeiten erforderlich sind. Die quantitative Bildanalyse bietet ein umfangreiches Untersuchungspotenzial.
Zusammenfassung
Die Immunfärbung von Drosophila melanogaster-Gehirnen ist unerlässlich, um die Mechanismen hinter komplexen Verhaltensweisen, neuronalen Schaltkreisen und Proteinexpressionsmustern zu erforschen. Traditionelle Methoden sind oft mit Herausforderungen verbunden, wie z. B. der Durchführung komplexer Dissektionen, der Aufrechterhaltung der Gewebeintegrität und der Visualisierung spezifischer Expressionsmuster während der hochauflösenden Bildgebung. Wir stellen ein optimiertes Protokoll vor, das Kryosektionen mit Fluoreszenzfärbung und Immunfärbung kombiniert. Diese Methode verbessert die Gewebekonservierung und Signalklarheit und reduziert den Bedarf an mühsamen Dissektionen für die Bildgebung des Drosophila-Gehirns. Die Methode umfasst eine schnelle Dissektion, eine optimale Fixierung, Kryoprotektion und Kryosektion, gefolgt von einer Fluoreszenzfärbung und Immunfärbung. Das Protokoll reduziert Gewebeschäden erheblich, verbessert die Penetration von Antikörpern und liefert scharfe, gut definierte Bilder. Wir demonstrieren die Wirksamkeit dieses Ansatzes, indem wir spezifische neuronale Populationen und synaptische Proteine mit hoher Genauigkeit visualisieren. Diese vielseitige Methode ermöglicht die Analyse verschiedener Proteinmarker im erwachsenen Gehirn über mehrere Z-Ebenen hinweg und kann für andere Gewebe und Modellorganismen angepasst werden. Das Protokoll bietet ein zuverlässiges und effizientes Werkzeug für Forscher, die qualitativ hochwertige Immunhistochemie in neurobiologischen Studien zu Drosophila durchführen. Die detaillierte Visualisierung dieser Methode ermöglicht eine umfassende Analyse der Neuroanatomie, Pathologie und Proteinlokalisierung, was sie besonders wertvoll für die neurowissenschaftliche Forschung macht.
Einleitung
Komplexe Verhaltensweisen, die von sozialen Interaktionen1, sensorischer Wahrnehmung und Verarbeitung2, Lernen3 bis hin zu Bewegung4 reichen, werden vom Gehirn gesteuert. Auch neurologische Störungen treten immer häufiger auf und werden voraussichtlich mit der Zeit zunehmen 5,6. Es ist wichtig zu untersuchen, wie das Gehirn sowohl bei Gesundheit als auch bei Krankheit funktioniert. Das zentrale Dogma der Molekularbiologie legt nahe, dass eine der wichtigsten Funktionen biologischer Einheiten Proteinesind 7, und sowohl wie viel und wo sie exprimiert werden, sind entscheidend für das Verständnis der Funktionsweise des Gehirns.
Drosophila melanogaster, allgemein bekannt als Fruchtfliege, ist ein sehr wertvolles Modell für die Untersuchung der Gehirnfunktion unter Alterung und pathophysiologischen Bedingungen8. Die Verfügbarkeit fortschrittlicher genetischer Werkzeuge in Drosophila ermöglicht es den Forschern, die Funktion fast jedes Proteins zu erforschen9, mit umfassenden genetischen Bibliotheken für fast jedes Gen, die leicht zugänglich sind10. In Verbindung mit ihrer kurzen Lebensdauer und ihrer hohen Fortpflanzungsrate machen diese Eigenschaften Drosophila zu einem außergewöhnlichen Modell für die Hirnforschung11. Dies führte zu bedeutenden Errungenschaften, darunter die Entwicklung einer vollständigen Gehirnkarte der Fliege12, und trug sogar zu einem Nobelpreis für die Aufklärung der neuronalen Mechanismen des zirkadianen Rhythmus und der molekularen Uhren bei 13,14,15. Infolgedessen bleibt Drosophila ein leistungsstarkes und vielseitiges System, das unser Verständnis der Gehirnfunktion vorantreibt und beispiellose Einblicke in neurologische Prozesse ermöglicht.
Immunhistochemie und Immunfluoreszenz sind grundlegende Werkzeuge zur Untersuchung der Proteinexpression in situ. Im Gegensatz zu Techniken wie Western Blot, die nur eine semiquantitative Analyse ermöglichen und typischerweise in Massengewebe durchgeführt werden16, oder komplizierten und teuren Techniken wie der Massenspektrometrie zur Messung des Proteinspiegels17, ist die Immunhistochemie relativ einfach und ermöglicht sowohl die Quantifizierung der Proteinexpression als auch die Messung der Lokalisierung eines Proteins innerhalb eines Gewebes oder einer Zelle. Wichtig ist, dass die fluoreszierende Immunhistochemie auch gemultiplext werden kann, um mehrere Proteine zu messen, um bestimmte Zelltypen und Gewebe zu identifizieren oder mehrere Fragen im selben Gewebe zu beantworten. Darüber hinaus kann die Gewebefixierung Vergleiche zwischen verschiedenen experimentellen Bedingungen, Genotypen, Altersgruppen und zirkadianen Zeitpunkten ermöglichen. Die fluoreszierende Immunhistochemie kann jedoch eine Herausforderung darstellen, und viele Faktoren können die Bildqualität beeinflussen. Dieses optimierte Kryosektions- und Immunfärbeprotokoll für Drosophila-Gehirne zielt darauf ab, die hochauflösende Bildgebung zu verbessern, indem es die Gewebekonservierung, die Antikörperpenetration und die Visualisierung von neuronalen Populationen und Proteinmarkern verbessert. Entwickelt, um Herausforderungen bei herkömmlichen Methoden zu bewältigen, wie z. B. komplexe Dissektionen, Gewebeschäden und begrenzte Bildgebungsauflösung im Zusammenhang mit Ganzhirn-Mounts18. Dieses Protokoll kombiniert Kryosektionen mit Fluoreszenzfärbungen, um die strukturelle Integrität und eine scharfe Bildgebung über mehrere Z-Ebenen hinweg zu gewährleisten. Im Vergleich zu Ganzpräparaten minimiert diese Methode den Verzerrung, ermöglicht eine tiefere Antikörperdiffusion und ermöglicht klare neuroanatomische und Proteinlokalisationsanalysen18. Seine Vielseitigkeit ermöglicht die Anpassung an andere Gewebe und Modellorganismen und bietet ein zuverlässiges und effizientes Werkzeug für die neurowissenschaftliche Forschung19,20. Es kann so angepasst werden, dass es fast jedes Protein betrachtet, und zur Untersuchung jedes Zustands, jeder Krankheit oder jedes Modells angewendet werden.
Protokoll
1. Vorbereitung der Ausrüstung
- Stellen Sie sicher, dass der Kryostat eingeschaltet und auf -20 °C eingestellt ist. Schalten Sie den Objektträgerwärmer oder einen kleinen Inkubator ein und stellen Sie sicher, dass er auf 37 °C eingestellt ist.
HINWEIS: Zu diesem Zeitpunkt können beschriftete Objektträger auf den Wärmer oder Inkubator gelegt und auf unbestimmte Zeit bis zum Schneiden belassen werden.
2. Vorbereitung der Lösungen
- Bereiten Sie 50 ml 1x phosphatgepufferte Kochsalzlösung (PBS) mit einem pH-Wert von 7,4 aus 10x PBS-Stamm vor. Bereiten Sie eine Lösung aus 4% Paraformaldehyd in PBS mit einem Endvolumen von 10 ml vor.
- Bereiten Sie eine Reinigungslösung aus 70% Ethanol in Wasser in einer Sprühflasche vor. Bereiten Sie eine Blockierungslösung vor (3 % Rinderserumalbumin (BSA) in Tris-gepufferter Kochsalzlösung aus dem 20-fachen Stamm). Bereiten Sie eine primäre Antikörperlösung vor (die Verdünnung ist experimentell abhängig). Hier wird eine 1:250 Verdünnung von ApoE Maus Antikörper in 3% BSA bei TBS verwendet.
- Bereiten Sie eine Sekundärantikörperlösung vor (die Verdünnung ist experimentell abhängig). Hier wird eine 1:500 Verdünnung von Alexa Flour 750 A21037 Goat Anti-Mouse Secondary in 3% BSA in TBS verwendet.
- Bereiten Sie die fluoreszierende Färbelösung vor (die Verdünnung ist experimentabhängig). Hier wird eine 5 μg/mL Lösung von Nilrot in PBS hergestellt.
HINWEIS: Alle Lösungen, insbesondere fluoreszierende Lösungen, sollten gekühlt und in einem dunklen Kühlbehälter gelagert werden. Außerdem sollten sie kurz vor dem Gebrauch auf Raumtemperatur gebracht werden.
3. Entnahme von Gewebe
- Nachdem Sie Fliegen in reifenden Fläschchen erhalten haben, öffnen Sie das Ventil an der CO2 -Matte und kippen Sie die Fliegen schnell auf die Matte, um ein Entweichen zu vermeiden. Warten Sie, bis die Fliegen größtenteils bewusstlos werden und die meisten Bewegungen aufhören. Die Position fliegt unter dem Mikroskop SZ61, indem die Matte unter die Objektivlinse geschoben wird. Passen Sie Vergrößerung und Fokussierung so an, dass die Fliegen deutlich sichtbar sind und sich bequem enthaupten lassen.
HINWEIS: Die in diesem Beispiel verwendeten Fliegen sind ELAV/+ und ELAV>ApoE4 - Federschere zwischen Brustkorb und Kopf einführen, fest zusammendrücken und pro Versuchsgruppe 5 bis 10 Fliegenköpfe enthaupten. Geben Sie unbenutzte Fliegen in ihr alterndes Fläschchen zurück.
HINWEIS: Wenn Bedenken hinsichtlich des Eindringens des Fixiermittels bestehen, kann ein kleiner Schnitt am hinteren Teil des Kopfes durchgeführt werden, um eine erhöhte Penetration des Fixiermittels in Schritt 4.1 zu ermöglichen. - Legen Sie die Köpfe mit einem Pinsel vorsichtig in markierte 1,5-ml-Röhrchen auf Eis, bis die ELAV/+- und ELAV>ApoE4-Gruppen gesammelt wurden.
4. Fixierung des gesamten Gewebes
- Nehmen Sie die Röhrchen aus dem Eis und pipettieren Sie 100 μl 4%iges Paraformaldehyd in PBS-Lösung in jedes Röhrchen, wobei Sie darauf achten, dass alle Köpfe in die Lösung eingetaucht sind. Wenn die Köpfe an den Wänden des Rohrs haften und den Kontakt mit der Lösung vermeiden, drücken Sie sie mit einer Bürste vorsichtig nach unten oder klopfen Sie leicht gegen eine horizontale Fläche, um einen angemessenen Kontakt zu gewährleisten.
- Auf einen Orbitalschüttler bei mittlerer Stufe 15 Minuten stellen. Entsorgen Sie nach 15 Minuten die Paraformaldehyd-Lösung und ersetzen Sie sie 10 Minuten lang durch 1x PBS, wobei Sie darauf achten müssen, dass alle Köpfe in die Lösung eingetaucht sind.
- Verwerfen Sie jedes Mal die vorherige Lösung und waschen Sie das Tuch mit PBS 2x für jeweils 10 Minuten, also insgesamt 3 Wäschen.
- Übertragen Sie die Köpfe nach dem letzten Waschen in eine 10%ige Saccharose in PBS-Lösung und stellen Sie sicher, dass die Köpfe in das Röhrchen eingetaucht sind. Lassen Sie diese über Nacht stehen, um eine optimale Sättigung zu erzielen.
HINWEIS: Wenn eine Bildgebung am selben Tag gewünscht wird, kann die Saccharoseinfusion reduziert werden. Aber auch die kryoprotektiven Wirkungen werden proportional reduziert.
5. Vorbereitung der Form
- Füllen Sie eine beschriftete Form zu ca. 50 % mit der optimalen Schnitttemperatur (OCT)-Masse, damit sie sich auf alle 4 Ecken der Form verteilen kann.
- Legen Sie die Köpfe mit einem Pinsel vorsichtig auf die Oberfläche des OCT in der Form. Wenn Sie mehrere Versuchsgruppen in dieselbe Form einsetzen, stellen Sie sicher, dass diese Gruppen innerhalb der Form getrennt sind, um Verwechslungen zu vermeiden.
HINWEIS: Es ist wichtig, eine Verdünnung der OCT-Verbindung durch Kontamination mit der vorherigen Saccharoselösung über den Pinsel zu verhindern. Darüber hinaus kann das Platzieren tief in das OCT mit dem Pinsel viele Blasen um die Köpfe herum erzeugen. Vermeiden Sie diese Fehler, um spätere Probleme bei der Aufteilung zu vermeiden. - Schiebe mit der Spitze der Pinzette jeden Kopf langsam mit den Augen nach unten zum Boden der Form. Diese Ausrichtung wird für einen Schnitt durch die koronale Ebene gewählt.
- Vermeiden Sie es, die Köpfe während dieses Vorgangs gegen den Boden der Form zu stechen oder zu quetschen. Richten Sie alle Köpfe in den Dimensionen X, Y und Z so aus, dass jeder Abschnitt alle Motive gleichzeitig enthält. Sorgen Sie für ein langsames Eintauchen, um die Bildung von Luftblasen zu reduzieren.
- Sobald alle Köpfe richtig ausgerichtet sind, stellen Sie die Formen vorsichtig direkt auf -20 °C zum Einfrieren.
HINWEIS: Wenn festgestellt wird, dass die Ausrichtung der Köpfe während des Schneidens erheblich abweicht, sollten Sie die Verwendung von Trockeneis oder flüssigem Stickstoff für das anfängliche Schockgefrieren der Form in Betracht ziehen. - Sobald die Form größtenteils gefroren ist, füllen Sie den Rest mit OCT und lassen Sie sie einfrieren, bevor Sie sie langfristig bei - 80 °C lagern.
6. Kryosektion von Formen
HINWEIS: Es ist im Allgemeinen ratsam, eine Rohform vorzubereiten und zu schneiden, bevor Sie Formen der Versuchsgruppe schneiden. Auf diese Weise kann die ordnungsgemäße Funktion des Rades, der Klinge und des Rollschutzglases unmittelbar vor dem Schneiden des Gewebes sichergestellt werden.
- Befestigen Sie den Spannbohrer an der Form, indem Sie eine großzügige Menge OCT auf die Form auftragen und den Bohrer darauf legen und flach drücken. Lassen Sie diesen im Kryostaten vollständig einfrieren, in der Regel innerhalb von 5 min.
- Lösen Sie den Bohrer und den OCT-Block aus der Form und setzen Sie ihn in das Spannfutter ein, um sicherzustellen, dass die Form von oben nach unten richtig ausgerichtet bleibt. Ziehen Sie den Bohrschlüssel fest, bis der Bohrer fest sitzt.
- Richten Sie den Block mit den Einstellknöpfen und den Futtertiefenreglern mit der Klinge aus.
- Stellen Sie die Schnittbreite auf 20 μm ein. Schneiden Sie jede Scheibe mit langsamen, aber gleichmäßigen Bewegungen, sodass das Anti-Roll-Glas jede Scheibe erfassen kann. Erfassen Sie Abschnitte mit den erwärmten Folien, indem Sie die Folie an die nähere Kante des Schnitts berühren und den Abschnitt auf die Folie aufsteigen lassen. Bis zu acht Abschnitte können bei entsprechendem Abstand auf eine Schiene in Standardgröße (25 mm x 75 mm x 1 mm) passen.
HINWEIS: Bei der Auswahl der zu sammelnden Abschnitte ist eine Frage der Wahl. Infolge der Einbettungsorientierung werden frühere Schnitte vom vorderen und spätere Abschnitte von den hinteren Teilen des Kopfes sein. Wenn das Interesse also mehr auf einem bestimmten Bereich als auf einem anderen liegt, kann die Abschnittsauswahl entsprechend angepasst werden. Alternativ können alle Schnitte auf mehreren Objektträgern entnommen werden, bis kein Gewebe mehr übrig ist. - Lassen Sie die Objektträger mindestens 30 Minuten, jedoch nicht länger als 1 Stunde bei Raumtemperatur trocknen.
7. Färbung und IHC
HINWEIS: Für dieses Protokoll wird die IHC unter Verwendung eines unkonjugierten primären Antikörpers detailliert beschrieben. Fluorochrom-konjugierte Antikörper oder andere Fluoreszenzfärbungen, die in einer einzigen Stufe durchgeführt werden können, sollten zusammen mit dem Sekundärantikörper verwendet werden, wenn beide zusammen verwendet werden sollen.
- Unmittelbar nach der Trocknungsphase das OCT an den Rändern des Objektträgers mit einer Rasierklinge entfernen, dabei Platz für einen hydrophoben Rand lassen. Zeichnen Sie mit dem Marker einen hydrophoben Rand auf jede Folie. Lassen Sie dies 5 Minuten trocknen.
- Waschen Sie alle Objektträger 3 Mal für jeweils 5 Minuten mit PBS, indem Sie vorsichtig auf den Objektträger pipettieren und das Pipettieren direkt auf das Gewebe vermeiden, wenn möglich.
HINWEIS: Die 1000 μL Pipette ist hier am nützlichsten. Ein Objektträger in Standardgröße mit Gewebe sollte vollständig mit 750 μl einer beliebigen Lösung bedeckt sein. Es können auch Schiebegestelle und Schaufeln verwendet werden. - Nachdem die Objektträger gewaschen wurden, pipettieren Sie 3% BSA in TBS-Blockierungslösung auf die Objektträger. 30 Minuten inkubieren lassen.
- Verwerfen Sie die Blockierungslösung und pipettieren Sie die primäre Antikörperlösung auf die Objektträger. In diesem Fall wird eine Verdünnung von SC-13521 ApoE in 3 % BSA in TBS im Verhältnis 1:250 durchgeführt. Der Antikörper wird über Nacht bei 4 °C oder 1 Stunde bei Raumtemperatur inkubiert. Verwenden Sie feuchte Tücher oder Papiertücher, um zu verhindern, dass die Lösung über Nacht austrocknet.
- Entsorgen Sie den Primärantikörper und waschen Sie ihn mit der Pipette 3 Mal für jeweils 5 Minuten mit PBS.
- Fügen Sie die sekundäre Antikörperlösung hinzu. In diesem Fall eine Verdünnung von 1:500 AF 750 Goat Anti-Mouse zusätzlich zu einer Konzentration von 5 μg/ml Nilrot, alles in 3 % BSA in TBS. Lassen Sie es 1 Stunde lang bei Raumtemperatur inkubieren.
HINWEIS: Wir inkubieren gleichzeitig einen Fluoreszenzfärbemittel und einen Sekundärantikörper im selben Puffer, 3 % BSA bei TBS. Dies ist vorzuziehen, solange keine Konflikte zwischen den beiden Reagenzien bekannt sind. Wenn Konflikte bestehen, inkubieren Sie separat und führen Sie zwischen den Inkubationen weitere 3 Waschgänge durch. - Waschen Sie die Objektträger 3 Mal mit PBS für jeweils 5 Minuten. Lassen Sie nach der letzten Wäsche eine kleine Menge PBS auf dem Objektträger.
8. Montage und Vorbereitung für die Bildgebung
- Geben Sie mit einer 1000-μl-Pipette 3-5 Tropfen DAPI-haltiges Eindeckmedium (0,9 μg/ml) gleichmäßig über den Objektträger, um ein direktes Tropfen auf das Gewebe zu vermeiden.
- Legen Sie das Deckglas auf die Schiene und vermeiden Sie dabei die Bildung von Luftblasen.
HINWEIS: Die Verwendung einer Pinzette kann dabei helfen, indem das Deckglas nahe an die Oberfläche des Objektträgers gleitet, bevor es schließlich gelöst wird. - Gehen Sie vorsichtig mit frisch montierten Dias um und lagern Sie sie flach, bis sie vollständig getrocknet sind. Versiegeln Sie Objektträger mit Nagellack, wenn eine Langzeitlagerung vorgesehen ist.
- Nehmen Sie so schnell wie möglich Bilder auf, um Fluoreszenzzerfall zu vermeiden.
9. Bilderfassung
HINWEIS: Für die Bildaufnahme wird die Verwendung der Olympus Cell Sense Dimensions Software detailliert beschrieben.
- Überprüfen Sie vor der Bildgebung die Objektträger und wischen Sie sie mit 70%iger Ethanol-in-Wasser-Lösung ab. Wenn Dias unmittelbar nach der Montage abgebildet werden, seien Sie bei der Reinigung besonders vorsichtig, um das Deckglas nicht zu beschädigen. Lassen Sie die Oberflächen des Objektträgers und des Deckglases 5 Minuten trocknen, bevor Sie die Bildgebung aufnehmen.
- Wählen Sie jeden gewünschten Kanal für die Aufnahme aus, in diesem Fall die Kanäle für DAPI, Nilrot und AF 750.
- Wählen Sie die gewünschte Vergrößerung wie unten beschrieben aus. Die Wahl der Vergrößerung ist experimentierabhängig; Verwenden Sie hier eine 10-fache Vergrößerung.
HINWEIS: Alle Vergrößerungen sind verwendbar, auch Gläser auf Ölbasis. Falls gewünscht, Immersionsöl auf die Objektträgeroberfläche auftragen. - Kalibrieren Sie für jeden Kanal die richtigen Belichtungszeiten basierend auf den hellsten fluoreszierenden Probanden in einem Experiment. Vermeiden Sie eine Überbelichtung und erzeugen Sie gleichzeitig ein möglichst helles Bild.
HINWEIS: Im Allgemeinen sind die beiden Hauptdeterminanten einer schlechten Prozesserfassung eine Überbelichtung, die zum Verlust der Definition führt, und zu viel Hintergrundsignal, das schwer vom wahren Signal zu trennen ist. Darüber hinaus müssen die Belichtungen für jede verwendete Vergrößerung unabhängig voneinander eingestellt werden. - Wählen Sie im Menü den Ordner aus, in dem Sie die zusammengeführten Bilder speichern möchten, und benennen Sie sie. Nach der Aufnahme befinden sich alle Bilder in diesem Ordner und tragen den hier definierten Namen.
- Nehmen Sie Bilder auf, indem Sie zuerst auf ein Motiv im Kanal fokussieren, das den besten Fokuspunkt ermöglicht, und dann mit der Aufnahme beginnen. Behalten Sie das Verfahren bei, sich auf jedes Subjekt im selben Kanal zu konzentrieren, um die Konsistenz im gesamten Experiment zu gewährleisten.
- Erfassen Sie alle Versuchsgruppen, die für spätere Vergleiche am selben Tag verwendet wurden, um einen Fluoreszenzzerfall zwischen den verglichenen Gruppen zu vermeiden.
- Wählen Sie die gewünschte Vergrößerung wie unten beschrieben aus. Die Wahl der Vergrößerung ist experimentierabhängig; Verwenden Sie hier eine 10-fache Vergrößerung.
10. Quantifizierung
HINWEIS: Die Quantifizierung kann mit einer Vielzahl von Softwares durchgeführt werden. Hier wird auf die Verwendung von Olympus CellSense Dimensions verwiesen.
- Sehen Sie sich nach der Sammlung die Bilder an. Entfernen Sie Abschnitte, die Unvollkommenheiten oder Schnittartefakte aufweisen, aus dem Quantifizierungsordner. Wählen Sie Bilder aus, die das Ziel der Quantifizierung widerspiegeln. Beispiele für Unvollkommenheiten sind Blasen, zerrissene Abschnitte, überlappendes Gewebe sowie Staub oder Ablagerungen.
- Um geeignete Bilder auszuwählen, stellen Sie sicher, dass alle Bilder mit Hirngewebe für die Quantifizierung verwendet werden, um die Gesamtexpression im gesamten Gehirn widerzuspiegeln. Alternativ können Sie Bilder verwenden, die nur das Vorder-, Mittel- oder Hinterhirn widerspiegeln, um einen Einblick in die Unterschiede in der Expression in diesen Bereichen zu geben.
- Bestimmen Sie in den Menüs "Zählen" und "Messen" die Parameter, die für die Quantifizierung von Bildern relevant sind.
- Für die Quantifizierung der ApoE-Expression durch Vergleich der mittleren Intensitätswerte wählen Sie die Schwellenwerte so, dass alle Pixel für diesen Kanal berücksichtigt werden (0 unendlich). Darüber hinaus können Sie interessante Bereiche mit den verfügbaren Zeichenwerkzeugen umreißen.
- Führen Sie die Zählung und Messung entweder in einem Stapel für alle Dateien oder einzeln für jedes Bild aus.
- Notieren Sie für die Stapelverarbeitung die Einstellungen und die Ausführung der Quantifizierung und wählen Sie dann den Ordner aus, in dem die Quantifizierung durchgeführt werden soll. Die Verarbeitung in einem Stapel ist über die Registerkarte Makro-Manager zugänglich und beschleunigt den Arbeitsablauf erheblich.
- Exportieren Sie die Datentabelle in eine Tabelle, um sie zu plotten. Verwenden Sie dazu das Menü "Zähl- und Messergebnisse", während Sie eine Tabelle automatisch öffnen oder in eine Tabelle exportieren, wenn Sie in einem Stapel arbeiten. Diese Datentabellen enthalten alle ausgewählten Parameter, die in Schritt 10.2 ausgewählt wurden.
- Für statistische Analysen und Diagramme können Sie die Daten direkt in einer Tabellenkalkulation oder über eine andere Software darstellen. Die Vertrautheit mit der gewählten Software ist der Schlüssel zu einer genauen Darstellung der experimentellen Ergebnisse. Hier wurden die absoluten Intensitätswerte der ApoE-Expression im Gehirn der Mutante auf die Kontrolle normalisiert und dann mit Hilfe von GraphPad Prism aufgetragen.
Ergebnisse
Das oben beschriebene Verfahren ermöglicht die Fluoreszenzbildgebung von adulten Fliegengehirnen zuverlässig und ohne langwierige Dissektion. Die Methode, die in Abbildung 1 einfach dargestellt ist, ist unkompliziert und kann schnell durchgeführt werden, wenn alle Proben, Geräte und Materialien leicht verfügbar sind. Alternativ können die Proben bei einer Lagerung bei -80 °C während der OCT-Formphase für die Verwendung viele Wochen später aufbewahrt werden. Forscher müssen nicht lange geschult werden, um die einfachen Präparier- und Einbettungstechniken zu erlernen, was diese Methode recht zugänglich macht.
Beispiele für die Fluoreszenzmikroskopie, die mit dieser Methode durchgeführt wurde, sind in Abbildung 2A-D zu sehen. Die Expression sowohl des Antikörper-Tags (ApoE) als auch des Fluoreszenzflecks (Nilrot) ist gut definiert. Darüber hinaus ist auch die hohe Integrität des Hirngewebes zu sehen. Bilder können mit gängigen Funktionen von Bildverarbeitungssoftware wie z. B. Dekonvolution, die auch in Abbildung 2A'-D' dargestellt ist, weiter verdeutlicht werden. Die Entfaltung ist nützlich, um Schärfe und Kontrast zu verbessern und das Rauschen zu reduzieren.
Im Hinblick auf die Quantifizierung von Bildern können alle Bilder für Standardparameter wie Objektanzahl, mittlere Objektfläche, Intensität und Flächenanteil quantifiziert werden. Die Grenzen der Quantifizierung hängen wirklich von der Software der Wahl ab, aber im Allgemeinen ermöglichen die oben aufgeführten Parameter eine angemessene Untersuchung und sind in den meisten Anwendungen verfügbar. Abbildung 3 zeigt ein Histogramm, das aus mittleren Intensitätswerten innerhalb der Hirnregionen mehrerer Bilder generiert wurde. Dies dient dazu, die mittlere Gehirnintensität eines bestimmten Genotyps sichtbar zu machen. In diesem Fall ELAV/+ und ELAV>ApoE4.
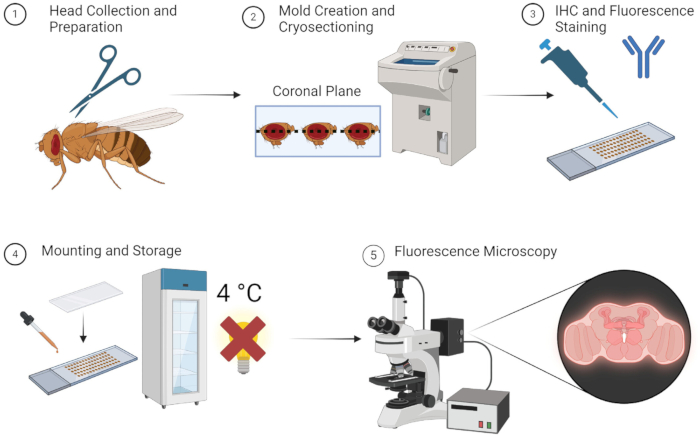
Abbildung 1: Arbeitsablauf für die Schnitte und Bildgebung des Drosophila-Gehirns. 1. Drosophila-Köpfe werden durch Enthauptung mit einer feinen Schere gesammelt. 2. Nach der Fixierung werden die entnommenen Köpfe mit OCT in eine Form eingebettet und kryogeschnitten, um dünne Hirnschnitte zu erhalten. 3. Die Hirnschnitte werden einer immunhistochemischen (IHC) Färbung mit Primärantikörpern oder einer Fluoreszenzfärbung unterzogen. 4. Nach dem Färben werden die Profile mit einem Deckglas versehen und bei 4 °C im Dunkeln gelagert, um die Fluoreszenzintegrität zu erhalten. 5. Die Hirnschnitte werden mit Hilfe der Fluoreszenzmikroskopie sichtbar gemacht, um die Zielproteine oder zellulären Strukturen zu untersuchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Immunhistochemie und Fluoreszenzfärbung von Kryosektionsköpfen. (A-D) Repräsentative Bilder von 7 Wochen alten weiblichen Fliegenköpfen, die auf ApoE-Expression, Lipide (Nilrot) und DAPI gefärbt wurden. Diese Bilder zeigen die Expression von humanem ApoE4 (Elav>ApoE4), während Kontrollfliegen Elav/+ diese ApoE-Expression nicht haben. Lipidfärbung mit Nilrot (Elav>ApoE4 und Elav/+). Die Integrität des Hirngewebes mit dieser Methode wird auch hier nachgewiesen. (A'-D') Diese repräsentieren die A, B, C und D nach der Dekonvolution. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Relative Quantifizierung von ApoE. Gezeigt werden die Ergebnisse der Quantifizierung der ApoE-Proteinexpression in 7 Wochen alten Drosophila-Gehirnen . Die absoluten Intensitätswerte wurden sowohl für Elav/+- als auch für Elav>ApoE4-mutierte Probanden erhoben und dann auf Elav/+ normiert. Die statistische Signifikanz zwischen Elav>ApoE4 und Elav/+ ist offensichtlich. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hier stellen wir ein Protokoll für die präzise Fluoreszenzbildgebung von kryosektionierten Drosophila-Köpfen vor. Dies ist ein unkomplizierter Ansatz, der mehrere wichtige Vorteile hat. Die Methoden sind nämlich so einfach, dass jeder mit einer grundlegenden Sicherheitsschulung im Labor sie absolvieren kann, sie sind anpassungsfähig, um die Expression jedes Proteins zu messen, für das hochwertige Antikörper existieren, und sie ermöglichen eine präzise Messung, sowohl wie viel ein Protein von Interesse exprimiert wird als auch wo diese Expression im Kopf stattfindet. Wenn die Gewebe- und Bildqualität hoch genug ist, könnte dies möglicherweise eine 3D-Kartierung der Expression im gesamten Drosophila-Kopf ermöglichen.
Im Gegensatz zu technisch anspruchsvollen Ansätzen, das Gehirn für die Bildgebung zu isolieren, kombiniert mit der konfokalen Mikroskopie, ermöglicht dieses Protokoll die Bildgebung im gesamten Drosophila-Kopf, nicht nur im Gehirn. Dies ist besonders wichtig, da das visuelle System der Fliege ein wichtiges Modell der neuronalen Funktionist 21, aber einige dieser Strukturen könnten während der Isolation des Gehirns verloren gehen. Es stellt auch Kontrollgewebe in Abschnitten, beispielsweise die Muskeln des Rüssels, zur Verfügung, um zu bestimmen, ob die Expression des interessierenden Proteins spezifisch für bestimmte Zelltypen oder Gewebetypen ist22. Dies ermöglicht einen direkten Vergleich zwischen Geweben, anstatt separate Abschnitte zu verwenden, die durch geringfügige Unterschiede in den Bedingungen beeinträchtigt werden könnten. Eine weitere Stärke dieses Protokolls und der Verwendung von Drosophila als Modellsystem besteht darin, dass die Fliegenköpfe sehr klein sind19,20, so dass eine relativ hochauflösende Fluoreszenzbildgebung durchgeführt werden kann. Wir haben es geschafft, über 50 Köpfe in einem einzigen Block unterzubringen. Mit 8 Abschnitten, die auf einer Folie in Industriestandardgröße platziert werden können, kann 1 Folie 8 einzigartige Abschnitte pro Fliege enthalten, was insgesamt 400 einzigartige Abschnitte ergibt. Wichtig ist, dass alle Sektionen den gleichen experimentellen Bedingungen und Zeitpunkten unterzogen werden, um eine hohe Integrität beim Vergleich zwischen den Gruppen zu erreichen. Darüber hinaus erfordert dieses Protokoll nur die Verwendung eines Standard-Fluoreszenzmikroskops anstelle eines konfokalen Mikroskops, was für Labore oder Institutionen, die nicht über eine hohe finanzielle Unterstützung verfügen und einen breiteren Zugang zu dieser Bildgebung ermöglichen, unerschwinglich sein kann.
Eine wesentliche Einschränkung dieses Protokolls, die der Immunfärbung inhärent ist, ist die Bedeutung der Verwendung hochwertiger Antikörper und geeigneter Kontrollen bei der Optimierung der Antikörper. Es ist wichtig zu überprüfen, ob die Antikörper selektiv und empfindlich auf das interessierende Protein reagieren, da es oft zu Off-Target-Färbungen kommt, die zu Schwierigkeiten bei der Feststellung führen können, ob das Fluoreszenzsignal echt ist. Testen Sie dazu sowohl den Primär- als auch den Sekundärantikörper. Glücklicherweise ist dies aufgrund der leicht verfügbaren genetischen Werkzeuge in Drosophila einfach. Um die Qualität des primären Antikörpers zu überprüfen, empfehlen wir, das Protokoll mit Wildtyp-Fliegen und Versuchsfliegen zusammen mit Positiv-Kontrollfliegen, die das Protein von Interesse überexprimieren, und Negativ-Kontrollfliegen, bei denen das Gen ausgeschaltet oder ausgeschaltet ist, durchzuführen. Diese Kontrollgruppen ermitteln den Bereich der Expressionsniveaus und der erwarteten Fluoreszenz und dienen als Referenzpunkte, um zu beurteilen, wo die experimentellen Fliegen innerhalb dieses Spektrums liegen. Es ist wichtig, mehrere Verdünnungen des Primärantikörpers zu testen, da zu wenig zu einer Färbung von schlechter Qualität führt, die nicht zu einer Fluoreszenz über dem Hintergrund führt, wo das Protein vorhanden ist, während zu viel Antikörper zu einer Off-Target-Färbung führt, bei der das Protein nicht vorhanden ist. Dieser Mehrfachverdünnungsansatz sollte eine Gruppe ohne primären Antikörper umfassen, die die Qualität des Sekundärantikörpers überprüft, da es in dieser Gruppe nur dann zu Fluoreszenz kommt, wenn Hintergrundfluoreszenz vorhanden ist, und eine zusätzliche negative Kontrollgruppe liefert, die die Grenzen der Fluoreszenzdetektion durch den Sekundärantikörper aufzeigt. Verwenden Sie bei Bedarf unterschiedliche Inkubationsbedingungen, d. h. Zeit oder Temperatur, um das Signal-Rausch-Verhältnis in Ihren endgültigen Bildern zu maximieren. Wir bekräftigen, dass hochwertige Antikörper zusammen mit hochwertigem Gewebe für eine qualitativ hochwertige Immunfluoreszenzbildgebung von entscheidender Bedeutung sind.
Insgesamt ist die Immunfluoreszenzbildgebung ein leistungsfähiges Werkzeug, um die Biologie im Allgemeinen und die Neurowissenschaften im Besonderen zu untersuchen. In Kombination mit den leistungsstarken genetischen Werkzeugen, die in Drosophila zur Verfügung stehen, hat dies das Potenzial, wichtige Erkenntnisse darüber zu gewinnen, wie Proteine Gesundheit und Krankheit beeinflussen. Das Fliegengehirn war nachweislich wichtig für die Entdeckung, wie das menschliche Gehirn funktioniert, und wird dies auch weiterhin tun. Aufgrund der Anpassungsfähigkeit des Protokolls, die wir hier beschreiben, kann die Rolle fast jedes Proteins (oder Lipids) im Kopf im Zusammenhang mit jeder Krankheit oder jedem Zustand untersucht werden, nur begrenzt durch die Qualität der Antikörper. Daher wird die Immunfluoreszenzbildgebung wahrscheinlich für die zukünftige Erforschung der Funktionsweise des Gehirns von entscheidender Bedeutung sein und einen erheblichen Einfluss auf die menschliche Gesundheit und die therapeutische Entwicklung haben.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir danken den Mitgliedern des Melkani-Labors für ihre Hilfe mit wertvollem Feedback bei der Entwicklung des Protokolls. Die Fliegenbestände Elav-Gal4 (BL#458) und UAS-ApoE4 (BL#76607) wurden vom Bloomington Drosophila Stock Center (Bloomington, IN, USA) bezogen. Diese Arbeit wurde durch Zuschüsse der National Institutes of Health (NIH) AG065992 und RF1NS133378 an G.C.M. unterstützt. Diese Arbeit wird auch von UAB Startup Funds 3123226 unterstützt und 3123227 an G.C.M.
Materialien
| Name | Company | Catalog Number | Comments |
| 1000 uL Pipette | Eppendorf | 3123000063 | |
| 1000 uL Pipette Tips | Olympus Plastics | 23-165R | |
| 10X Phosphate Buffered Saline (PBS) | Fisher | J62036.K7 | ph=7.4 |
| 200 Proof Ethanol | Decon Laboratories | 64-17-5 | |
| 20X Tris Buffered Saline | Thermo Scientific | J60877.K2 | pH=7.4 |
| AF750 Goat Anti-Mouse Secondary Antibody | Alexa Fluor | A21037 | |
| Anti-Roll Glass | IMEB | AR-14047742497 | |
| ApoE Mouse Primary Antibody | Santa Cruz | SC13521 | |
| Bovine Serum Albumin | Fisher | 9048-46-8 | |
| Centrifuge Tubes 1.5 mL | Fisher | 05-408-129 | |
| Charged Slides | Globe Scientific | 1415-15 | |
| Cryosectioning Molds | Fisher | 2363553 | |
| Cryostat | Leica | CM 3050 S | |
| Cryostat Blades | C.L. Sturkey | DT554N50 | |
| Distilled Water | |||
| Dry Ice | ??? | ??? | |
| Fine Forceps | Fine Science Tools | 11254-20 | |
| Fly Pad | Tritech Research | MINJ-DROS-FP | |
| Hardening mounting Media with Dapi | Vectashield | H-1800 | |
| Kimwipes | Kimtech | 34120 | |
| Microscope | Olympus | SZ61 | |
| Nile Red | Sigma | N3013 | |
| Optimal Cutting Temperature Compound | Fisher | 4585 | |
| Orbital Shaker | OHAUS | SHLD0415DG | |
| Paraformaldehyde 20% | Electron Microscopy Sciences | 15713 | |
| Razor Blades | Gravey | #40475 | |
| Spring Scissors | Fine Science Tools | 15000-10 | |
| Sucrose | Fisher | S5-500 |
Referenzen
- Fabbri-Destro, M., Rizzolatti, G. Mirror neurons and mirror systems in monkeys and humans. Physiology. 23, 171-179 (2008).
- Faust, T. E., Gunner, G., Schafer, D. P. Mechanisms governing activity-dependent synaptic pruning in the developing mammalian CNS. Nat Rev Neurosci. 22, 657-673 (2021).
- Roozendaal, B., McEwen, B. S., Chattarji, S. Stress, memory and the amygdala. Nat Rev Neurosci. 10, 423-433 (2009).
- Arber, S., Costa, R. M. Networking brainstem and basal ganglia circuits for movement. Nat Rev Neurosci. 23, 342-360 (2022).
- GBD 2019 Dementia Forecasting Collaborators. Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050: an analysis for the Global Burden of Disease Study 2019. Lancet Public Health. 7, e105-e125 (2022).
- Huang, Y., Li, Y., Pan, H., Han, L. Global, regional, and national burden of neurological disorders in 204 countries and territories worldwide. J Glob Health. 13, 04160 (2023).
- Crick, F. Central dogma of molecular biology. Nature. 227, 561-563 (1970).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9, 235-244 (2016).
- Hales, K. G., Korey, C. A., Larracuente, A. M., Roberts, D. M. Genetics on the Fly: A primer on the Drosophila model system. Genetics. 201, 815-842 (2015).
- Larkin, A., et al. FlyBase: updates to the Drosophila melanogaster knowledge base. Nucleic Acids Res. 49, D899-D907 (2021).
- Jeibmann, A., Paulus, W. Drosophila melanogaster as a model organism of brain diseases. Int J Mol Sci. 10, 407-440 (2009).
- Winding, M., et al. The connectome of an insect brain. Science. 379, eadd9330 (2023).
- Bargiello, T. A., Jackson, F. R., Young, M. W. Restoration of circadian behavioural rhythms by gene transfer in Drosophila. Nature. 312, 752-754 (1984).
- Zehring, W. A., et al. P-element transformation with period locus DNA restores rhythmicity to mutant, arrhythmic Drosophila melanogaster. Cell. 39, 369-376 (1984).
- Huang, R. C. The discoveries of molecular mechanisms for the circadian rhythm: The 2017 Nobel Prize in Physiology or Medicine. Biomed J. 41, 5-8 (2018).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. N Am J Med Sci. 4, 429-434 (2012).
- Ong, S. E., Foster, L. J., Mann, M. Mass spectrometric-based approaches in quantitative proteomics. Methods. 29, 124-130 (2003).
- Behnke, J. A., Ye, C., Moberg, K. H., Zheng, J. Q. A protocol to detect neurodegeneration in Drosophila melanogaster whole-brain mounts using advanced microscopy. STAR Protoc. 2, 100689 (2021).
- Moraes, R. C. M., et al. Apolipoprotein E induces lipid accumulation through Dgat2 that is prevented with time-restricted feeding in Drosophila. Genes. 15 (11), 1376 (2024).
- Roth, J. R., et al. Rapamycin reduces neuronal mutant huntingtin aggregation and ameliorates locomotor performance in Drosophila. Front Aging Neurosci. 15, 1223911 (2023).
- Currier, T. A., Pang, M. M., Clandinin, T. R. Visual processing in the fly, from photoreceptors to behavior. Genetics. 224, (2023).
- McKellar, C. E., Siwanowicz, I., Dickson, B. J., Simpson, J. H. Controlling motor neurons of every muscle for fly proboscis reaching. Elife. 9, (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten