Method Article
Выделение живых популяций миелоидных и эпителиальных клеток из легкого мыши
В этой статье
Резюме
В этом протоколе подробно описывается выделение живых иммунных и неиммунных популяций из легких мышей в стабильном состоянии и после гриппозной инфекции. Он также предоставляет стратегии гейтинга для идентификации субпопуляций эпителиальных и миелоидных клеток.
Аннотация
Легкие постоянно подвергаются воздействию патогенов и других вредных раздражителей окружающей среды, что делает его уязвимым к повреждениям, дисфункции и развитию заболеваний. Исследования с использованием мышиных моделей респираторных инфекций, аллергии, фиброза и рака сыграли решающую роль в выявлении механизмов прогрессирования заболевания и определении терапевтических мишеней. Тем не менее, большинство исследований, сосредоточенных на легких мышей, отдают приоритет выделению либо иммунных клеток, либо эпителиальных клеток, а не обеих популяций одновременно. В данной работе мы описываем метод получения комплексной суспензии одиночных клеток как иммунных, так и неиммунных популяций, пригодных для проточной цитометрии и сортировки клеток, активируемых флуоресценцией. Эти популяции включают эпителиальные клетки, эндотелиальные клетки, фибробласты и различные субпопуляции миелоидных клеток. Этот протокол влечет за собой бронхоальвеолярный лаваж и последующее раздувание легких с диспаузой. Затем легкие перевариваются в смеси либеразы. Этот метод обработки высвобождает множество различных типов клеток и приводит к получению суспензии одиночных клеток, которая не требует ручной диссоциации против фильтра, способствуя выживанию клеток и получая большое количество живых клеток для последующего анализа. В этом протоколе мы также определяем схемы стробирования для субпопуляций эпителиальных и миелоидных клеток как в наивных, так и в инфицированных гриппом легких. Одновременная изоляция живых иммунных и неиммунных клеток является ключом к исследованию межклеточных перекрестных помех и более глубокому пониманию биологии легких в здоровье и болезнях.
Введение
Легкое состоит из дыхательных путей, альвеол и интерстиция. Иммунные и неиммунные клетки находятся в этих компартментах, способствуя как гомеостатической функции легких (газообмену), так и защите организма от вредных факторов окружающей среды, таких как вирусная инфекция. Большие и малые дыхательные пути, или бронхи и бронхиолы, выстланы эпителиальными клетками. Преобладающими эпителиальными клетками в этих областях являются булавы и реснитчатые клетки, которые отвечают за секрецию защитных молекул и облегчение мукоцилиарного клиренса1. Альвеолы являются наиболее дистальными структурами в легких, выстланными двумя типами эпителиальных клеток: альвеолярными клетками I типа (ATI) и альвеолярными клетками II типа (ATII). ATI отвечают за газообмен, а ATII выделяют и перерабатывают поверхностно-активные вещества для обеспечения соответствующего поверхностного натяжения 2,3. ATII являются самообновляющимися и могут также дифференцироваться в ATI, что особенно актуально после повреждения легких4. Кроме того, ATII обеспечивают поддерживающую нишу для основного типа иммунных клеток, населяющих альвеолярную нишу, альвеолярных макрофагов (АМ)5,6. Помимо эпителия, фибробласты, эндотелиальные клетки и интерстициальные макрофаги (ИМ) (которые могут быть связаны как с нервами, так и с сосудами) составляют интерстиций 7,8,9,10. В ответ на инфекцию и повреждение многочисленные клетки легких погибают, а иммунные клетки, включая моноциты и нейтрофилы, проникают в ткань11,12. Моноциты, инфильтрирующие легкие, дифференцируются в макрофаги и могут вносить свой вклад в компартмент макрофагов в долгосрочной перспективе13.
Современные методы получения суспензий одиночных клеток из легкого мыши, как правило, основаны на коллагеназе и требуют физической диссоциации ткани14. Это может привести к низкому количеству жизнеспособных неиммунных клеточных популяций. Некоторые протоколы выделения эпителиальных клеток основаны на диспазе и позволяют получить более высокие доли живых эпителиальных клеток; Тем не менее, эти протоколы, как правило, не исследуют выход и жизнеспособность иммунных клеток 15,16,17. Проточная цитометрия является распространенным методом, используемым для различения клеточных популяций в переваренной ткани. На исходном уровне проточное цитометрическое стробирование для АМ, ИМ, моноцитов и нейтрофилов четко очерчено. Однако во время воспаления процесс гейтирования становится изменчивым и сложным для интерпретации из-за континуума экспрессии поверхностных маркеров инфильтрирующих моноцитов, дифференцирующихся в макрофаги. Таким образом, представленный здесь протокол также описывает стратегии гейтирования для идентификации популяций миелоидных клеток, представляющих интерес после инфицирования.
Надежная диссоциация эпителиальных и миелоидных клеток легких имеет важное значение для определения их гомеостатических и воспалительных функций. Метод параллельной изоляции этих клеточных компартментов позволит проводить последующий анализ ключевых типов клеток, которые поддерживают здоровье и вызывают заболевания. Схематический обзор рабочего процесса этого протокола можно найти на рисунке 1.
протокол
Этот протокол соответствует рекомендациям Комитета по институциональному уходу за животными и их использованию в Гарвардской медицинской школе (номера грантов: R35GM150816 и P30DK043351). Для экспериментов использовали самок мышей C57BL/6J в возрасте 8-12 недель. Этот протокол подходит и для самцов мышей. Подробная информация о реагентах и оборудовании, использованных в данном исследовании, представлена в Таблице материалов.
1. Подготовка материалов
- Разморозьте на льду необходимые ферменты, в том числе диспазу, либеразу и ДНК.
- Подготовьте другие необходимые реактивы. Наполните шприц объемом 10 мл 5 мл 2 мМ ЭДТА в DPBS и установите на него иглу 27 G. Наполните шприц объемом 1 мл DPBS и прикрепите катетер.
2. Забор легких
- Усыпите мышь путем внутрибрюшинного введения 400-500 мг/кг и 25-100 мг/кг смеси кетамина/ксилазина (в соответствии с утвержденными в учреждении протоколами). Приступайте к вскрытию, когда мышь перестает реагировать на защемление подушечки ноги (~5 минут).
Примечание: Смесь кетамина и ксилазина используется для эвтаназии вместо углекислого газа, чтобы предотвратить вызванное удушьем кровотечение и инфильтрацию иммунных клеток, которая может исказить результаты. - Опрыскайте мышь 70% этанолом. Препарируйте мышь с помощью тонких хирургических ножниц и щипцов #7. Сделайте надрез в области живота с помощью ножниц и разрежьте сбоку через брюшину.
- Сделайте небольшой надрез в диафрагме, чтобы выпустить вакуум. Вырежьте диафрагму и нижнюю грудную клетку из полости тела, чтобы обнажить легкие и сердце.
- Перфузируют легкие 5 мл 2 мМ ЭДТА в DPBS в шприц объемом 10 мл с иглой 27 G. Перфузия выполняется путем введения иглой в основание сердца, направленной справа в левый желудочек, и медленного дозирования жидкости из шприца18.
ПРИМЕЧАНИЕ: Перфузия должна выполняться медленно, чтобы предотвратить разрыв сосудистой системы. - Вскройте грудную клетку на грудине, отрезав боковые стороны грудной клетки, затем разрежьте вертикально через грудину, чтобы обнажить трахею19. Отрежьте как можно больше мышц и соединительной ткани с помощью тонких ножниц и щипцов #7, не прокалывая трахею или легкие.
- Оберните трахею швом (размер 2-0) как бы перевязывайте ее, но не затягивая. Процедите трахею латерально и вставьте катетер. Плотно закрепите шов вокруг катетера, плотно натянув шовный материал. Не вводите катетер более чем на 1 см в легкое.
- Накачайте легкие 1 мл DPBS. Извлеките DPBS, медленно потянув за шприц. Повторно накачайте легкие тем же DPBS и еще раз оттяните шприц для сбора бронхоальвеолярного лаважа жидкости (BALF).
- Отсоедините шприц от катетера, оставив катетер вставленным. Выдавите BALF в микроцентрифужную пробирку.
- Наполните тот же шприц объемом 1 мл 1 мл жидкостью и снова приложите его к катетеру. Дозируйте шприц для надувания легких с диспажем. Во время удаления катетера затяните шов вокруг трахеи, чтобы предотвратить вытекание отхождения.
- Разрежьте трахею сбоку. Удалите легкие из полости тела, разрезав соединительную ткань вдоль задней части грудной клетки, при этом с помощью щипцов вытяните легкие и трахею вверх.
- Удалите сердце из легких. Поместите легкие в 5 мл DPBS на лед.
- На этом этапе возьмите отделенный BALF и отжимайте при 400 x g в течение 5 минут при 4 °C. Надосадочная жидкость может быть аликвотирована и сохранена по мере необходимости. Должна быть видимая клеточная гранула, которую можно ресуспендировать в 100 мкл RPMI.
ПРИМЕЧАНИЕ: Можно подождать до 2 часов, чтобы приступить к пищеварению, что позволяет собирать несколько мышей одновременно.
3. Переваривание легких
- Приготовьте смесь для дайджеста. Добавьте 83 мкг/мл либеразы (50 мкл стокового раствора) и 100 мкг/мл ДНКазы (15 мкл стокового раствора) в 3 мл RPMI на легкое.
- Рассеките пять долей легких и отбросьте всю соединительную ткань19,20. Разрубите легкое ножницами в течение 1 минуты на предметном стекле.
- Переложите измельченное легкое в центрифужную пробирку объемом 50 мл с помощью ножниц для препарирования. Добавьте гранулу ячейки, извлеченную из BALF и ресуспендированную в RPMI, в центрифужную трубку. Добавьте 3 мл смеси для дигеста в пробирку с образцом с помощью серологической пипетки объемом 5 мл.
- Пипеткой переваривайте легкую смесь вверх и вниз 2-3 раза. Поместите при температуре 37 °C в орбитальный шейкер со скоростью 140 об/мин с метантеночными трубками, расположенными под углом 45 градусов, на 40 минут.
4. Приготовление одноклеточной суспензии
- Извлеките пробирки центрифуги объемом 50 мл из орбитального шейкера и положите их на лед. Пипеткой переваривайте легкую смесь вверх и вниз 5-6 раз. Отфильтруйте через сетчатый фильтр 70 μм в новую пробирку объемом 50 мл. Промойте все оставшиеся клетки через фильтр и нейтрализуйте ферменты 10 мл 5% FBS в RPMI.
- Отжим 5 мин при 4 °C при 600 x g. Отсасывайте надосадочную жидкость с помощью вакуумного аспиратора или пипетки. Ресуспендировать в 1 мл буфера для лизиса ACK и инкубировать в течение 3 мин при комнатной температуре для лизиса эритроцитов (эритроцитов). Добавьте 9 мл PBS и проводите пипеткой вверх и вниз.
- Отжим в течение 5 минут при 4 °C при 600 x g. Аспират надосадочная жидкость с помощью вакуумного аспиратора или пипетки. Ресуспендируйте в 1 мл буфера FACS (1% FBS в PBS) и отфильтруйте через меш 64 мкм в микроцентрифужную пробирку с помощью пипетки p1000.
5. Проточная цитометрия и последующие анализы
- При выполнении проточной цитометрии или флуоресцентно-активируемой сортировки клеток в 96-луночном планшете окрашивайте примерно 1-2 миллиона клеток на лунку, или 8% фракцию легочной суспензии.
- Вращаем ячейки вниз. Все вращения в 96-луночном планшете должны выполняться в течение 2,5 мин (4 °C) при 600 x g. Стряхните надосадочную жидкость и промойте ячейки один раз, повторно суспендируя 200 мкл DPBS. Вращайте вниз и проведите пальцем.
- Если клетки необходимо окрашивать для анализа проточной цитометрии, следует выполнить следующую процедуру окрашивания.
- Ресуспендировать клетки в живых/мертвых Zombie stain (1:150) и блоке Fc (1:250) в 25 мкл DPBS на 10 мин при комнатной температуре в темноте.
- Приготовьте смесь для окрашивания антител в 2-кратной концентрации в буфере FACS.
ПРИМЕЧАНИЕ: Окрашивающая смесь должна включать в себя все маркеры миелоидной панели (Таблица 1) или эпителиальной панели (Таблица 2) в их указанных концентрациях. - Добавьте 25 μл красящей смеси к 25 μл легочной суспензии в тарелке и выдерживайте на льду в течение 30 минут в темноте. Общий объем окрашивания теперь должен составлять 50 мкл, а концентрация первичных антител должна составлять 1x красящую.
- Добавьте 150 μL буфера FACS, уменьшите в течение 2,5 минут при 4 °C при 600 x g и стряхните надосадочную жидкость. Дважды промойте в 200 мкл буфера FACS.
- Если требуется внутриклеточное окрашивание, зафиксируйте клетки с помощью набора для внутриклеточной фиксации. Если внутриклеточное окрашивание не требуется, клетки могут быть зафиксированы в течение 20 мин в 4% PFA в DPBS.
- Смойте фиксатор 200 мкл буфера FACS три раза. Образцы могут храниться в ресуспендированном виде в 200 мкл буфера FACS при температуре 4 °C в темноте в течение 2-3 дней. Перед запуском образцов можно добавить счетные бусины для количественной оценки номеров ячеек.
- Если клетки необходимо отсортировать, проведите следующую процедуру окрашивания.
- Ресуспендируйте клетки в 1x окрашивающей смеси антител с Fc-блоком (1:250). Выдерживать 30 минут на льду в темноте.
- Добавьте 150 μL буфера FACS, уменьшите в течение 2,5 минут при 4 °C при 600 x g и стряхните надосадочную жидкость. Перед сортировкой трижды промойте 200 мкл буфера FACS и повторно суспендируйте в 200 мкл буфера FACS.
ПРИМЕЧАНИЕ: Перед сортировкой рекомендуется добавлять в клетки краситель жизнеспособности, такой как DAPI.
Результаты
В результате успешного переваривания получается примерно 20-25 миллионов клеток с жизнеспособностью 90-95%. Если примерно 25 000 счетных бусин добавляются к 8% легкого, бусины должны поставить под угрозу 1-3% собранных событий. После гейтирования на синглетах примерно 90%-95% клеток должны быть Zombie Aqua отрицательными (что указывает на жизнеспособность) (Рисунок 2А, Рисунок 3А).
Из CD45+ клеток CD64+F4/80+ клетки определяются как макрофаги (рис. 2B). На исходном уровне 80-90% всех макрофагов в легких определяются как АМ (Siglec-F+CD11c+), а остальные могут быть классифицированы как ИМ (Siglec-F-CD11c-) (рис. 2C). Однако во время инфекции и воспаления это определение смещается, и IM-гейтинг будет содержать моноцитарные макрофаги (moMacs) в дополнение к IM (Siglec-F-CD11clo/hi). Кроме того, это соотношение смещается примерно до 4% AM и 90% IMs/moMac через 9 дней после заражения (dpi) (рис. 2C).
Клетки, которые относятся к CD64-F4/80+, могут быть дополнительно гейтированы Siglec-F и Ly6C. Клетки Siglec-F+ являются эозинофилами (рис. 2D). Клетки Ly6C+Siglec-F-CD11b+ могут быть идентифицированы как моноциты (рис. 2D). Клетки, отрицательные как на CD64, так и на F4/80 (рис. 2B), могут быть дополнительно гейтированы как CD11b+Ly6G+ для идентификации нейтрофилов (рис. 2E).
Чтобы открыть эпителиальные клетки, сначала должны быть выведены CD45+ клетки (рис. 3). Затем можно идентифицировать эндотелиальные клетки (CD31+) и фибробласты (Pdgfra+) (рисунок 3B). Впоследствии CD31-Pdgfra-клетки, которые являются EpCAM+, идентифицируются как эпителиальные клетки (рис. 3C). Эпителиальные клетки могут быть дополнительно подразделены на ATII (MHC-II+CD104-), клетки дыхательных путей (клубовые и реснитчатые клетки) (CD104+) и другие эпителиальные клетки (MHC-II-CD104-) (рисунок 3D). Доля клеток ATII уменьшается во время инфекции.
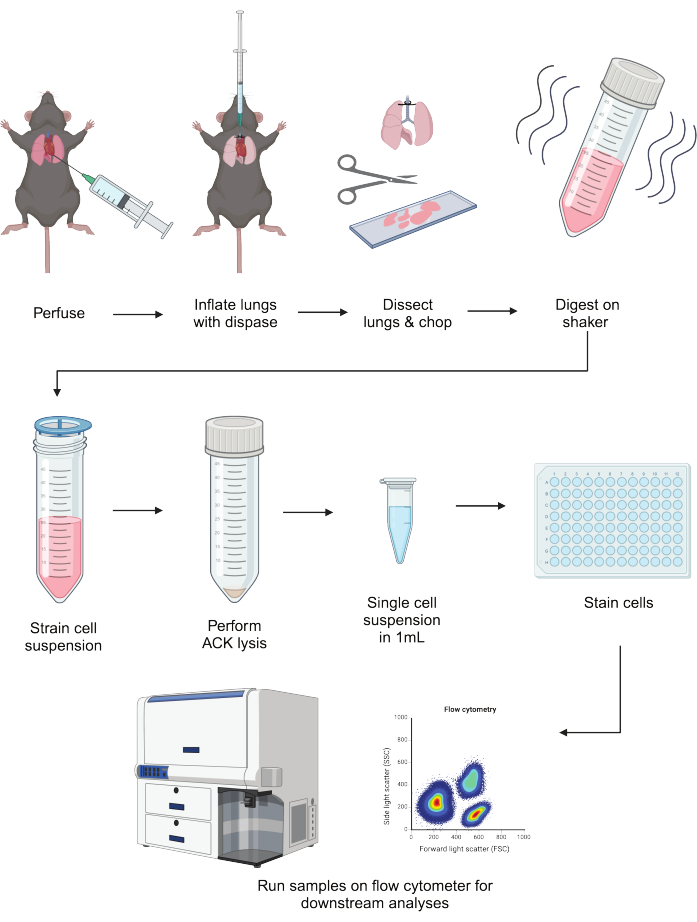
Рисунок 1: Схематическое изображение протокола. Легкие мышей перфузируют, надувают с помощью диспа и препарируют. После измельчения их переваривают в смеси либераза/ДНК с встряхиванием в течение 40 минут. Дигесты пропускаются через клеточное ситечко, а эритроциты лизируются. После ресуспендирования в буфере FACS клетки могут быть покрыты и окрашены перед последующим применением, включая проточную цитометрию. Эта фигура была создана с помощью BioRender. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Стратегия гейтирования миелоидных клеток. Репрезентативное гейтирование анализов проточной цитометрии легких мышей, которые не инфицированы, через 9 дней или 14 дней после инфицирования (dpi) гриппом A/Puerto Rico/8/34 (H1N1). (А) Гейтирование живых CD45+ клеток. (B) CD45+ клетки гейтируют CD64 с помощью F4/80. (C) CD64+F4/80+ клетки (макрофаги), гейтированные в AM и IMs/moMacs с использованием Siglec-F с помощью CD11c. (D) CD64-F4/80+ клетки, гейтированные в эозинофилы и моноциты. (E) CD64-F4/80-клетки, гейтированные для идентификации нейтрофилов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
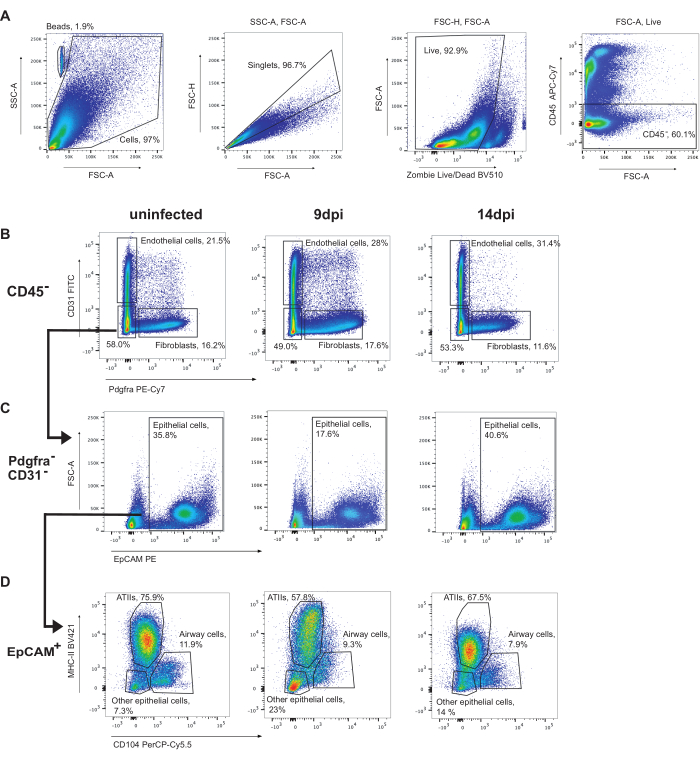
Рисунок 3: Стратегия гейтирования эпителиальных клеток. Репрезентативное гейтирование анализов проточной цитометрии неинфицированных легких мышей с разрешением 9 точек на дюйм или 14 точек на дюйм с гриппом A/Puerto Rico/8/34 (H1N1). (А) Гейтирование живых CD45-клеток. (B) CD45-клетки, сгубированные на CD31 (эндотелиальные клетки) с помощью Pdgfra (фибробласты). (C) CD31-Pdgfra-EpCAM+ клетки являются эпителиальными клетками. (D) Гейтирование эпителиальных клеток MHC-II по CD104 идентифицирует ATII (MHC-II+, CD104-), эпителиальные клетки дыхательных путей (включая реснитчатые и клубные клетки) (CD104+) и другие эпителиальные клетки (MHC-II-CD104-). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Антитело | Флуорофор | Концентрация окрашивания | Клон |
| антимышиный CD11c | АФ-488 | 1:300 | Н418 |
| антимышь CD170 (Siglec-F) | ПЭ | 1:200 | 1РНМ44Н |
| антимышь CD45 | БВ711 | 1:200 | 30-F11 |
| антимышиный CD64 (FcγRI) | БТР | 1:200 | Х54-5/7.1 |
| антимышь F4/80 | PE/Cy7 | 1:100 | БМ8 |
| антимышиный Ly-6C | БВ605 | 1:500 | HK1.4 |
| антимышиный Ly-6G | ПерХФГ/Цианин5.5 | 1:300 | 1А8 |
| антимышиный/человеческий CD11b | БВ421 | 1:800 | М1/70 |
| Живое/мертвое пятно | БВ510 | 1:150 | н.а. |
Таблица 1: Индекс антител к миелоидной панели. Антитела, используемые для стратегии миелоидного гейтирования.
| Антитело | Флуорофор | Концентрация окрашивания | Клон |
| антимышь CD104 | ПерХФГ/Цианин5.5 | 1:200 | 346-11А |
| антимышиный CD140a (Pdgfra) | ПЭ/Цианин7 | 1:200 | АПА5 |
| антимышь CD31 | ФИТК | 1:200 | 390 |
| антимышь CD326 (Ep-CAM) | ПЭ | 1:200 | Г8.8 |
| антимышь CD45 | БТР/Цианин7 | 1:200 | 30-F11 |
| антимышиный I-A/I-E (MHC-II) | БВ421 | 1:400 | М5/114.15.2 |
| Живое/мертвое пятно | БВ510 | 1:150 | н.а. |
Таблица 2: Индекс антител для эпителиальной панели. Антитела, используемые для стратегии эпителиального гейтирования.
Обсуждение
Этот протокол описывает процесс переваривания легких мыши, который выделяет примерно 20-25 миллионов клеток на мышь с жизнеспособностью 90-95%. Кроме того, он позволяет собирать BALF для дальнейшего анализа. Полученная клеточная суспензия совместима с различными лабораторными методами, включая проточную цитометрию и флуоресцентно-активируемую сортировку клеток для выделения клеток для секвенирования или культивирования клеток. Кратковременно, после перфузии, БАЛЬФ собирают, и надувают легкие с диспажем. Затем легкие измельчают и переваривают в растворе либеразы/ДНКазы. После лизиса и фильтрации можно приступать к последующим применениям, включая анализ проточной цитометрии миелоидных и эпителиальных субпопуляций при вирусной инфекции гриппа.
Если BALF не может быть извлечен и/или легкие не остаются должным образом надутыми, это может быть связано с неправильной установкой катетера. Если катетер будет размещен слишком глубоко в трахее/бронхах, он может прорвать ткань в брюшину. Это приведет к отсутствию накачивания и невозможности извлечения BALF. Если легкие раздулись, но жидкость не может быть вытянута из одной или нескольких долей легкого, это может быть связано с тем, что катетер направлен в один бронх. Вытягивание катетера немного дальше должно решить эту проблему. Требуется достаточная перфузия для устранения контаминации циркулирующих иммунных клеток21. При сильно поврежденных легких кровоизлияния и снижение целостности барьера могут сделать альвеолы более восприимчивыми к разрыву под давлением перфузии22. Поэтому крайне важно проводить перфузию мышам с поврежденными легкими очень медленно.
Ниже приведены некоторые рекомендации по передовым методам окрашивания проточной цитометрией. Что касается миелоидного гейтинга, если популяция Siglec-F+CD11c- присутствует в макрофагальных воротах (CD45+CD64+F4/80+), это, вероятно, контаминация эозинофилами. Мы обнаружили, что эозинофилы являются аутофлуоресцентными как в каналах PE, так и в каналах BV605, поэтому крайне важно избегать использования антител CD64, конъюгированных с этими флуорофорами. Кроме того, хотя этот метод расщепления может изолировать живые лимфоциты, многие поверхностные маркеры, специфичные для лимфоцитов, такие как CD4 и CD8, расщепляются в процессе. В результате этот протокол не подходит для анализа популяций Т-клеток методом проточной цитометрии. В таких случаях подход, основанный на коллагеназе, может быть более эффективной альтернативой 23,24.
Существует множество экспериментальных вопросов, требующих анализа как иммунных, так и неиммунных фракций от одной мыши25,26. Например, при изучении взаимодействий между различными типами клеток крайне важно собирать и анализировать популяции внутри одной мыши, чтобы свести к минимуму потенциальные артефакты, которые могут возникнуть из-за биологической изменчивости между отдельными животными. Кроме того, сравнение популяций иммунных и неиммунных клеток из одного и того же микроокружения позволяет получить более полное представление о динамике тканей и их роли как в поддержании гомеостаза, так и в управлении патологическими процессами.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была частично поддержана грантами Национальных институтов здравоохранения (R35GM150816 и P30DK043351), Фонда Чарльза Х. Худа и Гарвардского института стволовых клеток. Мы благодарим Александра Манна и всех других сотрудников лаборатории Франклина за их помощь и советы в разработке и совершенствовании схем и анализов проточной цитометрии. Мы также благодарим Ядро проточной цитометрии иммунологии в Гарвардской медицинской школе. Анализ проточной цитометрии проводили с помощью FlowJo. Схемы фигур были созданы с помощью BioRender.
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL syringe with Slip Tip | VWR | BD309659 | |
| 1.7 mL microcentrifuge tube | DOT Scientific | RN1700-GMT | |
| 10 mL pipettes (disposable) | Fisher Scientific | 12-567-603 | |
| 10 mL Syringe with BD Luer-Lok Tip | VWR | 75846-756 | |
| 123 count eBeads Counting Beads | Thermo Scientific | 01-1234-42 | |
| 12-channel pipette (30-300ul) | USA Scientific | 7112-3300 | |
| 16% paraformaldehyde | VWR | 100503-917 | |
| 23 G needle with regular bevel | VWR | 305194 | |
| 27 G needle with regular bevel | VWR | BD305109 | |
| 5 mL pipettes (disposable) | Thermo Fisher Scientific | 170373 | |
| 50 mL centrifuge tubes | Olympus | 28-108 | |
| 96-well round bottom plate | Corning | 3797 | |
| ACK lysing buffer | Gibco | A100492-01 | |
| Alexa Fluor 488 anti-mouse CD11c | BioLegend | 117311 | |
| Anti-F4/80 Rat Monoclonal Antibody (PE (Phycoerythrin)/Cy7) | BioLegend | 123114 | |
| APC anti-mouse CD64 (FcγRI) | BioLegend | 139306 | |
| APC/Cyanine7 anti-mouse CD45 | BioLegend | 103115 | |
| BD Insyte Autoguard Shielded IV Catheters | VWR | 381423 | |
| Brilliant Violet 421 anti-mouse I-A/I-E (MHC-II) | BioLegend | 107632 | |
| Brilliant Violet 421 anti-mouse/human CD11b | BioLegend | 101235 | |
| Brilliant Violet 605 anti-mouse Ly-6C | BioLegend | 128036 | |
| Brilliant Violet 711 anti-mouse CD45 | BioLegend | 103147 | |
| C57BL/6J mice | Jackson Laboratories | ||
| Cd140a (PDGFRA) Monoclonal Antibody (APA5), PE-Cyanine7, eBioscience | Life Technologies | 25-1401-82 | |
| CD170 (Siglec F) Monoclonal Antibody (1RNM44N), PE | Life Technologies | 12170280 | |
| Cell strainers | Corning | 352350 | |
| Centrifuge | Eppenodorf | Centrifuge 5910R | |
| Deoxyribonuclease I from bovine pancreas (DNase) | Millipore Sigma | DN25-100MG | Reconstituted at 20 mg/mL in DPBS as stock solution stored at -20 °C |
| Dispase | VWR | 76176-668 | Thawed once and stored as 1mL aliquots at -20 °C |
| Dissection forceps (Dumont #7) | Fine Science Tools | 11297-00 | |
| Dissection scissors | Fine Science Tools | 14060-09 | |
| DPBS | Thermo Fisher Scientific | 14190250 | |
| eBioscience fixation kit | Life Technologies | 00-5523-00 | |
| EDTA | Life Technologies | AM9260G | |
| Ethanol | VWR | TX89125170HU | |
| FBS | GeminiBio | 100-106 | Thawed once and heat-inactivated before long-term storage as aliquots at -20 °C |
| FITC anti-mouse CD31 Antibody | BioLegend | 102406 | |
| Gibco RPMI 1640 Medium | Fisher Scientific | 11-875-093 | |
| Glass slides | Fisher Scientific | 12-552-3 | |
| graduated reservoir | USA Scientific | 1930-2235 | |
| Ice bucket | Corning | 432128 | |
| Ketamine hydrocholoride injection (100 mg/mL) | Dechra | Ketamine and xyalazine euthanization mixture can be kept at 30 mg/mL ketamine hydrochloride and 4.5mg/mL xylazine in sterile DPBS for up to one month. | |
| Liberase | Millipore Sigma | 5401119001 | Reconstituted at 5 mg/mL in DPBS as stock solution stored at -20 °C |
| Lids for 96-well plates | Fisher Scientific | 07-201-731 | |
| Orbital Incubator Shaker | Barnstead Lab-Line | SHKE4000 | |
| p1000 pipette | Eppenodorf | 3123000063 | |
| p1000 tips | USA Scientific | 1122-1830 | |
| p200 pipette | Eppenodorf | 3123000055 | |
| p200 tips | USA Scientific | 1110-1700 | |
| PE anti-mouse CD326 (Ep-CAM) | BioLegend | 118206 | |
| PerCP/Cyanine5.5 anti-mouse CD104 Antibody | BioLegend | 123614 | |
| PerCP/Cyanine5.5 anti-mouse Ly-6G | BioLegend | 127616 | |
| Pipet-Aid | Drummond | 4-000-101 | |
| Purified anti-mouse CD16/32 | BioLegend | 101302 | Referred to as "Fc block" in text |
| Spray bottle | VWR | 23609-182 | |
| Suture (Size 2-0) | VWR | 100190-026 | |
| Underpads | VWR | 56617-014 | |
| Xysed (xylazine 100mg/mL) | Pivetal | See ketamine hydrocholoride notes above. | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
Ссылки
- Wanner, A., Salathé, M., O'Riordan, T. G. Mucociliary clearance in the airways. Am J Respir Crit Care Med. 154 (6), 1868-1902 (1996).
- Mason, R. J., Williams, M. C. Type II alveolar cell. Defender of the alveolus. Am Rev Respir Dis. 115 (1), 81-91 (1977).
- Fehrenbach, H. Alveolar epithelial type II cell: defender of the alveolus revisited. Respir Res. 2 (1), 33-46 (2001).
- Basil, M. C., Alysandratos, K. -. D., Kotton, D. N., Morrisey, E. E. Lung repair and regeneration: Advanced models and insights into human disease. Cell Stem Cell. 31 (4), 439-454 (2024).
- Hussell, T., Bell, T. J. Alveolar macrophages: plasticity in a tissue-specific context. Nat Rev Immunol. 14 (2), 81-93 (2014).
- Gschwend, J., et al. Alveolar macrophages rely on GM-CSF from alveolar epithelial type 2 cells before and after birth. J Exp Med. 218 (1), e20210745 (2021).
- Gillich, A., et al. Capillary cell-type specialization in the alveolus. Nature. 586 (7831), 785-789 (2020).
- Schyns, J., et al. Non-classical tissue monocytes and two functionally distinct populations of interstitial macrophages populate the mouse lung. Nat Commun. 10 (1), 3964 (2019).
- Chakarov, S., et al. Two distinct interstitial macrophage populations coexist across tissues in specific subtissular niches. Science. 363 (6432), eaat3773 (2019).
- Tsukui, T., et al. Collagen-producing lung cell atlas identifies multiple subsets with distinct localization and relevance to fibrosis. Nat Commun. 11 (1), 1920 (1920).
- Aegerter, H., et al. Influenza-induced monocyte-derived alveolar macrophages confer prolonged antibacterial protection. Nat Immunol. 21 (2), 145-157 (2020).
- Johansson, C., Kirsebom, F. C. M. Neutrophils in respiratory viral infections. Mucosal Immunol. 14 (4), 815-827 (2021).
- Li, F., et al. Monocyte-derived alveolar macrophages autonomously determine severe outcome of respiratory viral infection. Sci Immunol. 7 (71), eabj5761 (2022).
- Moll, H. P., et al. Orthotopic transplantation of syngeneic lung adenocarcinoma cells to study PD-L1 expression. J Vis Exp. (143), e58101 (2019).
- Warshamana, G. S., Corti, M., Brody, A. R. TNF-α, PDGF, TGF-β1 expression by primary mouse bronchiolar-alveolar epithelial and mesenchymal cells: TNF-α induces TGF-β1. Exp Mol Pathol. 71 (1), 13-33 (2001).
- Corti, M., Brody, A. R., Harrison, J. H. Isolation and primary culture of murine alveolar type II cells. Am J Respir Cell Mol Biol. 14 (3), 309-315 (1996).
- Quantius, J., et al. Influenza virus infects epithelial stem/progenitor cells of the distal lung: Impact on Fgfr2b-driven epithelial repair. PLoS Pathog. 12 (5), e1005544 (2016).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. BIO Protoc. 11 (8), e3988 (2021).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Bijgaart, R. J. E., van den Kong, N., Maynard, C., Plaks, V. Ex vivo live imaging of lung metastasis and their microenvironment. J Vis Exp. (108), e53741 (2016).
- Shi, W., et al. Isolation and purification of immune cells from the liver. Int Immunopharmacol. 85, 106632 (2020).
- Short, K. R., et al. Influenza virus damages the alveolar barrier by disrupting epithelial cell tight junctions. Eur Respir J. 47 (3), 954-966 (2016).
- Laidlaw, B. J., et al. CD4+ T cell help guides formation of CD103+ lung-resident memory CD8+ T cells during influenza viral infection. Immunity. 41 (4), 633-645 (2014).
- D'Agostino, M. R., et al. Protocol for isolation and characterization of lung tissue-resident memory T cells and airway-trained innate immunity after intranasal vaccination in mice. STAR Protoc. 3 (2), 101652 (2022).
- Waal, A. M., de Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Bhattacharya, J., Westphalen, K. Macrophage-epithelial interactions in pulmonary alveoli. Semin Immunopathol. 38 (4), 461-469 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены