Method Article
从小鼠肺中分离活髓细胞和上皮细胞群
摘要
该方案详细说明了在稳态下和流感感染后从小鼠肺中分离活免疫和非免疫种群。它还提供了用于识别上皮细胞和骨髓细胞亚群的门控策略。
摘要
肺持续暴露在病原体和其他有害环境刺激下,使其容易受到损伤、功能障碍和疾病的发展。利用呼吸道感染、过敏、纤维化和癌症的小鼠模型的研究对于揭示疾病进展的机制和确定治疗靶点至关重要。然而,大多数专注于小鼠肺的研究优先考虑免疫细胞或上皮细胞的分离,而不是同时分离这两个群体。在这里,我们描述了一种制备适用于流式细胞术和荧光激活细胞分选的免疫和非免疫群体的综合单细胞悬液的方法。这些群体包括上皮细胞、内皮细胞、成纤维细胞和各种髓系细胞亚群。该方案需要支气管肺泡灌洗和随后的分散酶肺充气。然后在 liberase 混合物中消化肺。这种处理方法可以释放各种不同的细胞类型,并产生单细胞悬液,无需在过滤器上手动解离,促进细胞存活并产生大量活细胞用于下游分析。在该协议中,我们还定义了幼稚和流感感染肺中上皮细胞和骨髓细胞亚群的门控方案。同时分离活免疫和非免疫细胞是研究细胞间串扰和更深入地了解健康和疾病中肺部生物学的关键。
引言
肺由气道、肺泡和间质组成。免疫和非免疫细胞驻留在这些隔室中,有助于稳态肺功能(气体交换)和宿主对环境损伤(如病毒感染)的防御。大气道和小气道,或支气管和细支气管,由上皮细胞排列。这些区域的主要上皮细胞是棒状细胞和纤毛细胞,它们负责分泌保护性分子并促进粘膜纤毛清除1。肺泡是肺部最远端的结构,由两种上皮细胞类型组成,即肺泡 I 型细胞 (ATI) 和肺泡 II 型细胞 (ATII)。ATI 负责气体交换,ATII 分泌和回收表面活性剂以确保适当的表面张力 2,3。ATII 是自我更新的,也可以分化为 ATI,这种作用在肺损伤后尤其重要4。此外,ATII 为填充肺泡生态位的主要免疫细胞类型肺泡巨噬细胞 (AM) 提供支持生态位5,6。除上皮细胞外,成纤维细胞、内皮细胞和间质巨噬细胞 (IM)(可以与神经和血管相关)构成间质 7,8,9,10。作为对感染和损伤的反应,许多肺细胞死亡,免疫细胞(包括单核细胞和中性粒细胞)浸润到组织中11,12。肺浸润性单核细胞分化为巨噬细胞,并可长期促进巨噬细胞区室13。
目前从小鼠肺制备单细胞悬液的方法通常是基于胶原酶的,并且需要组织的物理解离14。这可能导致活的非免疫细胞群数量减少。一些分离上皮细胞的方案是基于分散酶的,并且产生更高比例的活上皮细胞;然而,这些方案通常不研究免疫细胞产量和活力 15,16,17。流式细胞术是用于区分消化组织内细胞群的常用方法。在基线时,AMs、IMs、单核细胞和中性粒细胞的流式细胞术门控清晰。然而,在炎症期间,由于浸润性单核细胞分化为巨噬细胞的表面标志物表达的连续性,门控过程变得多变且难以解释。因此,本文介绍的方案还概述了感染后识别感兴趣的髓样细胞群的门控策略。
肺上皮细胞和骨髓细胞的稳健解离对于辨别它们的稳态和炎症功能至关重要。一种平行分离这些细胞区室的方法将能够对既维持健康又驱动疾病的关键细胞类型进行下游分析。该协议工作流程的示意图概述见 图 1。
研究方案
该协议符合哈佛医学院机构动物护理和使用委员会的指导方针(授权号:R35GM150816 和 P30DK043351)。实验采用 8-12 周龄雌性 C57BL/6J 小鼠。该协议也适用于雄性小鼠。材料 表中提供了本研究中使用的试剂和设备的详细信息。
1. 准备材料
- 在冰上解冻必要的酶,包括 dispase、liberase 和 DNAse。
- 准备其他必要的试剂。在 10 mL 注射器中加入 5 mL 的 2 mM EDTA DPBS 溶液,并安装 27 G 针头。用 DPBS 填充 1 mL 注射器并连接导管。
2. 收获肺部
- 通过腹膜内注射 400-500 mg/kg 和 25-100 mg/kg 氯胺酮/甲苯噻嗪混合物(遵循机构批准的方案)对小鼠实施安乐死。一旦鼠标对脚垫捏没有反应(~5 分钟),请继续解剖。
注意:氯胺酮/甲苯噻嗪混合物用于安乐死,而不是二氧化碳,以防止窒息引起的出血和免疫细胞浸润,这可能会混淆结果。 - 用 70% 乙醇喷洒鼠标。使用细手术剪刀和 #7 镊子解剖小鼠。用剪刀在腹部切开一个切口,然后横向切开腹膜。
- 在隔膜上做一个小切口以释放真空。将横膈膜和下肋骨从体腔中切出,露出肺和心脏。
- 在装有 27 G 针头的 10mL 注射器中,用 5 mL 的 2 mM EDTA 在 DPBS 中灌注肺部。灌注是通过用针头进入心脏底部,从右侧引导到左心室,然后从注射器18 中缓慢分配液体来进行的。
注意:应缓慢进行灌注,以防止脉管系统破裂。 - 切开胸腔的侧面,打开胸骨的胸腔,然后垂直切开胸骨,露出气管19。使用细剪刀和 #7 镊子尽可能多地剪掉肌肉和结缔组织,不要刺穿气管或肺。
- 用缝合线(2-0 号)包裹气管,好像要系好它,但不要收紧。在气管外侧划伤并插入导管。拉紧缝合线,将缝合线紧紧固定在导管周围。不要将导管插入肺部超过 1 厘米。
- 用 1 mL DPBS 给肺充气。慢慢拉回注射器,拉出 DPBS。使用相同的 DPBS 重新给肺部充气,然后再次拉回注射器以收集支气管肺泡灌洗液 (BALF)。
- 断开注射器与导管的连接,使导管插入。将 BALF 分配到微量离心管中。
- 在同一个 1 mL 注射器中加入 1 mL 分散酶,然后重新连接到导管上。分配注射器以用分散酶给肺部充气。拔除导管时,收紧气管周围的缝合线,以防止分散酶泄漏。
- 横向切开气管。通过沿着胸腔后部切开结缔组织,同时用镊子向上拉肺和气管,从体腔中取出肺。
- 从肺部取出心脏。将肺放入冰上的 5 mL DPBS 中。
- 在此步骤中,取分离的 BALF 并在 4 °C 下以 400 x g 旋转 5 分钟。 上清液可根据需要分装并储存。应该有一个可见的细胞沉淀,可以重悬于 100 μL RPMI 中。
注意:最多可以等待 2 小时进行消化,这样可以一次收获多只小鼠。
3. 消化肺部
- 准备摘要混合物。在每个肺的 3 mL RPMI 中加入 83 μg/mL liberase(50 μL 储备液)和 100 μg/mL DNAse(15 μL 储备液)。
- 解剖肺的五个叶并丢弃任何结缔组织19,20。用剪刀在载玻片上切肺 1 分钟。
- 使用解剖剪刀将切碎的肺转移到 50 mL 离心管中。将从 BALF 中回收的细胞沉淀并重悬于 RPMI 中,放入离心管中。使用 5 mL 血清移液管将 3 mL 消化混合物添加到含有样品的试管中。
- 上下吸取肺消化混合物 2-3 次。在 37 °C 下以 140 rpm 的转速置于轨道振荡器中,消化管以 45 度角放置 40 分钟。
4. 制备单细胞悬液
- 从定轨摇床中取出 50 mL 离心管,并将其置于冰上。上下移液肺消化混合物 5-6 次。通过 70 μm 细胞过滤器过滤到新的 50 mL 试管中。通过过滤器洗涤任何剩余的细胞,并用 10 mL 5% FBS 的 RPMI 溶液中和酶。
- 在 4°C 下以 600 x g 旋转 5 分钟。使用真空吸液器或移液管吸出上清液。重悬于 1 mL ACK 裂解缓冲液中,并在室温下孵育 3 分钟以裂解红细胞 (RBC)。加入 9 mL PBS 并上下移液。
- 在 4 °C 下以 600 x g 旋转 5 分钟。使用真空吸液器或移液管吸出上清液。重悬于 1 mL FACS 缓冲液(PBS 中的 1% FBS)中,并使用 p1000 移液器通过 64 μm 网孔过滤到微量离心管中。
5. 流式细胞术和下游分析
- 如果在 96 孔板中进行流式细胞术或荧光激活细胞分选,每孔可染色约 1-200 万个细胞,或占肺悬液的 8%。
- 将单元格向下旋转。96 孔板中的所有离心应在 600 x g 下进行 2.5 分钟 (4 °C)。弹掉上清液,重悬于 200 μL DPBS 中洗涤细胞一次。旋转并轻弹。
- 如果要对细胞进行染色以进行流式细胞术分析,请继续执行以下染色程序。
- 在室温下,在 25 μL DPBS 中,将活/死僵尸染色剂 (1:150) 和 Fc 块 (1:250) 中的细胞重悬 10 分钟。
- 在 FACS 缓冲液中制备 2x 浓度的抗体染色混合物。
注意:染色混合物应包括骨髓面板(表 1)或上皮面板(表 2)中指定浓度的所有标记物。 - 将 25 μL 染色混合物加入板中的 25 μL 肺悬液中,并在冰上避光孵育 30 分钟。现在总染色体积应为 50 μL,一抗应为其最终的 1 倍染色浓度。
- 加入 150 μL FACS 缓冲液,在 4 °C 下以 600 x g 离心 2.5 分钟,然后弹掉上清液。在 200 μL FACS 缓冲液中洗涤两次。
- 如果需要细胞内染色,请使用细胞内固定试剂盒固定细胞。如果不需要细胞内染色,可以将细胞在 DPBS 中的 4% PFA 中固定 20 分钟。
- 用 200 μL FACS 缓冲液洗掉固定剂 3 次。样品可以在 4 °C 下在 200 μL FACS 缓冲液中避光保存 2-3 天。在运行样品之前,可以添加计数珠以定量细胞数量。
- 如果要对细胞进行分选,请继续执行以下染色程序。
- 将细胞重悬于含有 Fc 块 (1:250) 的 1x 染色抗体混合物中。在黑暗中在冰上孵育 30 分钟。
- 加入 150 μL FACS 缓冲液,在 4 °C 下以 600 x g 离心 2.5 分钟,然后弹掉上清液。用 200 μL FACS 缓冲液洗涤 3 次,并在分选前重悬于 200 μL FACS 缓冲液中。
注:建议在分选前向细胞中添加活力染料,例如 DAPI。
结果
成功的消化将产生大约 20-2500 万个细胞,活力为 90%-95%。如果将大约 25,000 个计数珠添加到肺的 8% 部分中,则珠子应影响 1%-3% 的收集事件。在单粒上设门后,大约 90%-95% 的细胞应该是 Zombie Aqua 阴性(表明活力)(图 2A, 图 3A)。
在 CD45 + 细胞中,CD64 + F4 / 80 + 细胞被定义为巨噬细胞(图 2B)。在基线时,肺中 80%-90% 的巨噬细胞被定义为 AM (Siglec-F+CD11c+),其余的可归类为 IM (Siglec-F-CD11c-)(图 2C)。然而,在感染和炎症期间,这个定义发生了变化,除了 IM (Siglec-F-CD11clo/hi) 之外,IM 门控还将包含单核细胞衍生的巨噬细胞 (moMacs)。此外,在感染后 9 天 (dpi) 时,该比率转变为约 4% AM 和 90% IMs/moMacs(图 2C)。
CD64-F4/80 + 细胞可以通过 Siglec-F 和 Ly6C 进一步设门。Siglec-F + 细胞是嗜酸性粒细胞(图 2D)。Ly6C + Siglec-F-CD11b + 细胞可以鉴定为单核细胞(图 2D)。CD64 和 F4/80 阴性的细胞(图 2B)可以进一步设门为 CD11b+Ly6G+ 以识别中性粒细胞(图 2E)。
为了给上皮细胞设门,首先要把 CD45 + 细胞设门(图 3)。然后,可以鉴定内皮细胞 (CD31 + ) 和成纤维细胞 (Pdgfra + )(图 3B)。随后,作为 EpCAM + 的 CD31-Pdgfra- 细胞被鉴定为上皮细胞(图 3C)。上皮细胞可以进一步分为 ATII (MHC-II+CD104-)、气道细胞(俱乐部和纤毛细胞)(CD104+)和其他上皮细胞 (MHC-II-CD104-)(图 3D)。感染期间 ATII 细胞的比例降低。
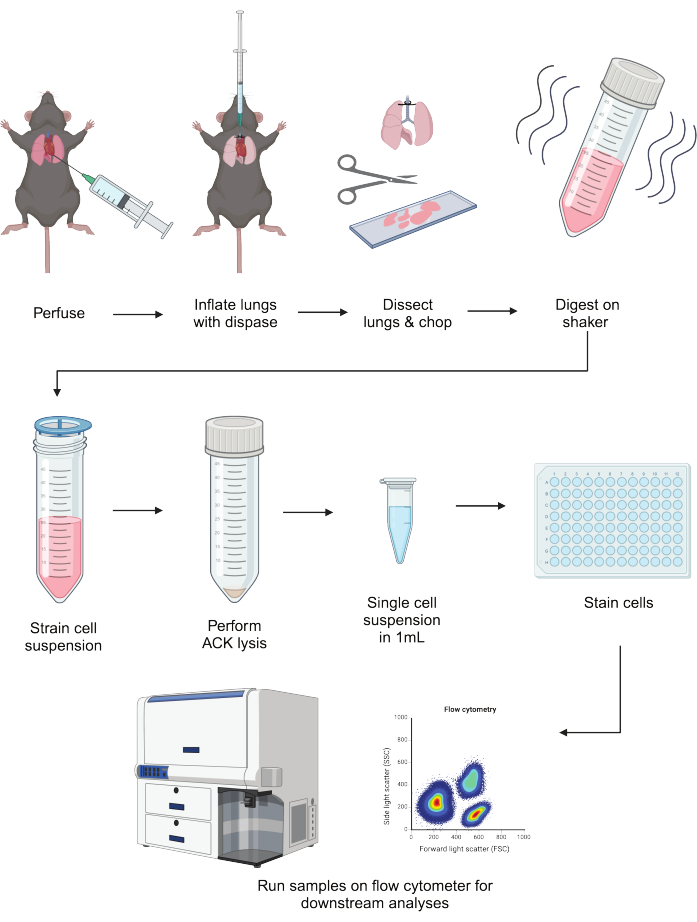
图 1:协议的示意图。 小鼠肺灌注,用分散酶充气,然后解剖。切碎后,将它们在 liberase/DNAse 混合物中振荡 40 分钟消化。消化物通过细胞过滤器运行,并裂解 RBC。在 FACS 缓冲液中重悬后,可以在下游应用(包括流式细胞术)之前对细胞进行铺板和染色。这个图是使用 BioRender 创建的。请单击此处查看此图的较大版本。

图 2:髓样细胞设门策略。对感染甲型流感/波多黎各/8/34 (H1N1) 后 (dpi) 未感染、9 天或 14 天的小鼠肺进行流式细胞术分析的代表性设门分析。(A) 活 CD45 + 细胞的设门。(B) 通过 F4/80 门控 CD64 的 CD45 + 细胞。(C) CD11c 使用 Siglec-F 将 CD64+F4/80+ 细胞(巨噬细胞)设门为 AM 和 IM/moMac。(D) CD64-F4/80+ 细胞设门为嗜酸性粒细胞和单核细胞。(E) 设门以识别中性粒细胞的 CD64-F4/80- 细胞。请单击此处查看此图的较大版本。
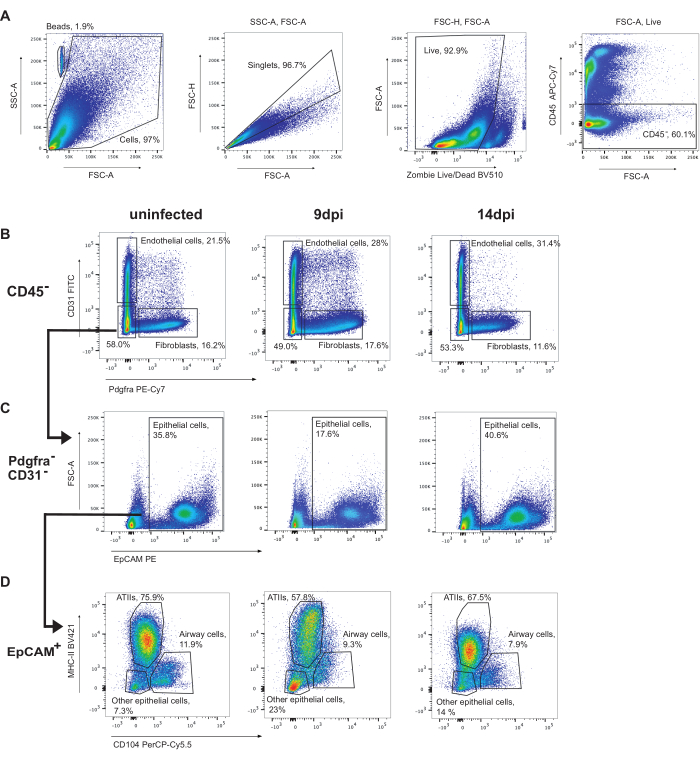
图 3:上皮细胞设门策略。 使用甲型流感/波多黎各/8/34 (H1N1) 对未感染的小鼠肺、9 dpi 或 14 dpi 进行流式细胞术分析的代表性设门。(A) 活 CD45- 细胞的门控。(B) 通过 Pdgfra(成纤维细胞)在 CD31(内皮细胞)上门控的 CD45 细胞。(C) CD31-Pdgfra-EpCAM+ 细胞是上皮细胞。(D) CD104 门控上皮细胞 MHC-II 识别 ATII(MHC-II+、CD104-)、气道上皮细胞(包括纤毛细胞和俱乐部细胞)(CD104+)和其他上皮细胞 (MHC-II-CD104-)。请单击此处查看此图的较大版本。
| 抗体 | 荧光基团 | 染色浓度 | 克隆 |
| 抗小鼠 CD11c | AF-488型 | 1:300 | 编号 N418 |
| 抗小鼠 CD170 (Siglec-F) | 体育 | 1:200 | 1RNM44N 系列 |
| 抗小鼠 CD45 | BV711 系列 | 1:200 | 30-F11 |
| 抗小鼠 CD64 (FcγRI) | APC公司 | 1:200 | X54-5/7.1 英寸 |
| 抗小鼠 F4/80 | PE/Cy7 系列 | 1:100 | BM8 系列 |
| 抗小鼠 Ly-6C | BV605 系列 | 1:500 | 1.4 港元 |
| 抗小鼠 Ly-6G | PerCP/花青素5.5 | 1:300 | 1A8 |
| 抗小鼠/人 CD11b | BV421型 | 1:800 | M1/70 系列 |
| 活/死污 | BV510 系列 | 1:150 | 不适用 |
表 1:骨髓面板的抗体指数。 用于髓系门控策略的抗体。
| 抗体 | 荧光基团 | 染色浓度 | 克隆 |
| 抗小鼠 CD104 | PerCP/花青素5.5 | 1:200 | 346-11A |
| 抗小鼠 CD140a (Pdgfra) | PE/花青7 | 1:200 | APA5 |
| 抗小鼠 CD31 | FITC | 1:200 | 390 |
| 抗小鼠 CD326 (Ep-CAM) | 体育 | 1:200 | G8.8 系列 |
| 抗小鼠 CD45 | APC/花青素7 | 1:200 | 30-F11 |
| 抗小鼠 I-A/I-E (MHC-II) | BV421型 | 1:400 | M5/114.15.2 号 |
| 活/死污 | BV510 系列 | 1:150 | 不适用 |
表 2:上皮面板的抗体指数。 用于上皮门控策略的抗体。
讨论
该方案概述了一种小鼠肺消化物,每只小鼠可分离约 20-2500 万个细胞,活力为 90%-95%。它还允许收集 BALF 以进行进一步分析。所得细胞悬液与多种实验室技术兼容,包括流式细胞术和荧光激活细胞分选,以分离细胞进行测序或细胞培养。简而言之,灌注后收集 BALF,并用分散酶给肺充气。然后将肺切碎并在 liberase/DNase 溶液中消化。裂解和过滤后,可以继续进行下游应用,包括流感病毒感染期间骨髓和上皮亚群的流式细胞术分析。
如果无法取回 BALF 和/或肺部没有正确保持充气状态,则可能是由于导管放置不正确。如果导管放置在气管/支气管中太远,它可能会突破组织进入腹膜。这将导致缺乏通货膨胀和无法取回 BALF。如果肺部已经充气但液体无法从肺的一个或多个肺叶中拉出,这可能是由于导管被引导到一个支气管中。将导管稍微拉出应该可以解决这个问题。需要足够的灌注来消除循环免疫细胞的污染21。在严重受损的肺中,出血和屏障完整性降低会使肺泡更容易因灌注压力而破裂22。因此,非常缓慢地灌注肺部受损的小鼠至关重要。
以下是流式细胞术染色最佳实践的一些指南。关于髓系门控,如果巨噬细胞门中存在 Siglec-F+CD11c- 群 (CD45+CD64+F4/80+),则很可能是嗜酸性粒细胞的污染。我们发现嗜酸性粒细胞在 PE 和 BV605 通道中都具有自发荧光 - 因此,避免使用与这些荧光团偶联的 CD64 抗体至关重要。此外,尽管这种消化方法可以分离活的淋巴细胞,但许多淋巴细胞特异性表面标志物,如 CD4 和 CD8,在此过程中被切割。因此,该方案不适用于 T 细胞群的流式细胞术分析。在这种情况下,基于胶原酶的方法可能是更有效的替代方案23,24。
有许多实验问题需要分析来自单只小鼠的免疫和非免疫组分25,26。例如,在研究不同细胞类型之间的相互作用时,从一只小鼠中收集和分析种群至关重要,以最大限度地减少由于个体动物之间的生物变异而可能出现的潜在伪影。此外,比较来自同一微环境的免疫和非免疫细胞群可以更全面地了解组织动力学及其在维持体内平衡和驱动疾病过程中的作用。
披露声明
作者没有什么可披露的。
致谢
这项工作部分得到了美国国立卫生研究院 (R35GM150816 和 P30DK043351)、Charles H. Hood 基金会和哈佛干细胞研究所的资助。我们感谢 Alexander Mann 和富兰克林实验室的所有其他成员在设计和改进流式细胞术门控方案和分析方面的帮助和建议。我们还要感谢哈佛医学院的免疫学流式细胞术核心。使用 FlowJo 进行流式细胞术分析。图 示意图是使用 BioRender 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe with Slip Tip | VWR | BD309659 | |
| 1.7 mL microcentrifuge tube | DOT Scientific | RN1700-GMT | |
| 10 mL pipettes (disposable) | Fisher Scientific | 12-567-603 | |
| 10 mL Syringe with BD Luer-Lok Tip | VWR | 75846-756 | |
| 123 count eBeads Counting Beads | Thermo Scientific | 01-1234-42 | |
| 12-channel pipette (30-300ul) | USA Scientific | 7112-3300 | |
| 16% paraformaldehyde | VWR | 100503-917 | |
| 23 G needle with regular bevel | VWR | 305194 | |
| 27 G needle with regular bevel | VWR | BD305109 | |
| 5 mL pipettes (disposable) | Thermo Fisher Scientific | 170373 | |
| 50 mL centrifuge tubes | Olympus | 28-108 | |
| 96-well round bottom plate | Corning | 3797 | |
| ACK lysing buffer | Gibco | A100492-01 | |
| Alexa Fluor 488 anti-mouse CD11c | BioLegend | 117311 | |
| Anti-F4/80 Rat Monoclonal Antibody (PE (Phycoerythrin)/Cy7) | BioLegend | 123114 | |
| APC anti-mouse CD64 (FcγRI) | BioLegend | 139306 | |
| APC/Cyanine7 anti-mouse CD45 | BioLegend | 103115 | |
| BD Insyte Autoguard Shielded IV Catheters | VWR | 381423 | |
| Brilliant Violet 421 anti-mouse I-A/I-E (MHC-II) | BioLegend | 107632 | |
| Brilliant Violet 421 anti-mouse/human CD11b | BioLegend | 101235 | |
| Brilliant Violet 605 anti-mouse Ly-6C | BioLegend | 128036 | |
| Brilliant Violet 711 anti-mouse CD45 | BioLegend | 103147 | |
| C57BL/6J mice | Jackson Laboratories | ||
| Cd140a (PDGFRA) Monoclonal Antibody (APA5), PE-Cyanine7, eBioscience | Life Technologies | 25-1401-82 | |
| CD170 (Siglec F) Monoclonal Antibody (1RNM44N), PE | Life Technologies | 12170280 | |
| Cell strainers | Corning | 352350 | |
| Centrifuge | Eppenodorf | Centrifuge 5910R | |
| Deoxyribonuclease I from bovine pancreas (DNase) | Millipore Sigma | DN25-100MG | Reconstituted at 20 mg/mL in DPBS as stock solution stored at -20 °C |
| Dispase | VWR | 76176-668 | Thawed once and stored as 1mL aliquots at -20 °C |
| Dissection forceps (Dumont #7) | Fine Science Tools | 11297-00 | |
| Dissection scissors | Fine Science Tools | 14060-09 | |
| DPBS | Thermo Fisher Scientific | 14190250 | |
| eBioscience fixation kit | Life Technologies | 00-5523-00 | |
| EDTA | Life Technologies | AM9260G | |
| Ethanol | VWR | TX89125170HU | |
| FBS | GeminiBio | 100-106 | Thawed once and heat-inactivated before long-term storage as aliquots at -20 °C |
| FITC anti-mouse CD31 Antibody | BioLegend | 102406 | |
| Gibco RPMI 1640 Medium | Fisher Scientific | 11-875-093 | |
| Glass slides | Fisher Scientific | 12-552-3 | |
| graduated reservoir | USA Scientific | 1930-2235 | |
| Ice bucket | Corning | 432128 | |
| Ketamine hydrocholoride injection (100 mg/mL) | Dechra | Ketamine and xyalazine euthanization mixture can be kept at 30 mg/mL ketamine hydrochloride and 4.5mg/mL xylazine in sterile DPBS for up to one month. | |
| Liberase | Millipore Sigma | 5401119001 | Reconstituted at 5 mg/mL in DPBS as stock solution stored at -20 °C |
| Lids for 96-well plates | Fisher Scientific | 07-201-731 | |
| Orbital Incubator Shaker | Barnstead Lab-Line | SHKE4000 | |
| p1000 pipette | Eppenodorf | 3123000063 | |
| p1000 tips | USA Scientific | 1122-1830 | |
| p200 pipette | Eppenodorf | 3123000055 | |
| p200 tips | USA Scientific | 1110-1700 | |
| PE anti-mouse CD326 (Ep-CAM) | BioLegend | 118206 | |
| PerCP/Cyanine5.5 anti-mouse CD104 Antibody | BioLegend | 123614 | |
| PerCP/Cyanine5.5 anti-mouse Ly-6G | BioLegend | 127616 | |
| Pipet-Aid | Drummond | 4-000-101 | |
| Purified anti-mouse CD16/32 | BioLegend | 101302 | Referred to as "Fc block" in text |
| Spray bottle | VWR | 23609-182 | |
| Suture (Size 2-0) | VWR | 100190-026 | |
| Underpads | VWR | 56617-014 | |
| Xysed (xylazine 100mg/mL) | Pivetal | See ketamine hydrocholoride notes above. | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
参考文献
- Wanner, A., Salathé, M., O'Riordan, T. G. Mucociliary clearance in the airways. Am J Respir Crit Care Med. 154 (6), 1868-1902 (1996).
- Mason, R. J., Williams, M. C. Type II alveolar cell. Defender of the alveolus. Am Rev Respir Dis. 115 (1), 81-91 (1977).
- Fehrenbach, H. Alveolar epithelial type II cell: defender of the alveolus revisited. Respir Res. 2 (1), 33-46 (2001).
- Basil, M. C., Alysandratos, K. -. D., Kotton, D. N., Morrisey, E. E. Lung repair and regeneration: Advanced models and insights into human disease. Cell Stem Cell. 31 (4), 439-454 (2024).
- Hussell, T., Bell, T. J. Alveolar macrophages: plasticity in a tissue-specific context. Nat Rev Immunol. 14 (2), 81-93 (2014).
- Gschwend, J., et al. Alveolar macrophages rely on GM-CSF from alveolar epithelial type 2 cells before and after birth. J Exp Med. 218 (1), e20210745 (2021).
- Gillich, A., et al. Capillary cell-type specialization in the alveolus. Nature. 586 (7831), 785-789 (2020).
- Schyns, J., et al. Non-classical tissue monocytes and two functionally distinct populations of interstitial macrophages populate the mouse lung. Nat Commun. 10 (1), 3964 (2019).
- Chakarov, S., et al. Two distinct interstitial macrophage populations coexist across tissues in specific subtissular niches. Science. 363 (6432), eaat3773 (2019).
- Tsukui, T., et al. Collagen-producing lung cell atlas identifies multiple subsets with distinct localization and relevance to fibrosis. Nat Commun. 11 (1), 1920 (1920).
- Aegerter, H., et al. Influenza-induced monocyte-derived alveolar macrophages confer prolonged antibacterial protection. Nat Immunol. 21 (2), 145-157 (2020).
- Johansson, C., Kirsebom, F. C. M. Neutrophils in respiratory viral infections. Mucosal Immunol. 14 (4), 815-827 (2021).
- Li, F., et al. Monocyte-derived alveolar macrophages autonomously determine severe outcome of respiratory viral infection. Sci Immunol. 7 (71), eabj5761 (2022).
- Moll, H. P., et al. Orthotopic transplantation of syngeneic lung adenocarcinoma cells to study PD-L1 expression. J Vis Exp. (143), e58101 (2019).
- Warshamana, G. S., Corti, M., Brody, A. R. TNF-α, PDGF, TGF-β1 expression by primary mouse bronchiolar-alveolar epithelial and mesenchymal cells: TNF-α induces TGF-β1. Exp Mol Pathol. 71 (1), 13-33 (2001).
- Corti, M., Brody, A. R., Harrison, J. H. Isolation and primary culture of murine alveolar type II cells. Am J Respir Cell Mol Biol. 14 (3), 309-315 (1996).
- Quantius, J., et al. Influenza virus infects epithelial stem/progenitor cells of the distal lung: Impact on Fgfr2b-driven epithelial repair. PLoS Pathog. 12 (5), e1005544 (2016).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. BIO Protoc. 11 (8), e3988 (2021).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Bijgaart, R. J. E., van den Kong, N., Maynard, C., Plaks, V. Ex vivo live imaging of lung metastasis and their microenvironment. J Vis Exp. (108), e53741 (2016).
- Shi, W., et al. Isolation and purification of immune cells from the liver. Int Immunopharmacol. 85, 106632 (2020).
- Short, K. R., et al. Influenza virus damages the alveolar barrier by disrupting epithelial cell tight junctions. Eur Respir J. 47 (3), 954-966 (2016).
- Laidlaw, B. J., et al. CD4+ T cell help guides formation of CD103+ lung-resident memory CD8+ T cells during influenza viral infection. Immunity. 41 (4), 633-645 (2014).
- D'Agostino, M. R., et al. Protocol for isolation and characterization of lung tissue-resident memory T cells and airway-trained innate immunity after intranasal vaccination in mice. STAR Protoc. 3 (2), 101652 (2022).
- Waal, A. M., de Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Bhattacharya, J., Westphalen, K. Macrophage-epithelial interactions in pulmonary alveoli. Semin Immunopathol. 38 (4), 461-469 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。