Method Article
בידוד אוכלוסיות תאים מיאלואידיים ואפיתל חיים מריאת העכבר
In This Article
Summary
פרוטוקול זה מפרט את הבידוד של אוכלוסיות חיסוניות ולא מחוסנות מריאות העכבר במצב יציב ובעקבות זיהום בשפעת. הוא גם מספק אסטרטגיות שער לזיהוי תת-קבוצות של תאים אפיתל ומיאלואידים.
Abstract
הריאה חשופה באופן רציף לפתוגנים ולגירויים סביבתיים מזיקים אחרים, מה שהופך אותה לפגיעה לנזק, תפקוד לקוי והתפתחות מחלות. מחקרים המשתמשים במודלים של עכברים של זיהום בדרכי הנשימה, אלרגיה, פיברוזיס וסרטן היו קריטיים לחשיפת מנגנוני התקדמות המחלה וזיהוי מטרות טיפוליות. עם זאת, רוב המחקרים המתמקדים בריאות העכבר נותנים עדיפות לבידוד של תאי חיסון או תאי אפיתל, ולא שתי האוכלוסיות בו זמנית. כאן, אנו מתארים שיטה להכנת תרחיף מקיף של תא בודד של אוכלוסיות חיסוניות ולא חיסוניות כאחד המתאים לזרימה ציטומטרית ומיון תאים המופעלים על ידי פלואורסצנטי. אוכלוסיות אלו כוללות תאי אפיתל, תאי אנדותל, פיברובלסטים ומגוון תת-קבוצות של תאים מיאלואידים. פרוטוקול זה כרוך בשטיפת סימפונות וניפוח הריאות לאחר מכן עם דיספאז. לאחר מכן הריאות מתעכלות בתערובת ליבראז. שיטת עיבוד זו משחררת מגוון סוגי תאים מגוונים ומביאה לתרחיף תא בודד שאינו דורש דיסוציאציה ידנית כנגד מסנן, מקדם את הישרדות התאים ומניב מספר גבוה של תאים חיים לניתוחים במורד הזרם. בפרוטוקול זה, אנו מגדירים גם תוכניות שער עבור תת-קבוצות של תאים אפיתל ומיאלואידים הן בריאות נאיביות והן בריאות נגועות בשפעת. בידוד סימולטני של תאים חיסוניים ולא חיסוניים חיים הוא המפתח לחקירת דיבור בין-תאי והשגת הבנה מעמיקה יותר של הביולוגיה של הריאות בבריאות ובמחלות.
Introduction
הריאה מורכבת מדרכי הנשימה, הנאדיות והאינטרסטיציום. תאים חיסוניים ולא חיסוניים שוכנים בתוך תאים אלה כדי לתרום הן לתפקוד הריאות ההומאוסטטי (חילופי גזים) והן להגנה על המארח מפני עלבונות סביבתיים, כגון זיהום ויראלי. דרכי הנשימה הגדולות והקטנות, או הסמפונות והסימפונות, מרופדות בתאי אפיתל. תאי האפיתל השולטים באזורים אלה הם תאים מועדונים וריסים האחראים על הפרשת מולקולות הגנה והקלה על פינוי רירית1. הנאדיות הן המבנים הדיסטליים ביותר בריאה, מרופדות על ידי שני סוגי תאי אפיתל, תאים מכתשית מסוג I (ATIs) ותאי מכתשית מסוג II (ATIIs). ATIs אחראים על חילופי גזים, ו-ATIIs מפרישים וממחזרים חומרים פעילי שטח כדי להבטיח מתח פנים מתאים 2,3. ATIIs מתחדשים מעצמם ויכולים גם להתבדל ל-ATIs, תפקיד רלוונטי במיוחד לאחר נזק לריאות4. בנוסף, ATIIs מספקים נישה תומכת לסוג התאים החיסוניים העיקריים המאכלס את הנישה המכתשית, מקרופאגים מכתשית (AMs)5,6. מעבר לאפיתל, פיברובלסטים, תאי אנדותל ומקרופאגים אינטרסטיציאליים (IMs) (שיכולים להיות קשורים הן לעצבים והן לכלי דם) מהווים את האינטרסטיציום 7,8,9,10. בתגובה לזיהום ופציעה, תאי ריאה רבים מתים, ותאי חיסון, כולל מונוציטים ונויטרופילים, חודרים לרקמה11,12. מונוציטים חודרים לריאות מתמיינים למקרופאגים ויכולים לתרום לתא המקרופאגים לטווח ארוך13.
השיטות הנוכחיות להכנת תרחיפים חד-תאיים מריאת העכבר מבוססות בדרך כלל על קולגנאז ודורשות דיסוציאציה פיזית של רקמה14. זה יכול לגרום למספר נמוך של אוכלוסיות תאים לא חיסוניות. חלק מהפרוטוקולים לבידוד תאי אפיתל מבוססים על דיספאז ומניבים פרופורציות גבוהות יותר של תאי אפיתל חיים; עם זאת, פרוטוקולים אלה בדרך כלל אינם חוקרים את תפוקת תאי החיסון ואת כדאיות 15,16,17. ציטומטריית זרימה היא שיטה נפוצה המשמשת להבחנה בין אוכלוסיות תאים בתוך רקמה מעוכלת. בנקודת ההתחלה, שער זרימה ציטומטרית עבור AMs, IMs, מונוציטים ונויטרופילים מוגדר בבירור. עם זאת, במהלך דלקת, תהליך השער הופך למשתנה ומאתגר לפירוש בשל הרצף בביטוי סמני פני השטח של מונוציטים חודרים המתמיינים למקרופאגים. לכן, הפרוטוקול המוצג כאן מתאר גם אסטרטגיות שער לזיהוי אוכלוסיות תאים מיאלואידים מעניינות לאחר הדבקה.
דיסוציאציה חזקה של תאי אפיתל ומיאלואידים של הריאות חיונית כדי להבחין בתפקודיהם ההומאוסטטיים והדלקתיים. שיטה לבודד את תאי התאים הללו במקביל תאפשר ניתוחים במורד הזרם של סוגי תאים מרכזיים שגם שומרים על הבריאות וגם מניעים מחלות. סקירה סכמטית של זרימת העבודה של פרוטוקול זה ניתן למצוא באיור 1.
Protocol
פרוטוקול זה תואם את ההנחיות של הוועדה המוסדית לטיפול ושימוש בבעלי חיים בבית הספר לרפואה של הרווארד (מספרי מענקים: R35GM150816 ו-P30DK043351). נקבות עכברי C57BL/6J בגילאי 8-12 שבועות שימשו לניסויים. פרוטוקול זה מתאים גם לעכברים זכרים. פרטי הריאגנטים והציוד המשמשים במחקר זה מסופקים בטבלת החומרים.
1. הכנת חומרים
- להפשיר אנזימים נחוצים על קרח, כולל דיספאז, ליבראז ו-DNAse.
- הכן ריאגנטים נחוצים אחרים. מלאו מזרק של 10 מ"ל ב-5 מ"ל של 2 מ"מ EDTA ב-DPBS והתאימו אותו עם מחט של 27 גרם. מלאו את המזרק של 1 מ"ל ב-DPBS והצמידו את הקטטר.
2. קצירת הריאות
- המתת חסד של העכבר על ידי הזרקה תוך-צפקית של 400-500 מ"ג/ק"ג ו-25-100 מ"ג/ק"ג תערובת קטמין/קסילזין (בהתאם לפרוטוקולים שאושרו על ידי המוסד). המשך בדיסקציה לאחר שהעכבר אינו מגיב לצביטה של כרית כף הרגל (~5 דקות).
הערה: תערובת קטמין/קסילזין משמשת להמתת חסד במקום פחמן דו חמצני כדי למנוע דימום הנגרם מחנק וחדירת תאי חיסון שעלולים לבלבל את התוצאות. - רססו את העכבר ב-70% אתנול. נתח את העכבר באמצעות מספריים כירורגיים עדינים ומלקחיים #7. בצע חתך בבטן בעזרת מספריים וחתך לרוחב דרך הצפק.
- בצע חתך קטן בסרעפת כדי לשחרר את הוואקום. חתכו את הסרעפת ואת כלוב הצלעות התחתון מחלל הגוף כדי לחשוף את הריאות והלב.
- לחלחל את הריאות עם 5 מ"ל של 2 מ"מ EDTA ב-DPBS במזרק 10 מ"ל המצויד במחט 27 גרם. הזלוף מתבצע על ידי כניסה לבסיס הלב עם המחט, מכוונת מימין לחדר השמאלי, והוצאת נוזלים לאט מהמזרק18.
הערה: יש לבצע זלוף לאט כדי למנוע קרע בכלי הדם. - פתח את כלוב הצלעות בעצם החזה על ידי חיתוך דפנות כלוב הצלעות, ולאחר מכן חתוך אנכית דרך עצם החזה כדי לחשוף את קנה הנשימה19. חתוך כמה שיותר שרירים ורקמות חיבור באמצעות מספריים עדינים ומלקחיים #7 מבלי לנקב את קנה הנשימה או הריאות.
- עטפו את קנה הנשימה בתפר (מידה 2-0) כאילו כדי לקשור אותו אך מבלי להדק. ניק קנה נשימה לרוחב והכנס את הקטטר. אבטח את התפר בחוזקה סביב הקטטר על ידי משיכת התפר בחוזקה. אין להכניס את הקטטר יותר מ-1 ס"מ לתוך הריאה.
- נפח ריאות עם 1 מ"ל DPBS. משוך החוצה את ה-DPBS על ידי משיכה איטית של המזרק. נפח מחדש את הריאות עם אותו DPBS ומשוך שוב את המזרק לאחור כדי לקצור נוזל שטיפת סימפונות (BALF).
- נתק את המזרק מהקטטר והשאיר את הקטטר מוכנס. יש להוציא את BALF לתוך שפופרת מיקרו-צנטריפוגה.
- מלאו את אותו מזרק של 1 מ"ל ב-1 מ"ל של דיספאז וחברו מחדש לקטטר. יש להוציא מזרק כדי לנפח את הריאות עם דיספאז. בזמן הסרת הקטטר, הדק את התפר סביב קנה הנשימה כדי למנוע דליפה של דיספאז.
- חותכים את קנה הנשימה לרוחב. הסר את הריאות מחלל הגוף על ידי חיתוך רקמת החיבור לאורך החלק האחורי של כלוב הצלעות תוך שימוש במלקחיים כדי למשוך את הריאות וקנה הנשימה כלפי מעלה.
- הסר את הלב מהריאות. הניחו את הריאות ב-5 מ"ל DPBS על קרח.
- בשלב זה, קח את ה-BALF המופרד וסובב כלפי מטה ב-400 x גרם למשך 5 דקות ב-4 מעלות צלזיוס. ניתן לצרף את הסופרנטנט ולאחסן אותו לפי הצורך. צריכה להיות גלולת תא גלויה שניתן להשעות מחדש ב-100 מיקרוליטר של RPMI.
הערה: ניתן להמתין עד שעתיים כדי להמשיך בעיכול, מה שמאפשר לקצור מספר עכברים בכל פעם.
3. עיכול הריאות
- מכינים את תערובת העיכול. הוסף 83 μg/mL liberase (תמיסת מלאי של 50 μL), ו-100 μg/mL DNAse (תמיסת מלאי של 15 μL) ב-3 מ"ל של RPMI לכל ריאה.
- לנתח את חמש האונות של הריאות ולהשליך כל רקמת חיבור19,20. קוצצים את הריאה במספריים למשך דקה על מגלשת זכוכית.
- מעבירים את הריאה הקצוצה לצינור צנטריפוגה של 50 מ"ל בעזרת מספריים לדיסקציה. הוסף כדור תא שהוחזר מ-BALF והושעה מחדש ב-RPMI לתוך צינור הצנטריפוגה. הוסף 3 מ"ל של תערובת עיכול לצינור המכיל את הדגימה באמצעות פיפטה סרולוגית של 5 מ"ל.
- תערובת עיכול ריאות פיפט למעלה ולמטה 2-3 פעמים. מניחים ב-37 מעלות צלזיוס בשייקר אורביטלי ב-140 סל"ד עם צינורות עיכול הממוקמים בזווית של 45 מעלות למשך 40 דקות.
4. הכנת המתלה החד-תאי
- הסר את צינורות הצנטריפוגה בנפח 50 מ"ל משייקר המסלול והנח אותם על קרח. תערובת עיכול ריאות פיפטה למעלה ולמטה 5-6 פעמים. מסננים דרך מסננת תאים של 70 מיקרומטר לתוך צינור חדש של 50 מ"ל. שטפו את כל התאים שנותרו דרך המסנן ונטרלו אנזימים עם 10 מ"ל 5% FBS ב-RPMI.
- סובב במשך 5 דקות 4 מעלות צלזיוס בטמפרטורה של 600 x גרם. שאפו את הסופרנטנט באמצעות שואב ואקום או פיפטה. השעו מחדש ב-1 מ"ל של מאגר ליזה ACK ודגרו למשך 3 דקות בטמפרטורת החדר כדי ליז כדוריות דם אדומות (RBCs). הוסף 9 מ"ל PBS ופיפטה למעלה ולמטה.
- יש לסובב במשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס בטמפרטורה של 600 x גרם. שאפו סופרנטנט באמצעות שואב ואקום או פיפטה. השעו מחדש ב-1 מ"ל של חוצץ FACS (1% FBS ב-PBS) וסננו דרך רשת של 64 מיקרומטר לתוך שפופרת מיקרו-צנטריפוגה באמצעות פיפטה p1000.
5. ציטומטריית זרימה וניתוחים במורד הזרם
- אם מבצעים ציטומטריית זרימה או מיון תאים המופעל על ידי פלואורסצנטי בצלחת של 96 בארות, יש לצבוע כ-1-2 מיליון תאים לבאר, או חלק של 8% מתרחיף הריאות.
- סובב את התאים כלפי מטה. יש לבצע את כל הסיבובים בצלחת של 96 בארות למשך 2.5 דקות (4 מעלות צלזיוס) בטמפרטורה של 600 x גרם. הסר את הסופרנטנט ושטוף את התאים פעם אחת על ידי השעיה מחדש של 200 מיקרוליטר של DPBS. סובב למטה והחליק.
- אם יש לצבוע תאים לניתוח ציטומטריית זרימה, המשך בהליך הצביעה הבא.
- השעו מחדש תאים בכתם זומבי חי/מת (1:150) ובלוק Fc (1:250) ב-25 מיקרוליטר של DPBS למשך 10 דקות בטמפרטורת החדר בחושך.
- הכן את תערובת צביעת הנוגדנים בריכוז פי 2 במאגר ה-FACS.
הערה: תערובת מכתים צריכה לכלול את כל הסמנים בלוח המיאלואיד (טבלה 1) או בלוח האפיתל (טבלה 2) בריכוזים המצוינים שלהם. - הוסף 25 מיקרוליטר של תערובת מכתים ל-25 מיקרוליטר של תרחיף ריאות בצלחת ודגירה על קרח למשך 30 דקות בחושך. נפח הצביעה הכולל צריך להיות כעת 50 מיקרוליטר, והנוגדנים הראשוניים צריכים להיות בריכוז הצביעה הסופי שלהם פי 1.
- הוסף 150 מיקרוליטר של חוצץ FACS, סובב כלפי מטה למשך 2.5 דקות ב-4 מעלות צלזיוס ב-600 x גרם, והחלק את ה-supernatant. שטפו פעמיים ב-200 מיקרוליטר של מאגר FACS.
- אם נדרש צביעה תוך תאית, תקן את התאים בעזרת ערכת קיבוע תוך תאית. אם אין צורך בצביעה תוך-תאית, ניתן לתקן תאים למשך 20 דקות ב-4% PFA ב-DPBS.
- שטפו את הקיבוע עם 200 מיקרוליטר של מאגר FACS שלוש פעמים. ניתן לאחסן דגימות בתלייה ב-200 מיקרוליטר של מאגר FACS ב-4 מעלות צלזיוס בחושך למשך 2-3 ימים. לפני הפעלת דגימות, ניתן להוסיף חרוזי ספירת כדי לכמת את מספרי התאים.
- אם יש למיין תאים, המשך בהליך הצביעה הבא.
- השעו מחדש תאים בתערובת נוגדנים מכתים 1x עם בלוק Fc (1:250). דגירה למשך 30 דקות על קרח בחושך.
- הוסף 150 מיקרוליטר של חוצץ FACS, סובב כלפי מטה למשך 2.5 דקות ב-4 מעלות צלזיוס ב-600 x גרם, והחלק את ה-supernatant. שטפו שלוש פעמים עם 200 מיקרוליטר של מאגר FACS והשהו מחדש ב-200 מיקרוליטר של מאגר FACS לפני המיון.
הערה: מומלץ להוסיף צבע כדאיות, כגון DAPI, לתאים לפני המיון.
תוצאות
עיכול מוצלח יביא לכ-20-25 מיליון תאים עם כדאיות של 90%-95%. אם מתווספים כ-25,000 חרוזי ספירה לחלק של 8% מהריאה, החרוזים אמורים לפגוע ב-1%-3% מהאירועים שנאספו. לאחר השער על סינגלים, כ-90%-95% מהתאים צריכים להיות שליליים ל-Zombie Aqua (מה שמעיד על כדאיות) (איור 2A, איור 3A).
מבין תאי CD45+, תאי CD64+F4/80+ מוגדרים כמקרופאגים (איור 2B). בנקודת ההתחלה, 80%-90% מכל המקרופאגים בריאה מוגדרים כ-AMs (Siglec-F+CD11c+), ואת השאר אפשר לסווג כ-IMs (Siglec-F-CD11c-) (איור 2C). עם זאת, במהלך זיהום ודלקת, הגדרה זו משתנה, ושער ה-IM יכיל מקרופאגים שמקורם במונוציטים (moMacs) בנוסף ל-IMs (Siglec-F-CD11clo/hi). יתר על כן, היחס משתנה לכ-4% AMs ו-90% IMs/moMac ב-9 ימים לאחר ההדבקה (dpi) (איור 2C).
תאים שהם CD64-F4/80+ יכולים להיות מגודרים עוד יותר על ידי Siglec-F ו-Ly6C. תאי Siglec-F+ הם אאוזינופילים (איור 2D). תאי Ly6C+Siglec-F-CD11b+ יכולים להיות מזוהים כמונוציטים (איור 2D). תאים שליליים גם ל-CD64 וגם ל-F4/80 (איור 2B) יכולים להיות מגודרים עוד יותר כ-CD11b+Ly6G+ כדי לזהות נויטרופילים (איור 2E).
כדי לשער תאי אפיתל, תאי CD45+ הראשונים צריכים להיות מגודרים החוצה (איור 3). לאחר מכן, תאי אנדותל (CD31+) ופיברובלסטים (Pdgfra+) יכולים להיות מזוהים (איור 3B). לאחר מכן, תאי CD31-Pdgfra- שהם EpCAM+ מזוהים כתאי אפיתל (איור 3C). תאי אפיתל עשויים להיות תת-מוגדרים עוד יותר ל-ATIIs (MHC-II+CD104-), תאי דרכי הנשימה (תאים קלאב ותאי ריסים) (CD104+) ותאי אפיתל אחרים (MHC-II-CD104-) (איור 3D). שיעור תאי ה-ATII יורד במהלך ההדבקה.
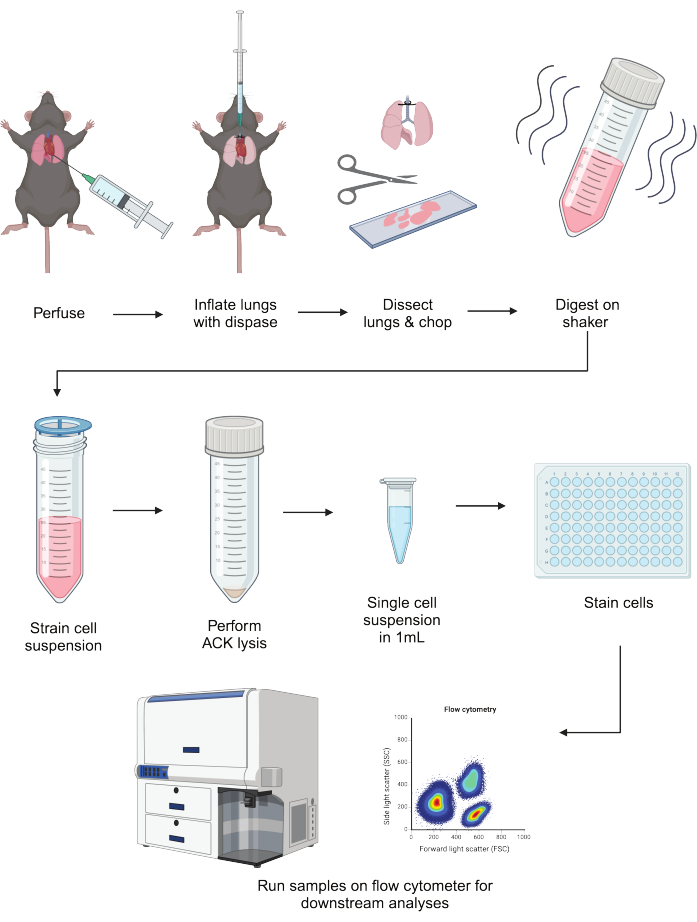
איור 1: ייצוג סכמטי של הפרוטוקול. ריאות העכבר מנופחות, מנופחות עם דיספאז ומנותחות. לאחר הקיצוץ הם מתעכלים בתערובת ליבראז/DNAse עם ניעור למשך 40 דקות. תקצירים מועברים דרך מסננת תאים, ו-RBCs עוברים ליזה. לאחר השעיה מחדש במאגר FACS, ניתן לצפות ולהכתים תאים לפני יישומים במורד הזרם, כולל ציטומטריית זרימה. דמות זו נוצרה באמצעות BioRender. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: אסטרטגיית שער תאים מיאלואידיים. שער מייצג של ניתוחי זרימה ציטומטרית של ריאות עכבר שאינן נגועות, 9 ימים או 14 ימים לאחר ההדבקה (dpi) בשפעת A/פוארטו ריקו/8/34 (H1N1). (A) שער של תאי CD45+ חיים. (B) תאי CD45+ מגודרים CD64 על F4/80. (C) תאי CD64+F4/80+ (מקרופאגים) מגודרים לתוך AMs ו-IMs/moMacs באמצעות Siglec-F על ידי CD11c. (D) תאי CD64-F4/80+ מגודרים לאאוזינופילים ומונוציטים. (E) תאי CD64-F4/80 מגודרים לזיהוי נויטרופילים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
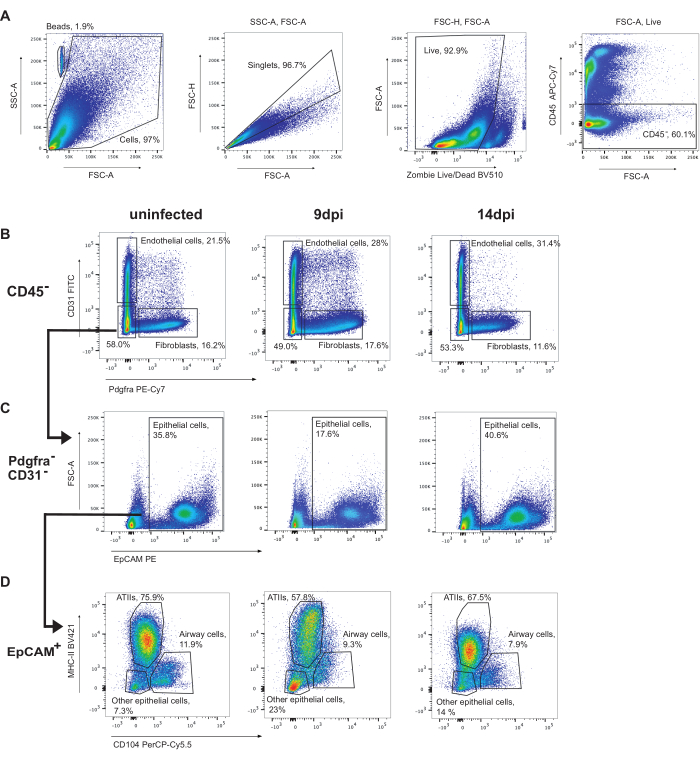
איור 3: אסטרטגיית שער תאי אפיתל. שער מייצג של ניתוחי זרימה ציטומטרית של ריאות עכבר לא נגועות, 9 dpi או 14 dpi עם שפעת A/פוארטו ריקו/8/34 (H1N1). (A) שער של תאי CD45 חיים. (B) תאי CD45 מגודרים על CD31 (תאי אנדותל) על ידי Pdgfra (פיברובלסטים). (C) תאי CD31-Pdgfra-EpCAM+ הם תאי אפיתל. (D) שער תאי אפיתל MHC-II על ידי CD104 מזהה ATIIs (MHC-II+, CD104-), תאי אפיתל של דרכי הנשימה (כולל תאים ריסניים ותאי מועדון) (CD104+), ותאי אפיתל אחרים (MHC-II-CD104-). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| נוגדן | פלואורופור | ריכוז צביעה | שיבוט |
| CD11c נגד עכבר | AF-488 | 1:300 | N418 |
| CD170 נגד עכבר (Siglec-F) | PE | 1:200 | 1RNM44N |
| CD45 נגד עכבר | רי"ב711 | 1:200 | 30-ו11 |
| CD64 נגד עכבר (FcγRI) | נגמ"ש | 1:200 | X54-5/7.1 |
| נגד עכבר F4/80 | PE/Cy7 | 1:100 | BM8 |
| נגד עכבר Ly-6C | BV605 | 1:500 | הונג קונגי1.4 |
| נגד עכבר Ly-6G | מחיר/ציאנין5.5 | 1:300 | 1א8 |
| CD11b נגד עכבר/אנושי | רי"ב421 | 1:800 | M1/70 |
| כתם חי/מת | BV510 | 1:150 | נ.א. |
טבלה 1: אינדקס נוגדנים לפאנל מיאלואידי. נוגדנים המשמשים לאסטרטגיית השער המיאלואידי.
| נוגדן | פלואורופור | ריכוז צביעה | שיבוט |
| CD104 נגד עכבר | מחיר/ציאנין5.5 | 1:200 | 346-11א |
| CD140a נגד עכבר (Pdgfra) | PE/ציאנין7 | 1:200 | APA5 |
| CD31 נגד עכבר | פיטק | 1:200 | 390 |
| CD326 נגד עכבר (Ep-CAM) | PE | 1:200 | G8.8 |
| CD45 נגד עכבר | נגמ"ש/ציאנין7 | 1:200 | 30-ו11 |
| I-A/I-E נגד עכבר (MHC-II) | רי"ב421 | 1:400 | M5/114.15.2 |
| כתם חי/מת | BV510 | 1:150 | נ.א. |
טבלה 2: אינדקס נוגדנים ללוח האפיתל. נוגדנים המשמשים לאסטרטגיית שער האפיתל.
Discussion
פרוטוקול זה מתאר עיכול ריאות של עכבר המבודד כ-20-25 מיליון תאים לעכבר עם כדאיות של 90%-95%. זה גם מאפשר איסוף של BALF לניתוח נוסף. תרחיף התאים המתקבל תואם למספר טכניקות מעבדה, כולל ציטומטריית זרימה ומיון תאים המופעל על ידי פלואורסצנטי לבידוד תאים לריצוף או תרבית תאים. בקצרה, לאחר הזילוף, נאסף BALF, והריאות מנופחות עם דיספאז. לאחר מכן קוצצים את הריאות ומתעכלים בתמיסת ליבראז/DNase. לאחר ליזה וסינון, ניתן להמשיך ביישומים במורד הזרם, כולל ניתוח ציטומטריית זרימה של תת-קבוצות מיאלואידיות ואפיתל במהלך זיהום בנגיף השפעת.
אם לא ניתן לאחזר BALF ו/או הריאות אינן נשארות מנופחות כראוי, ייתכן שהסיבה לכך היא מיקום לא נכון של הצנתר. אם הצנתר ממוקם רחוק מדי לתוך קנה הנשימה/הסמפונות, הוא יכול לפרוץ דרך הרקמה לתוך הצפק. זה יביא לחוסר אינפלציה וחוסר יכולת לאחזר BALF. אם הריאות התנפחו אך לא ניתן לשלוף נוזל מאונה אחת או יותר של הריאה, ייתכן שהסיבה לכך היא שהקטטר מופנה לסימפונות אחד. משיכת הקטטר מעט החוצה אמורה לפתור בעיה זו. דרוש זלוף מספיק כדי לסלק זיהום מתאי חיסון במחזור21. בריאות פגועות קשות, שטפי דם וירידה בשלמות המחסום יכולים להפוך את הנאדיות לרגישות יותר להתפוצצות מלחץ הזלוף22. לכן, זה קריטי לחלחל עכברים עם ריאות פגועות לאט מאוד.
להלן מספר הנחיות לשיטות עבודה מומלצות בצביעת זרימה ציטומטרית. לגבי שער מיאלואידי, אם קיימת אוכלוסיית Siglec-F+CD11c- בשער המקרופאגים (CD45+CD64+F4/80+), סביר להניח שמדובר בזיהום מאאוזינופילים. מצאנו שאאוזינופילים הם אוטו-פלואורסצנטיים הן בתעלות PE והן ב-BV605 - לכן, קריטי להימנע משימוש בנוגדנים CD64 המצומדים לפלואורופורים אלה. יתר על כן, למרות ששיטת עיכול זו יכולה לבודד לימפוציטים חיים, סמני שטח רבים ספציפיים ללימפוציטים, כגון CD4 ו-CD8, נבקעים בתהליך. כתוצאה מכך, פרוטוקול זה אינו מתאים לניתוח זרימה ציטומטרית של אוכלוסיות תאי T. במקרים כאלה, גישה מבוססת קולגנאז עשויה להיות חלופה יעילה יותר 23,24.
ישנן שאלות ניסיוניות רבות הדורשות ניתוח של מקטעים חיסוניים ולא חיסוניים מעכבר בודד25,26. לדוגמה, כאשר חוקרים אינטראקציות בין סוגי תאים שונים, זה קריטי לאסוף ולנתח אוכלוסיות מתוך עכבר בודד כדי למזער חפצים פוטנציאליים שיכולים להיווצר עקב שונות ביולוגית בין בעלי חיים בודדים. בנוסף, השוואה בין אוכלוסיות תאים חיסוניים ולא חיסוניים מאותה מיקרו-סביבה מאפשרת הבנה מלאה יותר של דינמיקת הרקמות ותפקידיהן הן בשמירה על הומאוסטזיס והן בהנעת תהליכי מחלה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה בחלקה על ידי מענקים מהמכונים הלאומיים לבריאות (R35GM150816 ו-P30DK043351), קרן צ'ארלס ה. הוד ומכון תאי הגזע של הרווארד. אנו מודים לאלכסנדר מאן ולכל שאר חברי מעבדת פרנקלין על עזרתם ועצתם בתכנון ושכלול תוכניות השער והניתוחים של זרימה ציטומטרית. אנו מודים גם לליבת אימונולוגיה ציטומטריית זרימה בבית הספר לרפואה של הרווארד. ניתוח ציטומטריית זרימה בוצע באמצעות FlowJo. סכמות איורים נוצרו באמצעות BioRender.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe with Slip Tip | VWR | BD309659 | |
| 1.7 mL microcentrifuge tube | DOT Scientific | RN1700-GMT | |
| 10 mL pipettes (disposable) | Fisher Scientific | 12-567-603 | |
| 10 mL Syringe with BD Luer-Lok Tip | VWR | 75846-756 | |
| 123 count eBeads Counting Beads | Thermo Scientific | 01-1234-42 | |
| 12-channel pipette (30-300ul) | USA Scientific | 7112-3300 | |
| 16% paraformaldehyde | VWR | 100503-917 | |
| 23 G needle with regular bevel | VWR | 305194 | |
| 27 G needle with regular bevel | VWR | BD305109 | |
| 5 mL pipettes (disposable) | Thermo Fisher Scientific | 170373 | |
| 50 mL centrifuge tubes | Olympus | 28-108 | |
| 96-well round bottom plate | Corning | 3797 | |
| ACK lysing buffer | Gibco | A100492-01 | |
| Alexa Fluor 488 anti-mouse CD11c | BioLegend | 117311 | |
| Anti-F4/80 Rat Monoclonal Antibody (PE (Phycoerythrin)/Cy7) | BioLegend | 123114 | |
| APC anti-mouse CD64 (FcγRI) | BioLegend | 139306 | |
| APC/Cyanine7 anti-mouse CD45 | BioLegend | 103115 | |
| BD Insyte Autoguard Shielded IV Catheters | VWR | 381423 | |
| Brilliant Violet 421 anti-mouse I-A/I-E (MHC-II) | BioLegend | 107632 | |
| Brilliant Violet 421 anti-mouse/human CD11b | BioLegend | 101235 | |
| Brilliant Violet 605 anti-mouse Ly-6C | BioLegend | 128036 | |
| Brilliant Violet 711 anti-mouse CD45 | BioLegend | 103147 | |
| C57BL/6J mice | Jackson Laboratories | ||
| Cd140a (PDGFRA) Monoclonal Antibody (APA5), PE-Cyanine7, eBioscience | Life Technologies | 25-1401-82 | |
| CD170 (Siglec F) Monoclonal Antibody (1RNM44N), PE | Life Technologies | 12170280 | |
| Cell strainers | Corning | 352350 | |
| Centrifuge | Eppenodorf | Centrifuge 5910R | |
| Deoxyribonuclease I from bovine pancreas (DNase) | Millipore Sigma | DN25-100MG | Reconstituted at 20 mg/mL in DPBS as stock solution stored at -20 °C |
| Dispase | VWR | 76176-668 | Thawed once and stored as 1mL aliquots at -20 °C |
| Dissection forceps (Dumont #7) | Fine Science Tools | 11297-00 | |
| Dissection scissors | Fine Science Tools | 14060-09 | |
| DPBS | Thermo Fisher Scientific | 14190250 | |
| eBioscience fixation kit | Life Technologies | 00-5523-00 | |
| EDTA | Life Technologies | AM9260G | |
| Ethanol | VWR | TX89125170HU | |
| FBS | GeminiBio | 100-106 | Thawed once and heat-inactivated before long-term storage as aliquots at -20 °C |
| FITC anti-mouse CD31 Antibody | BioLegend | 102406 | |
| Gibco RPMI 1640 Medium | Fisher Scientific | 11-875-093 | |
| Glass slides | Fisher Scientific | 12-552-3 | |
| graduated reservoir | USA Scientific | 1930-2235 | |
| Ice bucket | Corning | 432128 | |
| Ketamine hydrocholoride injection (100 mg/mL) | Dechra | Ketamine and xyalazine euthanization mixture can be kept at 30 mg/mL ketamine hydrochloride and 4.5mg/mL xylazine in sterile DPBS for up to one month. | |
| Liberase | Millipore Sigma | 5401119001 | Reconstituted at 5 mg/mL in DPBS as stock solution stored at -20 °C |
| Lids for 96-well plates | Fisher Scientific | 07-201-731 | |
| Orbital Incubator Shaker | Barnstead Lab-Line | SHKE4000 | |
| p1000 pipette | Eppenodorf | 3123000063 | |
| p1000 tips | USA Scientific | 1122-1830 | |
| p200 pipette | Eppenodorf | 3123000055 | |
| p200 tips | USA Scientific | 1110-1700 | |
| PE anti-mouse CD326 (Ep-CAM) | BioLegend | 118206 | |
| PerCP/Cyanine5.5 anti-mouse CD104 Antibody | BioLegend | 123614 | |
| PerCP/Cyanine5.5 anti-mouse Ly-6G | BioLegend | 127616 | |
| Pipet-Aid | Drummond | 4-000-101 | |
| Purified anti-mouse CD16/32 | BioLegend | 101302 | Referred to as "Fc block" in text |
| Spray bottle | VWR | 23609-182 | |
| Suture (Size 2-0) | VWR | 100190-026 | |
| Underpads | VWR | 56617-014 | |
| Xysed (xylazine 100mg/mL) | Pivetal | See ketamine hydrocholoride notes above. | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
References
- Wanner, A., Salathé, M., O'Riordan, T. G. Mucociliary clearance in the airways. Am J Respir Crit Care Med. 154 (6), 1868-1902 (1996).
- Mason, R. J., Williams, M. C. Type II alveolar cell. Defender of the alveolus. Am Rev Respir Dis. 115 (1), 81-91 (1977).
- Fehrenbach, H. Alveolar epithelial type II cell: defender of the alveolus revisited. Respir Res. 2 (1), 33-46 (2001).
- Basil, M. C., Alysandratos, K. -. D., Kotton, D. N., Morrisey, E. E. Lung repair and regeneration: Advanced models and insights into human disease. Cell Stem Cell. 31 (4), 439-454 (2024).
- Hussell, T., Bell, T. J. Alveolar macrophages: plasticity in a tissue-specific context. Nat Rev Immunol. 14 (2), 81-93 (2014).
- Gschwend, J., et al. Alveolar macrophages rely on GM-CSF from alveolar epithelial type 2 cells before and after birth. J Exp Med. 218 (1), e20210745 (2021).
- Gillich, A., et al. Capillary cell-type specialization in the alveolus. Nature. 586 (7831), 785-789 (2020).
- Schyns, J., et al. Non-classical tissue monocytes and two functionally distinct populations of interstitial macrophages populate the mouse lung. Nat Commun. 10 (1), 3964 (2019).
- Chakarov, S., et al. Two distinct interstitial macrophage populations coexist across tissues in specific subtissular niches. Science. 363 (6432), eaat3773 (2019).
- Tsukui, T., et al. Collagen-producing lung cell atlas identifies multiple subsets with distinct localization and relevance to fibrosis. Nat Commun. 11 (1), 1920 (1920).
- Aegerter, H., et al. Influenza-induced monocyte-derived alveolar macrophages confer prolonged antibacterial protection. Nat Immunol. 21 (2), 145-157 (2020).
- Johansson, C., Kirsebom, F. C. M. Neutrophils in respiratory viral infections. Mucosal Immunol. 14 (4), 815-827 (2021).
- Li, F., et al. Monocyte-derived alveolar macrophages autonomously determine severe outcome of respiratory viral infection. Sci Immunol. 7 (71), eabj5761 (2022).
- Moll, H. P., et al. Orthotopic transplantation of syngeneic lung adenocarcinoma cells to study PD-L1 expression. J Vis Exp. (143), e58101 (2019).
- Warshamana, G. S., Corti, M., Brody, A. R. TNF-α, PDGF, TGF-β1 expression by primary mouse bronchiolar-alveolar epithelial and mesenchymal cells: TNF-α induces TGF-β1. Exp Mol Pathol. 71 (1), 13-33 (2001).
- Corti, M., Brody, A. R., Harrison, J. H. Isolation and primary culture of murine alveolar type II cells. Am J Respir Cell Mol Biol. 14 (3), 309-315 (1996).
- Quantius, J., et al. Influenza virus infects epithelial stem/progenitor cells of the distal lung: Impact on Fgfr2b-driven epithelial repair. PLoS Pathog. 12 (5), e1005544 (2016).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. BIO Protoc. 11 (8), e3988 (2021).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Bijgaart, R. J. E., van den Kong, N., Maynard, C., Plaks, V. Ex vivo live imaging of lung metastasis and their microenvironment. J Vis Exp. (108), e53741 (2016).
- Shi, W., et al. Isolation and purification of immune cells from the liver. Int Immunopharmacol. 85, 106632 (2020).
- Short, K. R., et al. Influenza virus damages the alveolar barrier by disrupting epithelial cell tight junctions. Eur Respir J. 47 (3), 954-966 (2016).
- Laidlaw, B. J., et al. CD4+ T cell help guides formation of CD103+ lung-resident memory CD8+ T cells during influenza viral infection. Immunity. 41 (4), 633-645 (2014).
- D'Agostino, M. R., et al. Protocol for isolation and characterization of lung tissue-resident memory T cells and airway-trained innate immunity after intranasal vaccination in mice. STAR Protoc. 3 (2), 101652 (2022).
- Waal, A. M., de Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Bhattacharya, J., Westphalen, K. Macrophage-epithelial interactions in pulmonary alveoli. Semin Immunopathol. 38 (4), 461-469 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved