Method Article
マウス肺からの生きた骨髄系および上皮細胞集団の単離
要約
このプロトコルは、インフルエンザ感染後のマウス肺からの生存免疫集団および非免疫集団の定常状態からの分離を詳述しています。また、上皮細胞および骨髄系細胞サブセットを同定するためのゲーティング戦略も提供します。
要約
肺は病原体やその他の有害な環境刺激に絶えずさらされているため、損傷、機能障害、および病気の発症に対して脆弱になります。呼吸器感染症、アレルギー、線維症、がんのマウスモデルを用いた研究は、疾患の進行メカニズムを明らかにし、治療標的を特定するために重要です。しかし、マウスの肺に焦点を当てたほとんどの研究では、免疫細胞または上皮細胞のいずれかを同時に分離するのではなく、どちらか一方の分離を優先しています。ここでは、フローサイトメトリーおよび蛍光活性化細胞ソーティングに適した、免疫集団と非免疫集団の両方の包括的な単一細胞懸濁液を調製する方法について説明します。これらの集団には、上皮細胞、内皮細胞、線維芽細胞、およびさまざまな骨髄細胞サブセットが含まれます。このプロトコルには、気管支肺胞洗浄とそれに続く肺の膨張を伴います。その後、肺はリベラーゼ混合物で消化されます。この処理方法は、さまざまな多様な細胞タイプを遊離させ、フィルターに対する手動解離を必要としない単一細胞懸濁液をもたらし、細胞の生存を促進し、ダウンストリーム分析のために多数の生細胞を生成します。このプロトコルでは、ナイーブ肺とインフルエンザ感染肺の両方における上皮細胞および骨髄細胞サブセットのゲーティングスキームも定義します。生免疫細胞と非免疫細胞を同時に単離することは、細胞間クロストークを調査し、健康と疾患における肺の生物学をより深く理解するための鍵となります。
概要
肺は、気道、肺胞、間質で構成されています。免疫細胞と非免疫細胞はこれらのコンパートメント内に存在し、恒常性肺機能(ガス交換)とウイルス感染などの環境障害に対する宿主防御の両方に寄与します。大小の気道、または気管支と細気管支は、上皮細胞によって裏打ちされています。これらの領域の主な上皮細胞は、保護分子を分泌し、粘液繊毛クリアランスを促進する役割を担うクラブ細胞と繊毛細胞です1。肺胞は肺の最も遠位の構造であり、肺胞I型細胞(ATI)と肺胞II型細胞(ATI)の2つの上皮細胞タイプが並んでいます。ATIはガス交換を担当し、ATIは適切な表面張力を確保するために界面活性剤を分泌およびリサイクルします2,3。ATIは自己更新型であり、肺の損傷4の後に特に関連する役割であるATIに区別することもできます。さらに、ATIIは、肺胞ニッチに位置する主要な免疫細胞タイプである肺胞マクロファージ(AM)5,6に支持ニッチを提供します。上皮を超えて、線維芽細胞、内皮細胞、および間質性マクロファージ(IM)(神経と血管の両方に関連し得る)が間質7,8,9,10を構成します。感染や損傷に応答して、多数の肺細胞が死滅し、単球や好中球などの免疫細胞が組織に侵入します11,12。肺浸潤性単球はマクロファージに分化し、長期的にマクロファージコンパートメントに寄与することができる13。
マウス肺から単一細胞懸濁液を調製する現在の方法は、一般にコラゲナーゼベースであり、組織の物理的解離を必要とする14。これにより、生存可能な非免疫細胞集団の数が少なくなる可能性があります。上皮細胞を単離するためのいくつかのプロトコルはディスパーゼベースであり、生きた上皮細胞の割合が高くなります。しかし、これらのプロトコルは、一般に免疫細胞の収量および生存率15,16,17を調査しない。フローサイトメトリーは、消化された組織内の細胞集団を区別するために使用される一般的な方法です。ベースラインでは、AM、IM、単球、および好中球のフローサイトメトリーゲーティングが明確に描かれています。しかし、炎症時には、浸潤性単球の表面マーカー発現がマクロファージに分化する連続性のために、ゲーティングプロセスが変動し、解釈が困難になります。したがって、本明細書で提示するプロトコルは、感染後に目的の骨髄細胞集団を同定するためのゲーティング戦略も概説する。
肺上皮細胞と骨髄細胞の強固な解離は、それらの恒常性および炎症性機能を識別するために不可欠です。これらの細胞コンパートメントを並行して単離する方法により、健康を維持し、病気を引き起こす主要な細胞タイプの下流解析が可能になります。このプロトコルのワークフローの概略図の概要を 図1に示します。
プロトコル
このプロトコルは、ハーバード大学医学部の動物管理および使用委員会のガイドラインに準拠しています(助成金番号:R35GM150816およびP30DK043351)。実験には、8-12週齢の雌C57BL/6Jマウスを使用しました。このプロトコルは、雄マウスにも適しています。この研究で使用した試薬と機器の詳細は、 資料表に記載されています。
1. 資料の準備
- ディスパーゼ、リベラーゼ、DNAseなどの必要な酵素を氷上で解凍します。
- 他の必要な試薬を準備します。10 mLシリンジにDPBS中の5 mLの2 mM EDTAを入れ、27 G針で取り付けます。1mLシリンジにDPBSを充填し、カテーテルを取り付けます。
2.肺の収穫
- 400-500 mg/kg および 25-100 mg/kg ケタミン/キシラジン混合物の腹腔内注射によりマウスを安楽死させます (施設で承認されたプロトコルに従います)。マウスがフットパッドのピンチに反応しなくなったら、解剖を続行します (~5 分)。
注:ケタミン/キシラジン混合物は、窒息誘発性出血や免疫細胞の浸潤を防ぐために、二酸化炭素の代わりに安楽死に使用されます。 - マウスに70%エタノールをスプレーします。細かい手術用ハサミと#7鉗子を使用してマウスを解剖します。ハサミで腹部を切開し、腹膜を横方向に切り込みます。
- ダイヤフラムに小さな切り込みを入れて、真空を逃がします。横隔膜と下部胸郭を体腔から切り取り、肺と心臓を露出させます。
- 27 Gの針を取り付けた10 mLのシリンジで、DPBS中の5 mLの2 mM EDTAで肺を ?? 流します。.灌流は、針で心臓の基部に入り、右から左心室に向けられ、注射器18から液体をゆっくりと分配することによって行われる。
注:血管系の破裂を防ぐために、 ?? 流はゆっくりと行う必要があります。. - 胸郭の側面を切り取って胸骨の胸郭を開き、次に胸骨を垂直に切り込んで気管19を露出させます。細いハサミと#7鉗子を使用して、気管や肺に穴を開けずに、できるだけ多くの筋肉と結合組織を切り取ります。
- 気管を縫合糸(サイズ2-0)で包み、締め付けないように締めます。気管を横方向に切り込み、カテーテルを挿入します。縫合糸をしっかりと引っ張って、縫合糸をカテーテルの周りにしっかりと固定します。カテーテルを肺に1cm以上挿入しないでください。
- 1mLのDPBSで肺を膨らませます。シリンジをゆっくりと引き戻して、DPBSを引き出します。同じDPBSで肺を再度膨らませ、もう一度シリンジを引き戻して気管支肺胞洗浄液(BALF)を採取します。
- シリンジをカテーテルから外し、カテーテルを挿入したままにします。BALFを微量遠心チューブに分注します。
- 同じ1 mLシリンジに1 mLのディスパーゼを充填し、カテーテルに再度取り付けます。.ディスパーゼで肺を膨らませるためにシリンジを分注します。カテーテルを抜くときは、気管の周りの縫合糸を締めて、ディパスの漏れを防ぎます。
- 気管を横方向に切り込みます。鉗子を使用して肺と気管を上に引っ張りながら、胸郭の背面に沿って結合組織を切り裂くことにより、体腔から肺を取り出します。
- 肺から心臓を取り除きます。肺を氷上の5mLのDPBSに入れます。
- このステップでは、分離したBALFを取り、400 x g で4°Cで5分間スピンダウンします。 上清は、必要に応じて分注して保存することができます。100 μLのRPMIに再懸濁できる可視セルペレットが存在する必要があります。
注:消化を進めるために最大2時間待つことができ、一度に複数のマウスを収穫することができます。
3.肺の消化
- ダイジェストミックスを準備します。83 μg/mL リベラーゼ (50 μL ストック溶液) と 100 μg/mL DNAse (15 μL ストック溶液) を 3 mL RPMI に肺あたり添加します。
- 肺の5つの葉を解剖し、結合組織19,20を廃棄します。スライドガラスの上でハサミで肺を1分間切り刻みます。
- 解剖はさみを使用して、刻んだ肺を50mLの遠心チューブに移します。BALFから回収し、RPMIに再懸濁した細胞ペレットを遠心分離チューブに加えます。5 mLの血清ピペットを使用して、サンプルの入ったチューブに3 mLの消化物ミックスを加えます。
- 肺消化混合物を上下に2〜3回ピペットで動かします。37°Cで140rpmのオービタルシェーカーに置き、消化チューブを45度の角度で40分間配置します。
4. シングルセル懸濁液の調製
- 50 mLの遠心分離チューブをオービタルシェーカーから取り外し、氷の上に置きます。肺消化混合物を5〜6回上下にピペットで動かします。70 μmのセルストレーナーでろ過し、新しい50 mLチューブに入れます。残った細胞をフィルターで洗浄し、RPMI中の5%FBS液10mLで酵素を中和します。
- 600 x gで5分間、4°Cで遠心します。真空吸引器またはピペットを使用して上清を吸引します。1 mLのACK溶解バッファーに再懸濁し、室温で3分間インキュベートして赤血球(RBC)を溶解します。9mLのPBSを加え、ピペットで上下に動かします。
- 4°C、600 x gで5分間遠心します。真空吸引器またはピペットを使用して上清を吸引します。1 mLのFACSバッファー(PBS中の1% FBS)に再懸濁し、p1000ピペットを使用して64 μmメッシュで微量遠心チューブにろ過します。
5. フローサイトメトリーとダウンストリーム解析
- 96ウェルプレートでフローサイトメトリーまたは蛍光活性化細胞ソーティングを行う場合は、ウェルあたり約1〜200万個の細胞、または肺懸濁液の8%分画を染色します。
- セルをスピンダウンします。96ウェルプレート中のすべてのスピンは、600 x gで2.5分(4°C)実行する必要があります。上清をはじき取り、200 μLのDPBSに再懸濁して細胞を一度洗浄します。スピンダウンしてフリックします。
- フローサイトメトリー解析のために細胞を染色する場合は、以下の染色手順に進みます。
- 25 μLのDPBS中の生/死ゾンビ染色(1:150)およびFcブロック(1:250)中の細胞を、暗所の室温で10分間再懸濁します。
- 抗体染色ミックスをFACSバッファー中で2倍の濃度で調製します。
注:染色混合物には、骨髄パネル(表1)または上皮パネル(表2)のすべてのマーカーを、示された濃度で含める必要があります。 - プレート中の25 μLの肺懸濁液に25 μLの染色ミックスを加え、暗所で氷上で30分間インキュベートします。これで、総染色量は50 μLになり、一次抗体は最終的な1倍の染色濃度になります。
- 150 μLのFACSバッファーを加え、600 x gで4°Cで2.5分間スピンダウンし、上清をフリックオフします。200 μLのFACSバッファーで2回洗浄します。
- 細胞内染色が必要な場合は、細胞内固定キットで細胞を固定します。細胞内染色が不要な場合は、細胞をDPBS中の4%PFAに20分間固定できます。
- 固定液を200μLのFACSバッファーで3回洗い流します。サンプルは、200μLのFACSバッファーに再懸濁し、4°Cの暗所で2〜3日間保存できます。サンプルを泳動する前に、細胞数を定量するためにカウントビーズを添加することができます。
- 細胞を選別する場合は、以下の染色手順に進んでください。
- Fcブロック(1:250)を添加した1x染色抗体ミックスに細胞を再懸濁します。暗闇の中で氷の上で30分間インキュベートします。
- 150 μLのFACSバッファーを加え、600 x gで4°Cで2.5分間スピンダウンし、上清をフリックオフします。200 μLのFACSバッファーで3回洗浄し、ソーティングする前に200 μLのFACSバッファーに再懸濁します。
注:ソーティングする前に、DAPIなどの生存率色素を細胞に添加することをお勧めします。
結果
消化が成功すると、約2,000万〜2,500万個の細胞が得られ、生存率は90%〜95%になります。約25,000個のカウントビーズが肺の8%の割合に追加されると、ビーズは収集されたイベントの1%〜3%を損なうはずです。シングレットでゲーティングした後、細胞の約90%〜95%がZombie Aqua陰性(生存率を示す)になるはずです(図2A、 図3A)。
CD45+細胞のうち、CD64+F4/80+細胞はマクロファージとして定義されます(図2B)。ベースラインでは、肺内のすべてのマクロファージの80%〜90%がAM(Siglec-F + CD11c +)として定義され、残りはIM(Siglec-F-CD11c-)として分類できます(図2C)。しかし、感染や炎症時には、この定義が変わり、IMゲーティングにはIM(Siglec-F-CD11clo/hi)に加えて単球由来マクロファージ(moMac)が含まれるようになります。さらに、感染後9日(dpi)には、その比率はAMが約4%、IM/moMacが約90%にシフトします(図2C)。
CD64-F4/80+の細胞は、Siglec-FおよびLy6Cによってさらにゲーティングできます。Siglec-F+細胞は好酸球です(図2D)。Ly6C+Siglec-F-CD11b+細胞は単球として同定できます(図2D)。CD64とF4/80の両方に陰性の細胞(図2B)は、さらにCD11b+Ly6G+としてゲート化して好中球を同定できます(図2E)。
上皮細胞をゲートするために、まずCD45+細胞をゲートアウトします(図3)。その後、内皮細胞(CD31+)と線維芽細胞(Pdgfra+)を同定することができます(図3B)。その後、EpCAM+であるCD31-Pdgfra-細胞が上皮細胞として同定されます(図3C)。上皮細胞は、さらにATII(MHC-II+CD104-)、気道細胞(クラブおよび繊毛細胞)(CD104+)、およびその他の上皮細胞(MHC-II-CD104-)(図3D)にサブセット化されてもよい。ATII細胞の割合は感染時に減少します。
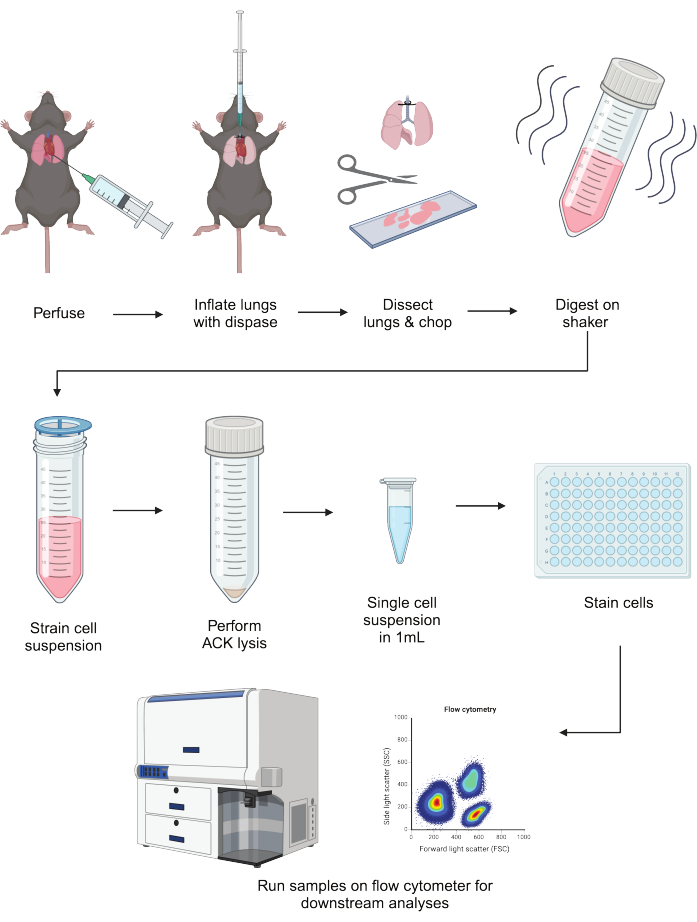
図1:プロトコルの概略図。 マウスの肺を灌流し、ディスパーゼで膨らませ、解剖します。刻んだ後、リベラーゼ/DNAse混合物中で40分間振とうしながら消化します。消化物を細胞ストレーナーに通し、赤血球を溶解します。FACSバッファーに再懸濁した後、フローサイトメトリーなどのダウンストリームアプリケーションの前に細胞をプレーティングおよび染色できます。この図は BioRender を使用して作成されました。この図の拡大版を表示するには、ここをクリックしてください。

図2:骨髄系細胞ゲーティング戦略。インフルエンザA/プエルトリコ/8/34(H1N1)に感染していない、感染後9日、または14日後(dpi)のマウス肺のフローサイトメトリー分析の代表的なゲーティング。(A)生CD45+細胞のゲーティング。(B)CD45+細胞はCD64をF4/80でゲーティングした。(C)CD64+F4/80+細胞(マクロファージ)を、CD11cによるSiglec-Fを用いてAMおよびIM/moMacsにゲート化 (D)CD64-F4/80+細胞を好酸球および単球にgated.(E)好中球を同定するためにゲーティングされたCD64-F4/80-細胞。この図の拡大版を表示するには、ここをクリックしてください。
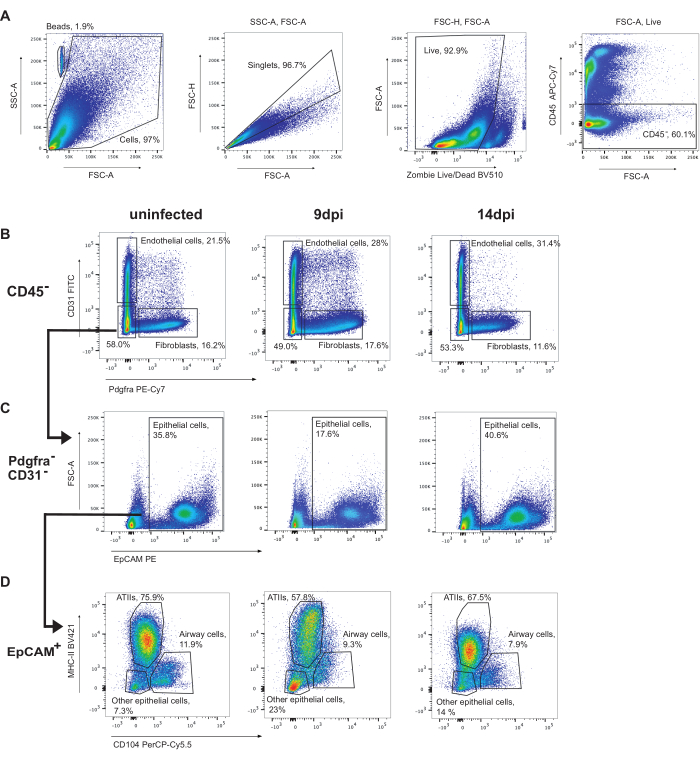
図3:上皮細胞ゲーティング戦略。 インフルエンザA/プエルトリコ/8/34(H1N1)に感染していないマウス肺、9 dpi、または14 dpiのフローサイトメトリー解析の代表的なゲーティング。(A)生CD45-細胞のゲーティング。(B)CD45細胞をCD31(内皮細胞)上にPdgfra(線維芽細胞)によってゲーティング。(C)CD31-Pdgfra-EpCAM+細胞は上皮細胞である。(D)CD104による上皮細胞MHC-IIのゲーティングにより、ATII(MHC-II+、CD104-)、気道上皮細胞(繊毛細胞およびクラブ細胞を含む)(CD104+)、およびその他の上皮細胞(MHC-II-CD104-)が同定されます。この図の拡大版を表示するには、ここをクリックしてください。
| 抗体 | フルオロフォア | 染色濃度 | クローン |
| 抗マウスCD11c | AF-488 | 1:300 | N418さん |
| 抗マウスCD170(Siglec-F) | PEの | 1:200 | 1RNM44N |
| 抗マウスCD45 | BV711 | 1:200 | 30-F11 |
| 抗マウスCD64(FcγRI) | APCの | 1:200 | X54-5/7.1 |
| アンチマウスF4/80 | PE/Cy7 | 1:100 | BM8の |
| 反マウス Ly-6C | BV605 | 1:500 | HK1.4 |
| 反マウス Ly-6G | PerCP/シアニン5.5 | 1:300 | 1A8 |
| 抗マウス/ヒトCD11b | BV421 | 1:800 | M1/70 |
| ライブ/デッドステイン | BV510 | 1:150 | N.A. |
表1:骨髄系パネルの抗体指数。 骨髄系ゲーティング戦略に用いる抗体。
| 抗体 | フルオロフォア | 染色濃度 | クローン |
| 抗マウスCD104 | PerCP/シアニン5.5 | 1:200 | 346-11A |
| 抗マウスCD140a(Pdgfra) | PE/シアニン7 | 1:200 | APA5の |
| 抗マウスCD31 | フィッツ | 1:200 | 390 |
| 抗マウスCD326(Ep-CAM) | PEの | 1:200 | G8.8の |
| 抗マウスCD45 | APC/シアニン7 | 1:200 | 30-F11 |
| アンチマウスI-A/I-E(MHC-II) | BV421 | 1:400 | M5/114.15.2 |
| ライブ/デッドステイン | BV510 | 1:150 | N.A. |
表2:上皮パネルの抗体指数。 上皮ゲーティング戦略に使用される抗体。
ディスカッション
このプロトコルは、マウスあたり約20〜2500万個の細胞を90%〜95%の生存率で分離するマウス肺消化物の概要を示しています。さらに、さらなる分析のためにBALFを収集することもできます。得られた細胞懸濁液は、フローサイトメトリーや蛍光活性化細胞ソーティングなど、複数の実験室技術に適合し、シーケンシングや細胞培養のために細胞を単離します。簡単に言えば、灌流後、BALFが収集され、肺がディスパーゼで膨らみます。次に、肺を切り刻み、リベラーゼ/DNase溶液で消化します。溶解とフィルタリングの後、インフルエンザウイルス感染時の骨髄系および上皮サブセットのフローサイトメトリー分析を含むダウンストリームアプリケーションに進むことができます。
BALFを回収できない場合、および/または肺が適切に膨らんだままでない場合は、カテーテルの配置が正しくないことが原因である可能性があります。カテーテルが気管/気管支に深く留まりすぎると、組織を突き破って腹膜に入る可能性があります。これにより、インフレが不足し、BALFを回収できなくなります。肺が膨らんでいるのに、肺の1つ以上の葉から液体を引き抜くことができない場合、これはカテーテルが1つの気管支に向けられていることが原因である可能性があります。カテーテルを少し外側に引っ張ると、この問題が解決するはずです。循環免疫細胞21からの汚染を除去するためには、十分な灌流が必要である。ひどく損傷した肺では、出血やバリアの完全性の低下により、肺胞が灌流の圧力から破裂しやすくなります22。したがって、肺が損傷したマウスは非常にゆっくりと灌流することが重要です。
以下は、フローサイトメトリー染色のベストプラクティスに関するガイドラインです。骨髄系ゲーティングについては、マクロファージゲート(CD45+CD64+F4/80+)にSiglec-F+CD11c-集団が存在する場合、好酸球による汚染である可能性が高いです。好酸球はPEチャネルとBV605チャネルの両方で自家蛍光性を示すことがわかっているため、これらの蛍光色素と結合したCD64抗体の使用を避けることが重要です。さらに、この消化法では生きたリンパ球を単離することができますが、CD4やCD8などの多くのリンパ球特異的な表面マーカーがその過程で切断されます。その結果、このプロトコルはT細胞集団のフローサイトメトリー分析には適していません。このような場合、コラゲナーゼベースのアプローチがより効果的な代替手段となる可能性があります23,24。
1匹のマウスからの免疫画分と非免疫画分の両方の分析を必要とする多くの実験上の問題があります25,26。例えば、異なる細胞タイプ間の相互作用を研究する場合、個々の動物間の生物学的変動によって発生する可能性のあるアーティファクトを最小限に抑えるために、1匹のマウスから集団を収集して分析することが重要です。さらに、同じ微小環境からの免疫細胞集団と非免疫細胞集団を比較することで、組織のダイナミクスと、恒常性の維持と疾患プロセスの駆動におけるそれらの役割をより完全に理解することができます。
開示事項
著者は何も開示していません。
謝辞
この研究は、国立衛生研究所(R35GM150816およびP30DK043351)、チャールズH.フッド財団、およびハーバード幹細胞研究所からの助成金によって部分的に支援されました。Alexander Mann氏をはじめとするFranklin研究室の全てのメンバーに対し、フローサイトメトリーのゲーティングスキームと解析の設計と改良にご協力いただき、ご助言いただいたことに感謝いたします。また、ハーバード大学医学部のImmunology Flow Cytometry Coreにも感謝しています。フローサイトメトリー解析は、FlowJoを用いて行いました。フィギュアの概略図はBioRenderを使用して作成されました。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe with Slip Tip | VWR | BD309659 | |
| 1.7 mL microcentrifuge tube | DOT Scientific | RN1700-GMT | |
| 10 mL pipettes (disposable) | Fisher Scientific | 12-567-603 | |
| 10 mL Syringe with BD Luer-Lok Tip | VWR | 75846-756 | |
| 123 count eBeads Counting Beads | Thermo Scientific | 01-1234-42 | |
| 12-channel pipette (30-300ul) | USA Scientific | 7112-3300 | |
| 16% paraformaldehyde | VWR | 100503-917 | |
| 23 G needle with regular bevel | VWR | 305194 | |
| 27 G needle with regular bevel | VWR | BD305109 | |
| 5 mL pipettes (disposable) | Thermo Fisher Scientific | 170373 | |
| 50 mL centrifuge tubes | Olympus | 28-108 | |
| 96-well round bottom plate | Corning | 3797 | |
| ACK lysing buffer | Gibco | A100492-01 | |
| Alexa Fluor 488 anti-mouse CD11c | BioLegend | 117311 | |
| Anti-F4/80 Rat Monoclonal Antibody (PE (Phycoerythrin)/Cy7) | BioLegend | 123114 | |
| APC anti-mouse CD64 (FcγRI) | BioLegend | 139306 | |
| APC/Cyanine7 anti-mouse CD45 | BioLegend | 103115 | |
| BD Insyte Autoguard Shielded IV Catheters | VWR | 381423 | |
| Brilliant Violet 421 anti-mouse I-A/I-E (MHC-II) | BioLegend | 107632 | |
| Brilliant Violet 421 anti-mouse/human CD11b | BioLegend | 101235 | |
| Brilliant Violet 605 anti-mouse Ly-6C | BioLegend | 128036 | |
| Brilliant Violet 711 anti-mouse CD45 | BioLegend | 103147 | |
| C57BL/6J mice | Jackson Laboratories | ||
| Cd140a (PDGFRA) Monoclonal Antibody (APA5), PE-Cyanine7, eBioscience | Life Technologies | 25-1401-82 | |
| CD170 (Siglec F) Monoclonal Antibody (1RNM44N), PE | Life Technologies | 12170280 | |
| Cell strainers | Corning | 352350 | |
| Centrifuge | Eppenodorf | Centrifuge 5910R | |
| Deoxyribonuclease I from bovine pancreas (DNase) | Millipore Sigma | DN25-100MG | Reconstituted at 20 mg/mL in DPBS as stock solution stored at -20 °C |
| Dispase | VWR | 76176-668 | Thawed once and stored as 1mL aliquots at -20 °C |
| Dissection forceps (Dumont #7) | Fine Science Tools | 11297-00 | |
| Dissection scissors | Fine Science Tools | 14060-09 | |
| DPBS | Thermo Fisher Scientific | 14190250 | |
| eBioscience fixation kit | Life Technologies | 00-5523-00 | |
| EDTA | Life Technologies | AM9260G | |
| Ethanol | VWR | TX89125170HU | |
| FBS | GeminiBio | 100-106 | Thawed once and heat-inactivated before long-term storage as aliquots at -20 °C |
| FITC anti-mouse CD31 Antibody | BioLegend | 102406 | |
| Gibco RPMI 1640 Medium | Fisher Scientific | 11-875-093 | |
| Glass slides | Fisher Scientific | 12-552-3 | |
| graduated reservoir | USA Scientific | 1930-2235 | |
| Ice bucket | Corning | 432128 | |
| Ketamine hydrocholoride injection (100 mg/mL) | Dechra | Ketamine and xyalazine euthanization mixture can be kept at 30 mg/mL ketamine hydrochloride and 4.5mg/mL xylazine in sterile DPBS for up to one month. | |
| Liberase | Millipore Sigma | 5401119001 | Reconstituted at 5 mg/mL in DPBS as stock solution stored at -20 °C |
| Lids for 96-well plates | Fisher Scientific | 07-201-731 | |
| Orbital Incubator Shaker | Barnstead Lab-Line | SHKE4000 | |
| p1000 pipette | Eppenodorf | 3123000063 | |
| p1000 tips | USA Scientific | 1122-1830 | |
| p200 pipette | Eppenodorf | 3123000055 | |
| p200 tips | USA Scientific | 1110-1700 | |
| PE anti-mouse CD326 (Ep-CAM) | BioLegend | 118206 | |
| PerCP/Cyanine5.5 anti-mouse CD104 Antibody | BioLegend | 123614 | |
| PerCP/Cyanine5.5 anti-mouse Ly-6G | BioLegend | 127616 | |
| Pipet-Aid | Drummond | 4-000-101 | |
| Purified anti-mouse CD16/32 | BioLegend | 101302 | Referred to as "Fc block" in text |
| Spray bottle | VWR | 23609-182 | |
| Suture (Size 2-0) | VWR | 100190-026 | |
| Underpads | VWR | 56617-014 | |
| Xysed (xylazine 100mg/mL) | Pivetal | See ketamine hydrocholoride notes above. | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
参考文献
- Wanner, A., Salathé, M., O'Riordan, T. G. Mucociliary clearance in the airways. Am J Respir Crit Care Med. 154 (6), 1868-1902 (1996).
- Mason, R. J., Williams, M. C. Type II alveolar cell. Defender of the alveolus. Am Rev Respir Dis. 115 (1), 81-91 (1977).
- Fehrenbach, H. Alveolar epithelial type II cell: defender of the alveolus revisited. Respir Res. 2 (1), 33-46 (2001).
- Basil, M. C., Alysandratos, K. -. D., Kotton, D. N., Morrisey, E. E. Lung repair and regeneration: Advanced models and insights into human disease. Cell Stem Cell. 31 (4), 439-454 (2024).
- Hussell, T., Bell, T. J. Alveolar macrophages: plasticity in a tissue-specific context. Nat Rev Immunol. 14 (2), 81-93 (2014).
- Gschwend, J., et al. Alveolar macrophages rely on GM-CSF from alveolar epithelial type 2 cells before and after birth. J Exp Med. 218 (1), e20210745 (2021).
- Gillich, A., et al. Capillary cell-type specialization in the alveolus. Nature. 586 (7831), 785-789 (2020).
- Schyns, J., et al. Non-classical tissue monocytes and two functionally distinct populations of interstitial macrophages populate the mouse lung. Nat Commun. 10 (1), 3964 (2019).
- Chakarov, S., et al. Two distinct interstitial macrophage populations coexist across tissues in specific subtissular niches. Science. 363 (6432), eaat3773 (2019).
- Tsukui, T., et al. Collagen-producing lung cell atlas identifies multiple subsets with distinct localization and relevance to fibrosis. Nat Commun. 11 (1), 1920 (1920).
- Aegerter, H., et al. Influenza-induced monocyte-derived alveolar macrophages confer prolonged antibacterial protection. Nat Immunol. 21 (2), 145-157 (2020).
- Johansson, C., Kirsebom, F. C. M. Neutrophils in respiratory viral infections. Mucosal Immunol. 14 (4), 815-827 (2021).
- Li, F., et al. Monocyte-derived alveolar macrophages autonomously determine severe outcome of respiratory viral infection. Sci Immunol. 7 (71), eabj5761 (2022).
- Moll, H. P., et al. Orthotopic transplantation of syngeneic lung adenocarcinoma cells to study PD-L1 expression. J Vis Exp. (143), e58101 (2019).
- Warshamana, G. S., Corti, M., Brody, A. R. TNF-α, PDGF, TGF-β1 expression by primary mouse bronchiolar-alveolar epithelial and mesenchymal cells: TNF-α induces TGF-β1. Exp Mol Pathol. 71 (1), 13-33 (2001).
- Corti, M., Brody, A. R., Harrison, J. H. Isolation and primary culture of murine alveolar type II cells. Am J Respir Cell Mol Biol. 14 (3), 309-315 (1996).
- Quantius, J., et al. Influenza virus infects epithelial stem/progenitor cells of the distal lung: Impact on Fgfr2b-driven epithelial repair. PLoS Pathog. 12 (5), e1005544 (2016).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. BIO Protoc. 11 (8), e3988 (2021).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Bijgaart, R. J. E., van den Kong, N., Maynard, C., Plaks, V. Ex vivo live imaging of lung metastasis and their microenvironment. J Vis Exp. (108), e53741 (2016).
- Shi, W., et al. Isolation and purification of immune cells from the liver. Int Immunopharmacol. 85, 106632 (2020).
- Short, K. R., et al. Influenza virus damages the alveolar barrier by disrupting epithelial cell tight junctions. Eur Respir J. 47 (3), 954-966 (2016).
- Laidlaw, B. J., et al. CD4+ T cell help guides formation of CD103+ lung-resident memory CD8+ T cells during influenza viral infection. Immunity. 41 (4), 633-645 (2014).
- D'Agostino, M. R., et al. Protocol for isolation and characterization of lung tissue-resident memory T cells and airway-trained innate immunity after intranasal vaccination in mice. STAR Protoc. 3 (2), 101652 (2022).
- Waal, A. M., de Hiemstra, P. S., Ottenhoff, T. H., Joosten, S. A., vander Does, A. M. Lung epithelial cells interact with immune cells and bacteria to shape the microenvironment in tuberculosis. Thorax. 77 (4), 408-416 (2022).
- Bhattacharya, J., Westphalen, K. Macrophage-epithelial interactions in pulmonary alveoli. Semin Immunopathol. 38 (4), 461-469 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved