Method Article
Трехмерная клеточная культура стволовых клеток жировой ткани в гидрогеле с фотобиомодуляционной аугментацией
В этой статье
Резюме
Здесь мы представляем протокол, демонстрирующий использование гидрогеля в качестве трехмерного (3D) каркаса клеточной культуры для культивирования стволовых клеток жировой ткани (ADSC) и внедрение фотобиомодуляции (PBM) для усиления пролиферации ADSC в условиях 3D-культуры.
Аннотация
Стволовые клетки, полученные из жировой ткани (ADSC), обладающие мультипотентными мезенхимальными характеристиками, близкими к стволовым клеткам, часто используются в регенеративной медицине из-за их способности к разнообразному диапазону клеточной дифференцировки и их способности усиливать миграцию, пролиферацию и смягчать воспаление. Тем не менее, ADSC часто сталкиваются с проблемами выживания и приживления в ранах, в первую очередь из-за неблагоприятных воспалительных условий. Для решения этой проблемы были разработаны гидрогели для поддержания жизнеспособности ADSC в ранах и ускорения процесса заживления ран. В данной работе мы поставили перед собой цель оценить синергетическое влияние фотобиомодуляции (ФБМ) на пролиферацию и цитотоксичность ADSC в рамках 3D-клеточной культуры. Иммортализированные АЦП высевали в гидрогели по 10 мкл плотностью 2,5 х 103 клетки и подвергали облучению с использованием диодов 525 нм и 825 нм при флюенциях 5 Дж/см2 и 10 Дж/см2. Морфологические изменения, цитотоксичность и пролиферацию оценивали через 24 ч и 10 дней после воздействия ПБМ. ADSC имели округлую морфологию и были рассеяны по всему гелю в виде отдельных клеток или сфероидных агрегатов. Важно отметить, что как PBM, так и 3D-культуральный каркас не оказывали цитотоксического воздействия на клетки, в то время как PBM значительно увеличивал скорость пролиферации ADSC. В заключение, это исследование демонстрирует использование гидрогеля в качестве подходящей 3D-среды для культуры ADSC и представляет PBM в качестве важной стратегии аугментации, в частности, для решения проблемы медленной скорости пролиферации, связанной с 3D-культурой клеток.
Введение
ADSC представляют собой мезенхимальные мультипотентные клетки-предшественники, обладающие способностью к самообновлению и дифференцировке в несколько клеточных линий. Эти клетки могут быть получены из стромально-васкулярной фракции (SVF) жировой ткани во время процедуры липоаспирации1. ADSC стали идеальным типом стволовых клеток для использования в регенеративной медицине, потому что эти клетки многочисленны, минимально инвазивны для сбора, легко доступны и хорошо охарактеризованы2. Терапия стволовыми клетками предлагает возможный путь к заживлению ран путем стимуляции миграции клеток, пролиферации, неоваскуляризации и уменьшения воспаления в ранах 3,4. Примерно 80% регенеративной способности ADSC связано с паракринной сигнализацией через их секретом5. Ранее предполагалось, что прямая местная инъекция стволовых клеток или факторов роста в поврежденную ткань может привести к возникновению достаточных механизмов репарации in vivo 6,7,8. Однако этот подход столкнулся с рядом проблем, таких как низкая выживаемость и снижение приживления стволовых клеток в поврежденных тканях в результате воспалительной среды 9. Кроме того, одной из названных причин было отсутствие внеклеточного матрикса для поддержки выживания и функциональности трансплантированныхклеток. Для преодоления этих проблем в настоящее время особое внимание уделяется разработке носителей биоматериала для поддержания жизнеспособности и функционирования стволовых клеток.
Трехмерная (3D) клеточная культура усиливает межклеточное и межматричное взаимодействие in vitro, обеспечивая среду, которая лучше напоминает среду in vivo 11. Гидрогели были широко изучены как класс носителей биоматериала, которые обеспечивают 3D-среду для культуры стволовых клеток. Эти структуры состоят из воды и сшитых полимеров12. Инкапсуляция АДСК в гидрогель практически не оказывает цитотоксического действия на клетки в процессе культивирования при сохранении жизнеспособности клеток6. Стволовые клетки, культивируемые в 3D, демонстрируют улучшенное сохранение своей стволовой способности и улучшенную способность к дифференцировке13. Аналогичным образом, засеянные гидрогелем ADSC продемонстрировали повышенную жизнеспособность и ускоренное закрытие ран на животных моделях14. Кроме того, гидрогелевая инкапсуляция значительно увеличивает приживление и удержание ADSC в ранах15,16. TrueGel3D изготавливается из полимера, поливинилового спирта или декстрана, затвердевающего сшивающим агентом, циклодекстрином или полиэтиленгликолем17. Гель представляет собой синтетический гидрогель, который не содержит каких-либо продуктов животного происхождения, которые могут помешать экспериментам или вызвать иммунную реакцию во время трансплантации геля пациенту, эффективно имитируя внеклеточный матрикс18. Гель полностью настраивается путем изменения состава и отдельных компонентов. Он может содержать различные стволовые клетки и поддерживать дифференцировку нескольких типов клеток, регулируя жесткость геля19. Сайты прикрепления могут быть созданы путем добавления пептидов20. Гель расщепляется за счет секреции металлопротеаз, что позволяет осуществлять миграцию клеток21. Наконец, он понятен и позволяет использовать методы визуализации.
ПБМ – это минимально инвазивная и легко выполняемая форма низкоуровневой лазерной терапии, используемая для стимуляции внутриклеточных хромофоров. Различные длины волн вызывают различное воздействие на клетки22. Свет в диапазоне от красного до ближнего инфракрасного стимулирует повышенную продукцию аденозинтрифосфата (АТФ) и активных форм кислорода (АФК) за счет усиления потока через цепь переноса электронов23. Свет в синем и зеленом диапазонах стимулирует светозависимые ионные каналы, обеспечивая неспецифический приток катионов, таких как кальций и магний, в клетки, что, как известно, усиливает дифференцировку. Конечным эффектом является генерация вторичных мессенджеров, которые стимулируют транскрипцию факторов, запускающих последующие клеточные процессы, такие как миграция, пролиферация и дифференцировка. PBM может быть использован для предварительной подготовки клеток к пролиферации или дифференцировке перед трансплантацией клеток в неблагоприятную среду, например, в поврежденную ткань26. До и после трансплантации ПБМ (630 нм и 810 нм) воздействие ADSC значительно повышало жизнеспособность и функцию этих клеток in vivo у крыс с диабетом модели27. Регенеративная медицина требует достаточного количества клеток для эффективного восстановления тканей28. В 3D-культуре клеток ADSC ассоциировались с более медленными темпами пролиферации по сравнению с двумерными клеточными культурами6. Тем не менее, PBM может быть использован для расширения процесса 3D-культивирования клеток ADSC за счет повышения жизнеспособности, пролиферации, миграции и дифференцировки29,30.
протокол
ПРИМЕЧАНИЕ: См. Таблицу материалов для получения подробной информации, относящейся ко всем материалам, реагентам и программному обеспечению, используемым в этом протоколе. Протокол графически представлен на рисунке 1.
1. Двумерная (2D) клеточная культура
ПРИМЕЧАНИЕ: Иммортализированные ADSC (1 x106 клеток) хранятся при температуре -195,8 °C в жидком азоте в криоконсервационном флаконе, содержащем 1 мл среды для замораживания клеток.
- Подготовка 2D-среды для восстановления клеток и 2D-колбы для культивирования
- Перелейте 39 мл базальной среды в центрифужную пробирку объемом 50 мл
- Обогащают базальную среду 20% фетальной бычьей сывороткой (FBS; 10 мл) и антибиотиками (1 мл) (0,5 мл пенициллина-стрептомицина и 0,5 мл амфотерицина В).
- Предварительно подготовьте колбу T75, переложив в колбу 6 мл среды для регенерации клеток, и инкубируйте ее при температуре 37 °C, 5%CO2 и влажности 85% в течение 45 минут (это можно сделать во время выполнения этапов восстановления клеток для экономии времени).
ПРИМЕЧАНИЕ: Перед использованием нагрейте всю среду до 37 °C и храните ее при температуре 4 °C не более 1 недели.
- Восстановление 2D-клеток
- Извлеките криовиал из резервуара для хранения жидкого азота и быстро разморозьте флакон на водяной бане при температуре 37 °C, пока он полностью не разморозится.
- Открутите криовиал с помощью центрифуги при 1006 x g в течение 5 минут (20 °C), а затем удалите надосадочную жидкость.
- Ресуспендируйте гранулированные ячейки, используя 1 мл предварительно нагретой среды для регенерации клеток.
- Равномерно распределите взвешенные клетки в предварительно кондиционированной колбе (окончательный объем 7 мл) и инкубируйте при 37 °C, 5%CO2 и влажности 85%.
- Через 24 ч утилизируйте и замените питательную среду для регенерации ячейки.
- Заменяйте питательную среду каждые 2-3 дня до тех пор, пока колба не станет сливаться с клетками.
- Сбор 2D-колб для культуры в одноклеточной суспензии и количество клеток
- Извлеките колбу для 2D-культуры из инкубатора и выбросьте питательную среду в соответствующий контейнер для отходов.
- Перелейте 10 мл промывочного раствора в колбу, чтобы промыть клетки и удалить отходы и скопления белка. После этого раствор для полоскания выбросьте.
- Добавьте 6 мл раствора для отслоения в колбу для культивирования, чтобы отделить клетки. Инкубируйте колбу при температуре 37 °C, 5%CO2 и влажности 85% в течение 2 минут.
ПРИМЕЧАНИЕ: Осмотрите колбу под микроскопом, чтобы убедиться, что все клетки были отделены. Если нет, аккуратно постучите по колбе и выдержите еще минуту. - После того, как все клетки будут отделены, перенесите клеточную суспензию в центрифужную пробирку объемом 15 мл и добавьте в пробирку 1 мл среды для восстановления клеток (содержащей 20% FBS). Это позволит нейтрализовать действие раствора для отслоения.
- Центрифугируйте пробирку в течение 5 мин при 1711 x g (20 °C).
- Удалите надосадочную жидкость и ресуспендируйте клетки в 1 мл полной среды.
- Удалите 10 мкл клеточной суспензии, поместите ее в микроцентрифужную пробирку объемом 500 мкл и смешайте с 10 мкл трипанового синего в соотношении 1:1.
- Поместите 10 мкл смеси раствора трипановых синих клеток в камеру для подсчета клеток в двух экземплярах.
- Поместите камеру для подсчета клеток в автоматический счетчик клеток. Счетчик клеток покажет общее количество клеток на мл, а также количество жизнеспособных и мертвых клеток. Рассчитайте среднее количество жизнеспособных клеток и количество жизнеспособных клеток, которые необходимо внедрить в 3D-гидрогель (шаг 2.2.6).
2. 3D культуре клеток
- Подготовка 3D-среды для культивирования
- Перелейте 44 мл базальной среды в центрифужную пробирку объемом 50 мл.
- Обогащают среду 10% ФБС (5 мл) и антибиотиками (1 мл) (0,5 мл пенициллина-стрептомицина и 0,5 мл амфотерицина В).
ПРИМЕЧАНИЕ: Перед использованием нагрейте весь носитель до 37 °C и храните его при температуре 4 °C не более одной недели.
- Приготовление гидрогеля
- Приготовьте быстрый декстран центрифугированием (1000 x g в течение 30 с при 20 °C) флакон с быстрым декстраном для концентрирования материала. Добавьте 175 мкл воды во флакон с быстрым декстраном, чтобы получить концентрацию 30 ммоль/л реактивных групп.
- Вкрутите пробирку (со средней скоростью в течение 30 с), содержащую раствор быстрого декстрана, до полного растворения материала. Инкубируйте растворенный материал на льду в течение 5 мин. Центрифугируйте пробирку, кратковременно встряхните ее и держите на льду во время дальнейшего использования.
- Центрифугируйте сшиватель (1000 x g в течение 30 с при 20 °C) для концентрирования материала. Добавьте 188 мкл воды во флакон сшивающего агента, чтобы получить концентрацию тиоловых групп 20 ммоль/л.
- Вкрутите пробирку (со средней скоростью в течение 30 с), содержащую раствор сшивателя, до тех пор, пока весь материал не растворится. Инкубируйте растворенный сшиватель при комнатной температуре (RT) в течение 5 мин. Центрифугируйте пробирку, ненадолго встряхните и удерживайте ее на RT во время дальнейшего использования.
- Адаптируйте протокол гидрогеля с 30 мкл до 10 мкл для снижения затрат (см. Таблицу 1 для получения более подробной информации).
- Приготовьте клеточную суспензию для достижения плотности посева 2,5 x 10,3 клетки на 10 мкл гидрогеля.
- Объедините компоненты в соответствии с таблицей 1 , чтобы создать мастер-микс. Перелейте 9 мкл мастер-смеси в лунку в 96-луночном планшете.
- Гель затвердеть, добавив 1 мкл разлагаемого сшивателя через 3 минуты после переноса мастер-смеси.
- Накройте гидрогели предварительно нагретой питательной средой объемом 170 мкл. Выдерживают в течение 1 ч. Через 1 ч замените питательную среду.
ПРИМЕЧАНИЕ: Клетки, внедренные в гидрогель, готовы к дальнейшим экспериментам или анализу в системе 3D-культивирования. Следуйте дополнительным протоколам по мере необходимости для последующих приложений.
3. Фотобиомодуляционное воздействие
- Настройка лазера
- Настройте диодную лазерную систему на зеленую (525 нм) или ближнюю инфракрасную (825 нм) длину волны. Включите лазеры и дайте им прогреться в течение рекомендуемого времени.
- Стабилизируйте выходную мощность лазеров, позволив им достичь устойчивого состояния. Это обеспечивает последовательное и точное облучение.
- Измерьте выходную мощность лазеров с помощью измерителя мощности лазера. Запишите значения мощности для каждой длины волны.
- Используйте уравнение 1 (Время лазерного облучения) для расчета времени лазерного облучения. Подставьте значения из таблицы 2 в уравнение 1, чтобы определить подходящее время облучения для каждой текучести. В уравнении 1 "r" представляет собой радиус зоны облучения лазера.

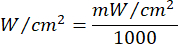

Уравнение 1 - В таблице 2 приведены конкретные параметры, необходимые для расчета, включая плавность (5 Дж/см² или 10 Дж/см²) и выходную мощность лазера.
- Облучение 3D-клеточных культур
- После полной замены носителя (шаг 2.2.9) поместите 96-луночную пластину с элементами, внедренными гидрогелем, под диодную лазерную систему. Облучают гидрогели с расчетным временем лазерного облучения для выбранной текучести (5 Дж/см² или 10 Дж/см²) на выбранной длине волны (зеленой или ближней инфракрасной). Поэтому культуры получат только одну дозу.
- Убедитесь, что каждая экспериментальная группа сопровождается контролем (n = 4), состоящим из АДСК, встроенных в гидрогель без воздействия ПБМ.
ПРИМЕЧАНИЕ: Всегда надевайте защитные очки, соответствующие длине волны света, с которой вы работаете. Лазеры используются вне защитного шкафа; Таким образом, крайне важно продезинфицировать область перед использованием. - Инкубируйте культуральные планшеты при температуре 37 °C, 5%CO2 и влажности 85% в течение всего эксперимента. Инкубируют планшеты в течение 24 ч для первого анализа или 10 дней для второго периода анализа, после облучения.
4. Морфология
- Микроскопия в инвертированном свете
- Включите микроскоп инвертированного света и дайте ему прогреться в течение нескольких минут. Убедитесь, что микроскоп правильно выровнен и откалиброван.
- Подготовьте образец для наблюдения на предметном стекле микроскопа или специализированной чашке для клеточных культур, в зависимости от экспериментальной установки. Откалибруйте микроскоп для получения оптимальных условий визуализации.
- При необходимости отрегулируйте параметры фокусировки, яркости и контрастности. Выберите объектив с 20-кратным увеличением на микроскопе для наблюдения и записи морфологии клеток.
- Поместите образец на предметный столик микроскопа и сосредоточьтесь на интересующих клетках с помощью окуляра. С помощью окуляра или камеры наблюдайте и записывайте морфологию клеток. Обратите внимание на форму, размер ячейки и любые отличительные особенности.
- Прикрепите модуль камеры к микроскопу. Настройте камеру для получения цифровых изображений. Обеспечьте правильное соединение и связь между камерой и микроскопом.
- Используя объектив с 20-кратным увеличением, сделайте цифровые снимки наблюдаемых клеток. Используйте элементы управления камерой для регулировки экспозиции, фокусировки и других важных параметров.
ПРИМЕЧАНИЕ: Убедитесь, что полученные изображения имеют высокое качество и дают репрезентативное представление о морфологии клеток. - Запустите программное обеспечение для работы с изображениями на компьютере. Сделайте снимок и используйте инструменты анализа в программном обеспечении для анализа морфологии клеток.
- Измеряйте размеры ячеек, подсчитывайте количество ячеек или выполняйте любой соответствующий анализ на основе целей эксперимента.
- Добавьте соответствующую масштабную линейку к изображениям с помощью программного обеспечения. Используйте известное увеличение объектива микроскопа, чтобы точно представить масштаб изображений.
5. Биохимические анализы
- Восстановление клеток
ПРИМЕЧАНИЕ: Клетки должны быть извлечены из гидрогеля в виде одноклеточной суспензии для дальнейшего биохимического анализа.- Приготовьте ферментативный раствор для восстановления клеток. В стерильной среде приготовьте рабочий раствор, разбавив ферментативный раствор для восстановления клеток фосфатно-солевым буфером (PBS) в соотношении 1:20 (Solution: PBS). Если требуется извлечение клеток из определенного количества гелей или лунок, рассчитайте общий требуемый объем из расчета 30 мкл раствора для восстановления на гель.
- Добавьте 30 мкл рабочего раствора в каждый гель или лунку, содержащую клетки, нуждающиеся в восстановлении. Обеспечьте тщательное и равномерное распределение раствора для восстановления, осторожно покачивая или вращая пластину. Инкубируйте планшет с восстановительным раствором в соответствии с рекомендуемым временем инкубации. Эту информацию обычно можно найти в техническом описании продукта или протоколе, предоставленном поставщиком.
- После инкубационного периода аккуратно извлеките пластину из инкубатора. Центрифугируйте планшеты при 1409 x g в течение 5 минут (20 °C), чтобы гранулировать клетки. Рекомендуемые условия центрифугирования см. в техническом описании продукта или протоколе. После завершения центрифугирования осторожно выбросьте надосадочную жидкость, стараясь не повредить гранулы клетки.
- Аккуратно ресуспендируйте гранулированные клетки в 220 мкл стерильного PBS. Обеспечьте тщательное перемешивание для получения однородной одноячеистой суспензии. Теперь клетки готовы к последующему биохимическому анализу. Следуйте конкретным протоколам для предполагаемых анализов, учитывая природу извлеченных клеток и требования экспериментальной установки.
- Анализ на цитотоксичность лактатдегидрогеназы (ЛДГ)
- Для каждой лунки осторожно удаляют 50 мкл полной питательной среды, обеспечивая минимальное воздействие на клеточный слой.
- Добавляют 50 мкл реагента цитотоксичности непосредственно в каждую лунку, содержащую оставшиеся 50 мкл питательной среды. Осторожно перемешайте, пипетируя вверх и вниз, чтобы обеспечить тщательное перемешивание образца с реагентом.
- Подготовьте положительный контроль. Установите тройные лунки с 5 мкл 10-кратного раствора лизиса на 50 мкл положительных контрольных ячеек, входящих в комплект.
- Инкубируйте планшет при рекомендуемой температуре и продолжительности. Этот этап позволяет реагенту цитотоксичности лизировать клетки и высвобождать ЛДГ в питательную среду.
- После инкубационного периода добавляют по 50 мкл стоп-раствора непосредственно в каждую лунку, содержащую реагент цитотоксичности и клеточный лизат. Осторожно перемешайте, пипетируя вверх и вниз, чтобы обеспечить надлежащую остановку реакции.
ПРИМЕЧАНИЕ: Стоп-раствор останавливает дальнейшее высвобождение ЛДГ и обеспечивает стабильность развития цвета. - Настройте считыватель спектрофотометрических пластин в соответствии с инструкциями производителя. Запишите поглощение каждой лунки на длине волны 490 нм. Эта длина волны специфична для колориметрического обнаружения продукта формазана, образующегося в результате реакции ЛДГ.
- Вычитание показаний фонового поглощения как из групп обработки, так и из контрольных скважин. Получение фоновых показаний из скважин, содержащих среды и реагенты цитотоксичности без клеток.
- Проанализируйте скорректированные значения абсорбции для каждого образца, чтобы определить уровень цитотоксичности. Более высокие значения абсорбции указывают на повышенное высвобождение ЛДГ и, следовательно, на более высокую цитотоксичность.
- Убедитесь, что каждая экспериментальная группа и контрольная группа состояла из четырех повторов (шаг 3.2.2) для статистической точности. Рассчитайте и импортируйте среднюю абсорбцию каждой группы и контроля в соответствующую статистическую программу.
- Сравните результаты между группами лечения и соответствующими контрольными группами, чтобы точно оценить цитотоксические эффекты и записать все показания абсорбции, расчеты и условия эксперимента для использования в будущем.
- Анализ на пролиферацию АТФ
- В стерильной среде смешайте 50 мкл восстановленных клеток с 50 мкл реагента АТФ в каждой лунке.
ПРИМЕЧАНИЕ: Регулируйте объем ячеек и реагентов в зависимости от количества лунок и плана эксперимента. Поддерживайте стабильные соотношения для получения точных результатов. - Поставьте тарелку на шейкер и энергично встряхивайте в темноте в течение 5 минут. Этот этап обеспечивает тщательное перемешивание клеток с реагентом. После встряхивания инкубируйте планшет еще 25 мин при РТ. Этот инкубационный период позволяет реагенту лизировать клетки и генерировать люминесцентный сигнал, пропорциональный количеству присутствующей АТФ.
- Настройте считыватель пластин в соответствии с инструкциями производителя для обнаружения люминесценции. Измерьте люминесценцию из каждой лунки, содержащей клеточный лизат и реагент АТФ. Убедитесь, что считыватель пластин настроен на измерение люминесценции с соответствующими настройками.
- Вычитание показаний фоновой люминесценции как из групп обработки, так и из контрольных скважин. Получение фоновых показаний из скважин, содержащих только реагент АТФ и PBS без ячеек.
- Проанализируйте скорректированные значения люминесценции для каждого образца, чтобы определить уровень АТФ, отражающий пролиферацию или жизнеспособность клеток.
- Убедитесь, что каждая экспериментальная группа и контрольная группа состояла из четырех повторов (шаг 3.2.2) для статистической точности. Рассчитать и импортировать среднюю люминесценцию каждой группы и контроля в соответствующую статистическую программу.
- Сравните результаты между группами лечения и соответствующими контрольными группами, чтобы точно оценить пролиферацию АТФ. Записывайте все показания люминесценции, расчеты и условия эксперимента для использования в будущем.
ПРИМЕЧАНИЕ: Для всех биохимических анализов в форме набора следуйте руководству или протоколу набора, предоставленному производителем, для получения конкретных деталей, таких как рекомендуемое время инкубации, концентрации и любые дополнительные шаги или соображения. Всегда соблюдайте правила техники безопасности при работе с химическими веществами и биологическими материалами.
- В стерильной среде смешайте 50 мкл восстановленных клеток с 50 мкл реагента АТФ в каждой лунке.
Результаты
Для оценки морфологии и визуального осмотра плотности клеток гидрогелей использовали обратную микроскопию (рис. 2). ADSC сохраняли округлую морфологию через 24 ч после посева и воздействия PBM. Клетки были разбросаны по всему гелю в виде одиночных клеток или в виноградоподобных кластерах. Морфология не изменялась через 10 дней в 3D-культуре. Не было отмечено окончательных различий в морфологии между экспериментальными и контрольными группами, а также между различными экспериментальными группами.
Для оценки цитотоксических эффектов воздействия ПБМ и 3D-культивирования с использованием гидрогеля измеряли утечку ЛДГ (рис. 3). Не было существенных различий между экспериментальными группами и контрольной группой через 24 ч или 10 дней, что указывает на то, что воздействие ПБМ и культивирование гидрогеля не оказывали вредного влияния на клетки.
Скорость клеточной пролиферации измеряли путем измерения содержания АТФ в ADSC (рис. 4). Воздействие ПБМ приводило к увеличению скорости пролиферации во всех экспериментальных группах по сравнению с контрольной группой. При 24-часовом воздействии после ПБМ длина волны 525 нм стимулировала самые высокие скорости пролиферации. Однако на 10-дневной отметке длина волны 825 нм продемонстрировала более высокую скорость пролиферации по сравнению с длиной волны 525 нм. В конце 10-дневного периода культивирования группа с длиной волны 825 нм, 10 Дж/см2 показала самую высокую скорость пролиферации.

Рисунок 1: Обзор протокола. Обобщенный протокол, в котором рассказывается о приготовлении гидрогеля в 96-луночных планшетах, экспозиции ПБМ, а также измерении морфологических и биохимических анализов через 24 ч и 10 дней после воздействия ПБМ. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: ADSC, самоагрегированные после посева. Клетки сохраняли морфологию от круглой до овальной формы и распределялись в гидрогеле либо в виде одиночных клеток, либо в виде агрегатов с виноградоподобным кластером через (A) 24 ч и (B) 10 дней после посева и воздействия PBM. После 10 дней инкубации окончательных изменений не наблюдалось. При использовании контрольных элементов (1 и 4) 525 нм при 5 Дж/см2 (2) и 10 Дж/см2 (5) или 825 нм при 5 Дж/см2 (3) и 10 Дж/см2 (6) соответственно. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3: Клеточная утечка ЛДГ как измерение цитотоксичности через 24 ч и 10 дней после воздействия ПБМ с использованием диода 525 нм и 825 нм (5 Дж/см2 и 10 Дж/см2) в гидрогеле. Существенного увеличения цитотоксичности по сравнению с экспериментальным контролем не наблюдалось. Положительный контроль был репрезентативным для полной гибели клеток. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4: Клеточное измерение АТФ через 24 ч и 10 дней после воздействия ПБМ с использованием диода 525 нм и 825 нм (5 Дж/см2 и 10 Дж/см2) в гидрогеле. Воздействие ПБМ стимулировало увеличение скорости пролиферации во всех экспериментальных группах в обоих временных точках и в обоих временных точках. Значимые различия (P < 0,001) обозначены ***. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| Компонент | Объем (мкл) на лунку |
| Полимер SLO-декстран (30 ммоль/л) | 0.7 |
| Клеточная суспензия | 2 |
| Буфер | 0.8 |
| Вода | 5.5 |
| Сшиватель | 1 |
| Общий объем | 10 |
Таблица 1: Объемы гидрогелевых (10 мкл) реагентов.
| Параметры лазера | Зеленый (G) | Ближний инфракрасный диапазон (NIR) |
| Источник света | Диодный лазер | Диодный лазер |
| Длина волны (нм) | 525 | 825 |
| Выходная мощность (мВт) | 553 | 515 |
| Удельная мощность (мВт/см2) | 57.48 | 53.53 |
Таблица 2: Параметры лазера.
Обсуждение
ADSC являются идеальным типом клеток для использования в регенеративной медицине, поскольку они стимулируют различные процессы, способствуя заживлению ран 3,4. Тем не менее, существует ряд проблем, которые необходимо обойти, например, низкая выживаемость и неэффективное приживление клеток в месте повреждения9. Иммортализированные клетки использовались в качестве коммерчески доступной клеточной линии, поскольку они могут пассировать в течение большего количества поколений по сравнению с первичными клетками, их не нужно собирать, они хорошо охарактеризованы и представляют собой однородные популяции, обеспечивающие стабильные результаты31. Целью данного исследования было определение аугментативного потенциала PBM на пролиферацию и цитотоксичность ADSC с использованием 3D клеточной культуры. Протокол производителя для гидрогеля объемом 30 мкл был адаптирован к гидрогелю объемом 10 мкл для экономиизатрат 32. Однако этот уменьшенный объем усложнил приготовление и обращение с гелем.
Было показано, что ADSC самоагрегируются в 3D-среде33. Точно так же в этом исследовании клетки образовывали клеточные агрегаты с виноградоподобным видом. Тем не менее, были выявлены и однояйцекладочные клетки. Линька клеток является известным свойством сфероидов, при котором клетки отделяются от основного сфероида или агрегатного тела и высвобождаются в культуральную среду. Линька клеток может быть результатом клеточной пролиферации, при которой жизнеспособные клетки высвобождаются во время митоза и обеспечивают миграцию34. С другой стороны, линька может произойти из-за гибели клеток и потери сфероида или агрегатаформы 35, особенно у очень больших сфероидов из-за растущего некротического ядра. Клетки приняли округлую морфологию в 3D-культуре по сравнению с веретенообразной формой в 2D-культурах. В соответствии с результатами аналогичных исследований, эти результаты обусловлены отсутствием сайтов прикрепления или внеклеточного матрикса, к которому клетки могли бы прилипнуть 6,9. Кроме того, клетки не показали значительной миграции в геле, что также указывает на необходимость мест прикрепления36. Рекомендуется добавить пептид адгезии или другой белок внеклеточного матрикса для облегчения прикрепления, адгезии и миграции. Ограничением исследования было использование инверсной световой микроскопии для наблюдения за 3D-морфологией ADSC вместо Z-укладки. Воздействие ПБМ и 3D-культивирование не оказывали существенного влияния на цитотоксичность ADSC как через 24 ч, так и через 10 дней после воздействия, что указывает на то, что культура гидрогеля и ПБМ безопасны и не оказывают негативного влияния на клетки 6,26. В 3D-культуре клеток ADSC ассоциировались с более медленными темпами пролиферации по сравнению с 2D-клеточной культурой. Это подтверждается низкой скоростью пролиферации нормальных контрольных групп в настоящем исследовании6. PBM (525 нм и 825 нм) значительно увеличивал скорость пролиферации ADSC в 3D-культуре. Первоначально зеленый свет (525 нм) при флюенциях 5 Дж/см2 и 10 Дж/см2 вызывал самые высокие скорости пролиферации по сравнению с ближним инфракрасным светом (825 нм). Тем не менее, на 10-дневной отметке ближний инфракрасный свет (825 нм) имеет самые высокие скорости пролиферации как на 5 Дж/см2, так и на 10 Дж/см2. Аналогичным образом, было продемонстрировано, что PBM (525 нм и 825 нм) увеличивает скорость пролиферации в 2D-культурах37. Рекомендуется также включить комбинированную группу длин волн, так как в других исследованиях сообщалось о синергетическом эффекте зеленого и ближнего инфракрасного света.
В заключение, используемый гидрогель представляет собой синтетический гидрогель с огромными возможностями настройки для удовлетворения потребностей различных применений. Текущее исследование показало, что гель не оказывает цитотоксического действия на клетки в культуре в течение 10-дневного периода. Кроме того, PBM продемонстрировал положительный аугментативный потенциал, значительно повысив скорость распространения ADSC, несмотря на то, что он находится в среде 3D-культуры. Таким образом, данный гидрогель может служить возможным носителем биоматериала для трансплантации в раны. Будущие исследования должны быть направлены на проверку потенциальной способности геля помогать в заживлении ран с помощью исследований на животных. Если результаты испытаний на животных будут благоприятными, предполагается, что ADSC, полученные от пациентов, могут быть собраны, инкапсулированы и дополнены PBM перед трансплантацией в раны, чтобы помочь в заживлении ран в клиническом применении.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Это исследование финансировалось Национальным исследовательским фондом Южной Африки Thuthuka Instrument, грант No TTK2205035996; Департамент науки и инноваций (DSI) профинансировал Африканский лазерный центр (ALC), грант номер HLHA23X задание ALC-R007; Научно-исследовательский совет университета, номер гранта 2022URC00513; Южноафриканская инициатива по созданию научно-исследовательских кафедр Министерства науки и технологий (DST-NRF/SARChI), номер гранта 98337. Финансирующие организации не играли никакой роли в разработке исследования, сборе, анализе, интерпретации данных или написании рукописи. Авторы благодарят Университет Йоханнесбурга (UJ) и Лазерный исследовательский центр (LRC) за использование оборудования и ресурсов.
Материалы
| Name | Company | Catalog Number | Comments |
| 525 nm diode laser | National Laser Centre of South Africa | EN 60825-1:2007 | |
| 825 nm diode laser | National Laser Centre of South Africa | SN 101080908ADR-1800 | |
| 96 Well Strip Plates | Sigma-Aldrich | BR782301 | |
| Amphotericin B | Sigma-Aldrich | A2942 | Antibiotic (0.5%; 0.5 mL) |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | ATP reagent, Proliferation assay Kit |
| Corning 2 mL External Threaded Polypropylene Cryogenic Vial | Corning | 430659 | cryovial |
| CryoSOfree | Sigma-Aldrich | C9249 | Cell freezing media |
| CytoTox96 Non-Radioactive Cytotoxicity Assay | Promega | G1780 | Cytotoxicity reagent |
| Dulbecco’s Modified Eagle Media | Sigma-Aldrich | D5796 | Basal medium (39 mL/44 mL) |
| FieldMate Laser Power Meter | Coherent | 1098297 | |
| Flat-bottomed Corning 96 well clear polystyrene plate | Sigma-Aldrich | CLS3370 | |
| Foetal bovine serum | Biochrom | S0615 | Culture medium enrichment (5 mL; 10% / 10 mL; 20%) |
| Hanks Balanced Salt Solution (HBSS) | Sigma-Aldrich | H9394 | Rinse solution |
| Heracell 150i CO2 incubator | Thermo Scientific | 51026280 | |
| Heraeus Labofuge 400 | Thermo Scientific | 75008371 | Plate spinner for 96 well plates |
| Heraeus Megafuge 16R centrifuge | ThermoFisher | 75004270 | |
| Immortalized ADSCs | ATCC | ASC52Telo hTERT, ATCC SCRC-4000 | Passage 37 |
| Invitrogen Countess 3 | Invitrogen | AMQAX2000 | Automated cell counter for Trypan Blue |
| Julabo TW20 waterbath | Sigma-Aldrich | Z615501 | Waterbath used to warm media to 37 °C |
| Olympus CellSens Entry | Olympus | Version 3.2 (23706) | Imaging software: digital image acquisition |
| Olympus CKX41 | Olympus | SN9B02019 | Inverted light microscope |
| Olympus SC30 camera | Olympus | SN57000530 | Camera attached to inverted light microscope |
| Opaque-walled Corning 96 well solid polystyrene microplates | Sigma-Aldrich | CLS3912 | Opaque well used for ATP luminescence |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | Antibiotic (0.5%; 0.5 mL) |
| SigmaPlot 12.0 | Systat Software Incorporated | ||
| TrueGel3D – True3 | Sigma-Aldrich | TRUE3-1KT | 10 µL |
| TrueGel3D Enzymatic Cell Recovery Solution | Sigma-Aldrich | TRUEENZ | 01:20 |
| Trypan Blue Stain | Thermo Fisher - Invitrogen | T10282 | 0.4% solution |
| TrypLE Select Enzyme (1x) | Gibco | 12563029 | Cell detachment solution |
| Victor Nivo Plate Reader | Perkin Elmer | HH3522019094 | Spectrophotometric plate reader |
Ссылки
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: Implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Yuan, X., et al. Strategies for improving adipose-derived stem cells for tissue regeneration. Burns Trauma. 10, (2022).
- Nilforoushzadeh, M. A., et al. Mesenchymal stem cell spheroids embedded in an injectable thermosensitive hydrogel: An in situ drug formation platform for accelerated wound healing. ACS Biomater Sci Eng. 6 (9), 5096-5109 (2020).
- Yang, M., et al. Thermosensitive injectable chitosan/collagen/β-glycerophosphate composite hydrogels for enhancing wound healing by encapsulating mesenchymal stem cell spheroids. ACS Omega. 5 (33), 21015-21023 (2020).
- Chimenti, I., et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ Res. 106 (5), 971-980 (2010).
- Hassan, W., Dong, Y., Wang, W. Encapsulation and 3d culture of human adipose-derived stem cells in an in-situ crosslinked hybrid hydrogel composed of peg-based hyperbranched copolymer and hyaluronic acid. Stem Cell Res Ther. 4 (2), 32 (2013).
- Wu, K. H., Mo, X. M., Han, Z. C., Zhou, B. Stem cell engraftment and survival in the ischemic heart. The Ann Thorac Surg. 92 (5), 1917-1925 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: General approaches and a review of recent developments. J R Soc Interface. 8 (55), 153-170 (2011).
- Koivunotko, E., et al. Angiogenic potential of human adipose-derived mesenchymal stromal cells in nanofibrillated cellulose hydrogel. Biomedicines. 10 (10), 2584 (2022).
- Dong, Y., et al. Injectable and tunable gelatin hydrogels enhance stem cell retention and improve cutaneous wound healing. Adv Funct Mater. 27 (24), 1606619 (2017).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3d cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Mantha, S., et al. Smart hydrogels in tissue engineering and regenerative medicine. Materials. 12 (20), 3323 (2019).
- Sung, T. -. C., et al. 3D culturing of human adipose-derived stem cells enhances their pluripotency and differentiation abilities. J Mater Sci Technol. 63, 9-17 (2021).
- Garg, R. K., et al. Capillary force seeding of hydrogels for adipose-derived stem cell delivery in wounds. Stem Cells Transl Med. 3 (9), 1079-1089 (2014).
- Kim, Y. M., et al. Adipose-derived stem cell-containing hyaluronic acid/alginate hydrogel improves vocal fold wound healing. Laryngoscope. 124 (3), E64-E72 (2014).
- Dong, Y., et al. Conformable hyaluronic acid hydrogel delivers adipose-derived stem cells and promotes regeneration of burn injury. Acta Biomater. 108, 56-66 (2020).
- Truegel3d hydrogel for 3d cell culture. Merck Available from: https://www.sigmaaldrich.com/ZA/en/technical-documents/technical-article/cell-culture-and-cell-culture-analysis/3d-cell-culture/truegel3d (2024)
- Braccini, S., Tacchini, C., Chiellini, F., Puppi, D. Polymeric hydrogels for in vitro 3d ovarian cancer modeling. Int J Mol Sci. 23 (6), 3265 (2022).
- Mashinchian, O., et al. In vivo transcriptomic profiling using cell encapsulation identifies effector pathways of systemic aging. eLife. 11, e57393 (2022).
- Matsushige, C., Xu, X., Miyagi, M., Zuo, Y. Y., Yamazaki, Y. Rgd-modified dextran hydrogel promotes follicle growth in three-dimensional ovarian tissue culture in mice. Theriogenology. 183, 120-131 (2022).
- Marx, V. How some labs put more bio into biomaterials. Nat Methods. 16 (5), 365-368 (2019).
- Marques, M. M. Photobiomodulation therapy weaknesses. Laser Dent Sci. 6 (3), 131-132 (2022).
- Hamblin, M. R. Mechanisms and mitochondrial redox signaling in photobiomodulation. Photochem Photobiol. 94 (2), 199-212 (2018).
- Chen, J., et al. Low-level controllable blue LEDs irradiation enhances human dental pulp stem cells osteogenic differentiation via transient receptor potential vanilloid 1. J Photochem Photobiol B. 233, 112472 (2022).
- Chang, S. -. Y., Carpena, N. T., Kang, B. J., Lee, M. Y. Effects of photobiomodulation on stem cells important for regenerative medicine. Med Lasers. 9 (2), 134-141 (2020).
- Bikmulina, P. Y., et al. Beyond 2d: Effects of photobiomodulation in 3d tissue-like systems. J Biomed Opt. 25 (4), 048001 (2020).
- Ahmadi, H., et al. Transplantation of photobiomodulation-preconditioned diabetic stem cells accelerates ischemic wound healing in diabetic rats. Stem Cell Res Ther. 11 (1), 494 (2020).
- Mao, A. S., Mooney, D. J. Regenerative medicine: Current therapies and future directions. Proc Natl Acad Sci U S A. 112 (47), 14452-14459 (2015).
- De Andrade, A. L. M., et al. Effect of photobiomodulation on the behaviour of mesenchymal stem cells in three-dimensional cultures. Lasers Med Sci. 38 (1), 221 (2023).
- Diniz, I. M., et al. Photobiomodulation of mesenchymal stem cells encapsulated in an injectable rhbmp4-loaded hydrogel directs hard tissue bioengineering. J Cell Physiol. 233 (6), 4907-4918 (2018).
- Carter, M., Shieh, J. C. . Guide to Research Techniques in Neuroscience. , (2015).
- Lutolf, M. P., et al. Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration: Engineering cell-invasion characteristics. Proc Natl Acad Sci U S A. 100 (9), 5413-5418 (2003).
- Robledo, F., et al. Spheroids derived from the stromal vascular fraction of adipose tissue self-organize in complex adipose organoids and secrete leptin. Stem Cell Res Ther. 14 (1), 70 (2023).
- Landry, J., Freyer, J. P., Sutherland, R. M. Shedding of mitotic cells from the surface of multicell spheroids during growth. J Cell Physiol. 106 (1), 23-32 (1981).
- Bogacheva, M. S., et al. Differentiation of human pluripotent stem cells into definitive endoderm cells in various flexible three-dimensional cell culture systems: Possibilities and limitations. Front Cell Dev Biol. 9, 726499 (2021).
- Chen, X., Thibeault, S. L. Biocompatibility of a synthetic extracellular matrix on immortalized vocal fold fibroblasts in 3-d culture. Acta Biomater. 6 (8), 2940-2948 (2010).
- Crous, A., Van Rensburg, M. J., Abrahamse, H. Single and consecutive application of near-infrared and green irradiation modulates adipose derived stem cell proliferation and affect differentiation factors. Biochimie. 196, 225-233 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены