Method Article
Dreidimensionale Zellkultur von aus Fett gewonnenen Stammzellen in einem Hydrogel mit Photobiomodulationsaugmentation
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll vor, das die Verwendung von Hydrogel als dreidimensionales (3D) Zellkulturgerüst für die ADSC-Kultur (Adipose-Derived Stem Cells) demonstriert und Photobiomodulation (PBM) einführt, um die Proliferation von ADSCs innerhalb der 3D-Kulturumgebung zu verbessern.
Zusammenfassung
Aus Fettgewebe gewonnene Stammzellen (ADSCs), die multipotente mesenchymale Eigenschaften ähnlich wie Stammzellen besitzen, werden häufig in der regenerativen Medizin eingesetzt, da sie eine Vielzahl von Zelldifferenzierungen ermöglichen und die Migration und Proliferation verbessern und Entzündungen lindern können. ADSCs stehen jedoch oft vor Herausforderungen beim Überleben und der Transplantation in Wunden, vor allem aufgrund ungünstiger entzündlicher Bedingungen. Um dieses Problem anzugehen, wurden Hydrogele entwickelt, um die Lebensfähigkeit von ADSC in Wunden zu erhalten und den Wundheilungsprozess zu beschleunigen. Hier wollten wir den synergistischen Einfluss der Photobiomodulation (PBM) auf die ADSC-Proliferation und Zytotoxizität innerhalb eines 3D-Zellkulturrahmens bewerten. Immortalisierte ADSCs wurden in 10-μl-Hydrogele mit einer Dichte von 2,5 x 103 Zellen ausgesät und mit 525-nm- und 825-nm-Dioden bei Fluenzen von 5 J/cm2 und 10 J/cm2 bestrahlt. Morphologische Veränderungen, Zytotoxizität und Proliferation wurden 24 Stunden und 10 Tage nach der PBM-Exposition bewertet. Die ADSCs wiesen eine abgerundete Morphologie auf und waren als einzelne Zellen oder Sphäroidaggregate über das Gel verteilt. Wichtig ist, dass sowohl PBM als auch 3D-Kulturrahmen keine zytotoxischen Wirkungen auf die Zellen zeigten, während PBM die Proliferationsraten von ADSCs signifikant erhöhte. Zusammenfassend zeigt diese Studie die Verwendung von Hydrogel als geeignete 3D-Umgebung für die ADSC-Kultur und führt PBM als signifikante Augmentationsstrategie ein, die insbesondere die langsamen Proliferationsraten im Zusammenhang mit 3D-Zellkulturen berücksichtigt.
Einleitung
ADSCs sind mesenchymale multipotente Vorläuferzellen mit der Fähigkeit, sich selbst zu erneuern und in mehrere Zelllinien zu differenzieren. Diese Zellen können während eines Lipoaspirationsverfahrens aus der stromalen vaskulären Fraktion (SVF) des Fettgewebes entnommen werden1. ADSCs haben sich als idealer Stammzelltyp für den Einsatz in der regenerativen Medizin herausgestellt, da diese Zellen reichlich vorhanden, minimalinvasiv zu ernten, leicht zugänglich und gut charakterisiert sind2. Die Stammzelltherapie bietet einen möglichen Weg zur Wundheilung, indem sie die Zellmigration, Proliferation, Neovaskularisation stimuliert und Entzündungen in Wunden reduziert 3,4. Etwa 80 % der Regenerationskapazität von ADSCs sind auf die parakrine Signalübertragung über ihr Sekretomzurückzuführen 5. Zuvor wurde vorgeschlagen, dass eine direkte lokale Injektion von Stammzellen oder Wachstumsfaktoren in geschädigtes Gewebe ausreichende In-vivo-Reparaturmechanismen verhindern könnte 6,7,8. Dieser Ansatz war jedoch mit mehreren Herausforderungen verbunden, wie z. B. einem schlechten Überleben und einer reduzierten Stammzelltransplantation in geschädigtem Gewebe als Folge der entzündlichen Umgebung 9. Darüber hinaus war einer der genannten Gründe das Fehlen einer extrazellulären Matrix, um das Überleben und die Funktionalität der transplantierten Zellen zu unterstützen10. Um diese Herausforderungen zu meistern, liegt der Schwerpunkt nun auf der Entwicklung von Biomaterialträgern zur Unterstützung der Lebensfähigkeit und Funktion von Stammzellen.
Dreidimensionale (3D) Zellkulturen verbessern die Zell-zu-Zell- und Zell-zu-Matrix-Interaktion in vitro, um eine Umgebung zu schaffen, die der In-vivo-Umgebung besser ähnelt11. Hydrogele wurden ausgiebig als eine Klasse von Biomaterialträgern untersucht, die eine 3D-Umgebung für die Stammzellkultur bieten. Diese Strukturen bestehen aus Wasser und vernetzten Polymeren12. Die Verkapselung von ADSCs in Hydrogel hat während der Kultur praktisch keine zytotoxische Wirkung auf die Zellen, während die Lebensfähigkeit der Zellen erhaltenbleibt 6. In 3D kultivierte Stammzellen zeigen eine verbesserte Beibehaltung ihrer Stammzellen und eine verbesserte Differenzierungsfähigkeit13. In ähnlicher Weise zeigten Hydrogel-ausgesäte ADSCs in Tiermodellen eine erhöhte Lebensfähigkeit und einen beschleunigten Wundverschluss14. Darüber hinaus erhöht die Hydrogelverkapselung die Transplantation und Retention von ADSCs in Wunden signifikant15,16. TrueGel3D besteht aus einem Polymer, entweder Polyvinylalkohol oder Dextran, das durch einen Vernetzer, entweder Cyclodextrin oder Polyethylenglykol17, verfestigt wird. Das Gel ist ein synthetisches Hydrogel, das keine tierischen Produkte enthält, die die Experimente stören oder eine Immunreaktion während der Transplantation des Gels in einen Patienten auslösen könnten, während es effektiv eine extrazelluläre Matrix nachahmt18. Das Gel ist vollständig anpassbar, indem die Zusammensetzung und die einzelnen Komponenten geändert werden. Es kann verschiedene Stammzellen beherbergen und die Differenzierung mehrerer Zelltypen unterstützen, indem es die Steifigkeit des Gels19 anpasst. Bindungsstellen können durch Zugabe von Peptiden20 erzeugt werden. Das Gel ist durch die Sekretion von Metalloproteasen abbaubar, was eine Zellmigration ermöglicht21. Schließlich ist es klar und ermöglicht bildgebende Verfahren.
PBM ist eine minimalinvasive und einfach durchzuführende Form der Low-Level-Lasertherapie zur Stimulation intrazellulärer Chromophore. Unterschiedliche Wellenlängen erzeugen unterschiedliche Wirkungen auf Zellen22. Licht im roten bis nahen Infrarotbereich stimuliert eine erhöhte Produktion von Adenosintriphosphat (ATP) und reaktiven Sauerstoffspezies (ROS), indem es den Fluss durch die Elektronentransportkette erhöht23. Licht im blauen und grünen Bereich stimuliert lichtgesteuerte Ionenkanäle und ermöglicht den unspezifischen Einstrom von Kationen wie Kalzium und Magnesium in die Zellen, was bekanntermaßen die Differenzierung verbessert24. Der Nettoeffekt ist die Erzeugung von sekundären Botenstoffen, die die Transkription von Faktoren stimulieren, die nachgelagerte zelluläre Prozesse wie Migration, Proliferation und Differenzierung auslösen25. PBM kann verwendet werden, um Zellen für die Proliferation oder Differenzierung vorzukonditionieren, bevor die Zellen in eine ungünstige Umgebung, z. B. beschädigtes Gewebe, transplantiert werden26. Die PBM-Exposition vor und nach der Transplantation (630 nm und 810 nm) von ADSCs verbesserte die Lebensfähigkeit und Funktion dieser Zellen in vivo in einem diabetischen Rattenmodell signifikant27. Die regenerative Medizin benötigt eine ausreichende Anzahl von Zellen für eine effektive Reparatur von Geweben28. In der 3D-Zellkultur wurden ADSCs mit langsameren Proliferationsraten im Vergleich zu zweidimensionalen Zellkulturen in Verbindung gebracht6. PBM kann jedoch verwendet werden, um den 3D-Zellkulturprozess von ADSCs zu verbessern, indem es die Lebensfähigkeit, Proliferation, Migration und Differenzierung verbessert29,30.
Protokoll
HINWEIS: In der Materialtabelle finden Sie Details zu allen Materialien, Reagenzien und Software, die in diesem Protokoll verwendet werden. Das Protokoll ist in Abbildung 1 grafisch zusammengefasst.
1. Zweidimensionale (2D) Zellkultur
HINWEIS: Immortalisierte ADSCs (1 x106 Zellen) werden bei -195,8 °C in flüssigem Stickstoff in einem Kryokonservierungsfläschchen mit 1 ml Zellgefriermedium gelagert.
- Vorbereitung des 2D-Zellrückgewinnungsmediums und des 2D-Kulturkolbens
- 39 ml des Basalmediums in ein 50-ml-Zentrifugenröhrchen überführen
- Reichern Sie das Basalmedium mit 20% fötalem Rinderserum (FBS; 10 ml) und Antibiotika (1 ml) (0,5 ml Penicillin-Streptomycin und 0,5 ml Amphotericin B) an.
- Konditionieren Sie einen T75-Kolben vor, indem Sie 6 ml des Zellrückgewinnungsmediums in den Kolben überführen und ihn 45 Minuten lang bei 37 °C, 5 % CO2 und 85 % Luftfeuchtigkeit inkubieren (dies kann während der Durchführung der Zellrückgewinnungsschritte erfolgen, um Zeit zu sparen).
HINWEIS: Erwärmen Sie das gesamte Medium vor Gebrauch auf 37 °C und lagern Sie es maximal 1 Woche bei 4 °C.
- 2D-Zellrückgewinnung
- Nehmen Sie ein Kryofläschchen aus dem Vorratstank für flüssigen Stickstoff und tauen Sie das Fläschchen in einem Wasserbad bei 37 °C schnell ab, bis es vollständig aufgetaut ist.
- Das Kryofläschchen wird mit einer Zentrifuge bei 1006 x g 5 min (20 °C) heruntergeschleudert und anschließend der Überstand entfernt.
- Resuspendieren Sie die pelletierten Zellen mit 1 ml vorgewärmtem Zellrückgewinnungsmedium.
- Die suspendierten Zellen werden gleichmäßig im vorkonditionierten Kolben (Endvolumen von 7 ml) verteilt und bei 37 °C, 5 % CO2 und 85 % Luftfeuchtigkeit inkubiert.
- Nach 24 h das Zellrückgewinnungsmedium entsorgen und ersetzen.
- Ersetzen Sie das Nährmedium alle 2-3 Tage, bis der Kolben mit den Zellen zusammenfließt.
- Ernte von 2D-Kulturkolben in Einzelzellsuspension und Zellzählung
- Nehmen Sie den 2D-Kulturkolben aus dem Inkubator und entsorgen Sie die Nährmedien in einem geeigneten Abfallbehälter.
- 10 ml Spüllösung werden in den Kolben gegeben, um die Zellen zu spülen und Abfallstoffe und Proteinablagerungen zu entfernen. Danach die Spüllösung entsorgen.
- Geben Sie 6 ml Ablöselösung in den Kulturkolben, um die Zellen abzulösen. Inkubieren Sie den Kolben 2 Minuten lang bei 37 °C, 5 % CO2 und 85 % Luftfeuchtigkeit.
Anmerkungen: Beobachten Sie den Kolben unter einem Mikroskop, um sicherzustellen, dass alle Zellen abgelöst wurden. Wenn nicht, klopfen Sie vorsichtig auf den Kolben und inkubieren Sie eine weitere Minute. - Sobald alle Zellen abgelöst wurden, geben Sie die Zellsuspension in ein 15-ml-Zentrifugenröhrchen und geben Sie 1 ml des Zellrückgewinnungsmediums (mit 20 % FBS) in das Röhrchen. Dadurch wird die Wirkung der Ablöselösung neutralisiert.
- Zentrifugieren Sie das Röhrchen 5 Minuten lang bei 1711 x g (20 °C).
- Entfernen Sie den Überstand und resuspendieren Sie die Zellen in 1 ml vollständigem Medium.
- Entfernen Sie 10 μl der Zellsuspension, geben Sie sie in ein 500-μl-Mikrozentrifugenröhrchen und mischen Sie sie mit 10 μl Trypanblau im Verhältnis 1:1.
- Geben Sie 10 μl der Trypanblauzellenlösungsmischung in zweifacher Ausführung in eine Zellzählkammer.
- Legen Sie die Zellzählkammer in den automatischen Zellzähler. Der Zellzähler zeigt die Gesamtzahl der Zellen pro ml sowie die Anzahl der lebensfähigen und toten Zellen an. Berechnen Sie die durchschnittliche Anzahl lebensfähiger Zellen und die Anzahl der lebensfähigen Zellen, die in das 3D-Hydrogel eingebettet werden müssen (Schritt 2.2.6).
2. 3D Zellkultur
- Vorbereiten des vollständigen 3D-Nährmediums
- 44 ml des Basalmediums in ein 50-ml-Zentrifugenröhrchen überführen.
- Reichern Sie das Medium mit 10 % FBS (5 ml) und Antibiotika (1 ml) (0,5 ml Penicillin-Streptomycin und 0,5 ml Amphotericin B) an.
HINWEIS: Erwärmen Sie das gesamte Medium vor Gebrauch auf 37 °C und lagern Sie es maximal eine Woche lang bei 4 °C.
- Vorbereiten des Hydrogels
- Bereiten Sie das schnelle Dextran vor, indem Sie das Fläschchen mit schnellem Dextran zentrifugieren (1000 x g für 30 s bei 20 °C), um das Material zu konzentrieren. Geben Sie 175 μl Wasser in die Durchstechflasche mit schnellem Dextran, um eine Endkonzentration von 30 mmol/l reaktiven Gruppen zu erreichen.
- Das Rohr (mittlere Geschwindigkeit für 30 s) mit der Fast-Dextran-Lösung vortexen, bis sich das Material vollständig aufgelöst hat. Inkubieren Sie das gelöste Material 5 Minuten lang auf Eis. Zentrifugieren Sie das Röhrchen, wirbeln Sie es kurz vor und halten Sie es während des weiteren Gebrauchs auf Eis.
- Zentrifugieren Sie den Vernetzer (1000 x g für 30 s bei 20 °C), um das Material zu konzentrieren. Geben Sie 188 μl Wasser in das Vernetzerfläschchen, um eine Endkonzentration von 20 mmol/l Thiolgruppen zu erreichen.
- Das Rohr mit der Vernetzerlösung (mittlere Geschwindigkeit für 30 s) vortexen, bis sich das gesamte Material aufgelöst hat. Inkubieren Sie den gelösten Vernetzer 5 Minuten lang bei Raumtemperatur (RT). Zentrifugieren Sie das Röhrchen, wirbeln Sie es kurz vor und halten Sie es während der weiteren Verwendung auf RT.
- Passen Sie das Hydrogelprotokoll von 30 μl auf 10 μl an, um die Kosten zu senken (siehe Tabelle 1 für spezifische Details).
- Bereiten Sie die Zellsuspension vor, um eine Aussaatdichte von 2,5 x 103 Zellen pro 10 μl Hydrogel zu erreichen.
- Kombinieren Sie die Komponenten gemäß Tabelle 1 zu einem Mastermix. Übertragen Sie 9 μl des Mastermixes in eine Vertiefung in einer 96-Well-Streifenplatte.
- Verfestigen Sie das Gel, indem Sie 3 Minuten nach dem Transfer des Mastermixes 1 μl des abbaubaren Vernetzers hinzufügen.
- Bedecken Sie die Hydrogele mit 170 μl vorgewärmtem Komplettkulturmedium. 1 h inkubieren. Ersetzen Sie nach 1 h das Nährmedium.
HINWEIS: Die in Hydrogel eingebetteten Zellen sind bereit für weitere Experimente oder Analysen innerhalb des 3D-Kultursystems. Befolgen Sie bei Bedarf zusätzliche Protokolle für nachgelagerte Anwendungen.
3. Photobiomodulations-Exposition
- Einrichten des Lasers
- Richten Sie das Diodenlasersystem entweder für grüne (525 nm) oder nahinfrarote (825 nm) Wellenlängen ein. Schalten Sie die Laser ein und lassen Sie sie für die empfohlene Dauer aufwärmen.
- Stabilisieren Sie die Ausgangsleistung der Laser, indem Sie ihnen erlauben, einen stationären Zustand zu erreichen. Dies gewährleistet eine gleichmäßige und genaue Bestrahlung.
- Messen Sie die Ausgangsleistung der Laser mit einem Laserleistungsmesser. Notieren Sie die Leistungswerte für jede Wellenlänge.
- Verwenden Sie Gleichung 1 (Laserbestrahlungszeit), um die Laserbestrahlungszeit zu berechnen. Ersetzen Sie die Werte aus Tabelle 2 in Gleichung 1, um die geeignete Bestrahlungszeit für jede Fluenz zu bestimmen. In Gleichung 1 steht "r" für den Radius der Bestrahlungszone des Lasers.

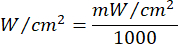

Gleichung 1 - In Tabelle 2 finden Sie die spezifischen Parameter, die für die Berechnung erforderlich sind, einschließlich der Flussflüsse (5 J/cm² oder 10 J/cm²) und der Laserleistung.
- Bestrahlung der 3D-Zellkulturen
- Nach dem Austausch des gesamten Mediums (Schritt 2.2.9) wird die 96-Well-Platte mit den in Hydrogel eingebetteten Zellen unter das Diodenlasersystem gelegt. Bestrahlen Sie die Hydrogele mit der berechneten Laserbestrahlungszeit für die gewählte Fluenz (5 J/cm² oder 10 J/cm²) bei der gewählten Wellenlänge (grün oder nahes Infrarot). Daher erhalten die Kulturen nur eine Einzeldosis.
- Es ist sicherzustellen, dass jede Versuchsgruppe von einer Kontrolle (n = 4) begleitet wird, die aus in Hydrogel eingebetteten ADSCs ohne PBM-Exposition besteht.
HINWEIS: Tragen Sie immer eine Schutzbrille, die für die Wellenlänge des Lichts geeignet ist, mit dem Sie arbeiten. Die Laser werden außerhalb eines Sicherheitsschranks eingesetzt; Daher ist es von entscheidender Bedeutung, den Bereich vor dem Gebrauch zu desinfizieren. - Die Kulturplatten werden für die Dauer der Experimente bei 37 °C, 5 % CO2 und 85 % Luftfeuchtigkeit inkubiert. Inkubieren Sie die Platten für 24 Stunden für die erste Analyse oder 10 Tage für die zweite Analyseperiode nach der Bestrahlung.
4. Morphologie
- Inverse Lichtmikroskopie
- Schalten Sie das Inverslichtmikroskop ein und lassen Sie es einige Minuten aufwärmen. Stellen Sie sicher, dass das Mikroskop richtig ausgerichtet und kalibriert ist.
- Bereiten Sie die Probe für die Betrachtung auf einem Objektträger oder einer speziellen Zellkulturschale vor, je nach Versuchsanordnung. Kalibrieren Sie das Mikroskop für optimale Bildgebungsbedingungen.
- Passen Sie die Einstellungen für Fokus, Helligkeit und Kontrast nach Bedarf an. Wählen Sie die 20-fache Objektivlinse am Mikroskop zur Beobachtung und Aufzeichnung der Zellmorphologie.
- Legen Sie die Probe auf den Mikroskoptisch und fokussieren Sie mit dem Okular auf die interessierenden Zellen. Beobachten und zeichnen Sie mit dem Okular oder der Kameraansicht die Zellmorphologie auf. Achten Sie auf Zellform, -größe und -merkmale.
- Befestigen Sie das Kameramodul am Mikroskop. Richten Sie die Kamera für die digitale Bildgebung ein. Stellen Sie sicher, dass die Kamera und das Mikroskop ordnungsgemäß angeschlossen und kommuniziert werden.
- Nehmen Sie mit dem 20-fachen Objektiv digitale Bilder der beobachteten Zellen auf. Verwenden Sie die Kamerasteuerung, um Belichtung, Fokus und andere relevante Einstellungen anzupassen.
HINWEIS: Stellen Sie sicher, dass die aufgenommenen Bilder von hoher Qualität sind und einen repräsentativen Überblick über die Zellmorphologie bieten. - Starten Sie die Imaging-Software auf dem Computer. Nehmen Sie das Bild auf und verwenden Sie die Analysewerkzeuge in der Software, um die Zellmorphologie zu analysieren.
- Messen Sie Zellabmessungen, zählen Sie Zellen oder führen Sie relevante Analysen basierend auf den experimentellen Zielen durch.
- Fügen Sie den Bildern mit der Software eine geeignete Maßstabsleiste hinzu. Verwenden Sie die bekannte Vergrößerung des Mikroskopobjektivs, um den Maßstab der Bilder genau darzustellen.
5. Biochemische Assays
- Zell-Rückgewinnung
HINWEIS: Die Zellen müssen aus dem Hydrogel in einer Einzelzellsuspension für weitere nachgelagerte biochemische Assays gewonnen werden.- Bereiten Sie die enzymatische Zellwiederherstellungslösung vor. Bereiten Sie in einer sterilen Umgebung eine Arbeitslösung her, indem Sie die enzymatische Zellwiederherstellungslösung mit phosphatgepufferter Kochsalzlösung (PBS) im Verhältnis 1:20 verdünnen (Lösung: PBS). Wenn die Rückgewinnung von Zellen aus einer bestimmten Anzahl von Gelen oder Vertiefungen erforderlich ist, berechnen Sie das erforderliche Gesamtvolumen basierend auf 30 μl Rückgewinnungslösung pro Gel.
- Geben Sie 30 μl der Arbeitslösung in jedes Gel oder jede Vertiefung, die die zu regenerierenden Zellen enthält. Sorgen Sie für eine gründliche und gleichmäßige Verteilung der Rückgewinnungslösung, indem Sie die Platte sanft schaukeln oder schwenken. Inkubieren Sie die Platte mit der Rückgewinnungslösung gemäß der empfohlenen Inkubationszeit. Diese Informationen finden Sie in der Regel im Produktdatenblatt oder Protokoll des Lieferanten.
- Nehmen Sie die Platte nach der Inkubationszeit vorsichtig aus dem Inkubator. Zentrifugieren Sie die Platten bei 1409 x g für 5 min (20 °C), um die Zellen zu pelletieren. Empfohlene Zentrifugationsbedingungen finden Sie im Produktdatenblatt oder -protokoll. Entsorgen Sie nach Abschluss der Zentrifugation den Überstand vorsichtig und achten Sie darauf, das Zellpellet nicht zu stören.
- Resuspendieren Sie die pelletierten Zellen vorsichtig in 220 μl sterilem PBS. Achten Sie auf gründliches Mischen, um eine homogene einzellige Suspension zu erhalten. Die Zellen sind nun bereit für nachgelagerte biochemische Assays. Befolgen Sie die spezifischen Protokolle für die beabsichtigten Assays unter Berücksichtigung der Art der gewonnenen Zellen und der Anforderungen des Versuchsaufbaus.
- Laktatdehydrogenase (LDH) Zytotoxizitätstest
- Entfernen Sie für jede Vertiefung vorsichtig 50 μl des vollständigen Nährmediums, um eine minimale Störung der Zellschicht zu gewährleisten.
- Geben Sie 50 μl des Zytotoxizitätsreagenzes direkt in jede Vertiefung, die die restlichen 50 μl Kulturmedien enthält. Mischen Sie vorsichtig, indem Sie auf und ab pipettieren, um eine gründliche Vermischung der Probe mit dem Reagenz zu gewährleisten.
- Bereiten Sie eine Positivkontrolle vor. Richten Sie dreifache Wells mit 5 μl 10-facher Lyselösung pro 50 μl positiver Kontrollzellen ein, die im Kit enthalten sind.
- Inkubieren Sie die Platte bei der empfohlenen Temperatur und Dauer. Dieser Schritt ermöglicht es dem Zytotoxizitätsreagenz, die Zellen zu lysieren und LDH in das Kulturmedium freizusetzen.
- Nach der Inkubationszeit werden 50 μl der Stopplösung direkt in jede Vertiefung gegeben, die das Zytotoxizitätsreagenz und das Zelllysat enthält. Mischen Sie vorsichtig, indem Sie auf und ab pipettieren, um sicherzustellen, dass die Reaktion ordnungsgemäß gestoppt wird.
HINWEIS: Die Stopplösung stoppt die weitere LDH-Freisetzung und gewährleistet die Stabilität der Farbentwicklung. - Richten Sie den spektralfotometrischen Plattenleser gemäß den Anweisungen des Herstellers ein. Zeichnen Sie die Extinktion jedes Wells bei 490 nm auf. Diese Wellenlänge ist spezifisch für die kolorimetrische Detektion des Formazanprodukts, das durch die LDH-Reaktion erzeugt wird.
- Subtrahieren Sie Hintergrundabsorptionswerte von beiden Behandlungsgruppen und Kontrollwells. Erhalten Sie Hintergrundwerte aus Vertiefungen, die Medien und Zytotoxizitätsreagenzien ohne Zellen enthalten.
- Analysieren Sie die korrigierten Absorptionswerte für jede Probe, um den Grad der Zytotoxizität zu bestimmen. Höhere Absorptionswerte deuten auf eine erhöhte LDH-Freisetzung und damit auf eine höhere Zytotoxizität hin.
- Es ist sicherzustellen, dass jede Versuchsgruppe und Kontrolle aus vier Wiederholungen besteht (Schritt 3.2.2), um statistische Genauigkeit zu gewährleisten. Berechnen Sie die durchschnittliche Absorption jeder Gruppe und Kontrolle und importieren Sie sie in ein geeignetes Statistikprogramm.
- Vergleichen Sie die Ergebnisse zwischen Behandlungsgruppen und geeigneten Kontrollen, um die zytotoxischen Wirkungen genau zu beurteilen, und zeichnen Sie alle Absorptionswerte, Berechnungen und Versuchsbedingungen für zukünftige Referenzen auf.
- ATP-Proliferations-Assay
- Mischen Sie in einer sterilen Umgebung 50 μl der gewonnenen Zellen mit 50 μl des ATP-Reagenzes in jeder Vertiefung.
HINWEIS: Passen Sie das Volumen der Zellen und Reagenzien basierend auf der Anzahl der Wells und dem Versuchsdesign an. Behalten Sie konsistente Verhältnisse für genaue Ergebnisse bei. - Stellen Sie den Teller auf einen Shaker und schütteln Sie ihn 5 Minuten lang kräftig im Dunkeln. Dieser Schritt sorgt für eine gründliche Durchmischung der Zellen mit dem Reagenz. Nach dem Schütteln die Platte weitere 25 Minuten bei RT inkubieren. Diese Inkubationszeit ermöglicht es dem Reagenz, die Zellen zu lysieren und ein Lumineszenzsignal zu erzeugen, das proportional zur Menge an vorhandenem ATP ist.
- Richten Sie den Plattenleser gemäß den Anweisungen des Herstellers für die Lumineszenzerkennung ein. Messen Sie die Lumineszenz aus jeder Vertiefung, die das Zelllysat und das ATP-Reagenz enthält. Stellen Sie sicher, dass der Plattenleser so eingestellt ist, dass er die Lumineszenz mit den entsprechenden Einstellungen misst.
- Subtrahieren Sie Hintergrundlumineszenzmesswerte sowohl von Behandlungsgruppen als auch von Kontrollwells. Erhalten Sie Hintergrundwerte aus Wells, die nur das ATP-Reagenz und PBS ohne Zellen enthalten.
- Analysieren Sie die korrigierten Lumineszenzwerte für jede Probe, um den ATP-Gehalt zu bestimmen, der die Zellproliferation oder Lebensfähigkeit widerspiegelt.
- Es ist sicherzustellen, dass jede Versuchsgruppe und Kontrolle aus vier Wiederholungen besteht (Schritt 3.2.2), um statistische Genauigkeit zu gewährleisten. Berechnen Sie die durchschnittliche Lumineszenz jeder Gruppe und Kontrolle und importieren Sie sie in ein geeignetes Statistikprogramm.
- Vergleichen Sie die Ergebnisse zwischen Behandlungsgruppen und relevanten Kontrollen, um die ATP-Proliferation genau zu beurteilen. Zeichnen Sie alle Lumineszenzmesswerte, Berechnungen und experimentellen Bedingungen für zukünftige Referenzen auf.
HINWEIS: Befolgen Sie für alle biochemischen Analysen in Kit-Form das vom Hersteller bereitgestellte Handbuch oder Protokoll des Kits für spezifische Details, wie z. B. empfohlene Inkubationszeiten, Konzentrationen und zusätzliche Schritte oder Überlegungen. Halten Sie sich beim Umgang mit Chemikalien und biologischen Materialien immer an die Sicherheitsrichtlinien des Labors.
- Mischen Sie in einer sterilen Umgebung 50 μl der gewonnenen Zellen mit 50 μl des ATP-Reagenzes in jeder Vertiefung.
Ergebnisse
Um die Morphologie zu beurteilen und die Zelldichte der Hydrogele visuell zu untersuchen, wurde die inverse Mikroskopie verwendet (Abbildung 2). Die ADSCs behielten 24 Stunden nach der Aussaat und PBM-Exposition eine abgerundete Morphologie bei. Die Zellen waren als Einzelzellen oder in traubenartigen Clustern über das Gel verstreut. Die Morphologie war nach 10 Tagen in 3D-Kultur unverändert. Es wurde kein eindeutiger Unterschied in der Morphologie zwischen den Versuchsgruppen und Kontrollen oder zwischen den verschiedenen Versuchsgruppen festgestellt.
Um die zytotoxischen Wirkungen der PBM-Exposition und der 3D-Kultur mit Hydrogel zu bewerten, wurde die LDH-Leckage gemessen (Abbildung 3). Es gab keine signifikanten Unterschiede zwischen den Versuchsgruppen und den Kontrollen nach 24 h oder 10 Tagen, was darauf hindeutet, dass PBM-Exposition und Hydrogelkultur keine nachteiligen Auswirkungen auf die Zellen hatten.
Die zellulären Proliferationsraten wurden durch Messung des ATP-Gehalts von ADSCs gemessen (Abbildung 4). Die PBM-Exposition führte in allen Versuchsgruppen zu erhöhten Proliferationsraten im Vergleich zu den Kontrollen. Bei 24 Stunden nach der PBM-Exposition stimulierte die Wellenlänge von 525 nm die höchsten Proliferationsraten. Nach 10 Tagen zeigte die Wellenlänge von 825 nm jedoch überlegene Proliferationsraten im Vergleich zur Wellenlänge von 525 nm. Am Ende der 10-tägigen Kulturperiode zeigte die 825 nm, 10 J/cm2-Gruppe die höchste Proliferationsrate.

Abbildung 1: Überblick über das Protokoll. Zusammengefasstes Protokoll, das die Herstellung des Hydrogels in 96-Well-Platten, die PBM-Exposition und die Messung der Morphologie und biochemischen Assays 24 h und 10 Tage nach der PBM-Exposition hervorhebt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: ADSCs werden nach dem Seeding selbst aggregiert. Die Zellen behielten eine runde bis ovale Morphologie bei und wurden im Hydrogel entweder als Einzelzellen oder Aggregate mit einem traubenartigen Cluster-Aussehen nach (A) 24 h und (B) 10 Tagen nach der Aussaat und PBM-Exposition verteilt. Nach 10 Tagen Inkubation wurde keine endgültige Veränderung beobachtet. Unter Verwendung der Kontrollen (1 und 4) 525 nm bei 5 J/cm2 (2) und 10 J/cm2 (5) bzw. 825 nm bei 5 J/cm2 (3) bzw. 10 J/cm2 (6). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Zelluläre LDH-Leckage als Messung der Zytotoxizität 24 h und 10 Tage nach PBM-Exposition unter Verwendung einer 525-nm- und 825-nm-Diode (5 J/cm2 und 10 J/cm2) im Hydrogel. Es wurde kein signifikanter Anstieg der Zytotoxizität im Vergleich zur experimentellen Kontrolle beobachtet. Die Positivkontrolle war repräsentativ für den vollständigen Zelltod. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Zelluläres ATP als Messung der Proliferation 24 h und 10 Tage nach PBM-Exposition unter Verwendung einer 525-nm- und 825-nm-Diode (5 J/cm2 und 10 J/cm2) im Hydrogel. Die PBM-Exposition stimulierte erhöhte Proliferationsraten in allen Versuchsgruppen zu beiden Zeitpunkten und zu beiden Flüssigkeiten. Signifikante Unterschiede (P < 0,001) sind durch *** gekennzeichnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Bestandteil | Volumen (μl) pro Vertiefung |
| SLO-Dextran-Polymer (30 mmol/L) | 0.7 |
| Zellen-Aufhängung | 2 |
| Puffer | 0.8 |
| Wasser | 5.5 |
| Vernetzer | 1 |
| Gesamtvolumen | 10 |
Tabelle 1: Hydrogel-Reagenzvolumina (10 μl).
| Laser-Parameter | Grün (G) | Nahinfrarot (NIR) |
| Lichtquelle | Diodenlaser | Diodenlaser |
| Wellenlänge (nm) | 525 | 825 |
| Leistung (mW) | 553 | 515 |
| Leistungsdichte (mW/cm 2) | 57.48 | 53.53 |
Tabelle 2: Laserparameter.
Diskussion
ADSCs sind ein idealer Zelltyp für die regenerative Medizin, da sie verschiedene Prozesse stimulieren, um die Wundheilung zu unterstützen 3,4. Es gibt jedoch mehrere Herausforderungen, die umgangen werden müssen, z. B. schlechte Überlebensraten und eine ineffektive Transplantation der Zellen an einer Verletzungsstelle9. Immortalisierte Zellen wurden als kommerziell erhältliche Zelllinie verwendet, da sie im Vergleich zu Primärzellen für mehr Generationen weitergegeben werden können, nicht geerntet werden müssen, gut charakterisiert sind und homogene Populationen sind, die konsistente Ergebnisse gewährleisten31. Ziel dieser Studie war es, das augmentative Potenzial von PBM auf die Proliferation und Zytotoxizität von ADSCs mit Hilfe von 3D-Zellkulturen zu bestimmen. Das Protokoll des Herstellers für ein 30-μl-Hydrogel wurde an ein 10-μl-Hydrogel angepasst, um Kostenzu sparen 32. Dieses reduzierte Volumen erschwerte jedoch die Zubereitung und Handhabung des Gels.
Es wurde gezeigt, dass ADSCs sich in einer 3D-Umgebung selbst aggregieren33. In ähnlicher Weise bildeten die Zellen in dieser Studie Zellaggregate mit einem traubenartigen Aussehen. Es wurden jedoch auch einfachliegende Zellen identifiziert. Zellablösung ist eine bekannte Eigenschaft von Sphäroiden, bei der sich Zellen vom Hauptsphäroid oder Aggregatkörper lösen und in die Kulturumgebung freigesetzt werden. Zellablösung kann aus zellulärer Proliferation resultieren, bei der lebensfähige Zellen während der Mitose abgestoßen werden und eine Migration ermöglichen34. Alternativ kann es zu einer Ablösung durch Zelltod und Verlust der Sphäroid- oder Aggregatform35 kommen, insbesondere bei sehr großen Sphäroiden aufgrund eines wachsenden nekrotischen Kerns. Die Zellen nahmen in 3D-Kulturen eine abgerundete Morphologie an, verglichen mit einer Spindelform in 2D-Kulturen. In Übereinstimmung mit den Ergebnissen ähnlicher Studien sind diese Ergebnisse auf einen Mangel an Anheftungsstellen oder extrazellulärer Matrix zurückzuführen, an denen die Zellen haften können 6,9. Darüber hinaus zeigten die Zellen keine signifikante Migration im Gel, was die Notwendigkeit von Anheftungsstellenweiter impliziert 36. Es wird empfohlen, ein Adhäsionspeptid oder ein anderes extrazelluläres Matrixprotein hinzuzufügen, um die Anheftung, Adhäsion und Migration zu erleichtern. Eine Einschränkung der Studie war die Verwendung der inversen Lichtmikroskopie zur Beobachtung der 3D-Morphologie der ADSCs anstelle von Z-Stacking. PBM-Exposition und 3D-Kultur hatten keinen signifikanten Einfluss auf die Zytotoxizität der ADSCs sowohl 24 h als auch 10 Tage nach der Exposition, was darauf hindeutet, dass Hydrogelkultur und PBM sicher sind und keine negativen Auswirkungen auf die Zellen haben 6,26. In der 3D-Zellkultur wurden ADSCs im Vergleich zur 2D-Zellkultur mit langsameren Proliferationsraten in Verbindung gebracht. Dies wird durch die geringen Proliferationsraten der normalen Kontrollen in der aktuellen Studie6 unterstützt. PBM (525 nm und 825 nm) erhöhte die Proliferationsraten von ADSCs in der 3D-Kultur signifikant. Anfänglich löste das grüne Licht (525 nm) sowohl bei 5 J/cm2 als auch bei 10 J/cm2 Fluenzen die höchsten Proliferationsraten im Vergleich zum Nahinfrarotlicht (825 nm) aus. Nach 10 Tagen weist das Nahinfrarotlicht (825 nm) jedoch die höchsten Proliferationsraten sowohl bei 5 J/cm2 als auch bei 10 J/cm2 Fluenzen auf. In ähnlicher Weise wurde gezeigt, dass PBM (525 nm und 825 nm) die Proliferationsraten in 2D-Kulturen erhöht37. Es wird empfohlen, auch eine Wellenlängenkombinationsgruppe einzubeziehen, da andere Studien über einen synergistischen Effekt von grünem und nahinfrarotem Licht berichtet haben.
Zusammenfassend lässt sich sagen, dass das verwendete Hydrogel ein synthetisches Hydrogel mit enormer Anpassungsfähigkeit ist, um den Anforderungen verschiedener Anwendungen gerecht zu werden. Die aktuelle Studie hat gezeigt, dass das Gel über einen Zeitraum von 10 Tagen keine zytotoxische Wirkung auf Zellen in Kultur hat. Darüber hinaus zeigte PBM ein positives augmentatives Potenzial, indem es die Proliferationsraten von ADSCs signifikant hochregulierte, obwohl es sich in einer 3D-Kulturumgebung befand. Somit kann dieses Hydrogel als möglicher Biomaterialträger für die Transplantation in Wunden dienen. Zukünftige Untersuchungen sollten darauf abzielen, die potenzielle Fähigkeit des Gels, die Wundheilung zu unterstützen, anhand von Tierversuchen zu testen. Wenn die Ergebnisse der Tierversuche günstig sind, ist vorgesehen, dass von Patienten stammende ADSCs vor der Transplantation in Wunden entnommen, eingekapselt und mit PBM angereichert werden können, um die Wundheilung in klinischen Anwendungen zu unterstützen.
Offenlegungen
Die Autoren erklären, dass keine konkurrierenden Interessen bestehen.
Danksagungen
Diese Forschung wurde finanziert von der National Research Foundation of South Africa Thuthuka Instrument, Fördernummer TTK2205035996; das vom Ministerium für Wissenschaft und Innovation (DSI) finanzierte African Laser Centre (ALC), Fördernummer HLHA23X Aufgabe ALC-R007; der University Research Council, Fördernummer 2022URC00513; die South African Research Chairs Initiative (DST-NRF/SARChI) des Ministeriums für Wissenschaft und Technologie, Fördernummer 98337. Die Fördergeber spielten keine Rolle bei der Konzeption der Studie, der Sammlung, der Analyse, der Interpretation der Daten oder dem Verfassen des Manuskripts. Die Autoren danken der University of Johannesburg (UJ) und dem Laser Research Centre (LRC) für die Nutzung der Einrichtungen und Ressourcen.
Materialien
| Name | Company | Catalog Number | Comments |
| 525 nm diode laser | National Laser Centre of South Africa | EN 60825-1:2007 | |
| 825 nm diode laser | National Laser Centre of South Africa | SN 101080908ADR-1800 | |
| 96 Well Strip Plates | Sigma-Aldrich | BR782301 | |
| Amphotericin B | Sigma-Aldrich | A2942 | Antibiotic (0.5%; 0.5 mL) |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | ATP reagent, Proliferation assay Kit |
| Corning 2 mL External Threaded Polypropylene Cryogenic Vial | Corning | 430659 | cryovial |
| CryoSOfree | Sigma-Aldrich | C9249 | Cell freezing media |
| CytoTox96 Non-Radioactive Cytotoxicity Assay | Promega | G1780 | Cytotoxicity reagent |
| Dulbecco’s Modified Eagle Media | Sigma-Aldrich | D5796 | Basal medium (39 mL/44 mL) |
| FieldMate Laser Power Meter | Coherent | 1098297 | |
| Flat-bottomed Corning 96 well clear polystyrene plate | Sigma-Aldrich | CLS3370 | |
| Foetal bovine serum | Biochrom | S0615 | Culture medium enrichment (5 mL; 10% / 10 mL; 20%) |
| Hanks Balanced Salt Solution (HBSS) | Sigma-Aldrich | H9394 | Rinse solution |
| Heracell 150i CO2 incubator | Thermo Scientific | 51026280 | |
| Heraeus Labofuge 400 | Thermo Scientific | 75008371 | Plate spinner for 96 well plates |
| Heraeus Megafuge 16R centrifuge | ThermoFisher | 75004270 | |
| Immortalized ADSCs | ATCC | ASC52Telo hTERT, ATCC SCRC-4000 | Passage 37 |
| Invitrogen Countess 3 | Invitrogen | AMQAX2000 | Automated cell counter for Trypan Blue |
| Julabo TW20 waterbath | Sigma-Aldrich | Z615501 | Waterbath used to warm media to 37 °C |
| Olympus CellSens Entry | Olympus | Version 3.2 (23706) | Imaging software: digital image acquisition |
| Olympus CKX41 | Olympus | SN9B02019 | Inverted light microscope |
| Olympus SC30 camera | Olympus | SN57000530 | Camera attached to inverted light microscope |
| Opaque-walled Corning 96 well solid polystyrene microplates | Sigma-Aldrich | CLS3912 | Opaque well used for ATP luminescence |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | Antibiotic (0.5%; 0.5 mL) |
| SigmaPlot 12.0 | Systat Software Incorporated | ||
| TrueGel3D – True3 | Sigma-Aldrich | TRUE3-1KT | 10 µL |
| TrueGel3D Enzymatic Cell Recovery Solution | Sigma-Aldrich | TRUEENZ | 01:20 |
| Trypan Blue Stain | Thermo Fisher - Invitrogen | T10282 | 0.4% solution |
| TrypLE Select Enzyme (1x) | Gibco | 12563029 | Cell detachment solution |
| Victor Nivo Plate Reader | Perkin Elmer | HH3522019094 | Spectrophotometric plate reader |
Referenzen
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: Implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Yuan, X., et al. Strategies for improving adipose-derived stem cells for tissue regeneration. Burns Trauma. 10, (2022).
- Nilforoushzadeh, M. A., et al. Mesenchymal stem cell spheroids embedded in an injectable thermosensitive hydrogel: An in situ drug formation platform for accelerated wound healing. ACS Biomater Sci Eng. 6 (9), 5096-5109 (2020).
- Yang, M., et al. Thermosensitive injectable chitosan/collagen/β-glycerophosphate composite hydrogels for enhancing wound healing by encapsulating mesenchymal stem cell spheroids. ACS Omega. 5 (33), 21015-21023 (2020).
- Chimenti, I., et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ Res. 106 (5), 971-980 (2010).
- Hassan, W., Dong, Y., Wang, W. Encapsulation and 3d culture of human adipose-derived stem cells in an in-situ crosslinked hybrid hydrogel composed of peg-based hyperbranched copolymer and hyaluronic acid. Stem Cell Res Ther. 4 (2), 32 (2013).
- Wu, K. H., Mo, X. M., Han, Z. C., Zhou, B. Stem cell engraftment and survival in the ischemic heart. The Ann Thorac Surg. 92 (5), 1917-1925 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: General approaches and a review of recent developments. J R Soc Interface. 8 (55), 153-170 (2011).
- Koivunotko, E., et al. Angiogenic potential of human adipose-derived mesenchymal stromal cells in nanofibrillated cellulose hydrogel. Biomedicines. 10 (10), 2584 (2022).
- Dong, Y., et al. Injectable and tunable gelatin hydrogels enhance stem cell retention and improve cutaneous wound healing. Adv Funct Mater. 27 (24), 1606619 (2017).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3d cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Mantha, S., et al. Smart hydrogels in tissue engineering and regenerative medicine. Materials. 12 (20), 3323 (2019).
- Sung, T. -. C., et al. 3D culturing of human adipose-derived stem cells enhances their pluripotency and differentiation abilities. J Mater Sci Technol. 63, 9-17 (2021).
- Garg, R. K., et al. Capillary force seeding of hydrogels for adipose-derived stem cell delivery in wounds. Stem Cells Transl Med. 3 (9), 1079-1089 (2014).
- Kim, Y. M., et al. Adipose-derived stem cell-containing hyaluronic acid/alginate hydrogel improves vocal fold wound healing. Laryngoscope. 124 (3), E64-E72 (2014).
- Dong, Y., et al. Conformable hyaluronic acid hydrogel delivers adipose-derived stem cells and promotes regeneration of burn injury. Acta Biomater. 108, 56-66 (2020).
- Truegel3d hydrogel for 3d cell culture. Merck Available from: https://www.sigmaaldrich.com/ZA/en/technical-documents/technical-article/cell-culture-and-cell-culture-analysis/3d-cell-culture/truegel3d (2024)
- Braccini, S., Tacchini, C., Chiellini, F., Puppi, D. Polymeric hydrogels for in vitro 3d ovarian cancer modeling. Int J Mol Sci. 23 (6), 3265 (2022).
- Mashinchian, O., et al. In vivo transcriptomic profiling using cell encapsulation identifies effector pathways of systemic aging. eLife. 11, e57393 (2022).
- Matsushige, C., Xu, X., Miyagi, M., Zuo, Y. Y., Yamazaki, Y. Rgd-modified dextran hydrogel promotes follicle growth in three-dimensional ovarian tissue culture in mice. Theriogenology. 183, 120-131 (2022).
- Marx, V. How some labs put more bio into biomaterials. Nat Methods. 16 (5), 365-368 (2019).
- Marques, M. M. Photobiomodulation therapy weaknesses. Laser Dent Sci. 6 (3), 131-132 (2022).
- Hamblin, M. R. Mechanisms and mitochondrial redox signaling in photobiomodulation. Photochem Photobiol. 94 (2), 199-212 (2018).
- Chen, J., et al. Low-level controllable blue LEDs irradiation enhances human dental pulp stem cells osteogenic differentiation via transient receptor potential vanilloid 1. J Photochem Photobiol B. 233, 112472 (2022).
- Chang, S. -. Y., Carpena, N. T., Kang, B. J., Lee, M. Y. Effects of photobiomodulation on stem cells important for regenerative medicine. Med Lasers. 9 (2), 134-141 (2020).
- Bikmulina, P. Y., et al. Beyond 2d: Effects of photobiomodulation in 3d tissue-like systems. J Biomed Opt. 25 (4), 048001 (2020).
- Ahmadi, H., et al. Transplantation of photobiomodulation-preconditioned diabetic stem cells accelerates ischemic wound healing in diabetic rats. Stem Cell Res Ther. 11 (1), 494 (2020).
- Mao, A. S., Mooney, D. J. Regenerative medicine: Current therapies and future directions. Proc Natl Acad Sci U S A. 112 (47), 14452-14459 (2015).
- De Andrade, A. L. M., et al. Effect of photobiomodulation on the behaviour of mesenchymal stem cells in three-dimensional cultures. Lasers Med Sci. 38 (1), 221 (2023).
- Diniz, I. M., et al. Photobiomodulation of mesenchymal stem cells encapsulated in an injectable rhbmp4-loaded hydrogel directs hard tissue bioengineering. J Cell Physiol. 233 (6), 4907-4918 (2018).
- Carter, M., Shieh, J. C. . Guide to Research Techniques in Neuroscience. , (2015).
- Lutolf, M. P., et al. Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration: Engineering cell-invasion characteristics. Proc Natl Acad Sci U S A. 100 (9), 5413-5418 (2003).
- Robledo, F., et al. Spheroids derived from the stromal vascular fraction of adipose tissue self-organize in complex adipose organoids and secrete leptin. Stem Cell Res Ther. 14 (1), 70 (2023).
- Landry, J., Freyer, J. P., Sutherland, R. M. Shedding of mitotic cells from the surface of multicell spheroids during growth. J Cell Physiol. 106 (1), 23-32 (1981).
- Bogacheva, M. S., et al. Differentiation of human pluripotent stem cells into definitive endoderm cells in various flexible three-dimensional cell culture systems: Possibilities and limitations. Front Cell Dev Biol. 9, 726499 (2021).
- Chen, X., Thibeault, S. L. Biocompatibility of a synthetic extracellular matrix on immortalized vocal fold fibroblasts in 3-d culture. Acta Biomater. 6 (8), 2940-2948 (2010).
- Crous, A., Van Rensburg, M. J., Abrahamse, H. Single and consecutive application of near-infrared and green irradiation modulates adipose derived stem cell proliferation and affect differentiation factors. Biochimie. 196, 225-233 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten