Method Article
光生体調節増強を用いたハイドロゲル中での脂肪由来幹細胞の三次元細胞培養
要約
ここでは、脂肪由来幹細胞(ADSC)培養のための3次元(3D)細胞培養フレームワークとしてのハイドロゲルの使用と、3D培養環境内でのADSCの増殖を促進するための光生体調節(PBM)の導入を実証するプロトコルを紹介します。
要約
脂肪由来幹細胞(ADSC)は、幹細胞に似た多能性間葉系の特徴を持ち、多様な細胞分化能を持ち、遊走・増殖の促進・炎症緩和などの能力を有することから、再生医療に利用されています。しかし、ADSCは、主に好ましくない炎症状態のために、創傷内での生存と生着に課題に直面することがよくあります。この問題に対処するために、創傷におけるADSCの生存率を維持し、創傷治癒プロセスを促進するハイドロゲルが開発されました。ここでは、3D細胞培養フレームワーク内でのADSC増殖と細胞毒性に対する光生体調節(PBM)の相乗効果を評価することを目的としていました。不死化ADSCを10μLのハイドロゲルに2.5×103 細胞の密度で播種し、525nmおよび825nmのダイオードを用いて5J/cm2 および10J/cm2の流暢さで照射した。形態学的変化、細胞毒性、および増殖は、PBM曝露後24時間および10日後に評価されました。ADSCは丸みを帯びた形態を示し、個々の細胞またはスフェロイド凝集体としてゲル全体に分散していました。重要なことは、PBMと3D培養フレームワークの両方が細胞に細胞傷害性の影響を示さなかったのに対し、PBMはADSCの増殖速度を有意に高めたことです。結論として、この研究は、ADSC培養に適した3D環境としてのハイドロゲルの使用を実証し、特に3D細胞培養に関連する増殖速度の遅さに対処する重要な増強戦略としてPBMを導入します。
概要
ADSCは、自己複製して複数の細胞系統に分化する能力を持つ間葉系多能性前駆細胞です。これらの細胞は、脂肪吸引法中に脂肪組織の間質血管分画(SVF)から採取することができる1。ADSCは、豊富で、採取に対する侵襲性が低く、入手が容易で、特性が良好であるため、再生医療に使用するのに理想的な幹細胞タイプとして浮上しています2。幹細胞治療は、細胞の遊走、増殖、血管新生を刺激し、創傷内の炎症を軽減することにより、創傷治癒の道筋を提供します3,4。ADSCの再生能力の約80%は、セクレトーム5を介したパラクリンシグナル伝達に起因しています。以前は、損傷した組織に幹細胞または成長因子を直接局所的に注入すると、in vivo修復メカニズムが十分に低下する可能性があることが示唆されていました6,7,8。しかし、このアプローチは、生存率の低下や、炎症環境の結果として損傷した組織内の幹細胞生着の減少など、いくつかの課題に直面していました9。さらに、理由の1つは、移植された細胞の生存と機能をサポートするための細胞外マトリックスの欠如であった10。これらの課題を克服するために、現在、幹細胞の生存率と機能をサポートする生体材料担体の開発に重点が置かれています。
3次元(3D)細胞培養は、in vitroでの細胞間および細胞とマトリックス間の相互作用を強化して、in vivo環境によりよく類似した環境を提供する11。ハイドロゲルは、幹細胞培養のための3D環境を提供する生体材料担体のクラスとして広く研究されてきました。これらの構造は、水と架橋ポリマー12からなる。ADSCをハイドロゲルに封入しても、細胞の生存率を維持しながら、培養中の細胞に細胞毒性の影響はほとんどありません6。3Dで培養された幹細胞は、幹細胞性の保持力を高め、分化能を向上させることを示している13。同様に、ハイドロゲルを播種したADSCは、動物モデルにおいて生存率の向上と創傷閉鎖の促進を示した14。さらに、ヒドロゲルのカプセル化は、創傷におけるADSCの生着および保持を有意に増加させる15,16。TrueGel3Dは、ポリビニルアルコールまたはデキストランのいずれかのポリマーを、架橋剤(シクロデキストリンまたはポリエチレングリコール)で固化させたものです17。ゲルは、細胞外マトリックスを効果的に模倣しながら、実験を妨害したり、ゲルの患者への移植中に免疫反応を引き起こしたりする可能性のある動物性製品を一切含まない合成ハイドロゲルである18。ゲルは、組成と個々の成分を変更することにより、完全にカスタマイズ可能です。異なる幹細胞を収容し、ゲル19の硬さを調整することにより、いくつかの細胞タイプの分化をサポートすることができる。結合部位は、ペプチド20の添加によって作成することができる。ゲルはメタロプロテアーゼの分泌によって分解され、細胞遊走を可能にする21。最後に、それは明確であり、イメージング技術を可能にします。
PBMは、細胞内の発色団を刺激するために使用される低侵襲で簡単に実行できる低レベルレーザー療法です。波長が異なれば、細胞に異なる効果がもたらされる22。赤色から近赤外の範囲の光は、電子伝達系を通るフラックスを増強することにより、アデノシン三リン酸(ATP)および活性酸素種(ROS)産生の増加を刺激する23。青と緑の範囲の光は、光依存性イオンチャネルを刺激し、カルシウムやマグネシウムなどの陽イオンの細胞内への非特異的流入を可能にし、分化を促進することが知られている24。正味の効果は、遊走、増殖、分化などの下流の細胞プロセスを引き起こす因子の転写を刺激する二次メッセンジャーの生成である25。PBMは、細胞を有害な環境、例えば損傷した組織に移植する前に、細胞が増殖または分化するように前もって調整するために用いることができる26。ADSCの移植前および移植後のPBM(630 nmおよび810 nm)曝露は、糖尿病ラットモデルにおいて、in vivoでのこれらの細胞の生存率および機能を有意に向上させた27。再生医療では、組織を効果的に修復するために十分な数の細胞が必要です28。3D細胞培養では、ADSCは2次元細胞培養と比較して増殖速度が遅いことがわかっている6。しかし、PBMは、生存率、増殖、遊走、および分化を促進することにより、ADSCの3D細胞培養プロセスを強化するために使用できます29,30。
プロトコル
注:このプロトコルで使用されるすべての材料、試薬、およびソフトウェアに関する詳細については、 材料表 を参照してください。プロトコルを 図1にまとめました。
1. 2次元(2D)細胞培養
注:不死化ADSC(1 x106 細胞)は、1 mLの細胞凍結培地を含む凍結保存バイアル内の液体窒素中で-195.8°Cで保存されます。
- 2D細胞回収培地および2D培養フラスコの調製
- 39 mLの基礎培地を50 mLの遠心チューブに移します
- 20%ウシ胎児血清(FBS;10 mL)と抗生物質(1 mL)(0.5 mLペニシリン-ストレプトマイシンおよび0.5 mLアムホテリシンB)で基礎培地を濃縮します。.
- 6 mLの細胞回収培地をフラスコに移してT75フラスコをプレコンディショニングし、37°C、5%CO2、湿度85%で45分間インキュベートします(これは、時間を節約するために細胞回収ステップの実行中に行うことができます)。
注:使用前に培地全体を37°Cに温め、4°Cで最大1週間保管してください。
- 2D細胞回収
- 液体窒素貯蔵タンクからクライオバイアルを取り出し、37°Cの水浴中でバイアルを完全に解凍するまで急速に解凍します。
- 1006 x g の遠心分離機でクライオバイアルを5分間(20°C)回転させ、その後上清を除去します。
- 予熱した細胞回収培地1 mLを使用して、ペレット化した細胞を再懸濁します。
- 浮遊細胞をプレコンディショニングフラスコ(最終容量7 mL)に均等に分配し、37°C、5%CO2、湿度85%でインキュベートします。
- 24時間後、細胞回収培地を廃棄して交換します。
- フラスコが細胞と合流するまで、2〜3日ごとに培地を交換します。
- 単一細胞懸濁液中の2D培養フラスコの回収と細胞数
- インキュベーターから2D培養フラスコを取り出し、培地を適切な廃液容器に廃棄します。
- 10 mLのリンス溶液をフラスコに移して細胞をすすぎ、老廃物やタンパク質の蓄積を取り除きます。その後、すすぎ液を捨てます。
- 培養フラスコに6 mLの剥離液を加え、細胞を剥離します。フラスコを37°C、5%CO2、湿度85%で2分間インキュベートします。
注:フラスコを顕微鏡で観察し、すべての細胞が剥離していることを確認します。そうでない場合は、フラスコをそっとたたき、さらに1分間インキュベートします。 - すべての細胞が剥離されたら、細胞懸濁液を15 mLの遠心チューブに移し、1 mLの細胞回収培地(20%FBSを含む)をチューブに加えます。これにより、デタッチメントソリューションの効果が中和されます。
- チューブを1711 x g(20°C)で5分間遠心分離します。
- 上清を除去し、細胞を1 mLの完全培地に再懸濁します。
- 細胞懸濁液10 μLを取り出し、500 μLの微量遠心チューブに入れ、10 μLのトリパンブルーと1:1の比率で混合します。
- 10 μLのトリパンブルー細胞溶液混合物を細胞計数チャンバーに2回入れます。
- 細胞計数チャンバーを自動セルカウンターに入れます。セルカウンターには、mLあたりの細胞の総数と、生細胞と死細胞の数が表示されます。平均生細胞数と、3Dハイドロゲルに包埋するために必要な生細胞数を計算します(ステップ2.2.6)。
2. 3D細胞培養
- 3D完全培地の調製
- 44 mLの基礎培地を50 mLの遠心チューブに移します。
- 10%FBS(5 mL)および抗生物質(1 mL)(0.5 mLペニシリン-ストレプトマイシンおよび0.5 mLアムホテリシンB)で培地を濃縮します。
注意: 使用前に培地全体を37°Cに温め、4°Cで最大1週間保管してください。
- ヒドロゲルの調製
- ファストデキストランバイアルを遠心分離(20°Cで30秒間1000 x g )してファストデキストランを調製し、材料を濃縮します。ファストデキストランバイアルに175 μLの水を加えて、最終濃度を30 mmol/Lの反応基にします。
- 材料が完全に溶解するまで、ファストデキストラン溶液を含むチューブをボルテックスします(中速で30秒)。溶解した物質を氷上で5分間インキュベートします。チューブを遠心分離し、短時間ボルテックスし、さらに使用する間は氷上に保管してください。
- 架橋剤(1000 x g 、20°Cで30秒)を遠心分離し、材料を濃縮します。架橋剤バイアルに188 μLの水を加え、最終濃度が20 mmol/Lのチオール基になるようにします。
- すべての材料が溶解するまで、架橋剤溶液を含むチューブをボルテックスします(中速で30秒)。溶解した架橋剤を室温(RT)で5分間インキュベートします。チューブを遠心分離し、短時間ボルテックスし、さらに使用する間は室温に保持します。
- コスト削減のために、ハイドロゲルプロトコルを 30 μL から 10 μL に適合させます(具体的な詳細については、 表 1 を参照)。
- 細胞懸濁液を調製して、ヒドロゲル10μLあたり2.5 x 103 細胞の播種密度を達成します。
- 表1に従って成分を組み合わせ、マスターミックスを作成します。マスターミックス 9 μL を 96 ウェルストリッププレートのウェルに移します。
- マスターミックスを転写してから3分後に分解性架橋剤1μLを添加してゲルを固化させます。
- ヒドロゲルを170μLの予熱した完全培地で覆います。1時間インキュベートします。1時間後、培地を交換します。
注:ハイドロゲル包埋細胞は、3D培養システム内でさらなる実験や分析を行う準備ができています。ダウンストリーム アプリケーションの必要に応じて、追加のプロトコルに従います。
3. 光生体調節曝露
- レーザーのセットアップ
- 緑色(525 nm)または近赤外(825 nm)の波長用にダイオードレーザーシステムをセットアップします。レーザーのスイッチを入れ、推奨される時間ウォームアップします。
- レーザーが定常状態に達するようにすることで、レーザーの出力を安定させます。これにより、安定した正確な照射が保証されます。
- レーザーパワーメーターを使用してレーザーの出力を測定します。各波長のパワー値を記録します。
- 式1(レーザー照射時間)を用いて、レーザー照射時間を計算します。 表2 の値を式1に代入して、各フルエンシーの適切な照射時間を決定します。式1中、「r」はレーザの照射ゾーンの半径を表す。

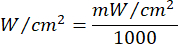

数式 1 - 流暢さ(5 J/cm²または10 J/cm²)やレーザー出力など、計算に必要な特定のパラメータについては、 表2 を参照してください。
- 3D細胞培養への照射
- 培地全体を交換した後(ステップ2.2.9)、ハイドロゲル包埋細胞を含む96ウェルプレートをダイオードレーザーシステムの下に置きます。選択した流暢さ(5 J /cm²または10 J /cm²)に対して計算されたレーザー照射時間を、選択した波長(緑色または近赤外)でハイドロゲルに照射します。したがって、培養物は単回投与のみを受けます。
- 各実験グループには、PBM曝露なしでハイドロゲルに埋め込まれたADSCで構成されるコントロール(n = 4)が添付されていることを確認します。
注意: 作業する光の波長に適した保護メガネを常に着用してください。レーザーは安全キャビネットの外で使用されます。したがって、使用前にその領域を消毒することが非常に重要です。 - 実験期間中、培養プレートを37°C、5%CO2、湿度85%でインキュベートします。照射後、最初の分析ではプレートを 24 時間、2 回目の分析期間では 10 日間インキュベートします。
4. 形態学
- 倒立光学顕微鏡
- 倒立光学顕微鏡の電源を入れ、数分間ウォームアップします。顕微鏡の位置が適切で校正されていることを確認します。
- 実験のセットアップに応じて、顕微鏡スライドまたは専用の細胞培養皿で観察するためにサンプルを準備します。最適なイメージング条件になるように顕微鏡を校正します。
- 必要に応じて、フォーカス、明るさ、コントラストの設定を調整します。顕微鏡の20倍対物レンズを選択して、細胞の形態を観察および記録します。
- サンプルを顕微鏡ステージに置き、接眼レンズを使用して目的の細胞に焦点を合わせます。接眼レンズまたはカメラビューを使用して、細胞の形態を観察し、記録します。セルの形状、サイズ、および特徴的な機能に注意してください。
- カメラモジュールを顕微鏡に取り付けます。デジタルイメージング用にカメラを設定します。カメラと顕微鏡の間の適切な接続と通信を確認してください。
- 20倍の対物レンズを使用して、観察された細胞のデジタル画像を撮影します。カメラコントロールを使用して、露出、フォーカス、およびその他の関連設定を調整します。
注:キャプチャされた画像が高品質であり、細胞形態の代表的なビューを提供することを確認してください。 - コンピュータでイメージングソフトウェアを起動します。画像をキャプチャし、ソフトウェア内の解析ツールを使用して細胞形態を解析します。
- 実験の目的に基づいて、細胞の寸法を測定したり、細胞をカウントしたり、関連する分析を実行したりします。
- ソフトウェアを使用して、画像に適切な縮尺記号を追加します。顕微鏡対物レンズの既知の倍率を使用して、画像のスケールを正確に表します。
5. 生化学的アッセイ
- 細胞の回収
注:細胞は、さらに下流の生化学的アッセイのために、単一細胞懸濁液中のハイドロゲルから回収する必要があります。- 酵素細胞回収液を調製します。無菌環境下で、酵素細胞回収液をリン酸緩衝生理食塩水(PBS)で1:20の割合で希釈して作業溶液を調製します(溶液:PBS)。特定の数のゲルまたはウェルから細胞を回収する必要がある場合は、ゲルあたり30 μLの回収溶液に基づいて必要な総容量を計算します。
- 回収が必要な細胞を含む各ゲルまたはウェルに30 μLの作業溶液を加えます。プレートを静かに揺らしたり渦巻かせたりして、回収液を完全かつ均一に分配します。推奨されるインキュベーション時間に従って、プレートを回収溶液でインキュベートします。この情報は通常、サプライヤーが提供する製品データシートまたはプロトコルに記載されています。
- インキュベーション期間が終わったら、プレートをインキュベーターから慎重に取り外します。プレートを1409 x g で5分間(20°C)遠心分離し、細胞をペレット化します。推奨される遠心分離条件については、製品データシートまたはプロトコールを参照してください。遠心分離が完了したら、細胞ペレットを乱さないように注意しながら、上清を慎重に廃棄します。
- ペレット化した細胞を220 μLの滅菌PBSに静かに再懸濁します。均一な単一細胞懸濁液を得るために、完全に混合してください。これで、細胞は下流の生化学的アッセイの準備が整いました。回収した細胞の性質と実験セットアップの要件を考慮して、目的のアッセイの特定のプロトコルに従ってください。
- 乳酸デヒドロゲナーゼ(LDH)細胞毒性アッセイ
- 各ウェルについて、50 μLの完全培地を慎重に除去し、細胞層への乱れを最小限に抑えます。
- 残りの50 μLの培地を含む各ウェルに、50 μLの細胞毒性試薬を直接添加します。ピペッティングで上下に穏やかに混合し、サンプルと試薬が完全に混合されるようにします。
- ポジティブコントロールを準備します。キットに含まれるポジティブコントロール細胞50 μLあたり5 μLの10倍溶解溶液で3重ウェルをセットアップします。
- プレートを推奨温度と時間でインキュベートします。このステップにより、細胞毒性試薬が細胞を溶解し、LDHを培地に放出することができます。
- インキュベーション期間終了後、細胞毒性試薬と細胞溶解液を含む各ウェルに50 μLの停止溶液を直接添加します。ピペッティングで上下に静かに混合し、反応を適切に停止させます。
注:ストップ溶液は、それ以上のLDH放出を停止し、発色の安定性を確保します。 - 分光光度計プレートリーダーは、製造元の指示に従ってセットアップしてください。490 nmにおける各ウェルの吸光度を記録します。この波長は、LDH反応によって生成されたホルマザン生成物の比色検出に特異的です。
- 処理群と対照ウェルの両方からバックグラウンド吸光度の読み取り値を差し引きます。培地を含むウェルおよび細胞を含まない細胞毒性試薬からバックグラウンド測定値を取得します。
- 各サンプルの補正された吸光度値を分析して、細胞毒性レベルを決定します。吸光度値が高いほど、LDHの放出が増加し、その結果、細胞毒性が高くなります。
- 統計的正確性のために、各実験グループとコントロールが4回の繰り返し(ステップ3.2.2)で構成されていることを確認します。各グループとコントロールの平均吸光度を計算し、適切な統計プログラムにインポートします。
- 治療群と適切な対照の結果を比較して、細胞毒性効果を正確に評価し、将来の参照のためにすべての吸光度の測定値、計算、および実験条件を記録します。
- ATP増殖アッセイ
- 無菌環境で、回収した細胞50 μLとATP試薬50 μLを各ウェルで混合します。
注:細胞と試薬の量は、ウェルの数と実験デザインに基づいて調整してください。正確な結果を得るために、一貫した比率を維持します。 - プレートをシェーカーの上に置き、暗闇で5分間激しく振る。このステップにより、細胞と試薬が完全に混合されます。振とう後、室温でさらに25分間プレートをインキュベートします。このインキュベーション期間により、試薬は細胞を溶解し、存在するATPの量に比例した発光シグナルを生成することができます。
- 発光検出に関する製造元の指示に従ってプレートリーダーをセットアップします。細胞ライセートとATP試薬を含む各ウェルからの発光を測定します。プレートリーダーが適切な設定で発光を測定するように設定されていることを確認します。
- 治療群と対照ウェルの両方からバックグラウンド発光測定値を減算します。ATP試薬とPBSのみを含むウェルからバックグラウンド測定値を取得し、細胞を含みません。
- 各サンプルの補正された発光値を分析して、細胞の増殖または生存率を反映したATPレベルを決定します。
- 統計的正確性のために、各実験グループとコントロールが4回の繰り返し(ステップ3.2.2)で構成されていることを確認します。各グループとコントロールの平均発光を計算し、適切な統計プログラムにインポートします。
- 治療群と関連する対照群の結果を比較して、ATP増殖を正確に評価します。将来の参照のために、すべての発光測定値、計算、および実験条件を記録します。
注:キット形式のすべての生化学的分析については、推奨されるインキュベーション時間、濃度、追加の手順や考慮事項など、具体的な詳細について、メーカーが提供するキットのマニュアルまたはプロトコルに従ってください。化学物質や生物学的物質を取り扱うときは、常に実験室の安全ガイドラインを遵守してください。
- 無菌環境で、回収した細胞50 μLとATP試薬50 μLを各ウェルで混合します。
結果
ハイドロゲルの形態を評価し、細胞密度を目視検査するために、逆顕微鏡を使用しました(図2)。ADSCは、播種およびPBM曝露後24時間で丸みを帯びた形態を保持しました。細胞は、単一細胞として、またはブドウのようなクラスターとしてゲル全体に散在していました。形態は3D培養で10日後も変化しなかった。実験群と対照群の間、または異なる実験群間で形態に決定的な違いは認められなかった。
PBM曝露およびハイドロゲルを用いた3D培養の細胞毒性効果を評価するために、LDH漏出を測定しました(図3)。24時間または10日後に実験群と対照群の間に有意差はなく、PBM曝露およびハイドロゲル培養は細胞に有害な影響を及ぼさなかったことが示された。
細胞増殖速度は、ADSCのATP含量を測定することによって測定されました(図4)。PBM曝露は、対照群と比較して、すべての実験群で増殖率の増加をもたらした。PBM曝露後24時間で、525 nmの波長が最も高い増殖速度を刺激しました。しかし、10日目の時点では、825nmの波長は525nmの波長と比較して優れた増殖速度を示しました。 10日間の培養期間の終わりに、825 nm、10 J/cm2 グループは最も高い増殖速度を示しました。

図1:プロトコルの概要 96ウェルプレートでのハイドロゲルの調製、PBM曝露、およびPBM曝露後24時間および10日での形態および生化学的アッセイの測定を強調する要約されたプロトコル。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2:シード後のADSCの自己集約 細胞は円形から楕円形の形態を保持し、播種およびPBM曝露の(A)24時間および(B)10日後にブドウのようなクラスター外観を有する単一細胞または凝集体としてハイドロゲル中に分布した。10日間のインキュベーション後に決定的な変化は観察されませんでした。.対照(1および4)を用いて、5 J/cm2 (2)および10 J/cm2 (5)で525 nm、または5 J/cm2 (3)および10 J/cm2 (6)で825 nm。 この図の拡大版をご覧になるには、ここをクリックしてください。

図3:ハイドロゲル中の525 nmおよび825 nmダイオード(5 J / cm2 および10 J / cm2)を使用した、PBM曝露後24時間および10日間の細胞毒性の測定としての細胞LDH漏出。 実験対照と比較して細胞毒性の有意な増加は観察されませんでした。.ポジティブコントロールは完全な細胞死を代表していました。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4:ハイドロゲル中の525 nmおよび825 nmダイオード(5 J/cm2 および10 J/cm2)を使用した、PBM曝露後24時間および10日間の増殖の測定値としての細胞ATP。 PBM曝露は、すべての実験群において、両方の時点および両方の流暢さにおいて増殖率の増加を刺激した。有意差(P < 0.001)は***で示されます。 この図の拡大版をご覧になるには、ここをクリックしてください。
| コンポーネント | ウェルあたりの容量(μL) |
| SLO-デキストランポリマー(30 mmol/L) | 0.7 |
| 細胞懸濁液 | 2 |
| バッファ | 0.8 |
| 水 | 5.5 |
| 架橋剤 | 1 |
| 総ボリューム | 10 |
表1:ハイドロゲル(10 μL)試薬量。
| レーザーパラメータ | グリーン(G) | 近赤外(NIR) |
| 光源 | ダイオードレーザー | ダイオードレーザー |
| 波長(nm) | 525 | 825 |
| 電力出力(mW) | 553 | 515 |
| 電力密度(mW/cm2) | 57.48 | 53.53 |
表2:レーザーパラメータ。
ディスカッション
ADSCは、創傷治癒を助けるさまざまなプロセスを刺激するため、再生医療に使用するのに理想的な細胞タイプです3,4。しかし、生存率の低さや損傷部位での細胞の生着効果のなさなど、回避しなければならないいくつかの課題があります9。不死化細胞は、初代細胞と比較してより多くの世代にわたって継代することができ、収穫する必要がなく、十分に特徴付けられており、一貫した結果を保証する均質な集団であるため、市販の細胞株として使用されました31。この研究の目的は、3D細胞培養を使用して、ADSCの増殖と細胞毒性に対するPBMの増強の可能性を決定することでした。30 μL のハイドロゲルに関するメーカーのプロトコルは、コスト32 を節約するために 10 μL に適合されています。しかし、この減容積により、ゲルの調製と取り扱いがより困難になりました。
ADSCは、3D環境内で自己凝集することが示されている33。この研究では、細胞はブドウのような外観の細胞凝集体を形成しました。しかし、単独産卵細胞も同定された。細胞脱落は、細胞がメインのスフェロイドまたは凝集体から分離し、培養環境に放出されるスフェロイドの既知の特性です。細胞の脱落は、有糸分裂中に生細胞が脱落し、遊走を可能にする細胞増殖から生じる可能性があります34。或いは、脱落は、細胞死およびスフェロイドまたは凝集体形状の喪失35、特に壊死コアの成長による非常に大きなスフェロイドにおいて生じ得る。細胞は、2D培養の紡錘体形状と比較して、3D培養では丸みを帯びた形態を採用しました。同様の研究の結果と一致して、これらの結果は、細胞が付着するための付着部位または細胞外マトリックスの欠如によるものです6,9。さらに、細胞はゲル内で有意な移動を示さず、接着部位36の必要性をさらに示唆した。接着ペプチドまたは別の細胞外マトリックスタンパク質を添加して、接着、接着、および遊走を促進することが推奨されます。この研究の限界は、Zスタッキングの代わりにADSCの3D形態を観察するために逆光学顕微鏡を使用していたことです。PBM曝露と3D培養は、曝露後24時間および10日後の両方でADSCの細胞毒性に有意な影響を及ぼさず、ハイドロゲル培養とPBMは安全であり、細胞に悪影響を及ぼさないことを示しています6,26。3D細胞培養では、ADSCは2D細胞培養と比較して増殖速度が遅いとされています。これは、現在の研究6における正常対照の増殖率の低さによって裏付けられています。PBM(525 nmおよび825 nm)は、3D培養におけるADSCの増殖速度を有意に増加させました。当初、5 J/cm2 と 10 J/cm2 の両方のフルエンシーの緑色光 (525 nm) は、近赤外光 (825 nm) と比較して最も高い増殖率を示しました。しかし、10日時点では、近赤外光(825 nm)は、5 J/cm2と10 J/cm2の両方のフルエンシーで最も高い増殖率を示しています。同様に、PBM(525 nmおよび825 nm)は、2D培養における増殖速度を増加させることが実証されている37。他の研究では、緑色光と近赤外光の相乗効果が報告されているため、波長の組み合わせグループを含めることもお勧めします。
結論として、使用されるハイドロゲルは、さまざまな用途のニーズに合わせて驚異的なカスタマイズ能力を備えた合成ヒドロゲルです。現在の研究では、ゲルが10日間にわたって培養中の細胞に細胞毒性効果を及ぼさないことが実証されています。さらに、PBMは、3D培養環境にあるにもかかわらず、ADSCの増殖速度を有意に向上させることにより、正の増強の可能性を示しました。したがって、このヒドロゲルは、創傷への移植のための可能な生体材料担体として役立つことができる。今後の研究は、動物実験を用いて創傷治癒を補助するゲルの潜在的な能力をテストすることを目的とすべきである。動物実験の結果が良好であれば、臨床応用における創傷治癒を支援するために、創傷に移植する前に、患者由来のADSCを採取し、カプセル化し、PBMで増強することが想定されています。
開示事項
著者らは、競合する利害関係がないことを宣言します。
謝辞
この研究は、南アフリカ国立研究財団のThuthuka Instrument、助成金番号TTK2205035996から資金提供を受けました。科学イノベーション省(DSI)は、アフリカレーザーセンター(ALC)に資金を提供し、助成金番号HLHA23XタスクALC-R007。大学研究評議会、助成金番号2022URC00513;科学技術省の南アフリカ研究委員長イニシアチブ(DST-NRF / SARChI)、助成金番号98337。資金提供機関は、研究のデザイン、収集、分析、データの解釈、原稿の執筆に何の役割も果たしませんでした。著者らは、ヨハネスブルグ大学(UJ)とレーザー研究センター(LRC)の施設とリソースの使用に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 525 nm diode laser | National Laser Centre of South Africa | EN 60825-1:2007 | |
| 825 nm diode laser | National Laser Centre of South Africa | SN 101080908ADR-1800 | |
| 96 Well Strip Plates | Sigma-Aldrich | BR782301 | |
| Amphotericin B | Sigma-Aldrich | A2942 | Antibiotic (0.5%; 0.5 mL) |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | ATP reagent, Proliferation assay Kit |
| Corning 2 mL External Threaded Polypropylene Cryogenic Vial | Corning | 430659 | cryovial |
| CryoSOfree | Sigma-Aldrich | C9249 | Cell freezing media |
| CytoTox96 Non-Radioactive Cytotoxicity Assay | Promega | G1780 | Cytotoxicity reagent |
| Dulbecco’s Modified Eagle Media | Sigma-Aldrich | D5796 | Basal medium (39 mL/44 mL) |
| FieldMate Laser Power Meter | Coherent | 1098297 | |
| Flat-bottomed Corning 96 well clear polystyrene plate | Sigma-Aldrich | CLS3370 | |
| Foetal bovine serum | Biochrom | S0615 | Culture medium enrichment (5 mL; 10% / 10 mL; 20%) |
| Hanks Balanced Salt Solution (HBSS) | Sigma-Aldrich | H9394 | Rinse solution |
| Heracell 150i CO2 incubator | Thermo Scientific | 51026280 | |
| Heraeus Labofuge 400 | Thermo Scientific | 75008371 | Plate spinner for 96 well plates |
| Heraeus Megafuge 16R centrifuge | ThermoFisher | 75004270 | |
| Immortalized ADSCs | ATCC | ASC52Telo hTERT, ATCC SCRC-4000 | Passage 37 |
| Invitrogen Countess 3 | Invitrogen | AMQAX2000 | Automated cell counter for Trypan Blue |
| Julabo TW20 waterbath | Sigma-Aldrich | Z615501 | Waterbath used to warm media to 37 °C |
| Olympus CellSens Entry | Olympus | Version 3.2 (23706) | Imaging software: digital image acquisition |
| Olympus CKX41 | Olympus | SN9B02019 | Inverted light microscope |
| Olympus SC30 camera | Olympus | SN57000530 | Camera attached to inverted light microscope |
| Opaque-walled Corning 96 well solid polystyrene microplates | Sigma-Aldrich | CLS3912 | Opaque well used for ATP luminescence |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | Antibiotic (0.5%; 0.5 mL) |
| SigmaPlot 12.0 | Systat Software Incorporated | ||
| TrueGel3D – True3 | Sigma-Aldrich | TRUE3-1KT | 10 µL |
| TrueGel3D Enzymatic Cell Recovery Solution | Sigma-Aldrich | TRUEENZ | 01:20 |
| Trypan Blue Stain | Thermo Fisher - Invitrogen | T10282 | 0.4% solution |
| TrypLE Select Enzyme (1x) | Gibco | 12563029 | Cell detachment solution |
| Victor Nivo Plate Reader | Perkin Elmer | HH3522019094 | Spectrophotometric plate reader |
参考文献
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: Implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Yuan, X., et al. Strategies for improving adipose-derived stem cells for tissue regeneration. Burns Trauma. 10, (2022).
- Nilforoushzadeh, M. A., et al. Mesenchymal stem cell spheroids embedded in an injectable thermosensitive hydrogel: An in situ drug formation platform for accelerated wound healing. ACS Biomater Sci Eng. 6 (9), 5096-5109 (2020).
- Yang, M., et al. Thermosensitive injectable chitosan/collagen/β-glycerophosphate composite hydrogels for enhancing wound healing by encapsulating mesenchymal stem cell spheroids. ACS Omega. 5 (33), 21015-21023 (2020).
- Chimenti, I., et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ Res. 106 (5), 971-980 (2010).
- Hassan, W., Dong, Y., Wang, W. Encapsulation and 3d culture of human adipose-derived stem cells in an in-situ crosslinked hybrid hydrogel composed of peg-based hyperbranched copolymer and hyaluronic acid. Stem Cell Res Ther. 4 (2), 32 (2013).
- Wu, K. H., Mo, X. M., Han, Z. C., Zhou, B. Stem cell engraftment and survival in the ischemic heart. The Ann Thorac Surg. 92 (5), 1917-1925 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: General approaches and a review of recent developments. J R Soc Interface. 8 (55), 153-170 (2011).
- Koivunotko, E., et al. Angiogenic potential of human adipose-derived mesenchymal stromal cells in nanofibrillated cellulose hydrogel. Biomedicines. 10 (10), 2584 (2022).
- Dong, Y., et al. Injectable and tunable gelatin hydrogels enhance stem cell retention and improve cutaneous wound healing. Adv Funct Mater. 27 (24), 1606619 (2017).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3d cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Mantha, S., et al. Smart hydrogels in tissue engineering and regenerative medicine. Materials. 12 (20), 3323 (2019).
- Sung, T. -. C., et al. 3D culturing of human adipose-derived stem cells enhances their pluripotency and differentiation abilities. J Mater Sci Technol. 63, 9-17 (2021).
- Garg, R. K., et al. Capillary force seeding of hydrogels for adipose-derived stem cell delivery in wounds. Stem Cells Transl Med. 3 (9), 1079-1089 (2014).
- Kim, Y. M., et al. Adipose-derived stem cell-containing hyaluronic acid/alginate hydrogel improves vocal fold wound healing. Laryngoscope. 124 (3), E64-E72 (2014).
- Dong, Y., et al. Conformable hyaluronic acid hydrogel delivers adipose-derived stem cells and promotes regeneration of burn injury. Acta Biomater. 108, 56-66 (2020).
- Truegel3d hydrogel for 3d cell culture. Merck Available from: https://www.sigmaaldrich.com/ZA/en/technical-documents/technical-article/cell-culture-and-cell-culture-analysis/3d-cell-culture/truegel3d (2024)
- Braccini, S., Tacchini, C., Chiellini, F., Puppi, D. Polymeric hydrogels for in vitro 3d ovarian cancer modeling. Int J Mol Sci. 23 (6), 3265 (2022).
- Mashinchian, O., et al. In vivo transcriptomic profiling using cell encapsulation identifies effector pathways of systemic aging. eLife. 11, e57393 (2022).
- Matsushige, C., Xu, X., Miyagi, M., Zuo, Y. Y., Yamazaki, Y. Rgd-modified dextran hydrogel promotes follicle growth in three-dimensional ovarian tissue culture in mice. Theriogenology. 183, 120-131 (2022).
- Marx, V. How some labs put more bio into biomaterials. Nat Methods. 16 (5), 365-368 (2019).
- Marques, M. M. Photobiomodulation therapy weaknesses. Laser Dent Sci. 6 (3), 131-132 (2022).
- Hamblin, M. R. Mechanisms and mitochondrial redox signaling in photobiomodulation. Photochem Photobiol. 94 (2), 199-212 (2018).
- Chen, J., et al. Low-level controllable blue LEDs irradiation enhances human dental pulp stem cells osteogenic differentiation via transient receptor potential vanilloid 1. J Photochem Photobiol B. 233, 112472 (2022).
- Chang, S. -. Y., Carpena, N. T., Kang, B. J., Lee, M. Y. Effects of photobiomodulation on stem cells important for regenerative medicine. Med Lasers. 9 (2), 134-141 (2020).
- Bikmulina, P. Y., et al. Beyond 2d: Effects of photobiomodulation in 3d tissue-like systems. J Biomed Opt. 25 (4), 048001 (2020).
- Ahmadi, H., et al. Transplantation of photobiomodulation-preconditioned diabetic stem cells accelerates ischemic wound healing in diabetic rats. Stem Cell Res Ther. 11 (1), 494 (2020).
- Mao, A. S., Mooney, D. J. Regenerative medicine: Current therapies and future directions. Proc Natl Acad Sci U S A. 112 (47), 14452-14459 (2015).
- De Andrade, A. L. M., et al. Effect of photobiomodulation on the behaviour of mesenchymal stem cells in three-dimensional cultures. Lasers Med Sci. 38 (1), 221 (2023).
- Diniz, I. M., et al. Photobiomodulation of mesenchymal stem cells encapsulated in an injectable rhbmp4-loaded hydrogel directs hard tissue bioengineering. J Cell Physiol. 233 (6), 4907-4918 (2018).
- Carter, M., Shieh, J. C. . Guide to Research Techniques in Neuroscience. , (2015).
- Lutolf, M. P., et al. Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration: Engineering cell-invasion characteristics. Proc Natl Acad Sci U S A. 100 (9), 5413-5418 (2003).
- Robledo, F., et al. Spheroids derived from the stromal vascular fraction of adipose tissue self-organize in complex adipose organoids and secrete leptin. Stem Cell Res Ther. 14 (1), 70 (2023).
- Landry, J., Freyer, J. P., Sutherland, R. M. Shedding of mitotic cells from the surface of multicell spheroids during growth. J Cell Physiol. 106 (1), 23-32 (1981).
- Bogacheva, M. S., et al. Differentiation of human pluripotent stem cells into definitive endoderm cells in various flexible three-dimensional cell culture systems: Possibilities and limitations. Front Cell Dev Biol. 9, 726499 (2021).
- Chen, X., Thibeault, S. L. Biocompatibility of a synthetic extracellular matrix on immortalized vocal fold fibroblasts in 3-d culture. Acta Biomater. 6 (8), 2940-2948 (2010).
- Crous, A., Van Rensburg, M. J., Abrahamse, H. Single and consecutive application of near-infrared and green irradiation modulates adipose derived stem cell proliferation and affect differentiation factors. Biochimie. 196, 225-233 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved