Method Article
Cultura Celular Tridimensional de Células-Tronco Derivadas do Tecido Adiposo em Hidrogel com Aumento da Fotobiomodulação
Neste Artigo
Resumo
Aqui, apresentamos um protocolo demonstrando o uso de hidrogel como uma estrutura de cultura de células tridimensional (3D) para cultura de células-tronco derivadas do tecido adiposo (ADSC) e introduzindo fotobiomodulação (PBM) para aumentar a proliferação de ADSCs dentro do ambiente de cultura 3D.
Resumo
Células-tronco derivadas do tecido adiposo (ADSCs), possuindo características mesenquimais multipotentes semelhantes às células-tronco, são frequentemente empregadas na medicina regenerativa devido à sua capacidade de diferenciação celular diversificada e sua capacidade de aumentar a migração, proliferação e mitigar a inflamação. No entanto, as ADSCs frequentemente enfrentam desafios na sobrevida e enxertia dentro de feridas, principalmente devido a condições inflamatórias desfavoráveis. Para resolver essa questão, hidrogéis foram desenvolvidos para sustentar a viabilidade de ADSC em feridas e agilizar o processo de cicatrização de feridas. Aqui, nosso objetivo foi avaliar o impacto sinérgico da fotobiomodulação (PBM) na proliferação e citotoxicidade de ADSC dentro de uma estrutura de cultura celular 3D. ADSCs imortalizadas foram semeadas em hidrogéis de 10 μL a uma densidade de 2,5 x 103 células e submetidas à irradiação usando diodos de 525 nm e 825 nm nas fluências de 5 J/cm2 e 10 J/cm2. Alterações morfológicas, citotoxicidade e proliferação foram avaliadas 24 h e 10 dias após a exposição ao PBM. As ADSCs exibiram uma morfologia arredondada e foram dispersas por todo o gel como células individuais ou agregados esferoides. É importante ressaltar que tanto o PBM quanto a estrutura de cultura 3D não apresentaram efeitos citotóxicos sobre as células, enquanto o PBM aumentou significativamente as taxas de proliferação de ADSCs. Em conclusão, este estudo demonstra o uso de hidrogel como um ambiente 3D adequado para cultura de ADSC e introduz o PBM como uma estratégia de aumento significativo, particularmente abordando as taxas de proliferação lentas associadas à cultura de células 3D.
Introdução
As ADSCs são células progenitoras mesenquimais multipotentes com capacidade de se auto-renovar e diferenciar-se em várias linhagens celulares. Essas células podem ser retiradas da fração vascular estromal (FVS) do tecido adiposo durante um procedimento delipoaspiração1. As ADSCs têm emergido como um tipo ideal de células-tronco para uso em medicina regenerativa, pois são abundantes, minimamente invasivas para a colheita, de fácil acesso e bemcaracterizadas2. A terapia com células-tronco oferece um caminho possível para a cicatrização de feridas, estimulando a migração celular, a proliferação, a neovascularização e reduzindo a inflamação dentro das feridas 3,4. Cerca de 80% da capacidade regenerativa das ADSCs é atribuível à sinalização parácrina através de seu secretoma5. Anteriormente, sugeriu-se que uma injeção local direta de células-tronco ou fatores de crescimento no tecido lesado poderia iludir mecanismos de reparo in vivo suficientes 6,7,8. No entanto, essa abordagem enfrentou vários desafios, como baixa sobrevida e redução do enxerto de células-tronco em tecidos lesados como resultado do ambiente inflamatório9. Além disso, um dos motivos citados foi a falta de matriz extracelular que sustentasse a sobrevida e a funcionalidade das células transplantadas10. Para superar esses desafios, a ênfase está sendo colocada no desenvolvimento de carreadores de biomateriais para apoiar a viabilidade e a função das células-tronco.
A cultura de células tridimensionais (3D) aumenta a interação célula-célula e célula-matriz in vitro para proporcionar um ambiente que melhor se assemelha ao ambiente in vivo 11. Hidrogéis têm sido extensivamente estudados como uma classe de carreadores de biomateriais que fornecem um ambiente 3D para cultura de células-tronco. Essas estruturas são constituídas por água e polímeros reticulados12. O encapsulamento de ADSCs em hidrogel praticamente não tem efeito citotóxico sobre as células durante o cultivo, mantendo a viabilidade das células6. Células-tronco cultivadas em 3D demonstram maior retenção de seu tronco e melhor capacidade de diferenciação13. Da mesma forma, as ADSCs semeadas com hidrogel demonstraram maior viabilidade e aceleraram o fechamento da ferida em modelos animais14. Além disso, o encapsulamento em hidrogel aumenta significativamente a enxertia e a retenção de ADSCs em feridas15,16. O TrueGel3D é feito de um polímero, seja álcool polivinílico ou dextrano, solidificado por um reticulante, ciclodextrina ou polietilenoglicol17. O gel é um hidrogel sintético que não contém nenhum produto de origem animal que possa interferir nos experimentos ou desencadear uma reação imunológica durante o transplante do gel em um paciente, mimetizando efetivamente uma matriz extracelular18. O gel é totalmente personalizável, alterando a composição e componentes individuais. Pode abrigar diferentes células-tronco e auxiliar na diferenciação de vários tipos celulares, ajustando a rigidez do gel19. Sites de fixação podem ser criados através da adição de peptídeos20. O gel é degradável pela secreção de metaloproteases, permitindo a migração celular21. Por fim, é claro e permite técnicas de imagem.
A PBM é uma forma minimamente invasiva e de fácil execução de laserterapia de baixa potência usada para estimular cromóforos intracelulares. Diferentes comprimentos de onda provocam diferentes efeitos nas células22. A luz na faixa do vermelho ao infravermelho próximo estimula o aumento da produção de adenosina trifosfato (ATP) e espécies reativas de oxigênio (ROS), aumentando o fluxo através da cadeia de transporte de elétrons23. A luz nas faixas azul e verde estimula canais iônicos dependentes de luz, permitindo o influxo inespecífico de cátions, como cálcio e magnésio, para dentro das células, o que sabidamente aumenta a diferenciação24. O efeito líquido é a geração de mensageiros secundários que estimulam a transcrição de fatores desencadeantes de processos celulares a jusante, como migração, proliferação ediferenciação25. O PBM pode ser usado para pré-condicionar as células a proliferar ou diferenciar-se antes de transplantá-las para um ambiente adverso, por exemplo, tecido danificado26. A exposição de PBM (630 nm e 810 nm) de ADSCs pré e pós-transplante aumentou significativamente a viabilidade e a função dessas células in vivo em um modelo de rato diabético27. A medicina regenerativa requer um número adequado de células para o reparo efetivo dos tecidos28. Em cultura de células 3D, ADSCs têm sido associadas a taxas de proliferação mais lentas em comparação com cultura celular bidimensional6. No entanto, o PBM pode ser usado para aumentar o processo de cultura de células 3D de ADSCs, aumentando a viabilidade, proliferação, migração e diferenciação29,30.
Protocolo
NOTA: Consulte a Tabela de Materiais para obter detalhes relacionados a todos os materiais, reagentes e software usados neste protocolo. O protocolo foi resumido graficamente na Figura 1.
1. Cultura celular bidimensional (2D)
NOTA: Os ADSCs imortalizados (1 x106 células) são armazenados a -195,8 °C em azoto líquido num frasco para injetáveis de criopreservação contendo 1 ml de meio de congelação celular.
- Preparação do meio de recuperação celular 2D e do frasco de cultura 2D
- Transferir 39 mL do meio basal para um tubo centrífugo de 50 mL
- Enriqueça o meio basal com 20% de soro fetal bovino (SFB; 10 mL) e antibióticos (1 mL) (0,5 mL de Penicilina-Estreptomicina e 0,5 mL de Anfotericina B).
- Pré-condicionar um frasco T75 transferindo 6 mL do meio de recuperação celular para o frasco e incubá-lo a 37 °C, 5% CO2 e 85% de umidade por 45 min (isso pode ser feito durante as etapas de recuperação celular para economizar tempo).
NOTA: Aqueça o meio completo a 37 °C antes de utilizar e guarde-o a 4 °C durante um período máximo de 1 semana.
- Recuperação de células 2D
- Retire um criovial do tanque de armazenamento de azoto líquido e descongele rapidamente o frasco para injetáveis num banho-maria a 37 °C, até que esteja completamente descongelado.
- Gire o criovial usando uma centrífuga a 1006 x g por 5 min (20 °C) e, em seguida, remova o sobrenadante.
- Ressuspender as células peletizadas usando 1 mL de meio de recuperação celular pré-aquecido.
- Distribuir uniformemente as células em suspensão no frasco pré-condicionado (volume final de 7 mL) e incubar a 37 °C, 5% CO2 e 85% de umidade.
- Após 24 h descarte e substitua o meio de recuperação celular.
- Substituir o meio de cultura a cada 2-3 dias até que o frasco se torne confluente com as células.
- Colheita de frasco de cultura 2D em suspensão unicelular e contagem de células
- Retire o frasco de cultura 2D da incubadora e descarte o meio de cultura em um recipiente apropriado para resíduos.
- Transferir 10 ml de solução de enxágüe para o balão para enxaguar as células e remover resíduos e acúmulo de proteínas. Depois disso, descarte a solução de enxágue.
- Adicionar 6 mL de solução descolante ao frasco de cultura para desprendimento das células. Incubar o balão a 37 °C, 5% CO2 e 85% de humidade durante 2 min.
NOTA: Observe o frasco ao microscópio para confirmar que todas as células foram destacadas. Caso contrário, bata suavemente no balão e incube por mais um minuto. - Uma vez que todas as células tenham sido destacadas, transfira a suspensão celular para um tubo de centrífuga de 15 mL e adicione 1 mL do meio de recuperação celular (contendo 20% de FBS) ao tubo. Isso neutralizará o efeito da solução de descolamento.
- Centrifugar o tubo durante 5 minutos a 1711 x g (20 °C).
- Remover o sobrenadante e ressuspender as células em 1 mL de meio completo.
- Retire 10 μL da suspensão celular, coloque-a num tubo de microcentrífuga de 500 μL e misture-a com 10 μL de azul de tripano numa proporção de 1:1.
- Colocar 10 μL da mistura de solução de células azuis de tripano numa câmara de contagem de células em duplicado.
- Coloque a câmara de contagem de células no contador de células automatizado. O contador de células indicará o número total de células por mL, bem como o número de células viáveis e mortas. Calcular a contagem média de células viáveis e o número de células viáveis necessárias para serem incorporadas no hidrogel 3D (passo 2.2.6).
2. 3D cultura celular
- Preparando o meio de cultura 3D completo
- Transferir 44 mL do meio basal para um tubo centrífugo de 50 mL.
- Enriqueça a mídia com SFB a 10% (5 mL) e antibióticos (1 mL) (0,5 mL de Penicilina-Estreptomicina e 0,5 mL de Anfotericina B).
NOTA: Aqueça o meio completo a 37 °C antes de utilizar e guarde-o a 4 °C durante um período máximo de uma semana.
- Preparo do hidrogel
- Prepare o frasco rápido de dextran centrifugando (1000 x g por 30 s a 20 °C) o frasco para injetáveis de dextran rápido para concentrar o material. Adicionar 175 μL de água ao frasco para injetáveis de fast-dextran para atingir uma concentração final de 30 mmol/L de grupos reativos.
- Vórtice o tubo (velocidade média para 30 s) contendo a solução de dextran rápido até que o material esteja totalmente dissolvido. Incubar o material dissolvido no gelo por 5 min. Centrifugar o tubo, agitá-lo brevemente e mantê-lo no gelo durante o uso posterior.
- Centrifugar o reticulante (1000 x g por 30 s a 20 °C) para concentrar o material. Adicionar 188 μL de água ao frasco para injetáveis reticulante para atingir uma concentração final de 20 mmol/L de grupos tiol.
- Vórtice o tubo (velocidade média para 30 s) contendo a solução reticulante até que todo o material esteja dissolvido. Incubar o reticulante dissolvido à temperatura ambiente (TR) durante 5 min. Centrifugar o tubo, brevemente vórtice, e mantê-lo em RT durante o uso posterior.
- Adaptar o protocolo de hidrogel de 30 μL para 10 μL para redução de custos (ver Tabela 1 para detalhes específicos).
- Preparar a suspensão celular para atingir uma densidade de semeadura de 2,5 x 103 células por 10 μL de hidrogel.
- Combine os componentes de acordo com a Tabela 1 para criar uma combinação mestre. Transfira 9 μL da mistura mestra para um poço em uma placa de tira de 96 poços.
- Solidificar o gel adicionando 1 μL do reticulante degradável 3 min após a transferência da mistura principal.
- Cobrir os hidrogéis com 170 μL de meio de cultura completo pré-aquecido. Incubar por 1 h. Após 1 h, substituir o meio de cultura.
NOTA: As células embutidas em hidrogel estão prontas para posterior experimentação ou análise dentro do sistema de cultura 3D. Siga protocolos adicionais conforme necessário para aplicativos downstream.
3. Exposição à fotobiomodulação
- Configuração do laser
- Configure o sistema de laser de diodo para comprimentos de onda verde (525 nm) ou infravermelho próximo (825 nm). Ligue os lasers e deixe-os aquecer durante a duração recomendada.
- Estabilize a potência dos lasers, permitindo que eles atinjam um estado estacionário. Isso garante uma irradiação consistente e precisa.
- Meça a potência de saída dos lasers usando um medidor de potência laser. Registre os valores de potência para cada comprimento de onda.
- Use a Equação 1 (Tempo de irradiação do laser) para calcular o tempo de irradiação do laser. Substitua os valores da Tabela 2 pela Equação 1 para determinar o tempo de irradiação adequado para cada fluência. Na Equação 1, "r" representa o raio da zona de irradiação do laser.

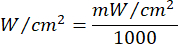

Equação 1 - Consulte a Tabela 2 para obter os parâmetros específicos necessários para o cálculo, incluindo fluências (5 J/cm² ou 10 J/cm²) e potência do laser.
- Irradiação das culturas de células 3D
- Após a substituição do meio completo (passo 2.2.9), colocar a placa de 96 poços contendo células emblocadas em hidrogel sob o sistema de laser de diodo. Irradiar os hidrogéis com o tempo de irradiação laser calculado para a fluência selecionada (5 J/cm² ou 10 J/cm²) no comprimento de onda escolhido (verde ou infravermelho próximo). Portanto, as culturas receberão apenas uma dose.
- Garantir que cada grupo experimental seja acompanhado por um controle (n = 4), composto por ADSCs embebidos em hidrogel sem exposição ao PBM.
NOTA: Use sempre óculos de segurança apropriados para o comprimento de onda da luz com a qual você está trabalhando. Os lasers são usados fora de um armário de segurança; Assim, é de fundamental importância desinfetar a área antes do uso. - Incubar as placas de cultura a 37 °C, 5% de CO2 e 85% de umidade durante os experimentos. Incubar as placas por 24 h para a primeira análise ou 10 dias para o segundo período de análise, pós-irradiação.
4. Morfologia
- Microscopia de luz invertida
- Ligue o microscópio de luz invertida e deixe aquecer por alguns minutos. Certifique-se de que o microscópio está devidamente alinhado e calibrado.
- Preparar a amostra para observação em uma lâmina de microscópio ou em uma placa de cultura de células especializada, dependendo da configuração experimental. Calibre o microscópio para obter as condições ideais de imagem.
- Ajuste as configurações de foco, brilho e contraste conforme necessário. Selecione a lente objetiva de 20x no microscópio para observar e registrar a morfologia celular.
- Coloque a amostra no estágio do microscópio e concentre-se nas células de interesse usando a ocular. Usando a ocular ou a visão da câmera, observe e registre a morfologia celular. Preste atenção à forma, tamanho e quaisquer características distintivas da célula.
- Conecte o módulo da câmera ao microscópio. Configure a câmera para imagens digitais. Garanta a conexão e a comunicação adequadas entre a câmera e o microscópio.
- Usando a lente objetiva de 20x, capture fotos digitais das células observadas. Use os controles da câmera para ajustar a exposição, o foco e outras configurações relevantes.
NOTA: Certifique-se de que as imagens capturadas são de alta qualidade e fornecem uma visão representativa da morfologia celular. - Inicie o software de geração de imagens no computador. Capture a imagem e use as ferramentas de análise dentro do software para analisar a morfologia celular.
- Meça as dimensões das células, conte as células ou realize qualquer análise relevante com base nos objetivos experimentais.
- Adicione uma barra de escala apropriada às imagens usando o software. Use a ampliação conhecida da objetiva do microscópio para representar com precisão a escala das imagens.
5. Ensaios bioquímicos
- Recuperação celular
NOTA: As células precisam ser recuperadas do hidrogel em uma suspensão de célula única para ensaios bioquímicos posteriores a jusante.- Preparar a solução de recuperação enzimática de células. Em um ambiente estéril, prepare uma solução de trabalho diluindo a solução de recuperação enzimática de células com solução salina tamponada com fosfato (PBS) na proporção de 1:20 (Solução: PBS). Se for necessária a recuperação de células de um número específico de géis ou poços, calcule o volume total necessário com base em 30 μL de solução de recuperação por gel.
- Adicionar 30 μL da solução de trabalho a cada gel ou poço contendo as células que necessitam de recuperação. Garanta uma distribuição completa e uniforme da solução de recuperação balançando ou girando suavemente a placa. Incubar a placa com a solução de recuperação de acordo com o tempo de incubação recomendado. Essas informações normalmente podem ser encontradas na ficha técnica do produto ou no protocolo fornecido pelo fornecedor.
- Após o período de incubação, remova cuidadosamente a placa da incubadora. Centrifugar as placas a 1409 x g durante 5 min (20 °C) para pellet das células. Consulte a ficha técnica ou o protocolo do produto para obter as condições de centrifugação recomendadas. Uma vez concluída a centrifugação, descarte cuidadosamente o sobrenadante, tomando cuidado para não perturbar a pastilha celular.
- Ressuspender suavemente as células peletizadas em 220 μL de PBS estéril. Garanta uma mistura completa para obter uma suspensão homogênea de célula única. As células estão agora prontas para ensaios bioquímicos a jusante. Seguir os protocolos específicos para os ensaios pretendidos, considerando a natureza das células recuperadas e as exigências do arranjo experimental.
- Ensaio de citotoxicidade da lactato desidrogenase (LDH)
- Para cada poço, remova cuidadosamente 50 μL de meios de cultura completos, garantindo o mínimo de perturbação na camada celular.
- Adicionar 50 μL do reagente de citotoxicidade diretamente em cada poço contendo os 50 μL restantes de meios de cultura. Misture suavemente pipetando para cima e para baixo para garantir a mistura completa da amostra com o reagente.
- Prepare um controle positivo. Montar poços triplicados com 5 μL de solução de lise 10x por 50 μL de células de controle positivo incluídas no kit.
- Incubar a placa à temperatura e duração recomendadas. Esta etapa permite que o reagente de citotoxicidade lise as células e libere LDH nos meios de cultura.
- Após o período de incubação, adicionar 50 μL da solução de paragem directamente a cada poço contendo o reagente de citotoxicidade e o lisado celular. Misture suavemente pipetando para cima e para baixo para garantir a interrupção adequada da reação.
NOTA: A solução de parada interrompe a liberação adicional de LDH e garante a estabilidade do desenvolvimento da cor. - Configure o leitor de placas espectrofotométricas de acordo com as instruções do fabricante. Registrar a absorbância de cada poço a 490 nm. Este comprimento de onda é específico para a detecção colorimétrica do produto formazana gerado pela reação de LDH.
- Subtrair as leituras de absorbância de fundo de ambos os grupos de tratamento e poços de controle. Obter leituras de fundo de poços contendo meios e reagentes de citotoxicidade sem células.
- Analisar os valores de absorbância corrigidos para cada amostra para determinar o nível de citotoxicidade. Maiores valores de absorbância indicam maior liberação de LDH e, consequentemente, maior citotoxicidade.
- Certificar-se de que cada grupo experimental e controle consistiu de quatro repetições (etapa 3.2.2) para precisão estatística. Calcular e importar a absorvância média de cada grupo e controle para um programa estatístico apropriado.
- Comparar os resultados entre os grupos de tratamento e os controles apropriados para avaliar os efeitos citotóxicos com precisão e registrar todas as leituras de absorbância, cálculos e condições experimentais para referência futura.
- Ensaio de proliferação de ATP
- Em um ambiente estéril, misturar 50 μL das células recuperadas com 50 μL do reagente ATP em cada poço.
NOTA: Ajustar o volume de células e reagentes com base no número de poços e no desenho experimental. Mantenha índices consistentes para obter resultados precisos. - Coloque o prato em uma coqueteleira e agite vigorosamente no escuro por 5 min. Esta etapa garante a mistura completa das células com o reagente. Após agitar, incubar a placa por mais 25 min no TR. Esse período de incubação permite que o reagente lise as células e gere um sinal luminescente proporcional à quantidade de ATP presente.
- Configure o leitor de placas de acordo com as instruções do fabricante para detecção de luminescência. Medir a luminescência de cada poço contendo o lisado celular e o reagente ATP. Certifique-se de que o leitor de placas esteja configurado para medir a luminescência com as configurações apropriadas.
- Subtrair as leituras de luminescência de fundo dos grupos de tratamento e dos poços de controle. Obter leituras de fundo de poços contendo apenas o reagente ATP e PBS sem células.
- Analisar os valores corrigidos de luminescência de cada amostra para determinar os níveis de ATP, refletindo a proliferação ou viabilidade celular.
- Certificar-se de que cada grupo experimental e controle consistiu de quatro repetições (etapa 3.2.2) para precisão estatística. Calcular e importar a luminescência média de cada grupo e controle para um programa estatístico apropriado.
- Comparar os resultados entre os grupos de tratamento e os controles relevantes para avaliar a proliferação de ATP com precisão. Registre todas as leituras de luminescência, cálculos e condições experimentais para referência futura.
NOTA: Para todas as análises bioquímicas em forma de kit, siga o manual ou protocolo do kit fornecido pelo fabricante para obter detalhes específicos, como tempos de incubação recomendados, concentrações e quaisquer etapas ou considerações adicionais. Siga sempre as diretrizes de segurança do laboratório ao manusear produtos químicos e materiais biológicos.
- Em um ambiente estéril, misturar 50 μL das células recuperadas com 50 μL do reagente ATP em cada poço.
Resultados
Para avaliar a morfologia e inspecionar visualmente a densidade celular dos hidrogéis, foi utilizada microscopia inversa (Figura 2). As ADSCs mantiveram uma morfologia arredondada 24 h após a semeadura e exposição ao PBM. As células foram espalhadas por todo o gel como células únicas ou em cachos semelhantes a uvas. A morfologia manteve-se inalterada após 10 dias em cultura 3D. Nenhuma diferença definitiva na morfologia foi observada entre os grupos experimentais e controles ou entre os diferentes grupos experimentais.
Para avaliar os efeitos citotóxicos da exposição ao PBM e da cultura 3D usando hidrogel, o extravasamento de LDH foi medido (Figura 3). Não houve diferenças significativas entre os grupos experimentais e controles em 24 h ou 10 dias, indicando que a exposição ao PBM e a cultura com hidrogel não tiveram efeito prejudicial sobre as células.
As taxas de proliferação celular foram medidas medindo-se o conteúdo de ATP das ADSCs (Figura 4). A exposição ao PBM resultou em aumento das taxas de proliferação em todos os grupos experimentais em comparação com os controles. Nas 24 h pós-exposição ao PBM, o comprimento de onda de 525 nm estimulou as maiores taxas de proliferação. No entanto, na marca de 10 dias, o comprimento de onda de 825 nm demonstrou taxas de proliferação superiores ao comprimento de onda de 525 nm. Ao final do período de 10 dias de cultivo, o grupo 825 nm, 10 J/cm2 apresentou a maior taxa de proliferação.

Figura 1: Visão geral do protocolo. Protocolo resumido destacando a preparação do hidrogel em placas de 96 poços, exposição ao PBM e a medição da morfologia e ensaios bioquímicos em 24 h e 10 dias pós-exposição ao PBM. Clique aqui para ver uma versão maior desta figura.

Figura 2: ADSCs autoagregados após a semeadura. As células mantiveram uma morfologia redonda a oval e foram distribuídas no hidrogel como células únicas ou agregados com aparência de cacho semelhante a uva em (A) 24 h e (B) 10 dias após a semeadura e exposição ao PBM. Nenhuma alteração definitiva foi observada após 10 dias de incubação. Usando controles (1 e 4), 525 nm a 5 J/cm2 (2) e 10 J/cm2 (5) ou 825 nm a 5 J/cm2 (3) e 10 J/cm2 (6), respectivamente. Clique aqui para ver uma versão maior desta figura.

Figura 3: Extravasamento celular de LDH como medida de citotoxicidade 24 h e 10 dias pós-exposição ao PBM, utilizando um diodo de 525 nm e 825 nm (5 J/cm2 e 10 J/cm2) no hidrogel. Não foi observado aumento significativo da citotoxicidade em relação ao controle experimental. O controle positivo foi representativo de morte celular completa. Clique aqui para ver uma versão maior desta figura.

Figura 4: ATP celular como medida da proliferação 24 h e 10 dias pós-PBM exposição, utilizando um diodo de 525 nm e 825 nm (5 J/cm2 e 10 J/cm2) no hidrogel. A exposição ao PBM estimulou o aumento das taxas de proliferação em todos os grupos experimentais, em ambos os momentos e em ambas as fluências. Diferenças significativas (P < 0,001) são indicadas por ***. Clique aqui para ver uma versão maior desta figura.
| Componente | Volume (μL) por poço |
| Polímero SLO-Dextran (30 mmol/L) | 0.7 |
| Suspensão celular | 2 |
| Buffer | 0.8 |
| Água | 5.5 |
| Reticulante | 1 |
| Volume total | 10 |
Tabela 1: Volumes de reagentes de hidrogel (10 μL).
| Parâmetros do laser | Verde (G) | Infravermelho próximo (NIR) |
| Luz | Laser de Diodo | Laser de Diodo |
| Comprimento de onda (nm) | 525 | 825 |
| Potência de saída (mW) | 553 | 515 |
| Densidade de potência (mW/cm2) | 57.48 | 53.53 |
Tabela 2: Parâmetros do laser.
Discussão
As ADSCs são um tipo celular ideal para uso em medicina regenerativa, pois estimulam vários processos para auxiliar na cicatrização de feridas 3,4. No entanto, há vários desafios que precisam ser contornados, por exemplo, baixas taxas de sobrevida e enxertia ineficaz das células em um local delesão9. As células imortalizadas foram utilizadas como linhagem celular comercialmente disponível, pois podem ser passadas por mais gerações em relação às células primárias, não precisam ser colhidas, são bem caracterizadas e são populações homogêneas garantindo resultados consistentes31. O objetivo deste estudo foi determinar o potencial aumentativo do PBM sobre a proliferação e citotoxicidade de ADSCs, utilizando cultura celular 3D. O protocolo do fabricante para um hidrogel de 30 μL foi adaptado para um hidrogel de 10 μL para economizar custos32. No entanto, esse volume reduzido dificultou o preparo e o manuseio do gel.
Foi demonstrado que os ADSCs se autoagregam em um ambiente 3D33. Da mesma forma, neste estudo, as células formaram agregados celulares com aparência de uva. No entanto, células de postura única também foram identificadas. A excreção celular é uma propriedade conhecida dos esferoides em que as células se desprendem do corpo principal do esferoide ou agregado e são liberadas no ambiente de cultura. A excreção celular pode resultar da proliferação celular, na qual células viáveis são eliminadas durante a mitose e permitem a migração34. Alternativamente, a excreção pode resultar devido à morte celular e perda da forma esferoide ou agregada35, especialmente em esferoides muito grandes devido a um núcleo necrótico em crescimento. As células adotaram uma morfologia arredondada em cultura 3D, comparada a uma forma fusiforme em culturas 2D. Em concordância com os achados de estudos semelhantes, esses resultados devem-se à falta de sítios de fixação ou matriz extracelular para as célulasaderirem6,9. Além disso, as células não apresentaram migração significativa no gel, implicando ainda na necessidade de sítios de fixação36. Recomenda-se adicionar um peptídeo de adesão ou outra proteína da matriz extracelular para facilitar a adesão, adesão e migração. Uma limitação do estudo foi o uso de microscopia de luz inversa para observar a morfologia 3D das ADSCs ao invés do empilhamento Z. A exposição ao PBM e a cultura 3D não tiveram efeito significativo sobre a citotoxicidade das ADSCs tanto na 24 h quanto no 10 dia pós-exposição, indicando que a cultura de hidrogel e a cultura de PBM são seguras e não têm impacto negativo sobre as células 6,26. Em cultura de células 3D, ADSCs têm sido associadas a taxas de proliferação mais lentas em comparação com cultura de células 2D. Isso é apoiado pelas baixas taxas de proliferação dos controles normais no presente estudo6. PBM (525 nm e 825 nm) aumentou significativamente as taxas de proliferação de ADSCs em cultura 3D. Inicialmente, a luz verde (525 nm) nas fluências de 5 J/cm2 e 10 J/cm2 provocou as maiores taxas de proliferação em comparação com a luz infravermelha próxima (825 nm). No entanto, na marca de 10 dias, a luz infravermelha próxima (825 nm) tem as maiores taxas de proliferação nas fluências de 5 J/cm2 e 10 J/cm2. Da mesma forma, foi demonstrado que o PBM (525 nm e 825 nm) aumenta as taxas de proliferação em culturas 2D37. Recomenda-se incluir também um grupo de combinação de comprimento de onda, pois outros estudos relataram um efeito sinérgico da luz verde e infravermelha próxima.
Em conclusão, o hidrogel utilizado é um hidrogel sintético com enorme capacidade de personalização para atender às necessidades de diversas aplicações. O presente estudo demonstrou que o gel não tem efeito citotóxico sobre as células em cultura durante um período de 10 dias. Além disso, o PBM demonstrou um potencial aumentativo positivo ao aumentar significativamente as taxas de proliferação de ADSCs, apesar de estar em um ambiente de cultura 3D. Assim, este hidrogel pode servir como um possível carreador de biomaterial para transplante em feridas. Investigações futuras devem ter como objetivo testar a capacidade potencial do gel de auxiliar na cicatrização de feridas usando estudos em animais. Se os resultados do estudo em animais forem favoráveis, prevê-se que as ADSCs derivadas do paciente possam ser colhidas, encapsuladas e aumentadas com PBM antes do transplante em feridas para auxiliar na cicatrização de feridas em aplicações clínicas.
Divulgações
Os autores declaram não haver interesses concorrentes.
Agradecimentos
Esta pesquisa foi financiada pela Fundação Nacional de Pesquisa da África do Sul Thuthuka Instrument, bolsa número TTK2205035996; o Departamento de Ciência e Inovação (DSI) financiou o Centro Africano de Laser (ALC), número de concessão HLHA23X tarefa ALC-R007; Conselho Universitário de Pesquisa, processo nº 2022URC00513; a Iniciativa de Cátedras de Pesquisa da África do Sul do Departamento de Ciência e Tecnologia (DST-NRF/SARChI), número de concessão 98337. Os órgãos financiadores não tiveram qualquer papel na concepção do estudo, coleta, análise, interpretação dos dados ou redação do manuscrito. Os autores agradecem à Universidade de Joanesburgo (UJ) e ao Centro de Pesquisa em Laser (LRC) pelo uso das instalações e recursos.
Materiais
| Name | Company | Catalog Number | Comments |
| 525 nm diode laser | National Laser Centre of South Africa | EN 60825-1:2007 | |
| 825 nm diode laser | National Laser Centre of South Africa | SN 101080908ADR-1800 | |
| 96 Well Strip Plates | Sigma-Aldrich | BR782301 | |
| Amphotericin B | Sigma-Aldrich | A2942 | Antibiotic (0.5%; 0.5 mL) |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | ATP reagent, Proliferation assay Kit |
| Corning 2 mL External Threaded Polypropylene Cryogenic Vial | Corning | 430659 | cryovial |
| CryoSOfree | Sigma-Aldrich | C9249 | Cell freezing media |
| CytoTox96 Non-Radioactive Cytotoxicity Assay | Promega | G1780 | Cytotoxicity reagent |
| Dulbecco’s Modified Eagle Media | Sigma-Aldrich | D5796 | Basal medium (39 mL/44 mL) |
| FieldMate Laser Power Meter | Coherent | 1098297 | |
| Flat-bottomed Corning 96 well clear polystyrene plate | Sigma-Aldrich | CLS3370 | |
| Foetal bovine serum | Biochrom | S0615 | Culture medium enrichment (5 mL; 10% / 10 mL; 20%) |
| Hanks Balanced Salt Solution (HBSS) | Sigma-Aldrich | H9394 | Rinse solution |
| Heracell 150i CO2 incubator | Thermo Scientific | 51026280 | |
| Heraeus Labofuge 400 | Thermo Scientific | 75008371 | Plate spinner for 96 well plates |
| Heraeus Megafuge 16R centrifuge | ThermoFisher | 75004270 | |
| Immortalized ADSCs | ATCC | ASC52Telo hTERT, ATCC SCRC-4000 | Passage 37 |
| Invitrogen Countess 3 | Invitrogen | AMQAX2000 | Automated cell counter for Trypan Blue |
| Julabo TW20 waterbath | Sigma-Aldrich | Z615501 | Waterbath used to warm media to 37 °C |
| Olympus CellSens Entry | Olympus | Version 3.2 (23706) | Imaging software: digital image acquisition |
| Olympus CKX41 | Olympus | SN9B02019 | Inverted light microscope |
| Olympus SC30 camera | Olympus | SN57000530 | Camera attached to inverted light microscope |
| Opaque-walled Corning 96 well solid polystyrene microplates | Sigma-Aldrich | CLS3912 | Opaque well used for ATP luminescence |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | Antibiotic (0.5%; 0.5 mL) |
| SigmaPlot 12.0 | Systat Software Incorporated | ||
| TrueGel3D – True3 | Sigma-Aldrich | TRUE3-1KT | 10 µL |
| TrueGel3D Enzymatic Cell Recovery Solution | Sigma-Aldrich | TRUEENZ | 01:20 |
| Trypan Blue Stain | Thermo Fisher - Invitrogen | T10282 | 0.4% solution |
| TrypLE Select Enzyme (1x) | Gibco | 12563029 | Cell detachment solution |
| Victor Nivo Plate Reader | Perkin Elmer | HH3522019094 | Spectrophotometric plate reader |
Referências
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: Implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Yuan, X., et al. Strategies for improving adipose-derived stem cells for tissue regeneration. Burns Trauma. 10, (2022).
- Nilforoushzadeh, M. A., et al. Mesenchymal stem cell spheroids embedded in an injectable thermosensitive hydrogel: An in situ drug formation platform for accelerated wound healing. ACS Biomater Sci Eng. 6 (9), 5096-5109 (2020).
- Yang, M., et al. Thermosensitive injectable chitosan/collagen/β-glycerophosphate composite hydrogels for enhancing wound healing by encapsulating mesenchymal stem cell spheroids. ACS Omega. 5 (33), 21015-21023 (2020).
- Chimenti, I., et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ Res. 106 (5), 971-980 (2010).
- Hassan, W., Dong, Y., Wang, W. Encapsulation and 3d culture of human adipose-derived stem cells in an in-situ crosslinked hybrid hydrogel composed of peg-based hyperbranched copolymer and hyaluronic acid. Stem Cell Res Ther. 4 (2), 32 (2013).
- Wu, K. H., Mo, X. M., Han, Z. C., Zhou, B. Stem cell engraftment and survival in the ischemic heart. The Ann Thorac Surg. 92 (5), 1917-1925 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: General approaches and a review of recent developments. J R Soc Interface. 8 (55), 153-170 (2011).
- Koivunotko, E., et al. Angiogenic potential of human adipose-derived mesenchymal stromal cells in nanofibrillated cellulose hydrogel. Biomedicines. 10 (10), 2584 (2022).
- Dong, Y., et al. Injectable and tunable gelatin hydrogels enhance stem cell retention and improve cutaneous wound healing. Adv Funct Mater. 27 (24), 1606619 (2017).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3d cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Mantha, S., et al. Smart hydrogels in tissue engineering and regenerative medicine. Materials. 12 (20), 3323 (2019).
- Sung, T. -. C., et al. 3D culturing of human adipose-derived stem cells enhances their pluripotency and differentiation abilities. J Mater Sci Technol. 63, 9-17 (2021).
- Garg, R. K., et al. Capillary force seeding of hydrogels for adipose-derived stem cell delivery in wounds. Stem Cells Transl Med. 3 (9), 1079-1089 (2014).
- Kim, Y. M., et al. Adipose-derived stem cell-containing hyaluronic acid/alginate hydrogel improves vocal fold wound healing. Laryngoscope. 124 (3), E64-E72 (2014).
- Dong, Y., et al. Conformable hyaluronic acid hydrogel delivers adipose-derived stem cells and promotes regeneration of burn injury. Acta Biomater. 108, 56-66 (2020).
- Truegel3d hydrogel for 3d cell culture. Merck Available from: https://www.sigmaaldrich.com/ZA/en/technical-documents/technical-article/cell-culture-and-cell-culture-analysis/3d-cell-culture/truegel3d (2024)
- Braccini, S., Tacchini, C., Chiellini, F., Puppi, D. Polymeric hydrogels for in vitro 3d ovarian cancer modeling. Int J Mol Sci. 23 (6), 3265 (2022).
- Mashinchian, O., et al. In vivo transcriptomic profiling using cell encapsulation identifies effector pathways of systemic aging. eLife. 11, e57393 (2022).
- Matsushige, C., Xu, X., Miyagi, M., Zuo, Y. Y., Yamazaki, Y. Rgd-modified dextran hydrogel promotes follicle growth in three-dimensional ovarian tissue culture in mice. Theriogenology. 183, 120-131 (2022).
- Marx, V. How some labs put more bio into biomaterials. Nat Methods. 16 (5), 365-368 (2019).
- Marques, M. M. Photobiomodulation therapy weaknesses. Laser Dent Sci. 6 (3), 131-132 (2022).
- Hamblin, M. R. Mechanisms and mitochondrial redox signaling in photobiomodulation. Photochem Photobiol. 94 (2), 199-212 (2018).
- Chen, J., et al. Low-level controllable blue LEDs irradiation enhances human dental pulp stem cells osteogenic differentiation via transient receptor potential vanilloid 1. J Photochem Photobiol B. 233, 112472 (2022).
- Chang, S. -. Y., Carpena, N. T., Kang, B. J., Lee, M. Y. Effects of photobiomodulation on stem cells important for regenerative medicine. Med Lasers. 9 (2), 134-141 (2020).
- Bikmulina, P. Y., et al. Beyond 2d: Effects of photobiomodulation in 3d tissue-like systems. J Biomed Opt. 25 (4), 048001 (2020).
- Ahmadi, H., et al. Transplantation of photobiomodulation-preconditioned diabetic stem cells accelerates ischemic wound healing in diabetic rats. Stem Cell Res Ther. 11 (1), 494 (2020).
- Mao, A. S., Mooney, D. J. Regenerative medicine: Current therapies and future directions. Proc Natl Acad Sci U S A. 112 (47), 14452-14459 (2015).
- De Andrade, A. L. M., et al. Effect of photobiomodulation on the behaviour of mesenchymal stem cells in three-dimensional cultures. Lasers Med Sci. 38 (1), 221 (2023).
- Diniz, I. M., et al. Photobiomodulation of mesenchymal stem cells encapsulated in an injectable rhbmp4-loaded hydrogel directs hard tissue bioengineering. J Cell Physiol. 233 (6), 4907-4918 (2018).
- Carter, M., Shieh, J. C. . Guide to Research Techniques in Neuroscience. , (2015).
- Lutolf, M. P., et al. Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration: Engineering cell-invasion characteristics. Proc Natl Acad Sci U S A. 100 (9), 5413-5418 (2003).
- Robledo, F., et al. Spheroids derived from the stromal vascular fraction of adipose tissue self-organize in complex adipose organoids and secrete leptin. Stem Cell Res Ther. 14 (1), 70 (2023).
- Landry, J., Freyer, J. P., Sutherland, R. M. Shedding of mitotic cells from the surface of multicell spheroids during growth. J Cell Physiol. 106 (1), 23-32 (1981).
- Bogacheva, M. S., et al. Differentiation of human pluripotent stem cells into definitive endoderm cells in various flexible three-dimensional cell culture systems: Possibilities and limitations. Front Cell Dev Biol. 9, 726499 (2021).
- Chen, X., Thibeault, S. L. Biocompatibility of a synthetic extracellular matrix on immortalized vocal fold fibroblasts in 3-d culture. Acta Biomater. 6 (8), 2940-2948 (2010).
- Crous, A., Van Rensburg, M. J., Abrahamse, H. Single and consecutive application of near-infrared and green irradiation modulates adipose derived stem cell proliferation and affect differentiation factors. Biochimie. 196, 225-233 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados