Method Article
زراعة الخلايا ثلاثية الأبعاد للخلايا الجذعية المشتقة من الدهون في هيدروجيل مع زيادة التعديل الحيوي الضوئي
In This Article
Summary
نقدم هنا بروتوكولا يوضح استخدام الهيدروجيل كإطار زراعة خلايا ثلاثية الأبعاد (3D) لثقافة الخلايا الجذعية المشتقة من الدهون (ADSC) وإدخال التعديل الحيوي الضوئي (PBM) لتعزيز انتشار ADSCs في بيئة الثقافة ثلاثية الأبعاد.
Abstract
غالبا ما تستخدم الخلايا الجذعية المشتقة من الدهون (ADSCs) ، التي تمتلك خصائص اللحمة المتوسطة متعددة القدرات المشابهة للخلايا الجذعية ، في الطب التجديدي نظرا لقدرتها على مجموعة متنوعة من تمايز الخلايا وقدرتها على تعزيز الهجرة والانتشار وتخفيف الالتهاب. ومع ذلك، غالبا ما تواجه كالوريمتر المسح الضوئي التفاضلي تحديات في البقاء على قيد الحياة والنقش داخل الجروح، ويرجع ذلك أساسا إلى الظروف الالتهابية غير المواتية. ولمعالجة هذه المشكلة، تم تطوير الهلاميات المائية للحفاظ على صلاحية كالوريمتر المسح الضوئي التفاضلي (ADSC) في الجروح وتسريع عملية التئام الجروح. هنا، نهدف إلى تقييم التأثير التآزري للتعديل الحيوي الضوئي (PBM) على انتشار ADSC والسمية الخلوية ضمن إطار زراعة الخلايا ثلاثية الأبعاد. تم زرع كاليستيدات المعالجة المعمقة في هلاميات مائية سعة 10 ميكرولتر بكثافة 2.5 × 103 خلايا وتعرضت للإشعاع باستخدام ثنائيات 525 نانومتر و825 نانومتر عند طلاقة 5 جول / سم2 و 10 جول / سم2. تم تقييم التغيرات المورفولوجية والسمية الخلوية والانتشار في 24 ساعة و 10 أيام بعد التعرض ل PBM. أظهرت ADSCs مورفولوجيا مستديرة وتم توزيعها في جميع أنحاء الهلام كخلايا فردية أو مجاميع كروية. الأهم من ذلك ، أن كلا من إطار زراعة PBM و 3D لم يظهرا أي تأثيرات سامة للخلايا على الخلايا ، في حين أن PBM عزز بشكل كبير معدلات انتشار ADSCs. في الختام، توضح هذه الدراسة استخدام الهيدروجيل كبيئة ثلاثية الأبعاد مناسبة لثقافة كؤوس التفاضل التفاضلي (ADSC) وتقدم PBM كاستراتيجية تعزيز مهمة، لا سيما معالجة معدلات الانتشار البطيئة المرتبطة بزراعة الخلايا ثلاثية الأبعاد.
Introduction
ADSCs هي خلايا سلفية متعددة القدرات وسيطة لها القدرة على التجديد الذاتي والتمايز إلى عدة سلالات خلوية. يمكن حصاد هذه الخلايا من الجزء الوعائي اللحمي (SVF) للأنسجة الدهنية أثناء إجراء شفط الدهون1. برزت كالتي تفاضل التفاضل التفاضلي (ADSCs) كنوع مثالي من الخلايا الجذعية لاستخدامها في الطب التجديدي لأن هذه الخلايا وفيرة، وطفيفة التوغل للحصاد، ويمكن الوصول إليها بسهولة، وتتميز بشكل جيد2. يوفر العلاج بالخلايا الجذعية وسيلة ممكنة لالتئام الجروح عن طريق تحفيز هجرة الخلايا وتكاثرها والأوعية الدموية الجديدة وتقليل الالتهاب داخل الجروح 3,4. ويعزى ما يقرب من 80٪ من القدرة التجديدية ل ADSCs إلى إشارات الباراكرين عبر إفرازها5. في السابق ، تم اقتراح الحقن المحلي المباشر للخلايا الجذعية أو عوامل النمو في الأنسجة التالفة يمكن أن يكون غير مشروع بما يكفي في آليات إصلاح الجسم الحي 6،7،8. ومع ذلك ، واجه هذا النهج العديد من التحديات ، مثل ضعف البقاء على قيد الحياة وانخفاض تطعيم الخلايا الجذعية داخل الأنسجة التالفة نتيجة للبيئة الالتهابية 9. علاوة على ذلك ، كان أحد الأسباب المذكورة هو عدم وجود مصفوفة خارج الخلية لدعم بقاء ووظائف الخلايا المزروعة10. للتغلب على هذه التحديات ، يتم التركيز الآن على تطوير ناقلات المواد الحيوية لدعم صلاحية الخلايا الجذعية ووظيفتها.
تعمل ثقافة الخلايا ثلاثية الأبعاد (3D) على تحسين التفاعل من خلية إلى خلية ومن خلية إلى مصفوفة في المختبر لتوفير بيئة تشبه بشكل أفضل البيئة في الجسم الحي 11. تمت دراسة الهلاميات المائية على نطاق واسع كفئة من ناقلات المواد الحيوية التي توفر بيئة 3D لزراعة الخلايا الجذعية. هذه الهياكل مصنوعة من الماء والبوليمرات المتشابكة12. إن تغليف كالوريمتر المسح الضوئي التفاضلي (ADSCs) في هيدروجيل ليس له أي تأثير سام للخلايا على الخلايا أثناء الزرع مع الحفاظ على صلاحية الخلايا6. تظهر الخلايا الجذعية المزروعة في 3D احتفاظا معززا بجذعها وقدرة تمايزمحسنة 13. وبالمثل، أظهرت كالوريدات المعالجة بالهلام الكهروضوئي المنشط (ADSCs) البذرية المائية زيادة في الصلاحية وسرعة إغلاق الجرح في النماذج الحيوانية14. علاوة على ذلك، يزيد تغليف الهيدروجيل بشكل كبير من النقش والاحتفاظ ب ADSCs في الجروح15,16. يتكون TrueGel3D من بوليمر ، إما كحول بولي فينيل أو ديكستران ، متصلب بواسطة رابط متشابك ، إما سيكلوديكسترين أو بولي إيثيلين جلايكول17. الجل عبارة عن هيدروجيل اصطناعي لا يحتوي على أي منتجات حيوانية قد تتداخل مع التجارب أو تؤدي إلى رد فعل مناعي أثناء زرع الجل في المريض بينما تحاكي بشكل فعال مصفوفة خارج الخلية18. الجل قابل للتخصيص بالكامل عن طريق تغيير التكوين والمكونات الفردية. يمكن أن يضم خلايا جذعية مختلفة ويدعم تمايز عدة أنواع من الخلايا عن طريق ضبط صلابة الجل19. يمكن إنشاء مواقع المرفقات من خلال إضافة الببتيدات20. الجل قابل للتحلل عن طريق إفراز ميتالوبروتياز ، مما يسمح بهجرة الخلايا21. أخيرا ، إنه واضح ويسمح بتقنيات التصوير.
PBM هو شكل طفيف التوغل ويمكن تنفيذه بسهولة من العلاج بالليزر منخفض المستوى يستخدم لتحفيز الكروموفورات داخل الخلايا. الأطوال الموجية المختلفة تثير تأثيرات مختلفة على الخلايا22. يحفز الضوء في النطاق الأحمر إلى القريب من الأشعة تحت الحمراء زيادة إنتاج الأدينوسين ثلاثي الفوسفات (ATP) وأنواع الأكسجين التفاعلية (ROS) عن طريق تعزيز التدفق عبر سلسلة نقل الإلكترون23. يحفز الضوء في النطاقات الزرقاء والخضراء القنوات الأيونية ذات البوابات الضوئية ، مما يسمح بالتدفق غير المحدد للكاتيونات ، مثل الكالسيوم والمغنيسيوم ، إلى الخلايا ، والذي يعرف بتعزيز التمايز24. التأثير الصافي هو توليد رسل ثانوي يحفز نسخ العوامل التي تؤدي إلى العمليات الخلوية النهائية مثل الهجرة والانتشار والتمايز25. يمكن استخدام PBM لتهيئة الخلايا مسبقا للتكاثر أو التمايز قبل زرع الخلايا في بيئة معاكسة ، على سبيل المثال ، الأنسجة التالفة26. أدى التعرض ل PBM قبل وبعد الزرع (630 نانومتر و 810 نانومتر) ل ADSCs إلى تعزيز صلاحية ووظيفة هذه الخلايا في الجسم الحي في نموذجالفئران السكري 27. يتطلب الطب التجديدي عددا كافيا من الخلايا لإصلاح الأنسجة بشكل فعال28. في زراعة الخلايا ثلاثية الأبعاد، ارتبطت كالوريمتر المسح الضوئي التفاضلي بمعدلات انتشار أبطأ مقارنة بزراعة الخلاياثنائية الأبعاد 6. ومع ذلك ، يمكن استخدام PBM لزيادة عملية زراعة الخلايا ثلاثية الأبعاد ل ADSCs من خلال تعزيز الجدوى والانتشار والهجرة والتمايز29,30.
Protocol
ملاحظة: راجع جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والكواشف والبرامج المستخدمة في هذا البروتوكول. تم تلخيص البروتوكول بيانيا في الشكل 1.
1. ثنائي الأبعاد (2D) ثقافة الخلية
ملاحظة: يتم تخزين كالوريمتر المسح الضوئي التفاضلي (1 × 106 خلايا) عند -195.8 درجة مئوية في النيتروجين السائل في قنينة حفظ بالتبريد تحتوي على 1 مل من وسائط تجميد الخلايا.
- تحضير وسيط استعادة الخلايا 2D وقارورة الثقافة ثنائية الأبعاد
- نقل 39 مل من الوسط القاعدي إلى أنبوب طرد مركزي سعة 50 مل
- إثراء الوسط القاعدي بمصل بقري جنيني بنسبة 20٪ (FBS ؛ 10 مل) ومضادات حيوية (1 مل) (0.5 مل بنسلين-ستربتومايسين و 0.5 مل أمفوتريسين ب).
- قم بتكييف قارورة T75 مسبقا عن طريق نقل 6 مل من وسط استعادة الخلية إلى القارورة واحتضانها عند 37 درجة مئوية و 5٪ CO2 و 85٪ رطوبة لمدة 45 دقيقة (يمكن القيام بذلك أثناء تنفيذ خطوات استعادة الخلية لتوفير الوقت).
ملاحظة: قم بتسخين الوسط الكامل إلى 37 درجة مئوية قبل الاستخدام وتخزينه في درجة حرارة 4 درجات مئوية لمدة أقصاها 1 أسبوع.
- استعادة الخلايا 2D
- قم بإزالة cryovial من خزان تخزين النيتروجين السائل وقم بإذابة القارورة بسرعة في حمام مائي عند 37 درجة مئوية ، حتى يتم إذابة الجليد تماما.
- قم بتدوير المبرد باستخدام جهاز طرد مركزي عند 1006 × جم لمدة 5 دقائق (20 درجة مئوية) وبعد ذلك قم بإزالة المادة الطافية.
- أعد تعليق الخلايا المحببة باستخدام 1 مل من وسط استعادة الخلايا المسخن مسبقا.
- قم بتوزيع الخلايا العالقة بالتساوي في الدورق المكيف مسبقا (الحجم النهائي 7 مل) واحتضانها عند 37 درجة مئوية و 5٪ CO2 و 85٪ رطوبة.
- بعد 24 ساعة تجاهل واستبدال وسط استعادة الخلية.
- استبدل وسط الاستزراع كل 2-3 أيام حتى تصبح القارورة متقاربة مع الخلايا.
- حصاد قارورة الثقافة 2D في تعليق خلية واحدة وعدد الخلايا
- قم بإزالة قارورة الثقافة 2D من الحاضنة وتخلص من وسائط الثقافة في حاوية نفايات مناسبة.
- انقل 10 مل من محلول الشطف إلى القارورة لشطف الخلايا وإزالة الفضلات وتراكم البروتين. بعد ذلك ، تخلص من محلول الشطف.
- أضف 6 مل من محلول الانفصال إلى دورق الثقافة لفصل الخلايا. احتضان القارورة عند 37 درجة مئوية ، 5٪ CO2 ، ورطوبة 85٪ لمدة دقيقتين.
ملاحظة: راقب القارورة تحت المجهر للتأكد من فصل جميع الخلايا. إذا لم يكن كذلك ، اضغط برفق على القارورة واحتضانها لمدة دقيقة أخرى. - بمجرد فصل جميع الخلايا ، انقل تعليق الخلية إلى أنبوب طرد مركزي سعة 15 مل وأضف 1 مل من وسائط استعادة الخلية (تحتوي على 20٪ FBS) إلى الأنبوب. سيؤدي ذلك إلى تحييد تأثير حل الانفصال.
- جهاز طرد مركزي الأنبوب لمدة 5 دقائق عند 1711 × جم (20 درجة مئوية).
- قم بإزالة المادة الطافية وإعادة تعليق الخلايا في 1 مل من الوسائط الكاملة.
- قم بإزالة 10 ميكرولتر من تعليق الخلية ، وضعه في أنبوب طرد مركزي صغير سعة 500 ميكرولتر واخلطه مع 10 ميكرولتر من تريبان الأزرق بنسبة 1: 1.
- ضع 10 ميكرولتر من مزيج محلول الخلايا الزرقاء تريبان في غرفة عد الخلايا في نسختين.
- ضع غرفة عد الخلايا في عداد الخلايا الآلي. سيشير عداد الخلايا إلى إجمالي عدد الخلايا لكل مل بالإضافة إلى عدد الخلايا القابلة للحياة والميتة. احسب متوسط عدد الخلايا القابلة للحياة وعدد الخلايا القابلة للحياة اللازمة لتضمينها في هيدروجيل ثلاثي الأبعاد (الخطوة 2.2.6).
زراعة الخلايا 2. 3D
- إعداد وسط ثقافة كاملة 3D
- نقل 44 مل من الوسط القاعدي إلى أنبوب طرد مركزي سعة 50 مل.
- إثراء الوسائط ب 10٪ FBS (5 مل) والمضادات الحيوية (1 مل) (0.5 مل من البنسلين والستربتومايسين و 0.5 مل من الأمفوتريسين B).
ملاحظة: قم بتسخين الوسائط الكاملة إلى 37 درجة مئوية قبل الاستخدام وتخزينها في درجة حرارة 4 درجات مئوية لمدة أسبوع واحد كحد أقصى.
- تحضير هيدروجيل
- تحضير ديكستران سريع عن طريق الطرد المركزي (1000 × جم لمدة 30 ثانية عند 20 درجة مئوية) قارورة ديكستران سريعة لتركيز المادة. أضف 175 ميكرولتر من الماء إلى قارورة ديكستران سريعة لتحقيق تركيز نهائي قدره 30 مليمول / لتر مجموعات تفاعلية.
- دوامة الأنبوب (سرعة متوسطة لمدة 30 ثانية) يحتوي على محلول ديكستران سريع حتى تذوب المادة بالكامل. احتضان المادة المذابة على الجليد لمدة 5 دقائق. قم بطرد الأنبوب ، وقم بتدويره لفترة وجيزة ، واحتفظ به على الجليد أثناء الاستخدام مرة أخرى.
- جهاز طرد مركزي التشابك (1000 × جم لمدة 30 ثانية عند 20 درجة مئوية) لتركيز المادة. أضف 188 ميكرولتر من الماء إلى قارورة الربط المتشابك لتحقيق تركيز نهائي قدره 20 مليمول / لتر من مجموعات الثيول.
- دوامة الأنبوب (سرعة متوسطة لمدة 30 ثانية) يحتوي على محلول التشابك حتى يتم إذابة جميع المواد. احتضان الوصلة المذابة في درجة حرارة الغرفة (RT) لمدة 5 دقائق. أجهزة الطرد المركزي الأنبوب ، دوامة لفترة وجيزة ، والاحتفاظ بها في RT أثناء الاستخدام مرة أخرى.
- تكييف بروتوكول هيدروجيل من 30 ميكرولتر إلى 10 ميكرولتر لخفض التكلفة (انظر الجدول 1 للحصول على تفاصيل محددة).
- تحضير تعليق الخلية لتحقيق كثافة البذر من 2.5 × 103 خلايا لكل 10 ميكرولتر هيدروجيل.
- ادمج المكونات وفقا للجدول 1 لإنشاء مزيج رئيسي. انقل 9 ميكرولتر من المزيج الرئيسي إلى بئر في لوحة شريطية ذات 96 بئرا.
- قم بتقوية الجل بإضافة 1 ميكرولتر من الرابط المتشابك القابل للتحلل بعد 3 دقائق من نقل المزيج الرئيسي.
- قم بتغطية الهلاميات المائية بوسائط استزراع كاملة دافئة مسبقا تبلغ 170 ميكرولتر. احتضان لمدة 1 ساعة. بعد 1 ساعة ، استبدل وسط الثقافة.
ملاحظة: الخلايا المدمجة هيدروجيل جاهزة لمزيد من التجارب أو التحليل داخل نظام ثقافة 3D. اتبع البروتوكولات الإضافية حسب الحاجة للتطبيقات النهائية.
3. التعرض للتعديل الضوئي
- إعداد الليزر
- قم بإعداد نظام ليزر الصمام الثنائي للأطوال الموجية الخضراء (525 نانومتر) أو القريبة من الأشعة تحت الحمراء (825 نانومتر). قم بتشغيل الليزر واسمح لهم بالإحماء للمدة الموصى بها.
- تثبيت خرج الطاقة من الليزر من خلال السماح لهم بالوصول إلى حالة مستقرة. هذا يضمن تشعيع متسق ودقيق.
- قم بقياس خرج الطاقة لليزر باستخدام مقياس طاقة الليزر. سجل قيم الطاقة لكل طول موجي.
- استخدم المعادلة 1 (وقت تشعيع الليزر) لحساب وقت تشعيع الليزر. استبدل القيم من الجدول 2 في المعادلة 1 لتحديد وقت التشعيع المناسب لكل طلاقة. في المعادلة 1 ، يمثل "r" نصف قطر منطقة تشعيع الليزر.

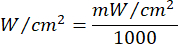

المعادلة 1 - راجع الجدول 2 للاطلاع على المعلمات المحددة اللازمة للحساب، بما في ذلك الطلاقة (5 جول/سم² أو 10 جول/سم²) وخرج طاقة الليزر.
- تشعيع الثقافات خلية 3D
- بعد استبدال الوسائط الكاملة (الخطوة 2.2.9) ، ضع اللوحة المكونة من 96 بئرا والتي تحتوي على خلايا مدمجة في هيدروجيل تحت نظام ليزر الصمام الثنائي. قم بتشعيع الهلاميات المائية بوقت تشعيع الليزر المحسوب للطلاقة المحددة (5 جول / سم² أو 10 جول / سم²) عند الطول الموجي المختار (أخضر أو قريب من الأشعة تحت الحمراء). لذلك ، لن تتلقى الثقافات سوى جرعة واحدة.
- تأكد من أن كل مجموعة تجريبية مصحوبة بعنصر تحكم (n = 4)، يتكون من كالوريمتر المسح الضوئي التفاضلي (ADSCs) مضمن في هيدروجيل دون التعرض ل PBM.
ملاحظة: احرص دائما على ارتداء نظارات السلامة المناسبة لطول موجة الضوء التي تعمل بها. يتم استخدام الليزر خارج خزانة الأمان. وبالتالي ، من المهم للغاية تطهير المنطقة قبل الاستخدام. - احتضان لوحات الاستزراع عند 37 درجة مئوية ، 5٪ CO2 ، و 85٪ رطوبة طوال مدة التجارب. احتضان اللوحات لمدة 24 ساعة للتحليل الأول أو 10 أيام لفترة التحليل الثانية ، بعد التشعيع.
4. مورفولوجيا
- المجهر الضوئي المقلوب
- قم بتشغيل المجهر الضوئي المقلوب واتركه يسخن لبضع دقائق. تأكد من محاذاة المجهر ومعايرته بشكل صحيح.
- قم بإعداد العينة للمراقبة على شريحة مجهرية أو طبق زراعة خلية متخصص ، اعتمادا على الإعداد التجريبي. معايرة المجهر للحصول على ظروف التصوير المثلى.
- اضبط إعدادات التركيز والسطوع والتباين حسب الحاجة. حدد العدسة الموضوعية 20x على المجهر لمراقبة وتسجيل مورفولوجيا الخلية.
- ضع العينة على مرحلة المجهر وركز على الخلايا ذات الأهمية باستخدام العدسة. باستخدام العدسة أو عرض الكاميرا ، راقب وسجل مورفولوجيا الخلية. انتبه إلى شكل الخلية وحجمها وأي ميزات مميزة.
- قم بتوصيل وحدة الكاميرا بالمجهر. قم بإعداد الكاميرا للتصوير الرقمي. تأكد من الاتصال والاتصال المناسبين بين الكاميرا والمجهر.
- باستخدام العدسة الموضوعية 20x ، التقط صورا رقمية للخلايا المرصودة. استخدم عناصر التحكم في الكاميرا لضبط التعرض والتركيز والإعدادات الأخرى ذات الصلة.
ملاحظة: تأكد من أن الصور الملتقطة ذات جودة عالية وتوفر عرضا تمثيليا لمورفولوجيا الخلية. - قم بتشغيل برنامج التصوير على الكمبيوتر. التقط الصورة واستخدم أدوات التحليل داخل البرنامج لتحليل مورفولوجيا الخلية.
- قم بقياس أبعاد الخلايا أو عد الخلايا أو إجراء أي تحليل ذي صلة بناء على الأهداف التجريبية.
- أضف شريط مقياس مناسب إلى الصور باستخدام البرنامج. استخدم التكبير المعروف لهدف المجهر لتمثيل مقياس الصور بدقة.
5. المقايسات الكيميائية الحيوية
- استعادة الخلايا
ملاحظة: يجب استعادة الخلايا من الهيدروجيل في تعليق أحادي الخلية لمزيد من المقايسات الكيميائية الحيوية النهائية.- تحضير حل استعادة الخلايا الأنزيمية. في بيئة معقمة ، قم بإعداد محلول عملي عن طريق تخفيف محلول استعادة الخلايا الأنزيمية بمحلول ملحي مخزن بالفوسفات (PBS) بنسبة 1:20 (المحلول: PBS). إذا كانت استعادة الخلايا من عدد معين من المواد الهلامية أو الآبار مطلوبة ، فاحسب الحجم الإجمالي المطلوب بناء على 30 ميكرولتر من محلول الاسترداد لكل هلام.
- أضف 30 ميكرولتر من محلول العمل إلى كل هلام أو بئر يحتوي على الخلايا التي تحتاج إلى الشفاء. تأكد من التوزيع الشامل والمتساوي لمحلول الاسترداد عن طريق هز اللوحة أو تحريكها برفق. احتضان اللوحة بمحلول الاسترداد وفقا لوقت الحضانة الموصى به. يمكن العثور على هذه المعلومات عادة في ورقة بيانات المنتج أو البروتوكول المقدم من المورد.
- بعد فترة الحضانة ، قم بإزالة اللوحة بعناية من الحاضنة. أجهزة الطرد المركزي لوحات في 1409 × غرام لمدة 5 دقائق (20 درجة مئوية) لبيليه الخلايا. ارجع إلى ورقة بيانات المنتج أو البروتوكول لمعرفة ظروف الطرد المركزي الموصى بها. بمجرد اكتمال الطرد المركزي ، تخلص بعناية من المادة الطافية ، مع الحرص على عدم إزعاج حبيبات الخلية.
- أعد تعليق الخلايا المحببة برفق في 220 ميكرولتر من برنامج تلفزيوني معقم. تأكد من الخلط الشامل لتحقيق تعليق متجانس أحادي الخلية. الخلايا جاهزة الآن للمقايسات الكيميائية الحيوية النهائية. اتبع البروتوكولات المحددة للمقايسات المقصودة ، مع الأخذ في الاعتبار طبيعة الخلايا المستردة ومتطلبات الإعداد التجريبي.
- مقايسة السمية الخلوية لنازعة هيدروجين اللاكتات (LDH)
- لكل بئر ، قم بإزالة 50 ميكرولتر من وسائط الاستزراع الكاملة بعناية ، مما يضمن الحد الأدنى من الاضطراب في طبقة الخلية.
- أضف 50 ميكرولتر من كاشف السمية الخلوية مباشرة إلى كل بئر يحتوي على 50 ميكرولتر المتبقية من وسائط الاستزراع. امزج برفق عن طريق السحب لأعلى ولأسفل لضمان الخلط الشامل للعينة مع الكاشف.
- إعداد السيطرة الإيجابية. قم بإعداد آبار ثلاثية مع 5 ميكرولتر من محلول تحلل 10x لكل 50 ميكرولتر من خلايا التحكم الإيجابية المضمنة في المجموعة.
- احتضان اللوحة في درجة الحرارة والمدة الموصى بها. تسمح هذه الخطوة لكاشف السمية الخلوية بتحلل الخلايا وإطلاق LDH في وسط الثقافة.
- بعد فترة الحضانة ، أضف 50 ميكرولتر من محلول التوقف مباشرة إلى كل بئر يحتوي على كاشف السمية الخلوية ومحلل الخلية. امزج برفق عن طريق سحب الإصبع لأعلى ولأسفل لضمان إيقاف التفاعل بشكل صحيح.
ملاحظة: يوقف حل الإيقاف المزيد من إطلاق LDH ويضمن استقرار تطور اللون. - قم بإعداد قارئ اللوحة الطيفية وفقا لتعليمات الشركة المصنعة. سجل امتصاص كل بئر عند 490 نانومتر. هذا الطول الموجي خاص بالكشف اللوني لمنتج الفورمازان الناتج عن تفاعل LDH.
- اطرح قراءات امتصاص الخلفية من كلتا مجموعتي العلاج وآبار التحكم. الحصول على قراءات خلفية من الآبار التي تحتوي على وسائط وكواشف السمية الخلوية بدون خلايا.
- تحليل قيم الامتصاص المصححة لكل عينة لتحديد مستوى السمية الخلوية. تشير قيم الامتصاص الأعلى إلى زيادة إطلاق LDH ، وبالتالي ارتفاع السمية الخلوية.
- تأكد من أن كل مجموعة تجريبية وعنصر تحكم يتكون من أربعة تكرارات (الخطوة 3.2.2) للدقة الإحصائية. حساب واستيراد متوسط الاستيعاب لكل مجموعة والتحكم في برنامج إحصائي مناسب.
- مقارنة النتائج بين مجموعات العلاج والضوابط المناسبة لتقييم التأثيرات السامة للخلايا بدقة وتسجيل جميع قراءات الامتصاص والحسابات والظروف التجريبية للرجوع إليها في المستقبل.
- مقايسة انتشار ATP
- في بيئة معقمة ، امزج 50 ميكرولتر من الخلايا المستردة مع 50 ميكرولتر من كاشف ATP في كل بئر.
ملاحظة: اضبط حجم الخلايا والكواشف بناء على عدد الآبار والتصميم التجريبي. الحفاظ على نسب ثابتة للحصول على نتائج دقيقة. - ضع الطبق على شاكر ورجه بقوة في الظلام لمدة 5 دقائق. تضمن هذه الخطوة خلطا شاملا للخلايا مع الكاشف. بعد الهز ، احتضن الطبق لمدة 25 دقيقة إضافية في RT. تسمح فترة الحضانة هذه للكاشف بتحلل الخلايا وتوليد إشارة إنارة تتناسب مع كمية ATP الموجودة.
- قم بإعداد قارئ الألواح وفقا لتعليمات الشركة المصنعة لاكتشاف التلألؤ. قياس التلألؤ من كل بئر يحتوي على محلل الخلية وكاشف ATP. تأكد من ضبط قارئ اللوحة لقياس التلألؤ بالإعدادات المناسبة.
- اطرح قراءات تلألؤ الخلفية من كلتا مجموعتي المعالجة وآبار التحكم. احصل على قراءات خلفية من الآبار التي تحتوي فقط على كاشف ATP و PBS بدون خلايا.
- تحليل قيم التلألؤ المصححة لكل عينة لتحديد مستويات ATP ، مما يعكس تكاثر الخلايا أو قابليتها للحياة.
- تأكد من أن كل مجموعة تجريبية وعنصر تحكم يتكون من أربعة تكرارات (الخطوة 3.2.2) للدقة الإحصائية. حساب واستيراد متوسط التلألؤ لكل مجموعة والتحكم في برنامج إحصائي مناسب.
- قارن النتائج بين مجموعات العلاج والضوابط ذات الصلة لتقييم انتشار ATP بدقة. سجل جميع قراءات التلألؤ والحسابات والظروف التجريبية للرجوع إليها في المستقبل.
ملاحظة: بالنسبة لجميع التحليلات الكيميائية الحيوية في شكل مجموعة ، اتبع دليل أو بروتوكول المجموعة المقدم من الشركة المصنعة للحصول على تفاصيل محددة ، مثل أوقات الحضانة الموصى بها والتركيزات وأي خطوات أو اعتبارات إضافية. التزم دائما بإرشادات السلامة المختبرية عند التعامل مع المواد الكيميائية والمواد البيولوجية.
- في بيئة معقمة ، امزج 50 ميكرولتر من الخلايا المستردة مع 50 ميكرولتر من كاشف ATP في كل بئر.
النتائج
لتقييم التشكل وفحص كثافة الخلايا للهلاميات المائية بصريا ، تم استخدام الفحص المجهري العكسي (الشكل 2). احتفظت ADSCs بمورفولوجيا مستديرة بعد 24 ساعة من البذر والتعرض ل PBM. كانت الخلايا منتشرة في جميع أنحاء الجل كخلايا مفردة أو في مجموعات تشبه العنب. لم يتغير التشكل بعد 10 أيام في ثقافة 3D. لم يلاحظ أي اختلاف نهائي في التشكل بين المجموعات التجريبية والضوابط أو بين المجموعات التجريبية المختلفة.
لتقييم التأثيرات السامة للخلايا للتعرض ل PBM والثقافة ثلاثية الأبعاد باستخدام هيدروجيل ، تم قياس تسرب LDH (الشكل 3). لم تكن هناك فروق ذات دلالة إحصائية بين المجموعات التجريبية والضوابط في 24 ساعة أو 10 أيام ، مما يشير إلى أن التعرض ل PBM وثقافة الهيدروجيل لم يكن لها تأثير ضار على الخلايا.
تم قياس معدلات الانتشار الخلوي عن طريق قياس محتوى ATP في ADSCs (الشكل 4). أدى التعرض ل PBM إلى زيادة معدلات الانتشار في جميع المجموعات التجريبية مقارنة بالضوابط. عند 24 ساعة بعد التعرض ل PBM ، حفز الطول الموجي 525 نانومتر أعلى معدلات الانتشار. ومع ذلك ، عند علامة 10 أيام ، أظهر الطول الموجي 825 نانومتر معدلات انتشار أعلى مقارنة بالطول الموجي 525 نانومتر. في نهاية فترة الاستزراع التي استمرت 10 أيام ، أظهرت مجموعة 825 نانومتر ، 10 جول / سم2 أعلى معدل انتشار.

الشكل 1: نظرة عامة على البروتوكول. بروتوكول موجز يسلط الضوء على تحضير الهيدروجيل في 96 لوحة بئر ، والتعرض ل PBM ، وقياس التشكل والمقايسات الكيميائية الحيوية في 24 ساعة و 10 أيام بعد التعرض ل PBM. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تجميع كالوريمتر المسح الضوئي التفاضلي (ADSCs) ذاتيا بعد البذر. احتفظت الخلايا بمورفولوجيا مستديرة إلى بيضاوية وتم توزيعها في الهيدروجيل إما كخلايا مفردة أو مجاميع ذات مظهر عنقودي يشبه العنب عند (A) 24 h و (B) بعد 10 أيام من البذر والتعرض ل PBM. لم يلاحظ أي تغيير نهائي بعد 10 أيام من الحضانة. باستخدام عناصر التحكم (1 و 4) ، 525 نانومتر عند 5 جول / سم2 (2) و 10 جول / سم2 (5) أو 825 نانومتر عند 5 جول / سم2 (3) و 10 جول / سم2 (6) ، على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تسرب LDH الخلوي كقياس للسمية الخلوية 24 ساعة و 10 أيام بعد التعرض ل PBM ، باستخدام الصمام الثنائي 525 نانومتر و 825 نانومتر (5 جول / سم2 و 10 جول / سم2) في الهيدروجيل. لم تلاحظ أي زيادة كبيرة في السمية الخلوية مقارنة بالمجموعة التجريبية. كان التحكم الإيجابي ممثلا لموت الخلية الكامل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: الأدينوسين الثلاثي الفوسفات الخلوي كقياس للانتشار بعد 24 ساعة و10 أيام من التعرض ل PBM ، باستخدام الصمام الثنائي 525 نانومتر و 825 نانومتر (5 جول / سم2 و 10 جول / سم2) في الهيدروجيل. حفز التعرض ل PBM على زيادة معدلات الانتشار في جميع المجموعات التجريبية في كل من النقاط الزمنية وكلا الطلاقة. يشار إلى الفروق ذات الدلالة الدلالة (P < 0.001) ب ***. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مكون | الحجم (ميكرولتر) لكل بئر |
| بوليمر سلو ديكستران (30 ملليمول/لتر) | 0.7 |
| تعليق الخلية | 2 |
| مخزن مؤقت | 0.8 |
| الماء | 5.5 |
| كروسلينكر | 1 |
| الحجم الكلي | 10 |
الجدول 1: أحجام كاشف هيدروجيل (10 ميكرولتر).
| معلمات الليزر | أخضر (غ) | بالقرب من الأشعة تحت الحمراء (NIR) |
| مصدر الضوء | ليزر | ليزر |
| الطول الموجي (نانومتر) | 525 | 825 |
| خرج الطاقة (ميغاواط) | 553 | 515 |
| كثافة الطاقة (ميغاواط / سم2) | 57.48 | 53.53 |
الجدول 2: معلمات الليزر.
Discussion
تعد كالوريمتر المسح الضوئي التفاضلي (ADSCs) نوعا مثاليا من الخلايا لاستخدامها في الطب التجديدي لأنها تحفز العمليات المختلفة للمساعدة في التئام الجروح 3,4. ومع ذلك ، هناك العديد من التحديات التي يجب التحايل عليها ، على سبيل المثال ، معدلات البقاء على قيد الحياة الضعيفة وعدم فعالية تطعيم الخلايا في موقع الإصابة9. تم استخدام الخلايا الخالدة كخط خلوي متاح تجاريا ، حيث يمكن تمريرها لأجيال أكثر مقارنة بالخلايا الأولية ، ولا تحتاج إلى حصادها ، وتتميز بشكل جيد ، وهي مجموعات متجانسة تضمن نتائج متسقة31. كان الهدف من هذه الدراسة هو تحديد الإمكانات المعززة ل PBM على انتشار وسمية الخلايا من ADSCs ، باستخدام ثقافة الخلايا 3D. تم تكييف بروتوكول الشركة المصنعة لهيدروجيل 30 ميكرولتر إلى 10 ميكرولتر لتوفير التكلفة32. ومع ذلك ، فإن هذا الحجم المنخفض جعل إعداد الجل والتعامل معه أكثر صعوبة.
وقد ثبت أن ADSCs تتجمع ذاتيا داخل بيئة ثلاثية الأبعاد33. وبالمثل في هذه الدراسة ، شكلت الخلايا تجمعات خلايا ذات مظهر يشبه العنب. ومع ذلك ، تم تحديد خلايا وضع واحد أيضا. سفك الخلايا هو خاصية معروفة للكرويات التي تنفصل فيها الخلايا عن الجسم الكروي الرئيسي أو الكلي ويتم إطلاقها في بيئة الثقافة. يمكن أن ينتج تساقط الخلايا عن التكاثر الخلوي ، حيث يتم التخلص من الخلايا القابلة للحياة أثناء الانقسام الميتوزي والسماح بالهجرة34. بدلا من ذلك ، يمكن أن ينتج التساقط بسبب موت الخلايا وفقدان الشكل الكروي أو الكلي35 ، خاصة في الكرات الكبيرة جدا بسبب نمو النواة الميتة. اعتمدت الخلايا مورفولوجيا مستديرة في ثقافة 3D ، مقارنة مع شكل المغزل في الثقافات 2D. تمشيا مع نتائج دراسات مماثلة ، ترجع هذه النتائج إلى نقص مواقع التعلق أو المصفوفة خارج الخلية للخلايا للالتصاقب 6,9. علاوة على ذلك ، لم تظهر الخلايا أي هجرة كبيرة في الجل ، مما يعني أيضا الحاجة إلى مواقع التعلق36. يوصى بإضافة ببتيد الالتصاق أو بروتين مصفوفة آخر خارج الخلية لتسهيل التعلق والالتصاق والهجرة. كان أحد قيود الدراسة هو استخدام المجهر الضوئي العكسي لمراقبة مورفولوجيا 3D ل ADSCs بدلا من تكديس Z. لم يكن للتعرض ل PBM وثقافة 3D تأثير كبير على السمية الخلوية ل ADSCs في كل من 24 ساعة و 10 أيام بعد التعرض ، مما يشير إلى أن ثقافة الهيدروجيل و PBM آمنة وليس لها تأثير سلبي على الخلايا 6,26. في زراعة الخلايا ثلاثية الأبعاد، ارتبطت كالوريمتر المسح الضوئي التفاضلي بمعدلات انتشار أبطأ مقارنة بزراعة الخلايا ثنائية الأبعاد. ويدعم ذلك انخفاض معدلات انتشار الضوابط العادية في الدراسةالحالية 6. PBM (525 نانومتر و 825 نانومتر) زاد بشكل كبير من معدلات انتشار ADSCs في ثقافة 3D. في البداية ، أثار الضوء الأخضر (525 نانومتر) عند كل من 5 J / cm2 و 10 J / cm2 طلاقة أعلى معدلات الانتشار مقارنة بالضوء القريب من الأشعة تحت الحمراء (825 نانومتر). ومع ذلك ، عند علامة 10 أيام ، فإن ضوء الأشعة تحت الحمراء القريبة (825 نانومتر) لديه أعلى معدلات الانتشار عند كل من 5 J / cm2 و 10 J / cm2 طلاقة. وبالمثل ، فقد ثبت أن PBM (525 نانومتر و 825 نانومتر) يزيد من معدلات الانتشار في الثقافات ثنائية الأبعاد37. يوصى أيضا بتضمين مجموعة تركيبة الطول الموجي ، حيث أبلغت دراسات أخرى عن تأثير تآزري للضوء الأخضر والأشعة تحت الحمراء القريبة.
في الختام ، فإن الهيدروجيل المستخدم هو هيدروجيل اصطناعي يتمتع بقدرة تخصيص هائلة لتناسب احتياجات التطبيقات المختلفة. أظهرت الدراسة الحالية أن الجل ليس له تأثير سام للخلايا على الخلايا في الثقافة على مدى 10 أيام. علاوة على ذلك ، أظهر PBM إمكانات معززة إيجابية من خلال تنظيم معدلات انتشار ADSCs بشكل كبير ، على الرغم من وجوده في بيئة ثقافة 3D. وبالتالي ، يمكن أن يكون هذا الهيدروجيل بمثابة حامل محتمل للمواد الحيوية لزرعها في الجروح. يجب أن تهدف التحقيقات المستقبلية إلى اختبار القدرة المحتملة للهلام للمساعدة في التئام الجروح باستخدام الدراسات على. إذا كانت نتائج التجارب على مواتية، فمن المتصور أن يتم حصاد كؤوس التفاضل التفاضلي (ADSCs) المشتقة من المريض وتغليفها وتعزيزها باستخدام PBM قبل زرعها في الجروح للمساعدة في التئام الجروح في التطبيقات السريرية.
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
تم تمويل هذا البحث من قبل المؤسسة الوطنية للبحوث في جنوب أفريقيا Thuthuka Instrument ، رقم المنحة TTK2205035996 ؛ وزارة العلوم والابتكار (DSI) بتمويل من المركز الأفريقي لليزر (ALC) ، رقم المنحة HLHA23X المهمة ALC-R007 ؛ مجلس البحوث الجامعية ، رقم المنحة 2022URC00513 ؛ مبادرة كراسي البحث في جنوب إفريقيا التابعة لوزارة العلوم والتكنولوجيا (DST-NRF / SARChI) ، رقم المنحة 98337. لم تلعب هيئات التمويل أي دور في تصميم الدراسة أو الجمع أو التحليل أو تفسير البيانات أو كتابة المخطوطة. يشكر المؤلفون جامعة جوهانسبرغ (UJ) ومركز أبحاث الليزر (LRC) على استخدامهم للمرافق والموارد.
Materials
| Name | Company | Catalog Number | Comments |
| 525 nm diode laser | National Laser Centre of South Africa | EN 60825-1:2007 | |
| 825 nm diode laser | National Laser Centre of South Africa | SN 101080908ADR-1800 | |
| 96 Well Strip Plates | Sigma-Aldrich | BR782301 | |
| Amphotericin B | Sigma-Aldrich | A2942 | Antibiotic (0.5%; 0.5 mL) |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9681 | ATP reagent, Proliferation assay Kit |
| Corning 2 mL External Threaded Polypropylene Cryogenic Vial | Corning | 430659 | cryovial |
| CryoSOfree | Sigma-Aldrich | C9249 | Cell freezing media |
| CytoTox96 Non-Radioactive Cytotoxicity Assay | Promega | G1780 | Cytotoxicity reagent |
| Dulbecco’s Modified Eagle Media | Sigma-Aldrich | D5796 | Basal medium (39 mL/44 mL) |
| FieldMate Laser Power Meter | Coherent | 1098297 | |
| Flat-bottomed Corning 96 well clear polystyrene plate | Sigma-Aldrich | CLS3370 | |
| Foetal bovine serum | Biochrom | S0615 | Culture medium enrichment (5 mL; 10% / 10 mL; 20%) |
| Hanks Balanced Salt Solution (HBSS) | Sigma-Aldrich | H9394 | Rinse solution |
| Heracell 150i CO2 incubator | Thermo Scientific | 51026280 | |
| Heraeus Labofuge 400 | Thermo Scientific | 75008371 | Plate spinner for 96 well plates |
| Heraeus Megafuge 16R centrifuge | ThermoFisher | 75004270 | |
| Immortalized ADSCs | ATCC | ASC52Telo hTERT, ATCC SCRC-4000 | Passage 37 |
| Invitrogen Countess 3 | Invitrogen | AMQAX2000 | Automated cell counter for Trypan Blue |
| Julabo TW20 waterbath | Sigma-Aldrich | Z615501 | Waterbath used to warm media to 37 °C |
| Olympus CellSens Entry | Olympus | Version 3.2 (23706) | Imaging software: digital image acquisition |
| Olympus CKX41 | Olympus | SN9B02019 | Inverted light microscope |
| Olympus SC30 camera | Olympus | SN57000530 | Camera attached to inverted light microscope |
| Opaque-walled Corning 96 well solid polystyrene microplates | Sigma-Aldrich | CLS3912 | Opaque well used for ATP luminescence |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | Antibiotic (0.5%; 0.5 mL) |
| SigmaPlot 12.0 | Systat Software Incorporated | ||
| TrueGel3D – True3 | Sigma-Aldrich | TRUE3-1KT | 10 µL |
| TrueGel3D Enzymatic Cell Recovery Solution | Sigma-Aldrich | TRUEENZ | 01:20 |
| Trypan Blue Stain | Thermo Fisher - Invitrogen | T10282 | 0.4% solution |
| TrypLE Select Enzyme (1x) | Gibco | 12563029 | Cell detachment solution |
| Victor Nivo Plate Reader | Perkin Elmer | HH3522019094 | Spectrophotometric plate reader |
References
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: Implications for cell-based therapies. Tissue Eng. 7 (2), 211-228 (2001).
- Yuan, X., et al. Strategies for improving adipose-derived stem cells for tissue regeneration. Burns Trauma. 10, (2022).
- Nilforoushzadeh, M. A., et al. Mesenchymal stem cell spheroids embedded in an injectable thermosensitive hydrogel: An in situ drug formation platform for accelerated wound healing. ACS Biomater Sci Eng. 6 (9), 5096-5109 (2020).
- Yang, M., et al. Thermosensitive injectable chitosan/collagen/β-glycerophosphate composite hydrogels for enhancing wound healing by encapsulating mesenchymal stem cell spheroids. ACS Omega. 5 (33), 21015-21023 (2020).
- Chimenti, I., et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ Res. 106 (5), 971-980 (2010).
- Hassan, W., Dong, Y., Wang, W. Encapsulation and 3d culture of human adipose-derived stem cells in an in-situ crosslinked hybrid hydrogel composed of peg-based hyperbranched copolymer and hyaluronic acid. Stem Cell Res Ther. 4 (2), 32 (2013).
- Wu, K. H., Mo, X. M., Han, Z. C., Zhou, B. Stem cell engraftment and survival in the ischemic heart. The Ann Thorac Surg. 92 (5), 1917-1925 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: General approaches and a review of recent developments. J R Soc Interface. 8 (55), 153-170 (2011).
- Koivunotko, E., et al. Angiogenic potential of human adipose-derived mesenchymal stromal cells in nanofibrillated cellulose hydrogel. Biomedicines. 10 (10), 2584 (2022).
- Dong, Y., et al. Injectable and tunable gelatin hydrogels enhance stem cell retention and improve cutaneous wound healing. Adv Funct Mater. 27 (24), 1606619 (2017).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3d cell culture. Biotechnol Bioeng. 103 (4), 655-663 (2009).
- Mantha, S., et al. Smart hydrogels in tissue engineering and regenerative medicine. Materials. 12 (20), 3323 (2019).
- Sung, T. -. C., et al. 3D culturing of human adipose-derived stem cells enhances their pluripotency and differentiation abilities. J Mater Sci Technol. 63, 9-17 (2021).
- Garg, R. K., et al. Capillary force seeding of hydrogels for adipose-derived stem cell delivery in wounds. Stem Cells Transl Med. 3 (9), 1079-1089 (2014).
- Kim, Y. M., et al. Adipose-derived stem cell-containing hyaluronic acid/alginate hydrogel improves vocal fold wound healing. Laryngoscope. 124 (3), E64-E72 (2014).
- Dong, Y., et al. Conformable hyaluronic acid hydrogel delivers adipose-derived stem cells and promotes regeneration of burn injury. Acta Biomater. 108, 56-66 (2020).
- Truegel3d hydrogel for 3d cell culture. Merck Available from: https://www.sigmaaldrich.com/ZA/en/technical-documents/technical-article/cell-culture-and-cell-culture-analysis/3d-cell-culture/truegel3d (2024)
- Braccini, S., Tacchini, C., Chiellini, F., Puppi, D. Polymeric hydrogels for in vitro 3d ovarian cancer modeling. Int J Mol Sci. 23 (6), 3265 (2022).
- Mashinchian, O., et al. In vivo transcriptomic profiling using cell encapsulation identifies effector pathways of systemic aging. eLife. 11, e57393 (2022).
- Matsushige, C., Xu, X., Miyagi, M., Zuo, Y. Y., Yamazaki, Y. Rgd-modified dextran hydrogel promotes follicle growth in three-dimensional ovarian tissue culture in mice. Theriogenology. 183, 120-131 (2022).
- Marx, V. How some labs put more bio into biomaterials. Nat Methods. 16 (5), 365-368 (2019).
- Marques, M. M. Photobiomodulation therapy weaknesses. Laser Dent Sci. 6 (3), 131-132 (2022).
- Hamblin, M. R. Mechanisms and mitochondrial redox signaling in photobiomodulation. Photochem Photobiol. 94 (2), 199-212 (2018).
- Chen, J., et al. Low-level controllable blue LEDs irradiation enhances human dental pulp stem cells osteogenic differentiation via transient receptor potential vanilloid 1. J Photochem Photobiol B. 233, 112472 (2022).
- Chang, S. -. Y., Carpena, N. T., Kang, B. J., Lee, M. Y. Effects of photobiomodulation on stem cells important for regenerative medicine. Med Lasers. 9 (2), 134-141 (2020).
- Bikmulina, P. Y., et al. Beyond 2d: Effects of photobiomodulation in 3d tissue-like systems. J Biomed Opt. 25 (4), 048001 (2020).
- Ahmadi, H., et al. Transplantation of photobiomodulation-preconditioned diabetic stem cells accelerates ischemic wound healing in diabetic rats. Stem Cell Res Ther. 11 (1), 494 (2020).
- Mao, A. S., Mooney, D. J. Regenerative medicine: Current therapies and future directions. Proc Natl Acad Sci U S A. 112 (47), 14452-14459 (2015).
- De Andrade, A. L. M., et al. Effect of photobiomodulation on the behaviour of mesenchymal stem cells in three-dimensional cultures. Lasers Med Sci. 38 (1), 221 (2023).
- Diniz, I. M., et al. Photobiomodulation of mesenchymal stem cells encapsulated in an injectable rhbmp4-loaded hydrogel directs hard tissue bioengineering. J Cell Physiol. 233 (6), 4907-4918 (2018).
- Carter, M., Shieh, J. C. . Guide to Research Techniques in Neuroscience. , (2015).
- Lutolf, M. P., et al. Synthetic matrix metalloproteinase-sensitive hydrogels for the conduction of tissue regeneration: Engineering cell-invasion characteristics. Proc Natl Acad Sci U S A. 100 (9), 5413-5418 (2003).
- Robledo, F., et al. Spheroids derived from the stromal vascular fraction of adipose tissue self-organize in complex adipose organoids and secrete leptin. Stem Cell Res Ther. 14 (1), 70 (2023).
- Landry, J., Freyer, J. P., Sutherland, R. M. Shedding of mitotic cells from the surface of multicell spheroids during growth. J Cell Physiol. 106 (1), 23-32 (1981).
- Bogacheva, M. S., et al. Differentiation of human pluripotent stem cells into definitive endoderm cells in various flexible three-dimensional cell culture systems: Possibilities and limitations. Front Cell Dev Biol. 9, 726499 (2021).
- Chen, X., Thibeault, S. L. Biocompatibility of a synthetic extracellular matrix on immortalized vocal fold fibroblasts in 3-d culture. Acta Biomater. 6 (8), 2940-2948 (2010).
- Crous, A., Van Rensburg, M. J., Abrahamse, H. Single and consecutive application of near-infrared and green irradiation modulates adipose derived stem cell proliferation and affect differentiation factors. Biochimie. 196, 225-233 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved