Method Article
Модифицированная пункция хвостовой вены и вены полового члена для забора крови на крысиной модели
* Эти авторы внесли равный вклад
В этой статье
Резюме
Здесь мы представляем протокол, предлагающий быстрые, простые и надежные альтернативы сбору крови для модели крыс. Мы описываем три различных метода забора крови в зависимости от контекста: пункция хвостовой вены под наркозом или на животном, находящемся в сознании, и пункция дорсальной вены полового члена под наркозом.
Аннотация
Образцы крови требуются в большинстве экспериментальных конструкций животных для оценки различных гематологических параметров. В этой статье представлены две процедуры забора крови у крыс: пункция боковой хвостовой вены и пункция дорсальной вены полового члена, которые имеют значительные преимущества по сравнению с другими ранее описанными методами. Это исследование показывает, что эти две процедуры позволяют быстро брать пробы (менее 10 минут) и дают достаточные объемы крови для большинства анализов (202 мкл ± 67,7 мкл). Пункция дорсальной вены полового члена должна проводиться под наркозом, тогда как пункция боковой хвостовой вены может быть сделана сознательному, сдержанному животному.
Таким образом, чередование этих двух методов позволяет брать кровь в любой ситуации. Несмотря на то, что всегда рекомендуется оказывать помощь оператору во время процедуры для обеспечения благополучия животных, для этих методов требуется только один оператор, в отличие от большинства методов отбора проб крови, для которых требуется два. Более того, в то время как эти ранее описанные методы (например, забор крови из яремной палочки, подключичной вены) требуют обширной предварительной подготовки, чтобы избежать причинения вреда или смерти животного, пункция хвостовой вены и дорсальной вены полового члена редко приводит к летальному исходу. По всем этим причинам и в зависимости от контекста (например, для исследований, включающих самцов крыс, во время периоперационного или непосредственного послеоперационного периода, для животных с тонкими хвостовыми венами) оба метода могут использоваться поочередно для повторного забора крови.
Введение
Забор крови необходим для большинства исследований на животных, как in vivo , так и in vitro. У крыс, поскольку частота и количество забора крови могут быть значительными, полезно иметь различные альтернативы для сбора. В предыдущих исследованиях были описаны различные методы.
Наиболее часто используемыми методами являются пункция хвостовой вены и забор крови из подкожной вены. Отбор проб хвостовых жил подходит для всех штаммов крыс. При надлежащем обучении процедура проста в выполнении и причиняет животному минимальные страдания1. Точно так же забор крови из подкожной вены, при условии, что он сделан правильно, также является быстрым и простым методом сбора. Ни один из методов не требует анестезии, и оба допускают повторные заборы небольшого количества крови. Тем не менее, пункция подкожной вены обычно дает меньший объем крови1 и требует присутствия двух человек, чтобы оставить одну заднюю конечность открытой для пункции2.
Если необходимо собрать большое количество крови у одного животного, можно использовать пункцию сердца или пункцию полой вены (до 10 мл крови может быть взято у крысы весом 150 г с помощью пункциисердца 2). Эти методы требуют анестезии и являются конечными процедурами. Животное должно быть усыплено после любого из этих двух методов2. Яремная палочка является альтернативой, которую можно использовать, если необходимо собрать большое количество крови в исследовании, которое еще не достигло своей конечной точки. Однако эта техника также требует значительных технических навыков, чтобы избежать вреда животному; следовательно, его использование должно быть ограничено3.
Другие методы, такие как забор крови из подключичной вены, не требуют использования анестетиков перед забором крови и позволяют многократно брать образцы небольших объемов крови. Однако для этого метода требуется сдержанное обращение и соответствующий разрез иглой. Неправильная операция может привести к боли или даже смертности животного, а обучение этому методу может быть привередливым4.
Другие анекдотические процедуры включают орбитальную пункцию и пункцию сублингвальной вены, обе из которых требуют анестетика и не рекомендуются и не используются широко. Хотя предыдущие исследования показали более быстрый сбор крови с помощью орбитальной пункции, чем с помощью пункции хвостовой вены, было обнаружено, что орбитальная пункция под анестезией диэтиловым эфиром переносится хуже, чем последний метод (на основе показателей возбуждения животных и выработки мочи)5. Более того, этот метод сильно зависит от мастерства человека, который выполняет процедуру, и в основном выполняется опытными ветеринарами. Для сравнения, пункция подъязычной вены менее болезненна и рекомендуется для повторного забора крови6. Однако этот метод имеет серьезные побочные эффекты, такие как снижение потребления пищи и воды, что может привести к смерти животного7.
В этом исследовании описаны два метода, используемых в нашей лаборатории для повторного забора крови. Пункция хвостовой вены может быть выполнена на животном, находящемся в сознании, при этом повреждение тканей и неблагоприятные последствия минимальны. Модификация этой техники в данном исследовании включает стабилизацию хвоста указательным и средним пальцами, что позволяет одному оператору выполнять забор крови. Пункция дорсальной вены полового члена уже была описана для простых внутривенных инъекций. Эта методика выполняется под наркозом и позволяет получить надежный источник крови в случае трудностей с другими методами (например, в ближайшем послеоперационном периоде, у небольшого животного, при проведении периоперационного забора крови под наркозом). Подобно отбору проб из хвостовой вены, травма в месте прокола окажет незначительное общее влияние на животное по сравнению с методами, упомянутыми выше8. Цель данной методики – предложить неопытным исследователям простые и надежные альтернативы забору крови в зависимости от контекста (например, для процедур, проводимых под наркозом, для исследований, включающих самцов крыс, для животных с тонкими хвостовыми венами).
протокол
Процедуры проводились на 3-месячных крысах-самцах Льюиса, каждая из которых весила 300-400 г. В общей сложности было включено 24 животных с тремя условиями пункции: 12 крысам была выполнена пункция хвостовой вены без анестезии (групповое телевидение без анестезии), а еще 12 крыс были анестезированы для проведения пункции хвостовой вены (групповое телевидение с анестезией) и пункции вены полового члена (группа PV с анестезией). Все процедуры были одобрены и соответствовали руководящим принципам Институционального комитета по уходу за животными и их использованию (IACUC). Все животные были подвергнуты эвтаназии в конце исследования (после 1 месяца наблюдения) путем передозировки углекислого газа. Подробную информацию обо всех материалах и инструментах, используемых в этом протоколе, см. в Таблице материалов .
1. Общие рекомендации
- В соответствии с рекомендациями IACUC убедитесь, что максимальный объем взятой крови составляет не более 10% от общего объема крови каждые 2 недели9. Например, у крысы весом 300 г общий объем крови должен составлять примерно 19,2 мл. В случае протокола, требующего четырех заборов крови только в течение первой недели (день 0, день 1, день 3, день 7), ограничьте сбор максимум 250 мкл крови на образец.
- Для процедур, выполняемых под наркозом, вводите изофлуран через прецизионный испаритель, чтобы обезболить животное. Индуцируют анестезию в камере с дозой 3-5% изофлурана в течение 5 мин и поддерживают, используя дозу 1%-3% изофлурана через носовой конус во время процедуры. Отрегулируйте уровень изофлурана на основе непрерывного мониторинга частоты дыхания. Перед началом процедуры проверьте, достаточна ли седация, ущипнув пальцы ног.
- Не оставляйте животное без присмотра во время процедуры или до тех пор, пока оно не придет в сознание, достаточное для поддержания лежачего положения грудины.
- После забора крови наблюдайте за животным до полного выздоровления, прежде чем возвращать его в клетку, и не вводите его в компанию других животных до полного выздоровления.
ПРИМЕЧАНИЕ: По согласованию с ветеринарными службами, после пункции хвостовой вены или вены полового члена не требовалось принимать обезболивающие препараты после процедуры.
2. Забор крови из вены полового члена
- Подготовка
- Подготовьте следующее оборудование: стерильную марлю, перчатки, спиртовые салфетки, микрокапиллярную пробирку ЭДТА для забора крови (фиолетовый колпачок) и инсулиновый шприц на 30 г (30 ЕД или 50 ЕД).
- Выньте крысу из клетки и поместите ее в камеру для индукции изофлураном через прецизионный испаритель (доза: 3% -5%). После того, как животное успокоено, перенесите его на процедурный стол и положите животное на спину, поместив нос в носовой конус, чтобы поддерживать анестезию. Контролируйте частоту дыхания и соответствующим образом регулируйте уровень изофлурана (поддерживающая доза: 1-3%). Перед началом процедуры убедитесь, что животное достаточно успокоено ущипыванием пальцев ног.
- Забор крови
- Несколько раз переместите поршень вперед и назад в шприце, чтобы сгладить вывод. Создайте отрицательное давление в шприце, потянув за поршень, чтобы удалить пару микролитров.
- С помощью недоминантной руки оттяните крайнюю плоть от конца полового члена, а головку зажмите между указательным и большим пальцами, осторожно потянув. Дорсальная вена полового члена будет выглядеть как поверхностный синий шнур. Смотрите рисунки 1 и 2.
- Так, чтобы ушко иглы было направлено вверх, введите инсулиновый шприц в вену под углом 35°. Как только игла попадет в вену, в шприц потечет кровь.
- Медленно извлеките поршень шприца с медленной и устойчивой скоростью, чтобы набрать желаемый объем.
ПРИМЕЧАНИЕ: Не снимайте поршень слишком быстро, так как это приведет к коллапсу вены и остановке кровотока. - Если кровоток уменьшается, слегка поверните иглу по часовой стрелке или против часовой стрелки.
- Извлеките шприц. На месте прокола образуется капля крови, аспирация которой позволит собрать еще несколько микролитров крови в случае проведения нестерильной процедуры.
- Если первый прокол не удался, снова введите иглу проксимальнее на вену.
ПРИМЕЧАНИЕ: В отличие от забора проб хвостовой вены, итеративная пункция дорсальной вены полового члена обычно безуспешна. - Слегка надавите на место прокола, чтобы остановить кровотечение, и протрите область новой спиртовой салфеткой.
- Верните пенис в нейтральное положение.
- Выключите изофлуран и наблюдайте за крысой до полного выздоровления. Верните крысу в клетку.
3. Пункция хвостовой вены
- Подготовка
- Подготовьте следующее оборудование: пластиковый удерживающий держатель, стерильную марлю, перчатки, спиртовые салфетки, пробирку ЭДТА для сбора микрокапиллярной крови (фиолетовый колпачок) и инсулиновый шприц 28 г 1/2 (30 ЕД или 50 ЕД).
- Выньте крысу из клетки и быстро закрепите ее в пластиковом удерживающем конусе. Закройте большой конец конуса вокруг основания хвоста. Убедитесь, что животное чувствует себя комфортно и что дыхание не ограничено на протяжении всей процедуры.
- Опустите хвост в теплую воду (37 °C) примерно на 1 минуту, чтобы расширить вену. Обсушите хвост бумажным полотенцем. Положите животное (в удерживающее устройство) лицом вниз, хвост положите на грелку.
- Выберите правую или левую хвостовую вену (синяя линия) для отбора проб, поворачивая все животное в любую сторону (это позволяет избежать скручивания хвоста). Используйте терминальную треть хвоста для прокола кровеносных сосудов, так как сосуды в этой зоне становятся более поверхностными. Артерия вентральная, а две вены боковые10.
- Протрите хвост салфетками с 70% этанолом в месте прокола.
- Поместите хвост на край грелки, чтобы создать угол в терминальной трети хвоста. Это выводит вену на поверхность и создает больше места для взятия образца.
- Забор крови
- Несколько раз переместите поршень вперед и назад в шприце, чтобы сгладить вывод. Создайте отрицательное давление в шприце, потянув за поршень, чтобы удалить пару микролитров.
- С помощью недоминантного указательного и среднего пальцев закрепите хвост плашмя на грелке. Поместите средний палец проксимально, а указательный дистально, так, чтобы место прокола было между этими двумя пальцами. Надавите на средний палец больше, чем на указательный, чтобы закрепить хвост, закупоривая сосуд только проксимально и позволяя крови скапливаться. Смотрите рисунки 1 и 3.
- Направляя ушко иглы вверх, наденьте инсулиновый шприц на указательный палец до тех пор, пока он не будет введен в вену (это создает угол 35° между иглой и хвостом). Как только игла попадет в вену, в шприц потечет кровь. В этот момент ослабьте давление на указательный и средний пальцы, чтобы убедиться, что кровоток не заблокирован.
- Медленно вынимайте поршень шприца с постоянной скоростью, чтобы набрать нужный объем.
ПРИМЕЧАНИЕ: Не снимайте поршень слишком быстро; Это приведет к коллапсу вены и остановит кровоток. - Если кровоток уменьшается, слегка поверните иглу в любом направлении.
- Извлеките шприц из хвоста. На месте прокола хвоста образуется капля крови. Аспирация этой крови позволяет собрать еще несколько микролитров крови в случае нестерильной процедуры.
- Если первый прокол не удался, снова введите иглу проксимальнее на вену.
ПРИМЕЧАНИЕ: Вена становится все более глубокой по мере приближения к основанию хвоста. Если в шприце нет кровотока, увеличьте угол между шприцем и хвостом или поверните иглу. - Надавите на место прокола, чтобы остановить кровотечение, и протрите область новой спиртовой салфеткой. Извлеките крысу из пластикового конуса и верните ее в клетку.
- Пункция хвостовой вены под наркозом
- Выполните шаги 2.1.1 и 2.1.2 для индукции и поддержания анестезии.
- Выполните шаги 3.1.3-3.2.7 для забора крови; см. рисунок 1.
- Выполните шаг 2.2.10 для восстановления животных.

Рисунок 1: Схемы различных методов пункции в этом протоколе. (А) Модифицированная пункция хвостовой вены находящемуся в сознании, удерживаемому животному; (B) модифицированная пункция хвостовой вены и пункция вены полового члена под наркозом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Успех определялся как забор крови, дающий не менее 100 мкл крови менее чем за 10 минут (от времени пункции до конца забора крови), а неудача определялась как забор крови, дающий менее 100 мкл крови или занимающий более 10 минут для получения необходимого объема крови. Допускается максимум 250 мкл крови на образец. Статистический анализ проводился с использованием одностороннего теста ANOVA для многократных сравнений и критерия хи-квадрат. Данные были представлены в виде среднего значения ± стандартного отклонения, а p < 0,05 использовался в качестве порога для определения статистической значимости.
Сравнение показателей успеха показало аналогичные результаты для пункции хвостовой вены у крыс в сознании (92%) и пункции вен полового члена под анестезией (83%) (p = 0,0543), как показано на рисунке 4. Интересно, что под наркозом хвостовая вена стала очень ненадежной, и пункция хвостовой вены под наркозом имела только 25% успеха в этом исследовании, вероятно, из-за истончения вены. В случае анестезии пункция вены полового члена была более успешной, чем пункция хвостовой вены для забора проб (p < 0,0001).
Мы сравнили объем собранной крови и продолжительность процедуры между пункцией хвостовой вены и дорсальной вены полового члена, выполненной на крысах под наркозом, и пункцией хвостовой вены, выполненной на крысах, находящихся в сознании. На рисунке 5 показано, что пункция хвостовой вены без анестезии (217,5 мкл ± 69,04 мкл) и вены полового члена под наркозом (185,8 мкл ± 66,4 мкл) дала сопоставимое количество крови (p = 0,4966), и эти объемы крови были значительно выше, чем объем, собранный при пункции хвостовой вены под наркозом (54,4 мкл ± 68,8 мкл) (p < 0,0001).
Продолжительность процедуры была одинаковой в группе пункции вен полового члена под наркозом (315,2 с ± 160 с) и в группе пункции хвостовой вены без анестезии (262,5 с ± 171 с) (p = 0,6632). На рисунке 6 показано, что отбор проб проводился менее чем за 6 мин в обеих группах, тогда как пункция хвостовой вены под наркозом заняла более 8 мин (500,8 с ± 196 с) из-за множественных неудач (p < 0,0382).
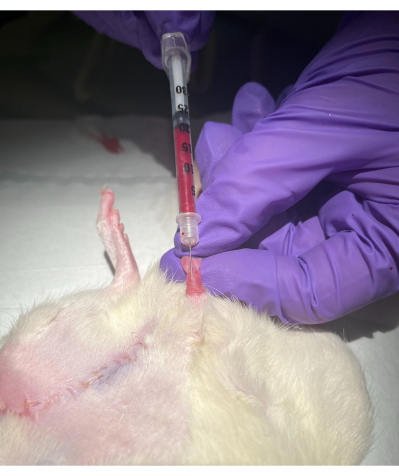
Рисунок 2: Метод пункции дорсальных вен полового члена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Модифицированный метод пункции хвостовой вены. Обратите внимание, что хвост прижат, а место прокола расположено между указательным и средним пальцами. Шприц должен отдыхать и скользить по указательному пальцу, чтобы поддерживать стабильный угол прокола. Использование недоминантной руки позволяет стабилизировать хвост у сознательного животного. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Показатели успешности пункции хвостовой вены под наркозом, пункции вены полового члена под наркозом и пункции хвостовой вены без анестезии. **** p < 0,0001 с помощью критерия хи-квадрат. Сокращения: ТВ = хвостовая жилка; PV = вена полового члена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
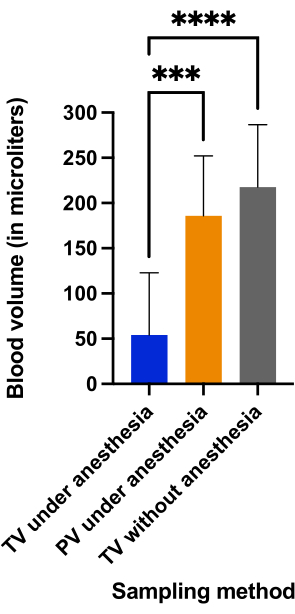
Рисунок 5: Сравнение объемов крови (в мкл), полученных в трех группах. ***p < 0,001; p < 0,0001 с анализом ANOVA для многократных сравнений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
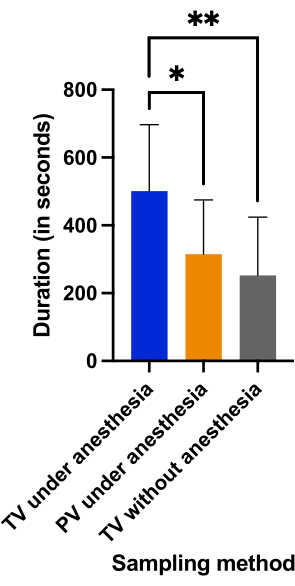
Рисунок 6: Сравнение продолжительности отбора проб (в секундах), определяемой как время от момента пункции до окончания забора крови, в трех группах. Неудача определялась как продолжительность забора крови продолжительностью более 600 с (10 мин). *p < 0,05; **p < 0,01 с анализом ANOVA для многократных сравнений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Пункция хвостовой вены является эффективным методом получения крови у крысы, находящейся в сознании. Однако, когда животное находится под наркозом, действие изофлурана может привести к спазмам сосудов и сделать непригодной пункцию хвостовой вены11. Как показано в этом исследовании, альтернативой в этой ситуации является сбор крови из вены полового члена, что является более успешным и дает значительно больший объем крови за меньшее время. Важно помнить, что в случае неудачи с этим методом с первой попытки, последующие попытки могут оказаться неудачными. Напротив, пункция хвостовой вены позволяет сделать несколько последующих пункций в случае затруднения с первой попытки (есть две вены, и можно попытаться сделать прокол выше на хвосте)1. Однако итерационные пункции могут вызвать гемолиз в образце, что искажает результаты из-за высвобождения гемоглобина и внутренних компонентов мембран эритроцитов. Это особенно верно, если анализируется плазма12. Предпочтительнее избегать множественных проколов и получать образец за один забор крови.
В этой работе отбор проб крови не превышал 250 мкл на образец в соответствии с этим протоколом и руководящими принципами IACUC по соблюдению благополучия животных в случае многократного отбора проб. Достижения в области биоаналитических методов позволили использовать микрообразцы размером менее 50 мкл для оценки биохимии крови и метаболических параметров 13. Таким образом, 250 мкл достаточно, чтобы сделать вывод о том, что оба метода эффективны для будущих исследований. Однако и хвостовая вена, и вена полового члена являются мелкими сосудами и не позволяют собирать большое количество крови. Эти описанные методы подходят для повторного отбора проб и мониторинга живых животных. Если необходимо большое количество крови (например, для процедур в конце исследования), следует рассмотреть другие методы, дающие больше крови, такие как пункция сердца.
Эти описанные процедуры являются двумя из многих; Наш выбор процедуры был мотивирован несколькими преимуществами. Оба эти метода могут быть выполнены одним оператором. Использование указательного и среднего пальцев для стабилизации хвостовой вены в модифицированной технике хвостовой вены делает ненужным дополнительное удержание человека. Тем не менее, необходимо оценить благополучие животного, и всегда рекомендуется помощь профессионала (например, ветеринара или ветеринарного техника), чтобы не подвергать животное ненужной боли или страданиям2.
Кроме того, ранее описанные методы (например, яремная палочка, забор крови из подключичной вены) требуют обширной предварительной подготовки, чтобы избежать причинения вреда или смерти животного. Напротив, пункция хвостовой вены или дорсальной вены полового члена редко приводит к летальному исходу для крысы, даже если она плохо выполнена. В этом исследовании были некоторые неудачи с обоими методами, но никаких других побочных эффектов или смертей не наблюдалось. Сообщалось о некоторых случаях задержки мочи после инъекций дорсального полового члена, но неясно, является ли сама инъекция или введенный агент ответственным за этот результат. Ни этот побочный эффект, ни аномальное заживление или инфекция в месте прокола не были отмечены в течение периода исследования. Кроме того, ежедневная оценка условий содержания животных не выявила боли или дистресса ни в одной группе (не было окрашивания порфирином, не было потери веса, животные были признаны комфортными исследовательской группой и ветеринарными специалистами). Однако длительное сдерживание и множественные проколы могут вызвать у животных страдания. Чтобы этого избежать, иглу следует вращать, когда кровоток замедляется, вместо того, чтобы повторять прокол. Для сокращения времени сдерживания рекомендуется правильно прогревать хвост горячей водой и грелкой для расширения сосудов хвостовой вены, а также практиковать эти методы.
Методы пункции хвостовой вены и дорсальной пункции вен полового члена позволяют быстро взять образец (менее 6 минут) и дают достаточные объемы крови для большинства анализов. Пункция хвостовой вены, сделанная на животном, находящемся в сознании, является эффективным и надежным методом получения крови. Однако у успокоенного животного анестетики, как правило, вызывают спазмы сосудов, и хвостовая вена подвержена значительному истончению11. В этом случае пункция дорсальной вены полового члена обеспечивает более высокий уровень успеха, чем пункция хвостовой вены, которая, как правило, ненадежна для сбора крови. Однако одним из ограничений забора крови из вены полового члена является то, что он может быть выполнен только на крысах-самцах и, следовательно, не подходит для исследований на крысах-самках. Таким образом, в зависимости от контекста (т.е. пола животного, периоперационного или послеоперационного забора крови, животных с тонкими хвостовыми венами) пункция вен полового члена и пункция хвостовой вены могут использоваться поочередно для повторных заборов крови, даже исследователями, практически не имеющими опыта исследований на животных.
Раскрытие информации
Ни у кого из авторов нет конфликтов интересов, о которых можно было бы заявить.
Благодарности
Эта работа финансировалась Shriners Children's Boston (B.E.U., K.U., C.L.C.). L.C. финансируется "La Bourse des Gueules Cassées", "La Bourse Année Recherche" и "La Bourse de l'Amicale des Anciens Internes des Hôpitaux de Paris". Y.B. финансируется "La Bourse des Gueules Cassées". Y.B. и I.F.V.R. финансируются детскими больницами Shriners (идентификатор стипендий: #84308-BOS-22, #84302-BOS-21 соответственно). Этот материал частично основан на работе, поддержанной Национальным научным фондом в рамках гранта No . 1941543 ЕЭС. Мы выражаем благодарность за частичную поддержку со стороны Национальных институтов здравоохранения США (R01EB028782, R56AI171958 и R01DK114506). Рисунок 1 был создан с помощью BioRender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.5 mL | 28 G ½ Insulin Syringes | BD | 329424 | for tail vein puncture |
| 0.5 mL | 30 G x 5/16 Insulin Syringes | BD | 320468 | for penile vein puncture |
| 250 L Microtainer blood collection tubes with K2EDTA | BD | 365974 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | for penile vein puncture |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | for penile vein puncture |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | for penile vein puncture |
| Rodent Restraint Cone | Harvard Apparatus | ST2 52-95-86 | for tail vein puncture |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Ссылки
- Lee, G., Goosens, K. A. Sampling blood from the lateral tail vein of the rat. Journal of Visualized Experiments. (99), e52766(2015).
- Beeton, C., Garcia, A., Chandy, K. G. Drawing blood from rats through the saphenous vein and by cardiac puncture. Journal of Visualized Experiments. (7), 266(2007).
- Luzzi, M., et al. Collecting blood from rodents: A discussion by the Laboratory Animal Refinement and Enrichment Forum. Animal Technology and Welfare. 4 (2), 99-102 (2005).
- Wang, L., et al. Repetitive blood sampling from the subclavian vein of conscious rat. Journal of Visualized Experiments. (180), e63439(2022).
- Van Herck, H., et al. Blood sampling from the retro-orbital plexus, the saphenous vein and the tail vein in rats: Comparative effects on selected behavioural and blood variables. Laboratory Animals. 35 (2), 131-139 (2001).
- Harikrishnan, V. S., Hansen, A. K., Abelson, K. S., Sørensen, D. B. A comparison of various methods of blood sampling in mice and rats: Effects on animal welfare. Laboratory Animals. 52 (3), 253-264 (2018).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animals. 32 (4), 369-376 (1998).
- Nightingale, C. H., Mouravieff, M. Reliable and simple method of intravenous injection into the laboratory rat. Journal of Pharmaceutical Sciences. 62 (5), 860-861 (1973).
- Blood collection: The rat. IACUC Guideline. UCSF Office of Research Institutional Animal Care and Use Program. , Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/guidelines%20-%20Blood%20Collection%20-%20Rat.pdf (2022).
- Staszyk, C., Bohnet, W., Gasse, H., Hackbarth, H. Blood vessels of the rat tail: A histological re-examination with respect to blood vessel puncture methods. Laboratory Animals. 37 (2), 121-125 (2003).
- Constantinides, C., Mean, R., Janssen, B. J. Effects of isoflurane anesthesia on the cardiovascular function of the C57BL/6 mouse. ILAR Journal. 52 (3), e21-e31 (2011).
- Hernaningsih, Y., Akualing, J. S. The effects of hemolysis on plasma prothrombin time and activated partial thromboplastin time tests using photo-optical method. Medicine. 96 (38), 7976(2017).
- Powles-Glover, N., Kirk, S., Jardine, L., Clubb, S., Stewart, J. Assessment of haematological and clinical pathology effects of blood microsampling in suckling and weaned juvenile rats. Regulatory Toxicology and Pharmacology. 69 (3), 425-433 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены