Method Article
Puntura modificata della vena della coda e della vena del pene per il prelievo di sangue nel modello di ratto
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per offrire alternative di raccolta del sangue rapide, facili e affidabili per il modello di ratto. Descriviamo tre diversi metodi di prelievo del sangue in base al contesto: puntura della vena della coda in anestesia o su un animale cosciente e puntura della vena del pene dorsale in anestesia.
Abstract
I campioni di sangue sono richiesti nella maggior parte dei progetti di animali sperimentali per valutare vari parametri ematologici. Questo documento presenta due procedure per la raccolta del sangue nei ratti: la puntura della vena laterale della coda e la puntura della vena del pene dorsale, che offrono vantaggi significativi rispetto ad altre tecniche precedentemente descritte. Questo studio mostra che queste due procedure consentono un campionamento rapido (meno di 10 minuti) e producono volumi di sangue sufficienti per la maggior parte dei test (202 μL ± 67,7 μL). La puntura della vena dorsale del pene deve essere eseguita in anestesia, mentre la puntura della vena laterale della coda può essere eseguita su un animale cosciente e trattenuto.
L'alternanza di queste due tecniche, quindi, consente il prelievo di sangue in qualsiasi situazione. Mentre è sempre consigliabile che un operatore sia assistito durante una procedura per garantire il benessere degli animali, queste tecniche richiedono un solo operatore, a differenza della maggior parte dei metodi di prelievo del sangue che ne richiedono due. Inoltre, mentre questi metodi precedentemente descritti (ad esempio, bastone giugulare, prelievo di sangue della vena succlavia) richiedono un ampio addestramento preliminare per evitare danni o morte dell'animale, la puntura della vena caudale e della vena dorsale del pene sono raramente fatali. Per tutti questi motivi, e a seconda del contesto (ad esempio, per studi che includono ratti maschi, durante il periodo perioperatorio o immediatamente postoperatorio, per animali con sottili vene della coda), entrambe le tecniche possono essere utilizzate alternativamente per consentire ripetuti prelievi di sangue.
Introduzione
Il prelievo di sangue è necessario per la maggior parte degli studi sugli animali, sia in vivo che in vitro. Nei ratti, poiché la frequenza e la quantità di prelievo di sangue possono essere significative, è utile avere diverse alternative per la raccolta. Vari metodi sono stati descritti in studi precedenti.
Le tecniche più comunemente usate sono la puntura della vena caudale e il prelievo di sangue della vena safena. Il campionamento delle vene della coda è adatto a tutti i ceppi di ratto. Con un addestramento adeguato, la procedura è semplice da eseguire e causa un disagio minimo all'animale1. Allo stesso modo, il prelievo di sangue della vena safena, a condizione che sia fatto correttamente, è anche un metodo di raccolta rapido e semplice. Nessuno dei due metodi richiede l'anestesia ed entrambi consentono prelievi ripetuti di piccole quantità di sangue. Tuttavia, la puntura della vena safena di solito produce un volume di sangue inferiore1 e richiede la presenza di due persone per lasciare un arto posteriore esposto per la puntura2.
Se è necessario raccogliere grandi quantità di sangue da un singolo animale, è possibile utilizzare la puntura cardiaca o la puntura della vena cava (fino a 10 ml di sangue possono essere prelevati da un ratto da 150 g con puntura cardiaca2). Queste tecniche richiedono l'anestesia e sono procedure terminali. L'animale deve essere eutanasia dopo una di queste due tecniche2. Il bastone giugulare è un'alternativa che può essere utilizzata se è necessario raccogliere grandi quantità di sangue in uno studio che non ha ancora raggiunto il suo endpoint. Tuttavia, questa tecnica richiede anche notevoli abilità tecniche per evitare danni all'animale; Pertanto, il suo uso dovrebbe essere limitato3.
Altre tecniche, come il prelievo di sangue della vena succlavia, non richiedono l'uso di anestetici prima della raccolta del sangue e consentono il campionamento ripetuto di piccoli volumi di sangue. Tuttavia, per questa tecnica sono necessarie una manipolazione moderata e un'appropriata incisione dell'ago. Un'operazione impropria può causare dolore animale o addirittura mortalità, e l'addestramento per questo metodo può essere meticoloso4.
Altre procedure aneddotiche includono la puntura orbitale e la puntura della vena sublinguale, entrambe le quali richiedono un anestetico, e non sono raccomandate né ampiamente utilizzate. Sebbene studi precedenti abbiano dimostrato una raccolta di sangue più rapida mediante puntura orbitale rispetto alla puntura della vena caudale, è stato riscontrato che la puntura orbitale in anestesia dietil-etere era meno ben tollerata rispetto a quest'ultimo metodo (basato sui punteggi di eccitazione degli animali e sulla produzione di urina)5. Inoltre, questo metodo è fortemente influenzato dall'abilità della persona che esegue la procedura e viene eseguito principalmente da veterinari esperti. Comparabilmente, la puntura venosa sublinguale è meno angosciante ed è raccomandata per il prelievo di sangue ripetuto6. Tuttavia, questa tecnica presenta gravi effetti avversi come una ridotta assunzione di cibo e acqua, che può portare alla morte dell'animale7.
Questo studio descrive due metodi utilizzati nel nostro laboratorio per il prelievo di sangue ripetuto. La puntura della vena della coda può essere eseguita su un animale cosciente e il danno tissutale e gli effetti avversi sono minimi. La modifica di questa tecnica in questo studio include la stabilizzazione della coda con l'indice e il medio, che consente a un singolo operatore di eseguire la raccolta del sangue. La puntura della vena del pene dorsale è già stata descritta per semplici iniezioni endovenose. Questa tecnica viene eseguita in anestesia e consente una fonte di sangue affidabile in caso di difficoltà con altri metodi (ad esempio, durante l'immediato periodo postoperatorio, con un piccolo animale, quando si esegue il prelievo di sangue perioperatorio in anestesia). Analogamente al campionamento delle vene caudali, la lesione nel sito di puntura avrà un effetto complessivo minore sull'animale rispetto alle tecniche sopra menzionate8. Lo scopo di questo documento sui metodi è quello di offrire ai ricercatori inesperti alternative di campionamento del sangue semplici e affidabili in base al contesto (ad esempio, per procedure eseguite in anestesia, per studi che includono ratti maschi, per animali con vene caudali sottili).
Protocollo
Le procedure sono state eseguite su ratti Lewis maschi di 3 mesi, ciascuno del peso di 300-400 g. Sono stati inclusi un totale di 24 animali, con tre condizioni di puntura: 12 ratti sono stati sottoposti a puntura della vena caudale senza anestesia (gruppo TV senza anestesia) e altri 12 ratti sono stati anestetizzati per sottoporsi sia alla puntura della vena caudale (gruppo TV con anestesia) che alla puntura della vena del pene (gruppo PV con anestesia). Tutte le procedure sono state approvate e hanno rispettato le linee guida dell'Institutional Animal Care and Use Committee (IACUC). Tutti gli animali sono stati eutanizzati alla fine dello studio (dopo un follow-up di 1 mese) per overdose di anidride carbonica. Vedere la tabella dei materiali per i dettagli relativi a tutti i materiali e gli strumenti utilizzati in questo protocollo.
1. Orientamenti generali
- In linea con le linee guida IACUC, assicurarsi che il volume massimo di sangue prelevato non sia superiore al 10% del volume totale del sangue ogni 2 settimane9. Ad esempio, un ratto di 300 g dovrebbe avere un volume totale di sangue di circa 19,2 ml. Nel caso di un protocollo che richiede quattro prelievi di sangue nella sola prima settimana (giorno 0, giorno 1, giorno 3, giorno 7), limitare la raccolta a un massimo di 250 μL di sangue per campione.
- Per le procedure eseguite in anestesia, somministrare isoflurano tramite un vaporizzatore di precisione per anestetizzare l'animale. Indurre l'anestesia in una camera con una dose di isoflurano al 3% -5% per 5 minuti e mantenere utilizzando una dose di isoflurano all'1% -3% attraverso un cono nasale durante la procedura. Regolare il livello di isoflurano in base al monitoraggio continuo della frequenza respiratoria. Verificare se la sedazione è sufficiente con il pizzico del dito prima di iniziare la procedura.
- Non lasciare l'animale incustodito durante la procedura o fino a quando non ha riacquistato sufficiente coscienza per mantenere la reclinazione sternale.
- Dopo la raccolta del sangue, monitorare l'animale fino al completo recupero prima di riportarlo nella sua gabbia e non introdurlo in compagnia di altri animali fino a quando non si è completamente ristabilito.
NOTA: In accordo con i servizi veterinari, non era necessario alcun farmaco antidolorifico post-procedura dopo la puntura della vena della coda o della vena del pene.
2. Prelievo di sangue dalla vena del pene
- Preparazione
- Preparare la seguente attrezzatura: garza sterile, guanti, salviette imbevute di alcool, un tubo EDTA per la raccolta di sangue microcapillare (cappuccio viola) e una siringa da insulina da 30 G (30 U o 50 U).
- Estrarre il topo dalla sua gabbia e metterlo in una camera per l'induzione con isoflurano tramite un vaporizzatore di precisione (dose: 3% -5%). Una volta che l'animale è sedato, trasferirlo sul tavolo della procedura e appoggiare l'animale sulla schiena con il naso posizionato nel cono del naso per mantenere l'anestesia. Monitorare la frequenza respiratoria e regolare di conseguenza il livello di isoflurano (dose di mantenimento: 1% -3%). Verificare che l'animale sia sufficientemente sedato dalla punta del piede prima di iniziare la procedura.
- Prelievo di sangue
- Spostare lo stantuffo avanti e indietro nella siringa più volte per attenuare il prelievo. Creare una pressione negativa nella siringa tirando lo stantuffo per rimuovere un paio di microlitri.
- Con l'aiuto della mano non dominante, ritrarre il prepuzio dalla fine del pene e tenere il glande tra l'indice e il pollice, tirando delicatamente. La vena dorsale del pene apparirà come un cordone blu superficiale. Vedere la Figura 1 e la Figura 2.
- Con la cruna dell'ago rivolta verso l'alto, inserire la siringa da insulina nella vena con un angolo di 35°. Una volta che l'ago è entrato nella vena, il sangue fluirà nella siringa.
- Estrarre lentamente lo stantuffo della siringa a una velocità lenta e costante per raccogliere il volume desiderato.
NOTA: Non estrarre lo stantuffo troppo velocemente, poiché ciò causerebbe il collasso della vena e interromperebbe il flusso sanguigno. - Se il flusso sanguigno diminuisce, ruotare leggermente l'ago in senso orario o antiorario.
- Rimuovere la siringa. Una goccia di sangue si formerà sul sito di puntura, la cui aspirazione consentirà la raccolta di qualche microlitro in più di sangue nel caso di una procedura non sterile.
- Se la prima puntura fallisce, reinserire l'ago più prossimalmente sulla vena.
NOTA: A differenza del campionamento delle vene della coda, la puntura iterativa della vena dorsale del pene di solito non ha successo. - Applicare una leggera pressione sul sito di puntura per fermare l'emorragia e pulire l'area con una nuova salvietta imbevuta di alcool.
- Rimetti il pene nella sua posizione neutra.
- Spegnere l'isoflurano e monitorare il ratto fino al completo recupero. Riporta il topo nella sua gabbia.
3. Puntura della vena della coda
- Preparazione
- Preparare la seguente attrezzatura: un supporto di contenimento in plastica, una garza sterile, guanti, salviette imbevute di alcool, un tubo EDTA per la raccolta del sangue microcapillare (cappuccio viola) e una siringa da insulina da 28 G 1/2 (30 U o 50 U).
- Porta il topo fuori dalla sua gabbia e fissalo rapidamente in un cono di contenimento di plastica. Chiudere la grande estremità del cono attorno alla base della coda. Assicurarsi che l'animale sia a suo agio e che la respirazione sia illimitata durante l'intera procedura.
- Immergere la coda in acqua tiepida (37 °C) per circa 1 minuto per dilatare la vena. Asciugare la coda con un tovagliolo di carta. Posizionare l'animale (nel suo contenitore) a faccia in giù, con la coda sdraiata su una piastra elettrica.
- Selezionare la vena caudale destra o sinistra (linea blu) per il campionamento ruotando l'intero animale su entrambi i lati (questo evita la torsione della coda). Utilizzare il terzo terminale della coda per la perforazione dei vasi sanguigni poiché i vasi diventano più superficiali in questa zona. L'arteria è ventrale e le due vene sono laterali10.
- Pulire la coda con salviette etanolo al 70% nel sito di puntura.
- Posizionare la coda sul bordo della piastra riscaldante per creare un angolo nel terzo terminale della coda. Questo porta la vena in superficie e crea più spazio per prelevare il campione.
- Prelievo di sangue
- Spostare lo stantuffo avanti e indietro nella siringa più volte per attenuare il prelievo. Creare una pressione negativa nella siringa tirando lo stantuffo per rimuovere un paio di microlitri.
- Con l'aiuto dell'indice e del dito medio non dominanti, fissare la coda piatta sul termoforo. Posizionare il dito medio prossimalmente e l'indice distale, con il sito di puntura tra queste due dita. Applicare più pressione sul dito medio che sull'indice per fissare la coda, occludendo il vaso solo prossimalmente e permettendo al sangue di accumularsi. Vedere la Figura 1 e la Figura 3.
- Con la cruna dell'ago rivolta verso l'alto, far scorrere la siringa da insulina contro l'indice fino a inserirla nella vena (questo crea un angolo di 35° tra l'ago e la coda). Una volta che l'ago è entrato nella vena, il sangue fluirà nella siringa. A questo punto, rilasciare la pressione sull'indice e sul medio per assicurarsi che il flusso sanguigno non sia occluso.
- Prelevare lentamente lo stantuffo della siringa a una velocità costante per raccogliere il volume desiderato.
NOTA: non estrarre lo stantuffo troppo velocemente; Ciò causerà il collasso della vena e fermerà il flusso sanguigno. - Se il flusso sanguigno diminuisce, ruotare leggermente l'ago in entrambe le direzioni.
- Rimuovere la siringa dalla coda. Una goccia di sangue si formerà sul sito di puntura della coda. L'aspirazione di questo sangue consente la raccolta di qualche microlitro in più di sangue nel caso di una procedura non sterile.
- Se la prima puntura fallisce, reinserire l'ago più prossimalmente sulla vena.
NOTA: La vena diventa progressivamente più profonda man mano che si avvicina alla base della coda. Se non c'è flusso sanguigno nella siringa, aumentare l'angolo tra la siringa e la coda, o ruotare l'ago. - Applicare pressione sul sito di puntura per fermare l'emorragia e pulire l'area con una nuova salvietta imbevuta di alcool. Rimuovere il topo dal cono di plastica e riportarlo nella sua gabbia.
- Puntura della vena della coda in anestesia
- Eseguire il passaggio 2.1.1 e il passaggio 2.1.2 per indurre e mantenere l'anestesia.
- Eseguire i passaggi 3.1.3-3.2.7 per la raccolta del sangue; vedere la Figura 1.
- Eseguire il passaggio 2.2.10 per il recupero degli animali.

Figura 1: Schemi dei diversi metodi di puntura in questo protocollo. (A) Puntura modificata della vena della coda su un animale cosciente e trattenuto; (B) puntura modificata della vena della coda e puntura della vena del pene sotto anestesia. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
Il successo è stato definito come un prelievo di sangue che produce almeno 100 μL di sangue in meno di 10 minuti (dal tempo di puntura alla fine della raccolta del sangue), e il fallimento è stato definito come un prelievo di sangue che produce meno di 100 μL di sangue o impiega più di 10 minuti per recuperare il volume di sangue richiesto. Era consentito un massimo di 250 μL di sangue per campione. Le analisi statistiche sono state condotte utilizzando un test ANOVA unidirezionale per confronti multipli e il test del chi quadrato. I dati sono stati presentati come valore medio ± deviazione standard e p < 0,05 è stato utilizzato come limite per determinare la significatività statistica.
Il confronto delle percentuali di successo ha mostrato risultati simili per la puntura della vena della coda nei ratti coscienti (92%) e la puntura della vena del pene in anestesia (83%) (p = 0,0543), come mostrato nella Figura 4. È interessante notare che, sotto anestesia, la vena della coda è diventata molto inaffidabile e la puntura della vena della coda in anestesia ha avuto solo un tasso di successo del 25% in questo studio, probabilmente a causa dell'assottigliamento della vena. Nel caso dell'anestesia, la puntura della vena del pene ha avuto più successo della puntura della vena della coda per il campionamento (p < 0,0001).
Abbiamo confrontato i volumi di sangue raccolti e la durata della procedura tra la vena della coda e la puntura della vena dorsale del pene eseguita su ratti in anestesia e la puntura della vena della coda eseguita su ratti coscienti. La figura 5 mostra che la puntura della vena caudale senza anestesia (217,5 μL ± 69,04 μL) e la vena del pene in anestesia (185,8 μL ± 66,4 μL) hanno prodotto quantità comparabili di sangue (p = 0,4966) e questi volumi di sangue erano significativamente superiori al volume raccolto con la puntura della vena caudale in anestesia (54,4 μL ± 68,8 μL) (p < 0,0001).
La durata della procedura è stata simile nel gruppo di puntura della vena del pene sotto anestesia (315,2 s ± 160 s) e nel gruppo di puntura della vena della coda senza anestesia (262,5 s ± 171 s) (p = 0,6632). La figura 6 mostra che il campionamento è stato eseguito in meno di 6 minuti in entrambi i gruppi, mentre la puntura della vena caudale in anestesia ha richiesto più di 8 minuti (500,8 s ± 196 s) a causa di guasti multipli (p < 0,0382).
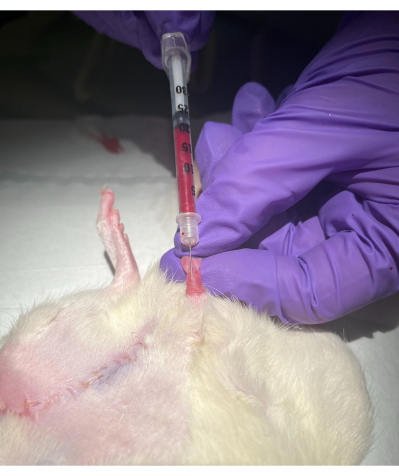
Figura 2: Metodo di puntura della vena del pene dorsale. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Metodo di puntura delle vene caudali modificato. Si noti che la coda è tenuta bassa e il sito di puntura si trova tra l'indice e il medio. La siringa deve appoggiarsi e scivolare contro il dito indice per mantenere un angolo di puntura stabile. L'uso della mano non dominante consente la stabilizzazione della coda su un animale cosciente. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: Percentuali di successo con puntura della vena caudale in anestesia, puntura della vena del pene in anestesia e puntura della vena della coda senza anestesia. P < 0,0001 con il test del chi quadrato. Abbreviazioni: TV = vena della coda; PV = vena del pene. Fare clic qui per visualizzare una versione ingrandita di questa figura.
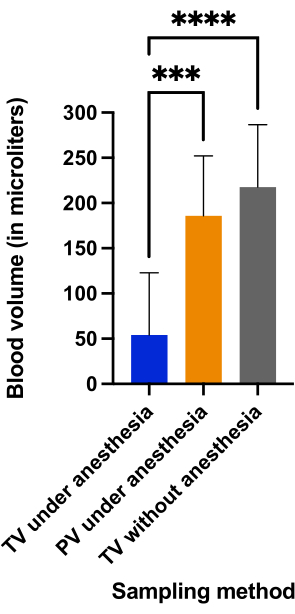
Figura 5: Confronto dei volumi ematici (in μL) ottenuti nei tre gruppi. < 0,001; p < 0,0001 con analisi ANOVA per confronti multipli. Fare clic qui per visualizzare una versione ingrandita di questa figura.
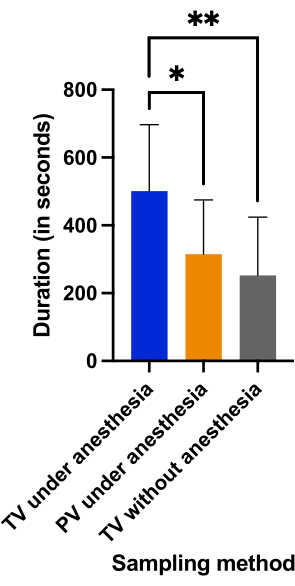
Figura 6: Confronto della durata del campionamento (in secondi), definita come il tempo dal momento della puntura alla fine del prelievo di sangue, nei tre gruppi. Il fallimento è stato definito come una durata del prelievo di sangue che dura più di 600 s (10 min). *p < 0,05; **p < 0.01 con analisi ANOVA per confronti multipli. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
La puntura della vena della coda è un metodo efficace per ottenere sangue da un ratto cosciente. Tuttavia, quando un animale è sotto anestesia, l'effetto dell'isoflurano può portare a spasmi vascolari e rendere inadatta la puntura della vena della coda11. Come dimostrato in questo studio, un'alternativa in questa situazione è quella di raccogliere il sangue dalla vena del pene, che ha più successo e produce un volume significativamente maggiore di sangue in meno tempo. È importante ricordare che in caso di errore con questo metodo al primo tentativo, i tentativi successivi potrebbero non avere successo. Al contrario, la puntura della vena della coda consente diverse forature successive in caso di difficoltà al primo tentativo (ci sono due vene e si può tentare di forare più in alto sulla coda)1. Tuttavia, le punture iterative possono causare emolisi nel campione, che distorce i risultati a causa del rilascio di emoglobina e dei componenti interni delle membrane eritrocitarie. Ciò è particolarmente vero se il plasma viene analizzato12. È preferibile evitare più punture e ottenere il campione in un singolo prelievo di sangue.
In questo lavoro, il prelievo di sangue non ha superato i 250 μL per campione in conformità con questo protocollo e le linee guida IACUC per rispettare il benessere degli animali in caso di campionamento multiplo. I progressi nelle tecniche bioanalitiche hanno permesso l'uso di microcampioni inferiori a 50 μL per valutare la biochimica del sangue e i parametri metabolici 13. Pertanto, 250 μL sono sufficienti per concludere che entrambi i metodi sono efficienti per studi futuri. Tuttavia, sia la vena della coda che la vena del pene sono piccoli vasi e non consentono la raccolta di grandi quantità di sangue. Questi metodi descritti sono appropriati per il campionamento ripetuto e il monitoraggio di animali vivi. Se sono necessarie grandi quantità di sangue (ad esempio, per le procedure di fine studio), devono essere presi in considerazione altri metodi che producono più sangue, come la puntura cardiaca.
Queste procedure descritte sono due tra le tante; La nostra scelta della procedura è stata motivata da alcuni vantaggi. Entrambe queste tecniche possono essere eseguite da un singolo operatore. L'uso dell'indice e del medio per stabilizzare la vena caudale nella tecnica della vena caudale modificata rende superfluo il contenimento umano complementare. Tuttavia, è necessario valutare il benessere dell'animale e si raccomanda sempre l'assistenza di un professionista (ad esempio, un veterinario o un tecnico veterinario) per evitare di sottoporre l'animale a dolore o angoscia inutili2.
Inoltre, i metodi precedentemente descritti (ad esempio, bastone giugulare, prelievo di sangue della vena succlavia) richiedono un ampio addestramento preliminare per evitare danni o morte dell'animale. Al contrario, la vena della coda o la puntura della vena dorsale del pene sono raramente fatali per il ratto, anche se non ben eseguite. Questo studio ha avuto alcuni fallimenti con entrambi i metodi, ma non sono stati osservati altri effetti avversi o decessi. Sono stati riportati alcuni casi di ritenzione urinaria dopo iniezioni del pene dorsale, ma non è chiaro se l'iniezione stessa o l'agente iniettato sia responsabile di questo risultato. Né questo effetto avverso né la guarigione anormale o l'infezione nel sito di puntura sono stati notati durante il periodo di studio. Inoltre, le valutazioni giornaliere delle condizioni degli animali non hanno rivelato dolore o angoscia in nessun gruppo (nessuna colorazione di porfirina, nessuna perdita di peso, animali giudicati a proprio agio dal team di ricerca e dai professionisti veterinari). Tuttavia, la contenzione prolungata e le forature multiple possono causare angoscia agli animali. Per evitare ciò, l'ago deve essere ruotato quando il flusso sanguigno rallenta invece di ripetere la puntura. Si consiglia di riscaldare correttamente la coda con acqua calda e una piastra riscaldante per vasodilatare la vena caudale, oltre a praticare questi metodi, per ridurre il tempo di contenimento.
I metodi di puntura della vena caudale e puntura della vena dorsale del pene consentono un campionamento rapido (meno di 6 minuti) e producono volumi di sangue sufficienti per la maggior parte dei test. Se eseguita su un animale cosciente, la puntura della vena caudale è un metodo efficiente e affidabile per ottenere sangue. Tuttavia, su un animale sedato, gli agenti anestetici tendono a causare spasmi vascolari e la vena della coda è soggetta a un importante assottigliamento11. In questo scenario, la puntura della vena dorsale del pene fornisce un tasso di successo migliore rispetto alla puntura della vena della coda, che tende ad essere inaffidabile per la raccolta del sangue. Tuttavia, una limitazione del prelievo di sangue della vena del pene è che può essere eseguito solo su ratti maschi ed è, quindi, inadatto per gli studi sui ratti femminili. Pertanto, a seconda del contesto (cioè il sesso dell'animale, il prelievo di sangue perioperatorio o post-operatorio, gli animali con sottili vene della coda), sia la puntura della vena del pene che la puntura della vena della coda possono essere utilizzate alternativamente per ripetuti prelievi di sangue, anche da ricercatori con poca o nessuna esperienza con gli studi sugli animali.
Divulgazioni
Nessuno degli autori ha conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato finanziato da Shriners Children's Boston (B. E. U., K.U., C.L.C.). L.C. è finanziato da "La Bourse des Gueules Cassées", "La Bourse Année Recherche" e "La Bourse de l'Amicale des Anciens Internes des Hôpitaux de Paris". Y.B. è finanziato da "La Bourse des Gueules Cassées". Y.B. e I.F.v.R. sono finanziati dagli Shriners Hospitals for Children (l'ID delle borse di studio è rispettivamente #84308-BOS-22 #84302-BOS-21). Questo materiale è parzialmente basato sul lavoro sostenuto dalla National Science Foundation sotto Grant No. CEE 1941543. Il sostegno parziale del National Institutes of Health degli Stati Uniti (R01EB028782, R56AI171958 e R01DK114506) è riconosciuto con gratitudine. La Figura 1 è stata creata con BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.5 mL | 28 G ½ Insulin Syringes | BD | 329424 | for tail vein puncture |
| 0.5 mL | 30 G x 5/16 Insulin Syringes | BD | 320468 | for penile vein puncture |
| 250 L Microtainer blood collection tubes with K2EDTA | BD | 365974 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | for penile vein puncture |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | for penile vein puncture |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | for penile vein puncture |
| Rodent Restraint Cone | Harvard Apparatus | ST2 52-95-86 | for tail vein puncture |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Riferimenti
- Lee, G., Goosens, K. A. Sampling blood from the lateral tail vein of the rat. Journal of Visualized Experiments. (99), e52766 (2015).
- Beeton, C., Garcia, A., Chandy, K. G. Drawing blood from rats through the saphenous vein and by cardiac puncture. Journal of Visualized Experiments. (7), 266 (2007).
- Luzzi, M., et al. Collecting blood from rodents: A discussion by the Laboratory Animal Refinement and Enrichment Forum. Animal Technology and Welfare. 4 (2), 99-102 (2005).
- Wang, L., et al. Repetitive blood sampling from the subclavian vein of conscious rat. Journal of Visualized Experiments. (180), e63439 (2022).
- Van Herck, H., et al. Blood sampling from the retro-orbital plexus, the saphenous vein and the tail vein in rats: Comparative effects on selected behavioural and blood variables. Laboratory Animals. 35 (2), 131-139 (2001).
- Harikrishnan, V. S., Hansen, A. K., Abelson, K. S., Sørensen, D. B. A comparison of various methods of blood sampling in mice and rats: Effects on animal welfare. Laboratory Animals. 52 (3), 253-264 (2018).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animals. 32 (4), 369-376 (1998).
- Nightingale, C. H., Mouravieff, M. Reliable and simple method of intravenous injection into the laboratory rat. Journal of Pharmaceutical Sciences. 62 (5), 860-861 (1973).
- Blood collection: The rat. IACUC Guideline. UCSF Office of Research Institutional Animal Care and Use Program Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/guidelines%20-%20Blood%20Collection%20-%20Rat.pdf (2022)
- Staszyk, C., Bohnet, W., Gasse, H., Hackbarth, H. Blood vessels of the rat tail: A histological re-examination with respect to blood vessel puncture methods. Laboratory Animals. 37 (2), 121-125 (2003).
- Constantinides, C., Mean, R., Janssen, B. J. Effects of isoflurane anesthesia on the cardiovascular function of the C57BL/6 mouse. ILAR Journal. 52 (3), e21-e31 (2011).
- Hernaningsih, Y., Akualing, J. S. The effects of hemolysis on plasma prothrombin time and activated partial thromboplastin time tests using photo-optical method. Medicine. 96 (38), 7976 (2017).
- Powles-Glover, N., Kirk, S., Jardine, L., Clubb, S., Stewart, J. Assessment of haematological and clinical pathology effects of blood microsampling in suckling and weaned juvenile rats. Regulatory Toxicology and Pharmacology. 69 (3), 425-433 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon