Method Article
Veia Caudal e Punção Peniana Modificadas para Coleta de Sangue no Modelo de Rato
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para oferecer alternativas rápidas, fáceis e confiáveis de coleta de sangue para o modelo de rato. Descrevemos três diferentes métodos de coleta de sangue de acordo com o contexto: punção da veia caudal sob anestesia ou em um animal consciente e punção da veia peniana dorsal sob anestesia.
Resumo
Amostras de sangue são necessárias na maioria dos desenhos experimentais em animais para avaliar vários parâmetros hematológicos. Este trabalho apresenta dois procedimentos para coleta de sangue em ratos: a punção lateral da veia caudal e a punção da veia peniana dorsal, que oferecem vantagens significativas em relação a outras técnicas descritas anteriormente. Este estudo mostra que esses dois procedimentos permitem uma amostragem rápida (menos de 10 min) e produzem volumes sanguíneos suficientes para a maioria dos ensaios (202 μL ± 67,7 μL). A punção da veia peniana dorsal deve ser feita sob anestesia, enquanto a punção lateral da veia caudal pode ser feita em um animal consciente e contido.
A alternância dessas duas técnicas, portanto, possibilita a coleta de sangue em qualquer situação. Embora seja sempre recomendado que um operador seja assistido durante um procedimento para garantir o bem-estar animal, essas técnicas exigem apenas um único operador, ao contrário da maioria dos métodos de coleta de sangue que exigem dois. Além disso, enquanto esses métodos descritos anteriormente (por exemplo, bastão jugular, coleta de sangue da veia subclávia) requerem treinamento prévio extensivo para evitar danos ou morte do animal, a punção da veia caudal e da veia peniana dorsal raramente é fatal. Por todas essas razões, e de acordo com o contexto (por exemplo, para estudos incluindo ratos machos, durante o período perioperatório ou pós-operatório imediato, para animais com veias caudais finas), ambas as técnicas podem ser usadas alternadamente para permitir repetidas coletas de sangue.
Introdução
A coleta de sangue é necessária para a maioria dos estudos em animais, tanto in vivo quanto in vitro. Em ratos, como a frequência e a quantidade de coleta de sangue podem ser significativas, é útil ter diferentes alternativas para coleta. Vários métodos foram descritos em estudos anteriores.
As técnicas mais utilizadas são a punção da veia caudal e a coleta de sangue da veia safena. A amostragem da veia da cauda é adequada para todas as estirpes de ratos. Com o treinamento adequado, o procedimento é simples de ser realizado e causa o mínimo de sofrimento ao animal1. Da mesma forma, a coleta de sangue da veia safena, desde que realizada corretamente, também é um método de coleta rápido e simples. Nenhum dos métodos requer anestesia, e ambos permitem coletas repetidas de pequenas quantidades de sangue. No entanto, a punção da veia safena geralmente produz um volume sanguíneo menor1 e requer a presença de duas pessoas para deixar um membro posterior exposto para a punção2.
Se grandes quantidades de sangue precisarem ser coletadas de um único animal, a punção cardíaca ou punção da veia cava pode ser usada (até 10 mL de sangue podem ser retirados de um rato de 150 g com punção cardíaca2). Essas técnicas requerem anestesia e são procedimentos terminais. O animal deve ser sacrificado após qualquer uma dessas duas técnicas2. A haste jugular é uma alternativa que pode ser utilizada caso seja necessário coletar grandes quantidades de sangue em um estudo que ainda não atingiu seu desfecho. No entanto, essa técnica também requer habilidades técnicas significativas para evitar danos ao animal; portanto, seu uso deve ser limitado3.
Outras técnicas, como a coleta de sangue da veia subclávia, dispensam o uso de anestésicos antes da coleta de sangue e permitem a coleta repetida de pequenos volumes de sangue. No entanto, o manuseio restrito e a incisão adequada da agulha são necessários para essa técnica. Uma operação inadequada pode resultar em dor no animal ou mesmo em mortalidade, e o treinamento para esse método pode ser exigente4.
Outros procedimentos anedóticos incluem a punção orbitária e a punção da veia sublingual, que requerem um anestésico, e não são recomendados nem amplamente utilizados. Embora estudos anteriores tenham mostrado coleta de sangue mais rápida por punção orbitária do que por punção da veia caudal, verificou-se que a punção orbitária sob anestesia com éter dietílico foi menos bem tolerada do que este último método (baseado nos escores de excitação dos animais e na produção de urina)5. Além disso, este método é altamente influenciado pela habilidade da pessoa que realiza o procedimento e é realizado principalmente por veterinários experientes. Comparativamente, a punção da veia sublingual é menos angustiante e é recomendada para repetidas coletas de sangue6. No entanto, essa técnica apresenta efeitos adversos graves, como redução da ingestão de alimentos e água, o que pode levar o animal à morte7.
Este estudo descreve dois métodos utilizados em nosso laboratório para repetidas coletas de sangue. A punção da veia caudal pode ser realizada em um animal consciente, e os danos teciduais e efeitos adversos são mínimos. A modificação dessa técnica neste estudo inclui a estabilização da cauda com o dedo indicador e médio, o que permite que um único operador realize a coleta de sangue. A punção da veia peniana dorsal já foi descrita para injeções intravenosas simples. Essa técnica é realizada sob anestesia e permite uma fonte de sangue confiável em caso de dificuldades com outros métodos (por exemplo, durante o período pós-operatório imediato, com um pequeno animal, ao realizar a coleta de sangue perioperatória sob anestesia). Semelhante à amostragem da veia caudal, a lesão no local da punção terá um efeito global menor sobre o animal em comparação com as técnicas mencionadasacima8. O objetivo deste artigo de métodos é oferecer aos pesquisadores inexperientes alternativas simples e confiáveis de coleta de sangue de acordo com o contexto (por exemplo, para procedimentos feitos sob anestesia, para estudos incluindo ratos machos, para animais com veias finas da cauda).
Protocolo
Os procedimentos foram realizados em ratos Lewis machos com 3 meses de idade, cada um pesando de 300-400 g. Foram incluídos 24 animais, com três condições de punção: 12 ratos foram submetidos à punção da veia caudal sem anestesia (grupo TV sem anestesia) e outros 12 ratos foram anestesiados para serem submetidos à punção da veia caudal (grupo TV com anestesia) e punção da veia peniana (grupo VP com anestesia). Todos os procedimentos foram aprovados e respeitaram as diretrizes da Comissão Institucional de Cuidados e Uso de Animais (IACUC). Todos os animais foram eutanasiados ao final do estudo (após 1 mês de seguimento) por overdose de dióxido de carbono. Consulte a Tabela de Materiais para obter detalhes relacionados a todos os materiais e instrumentos utilizados neste protocolo.
1. Orientações gerais
- De acordo com as diretrizes da IACUC, garantir que o volume máximo de sangue coletado não seja superior a 10% do volume sanguíneo total a cada 2 semanas9. Por exemplo, um rato de 300 g deve ter um volume sanguíneo total de aproximadamente 19,2 mL. No caso de um protocolo que exija quatro coletas de sangue apenas na primeira semana (dia 0, dia 1, dia 3, dia 7), limitar a coleta a um máximo de 250 μL de sangue por amostra.
- Para procedimentos realizados sob anestesia, administrar isoflurano através de vaporizador de precisão para anestesiar o animal. Induzir anestesia em câmara com dose de isoflurano a 3%-5% por 5 min e manter com dose de isoflurano a 1%-3% através de cone nasal durante o procedimento. Ajustar o nível de isoflurano com base na monitorização contínua da frequência respiratória. Verifique se a sedação é suficiente por pinça dos dedos dos pés antes de iniciar o procedimento.
- Não deixe o animal sozinho durante o procedimento ou até que ele tenha recuperado a consciência suficiente para manter a decúbito esternal.
- Após a coleta de sangue, monitorar o animal até a recuperação total antes de devolvê-lo à sua gaiola, e não apresentá-lo à companhia de outros animais até que esteja totalmente recuperado.
OBS: De acordo com os serviços veterinários, nenhuma medicação para dor pós-procedimento foi necessária após punção da veia caudal ou peniana.
2. Coleta de sangue da veia peniana
- Preparação
- Preparar os seguintes equipamentos: gaze estéril, luvas, toalhetes com álcool, tubo de coleta de sangue microcapilar EDTA (tampa roxa) e seringa de insulina 30 G (30 U ou 50 U).
- Retirar o rato de sua gaiola e colocá-lo em uma câmara para indução com isoflurano através de um vaporizador de precisão (dose: 3%-5%). Uma vez que o animal esteja sedado, transfira-o para a mesa de procedimentos e deite-o de costas com o nariz colocado no cone nasal para manter a anestesia. Monitorar a frequência respiratória e ajustar o nível de isoflurano de acordo (dose de manutenção: 1%-3%). Verifique se o animal está suficientemente sedado por pinça dos dedos dos pés antes de iniciar o procedimento.
- Coleta de sangue
- Mova o êmbolo para frente e para trás na seringa várias vezes para suavizar a retirada. Crie pressão negativa na seringa puxando o êmbolo para remover alguns microlitros.
- Com a ajuda da mão não dominante, retraia o prepúcio da extremidade do pênis e segure a glande entre o indicador e o polegar, puxando suavemente. A veia peniana dorsal aparecerá como um cordão azul superficial. Veja a Figura 1 e a Figura 2.
- Com o olho da agulha apontado para cima, insira a seringa de insulina na veia em um ângulo de 35°. Uma vez que a agulha tenha entrado na veia, o sangue fluirá para a seringa.
- Retire lentamente o êmbolo da seringa a um ritmo lento e constante para recolher o volume desejado.
NOTA: Não retire o êmbolo muito rápido, pois isso fará com que a veia entre em colapso e interrompa o fluxo sanguíneo. - Se o fluxo sanguíneo diminuir, gire a agulha ligeiramente no sentido horário ou anti-horário.
- Retire a seringa. Uma gota de sangue se formará no local da punção, cuja aspiração permitirá a coleta de mais alguns microlitros de sangue no caso de um procedimento não estéril.
- Se a primeira punção falhar, reinsira a agulha mais proximalmente na veia.
NOTA: Ao contrário da amostragem da veia caudal, a punção iterativa da veia peniana dorsal geralmente não é bem-sucedida. - Aplique uma leve pressão no local da punção para parar o sangramento e limpe a área com um novo lenço com álcool.
- Coloque o pênis de volta em sua posição neutra.
- Desligue o isoflurano e monitorize o rato até à recuperação completa. Devolva o rato à sua gaiola.
3. Punção da veia caudal
- Preparação
- Preparar os seguintes equipamentos: suporte plástico de contenção, gaze estéril, luvas, lenços umedecidos com álcool, tubo de coleta de sangue microcapilar EDTA (tampa roxa) e seringa de insulina 28 G 1/2 (30 U ou 50 U).
- Retire o rato de sua gaiola e prenda-o rapidamente em um cone de contenção de plástico. Feche a extremidade grande do cone em torno da base da cauda. Certifique-se de que o animal esteja confortável e que a respiração seja irrestrita durante todo o procedimento.
- Mergulhe a cauda em água morna (37 °C) por cerca de 1 min para dilatar a veia. Seque o rabo com um papel toalha. Coloque o animal (em seu contenção) de bruços, com a cauda deitada sobre uma almofada de aquecimento.
- Selecione a veia da cauda direita ou esquerda (linha azul) para amostragem girando todo o animal para ambos os lados (isso evita a torção da cauda). Use o terço terminal da cauda para punção dos vasos sanguíneos, uma vez que os vasos se tornam mais superficiais nesta zona. A artéria é ventral e as duas veiaslaterais10.
- Limpe a cauda com lenços umedecidos com etanol 70% no local da punção.
- Coloque a cauda na borda da almofada de aquecimento para criar um ângulo no terço terminal da cauda. Isso traz a veia para a superfície e cria mais espaço para a coleta da amostra.
- Coleta de sangue
- Mova o êmbolo para frente e para trás na seringa várias vezes para suavizar a retirada. Crie pressão negativa na seringa puxando o êmbolo para remover alguns microlitros.
- Com a ajuda do dedo indicador e médio não dominante, prenda a cauda na almofada de aquecimento. Posicionar o dedo médio proximalmente e o indicador distalmente, com o local de punção entre esses dois dedos. Aplique mais pressão no dedo médio do que no indicador para fixar a cauda, ocluindo o vaso apenas proximalmente e permitindo que o sangue se acumule. Veja a Figura 1 e a Figura 3.
- Com o olho da agulha apontado para cima, deslize a seringa de insulina contra o dedo indicador até que ela seja inserida na veia (isso cria um ângulo de 35° entre a agulha e a cauda). Uma vez que a agulha tenha entrado na veia, o sangue fluirá para a seringa. Neste ponto, libere a pressão no dedo indicador e médio para garantir que o fluxo sanguíneo não seja ocluído.
- Retire lentamente o êmbolo da seringa a uma taxa constante para recolher o volume desejado.
NOTA: Não retire o êmbolo muito rápido; Isso fará com que a veia entre em colapso e interrompa o fluxo sanguíneo. - Se o fluxo sanguíneo diminuir, gire a agulha ligeiramente em qualquer direção.
- Retire a seringa da cauda. Uma gota de sangue se formará no local da punção da cauda. A aspiração desse sangue permite a coleta de mais alguns microlitros de sangue no caso de um procedimento não estéril.
- Se a primeira punção falhar, reinsira a agulha mais proximalmente na veia.
NOTA: A veia torna-se progressivamente mais profunda à medida que se aproxima da base da cauda. Se não houver fluxo sanguíneo na seringa, aumente o ângulo entre a seringa e a cauda ou gire a agulha. - Aplique pressão no local da punção para parar o sangramento e limpe a área com um novo lenço com álcool. Retire o rato do cone de plástico e devolva-o à sua gaiola.
- Punção da veia caudal sob anestesia
- Realizar as etapas 2.1.1 e 2.1.2 para indução e manutenção da anestesia.
- Executar as etapas 3.1.3-3.2.7 para coleta de sangue; veja a Figura 1.
- Execute a etapa 2.2.10 para recuperação de animais.

Figura 1: Esquema dos diferentes métodos de punção neste protocolo. (A) Punção modificada da veia caudal em animal consciente e contido; (B) punção modificada da veia caudal e punção da veia peniana sob anestesia. Clique aqui para ver uma versão maior desta figura.
Resultados
O sucesso foi definido como uma coleta de sangue que produziu pelo menos 100 μL de sangue em menos de 10 min (desde o momento da punção até o final da coleta de sangue), e falha foi definida como uma coleta de sangue que produziu menos de 100 μL de sangue ou levou mais de 10 min para recuperar o volume de sangue necessário. Foi permitido um máximo de 250 μL de sangue por amostra. As análises estatísticas foram realizadas utilizando-se o teste ANOVA one-way para comparações múltiplas e o teste qui-quadrado. Os dados foram apresentados como média ± desvio padrão, e p < 0,05 foi utilizado como ponto de corte para determinar a significância estatística.
A comparação das taxas de sucesso mostrou resultados semelhantes para punção da veia caudal em ratos conscientes (92%) e punção da veia peniana sob anestesia (83%) (p = 0,0543), como mostra a Figura 4. Curiosamente, sob anestesia, a veia caudal tornou-se muito pouco confiável, e a punção da veia caudal sob anestesia teve apenas 25% de sucesso neste estudo, provavelmente devido ao afinamento da veia. No caso da anestesia, a punção da veia peniana foi mais bem sucedida do que a punção da veia caudal para amostragem (p < 0,0001).
Comparamos os volumes sanguíneos coletados e a duração do procedimento entre a punção da veia caudal e da veia peniana dorsal realizada em ratos sob anestesia e a punção da veia caudal realizada em ratos conscientes. A Figura 5 mostra que a punção da veia caudal sem anestesia (217,5 μL ± 69,04 μL) e a veia peniana sob anestesia (185,8 μL ± 66,4 μL) produziram quantidades comparáveis de sangue (p = 0,4966), e esses volumes de sangue foram significativamente maiores do que o volume coletado com punção da veia caudal sob anestesia (54,4 μL ± 68,8 μL) (p < 0,0001).
A duração do procedimento foi semelhante no grupo punção venosa peniana sob anestesia (315,2 s ± 160 s) e no grupo punção venosa caudal sem anestesia (262,5 s ± 171 s) (p = 0,6632). A Figura 6 mostra que a amostragem foi realizada em menos de 6 min em ambos os grupos, enquanto a punção da veia caudal sob anestesia levou mais de 8 min (500,8 s ± 196 s) devido a múltiplas falhas (p < 0,0382).
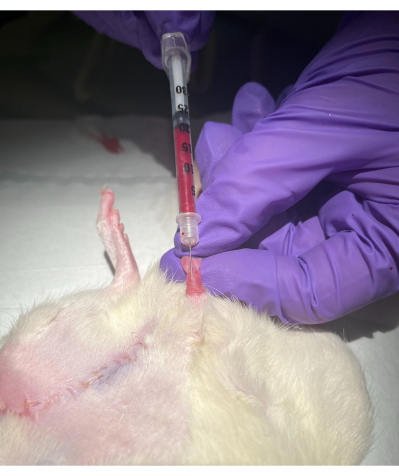
Figura 2: Método de punção da veia peniana dorsal. Clique aqui para ver uma versão maior desta figura.

Figura 3: Método de punção da veia caudal modificado. Observe que a cauda é mantida para baixo e o local da punção está localizado entre os dedos indicador e médio. A seringa deve repousar e deslizar contra o dedo indicador para manter um ângulo de punção estável. O uso da mão não dominante permite a estabilização da cauda em um animal consciente. Clique aqui para ver uma versão maior desta figura.

Figura 4: Taxas de sucesso com punção da veia caudal sob anestesia, punção da veia peniana sob anestesia e punção da veia caudal sem anestesia. **** p < 0,0001 com o teste do qui-quadrado. Abreviações: TV = veia da cauda; PV = veia peniana. Clique aqui para ver uma versão maior desta figura.
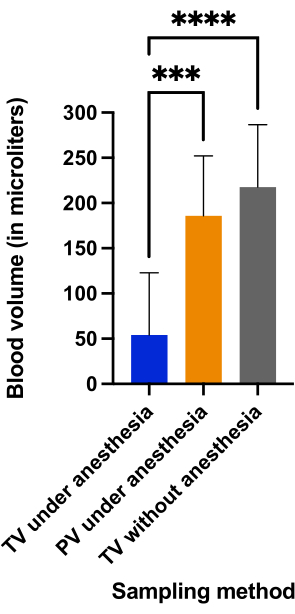
Figura 5: Comparação dos volumes sanguíneos (em μL) obtidos nos três grupos. ***p < 0,001; p < 0,0001 com análise ANOVA para comparações múltiplas. Clique aqui para ver uma versão maior desta figura.
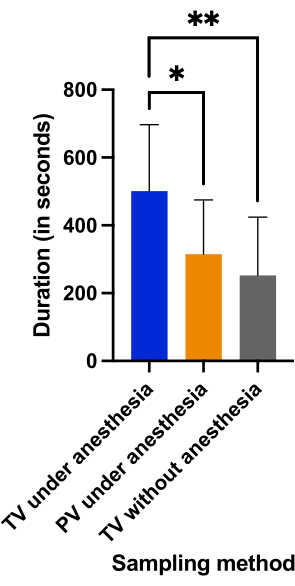
Figura 6: Comparação da duração da amostragem (em segundos), definida como o tempo decorrido desde o momento da punção até o término da coleta de sangue, nos três grupos. Falha foi definida como um tempo de coleta de sangue superior a 600 s (10 min). *p < 0,05; **p < 0,01 com análise ANOVA para comparações múltiplas. Clique aqui para ver uma versão maior desta figura.
Discussão
A punção da veia caudal é um método eficiente para obter sangue de um rato consciente. No entanto, quando um animal está sob anestesia, o efeito do isoflurano pode levar a espasmos vasculares e tornar a punção da veia caudal inadequada11. Como mostrado neste estudo, uma alternativa nessa situação é coletar sangue da veia peniana, que é mais bem sucedida e produz um volume significativamente maior de sangue em menos tempo. É importante lembrar que, no caso de falha com este método na primeira tentativa, as tentativas subsequentes podem não ser bem-sucedidas. Em contraste, a punção da veia caudal permite várias punções subsequentes em caso de dificuldade na primeira tentativa (há duas veias, e a punção mais acima na cauda pode ser tentada)1. No entanto, punções iterativas podem causar hemólise na amostra, o que distorce os resultados devido à liberação de hemoglobina e dos componentes internos das membranas eritrocitárias. Isso é especialmente verdadeiro se o plasma for analisado12. É preferível evitar múltiplas punções e obter a amostra em uma única coleta de sangue.
Neste trabalho, a coleta de sangue não excedeu 250 μL por amostra, de acordo com este protocolo e as diretrizes da IACUC para respeitar o bem-estar animal no caso de amostras múltiplas. Os avanços nas técnicas bioanalíticas têm possibilitado o uso de microamostras inferiores a 50 μL para avaliar a bioquímica sanguínea e parâmetros metabólicos 13. Portanto, 250 μL são suficientes para concluir que ambos os métodos são eficientes para estudos futuros. No entanto, tanto a veia caudal quanto a veia peniana são pequenos vasos e não permitem a coleta de grandes quantidades de sangue. Estes métodos descritos são adequados para a amostragem repetida e a monitorização de animais vivos. Se forem necessárias grandes quantidades de sangue (por exemplo, para procedimentos de final de estudo), outros métodos que produzam mais sangue, como a punção cardíaca, devem ser considerados.
Esses procedimentos descritos são dois entre muitos; Nossa escolha do procedimento foi motivada por algumas vantagens. Ambas as técnicas podem ser feitas por um único operador. O uso do dedo indicador e médio para estabilizar a veia caudal na técnica modificada da veia caudal torna desnecessária a contenção humana complementar. No entanto, é necessário avaliar o bem-estar do animal, e a assistência de um profissional (por exemplo, um veterinário ou técnico veterinário) é sempre recomendada para evitar submeter o animal a dor ou sofrimento desnecessários2.
Além disso, os métodos descritos anteriormente (por exemplo, bastão jugular, coleta de sangue da veia subclávia) requerem treinamento prévio extensivo para evitar danos ou morte do animal. Em contraste, a punção da veia caudal ou da veia peniana dorsal raramente é fatal para o rato, mesmo que não seja bem executada. Este estudo apresentou algumas falhas em ambos os métodos, mas nenhum outro efeito adverso ou óbito foi observado. Alguns casos de retenção de urina após injeções penianas dorsais foram relatados, mas não está claro se a injeção em si ou o agente injetado é responsável por esse resultado. Esse efeito adverso e a cicatrização anormal ou infecção no local da punção não foram observados durante o período do estudo. Além disso, as avaliações diárias das condições dos animais não revelaram dor ou sofrimento em nenhum grupo (sem coloração de porfirina, sem perda de peso, animais julgados confortáveis pela equipe de pesquisa e profissionais veterinários). No entanto, a contenção prolongada e múltiplas punções podem causar sofrimento ao animal. Para evitar isso, a agulha deve ser girada quando o fluxo sanguíneo diminui em vez de repetir a punção. Aquecer adequadamente a cauda com água quente e uma almofada de aquecimento para vasodilatar a veia da cauda, bem como praticar esses métodos, são recomendados para reduzir o tempo de contenção.
Os métodos de punção da veia caudal e punção da veia peniana dorsal permitem uma amostragem rápida (menos de 6 min) e produzem volumes sanguíneos suficientes para a maioria dos ensaios. Quando feita em um animal consciente, a punção da veia caudal é um método eficiente e confiável para obter sangue. No entanto, em um animal sedado, os agentes anestésicos tendem a causar espasmo dos vasos, e a veia caudal está sujeita a importante afinamento11. Nesse cenário, a punção da veia dorsal peniana proporciona melhor taxa de sucesso do que a punção da veia caudal, que tende a não ser confiável para a coleta de sangue. No entanto, uma limitação da coleta de sangue da veia peniana é que ela só pode ser realizada em ratos machos e, portanto, não é adequada para estudos com ratos fêmeas. Portanto, de acordo com o contexto (ou seja, o sexo do animal, coleta de sangue perioperatória ou pós-operatória, animais com veias finas da cauda), tanto a punção da veia peniana quanto a punção da veia caudal podem ser usadas alternadamente para repetidas coletas de sangue, mesmo por pesquisadores com pouca ou nenhuma experiência com estudos com animais.
Divulgações
Nenhum dos autores tem conflitos de interesse a declarar.
Agradecimentos
Este trabalho foi financiado pela Shriners Children's Boston (B. E. U., K.U., C.L.C.). L.C. é financiado por "La Bourse des Gueules Cassées", "La Bourse Année Recherche" e "La Bourse de l'Amicale des Anciens Internes des Hôpitaux de Paris". Y.B. é financiado por "La Bourse des Gueules Cassées". Y.B. e I.F.v.R. são financiados pelos Shriners Hospitals for Children (Fellowships ID é #84308-BOS-22 #84302-BOS-21 respectivamente). Este material é parcialmente baseado em trabalho apoiado pela National Science Foundation sob o Grant No. CEE 1941543. O apoio parcial dos Institutos Nacionais de Saúde dos EUA (R01EB028782, R56AI171958 e R01DK114506) é reconhecido com gratidão. A Figura 1 foi criada com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5 mL | 28 G ½ Insulin Syringes | BD | 329424 | for tail vein puncture |
| 0.5 mL | 30 G x 5/16 Insulin Syringes | BD | 320468 | for penile vein puncture |
| 250 L Microtainer blood collection tubes with K2EDTA | BD | 365974 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | for penile vein puncture |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | for penile vein puncture |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | for penile vein puncture |
| Rodent Restraint Cone | Harvard Apparatus | ST2 52-95-86 | for tail vein puncture |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Referências
- Lee, G., Goosens, K. A. Sampling blood from the lateral tail vein of the rat. Journal of Visualized Experiments. (99), e52766 (2015).
- Beeton, C., Garcia, A., Chandy, K. G. Drawing blood from rats through the saphenous vein and by cardiac puncture. Journal of Visualized Experiments. (7), 266 (2007).
- Luzzi, M., et al. Collecting blood from rodents: A discussion by the Laboratory Animal Refinement and Enrichment Forum. Animal Technology and Welfare. 4 (2), 99-102 (2005).
- Wang, L., et al. Repetitive blood sampling from the subclavian vein of conscious rat. Journal of Visualized Experiments. (180), e63439 (2022).
- Van Herck, H., et al. Blood sampling from the retro-orbital plexus, the saphenous vein and the tail vein in rats: Comparative effects on selected behavioural and blood variables. Laboratory Animals. 35 (2), 131-139 (2001).
- Harikrishnan, V. S., Hansen, A. K., Abelson, K. S., Sørensen, D. B. A comparison of various methods of blood sampling in mice and rats: Effects on animal welfare. Laboratory Animals. 52 (3), 253-264 (2018).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animals. 32 (4), 369-376 (1998).
- Nightingale, C. H., Mouravieff, M. Reliable and simple method of intravenous injection into the laboratory rat. Journal of Pharmaceutical Sciences. 62 (5), 860-861 (1973).
- Blood collection: The rat. IACUC Guideline. UCSF Office of Research Institutional Animal Care and Use Program Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/guidelines%20-%20Blood%20Collection%20-%20Rat.pdf (2022)
- Staszyk, C., Bohnet, W., Gasse, H., Hackbarth, H. Blood vessels of the rat tail: A histological re-examination with respect to blood vessel puncture methods. Laboratory Animals. 37 (2), 121-125 (2003).
- Constantinides, C., Mean, R., Janssen, B. J. Effects of isoflurane anesthesia on the cardiovascular function of the C57BL/6 mouse. ILAR Journal. 52 (3), e21-e31 (2011).
- Hernaningsih, Y., Akualing, J. S. The effects of hemolysis on plasma prothrombin time and activated partial thromboplastin time tests using photo-optical method. Medicine. 96 (38), 7976 (2017).
- Powles-Glover, N., Kirk, S., Jardine, L., Clubb, S., Stewart, J. Assessment of haematological and clinical pathology effects of blood microsampling in suckling and weaned juvenile rats. Regulatory Toxicology and Pharmacology. 69 (3), 425-433 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados